- Общая характеристика элементов Va группы
- Основное и возбужденное состояние азота
- Природные соединения
- Аммиак
- Соли аммония
- Оксид азота I — N2O
- Оксид азота II — NO
- Оксид азота III — N2O3
- Оксид азота IV — NO2
- Как называются бинарные соединения образованные азотом и металлом?
- Какие вещества Бинарные?
- Что такое бинарное соединение примеры?
- Как называются соединения с азотом?
- Какие соединения можно отнести к оксидам?
- Что такое Формула бинарных соединений?
- Как называются Бинарные соединения водорода?
- Что такое бинарные или двухэлементные соединения?
- Какие соединения называют бинарными какие бинарные?
- Какие бинарные соединения называют оксидами?
- Какой учёный назвал газ азотом?
- Кто открыл химический элемент азот?
- Как называется n2o5?
- ПОИСК
- Бинарные соединения | это… Что такое Бинарные соединения?
- Номенклатура
- Свойства
- Получение
- Применение
- Аммиак
- Гексафторид урана
- Карбид вольфрама
- Оксид диазота
- Хлороводород
- Литература
- 2.3.3. Химические свойства азота и фосфора
- Взаимодействие азота с металлами
- Взаимодействие азота с неметаллами
- Взаимодействие азота со сложными веществами
- Химические свойства фосфора
- Взаимодействие фосфора с неметаллами
- Взаимодействие фосфора с металлами
- Взаимодействие фосфора со сложными веществами
Азот — неметаллический элемент Va группы периодической таблицы Д.И. Менделеева. Составляет 78% воздуха. Входит в состав белков, являющихся важной частью живых организмов.
Температура кипения азота составляет -195,8 °C. Однако быстрого замораживания объектов, которое часто демонстрируют в кинофильмах, не происходит. Даже для заморозки растения нужно продолжительное время, это связано с низкой теплоемкостью азота.

Общая характеристика элементов Va группы
От N к Bi (сверху вниз в периодической таблице) происходит увеличение: атомного радиуса, металлических, основных, восстановительных свойств. Уменьшается электроотрицательность, энергия ионизация, сродство к электрону.
Азот, фосфор и мышьяк являются неметаллами, сурьма — полуметалл, висмут — металл.
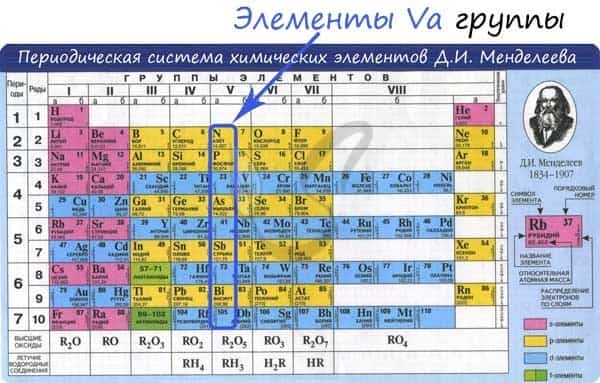
Электронные конфигурации у данных элементов схожи, так как они находятся в одной группе (главной подгруппе!), общая формула ns2np3:
- N — 2s22p3
- P — 3s23p3
- As — 4s24p3
- Sb — 5s25p3
- Bi — 6s26p3
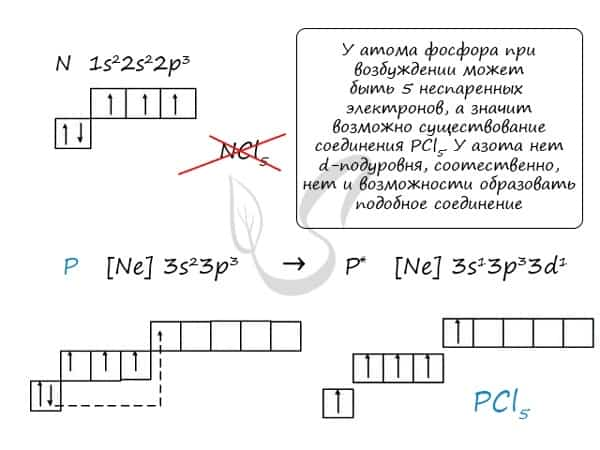
Основное и возбужденное состояние азота
При возбуждении атома фосфора электроны на s-подуровне распариваются и переходят на p-подуровень. Однако с азотом ситуация иная. Поскольку азот находится во втором периоде, то 3ий уровень у него отсутствует, а значит распаривание электронов на s-подуровне невозможно — возбужденное состояние у азота отсутствует.
Сравнивая возможности перемещения электронов у азота и фосфора, разница становится очевидна.
Природные соединения
В природе азот встречается в виде следующих соединений:
- Воздух — во вдыхаемом нами воздухе содержится 78% азота
- Азот входит в состав нуклеиновых кислот, белков
- KNO3 — индийская селитра, калиевая селитра
- NaNO3 — чилийская селитра, натриевая селитра
- NH4NO3 — аммиачная селитра (искусственный продукт, в природе не встречается)
Селитры являются распространенными азотными удобрениями, которые обеспечивают быстрый рост и развитие растений, повышают урожайность. Однако, следует строго соблюдать правила их применения, чтобы не превысить допустимые концентрации.

Получение
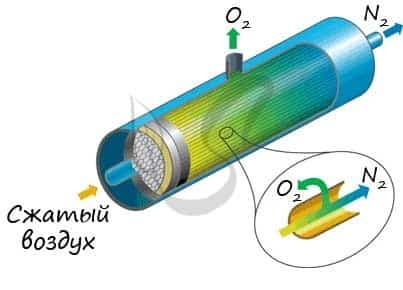
В промышленности азот получают путем сжижения воздуха. В дальнейшем путем испарения из сжиженного воздуха получают азот.
Применяют и метод мембранного разделения, при котором через специальный фильтр из сжатого воздуха удаляют кислород.
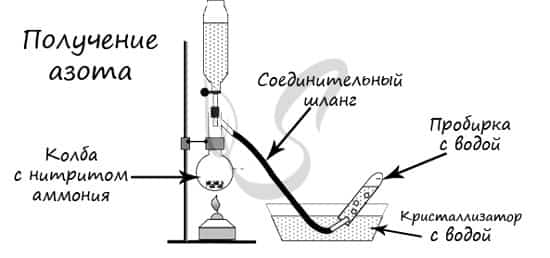
- В лаборатории методы не столь экзотичны. Чаще всего получают азот разложением нитрита аммония
- NH4NO2 → (t) N2 + H2O
- Также азот можно получить путем восстановления азотной кислоты активными металлами.
- HNO3(разб.) + Zn → Zn(NO3)2 + N2 + H2O
Химические свойства
Азот восхищает — он принимает все возможные для себя степени окисления от -3 до +5.
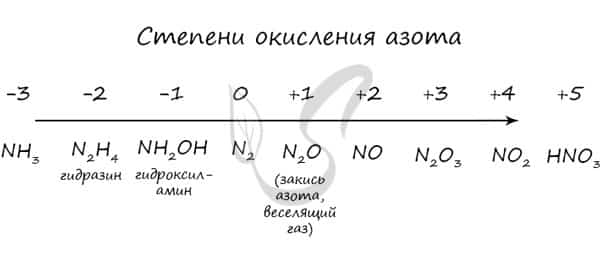
Молекула азота отличается большой прочностью из-за наличия тройной связи. Вследствие этого многие реакции эндотермичны: даже горение азота в кислороде сопровождается поглощением тепла, а не выделением, как обычно бывает при горении.
- Реакция с металлами
- N2 + Li → Li3N (нитрид лития)
- N2 + Mg → (t) Mg3N2
- N2 + Al → (t) AlN
- Реакция с неметаллами
Без нагревания азот взаимодействует только с литием. При нагревании реагирует и с другими металлами.
Важное практическое значение имеет синтез аммиака, который применяется в дальнейшим при изготовлении удобрений, красителей, лекарств. N2 + H2 ⇄ (t, p) NH3
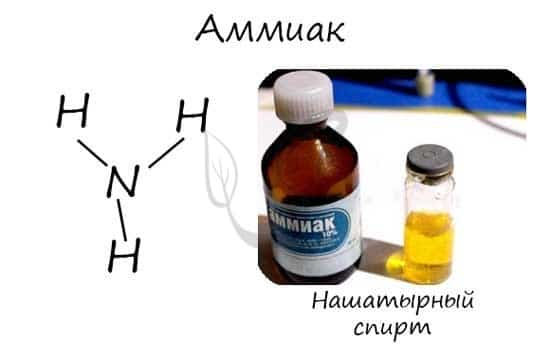
Аммиак
Бесцветный газ с резким едким запахом, раздражающим слизистые оболочки. Раствор концентрацией 10% аммиака применяется в медицинских целях, называется нашатырным спиртом.
- Получение
- В промышленности аммиак получают прямым взаимодействием азота и водорода.
- N2 + H2 ⇄ (t, p) NH3
- В лабораторных условиях сильными щелочами действуют на соли аммония.
- NH4Cl + NaOH → NH3 + NaCl + H2O
- Химические свойства
- Аммиак проявляет основные свойства, окрашивает лакмусовую бумажку в синий цвет.
- Реакция с водой
- Основные свойства
- Как основание аммиак способен реагировать с кислотами с образованием солей.
- NH3 + HCl → NH4Cl (хлорид аммония)
- NH3 + HNO3 → NH4NO3 (нитрат аммония)
- Восстановительные свойства
Образует нестойкое соединение — гидроксид аммония, слабое основание. Оно сразу же распадается на воду и аммиак. NH3 + H2O ⇄ NH4OH

Поскольку азот в аммиаке находится в минимальной степени окисления -3 и способен только ее повышать, то аммиак проявляет выраженные восстановительные свойства. Его используют для восстановления металлов из их оксидов. NH3 + FeO → N2↑ + Fe + H2O NH3 + CuO → N2↑ + Cu + H2O Горение аммиака без катализатора приводит к образованию азота в молекулярном виде. Окисление в присутствии катализатора сопровождается выделением NO. NH3 + O2 → (t) N2 + H2O NH3 + O2 → (t, кат) NO + H2O
Соли аммония
- Получение
- NH3 + H2SO4 → NH4HSO4 (гидросульфат аммония, избыток кислоты)
- 3NH3 + H3PO4 → (NH4)3PO4
- Химические свойства
- Помните, что по правилам общей химии, если по итогам реакции выпадает осадок, выделяется газ или образуется вода — реакция идет.
- Реакции с кислотами
- Реакции с щелочами
- Реакции с солями
- Реакция гидролиза
- В воде ион аммония подвергается гидролизу с образованием нестойкого гидроксида аммония.
- NH4+ + H2O ⇄ NH4OH + H+
- NH4OH ⇄ NH3 + H2O
- Реакции разложения
- NH4Cl → (t) NH3↑ + HCl↑
- (NH4)2CO3 → (t) NH3↑ + H2O + CO2↑
- NH4NO2 → (t) N2↑ + H2O
- NH4NO3 → (t) N2O↑ + H2O
- (NH4)3PO4 → (t) NH3↑ + H3PO4
NH4Cl + H2SO4 → (NH4)2SO4 + HCl↑
В реакциях с щелочами образуется гидроксид аммония — NH4OH. Нестойкое основание, которое легко распадается на воду и аммиак. NH4Cl + KOH → KCl + NH3 + H2O
(NH4)2SO4 + BaCl2 = BaSO4↓ + NH4Cl
Оксид азота I — N2O
Закись азота, веселящий газ — N2O — обладает опьяняющим эффектом. Несолеобразующий оксид. При н.у. является бесцветным газом с приятным сладковатым запахом и привкусом. В медицине применяется в больших концентрациях для ингаляционного наркоза.
- Получают N2O разложением нитрата аммония при нагревании:
- NH4NO3 → N2O + H2O
- Оксид азота I разлагается на азот и кислород:
- N2O → (t) N2 + O2
Оксид азота II — NO
Окись азота — NO. Несолеобразующий оксид. При н.у. бесцветный газ, на воздухе быстро окисляется до оксида азота IV.
- Получение
- В промышленных масштабах оксид азота II получают при каталитическом окислении аммиака.
- NH3 + O2 → (t, кат) NO + H2O
- В лабораторных условиях — в ходе реакции малоактивных металлов с разбавленной азотной кислотой.
- Cu + HNO3(разб.) → Cu(NO3)2 + NO + H2O
- Химические свойства
- На воздухе быстро окисляется с образованием бурого газа — оксида азота IV — NO2.
- NO + O2 → NO2
Оксид азота III — N2O3
При н.у. жидкость синего цвета, в газообразной форме бесцветен. Высокотоксичный, приводит к тяжелым ожогам кожи.
- Получение
- Получают N2O3 в две стадии: сначала реакцией оксида мышьяка III с азотной кислотой (две реакции, в которых образуется смесь оксидов азота), затем охлаждением полученной смеси газов до температуры — 36 °C.
- As2O3 + HNO3 + H2O → H3AsO4 + NO↑
- As2O3 + HNO3 + H2O → H3AsO4 + NO2↑
- При охлаждении газов образуется оксид азота III.
- NO + NO2 → N2O3
- Химические свойства
Является кислотным оксидом. соответствует азотистой кислоте — HNO2, соли которой называются нитриты (NO2-). Реагирует с водой, основаниями.
H2O + N2O3 → HNO2
NaOH + N2O3 → NaNO2 + H2O
Оксид азота IV — NO2
Бурый газ, имеет острый запах. Ядовит.
Получение
В лабораторных условиях данный оксид получают в ходе реакции меди с концентрированной азотной кислотой. Также NO2 выделяется при разложении нитратов.
Cu + HNO3(конц) → Cu(NO3)2 + NO2 + H2O
- Cu(NO3)2 → (t) CuO + NO2 + O2
- Pb(NO3)2 → (t) PbO + NO2 + O2
- Химические свойства
- Проявляет высокую химическую активность, кислотный оксид.
- Окислительные свойства
- Как окислитель NO2 ведет себя в реакциях с фосфором, углеродом и серой, которые сгорают в нем.
- NO2 + C → CO2 + N2
- NO2 + P → P2O5 + N2
- Окисляет SO2 в SO3 — на этой реакции основана одна из стадий получения серной кислоты.
- SO2 + NO2 → SO3 + NO
- Реакции с водой и щелочами
- NO2 + H2O → HNO3 + HNO2
- NO2 + LiOH → LiNO3 + LiNO2 + H2O
- Если растворение в воде оксида проводить в избытке кислорода, образуется азотная кислота.
- NO2 + H2O + O2 → HNO3
Оксид азота IV соответствует сразу двум кислотам — азотистой HNO2 и азотной HNO3. Реакции с водой и щелочами протекают по одной схеме.
Как называются бинарные соединения образованные азотом и металлом?
НИТРИДЫ Нитриды –соединения азота с более электроположительными элементами, металлами и неметаллам, и похожи на карбиды и гидриды.
Какие вещества Бинарные?
Ниже приведены примеры использования некоторых веществ, относящихся к бинарным соединениям.
- Аммиак
- Гексафторид урана
- Карбид вольфрама
- Оксид диазота
- Хлороводород
Что такое бинарное соединение примеры?
Большинство двухэлементных соединений (кроме основных, амфотерных и кислотных оксидов) и многоэлементных соединений (кроме гидроксидов и солей) часто относят к бинарным соединениям. Примеры: H2O, H2S, KBr, N2O, NH3, CaC2, SiH4, H2O2, NaCl, Mg3N2 и другие.
Как называются соединения с азотом?
Поныне соединения азота называют «нитраты», «нитриты» и «нитриды» :42.
Какие соединения можно отнести к оксидам?
Ответ: оксид алюминия – Al2O3, оксид кремния – SiO2, оксид железа (III) – Fe2O3, оксид водорода – Н2О, оксид углерода (IV) – СО2, оксид серы (IV) – SO2, оксид азота (II) – NO, оксид азота (IV) – NO2.
Что такое Формула бинарных соединений?
Неорганические вещества, состоящие из двух химических элементов, называются бинарными. … число атомов более электроотрицательного элемента в формуле соединения: CO–монооксид углерода, CO2 – диоксид углерода, SF6 – гексафторид серы.
Как называются Бинарные соединения водорода?
Бинарные соединения водорода. Гидриды – соединения водорода с металлами.
Что такое бинарные или двухэлементные соединения?
Бинарные соединения являются распространенным типом неорганических сложных веществ. К ним относятся двухэлементные соединения, в которых электроположительная и электроотрицательная составляющие представляют собой отдельные атомы одного элемента или одноэлементные группы атомов (например, NaCl, Al2S3, N2O, SnH4).
Какие соединения называют бинарными какие бинарные?
Бинарные соединения – это вещества, которые образованы атомами двух химических элементов. Оксиды – это бинарные соединения в состав которых входит кислород. Оксиды делятся на две группы – солеобразующие и несолеобразующие.
Какие бинарные соединения называют оксидами?
Окси́д (синонимы: о́кисел, о́кись) — бинарное соединение химического элемента с кислородом в степени окисления −2, в котором сам кислород связан только с менее электроотрицательным элементом.
Какой учёный назвал газ азотом?
Он выяснил, что газ, остающийся после сгорания соединений, не поддерживает горения и дыхания, и назвал его «удушливым воздухом». В 1787 году Антуан Лавуазье установил, что газы, входящие в состав обычного воздуха, — это простые химические элементы, и предложил название «Азот». Чуть позже (в 1784 г.)
Кто открыл химический элемент азот?
Даниель Резерфорд
Как называется n2o5?
Оксид азота(V)
Интересные материалы:
ПОИСК
Какие из щелочных металлов при непосредственном соединении с азотом образуют нитриды [c.268]
Какие соединения называют нитридами С каким из щелочных металлов азот образует нитрид ири обычной температуре [c.64]
Нитриды Других щелочных металлов могут быть получены взаимодействием их паров с азотом в поле тихого электрического разряда. [c.254]
Известны амиды, имиды и нитриды, они содержат соответственно ионы NHi, NH и N . Амиды щелочных металлов получают, действуя на них аммиаком. Амиды, имиды и нитриды ряда металлов образуются в результате некоторых реакций а среде жидкого аммиака (см. разд. 6.6). Многие нитриды получают нагреванием металлов в атмосфере азота. [c.399]
Известны амиды, имиды и нитриды они содержат соответственно NH2, NH и N . Амиды щелочных металлов получают, действуя на них аммиаком. Ион NHV имеет угловое строение. Амиды, имиды и нитриды ряда металлов образуются в результате некоторых реакций в среде жидкого аммиака (см. разд. 6.6). Многие нитриды получают нагреванием металлов в атмосфере азота. Это твердые вещества, обычно реагирующие с водой с образованием NH3 и гидроксидов металлов [c.397]
Свойства. Щелочные металлы Ыа, К, КЬ, Сз — легкоплавкие металлы. Ы, Ыа, К, КЬ имеют серебристо-белую окраску, а Сз — золотисто-желтую, не такую яркую как у золота, но вполне заметную. Находящиеся под керосином щелочные металлы бывают покрыты слоем нз оксидов и пероксидов (литпй — смес1 .
ю нитрида и оксида) . На воздухе они легко окисляются (КЬ и Сз — самовозгораются), реакция ускоряется под действием влаги в совершенно сухом кислороде при комнатной температуре натрий не окисляется н сохраняет блестящую поверхность. Литий приблизительно такой же мягкий, как свинец, натрий — как воск.
К, КЬ и Сз — еще мягче. Щелочные металлы обладают высокой сжимаемостью, электро- и теплопроводностью. Литий — самое легкое из твердых веществ, существующих прп комнатной температуре. Некоторые свойства щелочных металлов указаны в табл. 3.
1 Работа со щелочными металлами требует боль иой осторожно сти,. гак как они легко загораются, бурно реагируют с водой многими другими веществами.
При длительном хранении в керо сине калий покрывается слоем надпероксида, который при разре зании металла может с ним интенсивно реагировать, вызывая загорание и разбрызгивание горящей массы. [c.299]
Нитриды металлических элементов, как правило, тугоплавки и мало летучи. Расплавленные нитриды щелочных металлов электропроводны. Нитриды неметаллических элементов немногочисленны, и свойства их изучены еш,е недостаточно. [c.57]
Отношение к другим элементарным окислителям. Галогены, сера, азот, фосфор, водород и др. при определенных условиях относительно легко окисляют щелочные металлы с образованием галидов, сульфидов, нитридов, фосфидов, гидридов и др. (см. гл. I).
Эти реакции протекают с выделением большого количества тепла, часто в форме горения, а иногда со взрывом (например, калий при взаимодействии с бромом).
Менее активно взаимодействуют щелочные металлы с азотом и лишь литий соединяется с ним при обыкновенной температуре, но лучше при слабом нагревании [c.36]
Свойства, и, N8, К, КЬ, Са — легкоплавкие металлы, Ы, N3, К, НЬ имеют серебристо-белую окраску, а Са — золотисто-желтую, ие такую яркую, как у золота, хотя и вполне заметную. Хранящиеся под слоем керосина щелочные металлы обычно покрыты пленкой из оксидов и пероксидов Слитий -смесью нитрида и оксида). [c.319]
Нитрид ы щелочных металлов образуются при нагревании непосредственным взаимодействием [c.295]
По типу химической связи N—Э нитриды подразделяют на ионные (солеобразные), ковалентные и металлоподобные.
Многие нитриды получают непосредственным взаимодействием металла с азотом, например ионные нитриды щелочных и щелочно-земельных металлов. Нитриды подгрупп Си и Zn имеют преимущественно ионно-ковалентную связь.
С увеличением доли ковалентной связи возрастает устойчивость нитридов. [c.308]
Нитриды других щелочных металлов могут быть получены из их паров и азота в электрическом разряде. Они малоустойчивы. [c.324]
Благодаря малому радиусу атома и иона, литий по своим свойствам проявляет некоторое сходство с магнием (диагональное сходство), которое выражается, например, в образовании нитрида, малой устойчивости и относительно невысокой растворимости гидроксида. Однако наибольшее сходство у лития наблюдается все же со щелочными металлами. [c.229]
Образование сульфида (ЭгЗ) при растирании щелочного металла с порошком серы сопровождается взрывом.
При нагревании в атмосфере водорода литий и его аналоги образуют гидриды (ЭН), имеющие характер типичных солей, в которых отрицательным ионом является водород (Н-). С азотом и углеродом непосредственно соединяется только литий.
Образование его нитрида (ЫзЫ) медленно идет в атмосфере азота уже при обычных температурах. [c.404]
Нитриды щелочных металлов могут быть получены действием тихого электрического разряда иа пары металлов в атмосфере азота. Оип гигроскопичны и энергично взаимодействуют с водой [c.117]
Таким образом, можно рассматривать нитриды щелочных металлов как производные аммиака, но с более высокой полярностью а-связей. [c.307]
Нитриды s-металлов ПА-группы получают путем непосредственного взаимодействия. Они напоминают нитриды щелочных металлов, так как тоже разлагаются водой и слабыми кислотами [c.304]
По многим физико-химическим свойствам литий обнаруживает большее сходство с магнием—элементом, находящимся в Периодической системе по диагонали от него, чем со своим непосредственным химическим аналогом — натрием.
Так, литий при сгорании на воздухе образует оксид Li20, как и магний -MgO литий, в отличие от других щелочных металлов легко соединяется с азотом, давая нитрид LiaN, как и магний — Mga-Nj некоторые соли лития и магния — фториды, карбонаты, ортофосфаты, а также гидроксиды малорастворимы в воде гидроксиды лития и магния уже при умеренном нагревании (400—450 °С) разлагаются на соответствующий оксид и иоду, тогда как остальные щелочи в этих условиях термически устойчивы и образуют ионные расплавы. [c.196]
Нитриды щелочных металлов образуются при взаимодействии паров металлов с возбужденными атомами азота (тлеющий разряд). Они гигроскопичны и энергично взаимодействуют с водой [c.309]
С азотом щелочные металлы, за исключением Li, иеиосред-стзеиь о НС реагируют. Литий взаимодействует с азотом даже прн KOMiriTHOi температуре, образуя нитрид Li-N, который легко pea-r …v T с водой [c.304]
Как уже указывалось, в среде жидкого аммнака также могут быть получены весьма своеобразные соединения.
Некоторые из них можно получить только в жидком аммиаке наиример, единственным способом получения нитрида ртути HgзN2 является взаимодействие соли ртути с амидами щелочных металлов в жидком аммиаке (см. стр. 238). Аналогично получают нитриды висмута и таллия (Т1зЫ и В1Ы).
Иными способами приготовить эти соединения не удается. Вот несколько примеров аммонолиза, приводящих к образованию весьма своеобразных продуктов [c.257]
Из щелочных металлов только литий при срапиитсльно небольшом нагревании взаимодействует с азотом, углеродом и кремнием, образуя соответственно нитрид LiзN, карбид и силицид 115812. В присутствии влаги образование нитрида идет уже при комнатной температуре, [c.128]
Щелочные металлы образуют много бинарных соединений, самыми известными из которых являются нитриды MзN, карбиды (ацетилениды) М2С2 и гидриды МН. Все они энергично разлагаются водой [c.164]
Простые соли — соединения типичных металлических элементов с окислительными элементами (оксоидами). Связь между атомами в молекулах простых солей, находящихся в газовом состоянии, преимущественно ионная, по крайней мере для типичных случаев (т. е.
для соединений наиболее активных, например щелочных, металлов с активными оксоидами, например галогенами). Простые соли характеризуются кристаллическими решетками ионного типа, а в жидком состоянии — ионной электропроводностью.
Несомненно, что к классу простых солей должны быть отнесены оксиды и нитриды активных металлов, поскольку они характеризуются теми же типичными для солей признаками гидриды наиболее активных (например, щелочных) металлов также являются простыми солями, обладая всеми их признаками.
Характерной химической функцией простых солей является их способность бьта донорами положительно и отрицательно заряженных элементарных ионов, сочетаниями которых они являются. [c.51]
Как уже указывалось, весьма своеобразные соединения могут быть получены в среде жидкого аммиака, причем некоторые из них образуются только в жидком аммиаке. Например, единственным спосс м получения нитрида ртути HgзN2 является взаимодействие соли ртути с амидами щелочных металлов в жидком аммиаке. Аналогично получают нитриды висмута BiN и таллия TlзN. Другими способами приготовить эти соединения не удается. [c.305]
Как можно получить нитриды щелочных металлов Как шприды металлов взаимодействуют с водой [c.9]
Оксиды и гидроксиды щелочных металлов, основные свойства. Соли щелочных металлов, их растворимость в воде. Окраска иламени. Бинарные соединения ще.точных металлов-нитриды, карбиды, гидриды. Распространение в природе и при.менение щелочных металлов и их соединений. Франций. [c.163]
Помимо приведенных выше, укажем еще соединения щелочных металлов с азотом, фосфором, углеродом и кремнием нитрид лития Ь1дЫ, нитрид натрия N3314 с >осфиды типа МсдР, где Ме — щелочной металл карбиды типа наконец, силицид лития [c.249]
Аммиак относится к неэлектролитам. Однако по электрохимическому харак1ч ру его можно считать чрезвычайно слабой кислотой.
Его кислотные свойства проявляются в том, что он образует с металлами соединения типа Мб ,No — нитриды, которые водой или водяным паром гидролизуются с образованием аммиака (См.
1шже), а также в том, что жидкий аммиак реагирует с щелочными металлами [c.518]
Ддя лития характерны почти все важнейшие реакции щелочных металлов, но протекают они менее энергично [10, 14, 181. Реакция лития с воздухом зависит от чистоты и состояния поверхности металла, температуры и влажности воздуха.
С сухим воздухом он реагирует медленно и окисляется в нем только при нагревании, тогда как натрий и калий окисляются легко, а при нагревании загораются [8].
При влажности продукты коррозии состоят в основном из нитрида ЫзМ при более высокой влажности нитридообразование уступает место образованию гидроокиси ЫОН, которая частично карбони-зуется [19]. Температура вспышки рафинированного лития 640°, технического 200° [19].
С сухим кислородом при низкой температуре не реагирует, при нагревании горит голубым пламенем, образуя окись ЫгО. Образование перекисных соединений при окислении не характерно для лития, что объясняется высокой поляризующей способностью его ионов [8]., [c.8]
Из нитридов щелочных металлов (SsN) легко образуется только LI3N (т. пл. 845°С). Остальные могут быть получены лишь косвенными путями и гораздо менее устойчивы. Так, NaaN медленно разлагается на элементы уже при 200 °С, а нитриды К, Rb и s даже взрывчаты. [c.410]
Таким образом, радиусы соседних элементов, распо-локенных по диагонали, например и а также Ве II А1, оказываются близкими. Это положение было подмечено еще Д. И. Менделеевым. Оно лежит в основе закономерности, называемой диагональной .
В соответствии с ней литий по некоторым свойствам больше напоминает магний, чем остальные щелочные металлы. Так же как магний, в отличие от щелочных металлов, литий дает малорастворимый фосфат и карбонат.
Литий п магний сравннт-ельно легко взаимодействуют с молекулярным азотом с образованием нитридов. [c.75]
Для придания необходимых физико-механических свойств в оксидную пленку могут вводиться находящиеся в электролите нерастворимые в воде в этих условиях металлы, а также мелкодисперсные тугоплавкие соединения (карбиды, бориды, нитриды) и окислы за счет электрофоретической доставки их на анод.
Образование пленок происходит в локальных объемах порядка 10 см при температуре пробойного канала 2000 К и скорости охлаждения 10 — 10 градус/с. По такому принципу формируются керамические покрытия, применяемые для повыщения коррозионной и термической стойкости алюминиевых деталей.
Керамические покрытия получают из водных растворов силикатов щелочных металлов, например из 3-4-модульного силиката натрия (концентрация 0,1-0,2 М), они представляют собой шпинели AlSiOj, сформированные при анодировании в режиме искрового разряда (напряжение 350 В).
Дегидратация и спекание силикатов на аноде происходят в результате искрового пробоя окисного слоя, образующегося при анодировании алюминия. При электролизе на аноде происходит разряд гидроксил-ионов I. силикатных мицелл, а также образуются окислы [c.124]
С большинством металлов и их оксидов, а также со мн. неметаллами Г. дает карбиды. Со всеми щелочными металлами, нек-рыми галогенидами, оксифторидами, галогеиок-сидами, оксидами и сульфидами металлов образует соед.
включения, с нитридами металлов выше 1 ООО °С-твердые р-ры нитридов и карбидов, с боридами и карбидами-эвтектич. смеси с т-рами плавления 1800-3200 °С. Г. стоек к действию к-т, р-ров солей, расплавов фторидов, сульфидов, теллуридов, орг. соед.
, жидких углеводородов и др., ре- [c.608]
Бинарные соединения | это… Что такое Бинарные соединения?
Бина́рные соедине́ния — химические вещества, образованные, как правило, двумя химическими элементами. Термин «бинарные соединения» обычно не применяется в отношении основных и кислотных оксидов.
При этом несолеобразующие оксиды включают в бинарные соединения.
Многоэлементные вещества, в формульной единице которых одна из составляющих содержит не связанные между собой атомы нескольких элементов, а также одноэлементные или многоэлементные группы атомов (кроме гидроксидов и солей), рассматривают как бинарные соединения.
Бинарные соединения, несмотря на кажущуюся простоту их химического состава, представляют собой следующий после простых веществ принципиально важный объект изучения природы вещества.
С химической точки зрения, этот класс веществ обладает и качественно иными характеристиками, с которыми не приходится сталкиваться при изучении простых веществ.
Во-первых, помимо внешних факторов, влияющих на состояние и свойства вещества (температура и давление), здесь появляется и внутренний фактор — состав, и связанная с ним проблема постоянства и переменности состава, имеющая фундаментальное значение в химии.
Во-вторых, при описании бинарных соединений впервые формируются такие базисные понятия, как валентность, степень окисления, поляризация химической связи. Здесь, в отличие от простых веществ, появляются гетерополярная составляющая химической связи и все эффекты, связанные с разностью электроотрицательностей компонентов.
Исключительно важную роль играют бинарные соединения с классификационной точки зрения. Многие из них относятся и к так называемым характеристическим соединениям, отражающим типичные степени окисления и их сравнительную стабильность. К таким соединениям относятся прежде всего оксиды, летучие водородные соединения, а также галогениды.
Номенклатура
Бинарные соединения — это собирательная группа веществ, которые имеют различное химическое строение. Поэтому их номенклатура может варьироваться в зависимости от генетической принадлежности.
Названия простых бинарных веществ, как правило, образуются добавлением к названию более электроотрицательного элемента суффикса -ид. При необходимости к названиям элементов добавляют кратные приставки или указывают в скобках степень окисления электроположительного элемента без пробела:
- SiC — карби́д кре́мния
- KBr — броми́д ка́лия
- CS2 — дисульфи́д углеро́да или сульфид углерода(IV)
В сложных бинарных соединениях суффикс -ид добавляется к названиям элементов, находящихся в низших степенях окисления:
Многие широко известные бинарные соединения носят тривиальные названия, среди них уже приведенный выше фосген, вода H2O аммиак NH3, веселящий газ N2O и другие.
Свойства
- Группа бинарных соединений включает в себя очень большое число веществ, и, естественно, все эти вещества различаются по физическим свойствам. Среди бинарных соединений есть представляющие собой при нормальных условиях газы (например, аммиак, фосфин), жидкости (например, тетрахлорид титана TiCl4, дисульфид углерода CS2) и твердые вещества (например, нитрид бора BN, карбид кремния SiC)
- Химическая связь в бинарных соединениях — ковалентная полярная (в соединениях неметаллов и некоторых амфотерных элементов) или ионная (в солях бескислородных кислот).
- Многие бинарные соединения гидролизуются водой, например фосфин или хлорид алюминия.
Получение
Часто бинарные соединения можно получить прямым взаимодействием простых веществ между собой:
- N2 + 3H2 ⇆ 2NH3 (p, T, кат.)
- 2Na + Cl2 = 2NaCl
Другие бинарные вещества могут получаться более сложным путем — через реакции обмена или окислительно-восстановительные реакции:
- AgNO3(р.) + NaBr(р.) = AgBr↓ + NaNO3(р.)
- NH4NO3 = N2O + 2H2O (до 250 °C)
Применение
В силу того, что к данной группе веществ можно отнести очень большое их количество, можно сказать, что бинарные соединения применяются практически во всех областях деятельности человека, от приготовления пищи до использования в качестве сырья для крупнотоннажных производств. Ниже приведены примеры использования некоторых веществ, относящихся к бинарным соединениям.
Аммиак
Основная статья: Аммиак
В химической промышленности аммиак используется в качестве прекурсора для получения азотной кислоты и для производства химических удобрений.
Кроме того, аммиак используется в большом количестве разнообразных химических синтезов, в том числе в тонком органическом синтезе. В жидком аммиаке химически растворяются многие вещества, например, калий, натрий, сера.
Аммиак применялся в качестве хладагента в первых холодильниках, и до недавнего времени превалировал в промышленных холодильных установках.
Гексафторид урана
Основная статья: Гексафторид урана
Летучий гексафторид урана UF6 применяется для разделения изотопов урана в процессе его обогащения, а также как фторирующий агент.
Карбид вольфрама
Основная статья: Карбид вольфрама
Карбид вольфрама в силу своей исключительной твердости находит очень широкое применение в производстве разнообразного режущего инструмента. А в силу своей химической инертности — в производстве химического оборудования для работы в агрессивных средах.Пример:печи,ножи,лабораторное оборудование полный бред)
Оксид диазота
Основная статья: Оксид азота(I)
«Веселящий газ» N2O в смесях с кислородом применяется в медицине как агент для ингаляционного общего наркоза.
Хлороводород
Водный раствор хлороводорода (соляная кислота) широко используется для получения хлоридов, для травления металлов, очистки поверхности сосудов, скважин от карбонатов, обработки руд, при производстве каучуков, глутамата натрия, соды, хлора и других продуктов. Также применяется в органическом синтезе.
Литература
Андреева Л. Л., Лидин Р. А., Молочко В. А. Химические свойства неорганических веществ. Учебное пособие для вузов. — М.: Химия, 1996
Предыдущая Следующая
Неорганические вещества разделяются на классы либо по составу (двухэлементные, или бинарные, соединения и многоэлементные соединения; кислородсодержащие, азотосодержащие и т.
п.), либо по химическим свойствам, т.е. по функциям (кислотно-основным, окислительно-восстановительным и т.д.), которые эти вещества осуществляют в химических реакциях, — по их функциональным признакам.
К важнейшим бинарным соединениям относятся любые соединения только двух различных элементов. Например, бинарными соединениями азота и кислорода являются: N2O, NO, N2O3, NO2, N2O5; бинарные соединения меди и серы: Cu2S, CuS, CuS2.
В формулах бинарных соединений металлы всегда предшествуют неметаллам: SnCl2, Al3N.
Если бинарное соединение образовано двумя неметаллами, то на первом месте ставится символ того элемента, который располагается левее в следующей последовательности:
B, Si, C, As, P, H, Te, Se, S, I, Br, Cl, N, O, F.
Например, CBr4, H2O, SF6.
Если бинарное соединение состоит из двух металлов, то первым указывается металл, располагающийся в большом периоде раньше (от начала периода). Если оба металла находятся в одной группе, то первым указывается элемент с большим порядковым номером.
Бинарные соединения подразделяются на классы в зависимости от типа неметалла (табл. 1.2.), а остальные бинарные соединения относят к соединениям между металлами – интерметаллидам.
Таблица 3
Классы бинарных соединений от типа неметалла
| Класс | Неметалл | Пример формулы соединения | Название |
| Галогениды | F, Cl, Br, I | NaCl | Хлорид натрия |
| Оксиды | O | FeO | Оксид железа (II) |
| Халькогениды | S, Se, Te | ZnS | Сульфид цинка |
| Пниктогениды | N, P, As | Li3N | Нитрид лития |
| Гидриды | H | CaH2 | Гидрид кальция |
| Карбиды | C | SiC | Карбид кремния |
| Силициды | Si | FeSi | Силицид железа |
| Бориды | B | Mg3B2 | Борид магния |
Их названия образуются из латинского корня названия неметалла с окончанием «ид» и русского названия менее электроотрицательного элемента в родительном падеже (табл. 3).
Если менее электроотрицательный элемент может находиться в разных окислительных состояниях, то после его названия в скобках указывают римскими цифрами его степень окисления.
Так, Cu2O — оксид меди (I), CuO- оксид меди (II), CO — оксид углерода (II), CO2 — оксид углерода (IV), SF6 — фторид серы (VI). Можно также вместо степени окисления указывать с помощью греческих числительных приставок (моно-, ди-, три-, тетра-, пента-, гекса- и т.д.
) стехиометрический состав соединения: СО – монооксид углерода (приставку «моно» часто опускают), СО2 – диоксид углерода, SF6 – гексафторид серы, Fe3O4 – тетраоксид трижелеза. Для отдельных бинарных соединений сохраняют традиционные названия: Н2О – вода, NН3 – аммиак, РН3 – фосфин.
Предыдущая Следующая
2.3.3. Химические свойства азота и фосфора
Химический элемент азот образует только одно простое вещество. Данное вещество является газообразным и образовано двухатомными молекулами, т.е. имеет формулу N2.
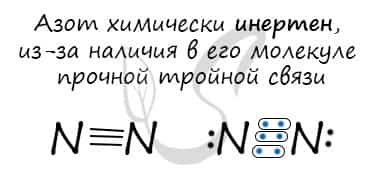
Не смотря то, что химический элемент азот имеет высокую электроотрицательность, молекулярный азот N2 является крайне инертным веществом. Обусловлен данный факт тем, что в молекуле азота имеет место крайне прочная тройная связь (N≡N).
По этой причине практически все реакции с азотом протекают только при повышенных температурах.
Взаимодействие азота с металлами
Единственное вещество, которое реагирует с азотом в обычных условиях – литий:
Интересным является тот факт, что с остальными активными металлами, т.е. щелочными и щелочноземельными, азот реагирует только при нагревании:
Взаимодействие азота с металлами средней и низкой активности (кроме Pt и Au) также возможно, однако требует несравнимо более высоких температур.
Нитриды активных металлов легко гидролизуются водой:
А также растворами кислот, например:
Взаимодействие азота с неметаллами
Азот реагирует с водородом при нагревании в присутствии катализаторов. Реакция является обратимой, поэтому для повышения выхода аммиака в промышленности процесс ведут при высоком давлении:
Как восстановитель азот реагирует со фтором и кислородом. Со фтором реакция идет при действии электрического разряда:
С кислородом реакция идет под действием электрического разряда или при температуре более 2000 оС и является обратимой:
Из неметаллов азот не реагирует с галогенами и серой.
Взаимодействие азота со сложными веществами
В рамках школьного курса ЕГЭ можно считать, что азот не реагирует ни с какими сложными веществами кроме гидридов активных металлов:
Химические свойства фосфора
Существует несколько аллотропных модификаций фосфора., в частности белый фосфор, красный фосфор и черный фосфор.
Белый фосфор образован четырехатомными молекулами P4, не является устойчивой модификацией фосфора. Ядовит. При комнатной температуре мягкий и подобно воску легко режется ножом. На воздухе медленно окисляется, и из-за особенностей механизма такого окисления светится в темноте (явление хемилюминесценции). Даже при слабом нагревании возможно самопроизвольное воспламенение белого фосфора.
Из всех аллотропных модификаций белый фосфор наиболее активен.
Красный фосфор состоит из длинных молекул переменного состава Pn. В некоторых источниках указывается то, что он имеет атомное строение, но корректнее все-таки считать его строение молекулярным.
Вследствие особенностей строения является менее активным веществом по сравнению с белым фосфором, в частности в отличие от белого фосфора на воздухе окисляется значительно медленнее и для его воспламенения требуется поджиг.
Черный фосфор состоит из непрерывных цепей Pn и имеет слоистую структуру схожую со структурой графита, из-за чего и внешне похож на него. Данная аллотропная модификация имеет атомное строение.
Самый устойчивый из всех аллотропных модификаций фосфора, наиболее химически пассивен.
По этой причине, рассмотренные ниже химические свойства фосфора следует относить прежде всего к белому и красному фосфору.
Взаимодействие фосфора с неметаллами
Реакционная способность фосфора является более высокой, чем у азота. Так, фосфор способен гореть после поджига при обычных условиях, образуя кислотный оксид Р2O5:
- а при недостатке кислорода оксид фосфора (III):
- Реакция с галогенами также протекает интенсивно. Так, при хлорировании и бромировании фосфора в зависимости от пропорций реагентов образуются тригалогениды или пентагалогениды фосфора:
- Ввиду существенно более слабых окислительных свойства йода по сравнению с остальными галогенами, возможно окисление фосфора йодом только до степени окисления +3:
- В отличие от азота фосфор с водородом не реагирует.
Взаимодействие фосфора с металлами
Фосфор реагирует при нагревании с активными металлами и металлами средней активности образуя фосфиды:
- Фосфиды активных металлов подобно нитридам гидролизуются водой:
- А также водными растворами кислот-неокислителей:
Взаимодействие фосфора со сложными веществами
Фосфор окисляется кислотами окислителями, в частности, концентрированными азотной и серной кислотами:
Следует знать, что белый фосфор реагирует с водными растворами щелочей. Однако, ввиду специфичности умение записывать уравнения таких взаимодействий на ЕГЭ по химии пока еще не требовалось.
- Тем не менее, тем, кто претендует на 100 баллов, для собственного спокойствия, можно запомнить следующие особенности взаимодействия фосфора с растворами щелочей на холоду и при нагревании.
- На холоду взаимодействие белого фосфора с растворами щелочей протекает медленно. Реакция сопровождается образованием газа с запахом тухлой рыбы — фосфина и соединения с редкой степенью окисления фосфора +1:
- При взаимодействии белого фосфора с концентрированным раствором щелочи при кипячении выделяется водород и образуется фосфит:






