- Химические свойства кислот, их классификация и реакции
- Химические свойства кислот
- 1. Диссоциация
- 2. Разложение
- 3. Реакция с металлами
- 4. Реакции с основаниями
- 5. Реакции кислот с солями
- 6. Реакция кислот с основными и амфотерными оксидами
- 7. Восстановительные свойства бескислородных кислот
- Физические свойства кислот
- 2.6. Характерные химические свойства кислот
- 1) Наличие атомов кислорода в кислоте
- 2) Основность кислоты
- 3) Летучесть
- 4) Растворимость
- 5) Устойчивость
- 6) Способность к диссоциации
- 7) Окисляющие свойства
- Химические свойства кислот
- 1. Способность к диссоциации
- 2. Взаимодействие кислот с металлами
- 3. Взаимодействие кислот с основными и амфотерными оксидами
- 4. Взаимодействие кислот с основаниями и амфотерными гидроксидами
- 5. Взаимодействие кислот с солями
- 6. Специфические окислительные свойства азотной и концентрированной серной кислот
- 7. Восстановительные свойства бескислородных кислот
- Взаимодействие металлов с растворами кислот
- Характерные химические свойства кислот
- Общая характеристика
- Классификация:
- Физические свойства
- Химические свойства
- Изменение цвета индикаторов
- Взаимодействие кислот с металлами
- Взаимодействие кислот с основными и амфотерными оксидами
- Взаимодействие кислот с основными и амфотерными гидроксидами
- Взаимодействие кислот с солями
- Разложение кислородсодержащих кислот
- Какие условия необходимы для взаимодействия металлов с растворами кислот?
- Page 2
С разбавленными кислотами, которые проявляют
окислительные свойства за счет ионов водорода (разбавленные серная,
фосфорная, сернистая, все бескислородные и органические кислоты и др.)
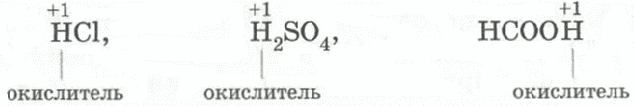
реагируют металлы:
• расположенные в ряду напряжений до водорода (эти металлы способны
вытеснять водород из кислоты);
• образующие с этими кислотами растворимые соли (на поверхности этих металлов
не образуется защитная солевая пленка).
В результате реакции образуются растворимые соли и выделяется водород:
2А1 + 6НСI = 2А1С13 + ЗН2↑
Мg
+ Н2SO4 =
МgSu
+ Н2 SO4 →X(так
как Сu
стоит после Н2) разб.
РЬ + Н2
SO4 →X(так
как РЬSO4
нерастворим
в воде) разб.
Некоторые кислоты являются окислителями за счет элемента, образующего кислотный
остаток, К ним относятся концентрированная серная, а также азотная кислота
любой концентрации. Такие кислоты называют кислотами-окислителями.
Анионы
данных кислот содержат атомы серы и азота в высших степенях окисления

Окислительные свойства кислотных остатков и
значительно сильнее, чем нона водорода Н, поэтому азотная и концентрированная
серная кислоты взаимодействуют практически со всеми металлами, расположенными в
ряду напряжений как до водорода, так и после него, кроме золота и платины.
Так как окислителями в этих случаях являются ноны кислотных остатков (за
счет атомов серы и азота в высших степенях окисления), а не ноны водорода Н, то
при взаимодействии азотной, а концентрированной серной кислот с металлами
не выделяется водород.
Металл под действием данных кислот окисляется до характерной
(устойчивой) степени окисления и образует соль, а продукт восстановления
кислоты зависит от активности металла и степени разбавления кислоты

Взаимодействие серной кислоты с металлами
Разбавленная и концентрированная серные кислоты ведут
себя по-разному. Разбавленная серная кислота ведет себя, как обычная
кислота. Активные металлы, стоящие в
ряду напряжений левее водорода
Li, К, Ca, Na, Mg, Al, Mn, Zn, Fe, Co, Ni, Sn, Pb, H2, Cu,
Hg, Ag, Au
вытесняют водород из разбавленной серной кислоты. Мы
видим пузырьки водорода при добавлении разбавленной серной кислоты в пробирку с
цинком.
-
H2SO4
+ Zn = Zn SO4 + H2 ↑ -
Медь стоит в ряду напряжений после водорода – поэтому
разбавленная серная кислота не действует на медь. А в концентрированной серной
кислоты, цинк и медь, ведут себя таким образом… -
Цинк, как активный металл, может образовывать с
концентрированной серной кислотой сернистый газ, элементарную серу, и даже
сероводород. -
2H2SO4 + Zn = SO2↑
+ZnSO4 + 2H2O
Медь — менее активный металл. При взаимодействии с
концентрированно серной кислотой восстанавливает ее до сернистого газа.
-
2H2SO4
конц. + Cu = SO2↑ + CuSO4 + 2H2O -
В пробирках с концентрированной серной кислотой
выделяется сернистый газа. -
Следует иметь в виду, что на схемах указаны продукты,
содержание которых максимально среди возможных продуктов восстановления кислот.
На основании
приведенных схем составим уравнения конкретных реакций — взаимодействия меди и
магния с концентрированной серной кислотой: 0 +6
+2 +4
С
u
+ 2Н2SO4
= СuSO4
+ SO2
+ 2Н2Og
+ 5Н2SO4
= 4МgSO4
+ Н2S
+ 4Н2O
Некоторые металлы (Fe.
АI, Сr)
не взаимодействуют с концентрированной серной и азотной кислотами при обычной
температуре,
так как происходит пассивации металла.
Это явление связано с образованием на поверхности металла тонкой, но очень
плотной оксидной пленки, которая и защищает металл. По этой причине азотную и концентрированную
серную кислоты транспортируют в железных емкостях.
Если металл проявляет переменные степени окисления, то с кислотами, являющимися
окислителями за счет ионов Н+, он образует соли, в которых его
степень окисления ниже устойчивой, а с кислотами-окислителями — соли, в которых
его степень окисления более устойчива: 0 +2 Fе+Н2SO4=
FеSO4+Н2
0 разб. +3
Fе+Н2SO4=
Fе2(SO4)3 + 3SO2 + 6Н2O
И.И.Новошинский
Н.С.Новошинская Химия
не забудь….) поделиться с друзьями
Химические свойства кислот, их классификация и реакции
Кислоты — класс сложных химических веществ, состоящих из атомов водорода и кислотных остатков.
В первую очередь кислоты делятся на:
- органические или карбоновые и
- неорганические или минеральные.
Свойства карбоновых кислот подробно разбираются в статье Карбоновые кислоты (ссылка на статью)
В зависимости от количества атомов водорода, которые могут замещаться в химических реакциях различают:
- одноосновные кислоты
- двухосновные кислоты
- трехосновные кислоты.
Не смотря на то, что в уксусной кислоте четыре атома водорода, три из них принадлежат кислотному остатку и в реакциях замещения не участвуют. Соответственно, уксусная кислота — одновалентная.
Свойства неорганических кислот также зависят от наличия в их составе кислорода и делятся на
- бескислородные
- кислородсодержащие.
Растворы кислот способны диссоциировать и проводить электрический ток т.е. являются электролитами. В зависимости от степени диссоциации делятся на:
- сильные
- слабые электролиты.

Химические свойства кислот
1. Диссоциация
- При диссоциации кислот образуются катионы водорода и анионы кислотного остатка.
- HNO3 → H+ + NO-3
- HCl → H+ + Cl-
- Многоосновные кислоты диссоциируют ступенчато.
- Н3РО4 ↔ Н+ + Н2РО-4 (первая ступень)
- Н2РО-4 ↔ Н+ + НРO2-4 (вторая ступень)
- НРО2-4 ↔ Н+ + PОЗ-4 (третья ступень)
2. Разложение
- Кислородсодержащие кислоты разлагаются на оксиды и воду.
- H2CO3 → H2O + CO2↑
- Бескислородные на простые вещества
3. Реакция с металлами
Кислоты реагируют лишь с теми металлами, что стоят в ряду активности до кислорода. В результате взаимодействия образуется соль и выделяется водород.
Mg + 2HCl → MgCl2 + H2↑
Найти ряд активности можно на последней странице электронного учебника «Химия 9 класс» под редакцией В. В. Еремина.
Бдительные ученики могут сказать: «Золото стоит в ряду активности металлов после водорода, а с „царской водкой“ реагирует. Как же так?»
Из всех правил есть исключения.
Поскольку в состав азотной кислоты входит азот со степенью окисления +5, а в состав серной — сера со степенью окисления +6, то с металлами реагируют не ионы водорода, а более сильные окислители. Образуется соль, но не происходит выделения водорода.
Au + HNO3 + 4HCl → HAuCl4 + NO + 2H2O.
4. Реакции с основаниями
В результате образуются соль и вода, происходит выделение тепла.
Na2CO3 + 2CH3 — COOH → 2CH3 — COONa + H2O + CO2↑.
Реакции такого типа называются реакциями нейтрализации. Простейшая реакция, которую можно провести на собственной кухне — гашение соды столовым уксусом или 9%раствором уксусной кислоты.
5. Реакции кислот с солями
Вспомним, когда мы разбирали ионные уравнения ( ссылка на статью), одним из условий протекания реакций было образование в ходе взаимодействия нерастворимой соли, выделение летучего газа или слабо диссоциирующего вещества — например, воды. Те же условия сохраняются и для реакций кислот с солями.
BaCl2 + H2SO4 → BaSO4↓ + 2HCl↑
6. Реакция кислот с основными и амфотерными оксидами
В ходе реакции образуется соль и происходит выделение воды.
K2O + 2HNO3 → 2KNO3 + H2O
7. Восстановительные свойства бескислородных кислот
Если в окислительных реакциях первую скрипку играет водород, то в восстановительных реакциях основная роль принадлежит анионному остатку. В результате реакций образуются свободные галогены.
4HCl + MnO2 → MnCl2 + Cl2↑ + 2H2O
Физические свойства кислот
При нормальных условиях (Атмосферное давление = 760 мм рт. ст. Температура воздуха 273,15 K = 0°C) кислоты чаще жидкости, хотя встречаются и твердые вещества: например ортофосфорная H3PO4 или кремниевая H2SiO3.
- Некоторые кислоты представляют собой растворы газов в воде: фтороводородная-HF, соляная-HCl, бромоводородная-HBr.
- Кислотные свойства кислот в ряду HF → HCl → HBr → HI усиливаются.
- Для некоторых кислот (соляная, серная, уксусная) характерен специфический запах.
- Благодаря наличию ионов водорода в составе, кислоты обладают характерным кислым вкусом.
- Химическая лаборатория не ресторан, и в целях безопасности существует жесткий запрет на опробование на вкус химических веществ.
- Как же можно определить кислота в пробирке или нет?
В 1300 году был открыт лакмус, и с тех пор алхимикам и химикам не пришлось рисковать своим здоровьем, пробуя на вкус содержимое пробирок. Запомните, что лакмус в кислой среде краснеет.
Вторым широко используемым индикатором является фенолфталеин.
Простой мнемонический стишок поможет запомнить, как ведут себя индикаторы в разных средах.
Индикатор лакмус — красный Кислоту укажет ясно. Индикатор лакмус — синий, Щёлочь здесь — не будь разиней, Когда ж нейтральная среда, Он фиолетовый всегда. Фенолфталеиновый — в щелочах малиновый
Но несмотря на это в кислотах он без цвета.
Что ещё почитать? Неметаллы Биография Д.И. Менделеева. Интересные факты из жизни великого химика Карбоновые кислоты Массовая доля вещества
18HBr + 2KMnO4 →2KBr + 2MnBr2 + 8H2O + 5Br2
14НI + K2Cr2O7 →3I2↓ + 2Crl3 + 2KI + 7H2O
#ADVERTISING_INSERT#
2.6. Характерные химические свойства кислот
Кислоты можно классифицировать исходя из разных критериев:
1) Наличие атомов кислорода в кислоте
| Кислородсодержащие | Бескислородные |
| H3PO4,HNO3,HNO2,H2SO4,H3PO4,H2CO3,H2CO3, HClO4 все органические кислоты (HCOOH, CH3COOH и т.д.) | HF, HCl, HBr, HI, H2S |
2) Основность кислоты
Основностью кислоты называют число «подвижных» атомов водорода в ее молекуле, способных при диссоциации отщепляться от молекулы кислоты в виде катионов водорода H+, а также замещаться на атомы металла:
| одноосновные | двухосновные | трехосновные |
| HBr, HCl, HNO3, HNO2, HCOOH, CH3COOH | H2SO4, H2SO3, H2CO3, H2SiO3 | H3PO4 |
3) Летучесть
Кислоты обладают различной способностью улетучиваться из водных растворов.
| Летучие | Нелетучие |
| H2S, HCl, CH3COOH, HCOOH | H3PO4, H2SO4, высшие карбоновые кислоты |
4) Растворимость
| Растворимые | Нерастворимые |
| HF, HCl, HBr, HI, H2S, H2SO3, H2SO4, HNO3, HNO2, H3PO4, H2CO3, CH3COOH, HCOOH | H2SiO3, высшие карбоновые кислоты |
5) Устойчивость
| Устойчивые | Неустойчивые |
| H2SO4, H3PO4, HCl, HBr, HF | H2CO3, H2SO3 |
6) Способность к диссоциации
| хорошо диссоциирующие (сильные) | малодиссоциирующие (слабые) |
| H2SO4, HCl, HBr, HI, HNO3, HClO4 | H2CO3, H2SO3, H2SiO3 |
7) Окисляющие свойства
| слабые окислители (проявляют окислительные свойства за счет катионов водорода H+) | сильные окислители (проявляют окислительные свойства за счет кислотообразующего элемента) |
| практически все кислоты кроме HNO3 и H2SO4 (конц.) | HNO3 любой концентрации, H2SO4 (обязательно концентрированная) |
Химические свойства кислот
1. Способность к диссоциации
- либо в таком виде: HCl = H+ + Cl—
- либо в таком: HCl → H+ + Cl—
- По сути направление стрелки говорит нам о том, что обратный процесс объединения катионов водорода с кислотными остатками (ассоциация) у сильных кислот практически не протекает.
- В случае, если мы захотим написать уравнение диссоциации слабой одноосновной кислоты, мы должны использовать в уравнении вместо знака две стрелки . Такой знак отражает обратимость диссоциации слабых кислот — в их случае сильно выражен обратный процесс объединения катионов водорода с кислотными остатками:
- CH3COOH CH3COO— + H+
Многоосновные кислоты диссоциируют ступенчато, т.е. катионы водорода от их молекул отрываются не одновременно, а по очереди. По этой причине диссоциация таких кислот выражается не одним, а несколькими уравнениями, количество которых равно основности кислоты. Например, диссоциация трехосновной фосфорной кислоты протекает в три ступени с поочередным отрывом катионов H+ :
- H3PO4 H+ + H2PO4—
- H2PO4— H+ + HPO42-
- HPO42- H+ + PO43-
Следует отметить, что каждая следующая ступень диссоциации протекает в меньшей степени, чем предыдущая. То есть, молекулы H3PO4 диссоциируют лучше (в большей степени), чем ионы H2PO4— , которые, в свою очередь, диссоциируют лучше, чем ионы HPO42-. Связано такое явление с увеличением заряда кислотных остатков, вследствие чего возрастает прочность связи между ними и положительными ионами H+.
Из многоосновных кислот исключением является серная кислота. Поскольку данная кислота хорошо диссоциирует по обоим ступеням, допустимо записывать уравнение ее диссоциации в одну стадию:
H2SO4 2H+ + SO42-
2. Взаимодействие кислот с металлами
Седьмым пунктом в классификации кислот мы указали их окислительные свойства. Было указано, что кислоты бывают слабыми окислителями и сильными окислителями. Подавляющее большинство кислот (практически все кроме H2SO4(конц.
) и HNO3) являются слабыми окислителями, так как могут проявлять свою окисляющую способность только за счет катионов водорода.
Такие кислоты могут окислить из металлов только те, которые находятся в ряду активности левее водорода, при этом в качестве продуктов образуется соль соответствующего металла и водород. Например:
H2SO4(разб.) + Zn ZnSO4 + H2
2HCl + Fe FeCl2 + H2
Что касается кислот-сильных окислителей, т.е. H2SO4 (конц.) и HNO3, то список металлов, на которые они действуют, намного шире, и в него входят как все металлы до водорода в ряду активности, так и практически все после.
То есть концентрированная серная кислота и азотная кислота любой концентрации, например, будут окислять даже такие малоактивные металлы, как медь, ртуть, серебро.
Более подробно взаимодействие азотной кислоты и серной концентрированной с металлами, а также некоторыми другими веществами из-за их специфичности будет рассмотрено отдельно в конце данной главы.
3. Взаимодействие кислот с основными и амфотерными оксидами
- Кислоты реагируют с основными и амфотерными оксидами. Кремниевая кислота, поскольку является нерастворимой, в реакцию с малоактивными основными оксидами и амфотерными оксидами не вступает:
- H2SO4 + ZnO ZnSO4 + H2O
- 6HNO3 + Fe2O3 2Fe(NO3)3 + 3H2O
- H2SiO3 + FeO ≠
4. Взаимодействие кислот с основаниями и амфотерными гидроксидами
HCl + NaOH H2O + NaCl
3H2SO4 + 2Al(OH)3 Al2(SO4)3 + 6H2O
5. Взаимодействие кислот с солями
- Данная реакция протекает в случае, если образуется осадок, газ либо существенно более слабая кислота, чем та, которая вступает в реакцию. Например:
- H2SO4 + Ba(NO3)2 BaSO4↓ + 2HNO3
- CH3COOH + Na2SO3 CH3COONa + SO2↑ + H2O
- HCOONa + HCl HCOOH + NaCl
6. Специфические окислительные свойства азотной и концентрированной серной кислот
Как уже было сказано выше, азотная кислота в любой концентрации, а также серная кислота исключительно в концентрированном состоянии являются очень сильными окислителями. В частности, в отличие от остальных кислот они окисляют не только металлы, которые находятся до водорода в ряду активности, но и практически все металлы после него (кроме платины и золота).
Так, например, они способны окислить медь, серебро и ртуть.
Следует однако твердо усвоить тот факт, что ряд металлов (Fe, Cr, Al) несмотря на то, что являются довольно активными (находятся до водорода), тем не менее, не реагируют с концентрированной HNO3 и концентрированной H2SO4 без нагревания по причине явления пассивации — на поверхности таких металлов образуется защитная пленка из твердых продуктов окисления, которая не позволяет молекулами концентрированной серной и концентрированной азотной кислот проникать вглубь металла для протекания реакции. Однако, при сильном нагревании реакция все таки протекает.
В случае взаимодействия с металлами обязательными продуктами всегда являются соль соответствующего метала и используемой кислоты, а также вода. Также всегда выделяется третий продукт, формула которого зависит от многих факторов, в частности, таких, как активность металлов, а также концентрация кислот и температура проведения реакций.
Высокая окислительная способность концентрированной серной и концентрированной азотной кислот позволяет им реагировать не только практическим со всеми металлами ряда активности, но даже со многими твердыми неметаллами, в частности, с фосфором, серой, углеродом. Ниже в таблице наглядно представлены продукты взаимодействия серной и азотной кислот с металлами и неметаллами в зависимости от концентрации:
7. Восстановительные свойства бескислородных кислот
Все бескислородные кислоты (кроме HF) могут проявлять восстановительные свойства за счет химического элемента, входящего в состав аниона, при действии различных окислителей. Так, например, все галогеноводородные кислоты (кроме HF) окисляются диоксидом марганца, перманганатом калия, дихроматом калия. При этом галогенид-ионы окисляются до свободных галогенов:
- 4HCl + MnO2 MnCl2 + Cl2↑ + 2H2O
- 16HBr + 2KMnO4 2KBr + 2MnBr2 + 8H2O + 5Br2
- 14НI + K2Cr2O7 3I2↓ + 2Crl3 + 2KI + 7H2O
Среди всех галогеноводородных кислот наибольшей восстановительной активностью обладает иодоводородная кислота. В отличие от других галогеноводородных кислот ее могут окислить даже оксид и соли трехвалентного железа.
- 6HI + Fe2O3 2FeI2 + I2↓ + 3H2O
- 2HI + 2FeCl3 2FeCl2 + I2↓ + 2HCl
- Высокой восстановительной активностью обладает также и сероводородная кислота H2S. Ее может окислить даже такой окислитель, как диоксид серы:
- 2H2S + SO2 3S↓+ 2H2O
Взаимодействие металлов с растворами кислот
- При взаимодействии с водными растворами кислот металлы проявляют типичные для них восстановительные свойства, кислоты выступают в качестве окислителей. Они делятся на две группы:
- · кислоты, окислителями в которых является ион водорода ( HCl, HBr, HI, разбавленная серная кислота и др.);
- · кислоты, окислителем в которых выступают анионы, содержащие элементы в высшей степени окисления, это концентрированная серная, азотная, хлорная (окислители – анионы SO42-, NO3- , ClO4 -) и другие кислоты.
- Для протекания любого окислительно-восстановительного процесса
необходимо выполнение условия: окислительно-восстановительный потенциал окислителя больше потенциала восстановителя (jок.>jвосст., Dj>0).
В соответствии с этим условием в кислотах первой группы (окислитель – ион водорода, j02H+¤ H2= 0 B) растворяются только металлы, характеризующиеся отрицательным стандартным потенциалом. Это металлы, стоящие в ряду стандартных электродных потенциалов (ряд напряжений, вытеснительный ряд) до водорода.
Пример. Рассмотрим взаимодействие магния и серебра с разбавленной серной кислотой.
- Выписываем из ряда стандартных окислительно-восстановительных потенциалов потенциалы окислителя и восстановителя (см.приложение 5):
- j02H+¤ H2= 0 B, j0Mg2+¤ Mg = -2,36 B, j0Ag+¤ Ag= 0,80 B.
- Для магния Dj=0-(-2,36) =2,36 В > 0,
- для серебра Dj=0-0,80 = -0,80 В < 0.
- Следовательно, магний растворяется, а серебро не растворяется в разбавленной серной кислоте.
- Уравнение реакции взаимодействия магния с разбавленной серной кислотой составляем, используя описанный ранее алгоритм.
- Mg + H2SO4разб. ® Mg2+, H2
- 1 Mg — 2e ® Mg2+
- 1 2H+ + 2e ® H2
- Mg + 2H+ ® Mg2+ + H2
- Mg + H2SO4 = MgSO4 + H2
- Состав продуктов взаимодействия металлов с концентрированной серной и азотной (как концентрированной, так и разбавленной) кислотами определяется активностью металла.
По активности металлы условно делят на три группы: активные металлы, стоящие в ряду стандартных потенциалов (ряд активности — см. приложение 3) до марганца (Li…Al), металлы средней активности – от марганца до свинца (Mn…Pb) – и малоактивные металлы, стоящие после водорода (Cu…Au).
- Ниже приведены схемы взаимодействия металлов с концентрированной серной и разбавленной азотной кислотами:
- -2
- акт. Ме Me n(SO4)m+Н2О + H2S
+6 ср. акт. Ме Me n(SO4)m + H2O + S0¯
- Ме0 + H2SO4 конц.
- вос-ль окислитель +4
- мало акт. Ме Me n(SO4)m + H2O + SO2
- -3
- акт. Ме Me (NO3)m+Н2О + NH4NO3
- 0 +1
+5 ср. акт. Ме Me(NO3)m + H2O +N2(или N2O)
- Ме0 + HNO3разб. +2
- вос-ль окислитель мало акт. Ме Me(NO3)m + H2O + NO
- С концентрированной азотной кислотой все металлы взаимодействуют согласно схеме:
- +5 +4
Me0 + HNO3 конц. ® Me n(NO3)m + H2O + NO2.
Золото и платина (Au,Pt) растворяются только в «царской водке» — смеси концентрированных соляной и азотной кислот.
Взаимодействие металлов с кислотами в некоторых случаях тормозится образованием нерастворимых оксидных или солевых пленок, препятствующих дальнейшему растворению. Такие пленки называются пассивирующими, а состояние металла – пассивным. В концентрированной холодной серной кислоте пассивируются Fe, Ni, Ti, Cr, Pb, в концентрированной холодной азотной кислоте — Al, Fe, Ni, Ti, Cr, Sn.
Взаимодействие металлов с водой
При взаимодействии металлов с водой вода является окислителем, а металл – восстановителем. Возможность взаимодействия, как и для любой ОВР, определяется условием jок — jвосст. > 0.
Стандартные окислительно-восстановительные потенциалы ряда металлов, кислорода и водорода в разных средах приведены в таблице –см. приложение 5.
При рассмотрении возможности реакции металла с водой необходимо учитывать не только разность потенциалов окислителя и восстановителя, но и характер образующегося продукта.
Пример. Рассмотреть устойчивость к воде алюминия.
- Сравниваем потенциалы металла и водорода в нейтральной среде(см. приложение 5):
- j02H2O/H2= -0,41 B, j0Al(OH)3/Al = -1,88 B;
- Dj = -0,41 -( -1,88) = 1,47 B > 0.
- Таким образом, условие взаимодействия выполняется. Записываем уравнение реакции:
- 2 Al — 3e + 3H2O ® Al(OH)3 + 3H+
- 3 2H2O + 2e ® H2 + 2OH-
- 2Al + 6H2O + 6H2O ® 2Al(OH)3 + 6H+ + 6OH- + 3H2
- 6H2O
- Молекулярное уравнение:
- 2 Al + 6H2O = 2Al(OH)3 ¯ + 3H2.
Образовавшаяся пленка нерастворимого гидроксида Al(OH)3 плотно прилегает к поверхности металла, защищая его от дальнейшего окисления. Следовательно, алюминий устойчив по отношению к воде. Вследствие образования нерастворимых гидроксидов не реагируют с водой цинк, хром, никель, титан и ряд других металлов.
Практически в воде растворяются только щелочные и щелочноземельные металлы (Li…Fr, Ca…Ra).
Характерные химические свойства кислот
Характерные химические свойства кислот добавить в закладки
Кислоты – это химические соединения, содержащие в себе положительный атом водорода (катион H+) и кислотный остаток (анион A-). Является сложным веществом.
Общая характеристика
В первую очередь кислоты различают по растворимости. Есть нерастворимые, растворимые и полурастворимые кислоты. Эти различия прописаны в таблице растворимости, так что наизусть запоминать не требуется.
Классификация:
- Кислоты различают по составу на кислородсодержащие и бескислородные. Примеры кислот приведены ниже в таблице. Бескислородные кислоты – это растворы галогеноводородов, атомы которых в растворе связаны полярной ковалентной связью. Название кислоты складывается из названия кислотного остатка в первую очередь, а дальше называется катион (водород). Так с хлором и водородом образуется хлороводородная кислота, а с серой – сероводородная. Кислородосодержащие кислоты, или оксокислоты называют за счёт наличия в них кислорода. Общего принципа построения названия этих кислот нет, так что их названия необходимо запоминать на память.
- Кислоты различают по количеству атомов водорода на одноосновные (один атом водорода), двухосновные (два атома водорода), трёхосновные (три атома водорода).
| Основность кислоты — это число активных атомов водорода в молекуле кислоты | |
| Одноосновные | HClO4, HCl |
| Двухосновные | H2SO4, H2CO3 |
| Трехосновные | H3PO4 |
- Кислоты разделяют на сильные и слабые. К сильным относят галогенводородные и высшие кислородсодержащие кислоты, они растворимы. К слабым относят неустойчивые и нерастворимые в воде кислоты. Чтобы определить силу кислоты, существует правило: из числа атомов кислорода вычесть число атомов водорода, если получаемое число 2 или 3 – кислота сильная, если 1 или 0 – кислота слабая.
Физические свойства
Кислоты, в зависимости от условий, могут быть в трёх агрегатных состояниях: в жидком, твёрдом и газообразном состоянии. Кислоты могут обладать цветом и запахом.
Химические свойства
Изменение цвета индикаторов
Кислота в водной среде способна изменить цвет разных индикаторов. Кислоты окрашивают в красных цвет лакмус, метилоранж и универсальный индикатор. Фенолфталеин не окрашивается.
Взаимодействие кислот с металлами
- Кислота способна реагировать только с металлами, находящимися левее водорода в ряду активности металлов.
- Mg + 2HCl → MgCl2 + H2↑
- Из приведенного выше химического уравнения нужно отметить, что при взаимодействии кислоты и металла происходит реакция замещения, образуется соль и выделяется H2.
Взаимодействие кислот с основными и амфотерными оксидами
- При взаимодействии кислоты с основным или амфотерным оксидами происходит реакция обмена в результате которой образуются соль и H2O.
- В качестве примера приведены следующие реакции:
- K2O + 2HNO3 → 2KNO3 + H2O Al2O3 + 6HCl → 2AlCl3 + 3H2O
- Из приведённого выше химического уравнения нужно отметить, что в реакциях основного оксида калия и амфотерного оксида алюминия (III) с кислотами, образуется соль и H2O.
Взаимодействие кислот с основными и амфотерными гидроксидами
При взаимодействии кислоты с основным и амфотерным гидроксидами образуются H2O и новая соль, как и в случае с оксидами, происходит реакция обмена. Второе название этой реакции — реакция нейтрализации.
KOH + HNO3 → KNO3 + H2O Al(OH)3 + 3HCl → AlCl3 + 3H2O
Из приведённой выше химического уравнения нужно отметить, что при реакции основного гидроксида калия и амфотерного гидроксида алюминия (III) с кислотами образуются соль и H2O.
Взаимодействие кислот с солями
Реакция кислоты с солью является реакцией обмена, так же ее называют реакцией нейтрализации. Она возможно только в случае выпадения соли в осадок, выделения газа, слабые электролиты или вода. Рассмотрим все случаи более подробно.
- Реакции, в результате которых выпадает осадок. H2SO4 + BaCl2 → BaSO4↓ + 2HCl Na2SiO3 + 2HNO3 → H2SiO3↓ + 2NaNO3 Из приведённого выше химического уравнения можно увидеть, что при взаимодействии кислоты и соли образуются новые кислота и нерастворимая соль, которые выпадают в осадок. Осадок может иметь различную окраску, плотность и консистенцию.
- Реакции, в результате которых при нагревании или обычных условиях выделяется газ. NaCl(тв.) + H2SO4 (конц.) → Na2SO4 + 2HCl↑ FeS + 2HCl → FeCl2 + H2S↑ Из приведённых выше химических уравнений нужно отметить, что при реакции соли с кислотой образуется новая соль и выделяется газ. Разберём одну из реакций: при взаимодействии твёрдого хлорида натрия с концентрированной хлороводородной кислотой образовалась натриевая соль серной кислоты и выделился летучий газ хлороводород.
- Реакции, в результате которых образуется слабый электролит. Такие реакции возможны только при условии, когда одним из реагентов сильный электролит. Для того, чтобы убедиться, что реакция будет протекать используют вытеснительный ряд: В этом ряду кислоты расположены так, что в растворах кислот и их солей могут в результате реакции вытесняют из раствора те, что стоят левее в ряду. Азотная и фосфорная кислоты находятся на одном месте в ряду, т.к. имеют одинаковые вытеснительные способности. Из приведённого выше химического уравнения нужно отметить, что хлороводородная кислота, которая находится в данном ряду левее, способна вытеснять кислотный остаток карбоновой кислоты, стоящей в ряду правее. Нужно учитывать, что карбоновая кислота слабая и при стандартных условиях она распадется на углекислый газ и воду. Углекислый газ выделяется из раствора, а вода остаётся.
Разложение кислородсодержащих кислот
В результате реакции разложения кислородсодержащих кислот всегда образуется вода и оксид.
Из приведённых выше реакций можно увидеть, что карбоновая легко разлагается при обычных условиях, так как является одной из самых слабой кислотой. Для разложения сернистой и кремниевой кислоты их растворы необходимо нагреть. Во всех трёх реакция в результате образуется вода и оксиды кислотных остатков.
Смотри также:
- Номенклатура неорганических веществ
- Характерные химические свойства простых веществ – металлов: щелочных, щелочноземельных, магния, алюминия; переходных металлов (меди, цинка, хрома, железа)
- Характерные химические свойства простых веществ – неметаллов: водорода, галогенов, кислорода, серы, азота, фосфора, углерода, кремния
- Характерные химические свойства оксидов: оснóвных, амфотерных, кислотных
- Характерные химические свойства оснований и амфотерных гидроксидов
- Характерные химические свойства солей: средних, кислых, оснóвных; комплексных ( на примере соединений алюминия и цинка)
- Взаимосвязь различных классов неорганических веществ
Какие условия необходимы для взаимодействия металлов с растворами кислот?
Поиск задач
Найти задачу можно, введя ее условие. Если с первого раза не нашли решение на нужное готовое задание, попробуте поиск по другим похожим ключевым фразам из ее условия
Page 2
Решенные задачи из задачников для школьников, абитуриентов, студентов по всем учебным дисциплинамСтраницы: 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 21 22 23 24 25 26 27 28 29 30 31 32 33 34 35 36 37 38 39 40 41 42 43 44 45 46 47 48 49 50 51 52 53 54 55 56 57 58 59 60 61 62 63 64 65 66 67 68 69 70 71 72 73 74 75 76 77 78 79 80 81 82 83 84 85 86 87 88 89 90 91 92 93 94 95 96 97 98 99 100 101 102 103 104 105 106 107 108 109 110 111 112 113 114 115 116 117 118 119 120 121 122 123 124 125 126 127 128 129 130 131 132 133 134 135 136 137 138 139 140 141 142 143 144 145 146 147 148 149 150 151 152 153 154 155 156 157 158 159 160 161 162 163 164 165 166 167 168 169 170 171 172 173 174 175 176 177 178 179 180 181 182 183 184 185 186 187 188 189 190 191 192 193 194 195 196 197 198 199 200 201 202 203 204 205 206 207 208 209 210 211 212 213 214 215 216 217 218 219 220 221 222 223 224 225 226 227 228 229 230 231 232 233 234 235 236 237 238 239 240 241 242 243 244 245 246 247 248 249 250 251 252 253 254 255 256 257 258 259 260 261 262 263 264 265 266 267 268 269 270 271 272 273 274 275 276 277 278 279 280 281 282 283 284 285 286 287 288 289 290 291 292 293 294 295 296 297 298 299 300 301 302 303 304 305 306 307 308 309 310 311 312 313 314 315 316 317 318 319 320 321 322 323 324 325 326 327 328 329 330 331 332 333 334 335 336 337 338 339 340 341 342 343 344 345 346 347 348 349 350 351 352 353 354 355 356 357 358 359 360 361 362 363 364 365 366 367 368 369 370 371 372 373 374 375 376 377 378 379 380 381 382 383 384 385 386 387 388 389 390 391 392 393 394 395 396 397 398 399 400 401 402 403 404 405 406 407 408 409 410 411 412 413 414 415 416 417 418 419 420 421 422 423 424 425 426 427 428 429 430 431 432 433 434 435 436 437 438 439 440 441 442 443 444 445 446 447 448 449 450 451 452 453 454 455 456 457 458 459 460 461 462 463 464 465 466 467 468 469 470 471 472 473 474 475 476 477 478 479 480 481 482 483 484 485 486 487 488 489 490 491 492 493 494 495 496 497 498 499 500 501 502 503 504 505 506 507 508 509 510 511 512 513 514 515 516 517 518 519 520 521 522 523 524 525 526 527 528 529 530 531 532 533 534 535 536 537 538 539 540 541 542 543 544 545 546 547 548 549 550 551 552 553 554 555 556 557 558 559 560 561 562 563 564 565 566 567 568 569 570 571 572 573 574 575 576 577 578 579 580 581 582 583 584 585 586 587 588 589 590 591 592 593 594 595 596 597 598 599 600 601 602 603 604 605 606 607 608 609 610 611 612 613 614 615 616 617 618 619 620 621 622 623 624 625 626 627 628 629 630 631 632 633 634 635 636 Число записей в разделе: 15897
Рисунок 1 воспроизводит несколько положений работающего подъемного крана. Можно ли считать поступательным движение стрелы? груза?
2. Какие элементы аттракциона Колесо обозрения (рис. 2) движутся поступательно?
- Можно ли принять Землю за материальную точку при расчете: а) расстояния от Земли до Солнца; б) пути, пройденного Землей по орбите вокруг Солнца за месяц; в) длины экватора Земли; г) скорости движения точки экватора при суточном вращении Земли вокруг оси; д) скорости движения Земли по орбите вокруг Солнца
- Указать, в каких из приведенных ниже случаях изучаемое тело можно принять за материальную точку: а) вычисляют давление трактора на грунт; б) определяют высоту поднятия ракеты; в) рассчитывают работу, совершенную при поднятии в горизонтальном положении плиты перекрытия известной массы на заданную высоту; г) определяют объем стального шарика, пользуясь измерительным цилиндром (мензуркой)
- Можно ли принять за материальную точку снаряд при расчете: а) дальности полета снаряда; б) формы снаряда, обеспечивающей уменьшение сопротивления воздуха
- Можно ли принять за материальную точку железнодорожный состав длиной около 1 км при расчете пути, пройденного за несколько секунд?
На рисунке 3 изображен план футбольного поля на пришкольном участке. Найти координаты угловых флажков (O, B, C, D), мяча (E), зрителей (K, L, M).
Найти координаты (приблизительно) левого нижнего угла доски, правого верхнего угла стола, за которым вы сидите. Для этого связать систему отсчета с классом и совместить ось X с линией пересечения пола и стены, на которой висит доска, ось Y с линией пересечения пола и наружной стены, а ось Z с линией пересечения этих стен.
Сравнить пути и перемещения вертолета и автомобиля, траектории которых показаны на рисунке 4
Путь или перемещение мы оплачиваем при поездке в такси? самолете?
Мяч упал с высоты 3 м, отскочил от пола и был пойман на высоте 1 м. Найти путь и перемещение мяча
Движущийся равномерно автомобиль сделал разворот, описав половину окружности. Сделать чертеж, на котором указать пути и перемещения автомобиля за все время разворота и за треть этого времени. Во сколько раз пути, пройденные за указанные промежутки времени, больше модулей векторов соответствующих перемещений?
- На рисунке 5 показаны перемещения пяти материальных точек. Найти проекции векторов перемещения на оси координат
- На рисунке 6 показана траектория движения материальной точки из А в В. Найти координаты точки в начале и конце движения, проекции перемещения на оси координат, модуль перемещения
- На рисунке 7 показана траектория ABCD движения материальной точки из А в D. Найти координаты точки в начале и конце движения, пройденный путь, перемещение, проекции перемещения на оси координат
- Тело переместилось из точки с координатами x1=0, y1=2 м в точку с координатами x2=4 м, y2=-1 м. Сделать чертеж, найти перемещение и его проекции на оси координат
- Вертолет, пролетев в горизонтальном полете по прямой 40 км, повернул под углом 90° и пролетел еще 30 км. Найти путь и перемещение вертолета
- Катер прошел по озеру в направлении на северо-восток 2 км, а затем в северном направлении еще 1 км. Найти геометрическим построением модуль и направление перемещения
- Туристы прошли сначала 400 м на северо-запад, затем 500 м на восток и еще 300 м на север. Найти геометрическим построением модуль и направление их перемещения
По прямолинейной автостраде (рис.  движутся равномерно: автобус-вправо со скоростью 20 м/с, легковой автомобиль-влево со скоростью 15 м/с и мотоциклист-влево со скоростью 10 м/с. Координаты этих экипажей в момент начала наблюдения равны соответственно 500, 200 и-300 м.
движутся равномерно: автобус-вправо со скоростью 20 м/с, легковой автомобиль-влево со скоростью 15 м/с и мотоциклист-влево со скоростью 10 м/с. Координаты этих экипажей в момент начала наблюдения равны соответственно 500, 200 и-300 м.
Написать их уравнения движения.
Найти: а) координату автобуса через 5 с; б) координату легкового автомобиля и пройденный путь через 10 с; в) через какое время координата мотоциклиста будет равна-600 м; г) в какой момент времени автобус проезжал мимо дерева; д) где был легковой автомобиль за 20 с до начала наблюдения.
Движение грузового автомобиля описывается уравнением x1=-270 + 12t, а движение пешехода по обочине того же шоссе-уравнением x2=-1,5t. Сделать пояснительный рисунок (ось X направить вправо), на котором указать положение автомобиля и пешехода в момент начала наблюдения. С какими скоростями и в каком направлении они двигались? Когда и где они встретились
По заданным графикам (рис. 9) найти начальные координаты тел и проекции скорости их движения. Написать уравнения движения тел x=x(t). Из графиков и уравнений найти время и место встречи тел, движения которых описываются графиками II и III
Движения двух велосипедистов заданы уравнениями: x1=5t, x2=150-10t. Построить графики зависимости x(t). Найти время и место встречи
Графики движения двух тел представлены на рисунке 10. Написать уравнения движения x=x(t). Что означают точки пересечения графиков с осями координат
По прямому шоссе в одном направлении движутся два мотоциклиста. Скорость первого мотоциклиста 10 м/с. Второй догоняет его со скоростью 20 м/с. Расстояние между мотоциклистами в начальный момент времени равно 200 м.
Написать уравнения движений мотоциклистов в системе отсчета, связанной с землей, приняв за начало координат место нахождения второго мотоциклиста в начальный момент времени и выбрав за положительное направление оси X направление движения мотоциклистов.
Построить на одном чертеже графики движения обоих мотоциклистов (рекомендуемые масштабы: в 1 см 100 м; в 1 см 5 с). Найти время и место встречи мотоциклистов






