- Особенности слесарно-механических способов восстановления деталей
- Восстановление металлических деталей сваркой и наплавкой
- Газовая сварка
- Электродуговая сварка
- Способ восстановления деталей наплавкой
- Ремонт и восстановление деталей металлизацией
- Технология восстановления деталей наращиванием слоя стали гальваникой
- Твердое никелирование
- Способы и методы восстановления деталей давлением
- Восстановление и склеивание деталей при помощи пластмасс
- Понятие о металлургии: общие способы получения металлов
- 1. Нахождение металлов в природе
- 2. Получение активных металлов
- 3. Получение малоактивных и неактивных металлов
- 3.1. Обжиг сульфидов
- 3.2. Восстановление металлов углем
- 3.3. Восстановление металлов угарным газом
- 3.4. Восстановление металлов более активными металлами
- 3.5. Восстановление металлов из оксидов водородом
- 4. Производство чугуна
- Восстановление металлов
- ПОИСК
25.03.2020

Даже если какая-то часть функционального узла или заготовка получила повреждения, это еще не значит, что ее нужно непременно утилизировать.
Рассмотрим основные способы восстановления деталей – алгоритм действий и оборудование, которым необходимо при этом пользоваться.
Зачем? Чтобы вы знали, как правильно провести починку, и могли продлить срок эксплуатации поломанного элемента, а не тратиться на дорогостоящую замену.

Сразу отметим, что во всех случаях это комплексный процесс, предполагающий предварительную, сопутствующую и/или последующую обработку.
Последняя нужна, чтобы обеспечить соответствие стандартным посадкам сопряжения, а также убрать конусность и овальность деформированных поверхностей и обеспечить финальную чистоту покрытий.
Выполняемые технологические операции – строгание, шлифование, шабрение, в зависимости от глубины, размеров, степени серьезности полученных повреждений.
Особенности слесарно-механических способов восстановления деталей
Начнем с них, потому что именно они используются в подавляющем большинстве ситуаций, даже после других методов – для доводки. Хотя наиболее распространенные объекты их применения – плоскости: направляющих, клиньев, планок.

С их помощью также ремонтируют винты, валы, оси и тому подобные элементы, причем начиная с центровых отверстий.
Если царапины, потертости, овальность и другие риски незначительны (до 0,02 мм), поверхности подвергаются шлифовке, если же деформации более глубокие и серьезные, требуется провести наращивание с последующим обтачиванием и выравниванием до ближайших по значению стандартных параметров.
Ключевая особенность – правильный выбор базы: в этом случае основная установочная уже не подойдет, поэтому следует ориентироваться именно на вспомогательную.
Если износ значительный, в ходе механического способа восстановления деталей зачастую используют промежуточные компенсаторы, которые могут быть:
- подвижные – устраняющие образованный зазор посредством своего перемещения и, таким образом, делающие ремонт необязательной мерой;
- сменные – актуальные тогда, когда люфт уже слишком велик, чтобы его могло нивелировать простое перекрытие комплектующими.
Несколько типовых случаев использования данных элементов:
- посадка на клей (или напрессовка) втулки на цилиндрическую наружную поверхность направляющей оси;
- установка полувтулки на изношенную шейку коленчатого вала;
- использование ввертыша для отверстия с расточенной резьбой;
- компенсация истирания плоскостей при помощи привинченной планки.
Скрепление обычно происходит с одним из элементов сопряжения.
Отдельную группу представляют собой дефекты, появляющиеся и развивающиеся вследствие накопления внутренних напряжений, действия чрезмерных усилий или возникновения трещин и пробоин, больших царапин и задиров, участков выкрашивания. В этих случаях можно выполнить заливку или запайку, поставить штифт или заплатку – в зависимости от материала и характера повреждения.
Восстановление металлических деталей сваркой и наплавкой
Эти несколько способов актуальны тогда, когда нужно получить неразъемные соединения, вернуть исходные размеры сильно деформированным или даже разрушенным элементам, а также повысить стойкость поверхностей к физическим воздействиям.

На заре становления данные операции проводились вручную, сегодня же технологические процессы ремонта автоматизированы, что улучшает точность результата и повышает экономическую эффективность проводимых работ.
Примером современных решений в данной области могут быть мобильные станки от ряда известных производителей, в частности – модели НК450, НК750 и НС Пионер-4000 от ижевского завода «Сармат».
Такие машины предназначены для возвращения исходной геометрии отверстиям (устранения элипсности, стандартизации диаметра) и отличаются высокой производительностью, а также опцией удобной регулировки скорости вращения и подачи.
Исправлять полученные повреждения вручную, естественно, не столь просто: нет такого количества дополнительных возможностей, итог сильно зависит от опыта и мастерства человека, легче допустить ошибку и так далее. Но если случай нестандартный, или когда ремонтные работы нужно проводить в труднодоступном месте, где не установить даже самое мобильное оборудование, это до сих пор единственный из реальных вариантов.

При этом актуальны 3 метода – рассмотрим каждый по очереди.
Газовая сварка
Применяется для самых разных элементов, выполненных как из серого чугуна, так и из стали толщиной до 3 мм (тонколистовая). Для нее характерны следующие особенности:
- Горючая среда – ацетилен (чаще всего) или метан, пропан-бутан, водород.
- Чем ближе основной слой по химическому составу к присадке, тем лучше.
- Для улучшения прочности шва берут высокоуглеродистые и/или высоколегированные проволоки – марок НП-40 и НП-50, Св-08А и Св-08ГС, НП-651 и НП-10ГЗ и так далее.
- Мощность пламени и скорость нагрева регулируются в течение технологического процесса – наконечниками и мундштуком соответственно, так, чтобы конец присадочного прутка и расправленный материал как можно дольше находились в рабочей зоне.

Это эффективный способ восстановления изношенных деталей после образования усадочных раковин, изломов, пробоин. Она остается актуальной даже несмотря на то, что чугун сваривается сравнительно плохо (из-за большого содержания углеродистых, фосфорных, серных добавок).
Затрудняет ситуацию и склонность материала к растрескиванию под воздействием внутренних напряжений и резких перепадов температур, а именно эти явления и наблюдаются в ходе работ.
Чтобы шов был ровным и непористым, задачу решают или при местном (до 300-400 0С), или при полном подогреве (до 600-800 0С).
Электродуговая сварка
Если сравнивать ее с газовой, то она экономичнее и обеспечивает лучшую надежность стыка. Это более рациональный способ восстановления детали, особенно при правильной подготовке, в рамках которой нужно сделать следующее:
- очистить и разделать кромки;
- пройтись по поверхности стальной щеткой для очистки налипших частиц, напильником и наждачкой для абразивного эффекта, пескоструйной машиной для шлифовки – чтобы удалить неровности;
- промыть с помощью керосина или бензина, протравить щелочным составом;
- скосить кромки (если свариваются листы) под углом 60-70 градусов, выровнять края пробоин или изломов.
Естественно, все эти вспомогательные операции отнимают какое-то количество времени, но это кажущийся минус, так как они способствуют итоговому качеству результата – это целесообразные траты.

Способ восстановления деталей наплавкой
Актуален тогда, когда в процессе эксплуатации определенные элементы постоянно контактируют друг с другом и поверхность хотя бы одного из них необходимо защитить от истирания. Для этого наваривается два-три слоя более твердых материалов, значительно продлевающих общий срок эксплуатации.
Внимание, итоговый уровень стыка самым серьезным образом зависит от того, насколько поврежден элемент, в каком состоянии он находится.
Если он выполнен из стали или чугуна с малым содержанием углерода и обладает значительным количеством трещин и пор, их следует обезжиривать, потому что они практически наверняка насобирали достаточное количество масла.
Для этого необходимо провести обжиг – используя простую паяльную лампу, газовую горелку или даже нагревательную печь. Образовавшийся при этом налет нужно удалить с помощью наждачки или ветоши, вымоченной в бензине или керосине, а затем пройтись по участку будущего стыка стальной щеткой или абразивом.
Ремонт и восстановление деталей металлизацией
Это способ, с применением которого можно вернуть исходную геометрию посадочных мест коленчатых валов, зубчатых колес, подшипников качения, муфт. Он заключается в покрытии основного материала новым – защитным, расплавленным. При его реализации характерны следующие особенности:
- присадка распыляется струей воздуха (или другого газа под давлением);
- наносимая добавка оседает на поверхности (предварительно обезжиренной) в виде малых окисленных частиц;
- полученная таким образом прослойка является пористой, а не монолитной структурой.
Для улучшения качества сцепления поврежденная заготовка должна быть заранее очищена не только от масла, но и от грязи, а также отшлифована с помощью пескоструйной машины. Чем тверже используемый присадочный материал, тем надежнее будет конечный результат.
Гальванические покрытия
Одним из классических способов восстановления и упрочнения деталей стало хромирование, то есть нанесение слоя хрома толщиной до 0,3 мм. Благодаря этому можно не только вернуть исходную геометрию истертого элемента, но и повысить его твердость.
Образованная поверхность может быть:
- Гладкая – актуальна для тех заготовок, которые эксплуатируются при неподвижных посадках, так как не удерживает смазку.
- Пористая – выполняемая электрохимическим путем (конкретно – анодным травлением) и создаваемая для тех частей функционального узла, которые работают в жестких условиях постоянно повышенные температуры или их перепады, значительная скорость скольжения, чрезмерное удельное давление и тому подобное).
Есть и другие варианты обеспечения гальванических покрытий – несколько отличных от уже описанных и поэтому заслуживающих отдельного рассмотрения.
Технология восстановления деталей наращиванием слоя стали гальваникой
Еще одно ее распространенное название – железнение. Согласно ей, основная поверхность усиливается материалом, толщина которого достигает 2-3 мм или даже превышает данный показатель. Естественно, это несколько утяжеляет конечный вес, но зато позволяет возвращать исходную геометрию следующих элементов:
- со сравнительно низкой твердостью;
- подверженным истиранию и серьезным ударам одновременно;
- с неподвижными посадками;
- работающим на износ свыше 0,5 мм.
То есть применяется также и в тех случаях, когда предыдущие рассмотренные варианты не могут быть использованы, а значит сохраняет свою актуальность.

Твердое никелирование
При нем заводские размеры возвращаются благодаря осаждению на изношенном слое специального никельфосфорного состава. Он укладывается на определенные участки заготовки, по специальной маске, электрическим или химическим путем. Последний легче в реализации, так как при его осуществлении можно с помощью специализированных реагентов выделить нужную присадку из раствора солей.

Способы и методы восстановления деталей давлением
Все они сходны и базируются на эффекте пластичности, то есть на способности металла менять свои габариты и пространственную геометрию под воздействием значительных нагрузок (но не разрушаться при этом). В каждом из подобных случаев используется приспособление, переносящее частицы основного материала с неиспользуемых зон в поврежденные.
В результате такой обработки другим становится не только внешний вид заготовки, но также ее свойства. Поэтому особенно важно, чтобы перераспределение стали или чугуна не ухудшало эксплуатационных характеристик элемента, выполненного из сплава, а также не снижало его прочность.
Под давлением на практике возможны следующие виды восстановления деталей оборудования:
- правка рычагов, а также валов, как коленчатых так и гладких;
- осадка зубчатых колес, используемых пальцев, истертых втулок;
- накатка для практического повышения диаметров цапф, шеек направляющих осей за счет образования канавок и поднятия гребешков;
- обжатие вкладышей подшипников;
- вдавливание шлицевых валиков;
- раздача роликов машин, поршней, подобных им комплектующих.
Еще перечисленные варианты обработки позволяют увеличивать долговечность и твердость используемых заготовок. В результате их поверхность становится лучше защищенной от ударных воздействий и трения. Также в числе проводимых операций чеканка, бомбардировка дробью, обкатка, причем не только шариками, но и роликами.
Восстановление и склеивание деталей при помощи пластмасс
Эти материалы часто используются для получения качественного и прочного соединения неметаллических поверхностей.
В числе наиболее часто применяемых текстолит, стиракрил (очень быстро твердеет, поэтому так удобен), а также различные древесно-слоистые составы.
Последние особенно эффективны при возвращении исходных размеров направляющих промышленных станков, подшипников скольжения, зубчатых колес, втулок и подобных им элементов, испытывающих значительное трение в течение эксплуатационного цикла.
Склеивание – это вполне актуальная операция, которая в целом ряде случаев является отличной альтернативой свалке, клепке, соединению болтами. В качестве составляющей части технологического процесса восстановления деталей обладает следующими преимуществами:
- скрепляет разные по структуре материалы;
- не повышает конечный вес заготовки, а зачастую даже снижает его;
- обеспечивает герметичность шва и дает ему антикоррозионные свойства;
- минимизирует стоимость проведения обслуживания.
В качестве веществ-соединителей можно использовать клеевые составы карбинольного и БФ-типа. Они сделают стык-шов достаточно надежным, непористым, защищенным от влаги, воздействия щелочей, спиртов, кислот, ацетона и других растворителей. При этом довольно известные их марки отличаются экологичностью и сравнительно сбалансированным содержанием компонентов.

Все актуальные на сегодня способы восстановления и ремонта деталей склеиванием осуществляются в 3 этапа:
- Подготовка скрепляемых поверхностей, то есть их очистка от масла и грязи, с последующей пригонкой.
- Нанесение связующего состава – при помощи стеклянного стека или кисточки, на оба соединяемых элемента.
- Выдерживание под прессом, в течение 15-240 минут, при температуре от 60 до 200 0С (в зависимости от марки клея).
Резину и стали скрепляют между собой при помощи БФ-6 (отличается самым быстрым высыханием – за 0,25-1 часа), для предметов, эксплуатируемых в щелочной среде, актуален БФ-4, для работающих при температурах до 90 градусов по Цельсию – БФ-2. Но любой из них следует наносить в 2 слоя, с интервалом в 70-75 минут. Прижимное усилие пресса должно быть 1-15 кг/см2.
Мы постарались сделать классификацию способов восстановления деталей как можно более подробной – чтобы вы могли сразу понять, каким методом лучше всего воспользоваться в вашем случае. И если этот вариант потребует использования наплавочного станка, вы уже знаете, у кого стоит заказать высокопроизводительную и точную модель – у ижевского производителя «Сармат».
Понятие о металлургии: общие способы получения металлов
Понятие о металлургии: общие способы получения металлов
Металлургия — это наука о промышленных способах получения металлов. Различают черную и цветную металлургию.
Черная металлургия — это производство железа и его сплавов (сталь, чугун и др.).
Цветная металлургия — производство остальных металлов и их сплавов.
Широкое применение находят сплавы металлов. Наиболее распространенные сплавы железа — чугун и сталь.
Чугун — это сплав железа, в котором содержится 2-4 масс. % углерода, а также кремний, марганец и небольшие количества серы и фосфора.
Сталь — это сплав железа, в котором содержится 0,3-2 масс. % углерода и небольшие примеси других элементов.
Легированные стали — это сплавы железа с хромом, никелем, марганцем, кобальтом, ванадием, титаном и другими металлами. Добавление металлов придает стали дополнительные свойства. Так, добавление хрома придает сплаву прочность, а добавление никеля придает стали пластичность.
Основные стадии металлургических процессов:
- Обогащение природной руды (очистка, удаление примесей)
- Получение металла или его сплава.
- Механическая обработка металла
1. Нахождение металлов в природе
Большинство металлов встречаются в природе в виде соединений. Наиболее распространенный металл в земной коре — алюминий. Затем железо, кальций, натрий и другие металлы.
| Нахождение металлов в природе | ||
| Активные металлы — в виде солей | Металлов средней активности — в виде оксидов и сульфидов | Малоактивные металлы -в виде простых веществ |
| Хлорид натрия NaCl |
2. Получение активных металлов
Активные металлы (щелочные и щелочноземельные) классическими «химическими» методами получить из соединений нельзя.
Такие металлы в виде ионов — очень слабые окислители, а в простом виде — очень сильные восстановители, поэтому их очень сложно восстановить из катионов в простые вещества.
Чем активнее металл, тем сложнее его получить в чистом виде — ведь он стремится прореагировать с другими веществами.
- Получить такие металлы можно, как правило, электролизом расплавов солей, либо вытеснением из солей другими металлами в жестких условиях.
- Натрий в промышленности получают электролизом расплава хлорида натрия с добавками хлорида кальция:
- 2NaCl = 2Na + Cl2
- Калий получают пропусканием паров натрия через расплав хлорида калия при 800°С:
- KCl + Na = K↑ + NaCl
- Литий можно получить электролизом расплава хлорида лития в смеси с KCl или BaCl2 (эти соли служат для понижения температуры плавления смеси):
- 2LiCl = 2Li + Cl2
- Цезий можно получить нагреванием смеси хлорида цезия и специально подготовленного кальция:
- Са + 2CsCl = 2Cs + CaCl2
- Магний получают электролизом расплавленного карналлита или хлорида магния с добавками хлорида натрия при 720–750°С:
- MgCl2 → Mg + Cl2
- Кальций получают электролизом расплавленного хлорида кальция с добавками фторида кальция:
- CaCl2 → Ca + Cl2
- Барий получают из оксида восстановлением алюминием в вакууме при 1200 °C:
- 4BaO+ 2Al = 3Ba + Ba(AlO2)2
- Алюминий получают электролизом раствора оксида алюминия Al2O3 в криолите Na3AlF6:
- 2Al2O3 → 4Al + 3O2
3. Получение малоактивных и неактивных металлов
Металлы малоактивные и неактивные восстанавливают из оксидов углем, оксидом углерода (II) СО или более активным металлом. Сульфиды металлов сначала обжигают.
3.1. Обжиг сульфидов
- При обжиге сульфидов металлов образуются оксиды:
- 2ZnS + 3O2 → 2ZnO + 2SO2
- Металлы получают дальнейшим восстановлением оксидов.
3.2. Восстановление металлов углем
Чистые металлы можно получить восстановлением из оксидов углем. При этом до металлов восстанавливаются только оксиды металлов, расположенных в ряду электрохимической активности после алюминия.

- Например, железо получают восстановлением из оксида углем:
- 2Fe2O3 + 6C → 2Fe + 6CO
- ZnO + C → Zn + CO
- Оксиды металлов, расположенных в ряду электрохимической активности до алюминия, реагируют с углем с образованием карбидов металлов:
- CaO + 3C → CaC2 + CO
3.3. Восстановление металлов угарным газом
Оксид углерода (II) реагирует с оксидами металлов, расположенных в ряду электрохимической активности после алюминия.

Например, железо можно получить восстановлением из оксида с помощью угарного газа:
2Fe2O3 + 6CО → 4Fe + 6CO2
3.4. Восстановление металлов более активными металлами
Более активные металлы вытесняют из оксидов менее активные. Активность металлов можно примерно оценить по электрохимическому ряду металлов:

Восстановление металлов из оксидов другими металлами — распространенный способ получения металлов. Часто для восстановления металлов применяют алюминий и магний. А вот щелочные металлы для этого не очень подходят – они слишком химически активны, что создает сложности при работе с ними.
- Например, цезий взрывается на воздухе.
- Алюмотермия – это восстановление металлов из оксидов алюминием.
- Например: алюминий восстанавливает оксид меди (II) из оксида:
- 3CuO + 2Al = Al2O3 + 3Cu
- Магниетермия – это восстановление металлов из оксидов магнием.
- CuO + Mg = Cu + MgO
- Железо можно вытеснить из оксида с помощью алюминия:
- 2Fe2O3 + 4Al → 4Fe + 2Al2O3
- При алюмотермии образуется очень чистый, свободный от примесей углерода металл.
- Активные металлы вытесняют менее активные из растворов их солей.
- Например, при добавлении меди (Cu) в раствор соли менее активного металла – серебра (AgNO3) произойдет химическая реакция:
- 2AgNO3 + Cu = Cu(NO3)2 + 2Ag
- Медь покроется белыми кристаллами серебра.
- При добавлении железа (Fe) в раствор соли меди (CuSO4) на железном гвозде появился розовый налет металлической меди:
- CuSO4 + Fe = FeSO4 + Cu
- При добавлении цинка в раствор нитрата свинца (II) на цинке образуется слой металлического свинца:
- Pb(NO3)2 + Zn = Pb + Zn (NO3)2
3.5. Восстановление металлов из оксидов водородом
Водород восстанавливает из оксидов только металлы, расположенные в ряду активности правее алюминия. Как правило, взаимодействие оксидов металлов с водородом протекает в жестких условиях – под давлением или при нагревании.
CuO + H2 = Cu + H2O
4. Производство чугуна
Чугун получают из железной руды в доменных печах.
Печь последовательно загружают сверху шихтой, флюсами, коксом, затем снова рудой, коксом и т.д.
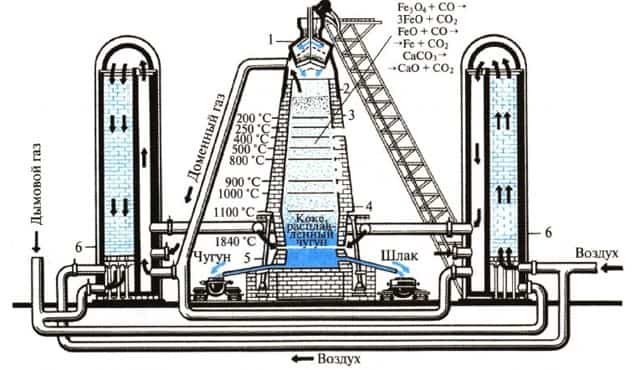
1- загрузочное устройство, 2 — колошник, 3 — шахта, 4 — распар, 5 — горн, 6 — регенератор
Доменная печь имеет форму двух усеченных конусов, соединенных основаниями. Верхняя часть доменной печи — колошник, средняя — шахта, а нижняя часть — распар.
В нижней части печи находится горн. Внизу горна скапливается чугун и шлак и отверстия, через которые чугун и шлак покидают горн: чугун через нижнее, а шлак через верхнее.
Наверху печи расположено автоматическое загрузочное устройство. Оно состоит из двух воронок, соединенных друг с другом. Руда и кокс сначала поступают в верхнюю воронку, а затем в нижнюю.
Из нижней воронки руда и кокс поступают в печь. во время загрузки руды и кокса печь остается закрытой, поэтому газы не попадают в атмосферу, а попадают в регенераторы. В регенераторах печной газ сгорает.
- Шихта — это железная руда, смешанная с флюсами.
- Снизу в печь вдувают нагретый воздух, обогащенный кислородом, кокс сгорает:
- C + O2 = CO2
- Образующийся углекислый газ поднимается вверх и окисляет кокс до оксида углерода (II):
- CO2 + С = 2CO
- Оксид углерода (II) (угарный газ) — это основной восстановитель железа из оксидов в данных процессах. Последовательность восстановления железа из оксида железа (III):
- Fe2O3 → Fe3O4 (FeO·Fe2O3) → FeO → Fe
- Последовательность восстановления оксида железа (III):
- 3Fe2O3 + CO → 2Fe3O4 + CO2
- Fe3O4 + CO → 3FeO + CO2
- FeO + CO → Fe + CO2
- Суммарное уравнение протекающих процессов:
- Fe2O3 + 3CO → 2Fe + 3CO2
При этом протекает также частичное восстановление примесей оксидов других элементов (кремния, марганца и др.). Эти вещества растворяются в жидком железе.
Чтобы удалить из железной руды тугоплавкие примеси (оксид кремния (IV) и др.). Для их удаления используют флюсы и плавни (как правило, известняк CaCO3 или доломит CaCO3·MgCO3). Флюсы разлагаются при нагревании:
- CaCO3 → CaO + CO2
- и образуют с тугоплавкими примесями легкоплавкие вещества (шлаки), которые легко можно удалить из реакционной смеси:
- CaO + SiO2 → CaSiO3
Восстановление металлов



Восстановление металлов, процесс получения металлов из руд при помощи восстановительных реакций. Под восстановлением металлов первоначально понимались реакции получения металлов из их окислов путём применения веществ, отличающихся более высоким сродством к кислороду, чем металл. Простейший пример — получение металлического железа из его закиси:
- FeO + С = Fe + CO,
- которое, в частности, протекает в доменных печах.
- Возможность восстановления металлов определяется изменением свободной энергии при реакции:
- MeO + В = Me + BO,
где MeO — окисел металла, В — восстановитель. Если при этой реакции (при постоянных температуре и давлении) сумма свободных энергий Me и BO меньше, чем MeO и В, то процесс протекает слева направо с образованием металла.
Процесс облегчается, если конечный продукт — металл — находится в виде раствора (твёрдого или жидкого), так как растворение сопровождается уменьшением свободной энергии.
Этим объясняется, что при восстановлении металлов из некоторых особенно прочных окислов получают в качестве конечных продуктов соответствующие сплавы. Таким образом, для восстановления металлов необходимо наличие определённого термодинамического стимула.
Наряду с этим большое значение имеют и кинетические условия восстановления, которые определяются кристаллохимическими превращениями (в случае твёрдых окислов), механизмом химических реакций на границах фаз, условиями массопереноса реагентов, например диффузией.
- В более общем, химическом смысле восстановление металлов сводится к присоединению электронов к атому или группе атомов. Поэтому к восстановлению металлов относятся и процессы получения металлов электролизом из солевых расплавов или растворов на катоде, например для меди:
- Cu++ + 2e = Cu,
- где е — электрон.
Наиболее важные примеры подобных процессов в технике — производство Al электролизом глинозёма из расплавов и Cu из водных растворов CuSO4.
Восстановление металлов осуществляется в цветной металлургии при получении металлов из сульфидов, хлоридов и других соединений.
Так как для восстановления необходимы электроны, которые отдаёт восстановитель, то восстановительные процессы неразрывно связаны с окислительными.
Лит.: Гельд П. В., Есин О. А., Процессы высокотемпературного восстановления, Свердловск, 1957; Полинг Л., Общая химия, пер. с англ., М., 1964.
Л. В. Ванюкова, Л. А. Шварцман.
ПОИСК
Большое распространение получили методы нанесения электропроводящего слоя на различные неметаллические изделия посредством химического восстановления металлов из растворов их солей. Наиболее часто применяется химическое серебрение, меднение или никелирование с предварительными операциями сенсибилизации и активирования покрываемой поверхности (стр. 443 сл.
). [c.431] Особым случаем восстановления металлов из их соединений можно считать термическую диссоциацию галогенидов металлов или реакцию внутримолекулярного окисления-восстановления, протекающую по уравнению [c.13]
На поверхность химически наносят проводящий слой путем восстановления металлов (Ag, Си, Аи, Pt и др.
) из водных растворов их солей или получают пленки в виде сернистых соединений некоторых металлов (Ag, Си). Наиболее широкое применение получили пленки серебра и меди. Серебро восстанавливается из раствора АдЫОз или комплексной аммиачной соли Ag(NHз) NOз органическими восстановителями (формальдегид, глюкоза, моносахариды, сегнетова соль, пирогаллол и т. д.).
Медь восстанавливается из аммиачных и щелочных глицератных растворов сахаром, сегнетовой солью, формальдегидом, гликолем, фенилгидразином, гидроксиламином и др. В обоих случаях необходима предварительная обработка — сенсибилизация — поверхности формы 0,1—3%-ным раствором двухлористого олова (погружением или распылением) с последующей тщательной [c.
443]
В металлургии водород используют для восстановления металлов из их соединений, резки и сварки металлов. [c.205]
Процессы восстановления металлов из растворов их солен электронами катода относятся уже к области электрометаллургии. [c.237]
Восстановление металлами или их амальгамами. Для восстановления Ре + чаще всего употребляют цинк [c.384]
Восстановление металла протекает только с участием антиокислителей, которые в гидроочищенные топлива вводят специально в прямогонных топливах антиокислителями являются фенолы и серосодержащие соединения, присутствующие в них. В гидроочищенных неингибированных топливах металлы в гомогенной фазе, т. е. в ионном виде, не проявляют себя как деактиваторы [176, 206]. [c.197]
Вакуум в печи создается специально как способ для осуществления некоторых термотехнологических процессов, которые невозможно провести в плотной газовой среде, или как средство для защиты во время их получения или термической обработки.
В вакууме взаимодействие металла с внешней газовой средой замедляется и практически прекращается при достижении глубокого вакуума. Снижение внешнего давления над металлом благоприятствует выделению из расплава растворенных газов и устраняет возможность окисления металлов.
В особо благоприятных условиях становится возможным восстановление металлов и оксидов. Например, в обычных условиях при атмосферном давлении процесс восстановления оксида магния углеродом не протекает, но становится возможным в вакууме.
При наличии восстановителя в разреженном пространстве оксид магния становится непрочным соединением. Равновесие взаимодействия углерода с оксидом магния смещается в сторону образования элементарного магния MgO + С Mg (г.) + СО (г.).
Причиной этого является высокое давление насыщенных паров магния, вследствие чего в глубоком вакууме он находится в парообразном состоянии и постоянно выводится из равновесного состояния отсасывающей системой, что способствует распаду MgO. [c.78]
Процессы восстановления металлов из руд различаются по природе восстановителя и по условиям восстановления. В качестве восстановителей применяют химические вещества (водород, оксид углерода (П), углерод, металлы) или электрический ток, а процесс восстановления можно проводить в растворе, в расплаве или в твердой фазе. В зависимости от этого различают следующие методы восстановления [c.10]
Оборудование для сушки и термической обработки материалов и катализаторов, применяемое при выпаривании, обезвоживании, прокаливании, спекании окислов, восстановлении металлов из окислов и т. д. [c.188]
В отсутствие ингибитора окисление топлива практически металлом не ускоряется, что показано как на смесях углеводородов, так и на топливе и масле, очищенных от природных антиокислителей.
Более того, в некоторых условиях наблюдается ингибирующее действие металла при окислении углеводородных смесей, не содержащих антиокислителя [2, 23, 26].
Это объясняют участием антиокислителя в реакции восстановления металла — катализатора из высшего валентного состояния в низшее. [c.125]
Физико-химические основы восстановления металлов из руд [c.10]
Восстановление металлами и водородом. При восстановлении сульфохлоридов металлами в щелочном или нейтральном растворе образуются соли сульфиновых кислот. Эта реакция легко идет с кальцием в водном растворе щелочи [64] и с цинковой пылью в воде [65, 66] или в спирте [65, 66в, 67] [c.326]
Еще одним методом получения покрытий является химическое восстановление металлов из растворов их солей. При этом образуется покрытие, прочно сцепленное с основным металлом. Процесс получения никелевых покрытий такого рода называется химическим никелированием. [c.231]
При восстановлении металлов из их соединений необходимо учитывать как принципиальную осуществимость этого процесса, так и полноту его протекания, от которой зависит экономичность процесса. [c.11]
Восстановление металлами (металлотермия). [c.12]
Так как теоретически возможно неограниченное повышение напряжения, то и ЛО- оо, то перед методом электролитического восстановления металлов открываются неограниченные возможности. [c.13]
Как показывает рассмотренный пример, при электролизе водных растворов солей, реакция которых близка к нейтральной, па катоде восстанавлнваются те металлы, электродные потенциалы которых значительно положительнее, чем —0,41 В.
Если потенциал металла значительно отрицательнее, чем —0,41 В, то на катоде будет выделяться водород .
При значениях электродного потенциала металла, близких к —0,41 В, возможно, в зависимости от концентрации соли металла и условий электролиза, как восстановление металла, так и выделение водорода (или совместное протекание обоих процессов). [c.190]
Полнота протекания процесса восстановления металла из его оксида зависит, очевидно, от сдвига вправо равновесия а . Условием этого является создание гетерогенной системы, что обеспечивает ——————— [c.13]
Таким образом, в основе любого металлургического процесса восстановления металла из его соединений лежит принцип перевода обрабатываемого сырья в гетерогенную систему, состоящую из двух, трех и более фаз, отличающихся друг от друга составом и физическими свойствами. При этом одна из фаз обо- [c.13]
Чем определяются принципиальная возможность и полнота протекания процесса восстановления металлов из руд [c.14]
В качестве катализаторов применяются разнообразные вещества восстановленные металлы, окислы, кислоты, основания, соли, сульфиды металлов, некоторые органические соединения.
Подбор катализаторов, изучение условий их изготовления и применения, пути регенерации и другие вопросы, связанные с катализом,— все это в настоящее время неотъемлемая часть нефтехимической технологии.
[c.218]
Однако скорость реакции при этом очень мала и необходимо применение катализаторов. Классическими катализаторами гидрирования являются восстановленные металлы Р1, Рс1, N1, Со, Ре.
Все эти катализаторы легко отравляются сернистыми соединениями и применяются только для селективного недеструктивного гидрирования олефинового сырья, не содержащего серы.
В условиях гидроочистки и гидрокрекинга поэтому применяют указанные выше сероустойчивые катализаторы. [c.266]
Следует отметить, что такие восстановленные металлы, как Ре, N1, Со, Си, очень чувствительны к кислороду воздуха.
Необходимо следить, чтобы аппаратура была герметична, и при хранении катализатора в трубке было бы несколько повышенное давление водорода или иного инертного газа.
Если катализатор (например, N1 Ре-нея) приготовлен в избытке, то хранить его необходимо под водой, спиртом или иной нейтральной жидкостью в герметизированном сосуде (стр. 340). [c.53]
Способность водорода присоединяться по месту кратных углеродных связей известна уже давно. Еще в середине XIX в. М. Фарадей, проведя реакцию взаимодействия водорода с этиленом над платиной, осуществил превращение этилена в этан. Однако долгое время разрозненные наблюдения отдельных авторов казались лишенными интереса.
Лишь после того, как было открыто замечательное свойство некоторых восстановленных металлов, например никеля, кобальта, меди [1], способствовать гидрированию, т. е. насыщению водородом алифатических и ароматических кратных связей, каталитическое гидрирование начало быстро развиваться.
В настоящее время им широко пользуются в исследовательской работе для изучения числа и характера насыщенных связей, определения строения неизвестных соединений, например природных веществ.
Внедрение гидрирования в технику явилось стимулом для грандиозного развития процессов деструктивного гидрирования, синтезов из окислов углерода, облагораживания топлива и многочисленных реакций восстановления. [c.338]
Восстановление металла.ми в присутствии кислоты [c.202]
Весьма возможно, что тщательно восстановленные металлы, приготовленные на носителе, наилучшим образом обеспечивают получение чистых металлических поверхностей. Это объясняется тем, что мельчайшие кристаллические частицы металла при этих условиях не могут спекаться друг с другом. Поэтому они не обладают способностью захватывать примеси [c.143]
К взрывоопасной категории Е отнесены производства, свя-заннье с применением горючих газов без жидкой фазы и взрывоопасной пыли в таком количестве, при котором могут образовываться взрывоопасные смеси в объеме, превышающем 5% объема помещения, в котором по условиям технологического процесса возможен только взрыв (без последующего горения) веществ, способных взрываться (без последующего горения) при взаимодействии с водой, кислородом воздуха или одно о другим. К этой категории относится, например, производство чистых металлов методом электролиза, а также восстановление металлов в среде водорода. [c.397]
Существуют также способы термического восстановления металлов из газообразных соединений (карбонилы, нитрозилы, гидриды и т. д.) и из специальных паст, наносимых на поверхность керамики или стекла с последующим вжиганием. [c.444]
Для мезаллоь, не восстаиазливаемь х нн углем, ни оксидом углерода(1I), применяются более сильные восстановите.ли водород, магний, алюминий, кремний. Восстановление металла из его оксида с помощью другого металла называется металлотер- [c.540]
Вследствие опасности отравления катализаторов внимание исследователей привлекает в первую очередь обеспечение их стабильности. Известно много публикаций, в которых утверждается, что созданы стабильные к отравлению катализаторы. Сообщалось о создании катализаторов, способных работать при 100 кгс/см на сырье с содержанием 1000—2000 млн азота.
В одном из рекламных сообщений указывается, что частичное восстановление металла в катализаторе Ni + W на AijOj -f SiOj (6% восстановленного Ni и 19% W в виде сульфида) повысило его азотоустойчивость.
В присутствии этого катализатора удалялось 92,5% азота (содержание азота в перерабатываемом газойле 0,319% давление 70 кгс/см ) против 80% на алюмокобальтмолибденовом катализаторе через 90 суток он еще удалял 75% азота. [c.323]
Катодное восстановление металлов используется для промыщ-ленного получения, а также рафинирования многих металлов. Электролиз в этих случаях проводится обычно в растворах или расплавах электролитов. [c.211]
Руды почти всегда бывают загрязнены так называемой иусто породой. Примеси пустой породы часто затрудняют процессы восстановления металлов из руд. В связи е этим металлические руды подвергают очистке от пустой породы, или так называемому обогащению.
Для обогащения металлических руд применяют различные методы механические, электромагнитные, физико-химические. Из последних нгирокое раслространеине получил метод флотации (т. е.
всплывания), основанный на разл[[чной смачиваемости водой частиц смеси гидрофобного и 1Идрофильиого порошков. [c.235]
Для восстановления металлов в промыи1ленности используются различные процессы. Пирометаллургическими называют процессы восстановлення металлов из безводных соединений при высоких температурах.
Гидрометаллургическими являются процессы восстановления металлов из водных растворов их солей. Наконец, к электрометаллургическим относят процессы восстановления металлов электронами катода нри электролизе.
[c.236]
Вторичная обработка восстановленного металла проводится для его очистки, а также с целью перестройки кристаллической структуры металла, изменения его состава и свойств.
К операциям вторичной обработки относятся рчистка металла методами дистилляции, электролиза, электрошлакового переплава и зонной плавки получение сплавов, закалка, отжиг, отпуск, цементирование и др.
Некоторые из них рассматриваются ниже. [c.9]
Карбогермил — так называется метод восстановления металлов из их оксидов углеродом. По восстановительной способности углерод уступает многим металлам. Поскольку энтальпия образования, а точнее эиергня Гиббса образования оксидов углерода меньше энтальпии (эиергии Гиббса) образования бол1)1нинства оксидов металлов, окислительно-восстановительная реакция [c.237]
Гидрометаллургия.
Процессы восстановления металлов из водных растворов их солей осуществляются при обычных температурах, причем B0 1 а повителями могут служить или сравнительно б( лее активные металлы, или же непосредственно электроны, выделяемые катодом при электролизе.
При гидрометаллургическом восстановлении металлы обычно получаются в мелкораздробленном состоянии. Восстановлению из водных растворов могут подвергаться металлы не только из элементарных, ио и из комплексных ионов, например [c.237]
Температурно-программирован1юе восстановление (ТПВ) катализаторов позволяет установить как температуру, так и степень восстановления металлов —активных компонентов катализаторов [181 I. [c.82]
Конверсия метана природного газа с водяным паром — пока основной промышленный способ производства водорода. Первичный продукт конверсии метана — это синтез-газ (тСО + пИ.
2), который помимо получения водорода применяется для производства метанола, высших спиртов, синтетического бензина и др. Предполагается применепне синтез-газа в качестве восстановительного агента для прямого восстановления металлов (железа) из руд.
Метод конверсии состоит в окислении метана водным паром или кислородом по следующим основным уравнениям реакций [c.73]
Укажите особенности гидрометаллургического, гдроэлектрометал-лургического, пирометаллургического и электропирометаллурги-ческого методов восстановления металлов из их соединений. [c.14]
Вид металла, способ его введения и вариации технологических режимов карбонизации волокон определяют структуру, элементный и фазовый состав формирующихся Ме-УВ, позволяют в широких пределах регулировать их свойства Металлосодержащие включения в составе Ме-УВ в виде оксидов, карбидов, высокодисперсных (3-20 нм) восстановленных металлов придают им высокие адсорбционно-каталитические свойства в ряде химических реакций, улучшают смачивание волокон различными видами связующих, влияют на характер взаимодействия реагирую1Ш1Х компонентов на границе раздела фаз волокнистый наполнитель-полимер. Структурно-активные фуппы Ме-УВ могут служить центрами кристаллизации полимеров, ориентировать макромолекулы в гюверхностном слое, изменяя структуру и свойства межфазного слоя и в целом всего армированного волокнами композита. [c.182]






