- Электрохимический ряд напряжений металлов
- Что показывает электродный потенциал
- Активные металлы — список в химии, таблица, реакции и ряд — Природа Мира
- Подведение итогов
- Ряд активности металлов в химии
- Алюминий
- Кальций
- Железо и его соединения
- Производство чугуна и стали
- Примеры решения задач
- Электрохимический ряд напряжений металлов (ряд Бекетова)
- Из электрохимического ряда напряжений металлов вытекает ряд важных следствий:
- Электрохимический ряд напряжений металлов (ЭРН)
- Взаимодействие металлов с кислотами
- Взаимодействие металлов с водой
- Взаимодействие металлов с водными растворами солей
- Процесс термического распада нитратов
- Как определить активность металла?
- Кто составил ряд активности металлов?
- Какие металлы активные средней активности?
- Как определить какой из двух металлов активнее?
- Как увеличивается химическая активность щелочных металлов?
- Как изменяется восстановительная активность металлов в электрохимическом ряду?
- Как изменяется активность металлов в таблице Менделеева?
- Какие металлы стоят до водорода?
- Зачем ряд активности металлов?
- Какой из металлов более активен?
- Что относится к технологическим свойствам?
- Какой из металлов наиболее активно реагирует с водой?
- Как определить какой элемент активнее?
- Что такое электрохимический ряд напряжений металлов какими двумя?
Макеты страниц
Если из всего ряда стандартных электродных потенциалов выделить только те электродные процессы, которые отвечают общему уравнению
то получим ряд напряжений металлов. В этот ряд всегда помешают, кроме металлов, также водород, что позволяет видеть, какие металлы способны вытеснять водород из водных растворов кислот.
Таблица 19. Ряд напряжений металлов
Ряд напряжений для важнейших металлов приведен в табл. 19. Положение того или иного металла в ряду напряжений характеризует его способность к окислительно-восстановительным взаимодействиям в водных растворах при стандартных условиях.
Ионы металлов являются окислителями, а металлы в виде простых веществ — восстановителями.
При этом, чем дальше расположен металл в ряду напряжений, тем более сильным окислителем в водном растворе являются его ионы, и наоборот, чем ближе металл к началу ряда, тем более сильные восстановительные свойства проявляет простое вещество — металл.
Потенциал электродного процесса
в нейтральной среде равен В (см. стр. 273). Активные металлы начала ряда, имеющие потенциал, значительно более отрицательный, чем —0,41 В, вытесняют водород из воды. Магний вытесняет водород только из горячей воды. Металлы, расположенные между магнием и кадмием, обычно не вытесняют водород из воды. На поверхности этих металлов образуются оксидные пленки, обладающие защитным действием .
Металлы, расположенные между магнием и водородом, вытесняют водород из растворов кислот. При этом на поверхности некоторых металлов также образуются защитные пленки, тормозящие реакцию. Так, оксидная пленка на алюминии делает этот металл стойким не только в воде, но и в растворах некоторых кислот.
Свинец не растворяется в серной кислоте при ее концентрации ниже , так как образующаяся при взаимодействии свинца с серной кислотой соль нерастворима и создает на поверхности металла защитную пленку. Явление глубокого торможения окисления металла, обусловленное наличием на его поверхности защитных оксидных или солевых пленок, называется пассивностью, а состояние металла при этом — пассивным состоянием.
Металлы способны вытеснять друг друга из растворов солей. Направление реакции определяется при этом их взаимным положением в ряду напряжений.
Рассматривая конкретные случаи таких реакций, следует помнить, что активные металлы вытесняют водород не только из воды, но и из любого водного раствора.
Поэтому взаимное вытеснение металлов из растворов их солей практически происходит лишь в случае металлов, расположенных в ряду после магния.
Вытеснение металлов из их соединений другими металлами впервые подробно изучал Бекетов. В результате своих работ он расположил металлы по их химической активности в вытеснительный ряд», являющийся прототипом ряда напряжений металлов.
Взаимное положение некоторых металлов в ряду напряжений и в периодической системе на первый взгляд не соответствует друг, другу. Например, согласно положению в периодической системе химическая активность калия должна быть больше, чем натрия, а натрия — больше, чем лития.
В ряду же напряжений наиболее активным оказывается литий, а калий занимает среднее положение между литием и натрием. Цинк и медь по их положению в периодической системе должны иметь приблизительно равную химическую активность, но в ряду напряжений цинк расположен значительно раньше меди.
Причина такого рода несоответствий состоит в следующем.
При сравнении металлов, занимающих то или иное положение в периодической системе, за меру их химической активности — восстановительной способности — принимается величина энергии ионизации свободных атомов.
Действительно, при переходе, например, сверху вниз по главной подгруппе I группы периодической системы энергия ионизации атомов уменьшается, что связано с увеличением их радиусов (т. е. с большим удалением внешних электронов от ядра) и с возрастающим экранированием положительного заряда ядра промежуточными электронными слоями (см. § 31).
Поэтому атомы калия проявляют большую химическую активность — обладают более сильными восстановительными свойствами, — чем атомы натрия, а атомы натрия — большую активность, чем атомы лития.
При сравнении же металлов в ряду напряжений за меру химической активности принимается работа превращения металла, находящегося в твердом состоянии, в гидратированные ионы в водном растворе.
Эту работу можно представить как сумму трех слагаемых: энергии атомизации — превращения кристалла металла в изолированные атомы, энергии ионизации свободных атомов металла и энергии гидратации образующихся ионов. Энергия атомизации характеризует прочность кристаллической решетки данного металла.
Энергия ионизации атомов — отрыва от них валентных электронов — непосредственно определяется положением металла в периодической системе. Энергия, выделяющаяся при гидратации, зависит от электронной структуры иона, его заряда и радиуса.
Ионы лития и калия, имеющие одинаковый заряд, но различные радиусы, будут создавать около себя неодинаковые электрические поля. Поле, возникающее вблизи маленьких ионов лития, будет более сильным, чем поле около больших ионов калия. Отсюда ясно, что ионы лития будут гидратироваться с выделением большей энергии, чем ноны калия.
Таким образом, в ходе рассматриваемого превращения затрачивается энергия на атомизацию и ионизацию и выделяется энергия при гидратации. Чем меньше будет суммарная затрата энергии, тем легче будет осуществляться весь процесс и тем ближе к началу ряда напряжений будет располагаться данный металл.
Но из трех слагаемых общего баланса энергии только одно — энергия ионизации—непосредственно определяется положением металла в периодической системе. Следовательно, нет оснований ожидать, что взаимное положение тех или иных металлов в ряду напряжений всегда будет соответствовать их положению в периодической системе.
Так, для лития суммарная затрата энергии оказывается меньшей, чем для калия, в соответствии с чем литий стоит в ряду напряжений раньше калия.
Для меди и цинка затрата энергии на ионизацию свободных атомов и выигрыш ее при гидратации ионов близки. Но металлическая медь образует более прочную кристаллическую решетку, чем цинк, что видно из сопоставления температур плавления этих Металлов: цинк плавится при , а медь только при . Поэтому энергия, затрачиваемая на атомизацию этих металлов, существенно различна, вследствие чего суммарные энергетические затраты на весь процесс в случае меди гораздо больше, чем в случае цинка, что и объясняет взаимное положение этих металлов в ряду напряжений.
При переходе от воды к неводным растворителям взаимное положение металлов в ряду напряжений может изменяться. Причина этого лежит в том, что энергия сольватации ионов различных металлов по-разному изменяется при переходе от одного растворителя к другому.
В частности, ион меди весьма энергично сольватируется в некоторых органических растворителях; это приводит к тому, что в таких растворителях медь располагается в ряду напряжений до водорода и вытесняет его из растворов кислот.
Таким образом, в отличие от периодической системы элементов, ряд напряжений металлов не является отражением общей Закономерности, на основе которой можно давать разностороннюю Характеристику химических свойств металлов.
Ряд напряжений Характеризует лишь окислительно-восстановительную способность Электрохимической системы «металл — ион металла» в строго определенных условиях: приведенные в нем величины относятся к водному раствору, температуре и единичной концентрации (активности) ионов металла.
Электрохимический ряд напряжений металлов
| Стандартным электродным потенциалом металла E0 называют разность потенциалов между металлом, который погружен в раствор своей соли (концентрация ионов металла 1 моль/л), и стандартным водородным электродом (при н.у.) |
- Понятно, что ничего не понятно.
- Разберем более подробно процессы, которые могут происходить при погружении металлической пластины в раствор соли того же металла, из которого изготовлена и сама пластина, которую, в подобных случаях называют электродом.
- Возможны два варианта.
Вариант 1.
Электрод изготовлен из металла, являющегося активным восстановителем (ему не «жалко» отдавать свои электроны), пусть это будет, скажем, цинк.
После того, как цинковый электрод погружается в раствор, диполи воды, присутствующие в растворе, начинают притягивать к себе определенную часть атомов цинка, которые переходят в раствор в виде гидратированных ионов, но при этом оставляют свои электроны на поверхности электрода.
Me0+mH2O → Men+·mH2O+ne-
Me0 → Men++ne-
Постепенно на поверхности цинкового электрода накапливается все больше и больше «брошенных» отрицательных электронов, — цинковый электрод приобретает отрицательный заряд.
Параллельно с этим процессом в растворе увеличивается количество положительно заряженных ионов цинка, которые покинули электрод.
Катионы цинка начинают притягиваться отрицательно заряженным электродом, в результате чего на границе электрод-раствор образуется так называемый двойной электрический слой (ДЭС).
Вариант 2. Электрод изготовлен из металла, который является слабым восстановителем (ему «жалко» расставаться со своими электронами). Пускай роль такого металла играет медь.
Таким образом, ионы меди, содержащиеся в растворе, являются сильными окислителями.
При погружении медного электрода в раствор часть ионов меди начинает контактировать с поверхностью электрода и восстанавливается за счет свободных электронов, присутствующих в меди.
Men++ne- → Me0
Идет процесс, обратный Варианту 1. Постепенно все больше и больше катионов меди осаждаются на поверхности электрода.
Восстанавливаясь, катионы заряжают медную пластину положительно, по мере увеличения заряда положительный медный электрод все больше и больше притягивает отрицательно заряженных ионов, таким образом, формируется двойной электрический слой, но обратной полярности, чем это было в Варианте 1.
Формируемая на границе электрод-раствор разность потенциалов, называется электродным потенциалом.
Измерить такой потенциал очень сложно. Чтобы выйти из трудного положения, решили брать не абсолютные значения, а относительные, при этом в качестве эталона решили взять потенциал водородного электрода, принятый равным нулю.
- Потенциал конкретного металлического электрода зависит от природы металла, концентрации и температуры раствора.
- Поскольку щелочные и щелочноземельные металлы в водных растворах реагируют с водой — их электродным потенциалы рассчитывают теоретически.
- Все металлы принято располагать в порядке возрастания значения их стандартного электродного потенциала — такой ряд называется электрохимическим рядом напряжений металлов:

Что показывает электродный потенциал
Электродный потенциал отражает в численном значении способность металла отдавать свои электроны или восстанавливаться, говоря другими словами, отражает химическую активность металла.
Чем левее в электрохимическом ряду стоит металл (см. выше), тем он легче отдает свои электроны, т.е., является более активным, легче вступает в реакции с другими элементами.
Если брать крайности, то:
- литий самый сильный восстановитель, а ион лития — самый слабый окислитель;
- золото самый слабый восстановитель, а ион золота — самый сильный окислитель.
Следствия, вытекающие из электрохимического ряда напряжений металлов:
- Металл вытесняет из солей все другие металлы, стоящее в ряду правее него (являющиеся более слабыми восстановителями);
- Металлы, имеющие отрицательное значение электродного потенциала, т.е., стоящие левее водорода, вытесняют его из кислот;
- Самые активные металлы, имеющие самые низкие значения электродного потенциала (это металлы от лития до натрия), в водных растворах в первую очередь реагируют с водой.
Следует обратить внимание, что положение металлов в Периодической таблице и положение этих же металлов в электрохимическом ряду напряжений немного отличаются.
Данный факт объясняет тем, что значение электродного потенциала зависит не только от энергии, необходимой для отрыва электронов от изолированного атома, но сюда входит также еще и энергия, требуемая для разрушения кристаллической решетки + энергия, которая выделяется при гидратации ионов.
Активные металлы — список в химии, таблица, реакции и ряд — Природа Мира
Среди всех металлов некоторые отличаются тем, что они очень легко вступают в восстановительные реакции. Такие металлы имеют много схожих свойств и объединяются в класс активных металлов.
К активным металлам относятся три группы элементов:
- щелочные металлы;
- щелочноземельные металлы;
- алюминий.
Щелочные металлы находятся в первой группе таблицы Менделеева, то есть занимают в ней крайнее левое положение. В частности щелочными металлами являются:
- литий (Li);
- натрий (Na);
- калий (K);
- рубидий (Rb);
- цезий (Cs);
- франций (Fr).
Щелочноземельные металлы находятся во второй группе, то есть правее щелочных металлов. К ним относятся:
- бериллий (Be);
- магний (Mg);
- кальций (Ca);
- стронций (Sr);
- барий (Ba);
- радий (Ra).
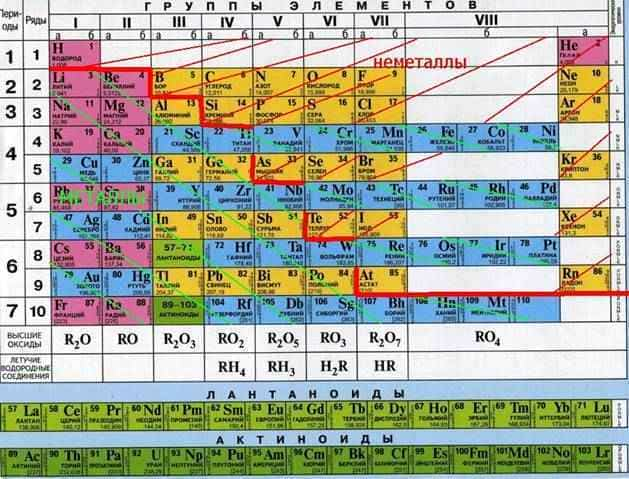 Активные металлы в таблице Менделеева
Активные металлы в таблице Менделеева
В целом активные металлы отличаются тем, что имеют один или два валентных электрона, поэтому они легко отдают эти электроны в ходе химических реакций, выступая в качестве восстановителей.
Степень активности металла можно оценить по его расположению в электрохимическом ряде активности металлов. Чем левее там находится металл, тем сильнее выражены его восстановительные свойства. Крайнее левое положение в ряде занимает литий.
В вот крайне правое положение в ряду занимает золото, именно поэтому оно почти не окисляется кислотами.
 Электрохимический ряд напряжений металлов
Электрохимический ряд напряжений металлов
Алюминий – это так называемый постпереходный металл, по своим свойствам он находится где-то между активными и среднеактивными металлами. Разные ученые придерживаются различного мнения о том, стоит ли считать алюминий активным металлом.
Активные металлы не встречаются в природе в чистом виде, так как они быстро вступают в химические реакции с другими элементами. Чаще всего в природе они присутствуют в виде оксидов. Например, даже если алюминий получен в чистом виде, то на воздухе он быстро покрывается оксидной пленкой.
Цвет всех щелочных металлов – белый, с серебристым оттенком. Исключением является цезий, имеющий серебристо-желтый цвет. Щелочные металлы можно резать простым скальпелем, так как у них низкая твердость. Также они имеют малую плотность – от 534 кг/м3 у лития до 1900 кг/м3 у цезия.
Литий, калий и натрий настолько легкие, что они плавают в воде, но построить корабль из них не получится, так как вода быстро окисляет и разрушает эти металлы.
Франций и цезий плавятся уже при комнатной температуре, а самый тугоплавкий щелочной металл – это литий, плавящийся при 180,6°С.
Для защиты щелочных металлов от воздуха и волы их хранят в керосине. При реагировании лития с водой выделяется водород, а натрий и особенно калий просто взрываются в воде. При взаимодействии с кислородом образуются оксиды.
Щелочноземельные металлы значительно тверже щелочных, их нельзя просто взять и разрежать ножом. Также они тяжелее – их плотность колеблется от 1550 кг/м3 у кальция до 5500 кг/м3 у радия. Цвет щелочноземельных металлов – серый. Температуры плавления этих элементов находятся в диапазоне 650-840°С. Исключение – бериллий, плавящийся лишь при 1278°С.
Чем больше порядковый номер щелочноземельного металла в таблице Менделеева, тем выше его химическая активность. Например, бериллий вообще не взаимодействует с кислородом и по своим свойствам напоминает алюминий. Наиболее активные стронций, барий и радий приходится хранить в керосине, также как и щелочные металлы.
Подведение итогов
Активные металлы отличаются тем, что имеют лишь один-два валентных электрона, которые они легко отдают. Поэтому эти элементы очень быстро вступают в химические реакции, а в природе в чистом виде не встречаются.
Не все нашли? Используйте поиск по сайту
Ряд активности металлов в химии
Все металлы, в зависимости от их окислительно-восстановительной активности объединяют в ряд, который называется электрохимическим рядом напряжения металлов (так как металлы в нем расположены в порядке увеличения стандартных электрохимических потенциалов) или рядом активности металлов:
Li, K, Ва, Ca, Na, Mg, Al, Zn, Fe, Ni, Sn, Pb, H2, Cu, Hg, Ag, Рt, Au
Наиболее химически активные металлы стоят в ряду активности до водорода, причем, чем левее расположен металл, тем он активнее. Металлы, занимающие в ряду активности, место после водорода считаются неактивными.
Алюминий
Алюминий представляет собой серебристо-белого цвета. Основные физические свойства алюминия – легкость, высокая тепло- и электропроводность. В свободном состоянии при пребывании на воздухе алюминий покрывается прочной пленкой оксида Al2O3, которая делает его устойчивым к действию концентрированных кислот.
Алюминий относится к металлам p-семейства. Электронная конфигурация внешнего энергетического уровня – 3s23p1. В своих соединениях алюминий проявляет степень окисления равную «+3».
Алюминий получают электролизом расплава оксида этого элемента:
2Al2O3 = 4Al + 3O2↑
Однако из-за небольшого выхода продукта, чаще используют способ получения алюминия электролизом смеси Na3[AlF6] и Al2O3. Реакция протекает при нагревании до 960С и в присутствии катализаторов – фторидов (AlF3, CaF2 и др.), при этом на выделение алюминия происходит на катоде, а на аноде выделяется кислород.
- Алюминий способен взаимодействовать с водой после удаления с его поверхности оксидной пленки (1), взаимодействовать с простыми веществами (кислородом, галогенами, азотом, серой, углеродом) (2-6), кислотами (7) и основаниями (8):
- 2Al + 6H2O = 2Al(OH)3 +3H2↑ (1)
- 2Al +3/2O2 = Al2O3 (2)
- 2Al + 3Cl2 = 2AlCl3 (3)
- 2Al + N2 = 2AlN (4)
- 2Al +3S = Al2S3 (5)
- 4Al + 3C = Al4C3 (6)
- 2Al + 3H2SO4 = Al2(SO4)3 + 3H2↑ (7)
- 2Al +2NaOH +3H2O = 2Na[Al(OH)4] + 3H2↑ (8)
Кальций
В свободном виде Ca – серебристо-белый металл. При нахождении на воздухе мгновенно покрывается желтоватой пленкой, которая представляет собой продукты его взаимодействия с составными частями воздуха. Кальций – достаточно твердый металл, имеет кубическую гранецентрированную кристаллическую решетку.
Электронная конфигурация внешнего энергетического уровня – 4s2. В своих соединениях кальций проявляет степень окисления равную «+2».
- Кальций получают электролизом расплавов солей, чаще всего – хлоридов:
- CaCl2 = Ca + Cl2↑
- Кальций способен растворяются в воде с образованием гидроксидов, проявляющих сильные основные свойства (1), реагировать с кислородом (2), образуя оксиды, взаимодействовать с неметаллами (3 -8), растворяться в кислотах (9):
- Ca + H2O = Ca(OH)2 + H2↑ (1)
- 2Ca + O2 = 2CaO (2)
- Ca + Br2 =CaBr2 (3)
- 3Ca + N2 = Ca3N2 (4)
- 2Ca + 2C = Ca2C2 (5)
- Ca +S = CaS (6)
- 2Ca + 2P = Ca3P2 (7)
- Ca + H2 = CaH2 (8)
- Ca + 2HCl = CaCl2 + H2↑ (9)
Железо и его соединения
Железо – металл серого цвета. В чистом виде оно довольно мягкое, ковкое и тягучее. Электронная конфигурация внешнего энергетического уровня – [Ar]3d 64s2. В своих соединениях железо проявляет степени окисления «+2» и «+3».
- Металлическое железо реагирует с водяным паром, образуя смешанный оксид (II, III) Fe3O4:
- 3Fe + 4H2O(v) ↔ Fe3O4 + 4H2↑
- На воздухе железо легко окисляется, особенно в присутствии влаги (ржавеет):
- 3Fe + 3O2 + 6H2O = 4Fe(OH)3
- Как и другие металлы железо вступает в реакции с простыми веществами, например, галогенами (1), растворяется в кислотах (2):
- 2Fe + Br2 = 2FeBr3 (при нагревании) (1)
- Fe + 2HCl = FeCl2 + H2↑ (2)
Железо образует целый спектр соединений, поскольку проявляет несколько степеней окисления: гидроксид железа (II), гидроксид железа (III), соли, оксиды и т.д. Так, гидроксид железа (II) можно получить при действии растворов щелочей на соли железа (II) без доступа воздуха:
- FeSO4 + 2NaOH = Fe(OH)2↓ + Na2SO4
- Гидроксид железа (II) растворим в кислотах и окисляется до гидроксида железа (III) в присутствии кислорода.
- Соли железа (II) проявляют свойства восстановителей и превращаются в соединения железа (III).
- Оксид железа (III) нельзя получить по реакции горения железа в кислороде, для его получения необходимо сжигать сульфиды железа или прокаливать другие соли железа:
- 4FeS2 + 11O2 = 2Fe2O3 +8SO2↑
- 2FeSO4 = Fe2O3 + SO2↑ + 3H2O
- Соединения железа (III) проявляют слабые окислительные свойства и способны вступать в ОВР с сильными восстановителями:
- 2FeCl3 + H2S = Fe(OH)3↓ + 3NaCl
Производство чугуна и стали
Стали и чугуны – сплавы железа с углеродом, причем содержание углерода в стали до 2%, а в чугуне 2-4%. Стали и чугуны содержат легирующие добавки: стали– Cr, V, Ni, а чугун – Si.
Выделяют различные типы сталей, так, по назначению выделяют конструкционные, нержавеющие, инструментальные, жаропрочные и криогенные стали. По химическому составу выделяют углеродистые (низко-, средне- и высокоуглеродистые) и легированные (низко-, средне- и высоколегированные). В зависимости от структуры выделяют аустенитные, ферритные, мартенситные, перлитные и бейнитные стали.
Стали нашли применение во многих отраслях народного хозяйства, таких как строительная, химическая, нефтехимическая, охрана окружающей среды, транспортная энергетическая и другие отрасли промышленности.
В зависимости от формы содержания углерода в чугуне — цементит или графит, а также их количества различают несколько типов чугуна: белый (светлый цвет излома из-за присутствия углерода в форме цементита), серый (серый цвет излома из-за присутствия углерода в форме графита), ковкий и жаропрочный. Чугуны очень хрупкие сплавы.
Области применения чугунов обширны – из чугуна изготавливают художественные украшения (ограды, ворота), корпусные детали, сантехническое оборудование, предметы быта (сковороды), его используют в автомобильной промышленности.
Примеры решения задач
Электрохимический ряд напряжений металлов (ряд Бекетова)
Электрохимический ряд напряжений металлов опытным путем установил Алессандро Вольта, на тот момент он выглядел следующим образом: Zn, Pb, Sn, Fe, Cu, Ag, Au. Величина электродного потенциала зависела оттого, насколько далеко отстояли друг от друга члены ряда.
Но причина этого была неизвестна. В 1853 г. русский учёный Николай Николаевич Бекетов (1827-1911) сделал в Париже сообщение на тему “Исследование над явлениями вытеснения одних элементов другими”.
В этой работе он обобщил различные исследования способности одних металлов вытеснять другие из растворов их солей.
Первоначально Бекетов предполагал, что способность одних металлов вытеснять из растворов солей другие металлы связана с их плотностью: более лёгкие металлы способны вытеснять металлы более тяжелые. Но опыты говорили о ином.
Непонятно было и то, как связан “вытеснительный ряд” с рядом напряжений Алессандро Вольта. Со временем накапливалось всё больше экспериментальных данных того, что некоторые правила вытеснения нарушаются при определенных условиях.
Бекетов обнаружил, что водород под давлением 10 атмосфер вытесняет серебро из раствора нитрата серебра. Английский химик Уильям Одлинг (1829-1921) описал множество случаев подобных аномалий.
Например, медь вытесняет олово из концентрированного подкисленного раствора хлорида олова (II) и свинец – из кислого раствора хлорида свинца (II). Медь, олово и свинец находятся в ряду правее кадмия, однако могут вытеснять его из кипящего слабо подкисленного раствора хлорид кадмия.
Теоретическую основу ряда активности (и ряда напряжений) заложил немецкий физикохимик Вальтер Нернст (1864-1941).
Вместо качественной характеристики – “склонности” металла и его иона к тем или иным реакциям – появилась точная количественная величина.
Такой величиной стал стандартный электродный потенциал металла, а соответствующий ряд, выстроенный в порядке изменения потенциалов, называется рядом стандартных электродных потенциалов.
Электрохимический ряд напряжений металлов (ряд Бекетова) это последовательность расположения металлов и их ионов в порядке возрастания стандартных электродных потенциалов в растворах электролитов. Электродом сравнения обычно служит стандартный водородный электрод, электродный потенциал которого условно принимается равным нулю.
| Восстановленная форма | Число отданных електронов | Окисленная форма | Стандартный электродный потенциал, В |
| Li | 1e | Li+ | -3,05 |
| K | 1e | K+ | -2,925 |
| Rb | 1e | Rb+ | -2,925 |
| Cs | 1e | Cs+ | -2,923 |
| Ba | 2e | Ba2+ | -2,91 |
| Sr | 2e | Sr2+ | -2,89 |
| Ca | 2e | Ca2+ | -2,87 |
| Na | 1e | Na+ | -2,71 |
| Mg | 2e | Mg2+ | -2,36 |
| Al | 3e | Al3+ | -1,66 |
| Mn | 2e | Mn2+ | -1,18 |
| Zn | 2e | Zn2+ | -0,76 |
| Cr | 3e | Cr3+ | -0,74 |
| Fe | 2e | Fe2+ | -0,44 |
| Cd | 2e | Cd2+ | -0,40 |
| Co | 2e | Co2+ | -0,28 |
| Ni | 2e | Ni2+ | -0,25 |
| Sn | 2e | Sn2+ | -0,14 |
| Pb | 2e | Pb2+ | -0,13 |
| Fe | 3e | Fe3+ | -0,04 |
| H2 | 2e | 2H+ | 0,00 |
| Cu | 2e | Cu2+ | 0,34 |
| Cu | 1e | Cu+ | 0,52 |
| 2Hg | 2e | Hg2 2+ | 0,79 |
| Ag | 1e | Ag+ | 0,80 |
| Hg | 2e | Hg2+ | 0,85 |
| Pt | 2e | Pt2+ | 1,20 |
| Au | 3e | Au3+ | 1,50 |
Место каждого элемента в ряду напряжений условно, т.к. величина электродного потенциала зависит от температуры и состава раствора, в который погружены электроды, в частности от концентрации ионов.
Большое значение также имеет состояние поверхности электрода (гладкая, шероховатая).
Стандартный электродный потенциал относится к водным растворам при температуре 25 °С, давлении газов 1 атмосфера и концентрации ионов 1 моль/л.
Из электрохимического ряда напряжений металлов вытекает ряд важных следствий:
- Каждый металл способен вытеснять (замещать) из растворов солей все другие металлы, стоящие правее данного металла;
- Все металлы, расположенные левее водорода, способны вытеснять его из кислот;
- Чем дальше расположены друг от друга два металла в ряду напряжений, тем большее напряжение может давать созданный из них гальванический элемент.
Восстановление водородом из оксидов
| Металлы, которые водород не восстанавливает из их оксидов | Металлы, которые водород восстанавливает из их оксидов |
| K, Ba, Sr, Ca, Na, Mg, Al, Mn, Zn, Cr | Fe, Cd, Co, Ni, Sn, Pb, W, Sb, As, Bi, Cu, Hg, Ag |
| BaO + H2 ≠ | FeO + H2 = Fe + H2O |
версия для печати
Сводная таблица свойств
| Li | K | Ca | Na | Mg | Al | Mn | Zn | Cr | Fe | Ni | Sn | Pb | H | Cu | Hg | Ag | Pd | Pt | Au |
|
→ Восстановительные свойства металлов ослабевают |
|||||||||||||||||||
| В природе встречаются только в виде соединений | Встречаются в чистом виде и в виде соединений | Встречаются в самородном виде | |||||||||||||||||
| Хранят в плотно закрытых сосудах под керосином или вазелином | Хранят в плотно закрытых сосудах | Хранят в любых сосудах | |||||||||||||||||
| Окисляются при н. у. | При н. у. окисляются только с поверхности | Окисляются только при нагревании | Не окисляются | ||||||||||||||||
|
С Н2О взаимодействуют при н. у. с выделением Н2↑ и МеОН |
С Н2О взаимодействуют при нагревании с выделением Н2↑ и МеО | С водой не взаимодействуют | |||||||||||||||||
| При взаимодействии с растворами кислот вытесняют водород Н2 (кроме HNO3) | Из растворов кислот не вытесняют водород | Растворяются в «царской водке» | |||||||||||||||||
| С H2SO4 конц. в зависимости от условий, восстановительных свойств металлов образуются SO2, S, H2S, сульфат и вода (Fe, Ni пассивируют) | С H2SO4 конц. образуется SO2 | Не взаимодей-ствуют | |||||||||||||||||
| С HNO3 конц. образуется NO2, нитрат, Н2О (Fe, Cr, Al пассивируются при обычной температуре) | Не взаимод. | ||||||||||||||||||
| С HNO3 разб. образуется NН3, нитрат, Н2О (так же с Fe, Sn) | С HNO3 разб. образуется NО, нитрат, Н2О | Не взаимодей-ствуют | |||||||||||||||||
| Ве, Аl, Zn, Sn, Pb вытесняют водород из растворов щелочей. Zn + 2NaOH + 2H2O = Na2[Zn(OH)4]+H2↑ | |||||||||||||||||||
| Оксиды растворяются в воде с образованием МеОН | Оксиды в воде не растворяются | ||||||||||||||||||
| При нагревании оксиды не разлагаются | При нагревании оксиды разлагаются | ||||||||||||||||||
| Гидроксиды при нагревании не разлагаются | Гидроксиды при нагревании разлагаются на оксид и Н2О | Гидроксиды разлагаются в воде | |||||||||||||||||
| Более активный металл вытесняет из раствора соли менее активный | |||||||||||||||||||
| Нитраты при нагревании разлагаются на MeNO2, и O2 | Нитраты при нагревании разлагаются на оксид, NO2 и O2 | Нитраты при нагревании разлагаются на металл, NO2 и O2 | |||||||||||||||||
| Гидролиз не идет у солей, образованных сильными кислотами | Соли, образованные сильными кислотами гидролизуются с образованием кислой среды | ||||||||||||||||||
| Соли, образованные слабыми кислотами гидролизуются с образованием щелочной среды | Существующие и растворимые соли, образованные слабыми кислотами, гидролизуются полностью | ||||||||||||||||||
| При электролизе водных растворов солей на катоде восстанавливается вода до Н2 | На катоде восстанавливаются одновременно вода до Н2 и катионы металла | На катоде восстанавливаются катионы металла |
версия для печати
Электрохимический ряд напряжений металлов (ЭРН)
| Li | K | Ba | Ca | Na | Mg | Al | Mn | Zn | Cr | Fe | Ni | Sn | Pb | H | Cu | Hg | Ag | Pt | Au |
Ряд напряжений металлов широко используется в неорганической химии. В частности, результаты многих реакций и даже возможность их осуществления зависят от положения некоторого металла в ЭРН. Обсудим этот вопрос подробнее.
Взаимодействие металлов с кислотами
Металлы, находящиеся в ряду напряжений левее водорода, реагируют с кислотами — неокислителями. Металлы, расположенные в ЭРН правее Н, взаимодействуют только с кислотами — окислителями (в частности, с HNO3 и концентрированной H2SO4).
- Пример 1. Цинк расположен в ЭРН левее водорода, следовательно, способен реагировать практически со всеми кислотами:
- Zn + 2HCl = ZnCl2 + H2
- Zn + H2SO4 = ZnSO4 + H2
- Пример 2. Медь находится в ЭРН правее Н; данный металл не реагирует с «обычными» кислотами (HCl, H3PO4, HBr, органические кислоты), однако вступает во взаимодействие с кислотами-окислителями (азотная, концентрированная серная):
- Сu + 2HCl ≠
- Cu + 4HNO3(конц.) = Cu(NO3)2 + 2NO2 + 2H2O
- Cu + 2H2SO4(конц.) = CuSO4 + SO2 + 2H2O
Обращаю внимание на важный момент: при взаимодействии металлов с кислотами-окислителями выделяется не водород, а некоторые другие соединения. Подробнее об этом можно почитать здесь!
Взаимодействие металлов с водой
- Металлы, расположенные в ряду напряжений левее Mg, легко реагируют с водой уже при комнатной температуре с выделением водорода и образованием раствора щелочи.
- Пример 3.
Натрий, калий, кальций легко растворяются в воде с образованием раствора щелочи:
- 2Na + 2H2O = 2NaOH + H2
- 2K + 2H2O = 2KOH + H2
- Ca + 2H2O = Ca(OH)2 + H2
Металлы, расположенные в ряду напряжений от водорода до магния (включительно), в ряде случаев взаимодействуют с водой, но реакции требуют специфических условий. Например, алюминий и магний начинают взаимодействие с Н2О только после удаления оксидной пленки с поверхности металла. Железо не реагирует с водой при комнатной температуре, но взаимодействует с парами воды. Кобальт, никель, олово, свинец практически не взаимодействуют с H2O не только при комнатной температуре, но и при нагревании.
Металлы, расположенные в правой части ЭРН (серебро, золото, платина) не реагируют с водой ни при каких условиях.
Взаимодействие металлов с водными растворами солей
- Речь пойдет о реакциях следующего типа:
- металл (*) + соль металла (**) = металл (**) + соль металла (*)
- Хотелось бы подчеркнуть, что звездочки обозначают в данном случае не степень окисления, не валентность металла, а просто позволяют различить металл № 1 и металл № 2.
- Для осуществления подобной реакции необходимо одновременное выполнение трех условий:
- соли, участвующие в процессе, должны растворяться в воде (это легко проверить, пользуясь таблицей растворимости);
- металл (*) должен находиться в ряду напряжений левее металла (**);
- металл (*) не должен реагировать с водой (что тоже легко проверяется по ЭРН).
- Пример 4. Рассмотрим несколько реакций:
- Zn + CuSO4 = ZnSO4 + Cu
- Fe + CuS ≠
- Pb + FeSO4 ≠
- K + Ni(NO3)2 ≠
- Первая реакция легко осуществима, все перечисленные выше условия выполнены: сульфат меди растворим в воде, цинк находится в ЭРН левее меди, Zn не реагирует с водой.
Вторая реакция невозможна, т. к. не выполнено первое условие (сульфид меди (II) практически не растворяется в воде). Третья реакция неосуществима, поскольку свинец — менее активный металл, нежели железо (находится правее в ЭРН). Наконец, четвертый процесс НЕ приведет к осаждению никеля, поскольку калий реагирует с водой; образовавшийся гидроксид калия может вступить в реакцию с раствором соли, но это уже совершенно другой процесс.
Процесс термического распада нитратов
Напомню, что нитраты — это соли азотной кислоты. Все нитраты разлагаются при нагревании, но вот состав продуктов разложения может быть разным. Состав определяется положением металла в ряду напряжений.
- Нитраты металлов, расположенных в ЭРН левее магния, при нагревании образуют соответствующий нитрит и кислород:
- 2KNO3 = 2KNO2 + O2
- В ходе термического разложения нитратов металлов, расположенных в ряду напряжений от Mg до Cu включительно, образуются оксид металла, NO2 и кислород:
- 2Cu(NO3)2 = 2CuO + 4NO2 + O2
- Наконец, при разложении нитратов наименее активных металлов (расположенных в ЭРН правее меди) образуются металл, диоксид азота и кислород:
- Hg(NO3)2 = Hg + 2NO2 + O2
Как определить активность металла?
Узнать степень активности металла можно по электрохимическому ряду напряжений металлов. Чем левее от водорода расположен элемент, тем более он активен.
Металлы, стоящие справа от водорода, малоактивны и могут взаимодействовать только с концентрированными кислотами.
Чем меньше энергия ионизации, тем легче атомы отдают электроны, и тем активнее металл.
В подгруппах s- и p-металлов химическая активность сверху вниз увеличивается, в подгруппах d -элементов — убывает.
Кто составил ряд активности металлов?
В 1793 году Алессандро Вольта, конструируя гальванический элемент (Вольтов столб), установил относительную активность известных тогда металлов: Zn, Pb, Sn, Fe, Cu, Ag, Au. «Сила» гальванического элемента оказывалась тем больше, чем дальше стояли друг от друга металлы в этом ряду (ряд напряжений).
Какие металлы активные средней активности?
1) Активные металлы: к таким металлам относятся все щелочные металлы, щелочноземельные металлы, а также магний и алюминий. 2) Металлы средней активности: к таковым относят металлы, расположенные между алюминием и водородом в ряду активности.
Как определить какой из двух металлов активнее?
Существует такая вещь, которая называется электрохимический ряд напряжений металлов. Вот он, этот ряд, по нему и определяют. Чем левее стоит металл, в этом ряду, тем он активней, вот например, сравнить активность натрия и железа.
Как увеличивается химическая активность щелочных металлов?
Мы знаем, что щелочные металлы — одни из самых мощных восстановителей и в химических реакциях они имеют тенденцию отдавать свой валентный электрон. То есть чем легче щелочной металл отдаёт валентный электрон, тем он химически активен. … Тогда и химическая активность щелочных металлов от лития до франция возрастает.
Как изменяется восстановительная активность металлов в электрохимическом ряду?
Восстановительная активность металлов (свойство отдавать электроны) уменьшается, а окислительная способность их катионов (свойство присоединять электроны) увеличивается в указанном ряду сверху вниз (если ряд был в горизонтальном расположении — слева направо). …
Как изменяется активность металлов в таблице Менделеева?
Изменение металлических свойств в таблице Менделеева. … Слева от водорода находятся активные металлы (активность увеличивается к левому краю), справа – неактивные. Наибольшую активность проявляют щелочные металлы, находящиеся в I группе периодической таблицы и стоящие левее водорода в электрохимическом ряду напряжений.
Какие металлы стоят до водорода?
Мы увидели, что металлы, стоящие в электрохимическом ряду напряжений до водорода (железо, алюминий и магний), восстанавливают его из растворов кислот. Металлы, стоящие в ряду после водорода (в нашем опыте – медь), не восстанавливают его из кислот.
Зачем ряд активности металлов?
Ряд напряжений (ряд активности или электрохимический ряд напряжения ЭХРН) металлов используется на практике для относительной оценки химической активности металлов в реакциях с водными растворами солей и кислот и для оценки катодных и анодных процессов при электролизе.
Какой из металлов более активен?
Наиболее активными считаются щелочные металлы:
- литий;
- натрий;
- калий;
- рубидий;
- цезий;
- франций.
Что относится к технологическим свойствам?
Технологические свойства определяют пригодность материала для изготовления из него детали тем или иным способом. К числу этих свойств относятся: обрабатываемость резанием, ковкость, свариваемость, жидкотекучесть, усадка, склонность к ликвации и др.
Какой из металлов наиболее активно реагирует с водой?
Взаимодействие щелочных металлов с водой Щелочные металлы: литий, натрий, калий — очень активны.
Как определить какой элемент активнее?
Самый активный металл – это Цезий Наиболее активными металлами являются элементы I и II групп, находящиеся с левой стороны периодической таблицы Менделеева. Металл считается активным, когда он сильно и быстро реагирует с другими элементами.
Что такое электрохимический ряд напряжений металлов какими двумя?
Электрохимический ряд напряжений металлов — это последовательность металлов, в которой слева направо их восстановительные свойства уменьшаются. … 2) Металл способен вытеснять из растворов солей другие металлы, которые стоят в ряду напряжений после него.
Интересные материалы:
Как определить в Вайбере что сообщение прочитано? Как определить варикоз малого таза? Как определить величину интервала? Как определить вес бриллианта по диаметру? Как определить вес сухого корма без весов? Как определить вид позиции плода? Как определить вино или уже уксус? Как определить вино из порошка или нет? Как определить вкус кофе? Как определить владельца процесса?






