- Ковалентная полярная связь
- Механизмы образования ковалентной связи
- Кратность ковалентной связи
- Характеристики ковалентной связи
- Насыщаемость ковалентной связи
- Полярность ковалентной связи
- Направленность ковалентной связи
- Вопросы для самопроверки
- Химические связи
- Ковалентная связь ( лат. со — совместно + valens — имеющий силу)
- Ионная связь
- Металлическая связь
- Водородная связь
- Ковалентные неполярные и полярные связи — урок. Химия, 8 класс
- Типы химических связей
- Ковалентная связь
- Ковалентная неполярная связь
- Ковалентная полярная связь
- Ионная связь
- Водородная связь
- Примеры решения задач по химии в ЕГЭ на типы химических связей
- Строение веществ. Химическая связь: ковалентная (полярная и неполярная), ионная, металлическая – HIMI4KA
- Тренировочные задания
- Ответы
- 1.3.1. Ковалентная химическая связь, ее разновидности и механизмы образования. Характеристики ковалентной связи (полярность и энергия связи). Ионная связь. Металлическая связь. Водородная связь
- Ковалентная связь
- Ионная связь
- Металлическая связь
- Водородная связь
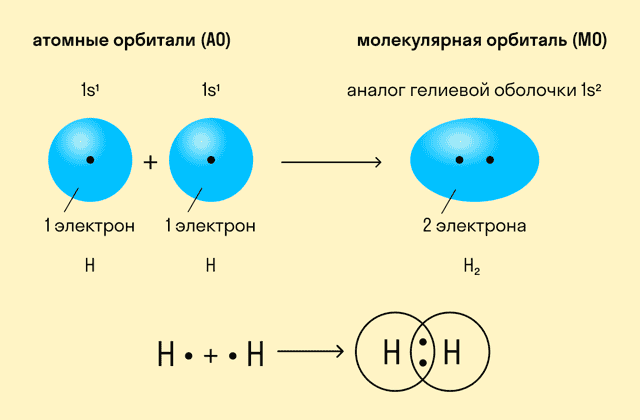
На примере ковалентных связей удобно описывать механизм химической связи в целом. Впервые это сделал американский ученый Гилберт Льюис, анализируя взаимодействие между частицами в молекулах водорода, азота, кислорода и других простых неметаллов.
Как происходит такое взаимодействие? Атом водорода отличается очень простым строением — его электронное облако или орбиталь содержит лишь один свободный (валентный) электрон. При сближении двух атомов водорода их орбитали пересекаются и начинают частично перекрывать друг друга.
Свободные электроны на этих орбиталях объединяются в пару, которая принадлежит обоим участникам взаимодействия. Это и есть процесс образования ковалентной связи. По ее итогам каждый атом имеет уже два электрона и приобретает устойчивую внешнюю оболочку.
| Ковалентная связь — это образование общей электронной пары у двух атомов вещества при сближении ядер этих атомов. В зависимости от того, будет ли пара принадлежать обоим атомам в равной мере или сместится к одному из них, ковалентная связь бывает полярной или неполярной. |
Приведенный выше пример с атомами водорода иллюстрирует ковалентную неполярную связь. Образованная пара электронов находится на общей молекулярной орбитали и принадлежит обоим атомам. Это происходит потому, что в простых веществах взаимодействуют атомы с одинаковой электроотрицательностью (ЭО), т. е. они имеют равную способность притягивать электроны.
| Ковалентная неполярная связь — это такое взаимодействие двух атомов, при котором их общая пара электронов равноудалена от атомных ядер и одинаково принадлежит обоим атомам. Другими словами, электронная плотность (область, в которой наиболее вероятно нахождение электронов) распределена равномерно. Ковалентная неполярная связь образуется между атомами элементарных веществ с одинаковой ЭО. |
Интересный пример ковалентной связи этого типа — молекула ромбической серы S8. У атома серы есть 2 свободных электрона, поэтому он может образовать 2 связи. Это простое вещество, а значит, все атомы будут притягивать электроны с одинаковой силой.
Формула данного вещества с ковалентной неполярной связью:
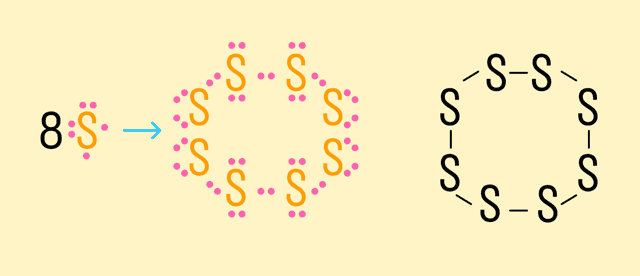
Ковалентная полярная связь
Мы рассмотрели, как проходит ковалентная химическая связь в молекулах, где все частицы одинаковы. Но если сблизить два атома с разной ЭО — например, водорода и хлора, получится другая картина. Поскольку у хлора ЭО выше и он притягивает электроны немного сильнее, чем водород, общая пара смещается в его сторону. Другими словами, у такой химической связи есть полярность.
Атом, принимающий электроны (в данном случае хлор), приобретает условно отрицательный заряд. Второй же атом, отдающий валентные электроны, заряжается положительно.
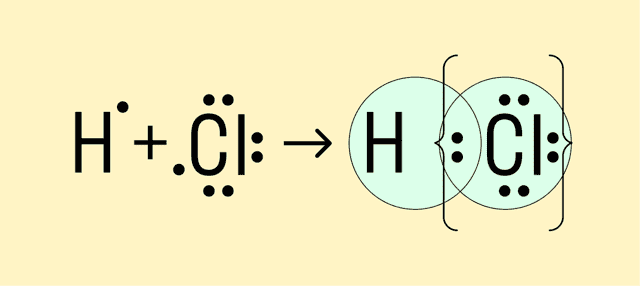
| Ковалентная полярная связь — это электронный обмен между двумя атомами в молекуле вещества, при котором общая пара электронов смещается к одному атому (более электроотрицательному). Электронная плотность распределена неравномерно. Ковалентная полярная связь образуется между атомами неметаллов с разной ЭО в составе сложных веществ. |
Проиллюстрируем все, о чем сказано в определении ковалентной полярной связи, на примерах.
В молекуле аммиака NH3 атом азота имеет 3 свободных электрона, т. е. может образовать 3 химические связи. Поскольку это сложное вещество, состоящее из атомов неметаллов, можно говорить о полярности. Атом азота имеет общие электронные пары с тремя атомами водорода. При этом азот обладает более высокой ЭО, чем водород, поэтому электронная плотность смещена в его сторону.
Формула данного вещества с ковалентной полярной связью:
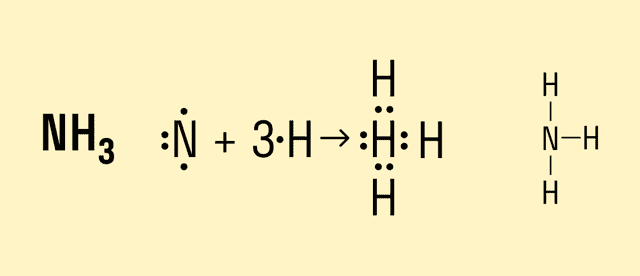
Механизмы образования ковалентной связи
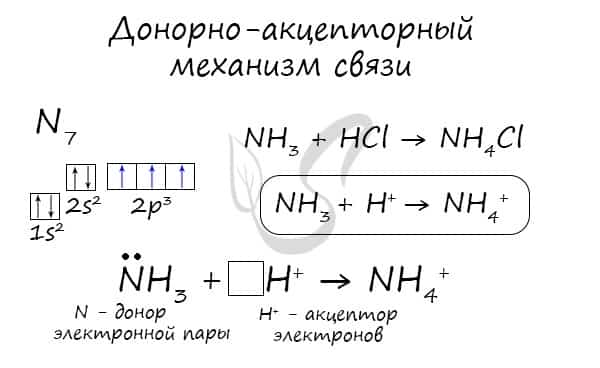
Не всегда взаимодействие атомов происходит так, как в молекуле водорода. Иногда один атом отдает оба электрона, а второй забирает их на свою свободную орбиталь. В зависимости от этого выделяют два механизма ковалентной связи:
- Обменный механизм — объединение в пару свободных электронов от взаимодействующих атомов (по одному электрону от каждого).
- Донорно-акцепторный механизм — процесс, при котором атом-донор отдает два электрона, а атом-акцептор предоставляет для них орбиталь.
Химическую связь, образованную по донорно-акцепторному принципу, можно рассмотреть на примере молекулы катиона аммония.
В данном случае атом азота, который содержится в аммиаке NH3, имеет неподеленную пару электронов и является донором. Он передает эти электроны на орбиталь атома водорода — акцептора.
В результате такой связи образуется молекула NH4+ в форме тетраэдра, где углы представлены четырьмя атомами водорода.
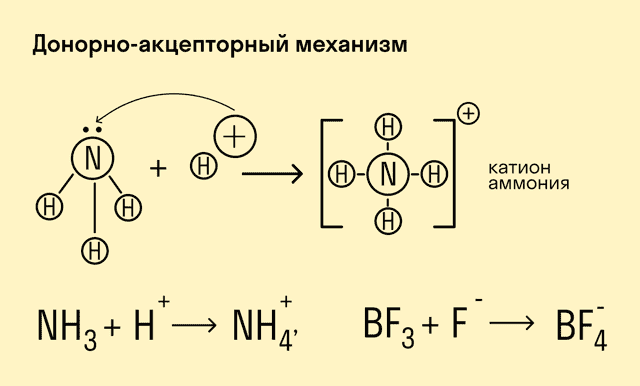
Вещества, в молекулах которых есть хотя бы одна ковалентная химическая связь, осуществляемая по донорно-акцепторному принципу:
- NH4+Cl, NH4+Br;
- NO3-;
- KNO3, LiNO3;
- O3;
- H3O+;
- CO;
- K(Al(OH)4), Na2(Zn(OH)4).
Кратность ковалентной связи
Ковалентная связь может подразумевать образование как одной пары электронов, так и двух или даже трех. Исходя из того, сколько именно получилось пар, выделяют одинарные, двойные и тройные связи. В формулах они обозначаются соответствующим количество черточек.
| Кратность ковалентной связи — это количество созданных общих электронных пар у двух атомов. |
Например, в молекуле хлора Cl2 каждый атом содержит по одному валентному электрону на внешней p-орбитали. При сближении атомов происходит перекрывание орбиталей и свободные электроны соединяются в одну общую пару. Это одинарная ковалентная связь. В данном случае она будет неполярной, поскольку речь идет о простом веществе.
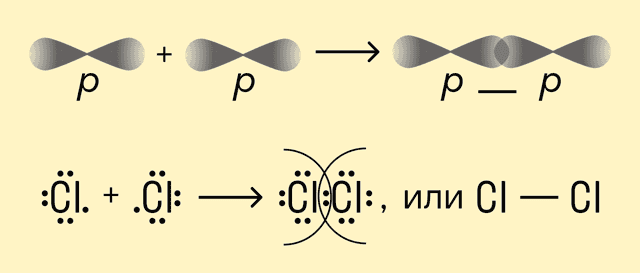
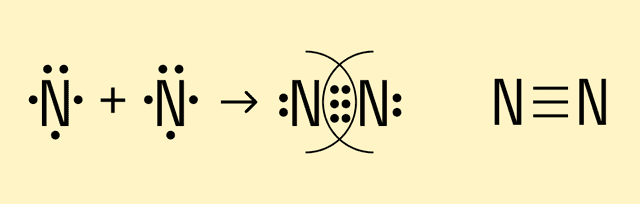
Посмотрим теперь, что происходит с атомами азота, у которых на внешней орбитали целых 5 валентных электронов.
Как мы помним, все частицы стремятся приобрести устойчивую форму, которая предполагает двухэлектронную или восьмиэлектронную внешнюю оболочку.
Таким образом, атомам азота нужно довести количество электронов на внешней орбитали до 8, для чего они отдают в общие пары по 3 электрона. В результате получаются 3 электронные пары, и такая химическая связь называется тройной.
Характеристики ковалентной связи
К ковалентным связям применимы те же общие закономерности, что и для других типов. Например, чем меньше длина ковалентной связи, тем она прочнее. Но есть и специфические свойства, которые появляются только при этом виде взаимодействия:
- насыщаемость,
- полярность,
- направленность.
Насыщаемость ковалентной связи
Насыщаемость говорит об ограничениях по количеству взаимодействий, в которые может вступать один атом. Таких взаимодействий, т. е. химических связей, может быть ровно столько, сколько у атома неспаренных электронов. Как мы помним из примеров выше, у водорода один валентный электрон, поэтому он может образовать только одинарную ковалентную связь.
Количество свободных электронов может увеличиться, если атом перейдет в возбужденное состояние. В этом случае происходит распаривание электронов и перемещение их на свободные орбитали более высоких подуровней внешнего уровня. Эти распаренные электроны также способны вступать в химические связи.
Полярность ковалентной связи
Полярность связи — это смещение электронной плотности к одному из атомов. Чем больше выражено такое смещение, тем более полярной является связь. Напомним, что электронная плотность смещается всегда в сторону более электроотрицательного элемента. Следовательно, большая разница в ЭО между атомами обуславливает высокую полярность связи.
Атом, к которому смещается общая пара электронов, заряжается отрицательно. Данный заряд обозначают буквой δ-. Второй атом заряжается положительно, и этот заряд обозначают буквой δ+. Очень часто центры положительного и отрицательного зарядов разделяет некоторое расстояние. Молекулы с таким устройством называют диполями (поскольку они имеют два полюса)
Логично предположить, что ковалентная полярная химическая связь всегда ведет к образованию диполей. Но это не так. В одной молекуле часто присутствует несколько типов связи, и если один из них вызывает смещение электронной пары, то другой может это компенсировать. В таком случае получится неполярная молекула (например, CO2)
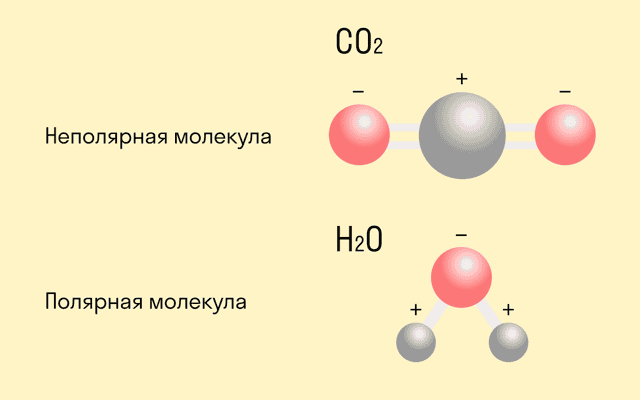
Смещение электронной плотности в сторону одного из атомов, связанных ковалентной полярной связью, в структурной формуле можно обозначить стрелкой или дугой. Стрелка используется, если перекрываемые орбитали атомов находятся на одной оси, а дуга — если они расположены под углом.
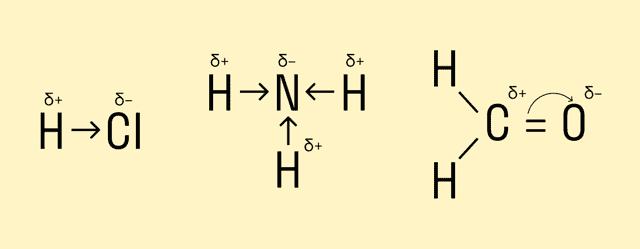
Направленность ковалентной связи
Ковалентная связь становится направленной, если в ней участвуют атомы, чьи орбитали (электронные облака) находятся под определенным углом друг к другу. Если провести воображаемые линии между связанными атомами, можно увидеть этот угол — он называется валентным. По значениям валентных углов легко определить строение молекулы вещества, ее геометрическую форму.
В зависимости от взаимного расположения орбиталей выделяют:
- σ-связи, которые образуются, если перекрывание орбиталей идет по оси, соединяющей ядра атомов (т. е. линейно);
- π-связи, которые предполагают боковое перекрывание (электронные облака находятся под углом друг к другу).
Как понятно из этих определений, два атома могут иметь только одну σ-связь, а в дополнение к этому они могут быть связаны с другими атомами π-связями.
Вопросы для самопроверки
-
Дайте определение ковалентной связи.
-
Что такое ковалентная полярная связь, чем она отличается от неполярной?
-
Исключите лишнее: ковалентная полярная связь характерна для H2S, O2, N2O5, SF6.
-
Чем обусловлена кратность химической связи?
-
Назовите два механизма образования ковалентной связи.
Летняя перезагрузка
Бесплатный телеграм-марафон для мам и пап. Узнайте, как провести семейное лето с пользой, и подготовьтесь к нему уже сейчас!
Химические связи
Химическая связь — связь между атомами в молекуле или молекулярном соединении, возникающая в результате переноса электронов с одного атома на другой, либо обобществления электронов для обоих атомов.
Различают несколько типов химических связей: ковалентная, ионная, металлическая, водородная.
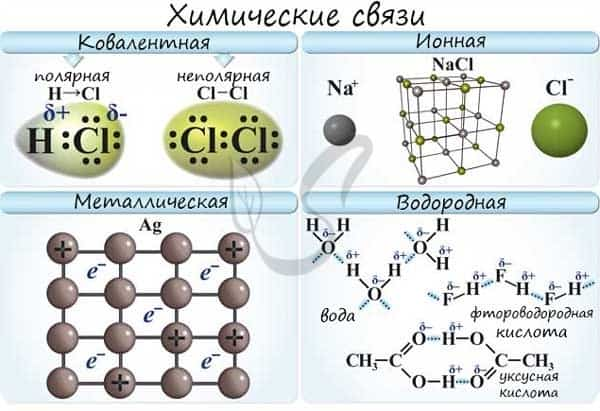
Ковалентная связь ( лат. со — совместно + valens — имеющий силу)
Ковалентная связь возникает между двумя атомами по обменному механизму (обобществление пары электронов) или донорно-акцепторному механизму (электронов донора и свободной орбитали акцептора).
Ковалентной связью соединены атомы в молекулах простых веществ (Cl2, Br2, O2), органических веществ (C2H2), а также, в общем случае, между атомами неметалла и другого неметалла (NH3, H2O, HBr).
Если атомы, образующие ковалентную связь, имеют одинаковые значения электроотрицательности, то связь между ними называется ковалентной неполярной связью. В таких молекулах нет «полюса» — электронная плотность распределяется равномерно. Примеры: Cl2, O2, H2, N2, I2.
Если атомы, образующие ковалентную связь, имеют разные значения электроотрицательности, то связь между ними называется ковалентной полярной. В таких молекулах имеется «полюс» — электронная плотность смещена к более электроотрицательному элементу. Примеры: HCl, HBr, HI, NH3, H2O.

Ковалентная связь может быть образована по обменному механизму — обобществлению электронной пары. В таком случае каждый атом «одинаково» вкладывается создание связи. Например, два атома азота, образующие молекулу N2, отдают по 3 электрона с внешнего уровня для создания связи.

Существует донорно-акцепторный механизм образования ковалентной связи, при котором один атом выступает в качестве донора неподеленной электронной пары. Другой атом не тратит свои электроны, а только лишь предоставляет орбиталь (ячейку) для этой электронной пары.
Рекомендую выучить список веществ, образованных по донорно-акцепторному механизму:
- NH4+ — в ионе аммония
- NH4+Cl, NH4+Br — внутри иона аммония во всех его солях
- NO3- — в нитрат ионе
- KNO3, LiNO3 — внутри нитрат иона во всех нитратах
- O3 — озон
- H3O+ — ион гидроксония
- CO — угарный газ
- K[Al(OH)4], Na2[Zn(OH)4] — во всех комплексных солях есть хотя бы одна ковалентная связь, возникшая по донорно-акцепторному механизму
Ионная связь
- Ионная связь — один из видов химической связи, в основе которого лежит электростатическое взаимодействие между противоположно заряженными ионами.
- В наиболее частом случае ионная связь образуется между типичным металлом и типичным неметаллом. Примеры:
- NaF, CaCl2, MgF2, Li2S, BaO, RbI.
Большой подсказкой служит таблица растворимости, ведь все соли имеют ионные связи: CaSO4, Na3PO4.
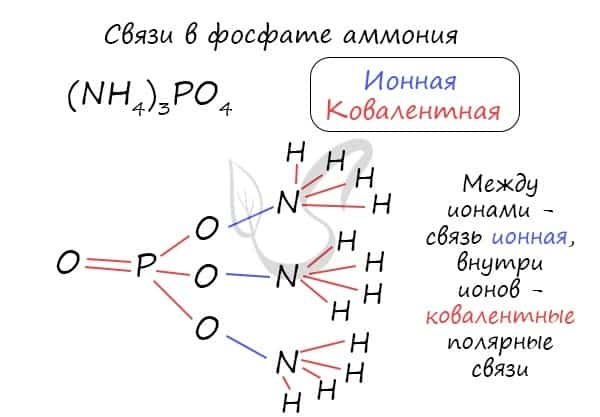
Даже ион аммония не исключение, между катионом аммония и различными анионами образуются ионные связи, например в соединениях: NH4I, NH4NO3, (NH4)2SO4.
Часто в химии встречаются несколько связей внутри одной молекулы. Рассмотрим, например, фосфат аммония, обозначив тип каждой связи внутри этой молекулы.
Металлическая связь
Металлическая связь — вид химической связи удерживающая вместе атомы металла. Этот тип связи выделен отдельно, так как его отличием является наличие высокой концентрации в металлах электронов проводимости — «электронного газа». По природе металлическая связь близка к ковалентной.
«Облако» электронов в металлах способно приходить в движение под различным воздействием. Именно оно является причиной электропроводности металлов.
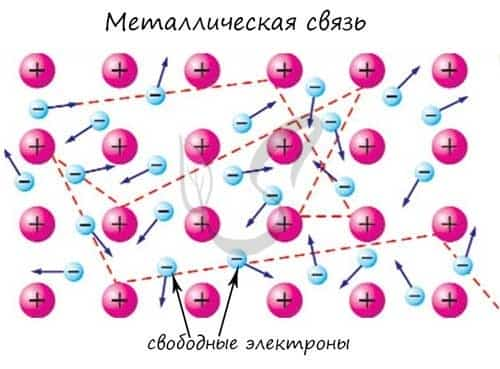
Водородная связь
Водородная связь — вид химической связи, образующийся между некоторыми молекулами, содержащими водород. Одна из наиболее частых ошибок считать, что в самом газе, водороде, имеются водородные связи — это вовсе не так.
Водородные связи возникают между атомом водорода и другим более электроотрицательным атомом (O, S, N, C).
Необходимо осознать самую важную деталь: водородные связи образуются между молекулами, а не внутри. Они имеются между молекулами:
- H2O
- NH3
- HF
- Органических спиртов: С2H5OH, C3H7OH
- Органических кислот: CH3COOH, C2H5COOH
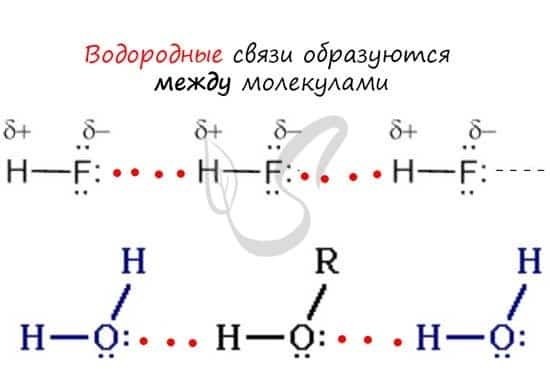
Отчасти за счет водородных связей наблюдается то самое исключение, связанное с усилением кислотных свойств в ряду галогеноводородных кислот: HF → HCl → HBr → HI. Фтор является самым ЭО-ым элементов, сильно притягивает к себе атом водорода другой молекулы, что снижает способность кислоты отщеплять водород и снижает ее силу.
Ковалентные неполярные и полярные связи — урок. Химия, 8 класс
Общие электронные пары, образующиеся в простых веществах H2,O2,Cl2,F2,N2, в одинаковой степени принадлежат обоим атомам. Такая ковалентная связь называется неполярной.
Ковалентная неполярная связь соединяет атомы в простых веществах-неметаллах.
Если ковалентная связь образуется между разными атомами, то общая электронная пара смещается к тому из них, который имеет более высокую электроотрицательность (ЭО). Он получает частичный отрицательный заряд. Атом, имеющий меньшую ЭО, становится заряжённым положительно. В этом случае образуется полярная ковалентная связь.
Ковалентная полярная связь образуется между атомами неметаллов в сложных веществах.
Рассмотрим образование ковалентных связей в сложных веществах.
1. Образование молекулы хлороводорода.
У атома водорода на внешнем уровне — один электрон. У хлора на внешнем уровне — семь электронов, один из которых неспаренный.
Образуется одна общая электронная пара, которая смещена к атому хлора. В результате
появляются частичные заряды: на атоме хлора — отрицательный, а на атоме водорода — положительный. Сдвиг электронной плотности принято обозначать греческой буквой дельта δ:

Рис. (1). Образование молекулы хлороводорода
- Структурная формула хлороводорода H−Cl
- Подобным образом соединяются атомы в молекулах других галогеноводородов:
- H−F,H−Br,H−I.
2. Образование молекулы воды.
На внешнем уровне атома кислорода — шесть электронов, два из которых неспаренные.
Атом кислорода образует две общие электронные пары с двумя атомами водорода.
Электронная плотность этих общих пар сдвинута к более электроотрицательному кислороду. Атом кислорода имеет отрицательный заряд, а атомы водорода — положительный.
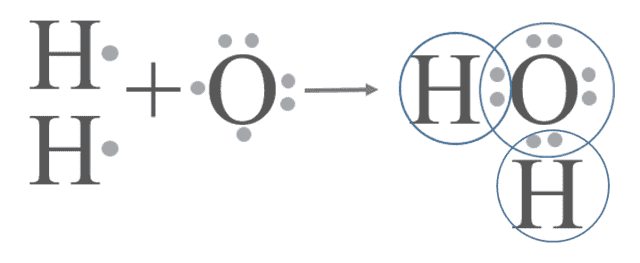
Рис. (2). Образование молекулы воды
Сходное строение имеет молекула сероводорода. Структурные формулы воды и сероводорода:
H−OH−S||HH
3. Образование молекулы аммиака.
- У атома азота — пять внешних электронов, три из которых неспаренные.
- Атом азота присоединяет к себе три атома водорода.
- Азот — более электроотрицательный элемент, поэтому на его атоме будет отрицательный заряд, а на атомах водорода — положительные заряды.
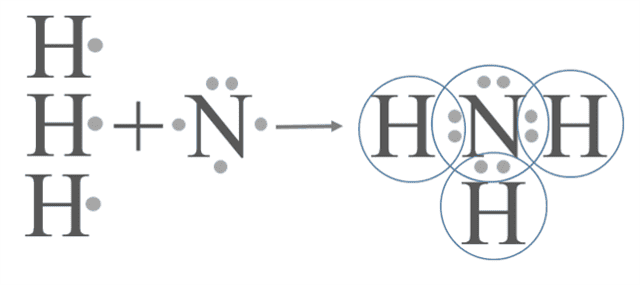
Рис. (3). Образование молекулы аммиака
- Структурная формула аммиака:
- H−N−H|H
- Для того чтобы определить знаки частичных зарядов на атомах в веществе, надо сравнить ЭО неметаллов.
Пример:
определим частичные заряды атомов в соединении CCl4.
Вспомним положение углерода и хлора в ряду ЭО:
По положению элементов в этом ряду видно, что более электроотрицательный элемент в этой паре — хлор. Его атом оттягивает к себе общие электронные пары от атома углерода. Значит, на атоме хлора будет частичный отрицательный заряд, а на атоме углерода — частичный положительный:
C+δCl4−δ.
Полярную ковалентную связь часто изображают стрелкой: H→Cl. Стрелка показывает направление смещения общей электронной плотности.
Источники:
Рис. 1. Образование молекулы хлороводорода © ЯКласс
Рис. 2. Образование молекулы воды © ЯКласс
Рис. 3. Образование молекулы аммиака © ЯКласс
Типы химических связей
Химическая связь — это взаимодействие атомов, осуществляемое путем обмена электронами. Причина образования химических связей ― выигрыш в энергии системы связанных атомов по сравнению с изолированными атомами.
Выделяют 4 разновидности химической связи ― ковалентная, которая в свою очередь делится на полярную и неполярную, ионная, металлическая и водородная.
Полярность связи зависит от электроотрицательности элементов.
Ковалентная связь
Ковалентная неполярная связь
- Образуется между одинаковыми неметаллами, то есть эти элементы имеют одинаковую ЭО.
- Рассмотри образование ковалентной неполярной связи, на примере водорода:

Ковалентная полярная связь
- Образуется между разными неметаллами, то есть между этими элементами есть небольшая разница в ЭО.
- Рассмотрим образование ковалентной полярной связи, на примере сероводорода:
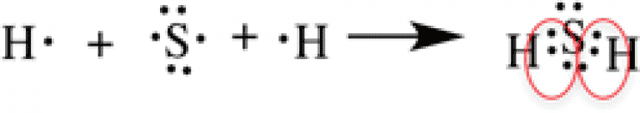
Ионная связь
Образуется между металлом и неметаллом, то есть между веществами большая разница ЭО. Один из элементов отдает свои электроны и он заряжается положительно. Элемент, который принимает электроны заряжается отрицательно.
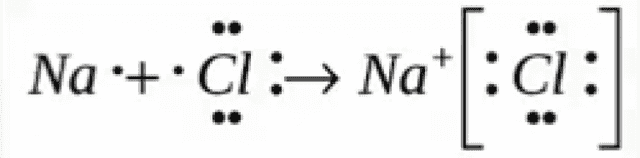
Металлическая связь ― обобществление валентных электронов «электронный газ» осуществляется в простых веществах металлах и их сплавах (Na, Fe, Сг, Al и т. д.).
Водородная связь
Водородная связь ― связь между электроотрицательным атомом (F, O, N) и атомом водорода, который ковалентно связан с другим электроотрицательным атомом (F, O, N).
Водородные связи влияют на физические (температуру кипения, температуру плавления) и химические (кислотно-основные) свойства соединений.
Межмолекулярные водородные связи обусловливают ассоциацию молекул, что приводит к повышению температур кипения и плавления вещества. Например, этиловый спирт C2H5OH, способный к ассоциации, кипит при +78,3°С, а диметиловый эфир СН3ОСН3, не образующий водородных связей, лишь при –24°С (молекулярная формула обоих веществ С2Н6О).
| Тип связи | Примеры |
| Ковалентная неполярная | Cl2, O2, Br2, I2, N2 и др. |
| Ковалентная полярная | HCl, H2S, HBr, H2O, SO2, SO3 и др. |
| Ионная | NaCl, KCl, CaBr2, Na2O и др. |
| Металлическая | Na, Ca, Zn, Al и др. |
| Водородная | Между молекулами: |
Примеры решения задач по химии в ЕГЭ на типы химических связей
Задача 1. Из предложенного перечня выберите два соединения, в которых присутствует ионная химическая связь.
- Ca(ClO2)2
- HClO3
- NH4Cl
- HClO4
- Cl2O7
Решение: Ионная химическая связь характерна для оксидов, гидроксидов и солей металлов (+соли аммония и гидроксид аммония). Соли —это вариант 1 и 3.
Задача 2. Из предложенного перечня выберите два соединения, в которых присутствует ковалентная химическая связь.
https://www.youtube.com/watch?v=sumqgnXqg_Yu0026t=307s
Запишите в поле ответа номера выбранных соединений. Решение: Ковалентная связь характерна для простых веществ-неметаллов и соединений типа неметалл-неметалл. Это простое вещество хлор и сульфид углерода. Таким образом ответ будет 1 и 2.
Задача 3. Из предложенного перечня выберите два соединения, в которых присутствует ковалентная полярная химическая связь.
Решение: Ковалентная полярная связь образуется между двумя разными неметаллами. Ответ 34.
Задача 4. Из предложенного перечня выберите два соединения, в которых присутствует водородная химическая связь.
Решение: Водородная химическая связь возникает между молекулами воды и одноатомных спиртов. Ответ 14.
Задача 5. Из предложенного перечня выберите два соединения, в которых ковалентная связь образована по донорно-акцепторному механизму.
- Карбид кальция
- Сульфат аммония
- Оксид фосфора (V)
- Криптон
- Угарный газ
Решение: Донорно-акцепторный механизм образования связи характерен для иона аммония и угарного газа в связи с наличием неподеленной электронной пары на азоте и углероде соответственно. Ответ: 25.
Задача 6. Из предложенного перечня выберите два соединения, в которых присутствует ковалентная неполярная химическая связь.
https://www.youtube.com/watch?v=sumqgnXqg_Yu0026t=307s
Запишите в поле ответа номера выбранных соединений. Решение: ковалентная неполярная связь образуется между одинаковыми атомами. Это фтор и кислород.
Ответ 35.
Задача 7. Из предложенного перечня выберите два вещества, с каждым из которых сера образует ионные связи.
- Фтор
- Натрий
- Кислород
- Кальций
- Углерод
Запишите в поле ответа номера выбранных соединений. Решение: Ионные связи образуются между металлом и неметаллом. Сера-неметалл, значит, нужно выбрать металлы. Это натрий и кальций.
Ответ: 24.
Задача 8. Из предложенного перечня выберите два вещества, в молекулах которых имеются как полярные, так и неполярные ковалентные связи.
- Решение: В молекуле под номером 1 есть 4 связи C-Cl, все они полярные, но в задании нужно найти молекулу как с полярными, так и с неполярными связями.
- В молекуле бензола (под номером 2) содержится 2 вида связей: C-C неполярная и C-H полярная.
- В молекуле HNO3 хоть и 3 кислорода, но между собой они не связаны, поэтому наблюдается 2 вида только полярных связей H-N, N-O.
- В молекуле N2O4 2 типа связей: N-N неполярная и N-O полярная.
В молекуле углекислого газа оба кислорода связаны только с углеродом, образуя только полярные связи. Ответ 24.
Задача 9. Из предложенного перечня выберите два вещества, в которых присутствует металлическая связь.
Решение: металлическая связь характерная для металлов и сплавов. Металлы здесь — железо и цинк. Ответ 35.
Задача 10. Из предложенного перечня выберите два вещества, с которыми соединения хлора имеют ковалентную полярную связь.
- Водород
- Калий
- Магний
- Натрий
- Фосфор
Запишите в поле ответа номера выбранных соединений. Решение: Ковалентная полярная связь образуется в молекулах между атомами разных неметаллов, ионная — между атомами металлов и неметаллов.
Поэтому ковалентную полярную связь имеет соединение хлора с водородом и фосфором. С остальными — связь ионная. Ответ: 15.
Задача 11. Из предложенного перечня выберите два соединения, в которых имеются только ионные связи.
Решение: Ковалентная не полярная связь образуется в молекулах между атомами одного элемента-неметалла. Ковалентная полярная связь образуется в молекулах между атомами разных неметаллов, ионная — между атомами металлов и неметаллов.
Поэтому только ионные связи присутствуют в KI и BaCl2. Ответ: 12.
Задача 12. Из предложенного перечня выберите два соединения, между молекулами которых образуются водородные связи.
- Фтороводород
- Бутанол
- Хлорметан
- Диметиловый эфир
- Этилен
Решение: Межмолекулярная водородная связь образуется между атомом водорода, ковалентно связанным с атомом с высокой электроотрицательностью (F, O и N), одной молекулы и атомом элемента с высокой электроотрицательностью (F, O, N, Cl) другой молекулы.
Среди предложенных веществ водородная связь образуется между молекулами фторводорода и бутанола. Ответ: 12.
Задача 13. Из предложенного перечня выберите два соединения, образованные как ковалентной, так и ионной связью.
- CaSO4
- C2H5OH
- NH4NO3
- NaCl
- C6H6
Решение: В этиловом спирте связи ковалентные, в хлориде натрия — ионные, в бензоле — ковалентные. В нитрате аммония и сульфате кальция связи в ионе аммония и нитратном и сульфатном анионах ковалентные, а между ионом аммония и нитратным анионом, а также ионом кальция и сульфат анионом — ионная. Ответ: 13
Задача 14. Из предложенного перечня выберите два соединения, где кислород образует ковалентную полярную связь.
Решение: Ковалентная полярная связь осуществляется между разными неметаллами. Ответ: 13
Задача 15. Из предложенного перечня выберите два типа химических связей, которые реализуются в сульфате калия.
- ковалентная неполярная
- ковалентная полярная
- ионная
- металлическая
- водородная
Решение: Ковалентная неполярная связь образуется в молекулах между атомами одного элемента-неметалла.
Ковалентная полярная связь образуется в молекулах между атомами разных неметаллов, ионная — между атомами металлов и неметаллов.
В сульфате калия между ионами калия и сульфат-ионами связь ионная, а между кислородом и серой в сульфат-ионе — ковалентная полярная. Ответ: 23.
Строение веществ. Химическая связь: ковалентная (полярная и неполярная), ионная, металлическая – HIMI4KA
ОГЭ 2018 по химии › Подготовка к ОГЭ 2018
Химическая связь — электростатическое взаимодействие между электронами и ядрами, приводящее к образованию молекул.
Химическую связь образуют валентные электроны. У s- и p-элементов валентными являются электроны внешнего слоя, у d-элементов — s-электроны внешнего слоя и d-электроны предвнешнего слоя. При образовании химической связи атомы достраивают свою внешнюю электронную оболочку до оболочки соответствующего благородного газа.
- Длина связи — среднее расстояние между ядрами двух химически связанных между собой атомов.
- Энергия химической связи — количество энергии, необходимое для того, чтобы разорвать связь и отбросить фрагменты молекулы на бесконечно большое расстояние.
- Валентный угол — угол между линиями, соединяющими химически связанные атомы.
- Известны следующие основные типы химической связи: ковалентная (полярная и неполярная), ионная, металлическая и водородная.
- Ковалентной называют химическую связь, образованную за счёт образования общей электронной пары.
Если связь образует пара общих электронов, в равной мере принадлежащая обоим соединяющимся атомам, то её называют ковалентной неполярной связью. Эта связь существует, например, в молекулах H2, N2, O2, F2, Cl2, Br2, I2. Ковалентная неполярная связь возникает между одинаковыми атомами, а связующее их электронное облако равномерно распределено между ними.
В молекулах между двумя атомами может формироваться различное число ковалентных связей (например, одна в молекулах галогенов F2, Cl2, Br2, I2, три — в молекуле азота N2).
Ковалентная полярная связь возникает между атомами с разной электроотрицательностью. Образующая её электронная пара смещается в сторону более электроотрицательного атома, но остаётся связанной с обоими ядрами. Примеры соединений с ковалентной полярной связью: HBr, HI, H2S, N2O и т. д.
Ионной называют предельный случай полярной связи, при которой электронная пара полностью переходит от одного атома к другому и связанные частицы превращаются в ионы.
Строго говоря, к соединениям с ионной связью можно отнести лишь соединения, для которых разность в электроотрицательности больше 3, но таких соединений известно очень мало. К ним относят фториды щелочных и щёлочноземельных металлов.
Условно считают, что ионная связь возникает между атомами элементов, разность электроотрицательности которых составляет величину больше 1,7 по шкале Полинга. Примеры соединений с ионной связью: NaCl, KBr, Na2O.
Подробнее о шкале Полинга будет рассказано в следующем уроке.
Металлической называют химическую связь между положительными ионами в кристаллах металлов, которая осуществляется в результате притяжения электронов, свободно перемещающихся по кристаллу металла.
Атомы металлов превращаются в катионы, формируя металлическую кристаллическую решётку. В этой решётке их удерживают общие для всего металла электроны (электронный газ).
Тренировочные задания
- 1. Ковалентной неполярной связью образовано каждое из веществ, формулы которых
- 1) O2, H2, N2 2) Al, O3, H2SO4 3) Na, H2, NaBr 4) H2O, O3, Li2SO4
- 2. Ковалентной полярной связью образовано каждое из веществ, формулы которых
- 1) O2, H2SO4, N2 2) H2SO4, H2O, HNO3 3) NaBr, H3PO4, HCl 4) H2O, O3, Li2SO4
- 3. Только ионной связью образовано каждое из веществ, формулы которых
- 1) CaO, H2SO4, N2 2) BaSO4, BaCl2, BaNO3 3) NaBr, K3PO4, HCl 4) RbCl, Na2S, LiF
- 4. Металлическая связь характерна для элементов списка
- 1) Ba, Rb, Se 2) Cr, Ba, Si 3) Na, P, Mg
- 4) Rb, Na, Cs
- 5. Соединениями только с ионной и только с ковалентной полярной связью являются соответственно
- 1) HCl и Na2S 2) Cr и Al(OH)3 3) NaBr и P2O5 4) P2O5 и CO2
- 6. Ионная связь образуется между элементами
- 1) хлором и бромом 2) бромом и серой 3) цезием и бромом
- 4) фосфором и кислородом
- 7. Ковалентная полярная связь образуется между элементами
- 1) кислородом и калием 2) серой и фтором 3) бромом и кальцием
- 4) рубидием и хлором
- 8. В летучих водородных соединениях элементов VA группы 3-го периода химическая связь
- 1) ковалентная полярная 2) ковалентная неполярная 3) ионная
- 4) металлическая
- 9. В высших оксидах элементов 3-го периода вид химической связи с увеличением порядкового номера элемента изменяется
- 1) от ионной связи к ковалентной полярной связи 2) от металлической к ковалентной неполярной 3) от ковалентной полярной связи до ионной связи
- 4) от ковалентной полярной связи до металлической связи
- 10. Длина химической связи Э–Н увеличивается в ряду веществ
- 1) HI – PH3 – HCl 2) PH3 – HCl – H2S 3) HI – HCl – H2S 4) HCl – H2S – PH3
- 11. Длина химической связи Э–Н уменьшается в ряду веществ
- 1) NH3 – H2O – HF 2) PH3 – HCl – H2S 3) HF – H2O – HCl 4) HCl – H2S – HBr
- 12. Число электронов, которые участвуют в образовании химических связей в молекуле хлороводорода, —
- 1) 4 2) 2 3) 6
- 4) 8
- 13. Число электронов, которые участвуют в образовании химических связей в молекуле P2O5, —
- 1) 4 2) 20 3) 6
- 4) 12
- 14. В хлориде фосфора (V) химическая связь
- 1) ионная 2) ковалентная полярная 3) ковалентная неполярная
- 4) металлическая
- 15. Наиболее полярная химическая связь в молекуле
- 1) фтороводорода 2) хлороводорода 3) воды
- 4) сероводорода
- 16. Наименее полярная химическая связь в молекуле
- 1) хлороводорода 2) бромоводорода 3) воды
- 4) сероводорода
- 17. За счёт общей электронной пары образована связь в веществе
- 1) Mg 2) H2 3) NaCl
- 4) CaCl2
- 18. Ковалентная связь образуется между элементами, порядковые номера которых
- 1) 3 и 9 2) 11 и 35 3) 16 и 17
- 4) 20 и 9
- 19. Ионная связь образуется между элементами, порядковые номера которых
- 1) 13 и 9 2) 18 и 8 3) 6 и 8
- 4) 7 и 17
- 20. В перечне веществ, формулы которых соединения только с ионной связью, это
- 1) NaF, CaF2 2) NaNO3, N2 3) O2, SO3 4) Ca(NO3)2, AlCl3
Ответы
1.3.1. Ковалентная химическая связь, ее разновидности и механизмы образования. Характеристики ковалентной связи (полярность и энергия связи). Ионная связь. Металлическая связь. Водородная связь
Крайне редко химические вещества состоят из отдельных, не связанных между собой атомов химических элементов. Таким строением в обычных условиях обладает лишь небольшой ряд газов называемых благородными: гелий, неон, аргон, криптон, ксенон и радон.
Чаще же всего химические вещества состоят не из разрозненных атомов, а из их объединений в различные группировки. Такие объединения атомов могут насчитывать несколько единиц, сотен, тысяч или даже больше атомов.
Сила, которая удерживает эти атомы в составе таких группировок, называется химическая связь.
Другими словами, можно сказать, что химической связью называют взаимодействие, которое обеспечивает связь отдельных атомов в более сложные структуры (молекулы, ионы, радикалы, кристаллы и др.).
- Причиной образования химической связи является то, что энергия более сложных структур меньше суммарной энергии отдельных, образующих ее атомов.
- Так, в частности, если при взаимодействии атомов X и Y образуется молекула XY, это означает, что внутренняя энергия молекул этого вещества ниже, чем внутренняя энергия отдельных атомов, из которых оно образовалось:
- E(XY) < E(X) + E(Y)
- По этой причине при образовании химических связей между отдельными атомами выделятся энергия.
- Упрощенно можно считать, что в основе химических связей лежат электростатические силы, обусловленные взаимодействиями положительно заряженных ядер и отрицательно заряженных электронов.
- В образовании химических связей элементов главных подгрупп принимают участие электроны внешнего электронного слоя с наименьшей энергией связи с ядром, называемые валентными. Например, у бора таковыми являются электроны 2 энергетического уровня – 2 электрона на 2s-орбитали и 1 на 2p-орбитали:
При образовании химической связи каждый атом стремится получить электронную конфигурацию атомов благородных газов, т.е. чтобы в его внешнем электронном слое было 8 электронов (2 для элементов первого периода). Это явление получило название правила октета.
Достижение атомами электронной конфигурации благородного газа возможно, если изначально одиночные атомы сделают часть своих валентных электронов общими для других атомов. При этом образуются общие электронные пары.
В зависимости от степени обобществления электронов можно выделить ковалентную, ионную и металлическую связи.
Ковалентная связь
Ковалентная связь возникает чаще всего между атомами элементов неметаллов. Если атомы неметаллов, образующие ковалентную связь, относятся к разным химическим элементам, такую связь называют ковалентной полярной.
Причина такого названия кроется в том, что атомы разных элементов имеют и различную способность притягивать к себе общую электронную пару. Очевидно, что это приводит к смещению общей электронной пары в сторону одного из атомов, в результате чего на нем формируется частичный отрицательный заряд.
В свою очередь, на другом атоме формируется частичный положительный заряд. Например, в молекуле хлороводорода электронная пара смещена от атома водорода к атому хлора:
Примеры веществ с ковалентной полярной связью:
СCl4, H2S, CO2, NH3, SiO2 и т.д.
Ковалентная неполярная связь образуется между атомами неметаллов одного химического элемента. Поскольку атомы идентичны, одинакова и их способность оттягивать на себя общие электроны. В связи с этим смещения электронной пары не наблюдается:
Вышеописанный механизм образования ковалентной связи, когда оба атома предоставляют электроны для образования общих электронных пар, называется обменным.
Также существует и донорно-акцепторный механизм.
При образовании ковалентной связи по донорно-акцепторному механизму общая электронная пара образуется за счет заполненной орбитали одного атома (с двумя электронами) и пустой орбитали другого атома.
Атом, предоставляющий неподеленную электронную пару, называют донором, а атом со свободной орбиталью – акцептором.
В качестве доноров электронных пар выступают атомы, имеющие спаренные электроны, например N, O, P, S.
Например, по донорно-акцепторному механизму происходит образование четвертой ковалентной связи N-H в катионе аммония NH4+:
Помимо полярности ковалентные связи также характеризуются энергией. Энергией связи называют минимальную энергию, необходимую для разрыва связи между атомами.
Энергия связи уменьшается с ростом радиусов связываемых атомов. Так, как мы знаем, атомные радиусы увеличиваются вниз по подгруппам, можно, например, сделать вывод о том, что прочность связи галоген-водород увеличивается в ряду:
HI < HBr < HCl < HF
Также энергия связи зависит от ее кратности – чем больше кратность связи, тем больше ее энергия. Под кратностью связи понимается количество общих электронных пар между двумя атомами.
Ионная связь
Ионную связь можно рассматривать как предельный случай ковалентной полярной связи.
Если в ковалентной-полярной связи общая электронная пара смещена частично к одному из пары атомов, то в ионной она практически полностью «отдана» одному из атомов.
Атом, отдавший электрон(ы), приобретает положительный заряд и становится катионом, а атом, забравший у него электроны, приобретает отрицательный заряд и становится анионом.
- Таким образом, ионная связь — это связь, образованная за счет электростатического притяжения катионов к анионам.
- Образование такого типа связи характерно при взаимодействии атомов типичных металлов и типичных неметаллов.
- Например, фторид калия. Катион калия получается в результате отрыва от нейтрального атома одного электрона, а ион фтора образуется при присоединении к атому фтора одного электрона:
- Между получившимися ионами возникает сила электростатического притяжения, в результате чего образуется ионное соединение.
- При образовании химической связи электроны от атома натрия перешли к атому хлора и образовались противоположно заряженные ионы, которые имеют завершенный внешний энергетический уровень.
- Установлено, что электроны от атома металла не отрываются полностью, а лишь смещаются в сторону атома хлора, как в ковалентной связи.
Большинство бинарных соединений, которые содержат атомы металлов, являются ионными. Например, оксиды, галогениды, сульфиды, нитриды.
Ионная связь возникает также между простыми катионами и простыми анионами (F−, Cl−, S2-), а также между простыми катионами и сложными анионами (NO3−, SO42-, PO43-, OH−). Поэтому к ионным соединениям относят соли и основания (Na2SO4, Cu(NO3)2, (NH4)2SO4), Ca(OH)2, NaOH).
Металлическая связь
Данный тип связи образуется в металлах.
У атомов всех металлов на внешнем электронном слое присутствуют электроны, имеющие низкую энергию связи с ядром атома. Для большинства металлов, энергетически выгодным является процесс потери внешних электронов.
Ввиду такого слабого взаимодействия с ядром эти электроны в металлах весьма подвижны и в каждом кристалле металла непрерывно происходит следующий процесс:
М0 — ne− = Mn+ , где М0 – нейтральный атом металла, а Mn+ катион этого же металла. На рисунке ниже представлена иллюстрация происходящих процессов.
То есть по кристаллу металла «носятся» электроны, отсоединяясь от одного атома металла, образуя из него катион, присоединяясь к другому катиону, образуя нейтральный атом.
Такое явление получило название “электронный ветер”, а совокупность свободных электронов в кристалле атома неметалла назвали “электронный газ”.
Подобный тип взаимодействия между атомами металлов назвали металлической связью.
Водородная связь
Если атом водорода в каком-либо веществе связан с элементом с высокой электроотрицательностью (азотом, кислородом или фтором), для такого вещества характерно такое явление, как водородная связь.
Поскольку атом водорода связан с электроотрицательным атомом, на атоме водорода образуется частичный положительный заряд, а на атоме электроотрицательного элемента — частичный отрицательный.
В связи с этим становится возможным электростатическое притяжения между частично положительно заряженным атомом водорода одной молекулы и электроотрицательным атомом другой.
Например водородная связь наблюдается для молекул воды:
Именно водородной связью объясняется аномально высокая температура плавления воды. Кроме воды, также прочные водородные связи образуются в таких веществах, как фтороводород, аммиак, кислородсодержащие кислоты, фенолы, спирты, амины.






