- Общая характеристика
- Природные соединения
- Получение
- Химические свойства
- Оксиды щелочных металлов
- Получение
- Химические свойства
- Гидроксиды щелочных металлов
- Получение
- Химические свойства
- Щелочные металлы – список и особенности взрывоопасных элементов
- Что представляют собой
- Особенности структуры
- Как представлены в природе
- Технология получения
- Физико-химические свойства
- Физические характеристики
- Химические параметры
- Где используются
- Техника безопасности
- Тесты по химии на тему "Щелочные металлы и их соединения"(9 класс)
- Щелочные металлы в химии
- Физические свойства щелочных металлов
- Получение щелочных металлов
- Химические свойства щелочных металлов
- Качественные реакции
- Примеры решения задач
- Тема: Соединения щелочных металлов Тест по теме: Щелочные металлы. Ответы: 1- г 2
- Урок 6: Щелочные металлы
- Представители щелочных металлов
- Строение атомов щелочных металлов
- Изменение химических свойств щелочных металлов
- Внешний вид и физические свойства щелочных металлов
- Нахождение в природе щелочных металлов
- Обнаружение ионов металлов в соединениях
- Качественные реакции
- Обнаружение катионов лития
- Обнаружение катиона натрия
- Обнаружение катиона калия
- Обнаружение катионов рубидия, цезия
- Обнаружение ионов франция
- Химические свойства щелочных металлов
- Реакция с простыми неметаллами
- Взаимодействие с водой
- Взаимодействие с сильными кислотами
- Специфические химические свойства лития
- Получение щелочных металлов
- Применение соединений щелочных металлов
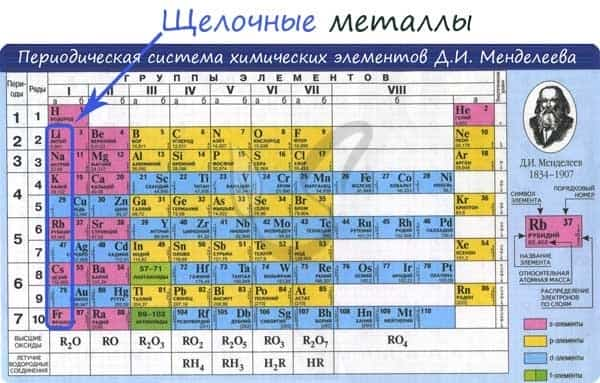
К щелочным металлам относят химические элементы: одновалентные металлы, составляющие Ia группу: литий, натрий, калий, рубидий, цезий и франций.
Эти металлы очень активны, быстро окисляются на воздухе и бурно реагируют с водой. Их хранят под слоем керосина из-за их сильной реакционной способности.

Общая характеристика
От Li к Fr (сверху вниз в периодической таблице) происходит увеличение: атомного радиуса, металлических, основных, восстановительных свойств, реакционной способности. Уменьшается электроотрицательность, энергия ионизации, сродство к электрону.
Электронные конфигурации у данных элементов схожи, так как они находятся в одной группе (главной подгруппе!), общая формула ns1:
- Li — 2s1
- Na — 3s1
- K — 4s1
- Rb — 5s1
- Cs — 6s1
- Fr — 7s1
Природные соединения
В природе щелочные металлы встречаются в виде следующих соединений:
- NaCl — галит (каменная соль)
- KCl — сильвин
- NaCl*KCl — сильвинит

Получение
Получить такие активные металлы электролизом водного раствора — невозможно. Для их получения применяют электролиз расплавов при высоких температурах (естественно — безводных):
NaCl → Na + Cl2↑ (электролиз расплава каменной соли)
Химические свойства
- Реакция с кислородом
- Li + O2 → Li2O (оксид лития)
- Na + O2 → Na2O2 (пероксид натрия)
- K + O2 → KO2 (супероксид калия)
- Реакции с неметаллами
- Li + H2 → LiH (в гидридах водород -1)
- Na + F2 → NaF (в фторидах фтор -1)
- Na + S → Na2S (в сульфидах сера -2)
- K + N2 → K3N (в нитридах азот -3)
- Реакция с водой
- Окрашивание пламени
Одной из особенностей щелочных металлов является их реакция с кислородом. Литий в такой реакции преимущественно образует оксид, натрий — пероксид, калий, рубидий и цезий — супероксиды.
Помните, что металлы никогда не принимают отрицательных степеней окисления. Щелочные металлы одновалентны, и проявляют постоянную степень окисления +1 в различных соединениях: гидриды, галогениды (фториды, хлориды, бромиды и йодиды), нитриды, сульфиды и т.д.
Щелочные металлы бурно взаимодействуют с водой, при этом часто происходит воспламенение, а иногда — взрыв.
Na + H2O → NaOH + H2↑ (воду можно представить в виде HOH — натрий вытесняет водород)
Иногда в задачах может проскользнуть фраза такого плана: «… в ходе реакции выделился металл, окрашивающий пламя горелки в желтый цвет». Тут вы сразу должны догадаться: речь, скорее всего, про натрий.
Щелочные металлы по-разному окрашивают пламя. Литий окрашивает в алый цвет, натрий — в желтый, калий — в фиолетовый, рубидий — синевато-красный, цезий — синий.

Оксиды щелочных металлов
Имеют общую формулу R2O, например: Na2O, K2O.
Получение
- Получение оксидов щелочных металлов возможно в ходе реакции с кислородом. Для лития все совсем несложно:
- Li + O2 → Li2O (оксид лития)
- В подобных реакциях у натрия и калия получается соответственно пероксид и супероксид, что приводит к затруднениям. Как из пероксида, так и из супероксида, при желании можно получить оксид:
- Na2O2 + Na → Na2O
- KO2 + K → K2O
Химические свойства
По свойствам эти оксиды являются основными. Они хорошо реагируют c водой, кислотными оксидами и кислотами:
Li2O + H2O → LiOH (осн. оксид + вода = основание — реакция идет, только если основание растворимо)
K2O + CO2 → K2CO3 (осн. оксид + кисл. оксид = соль)
Na2O + SO2 → Na2SO3 (обратите внимание — мы сохраняем СО серы +4)
Li2O + HCl → LiCl + H2O
Гидроксиды щелочных металлов
Относятся к щелочам — растворимым основаниям. Наиболее известные представители: NaOH — едкий натр, KOH — едкое кали.
Получение
- Гидроксиды щелочных металлов получаются в ходе электролиза водных растворов их солей, в реакциях обмена, в реакции щелочных металлов и их оксидов с водой:
- KCl + H2O → (электролиз!) KOH + H2 + Cl2 (на катоде выделяется водород, на аноде — хлор)
- Li2CO3 + Ca(OH)2 → CaCO3↓ + LiOH
- K + H2O → KOH + H2↑
- Rb2O + H2O → RbOH

Химические свойства
Проявляют основные свойства. Хорошо реагируют с кислотами, кислотными оксидами и солями, если в ходе реакции выпадает осадок, выделяется газ или образуется слабый электролит (вода).
- LiOH + H2SO4 → LiHSO4 + H2O (соотношение 1:1, кислота в избытке — получается кислая соль)
- 2LiOH + H2SO4 → Li2SO4 + 2H2O (соотношение 2:1, основание в избытке — получается средняя соль)
- KOH + SO2 → KHSO3 (соотношение 1:1 — получается кислая соль)
- 2KOH + SO2 → K2SO3 + H2O (соотношение 2:1 — получается средняя соль)
- NaOH + MgBr2 → NaBr + Mg(OH)2↓
- С амфотерными гидроксидами реакции протекают с образованием комплексных солей (в водном растворе) или с образованием окиселов — смешанных оксидов (при высоких температурах — прокаливании).
- NaOH + Al(OH)3 → Na[Al(OH)4] (в водном растворе образуются комплексные соли)
- NaOH + Al(OH)3 → NaAlO2 + H2O (при прокаливании образуется окисел — смесь двух оксидов: Al2O3 и Na2O, вода испаряется)
- Реакции щелочей с галогенами заслуживают особого внимания. Без нагревания они идут по одной схеме, а при нагревании эта схема меняется:
- NaOH + Cl2 → NaClO + NaCl + H2O (без нагревания хлор переходит в СО +1 и -1)
- NaOH + Cl2 → NaClO3 + NaCl + H2O (с нагреванием хлор переходит в СО +5 и -1)
- В реакциях щелочей с йодом образуется исключительно иодат, так как гипоиодит неустойчив даже при комнатной температуре, не говоря о нагревании. С серой реакция протекает схожим образом:
- NaOH + I2 → NaIO3 + NaI + H2O (с нагреванием)

- NaOH + S → Na2S + Na2SO3 + H2O (сера переходит в СО -2 и +4)
- Уникальным является также взаимодействие щелочей с кислотным оксидом NO2, который соответствует сразу двум кислотам — и азотной, и азотистой.
- LiOH + NO2 → LiNO2 + LiNO3 + H2O
Щелочные металлы – список и особенности взрывоопасных элементов
Продукты на основе этих металлов стали неотъемлемой частью жизни человека. Это и поваренная соль, и пищевая сода, и марганцовка.
Щелочные металлы ценят преподаватели химии: опыты с такими субстанциями способны увлечь химией любого.

Что представляют собой
Щелочные металлы – это элементы, занимающие почти весь первый столбец таблицы Менделеева. Кроме них, там расположился только водород.
К щелочным металлам относятся:
- литий;

- натрий;
 Свежесрезанный натрий
Свежесрезанный натрий - калий.
 Калий под слоем ТГФ
Калий под слоем ТГФ
Плюс:
- рубидий;

- цезий;

- франций.
Названы щелочными вследствие растворимости соединений водой.
Результат воздействия воды – гидроксиды. Они также растворимы, потому называются щелочами.
Древние славяне под выщелачиванием подразумевали растворение вещества водой.
Особенности структуры
У атома щелочного металла на внешнем слое один электрон. Степень окисления у металлов группы одна – +1.
Этим обусловлена сходность характеристик элементов щелочного сегмента.
Как представлены в природе
Щелочная группа представлена на планете по-разному:
- Самые распространенные элементы – натрий с калием.
- Литий, рубидий, цезий причислены к редким и рассеянным.
- Самым редкостным щелочным металлом является франций. По редкости этот радиогенный материал – второй на планете: суммарный объем в земной коре не превышает трети килограмма.
Из-за повышенной активности щелочные металлы в природе не встречаются. Лишь как соединения с прочими элементами.
Поставщики натрия с калием:
- Хлорид натрия – обычная каменная соль. Ее содержит вода морей и океанов.
- Глауберова соль.
- Соли калия находят в почвах.
Металлы входят в структуру ряда минералов. Это в основном алюмосиликаты: альбит – натриевый; ортоклаз (полевой шпат) – калийный.
Технология получения
Щелочные металлы получают несколькими способами:
- Электролиз. Материалом служат расплавы их хлоридов (или других галогенидов) либо гидроксиды. Растворы солей как исходник не годятся: конечным продуктом становятся водород и щелочи.
- Восстановление из бромида, хромата либо хлорида. Восстановителями выступают магний, цирконий, кальций, кремний. Процесс получения протекает в вакууме при температурах под 1000°С, образующийся металл периодически отгоняется.
Натрий восстанавливают из карбоната. Ингредиенты: уголь, известняк, температура 990°C. Для промышленных нужд синтезируют гидроксид из крепкого раствора поваренной соли.
Физико-химические свойства
Металлы щелочного сегмента наделены общими и оригинальными физическими и химическими свойствами.
Физические характеристики
Элементы группы наделены общими физическими свойствами:
- Мягкость. Любой (кроме лития) легко режется.
- Легкость. Плотность лития, натрия, калия меньше единицы. Они не тонут в воде.
- Серебристо-белый цвет. Только цезий наделен желтоватостью на серебристом фоне.
- Металлический отблеск.
Оксиды группы обладают типичными для этого вида соединений свойствами: реагируют с водой, кислотами, их оксидами. У каждого свой цвет. Устойчивость и цветность оксидов щелочных элементов увязана с габаритами атома.
Химические параметры
Главная особенность щелочной группы – чрезмерная химическая активность:
- Разогретые щелочные элементы реагируют с азотом, кремнием, галогенами, серой, фосфором, углеродом. Результат – соответствующие продукты (галогениды, сульфиды, карбиды, силициды, др.)
- При нагревании с прочими металлами образуются полуметаллы (интерметаллиды).
- На воздухе сгорают.
При взаимодействии металлов с водой выделяется водород, возможен взрыв.
Окраска пламени щелочными металлами и их соединениями:
| Li | Карминно-красный |
| Na | Жёлтый |
| K | Фиолетовый |
| Rb | Буро-красный |
| Cs | Фиолетово-красный |
Элементы, не тонущие в воде, горят и взрываются в ней:
- Калий создает пламя фиалковой гаммы, взрыв самый сильный.
- У натрия пламя желтое, взрыв послабее.
- Литий просто горит.
Взрывом заканчивается реакция с кислотами.
Все щелочные металлы бурно реагируют на воду. Процесс сопровождается водородным фонтаном, затем пламенем, взрывом.
Мирно протекают реакции со спиртами, карбоновыми кислотами, другими органическими субстанциями.
| Li2O | Белый |
| Na2O | Белый |
| K2O | Желтоватый |
| Rb2O | Жёлтый |
| Cs2O | Оранжевый |
| Na2O2 | Светло- жёлтый |
| KO2 | Оранжевый |
| RbO2 | Тёмно- коричневый |
| CsO2 | Жёлтый |
Вид щелочного металла «выдает» окрас пламени:
- Калий – фиолетовый.
- Цезий – красновато-фиалковый.
- Рубидий – цвет чайной розы.
- Литий – пурпурный.
Натрий либо его соединения делают пламя охристо-желтым.
Где используются
Промышленники оценили утилитарные свойства щелочных металлов. Они легкоплавки, пластичны (раскатываются до фольги), хорошо куются, пропускают тепло и электричество.
Самый известный продукт – поваренная соль (формула NaCl). Ее дополняют кальцинированная сода с едким натром (карбонат, гидроксид натрия), марганцовка (перманганат калия).
Их производят миллионами тонн:
- Каустическая сода (в просторечии едкий натр) – ингредиент при варке мыла, производстве алюминия, искусственных волокон.
- Кальцинированная сода – сырье для получения мыла, стекла, заменитель хозяйственного мыла.
Каустическая и кальцинированная сода, глауберова соль несъедобны. Только столовая сода и поваренная соль.
- Пищевая сода нашла применение как домашнее средство для устранения ангины, обязательный ингредиент выпечки, натуральный консервант.
Альбит и ортоклаз классифицируются как коллекционный и декоративно-поделочный материал.
Техника безопасности
Химически активные элементы требуют осторожности.
При самостоятельной работе соблюдают следующие правила:
- Перед началом работы надеть защитные перчатки и очки (маску).
- Кусочек отрезают скальпелем от массива, не вытаскивая из керосина.
- В емкости, заполненной аргоном, счищают с поверхности остатки оксидов.
- Очищенный образец помещают в сосуд, где будет проводиться опыт.
- Остатки, не затронутые реакцией, засыпают сухим спиртом.
Аналогичный порядок работы со щелочноземельными элементами. Они так же химически активны.
Щелочные и щелочноземельные металлы хранят притопленными в керосине: контакт с водой, воздухом заканчивается взрывом.
Проверить совместимость мужчины и женщины по Знаку Зодиака
Тесты по химии на тему "Щелочные металлы и их соединения"(9 класс)
- Тесты по химии для 9 класса
- Тема «Щелочные металлы и их соединения».
- Вариант 1
- Часть А (задание с
выбором ответа) - А1. Элементы
основной подгруппы 1 группы имеют названия - 1.
Щелочные металлы - 2.
Щелочноземельные металлы - 3.
Галогены
4.
Переходные металлы.
А 2. Укажите верное
суждение: А) Щелочные металлы – это серебристо-белые мягкие вещества; Б)
Щелочные металлы — это легкие и легкоплавкие металлы.
- 1.
верно только А - 2.
Верно только Б - 3.
Верны оба суждения
4.
Оба суждения неверны.
- А 3.Самый активный
щелочной металл - 1.
Na - 2.
K - 3.
Li - 4.
Cs - А4. Наиболее
легкоплавкий металл - 1.
Rb - 2.
Cs - 3.
Li - 4.
Na
А5. Металл,
образующий оксид при взаимодействии с кислородом.
- 1.
Li - 2.
K - 3.
Na - 4.
Rb - А 6. Определите
вещество Х в схеме получения оксида натрия: -
Na + X =Na2O - 1.
O2 - 2.
NaH - 3.
NaOH - 4.
Na2O2 - А7.Раствор
гидроксида натрия окрашивает метиоранж в следующий цвет - 1.
желтый - 2.
красный - 3.
синий - 4.
оранжевый - Часть В (задание с
кратким ответом) - В1 Расположите
щелочные металлы в порядке усиления восстановительной способности :1)Rb 2)Cs 3) Li 4)K 5)Na/ Ответ дайте в виде последовательности цифр.
В2. Установите
соответствие между щелочным металлом и соединением, полученным при
взаимодействии этого металла с кислородом. Ответ дайте в виде
последовательности цифр, соответствующих буквам по алфавиту.
- ЩЕЛОЧНОЙ МЕТАЛЛ СОЕДИНЕНИЕ
С КИСЛОРОДОМ - А)
К
1)оксид - Б) Na
2)пероксид - В) Li
- Г)Cs
Б3. Расположите
щелочные металлы в порядке уменьшения скорости взаимодействия с водой 1)К,
2)Na 3)Сs 4)Rb 5)Li.
Ответ дайте в виде
последовательности цифр
В4. Установите
соответствие между формулой соединения и его названием. Ответ дайте в виде
последовательности цифр, соответствующих буквам по алфавиту.
- ФОРМУЛА
СОЕДИНЕНИЯ НАЗВАНИЕ СОЕДИНЕНИЯ: - А) NaOH
1.Поташ - Б) Na2CO3*10 H2O
2. Поваренная соль - В) KOH
3.Каустик - Г) K2CO3
4. Кристаллическая сода - Д) NaCL
5. Едкое кали
В5. Установите
соответствие между свойствами ионов металла и формулой этого соединения. Ответ
дайте в виде последовательности цифр, соответствующим буквам по алфавите.
- СВОЙСТВА
ИОНА ФОРМУЛА ИОНА - А) главный
внеклеточный ион, 1) Na+ - содержится в крови и
лимфе - Б) Основной
внутриклеточный ион 2) К+ - В) Окрашивает пламя в
желтый цвет - Г)Поддерживает работу
сердечной мышцы - Д) окрашивает пламя в
розово-фиолетовый цвет - Тесты по химии для 9 класса
- Тема «Щелочные металлы и их соединения».
- Вариант 2
- Часть
А (задание с выбором ответа) - А1. Элементы
основной подгруппы 1 группы имеют названия - 1.
Галогены - 2.
Щелочноземельные металлы - 3.
Щелочные металлы
4.
Переходные металлы.
А 2. Укажите
верное суждение: А) Щелочные металлы с характерным блеском на свежесрезанной
поверхности; Б) Щелочные металлы – активно взаимодействуют со всеми
неметаллами.
- 1.
верно только А - 2.
Верно только Б - 3.
Верны оба суждения
4.
Оба суждения неверны.
- А 3.Самый активный
щелочной металл - 1.
K - 2.
Na - 3.
Fr - 4.
Cs - А4. Обладает
наибольшей плотностью - 1.
Rb - 2.
Cs - 3.
Li - 4.
Na
А5. Металл,
образующий пероксид при взаимодействии с кислородом.
- 1.
Li - 2.
K - 3.
Na - 4.
Rb - А 6. Определите
вещество Х в схеме получения пероксида натрия: - Na + X =Na2O2
- 1.
O2 - 2.
NaH - 3.
NaOH - 4.
Na2O2 - А7. Раствор
гидроксида натрия окрашивает фенолфталеиновый в следующий цвет - 1.
желтый - 2.
красный - 3.
синий - 4.
малиновый - Часть В (задание с
кратким ответом)
В1 Расположите
щелочные металлы в порядке ослабления металлических свойств : 1)Rb 2)Cs 3) Li 4)K 5)Na. Ответ дайте в виде последовательности цифр.
В2. Установите
соответствие между щелочным металлом и соединением, полученным при
взаимодействии этого металла с кислородом. Ответ дайте в виде
последовательности цифр, соответствующих буквам по алфавиту.
- ЩЕЛОЧНОЙ
МЕТАЛЛ СОЕДИНЕНИЕ С КИСЛОРОДОМ - А)
К
1)оксид - Б) Na
2)пероксид - В) Li
- Г)Cs
Б3. Расположите
щелочные металлы в порядке увеличения скорости взаимодействия с водой
1)К, 2)Na 3)Сs 4)Rb
5)Li.
Ответ дайте в виде
последовательности цифр
В4. Установите
соответствие между формулой соединения и его названием. Ответ дайте в виде
последовательности цифр, соответствующих буквам по алфавиту.
- ФОРМУЛА
СОЕДИНЕНИЯ НАЗВАНИЕ СОЕДИНЕНИЯ: - А) NaOH
1.Глауберовая соль - Б) Na2CO3*10 H2O
2. Поваренная соль - В) KOH
3.Каустик - Г) K2SO4*10 H2O 4.
Кристаллическая сода - Д) NaCI
5. Едкое кали - В5 Установите
соответствие между формулой соли и ее применением. Ответ дайте в виде последовательности
цифр, соответствующим буквам по алфавиту - ФОРМУЛА
СОЕДИНЕНИЯ ПРИМЕНЕНИЕ - А) K2CO3
1)для
производства мыла и волокон - Б) NaOH
2)для приготовления тугоплавкого стекла - В) Na2CO3*10 H2O 3)для производства
стекла, бумаги, мыла - Г) NaCL
4)слабительное средство - Д) K2SO4*10 H2O
5)приправа к пище - Ответы к тестам
«Щелочные металлы и их соединения».9 класс - Вариант 1.
Вариант 2 - А1
-1 А1-3 - А2-4
А2 –4 - А3-4
А3- 3 - А4-2
А4.-2 - А5-1
А5-3 - А6-4
А6.-1 - А7-1
А7.-4 - В1- 3, 5, 4, 1, 2 В1.-2,1,4,5,3
В2. А-2, Б-2, В-1,
Г-2 В2.-А-2, Б-2, В-1,Г-2
В3. – 4, 3, 1, 2,
5 В3.- 5, 2, 1, 4, 3
В4. –А-3, Б-4,
В-5, Г-1, Д-2 В4.-А-1,Б-4, В-5, Г-1, Д-2
В5. А-1, Б-2, В-1, Г-2, Д-2
В5.В-5 А-2, Б-1, В-3, Г-5, Д -4 (вариант -2)
Щелочные металлы в химии
К щелочным металлам относятся металлы IA группы Периодической системы Д.И. Менделеева – литий (Li), натрий (Na), калий (K), рубидий (Rb), цезий (Cs) и франций (Fr).
На внешнем энергетическом уровне щелочных металлов находится один валентный электрон. Электронная конфигурация внешнего энергетического уровня щелочных металлов – ns1.
В своих соединениях они проявляют единственную степень окисления равную +1. В ОВР являются восстановителями, т.е. отдают электрон.
Физические свойства щелочных металлов
- Все щелочные металлы легкие (обладают небольшой плотностью), очень мягкие (за исключением Li легко режутся ножом и могут быть раскатаны в фольгу), имеют низкие температуры кипения и плавления (с ростом заряда ядра атома щелочного металла происходит понижение температуры плавления).
- В свободном состоянии Li, Na, K и Rb – серебристо-белые металлы, Cs – металл золотисто-желтого цвета.
- Щелочные металлы хранят в запаянных ампулах под слоем керосина или вазелинового масла, поскольку они обладают высокой химической активностью.
- Щелочные металлы обладают высокой тепло- и электропроводностью, что обусловлено наличием металлической связи и объемоцентрированной кристаллической решетки
Получение щелочных металлов
- Все щелочные металлы возможно получить электролизом расплава их солей, однако на практике таким способом получают только Li и Na, что связано с высокой химической активностью K, Rb, Cs:
- 2LiCl = 2Li + Cl2↑
- 2NaCl = 2Na + Cl2↑
Любой щелочной металл можно получить восстановлением соответствующего галогенида (хлорида или бромида), применяя в качестве восстановителей Ca, Mg или Si. Реакции проводят при нагревании (600 – 900С) и под вакуумом. Уравнение получения щелочных металлов таким способом в общем виде:
- 2MeCl + Ca = 2Mе↑ + CaCl2,
- где Ме – металл.
- Известен способ получения лития из его оксида. Реакцию проводят при нагревании до 300°С и под вакуумом:
- 2Li2O + Si + 2CaO = 4Li + Ca2SiO4
- Получение калия возможно по реакции между расплавленным гидроксидом калия и жидким натрием. Реакцию проводят при нагревании до 440°С:
- KOH + Na = K + NaOH
Химические свойства щелочных металлов
Все щелочные металлы активно взаимодействуют с водой образуя гидроксиды. Из-за высокой химической активности щелочных металлов протекание реакции взаимодействия с водой может сопровождаться взрывом. Наиболее спокойно с водой реагирует литий. Уравнение реакции в общем виде:
- 2Me + H2O = 2MeOH + H2↑
- где Ме – металл.
- Щелочные металлы взаимодействуют с кислородом воздуха образую ряд различных соединений – оксиды (Li), пероксиды (Na), надпероксиды (K, Rb, Cs):
- 4Li + O2 = 2Li2O
- 2Na + O2 =Na2O2
- K + O2 = KO2
Все щелочные металлы при нагревании реагируют с неметаллами (галогенами, азотом, серой, фосфором, водородом и др.). Например:
- 2Na + Cl2 =2NaCl
- 6Li + N2 = 2Li3N
- 2Li +2C = Li2C2
- 2K + S = K2S
- 2Na + H2 = 2NaH
- Щелочные металлы способны взаимодействовать со сложными веществами (растворы кислот, аммиак, соли). Так, при взаимодействии щелочных металлов с аммиаком происходит образование амидов:
- 2Li + 2NH3 = 2LiNH2 + H2↑
- Взаимодействие щелочных металлов с солями происходит по следующему принципу –вытесняют менее активные металлы (см. ряд активности металлов) из их солей:
- 3Na + AlCl3 = 3NaCl + Al
- Взаимодействие щелочных металлов с кислотами неоднозначно, поскольку при протекании таких реакций металл первоначально будет реагировать с водой раствора кислоты, а образующаяся в результате этого взаимодействия щелочь будет реагировать с кислотой.
- Щелочные металлы реагируют с органическими веществами, такими, как спирты, фенолы, карбоновые кислоты:
- 2Na + 2C2H5OH = 2C2H5ONa + H2↑
- 2K + 2C6H5OH = 2C6H5OK + H2↑
- 2Na + 2CH3COOH = 2CH3COONa + H2↑
Качественные реакции
Качественной реакцией на щелочные металлы является окрашивание пламени их катионами: Li+ окрашивает пламя в красный цвет, Na+ — в желтый, а K+, Rb+, Cs+ — в фиолетовый.
Примеры решения задач
| Понравился сайт? Расскажи друзьям! |
Тема: Соединения щелочных металлов Тест по теме: Щелочные металлы. Ответы: 1- г 2
1 Тема: Соединения щелочных металлов Тест по теме: Щелочные металлы. Ответы: 1- г 2 — в 3 — б 4 — в 5 — а 6 — г 7 — б 8 — а 9 — б 10 — в. Шкала оценивания: нет ошибок – «5», 1,2 ошибки – «4», 3,4 ошибки – «3», более – «2» Д/з § 11, упр.
1 (б) стр К щелочным металлам не относится: а) рубидий; в) калий; б) цезий; г) медь. 2.Электронная формула 1s 2 2s 2 2p 6 3s 2 3p 6 4s 1 соответствует элементу: а) литию; в) калию; б) натрию; г) меди. 3.
Радиус атома у элементов I группы главной подгруппы с увеличением заряда ядра: а) изменяется периодически; в) не изменяется; б) увеличивается; г) уменьшается. 4.Щелочные металлы проявляют очень сильные: а) окислительные свойства; в) восстановительные свойства; б) амфотерные свойства; г) нейтральные свойства. 5.
Во всех своих соединениях щелочные металлы проявляют степень окисления: а) +1; в) +2; б) +3; г) К физическим свойствам щелочных металлов не относится: а) серебристо-белые ; в) хорошие электропроводники; б) мягкие и легкие; г) тугоплавкие. 7.
При взаимодействии элементов I группы главной подгруппы с водой образуется: а) кислота; в) оксид и выделяется водород; б) щелочь и выделяется водород; г) соль. 8. При взаимодействии кислорода со щелочными металлами оксид образуется только с: а) литием; в) калием; б) натрием; г) рубидием. 9.
Щелочные металлы не взаимодействуют с: а) неметаллами; в) водой; б) растворами кислот; г) концентрированными кислотами. 10. Натрий и калий хранят в керосине или в минеральном масле, потому что они: а) имеют резкий запах; в) легко окисляются на воздухе; б) очень легкие; г) сильные окислители.
2 1. Оксиды щелочных металлов а) физические свойства: б) химические свойства:
3 2. Гидроксиды щелочных металлов а) физические свойства: б) химические свойства: Инструкция 1.Налейте в чистую пробирку гидроксид натрия, добавьте несколько капель фенолфталеина. Что наблюдаете? 2.Добавьте в эту же пробирку раствор соляной кислоты. Что наблюдаете? Запишите уравнение реакции. 3.
Налейте в чистую пробирку гидроксид натрия и добавьте раствор сульфата меди. Что наблюдаете? Запишите уравнение реакции. 4.В пробирку с гидроксидом цинка осторожно добавьте гидроксид натрия. Что наблюдаете? Запишите уравнение реакции. Сделайте вывод о химических свойствах гидроксидов щелочных металлов.
4 2. Гидроксиды щелочных металлов в) применение: Гидроксид натрия – NaOH – едкий натр, каустическая сода, каустик. Гидроксид калия – КОН – едкое кали. NaOH и КОН – едкие щелочи, разъедают ткани и бумагу
5 3. Соли щелочных металлов Формула солиназваниеприменение пищевая сода поташ поваренная соль глауберова соль кристаллическая сода
6 4. Значение соединений щелочных металлов в жизнедеятельности организмов Ионы натрия и калия играют большую биологическую роль: Na + — главный внеклеточный ион, содержится в крови и лимфе, а К + — основной внутриклеточный ион.
Соотношение концентрации этих ионов регулирует давление крови в живом организме и обеспечивает перемещение растворов солей из корней в листья растений. Ионы калия — поддерживают работу сердечной мышцы, помогают при ревматизме, улучшают работу кишечника.
Соединения калия – устраняют отеки.
7 Взрослый человек должен в сутки потреблять с пищей 3,5г ионов калия. Задача. В 100г кураги содержится 2,034г калия. Сколько граммов кураги нужно съесть, чтобы получить суточную норму калия? Итог урока: 1.Какие физические и химические свойства характерны для оксидов, гидроксидов щелочных металлов. 2.Где применяются гидроксиды и соли щелочных металлов Спасибо за работу.
Урок 6: Щелочные металлы
- План урока:
- Представители щелочных металлов
- Строение атомов щелочных металлов
- Изменение химических свойств щелочных металлов
- Внешний вид и физические свойства щелочных металлов
- Нахождение в природе
- Качественные реакции
- Химические свойства щелочных металлов
- Получение щелочных металлов
- Применение соединений щелочных металлов
Представители щелочных металлов
Щелочные металлы – это группа высокоактивных металлов. Название происходит от продукта взаимодействия этих веществ с водой, в результате которой образуется щелочь (сложное химическое соединение). Найти в природе такие металлы, сделать из них изделие или просто хранить в виде слитка невозможно. Эти металлы сразу окисляются кислородом воздуха.
К щелочным металлам относятся: литий, натрий, калий, рубидий, цезий, франций.
Строение атомов щелочных металлов
В таблице Менделеева щелочные металлы расположены в первой группе. Такое положение не случайно, а отражает строение атома и химические свойства.
Химические свойства элементов напрямую зависят от строения атома. Атом любого элемента состоят из ядра, имеющего положительный заряд и электронов, образующих энергетически облака вокруг ядра.
Ядро и электроны притягиваются за счет электростатического напряжения. Соответственно, чем меньше у электрона силы сопротивления, тем ближе он будет к ядру. Электроны с большей энергией способны отдаляться на периферию атома.
По мере смены периодом, количество электронов и энергетических уровней будет увеличиваться. Общий параметр атомов всех щелочных металлов является 1 электрон на внешнем энергетическом уровне.
Изменение химических свойств щелочных металлов
По мере продвижения от первого до последнего периода, в атомах щелочных металлов происходит увеличение количества атомов и электронных облаков. Чем дальше атом оказался от ядра, тем меньше притяжение между ними.
За счет этого, отдаленный (последний) электрон проще отсоединить от атома. Легкость отщепления электронов определяет реакционную способность.
Отщепление электрона приводит к окислению собственного атома и восстановлению окислителя.
Таким образом, восстановительные свойства щелочных металлов увеличиваются сверху вниз в группе. Самый активный металл – цезий.
Внешний вид и физические свойства щелочных металлов
Щелочные металлы обладают всеми характерными свойствами: серебристый цвет (исключение: цезий – золотистого цвета) металлический блеск, электро- и теплопроводность, ковкость, пластичность.
Особенным качеством является мягкость и легкость за счет низкой плотности вещества. Эти металлы можно резать ножом, разминать руками (в перчатках) и ломать.
Нахождение в природе щелочных металлов
Из-за высокой реакционной активности, щелочные металлы не встречаются в природе в виде самородков или чистых залежей. Обнаружить их можно в составе солей. Многие природные минералы содержат ион щелочного металла в своей структуре.
Таблица. Минералы, в состав которых входят ионы щелочных металлов
Как видно из таблицы, чем выше активность элемента, тем ниже его встречаемость в природе. Элемент последнего периода первой группы – франций – вообще не встречается в природе даже в составе минералов. Этот элемент является радиоактивным и является промежуточным продуктом распада Урана-235. Его общее содержание в земной коре оценивается в 380 граммов.
Обнаружение ионов металлов в соединениях
Самый простой способ определения иона металла – окраска пламени. Для соли каждого металла характерен свой цвет:
- Литий – красный,
- Калий – фиолетовый,
- Натрий – желтый,
- Рубидий – розовый,
- Цезий – синий.
Соли франция такой проверке не подвергаются.
Для такой проверки важно, чтобы в пламени не было других примесей, меняющий цвет, иначе проверка будет недостоверна.
Качественные реакции
Обнаружение катионов лития
Обнаружить ионы металлов в соли можно с помощью качественной реакции.
- Для обнаружения катионов лития используют фосфорную кислоту. Получившийся белый фосфат лития растворим только в концентрированной азотной кислоте и солях аммония:
- 3Li+ + PO43- = Li 3РО 4↓
- В растворимых солях литий можно обнаружить с помощью фторида аммония. При реакции образуется белый нерастворимый осадок фторида лития:
- Li+ + F- = LiF↓
Обнаружение катиона натрия
Ионы натрия можно обнаружить реакцией с комплексной солью гексагидроксостибатом (V). При низких температурах и в нейтральной среде образуется мелкокристаллическая белая соль натрия:
Na+ + [Sb (OH)6]– = Na[Sb(OH)6] ↓
Эту реакцию проводят на предметном стекле. За образованием и формой кристаллов наблюдают под микроскопом или бинокуляром.
Обнаружение катиона калия
В кислой и нейтральной среде ионы калия образуют двойную комплексную соль с гексанитрокабальтатом натрия (III). Эта соль нерастворима в воде и имеет желтый цвет:
2K+ + Na3[Co(NO2)6] = NaK2[Co(NO2)6] ↓+ 2Na+
Особенность реакции в ее медленном течении. Реакционную смесь оставляют на несколько часов. Для ускорения реакции можно тереть стеклянной палочкой по стенке пробирки. Это приводит к формированию статического электричества, что усиливает притяжение ионов друг к другу.
Еще одним способом обнаружения катионов калия служит реакция с гидротартратом натрия NaHC4H4O6. В этом случае образуется соль белого цвета. Реакцию можно ускорить потиранием стеклянной палочной о поверхность пробирки:
K+ + NaHC4H406= KHC4H4O6↓ + Na+.
Обнаружение катионов рубидия, цезия
Катионы рубидия и цезия – высокоактивные ионы, поэтому не обнаруживаются качественными реакциями. Все соединения прозрачные и хорошо растворимы в воде. Основными способами их обнаружения в составе соли служит осаждение органическими ароматическими растворами. Способа разделения цезия и рубидия из смеси в настоящее время нет.
Обнаружение ионов франция
Как радиоактивный металл, франций не входит в состав обычных солей. Его обнаружение проводится методом спектрометрии и радиационных приборов.
Химические свойства щелочных металлов
Все металлы являются восстановителями, поэтому они вступают в реакцию с различными окислителями. К таким относятся простые неметаллы и сложные соединения, обладающие окислительными свойствами.
Реакция с простыми неметаллами
Щелочные металлы активно вступают в реакции с галогенами. При этом образуется соответствующий галогенид. С серой, фосфором и водородом с образованием сульфидов, гидридов, фосфидов реагируют только при нагревании:
- 2Na + Cl2→ 2NaCl
- 2К + S К2S
- 2Rb + H2 2RbH
- 3Na + P Na3P
- В реакции с кислородом щелочные металлы образуют пероксиды (кроме лития), повторное окисление которых приводит к образованию оксидов:
- 2Na + О2 = Na2О2
- 2 Na2О2 + О2 = 2Na2О
- Специальных условий для окисления металлов кислородом не требуется, поэтому щелочные металлы хранят под слоем парафина, вазелина или масла без доступа кислорода.
Взаимодействие с водой
Реакция щелочных металлов с водой происходит с выделением большого количества тепла. Выделяющийся в ходе реакции водород может воспламеняться, что в некоторых случаях приводит к взрыву.
Взаимодействие с сильными кислотами
- В реакциях щелочных металлов с кислотами образуются соответствующие соли. Особенных проявлений свойств щелочных металлов здесь нет:
- 8K + 10HNO3 (конц) → 8KNO3 + N2O +5 H2O
- 8Na + 5H2SO4 (конц) → 4Na2SO4 + H2S↑ + 4H2O
Специфические химические свойства лития
- В некоторых реакциях литий проявляет отличные от остальных щелочных металлов свойства. Например, это единственный металл, реагирующий с азотом без нагревания:
- 6Li + N2 = 2Li3N
- Нитрид лития подвергается необратимому гидролизу.
- Li3N + 3H2O → 3LiOH + NH3↑
- В реакции с лития с кислородом образуется оксид лития:
- 4Li + О2 = 2Li2О
Получение щелочных металлов
Получить щелочные металлы в чистом виде можно только электролизом расплавов их солей:
- NaCl Na+ + Cl–;
- катод (–) (Na+): Na+ + е = Na0,
- анод (–) (Cl–): Cl– – е = Cl0, 2Cl0 = Cl2;
- 2NaCl = 2Na + Cl2 .
- Если использовать раствор соли, катионы металла будут сразу вступать в реакцию с образованием щелочей:
- NaCl Na+ + Cl–,
- H2O Н+ + ОН–;
- катод (–) (Na+; Н+): H+ + е = H0, 2H0 = H2
- (2H2O + 2е = H2 + 2OH–),
- анод (+) (Cl–; OН–): Cl– – е = Cl0, 2Cl0 = Cl2;
- 2NaCl + 2H2O = 2NaOH + Cl2 + H2 .
Применение соединений щелочных металлов
Основные области применения данных солей – медицина, кулинария, строительство, химическая промышленность.
Наиболее используемый щелочной металл – натрий. Он служит катализатором синтеза металлов, служит теплоносителем в атомных реакторах.
Хлорид натрия – соединение, используемое в каждом доме. Это безопасная соль, используемая в кулинарии. Так же, хлорид натрия применяется в медицине для приготовления физиологических растворов.
Литий и его щелочи служат основой изготовления щелочных батареек. Длительное время это был единственный способ создания портативных энергоносителей.
Калий и натрий используются для изготовления мыла в качестве омыляющего компонента.
Соли калия используются в сельском хозяйстве в качестве удобрения.
Калий, рубидий и натрий используются в атомной промышленности и атомной энергетике. Эти металлы служат катализаторами многих реакций.
- Литий добавляется во многие сплавы для улучшения металлических свойств.
- Соединения лития, рубидия и цезия используют при изготовлении цветных стекол.
- Франций пока не имеет практического применения в связи с высокой радиоактивностью.






