- Список радиоактивных металлов
- Самый радиоактивный металл
- Что такое радиация
- Изучение радиоактивных элементов
- Добыча и синтез
- Практическое применение
- Радиоактивные предметы среди нас
- Светомасса постоянного действия
- Минералы
- Торий кроется в деталях
- Специально созданные источники радиации
- Радиоактивные элементы
- Как был открыт
- Свойства и применение
- Запасы и месторождения
- Биологическая роль
- Радиоактивные металлы: список
- Свойства и характеристики
- Уран
- Радий
- Плутоний
- Биологическое воздействие
- Теги
- Радиоактивные металлы
- Радиоактивные металлы
Радиоактивные металлы — это металлы, которые самопроизвольно излучают поток элементарных частиц во внешнюю среду. Этот процесс называют альфа(α), бета(β), гамма(γ) излучением или просто радиоактивным излучением.
Все радиоактивные металлы со временем распадаются и превращаются в стабильные элементы (иногда проходя целую цепочку превращений). У разных элементов радиоактивный распад может длиться от нескольких миллисекунд до нескольких тысяч лет.
Рядом с названием радиоактивного элемента часто указывается массовое число его изотопа. Например, Технеций-91 или 91Tc. Разные изотопы одного и того же элемента как правило имеют общие физические свойства и различаются лишь длительностью радиоактивного распада.
Список радиоактивных металлов
| Технеций | Technetium | Tc-91 | 4.21 x 106 лет |
| Прометий | Promethium | Pm-145 | 17.4 года |
| Полоний | Polonium | Po-209 | 102 года |
| Астат | Astatine | At-210 | 8.1 часов |
| Франций | Francium | Fr-223 | 22 минут |
| Радий | Radium | Ra-226 | 1600 лет |
| Актиний | Actinium | Ac-227 | 21.77 лет |
| Торий | Thorium | Th-229 | 7.54 x 104 лет |
| Протактиний | Protactinium | Pa-231 | 3.28 x 104 лет |
| Уран | Uranium | U-236 | 2.34 x 107 лет |
| Нептуний | Neptunium | Np-237 | 2.14 x 106 лет |
| Плутоний | Plutonium | Pu-244 | 8.00 x 107 лет |
| Америций | Americium | Am-243 | 7370 лет |
| Кюрий | Curium | Cm-247 | 1.56 x 107 лет |
| Беркелий | Berkelium | Bk-247 | 1380 лет |
| Калифорний | Californium | Cf-251 | 898 лет |
| Эйнштейний | Einsteinium | Es-252 | 471.7 дней |
| Фермий | Fermium | Fm-257 | 100.5 дней |
| Менделевий | Mendelevium | Md-258 | 51.5 дней |
| Нобелий | Nobelium | No-259 | 58 минут |
| Лоуренсий | Lawrencium | Lr-262 | 4 часа |
| Резенфордий | Rutherfordium | Rf-265 | 13 часов |
| Дубний | Dubnium | Db-268 | 32 часа |
| Сиборгий | Seaborgium | Sg-271 | 2.4 минуты |
| Борий | Bohrium | Bh-267 | 17 секунд |
| Ганий | Hassium | Hs-269 | 9.7 секунд |
| Мейтнерий | Meitnerium | Mt-276 | 0.72 секунды |
| Дармштадий | Darmstadtium | Ds-281 | 11.1 секунды |
| Рентгений | Roentgenium | Rg-281 | 26 секунд |
| Коперниций | Copernicium | Cn-285 | 29 секунд |
| Унунтрий | Ununtrium | Uut-284 | 0.48 секунд |
| Флеровий | Flerovium | Fl-289 | 2.65 секунд |
| Унунпентий | Ununpentium | Uup-289 | 87 миллисекунд |
| Ливерморий | Livermorium | Lv-293 | 61 миллисекунда |
Радиоактивные элементы делятся на естественные (существующие в природе) и искусственные (получаемые в результате лабораторного синтеза). Естественных радиоактивных металлов не много — это полоний, радий, актиний, торий, протактиний и уран. Их наиболее стабильные изотопы встречаются в природе, чаще в виде руды. Все остальные металлы из списка созданы человеком.
Самый радиоактивный металл
Самый радиоактивный металл на данный момент — ливерморий. Его изотоп Ливерморий-293 распадается всего за 61 милисекунду. Впервые этот изотоп был получен в Дубне, в 2000 году.
Другой очень радиоактивный металл — унунпентий. Изотоп унунпентий-289 имеет чуть больший период распада (87 милисекунд).
Из более-менее стабильных, практически применяемых веществ, самым радиоактивным металлом считается полоний (изотоп полоний-210). Это серебристый белый радиоактивный металл. Хотя его период полураспада достигает 100 и более дней, даже один грамм этого вещества раскаляется до 500°C, а излучение может мгновенно убить человека.
Что такое радиация
Всем известно, что радиация очень опасна и лучше держаться подальше от радиоактивного излучения. С этим трудно поспорить, хотя в реальности мы постоянно подвержены влиянию радиации, где бы не находились. В земле залегает довольно большое количество радиоактивной руды, а из космоса на Землю постоянно прилетают заряженные частицы.
Кратко говоря, радиация это самопроизвольное испускание элементарных частиц. От атомов радиоактивного вещества отделяются протоны и нейтроны, «улетая» во внешнюю среду.
Ядро атома при этом постепенно изменяется, превращаясь в другой химический элемент. Когда все нестабильные частицы отделяются от ядра, атом перестает быть радиоактивным.
Например, торий-232 в конце своего радиоактивного распада превращается в стабильный свинец.
Наука выделяет 3 основных вида радиоактивного излучения
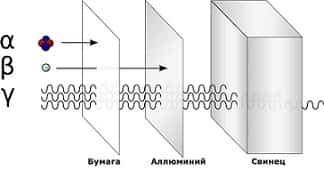
Альфа излучение(α) — поток альфа-частиц, положительно заряженных. Они сравнительно большие по размеру и плохо проходят даже через одежду или бумагу.
Бета излучение(β) — поток бета-частиц, негативно заряженных. Они довольно малы, легко проходят через одежду и проникают внутрь клеток кожи, что наносит большой вред здоровью. Но бета-частицы не проходят через плотные материалы, такие как алюминий.
Гамма излучение(γ) — это высокочастотная электромагнитная радиация. Гамма-лучи не имеют заряда, но содержат очень много энергии. Скопление гамма-частиц излучает яркое свечение. Гамма-частицы проходят даже через плотные материалы, что делает их очень опасными для живых существ. Их останавливают только самые плотные материалы, например, свинец.
Все эти виды излучения так или иначе присутствуют в любой точке планеты. Они не представляют опасности в малых дозах, но при высокой концентрации могут причинить очень серьезный ущерб.
Изучение радиоактивных элементов
Первооткрывателем радиоактивности является Вильгельм Рентген. В 1895 году этот Прусский физик впервые наблюдал радиоактивное излучение. На основе этого открытия был создан знаменитый медицинский прибор, названый в честь ученого.
В 1896 г изучение радиоактивности продолжил Анри Беккерель, он экспериментировал с солями урана.
В 1898 г Пьер Кюри в чистом виде получил первый радиоактивный металл — Радий. Кюри хоть и открыл первый радиоактивный элемент, однако, не успел толком его изучить.
И выдающиеся свойства радия привели к быстрой гибели ученого, который беспечно носил свое «детище» в нагрудном кармане.
Великое открытие отомстило своему первооткрывателю — Кюри умер в возрасте 47 лет от мощной дозы радиоактивного облучения.
В 1934 г был впервые синтезирован искусственный радиоактивный изотоп.
Сейчас изучением радиоактивности занимаются множество ученых и организаций.
Добыча и синтез
Даже естественные радиоактивные металлы не встречаются в природе в чистом виде. Их синтезируют из урановой руды. Процесс получения чистого металла чрезвычайно трудоемок. Состоит он из нескольких стадий:
- концентрирование (дробление и выделение осадка с ураном в воде);
- выщелачивание — то есть, перевод уранового осадка в раствор;
- выделение чистого урана из полученного раствора;
- перевод урана в твердое состояние.
В итоге, из тонны урановой руды можно получить всего несколько граммов урана.
Синтез искусственных радиоактивных элементов и их изотопов проходит в специальных лабораториях, в которых создаются условия для работы с подобными веществами.
Практическое применение
Чаще всего, радиоактивные металлы используют для выработки энергии.
Ядерные реакторы — это устройства, использующие уран для нагревания воды и создания потока пара, который вращает турбину, с помощью чего вырабатывается электричество.
Вообще, сфера применения радиоактивных элементов довольно широка. Они используются для изучения живых организмов, диагностирования и лечения болезней, выработки энергии и для мониторинга промышленных процессов. Радиоактивные металлы являются основой для создания ядерного оружия — самого разрушительного оружия на планете.
Радиоактивные предметы среди нас
13 сентября 1987 года в жарком бразильском городе Гойяния произошла мелкая кража. Двое мужчин по имени Роберто Алвес и Вагнер Перейра, воспользовавшись отсутствием охраны, пробрались в заброшенный больничный корпус.
Разобрав на металлолом странную медицинскую установку, они погрузили детали в тачку и покатили ее домой к Алвесу. Никто не знал, что это начало самого пугающего инцидента с радиоактивными материалами в гражданской сфере.
Да, сотрудники Гойянского Института радиотерапии были в курсе, что при переезде в новое здание установленный в 1977 году громоздкий аппарат лучевой терапии остался на прежнем месте. Но собственник здания открыл имущественный спор с организацией.
В дело вступили страховщики, при поддержке полиции запретившие вывозить оставшееся оборудование. На это один из совладельцев Института, Карлос Фигуеиредо Безеррил, только сказал напоследок, что на президенте страховой компании Лисио Боргесе будет лежать ответственность за то, что произойдет с «цезиевой бомбой».
А цезиевая бомба, точнее — источник гамма-излучения в виде изотопа цезия-137, помещенного в капсулу с излучающим окошком и смонтированного в аппарате радиотерапии, в течение четырех месяцев пылилась в покинутом здании, пока ее не свинтили оттуда двое друзей-мародеров. Тем же вечером они приступили к разборке подвижной головки прибора, откуда в конце концов ими была извлечена злополучная капсула. Немного поблевав, друзья разошлись по своим делам: Перейра все же обратился в госпиталь, где ему диагностировали пищевое отравление, а Алвес на следующий день продолжил разборку капсулы. Несмотря на полученные непонятные ожоги, 16 сентября он успешно проковырял в окошке капсулы отверстие и вынул на кончике отвертки странный светящийся порошок. Попытавшись его поджечь, он в дальнейшем потерял интерес к капсуле и продал ее на свалку человеку по имени Девейр Феррейра. Ночью 18 сентября Феррейра увидел таинственный синий свет, исходящий от капсулы. Восхитившись невероятным феноменом, он тут же притащил столь замечательную вещь себе домой. Там он демонстрировал светящуюся капсулу своим родственникам и друзьям. Один из друзей 21 сентября доломал окошко капсулы, вытащив наружу несколько гранул вещества. Никто из них не знал, какой ящик Пандоры был ими взломан. Хлорид цезия-137 стал в буквальном смысле ходить по рукам. 24 сентября брат Феррейры Айво утащил светящийся порошок к себе домой, рассыпав его на бетонный пол. Его шестилетняя дочь ползала по этому полу, жуя бутерброд и с восторгом обмазываясь необычным светящимся веществом… Параллельно с этим жена Феррейры Габриэла серьезно заболела. 25 сентября тот взял странную капсулу и перепродал ее на соседний разбор металлолома. Однако Габриэла оказалась настоящей героиней в этой истории. Уже получив смертельную дозу радиации в 5,7 Грей, она сопоставила свое заболевание, похожие недомогания у знакомых и странную вещь, принесенную мужем. 28 сентября она нашла в себе силы пойти на вторую свалку, вытащить злополучную капсулу и вместе с ней поехать в больницу. В больнице, конечно, пришли в ужас, быстро распознав назначение странной детали, но к счастью, женщина упаковала фонивший материал и заражение в больнице оказалось незначительным. Габриэла умерла 23 октября в один день с маленькой племянницей Феррейры. Кроме них умерли еще двое работников свалки, раскурочивших капсулу до конца. МАГАТЭ назвало инцидент в Гойянии самым кошмарным радиационным инцидентом в мире. Только по благоприятному стечению обстоятельств последствия оказались локальными, но потенциально они могли затронуть огромное количество людей в густонаселенном городе. Всего заражены оказались 249 человек, 42 здания, 14 машин, 3 куста, 5 свиней и 50000 рулонов туалетной бумаги. Власти вывезли с мест заражения верхний слой почвы и почистили территорию ионообменными реагентами. Маленькую дочь Айво пришлось хоронить в герметичном гробу под протесты местных жителей, не желавших захоронения ее радиоактивного тела на кладбище.
В том же году мальчик из Мичигана по имени Дэвид Хан получил на десятый день рождения том «The Golden Book of Chemistry Experiments», который сделает его одиозным авантюристом, известным как «Радиоактивный Бойскаут».
Количество радиоактивных веществ, которое он наковырял из самых разных предметов, причем совершенно сознательно, поражает воображение.
Торий, америций, тритий, радий и даже собственноручно собранный ядерный реактор из этих материалов — то, к чему он навязчиво стремился всю свою жизнь.
Эти примеры показывают, что на самом деле в нашем быту до сих пор остается множество различных предметов, которые могли раньше считаться вполне безопасными, либо считались безопасными в руках специалистов, но из этих рук пошли гулять по другим, либо по какой-то причине оказались заброшенными, украденными и так далее.
В принципе об этих предметах дает представление Интернет в виде обсуждений на специализированных форумах, зачастую эпичных по объему и с весьма говорящим названием.
Но все же я решил более-менее классифицировать все те высокоэнергетические предметы, которые до сих пор в ходу в нашем мире, чтобы люди не слишком восхищались разного рода свечением, не брали в руки странные штуковины с окошками и не сдавали их на металлолом (наверное, вообще худшее, что можно сделать!).
 Радиоактивная лечебная вода Radithor, выпускалась в США в 1918-1928 гг
Радиоактивная лечебная вода Radithor, выпускалась в США в 1918-1928 гг
Светомасса постоянного действия
Таким словосочетанием обозначается постоянно фосфоресцирующий состав, наносимый на все, что нужно видеть в темноте. До эры светодиодов, миниатюрных качественных лампочек и надежных элементов питания подсветить какую-нибудь шкалу прибора лампочкой было ненадежно. Куда как более дешево и безотказно действует светящаяся несколько десятилетий подряд краска.
Достаточно нанести краску на стрелки аналоговых (а других и не было) приборов, выполнить ей деления шкал — и прибор становится читаемым днем и ночью. Самым, наверное, знакомым для людей моего поколения таким прибором является популярный советский компас Андрианова:  Ну а в целом, очень многие вещи военного назначения, «старой закалки», выполнялись с помощью радиоактивной краски. Часы, водолазные часы, шкалы с приборных досок военной техники. Все это выполнено светящейся зеленым краской на основе радия-226. В основном это все-таки касается авиации и флота, причем середины ХХ века. Поэтому если вы коллекционируете подобные предметы, восстанавливаете ретро-технику, помните: женщины, наносившие эту краску на стрелки приборов в военное время, страдали от серьезных проблем со здоровьем. Вам это не нужно.
Ну а в целом, очень многие вещи военного назначения, «старой закалки», выполнялись с помощью радиоактивной краски. Часы, водолазные часы, шкалы с приборных досок военной техники. Все это выполнено светящейся зеленым краской на основе радия-226. В основном это все-таки касается авиации и флота, причем середины ХХ века. Поэтому если вы коллекционируете подобные предметы, восстанавливаете ретро-технику, помните: женщины, наносившие эту краску на стрелки приборов в военное время, страдали от серьезных проблем со здоровьем. Вам это не нужно.  Авиационные приборы с радиевой краской на шкалах Конечно, такие количества краски, которую вы не наносите сами, а всего лишь наблюдаете уже на излете ее активности, дают минимальное излучение, но я вот как-то морщусь, вспоминая детский восторг от близко поднесенного к лицу фосфоресцирующего компаса. Ну а если краска уже облупляется, то дышать такими микрочастицами вообще точно не стоит. Сегодня радиевая краска запрещена уже почти полвека, а в состав СПД теперь входит тритий. Он считается более безопасным, хотя и сложен в получении. Ежегодно производится около 400 г трития, причем стоимость доходит до $30000 за грамм.
Авиационные приборы с радиевой краской на шкалах Конечно, такие количества краски, которую вы не наносите сами, а всего лишь наблюдаете уже на излете ее активности, дают минимальное излучение, но я вот как-то морщусь, вспоминая детский восторг от близко поднесенного к лицу фосфоресцирующего компаса. Ну а если краска уже облупляется, то дышать такими микрочастицами вообще точно не стоит. Сегодня радиевая краска запрещена уже почти полвека, а в состав СПД теперь входит тритий. Он считается более безопасным, хотя и сложен в получении. Ежегодно производится около 400 г трития, причем стоимость доходит до $30000 за грамм.
Минералы
Необязательно работать на урановых рудниках для облучения себя повышенным фоном. Обычные граниты тоже могут давать превышение естественного фона. Все зависит от конкретного состава минералов.
В России, на границе Иркутской области и Якутии, существует единственное в мире месторождение чароита — минерала с уникальным сиреневым цветом. Квота на добычу этого камня установлена республикой Саха-Якутия всего в 100 тонн в год. Поэтому изделия из него постоянно дорожают.
Однако помимо марганца, дающего характерную окраску, в жилах могут содержаться примеси редкоземельных элементов и тория. Эти примеси могут давать сырью существенный фон.
Маловероятно, но не исключено, что изделие из такого камня окажется неприятным источником излучения. Существуют, однако, гораздо более популярные, ныне уже не выпускаемые по объективным причинам, но все еще ходящие по рукам коллекционеров бытовые предметы из уранового стекла — вполне говорящее название, правда? Оно изготавливалось добавлением в стекло оксидов урана или ураната натрия. Помимо красивого зеленого цвета, предметы, отлитые из него, могут также испускать великолепное зеленое свечение под действием ультрафиолета. Изделия, изготовленные в СССР, обычно матово-зеленые либо коричневые, а сделанные в Европе — полупрозрачные, и называются на американском английском vaseline glass.  Изделия из уранового стекла. лот ebay Вы вполне можете вбить это словосочетание в поиске на ebay, и получите множество симпатичных и забавных сувениров из этого материала, испускающего множество быстрых и веселых бета-частиц. Энергия такого излучения невысока, но лучше любоваться этими вещами из-за стекла, а не держать на обеденном столе.
Изделия из уранового стекла. лот ebay Вы вполне можете вбить это словосочетание в поиске на ebay, и получите множество симпатичных и забавных сувениров из этого материала, испускающего множество быстрых и веселых бета-частиц. Энергия такого излучения невысока, но лучше любоваться этими вещами из-за стекла, а не держать на обеденном столе.  Конфетница в виде головы добермана, урановое стекло. лот ebay
Конфетница в виде головы добермана, урановое стекло. лот ebay
Торий кроется в деталях
Также вам могут встретиться в жизни некоторые неприятные торированные предметы. Упоминавшийся «Радиоактивный Бойскаут» активно (извините за каламбур) использовал в своих опытах калильные сетки туристических ламп. Удобная вещь, умеющая превращать нагревание топливом в свет посредством эффекта кандолюминесценции — переизлучения тепла в видимый спектр.
Уже не выпускаются, но все еще продаются. Химик Карл Ауэр фон Вельсбах установил а начале ХХ века, что оптимальным составом для калильных сеток является 99% тория к 1% церия. Очень малоприятный состав, да еще для раскаленного добела сплава. Торий могут также содержать некоторые вольфрамовые электроды.
Если когда-либо придется с такими работать — обратите внимание на красную маркировку, и имейте в виду, что часть перегретого при сварке материала испаряется.  Отдельная проблема с торием лежит в области раритетной фототехники. Существует большое количество моделей старых объективов с торированной оптикой. Торирование использовалось в качестве просветляющего напыления до 1970-х годов. Список торированных объективовSuper Takumar 35/2 (V2, 49mm filter) introduced 1968 S-M-C Takumar 35/2 1972 Super Takumar 50/1.4 (V2) 1967 S-M-C Takumar 50/1.4 1971 Super and S-M-C Takumar 6X7 105/2.4 1969 Kodak Ektar 101mm f/4.5 (Miniature Crown Graphic camera) lens mfg. 1946 Kodak Ektar 38mm f/2.8 (Kodak Instamatic 814 camera) lens mfg 1968—1970 Kodak Ektanar 50mm f/2.8 (Kodak Signet 80 camera) lens mfg. 1958—1962 (3 examples) Kodak Ektanar 90mm f/4 (Kodak Signet 80 camera) lens mfg. 1958—1962 Kodak Ektanar, 44mm f/2.8 (Kodak Signet 30, Kodak Signet 50, Kodak Automatic 35/Motormatic 35 cameras) lenses mfg. 1959—1969 Kodak Ektanon 50mm f/3.9 (Kodak Bantam RF camera) lens mfg. 1954—1957 Kodak Ektanon 46mm f/3.5 (Kodak Signet 40 camera) lens mfg. 1956—1959 Kodak Anastar 44mm f/3.5 (Kodak Pony IV camera) Kodak Color Printing Ektar 96mm f/4.5 lens mfg. 1963 ПРЕДПОЛОЖИТЕЛЬНО ТАКЖЕ Canon FL 58mm f/1.2 Canon FD 35mm f/2.0 (versions from the early 1970's) Canon FD 55mm f/1.2 S.S.C. Aspherical Carl Zeiss Jena Pancolar 55mm f1.4 (measured at 2360 nSv/h) Carl Zeiss Jena Pancolar 50mm f1.8 «Zebra» Carl Zeiss Jena Biometar 80mm f2.8 «Zebra» «(Only P6 mount version ) Carl Zeiss Jena Flektogon 50mm f4 «Zebra» «(Only P6 mount version ) GAF Anscomatic 38mm f/2.8 (GAF Anscomatic 726 camera)
Отдельная проблема с торием лежит в области раритетной фототехники. Существует большое количество моделей старых объективов с торированной оптикой. Торирование использовалось в качестве просветляющего напыления до 1970-х годов. Список торированных объективовSuper Takumar 35/2 (V2, 49mm filter) introduced 1968 S-M-C Takumar 35/2 1972 Super Takumar 50/1.4 (V2) 1967 S-M-C Takumar 50/1.4 1971 Super and S-M-C Takumar 6X7 105/2.4 1969 Kodak Ektar 101mm f/4.5 (Miniature Crown Graphic camera) lens mfg. 1946 Kodak Ektar 38mm f/2.8 (Kodak Instamatic 814 camera) lens mfg 1968—1970 Kodak Ektanar 50mm f/2.8 (Kodak Signet 80 camera) lens mfg. 1958—1962 (3 examples) Kodak Ektanar 90mm f/4 (Kodak Signet 80 camera) lens mfg. 1958—1962 Kodak Ektanar, 44mm f/2.8 (Kodak Signet 30, Kodak Signet 50, Kodak Automatic 35/Motormatic 35 cameras) lenses mfg. 1959—1969 Kodak Ektanon 50mm f/3.9 (Kodak Bantam RF camera) lens mfg. 1954—1957 Kodak Ektanon 46mm f/3.5 (Kodak Signet 40 camera) lens mfg. 1956—1959 Kodak Anastar 44mm f/3.5 (Kodak Pony IV camera) Kodak Color Printing Ektar 96mm f/4.5 lens mfg. 1963 ПРЕДПОЛОЖИТЕЛЬНО ТАКЖЕ Canon FL 58mm f/1.2 Canon FD 35mm f/2.0 (versions from the early 1970's) Canon FD 55mm f/1.2 S.S.C. Aspherical Carl Zeiss Jena Pancolar 55mm f1.4 (measured at 2360 nSv/h) Carl Zeiss Jena Pancolar 50mm f1.8 «Zebra» Carl Zeiss Jena Biometar 80mm f2.8 «Zebra» «(Only P6 mount version ) Carl Zeiss Jena Flektogon 50mm f4 «Zebra» «(Only P6 mount version ) GAF Anscomatic 38mm f/2.8 (GAF Anscomatic 726 camera)
Industar 61 L/Z MC (desert_beaver пишет в х, что использовавшийся вместо тория лантан все же безопаснее)
Kodak Aero-Ektars (various models) Kodak Ektanon 50mm f/3.9 (Kodak Bantam RF camera) Nikkor 35mm f/1.4 (early variant with thorium glass elements) Olympus Zuiko Auto-S 1:1,2/55 mm (first version with thorium glass elements) Olympus Zuiko Auto-S 1:1,4/50 mm (only first version «Silvernose» is Radioactive) Pentax Super Takumar 35mm f/2 (Asahi Optical Co.) Pentax Super Takumar 50mm f/1.4 (Asahi Optical Co.) SMC Takumar 35mm f/2.0 (Asahi Optical Co.) Super Takumar 35mm f/2.0 (Asahi Optical Co.) SMC Takumar 50mm f/1.4 (Asahi Optical Co.) Super Takumar 50mm f/1.4 (Only latest Version 2) SMC Takumar 55mm f/1.8 (Asahi Optical Co.) Super Takumar 6×7 105mm f2.4 (Asahi Optical Co.) Yashinon-DS 50mm f1.7 (Yashica) Yashinon 55mm f1.2 (Tomioka) Leitz Wetzlar Summicron 5cm f/2.0 (M39) Vivitar Series 1 28mm F1.9
Источник (опять каламбур, извините)
Специально созданные источники радиации
Если все предыдущее было недоразумением технологий первой половины XX века, когда еще не такое большое значение придавали радиоактивности предметов, то следующие устройства представляют серьезнейшую опасность и по идее вообще не должны попадаться вам в быту и вообще в какие-либо не те руки.
Это — штатные источники излучения, находящиеся в специальных приборах и устройствах. Если вы нашли что-то подобное и не умеете с ним обращаться — вызывайте МЧС и не дожидайтесь наступления вашего персонального Чернобыля.
Гамма-источники используются в качестве уровнемеров в каменоломнях и карьерах, в гамма-дефектоскопии и прочей промышленности.  Сходный принцип действия с уровнемерами и у датчиков дыма. Радиоактивный источник постоянно облучает датчик напротив. Дым (твердые частицы) ослабляет поток, что замечается датчиком, и включается тревога. В датчиках дыма используется изотоп америция-241, хотя в старых советских РИД-1 применялся аж плутоний-239. Разбирать их или тем более выкидывать в мусор крайне не рекомендуется.
Сходный принцип действия с уровнемерами и у датчиков дыма. Радиоактивный источник постоянно облучает датчик напротив. Дым (твердые частицы) ослабляет поток, что замечается датчиком, и включается тревога. В датчиках дыма используется изотоп америция-241, хотя в старых советских РИД-1 применялся аж плутоний-239. Разбирать их или тем более выкидывать в мусор крайне не рекомендуется.  Датчики РИД-1
Датчики РИД-1
И снова тот же самый принцип. Есть толщина чего-то, которая перекрывает путь ионизирующему излучению. На покрытом радиевой СПД табло загорается тревожная лампочка: «обледенение». На фото — датчик обледенения РИО-3, на отечественной авиации получил широкое распространение, поэтому вполне может внезапно встретиться на заброшенных аэродромах, военных базах тем, кто залезет туда посталкерить, с плачевными последствиями:
 Допустим, прочитав эту статью, вы запаниковали и побежали сталкерить покупать недорогой и сердитый армейский или геологический дозиметр на Авито. Тем самым вы приобретаете и невзрачный, маленький, но совсем не безобидный контрольный источник, для калибровки прибора:
Допустим, прочитав эту статью, вы запаниковали и побежали сталкерить покупать недорогой и сердитый армейский или геологический дозиметр на Авито. Тем самым вы приобретаете и невзрачный, маленький, но совсем не безобидный контрольный источник, для калибровки прибора:  Источник источника Это тоже радиоактивный источник, вполне серьезный и опасный для здоровья, несмотря на свою миниатюрность. Его нельзя терять, ломать, давить или выкидывать.
Источник источника Это тоже радиоактивный источник, вполне серьезный и опасный для здоровья, несмотря на свою миниатюрность. Его нельзя терять, ломать, давить или выкидывать.
Если вы думаете, что целью статьи было показать, как страшно жить — вовсе нет.
Попробуйте посмотреть на это с другой стороны: вы предупреждены, и теперь не будете покупать для своих проектов на ардуино стильные аналоговые циферблаты от авиационных и флотских приборных панелей, поостережетесь сваривать ториевыми электродами и фотографировать на просветленный винтажный объектив. И тем более, чтобы заработать на все это денег — не потащите в металлолом найденный на каком-то заброшенном заводе пузатый гамма-источник с проушиной сверху.
Радиоактивные элементы
Радий довольно редок. За прошедшее с момента его открытия время — более столетия — во всём мире удалось добыть всего только 1,5 кг чистого радия. Одна тонна урановой смолки, из которой супруги Кюри получили радий, содержит лишь около 0,0001 г радия-226.
Весь природный радий возникает при распаде урана-238, урана-235 или тория-232; наиболее распространённым и долгоживущим изотопом (период полураспада 1602 года) является радий-226, входящий в радиоактивный ряд урана-238.
В равновесии отношение содержания урана-238 и радия-226 в руде равно отношению их периодов полураспада: (4,468×109 лет)/(1602 года)=2,789×106. Таким образом, на каждые три миллиона атомов урана в природе приходится лишь один атом радия.
Как оплатить интернет Йота по лицевому счету
Как был открыт
Открытие радия (1898 год) – заслуга Марии Кюри:
- Годами она работала с урановой смолкой. Это были отходы с местного предприятия. После извлечения урана они должны были быть «чистыми», но «фонили» сильнее чистого урана.
- Позднее к ней присоединился супруг Пьер и коллега Жан Бемон.
- Лишь через 12 лет была получена первая в истории «песчинка» чистого радия.
 Реплики продуктов начала XX века, содержащих радий, на витрине в Музее Марии Кюри, Париж
Реплики продуктов начала XX века, содержащих радий, на витрине в Музее Марии Кюри, Париж
В тонне урановой смолки, которую перерабатывали супруги Кюри, было 0,1 г радия.
- Первые образцы стали самым дорогим веществом на планете: цена 1 г радия превосходила стоимость двух центнеров золота.
Попутно Мария открыла элемент, который назвала полонием – в честь своей родной страны Польши.
Можно ли на Озоне оплатить заказ при получении? Как? Отопление радием-камин 21 века. Французская карточка 1910 года
Отопление радием-камин 21 века. Французская карточка 1910 года
За открытие радия Марии Склодовской-Кюри присудили в 1911 году Нобелевскую премию.
Свойства и применение
Также радий — химический элемент, который формирует ряд солей. Известны его нитриды, хлориды, сульфаты, нитраты, карбонаты, фосфаты, хроматы. Также есть двойные соли с вольфрамом и бериллием.
То, что радий-226 может быть опасен для здоровья, его первооткрыватель Пьер Кюри узнал не сразу. Однако сумел убедиться в этом, когда провел эксперимент: сутки он ходил с привязанной к плечевой части руки пробиркой с металлом.
На месте контакта с кожей появилась незаживающая язва, избавиться от которой ученый не мог больше двух месяцев.
От своих экспериментов над явлением радиоактивности супруги не отказались, поэтому и умерли оба от большой дозы облучения.
Почему Пропали Все Публикации в Инстаграме
Помимо отрицательного значения, существует и ряд областей, в которых радий-226 находит применение и приносит пользу:
- Индикатор смещения уровня океанских вод.
- Используется для определения количества урана в породе.
- Входит в состав осветительных смесей.
- В медицине используется для формирования лечебных радоновых ванн.
- Применяют с целью снятия электрических зарядов.
- С его помощью проводится дефектоскопия литья и свариваются швы деталей.
Запасы и месторождения
Запасы и месторождения представителей радиоактивной группы:
- Уран. Залежи металла в слоях литосферы на толщину 20 км — 1.3х1014 т. Содержание в морской воде — 3 мкг/л. Больше всего урана содержится в кислых породах, содержащих кремний.
- Радий. Редкий элемент. За все время было добыто не более 1,5 килограмма чистого радия. Природный радий появляется после распада урана 235 и урана 238.
- Плутоний. Из-за отсутствия стабильных изотопов его сложно найти в природе. Изотопы, с длительным периодом полураспада — 239, 244. В природе он встречается в виде соединения PuO2. Его добыча не имеет смысла из-за малого количества.
- Торий. Был открыт в 1815 году. Все природные изотопы элемента состоят из этого нуклида. В большом количестве содержится в природе. Самые стабильные изотопы — 232, 230, 229.
- Берклий. Некоторые изотопы этого радиоактивного элемента можно получить при облучении урановых, плутониевых руд в ядерных реакторах. Самые стабильные изотопы — 247, 249.
Большинство радиоактивных металлов редко встречаются в природе, добывать их сложно.
 Добыча руды ( Instagram / nornickel_official)
Добыча руды ( Instagram / nornickel_official)
Биологическая роль
Радий чрезвычайно радиотоксичен. В организме он ведёт себя подобно кальцию — около 80 % поступившего в организм радия накапливается в костной ткани. Большие концентрации радия вызывают остеопороз, самопроизвольные переломы костей и злокачественные опухоли костей и кроветворной ткани. Опасность представляет также радон — газообразный радиоактивный продукт распада радия.
Преждевременная смерть Марии Кюри произошла вследствие хронического отравления радием, так как в то время опасность облучения ещё не была осознана.
В начале XX века радий даже считался полезным и включался в состав многих продуктов и бытовых предметов: хлеб, шоколад, питьевая вода, зубная паста, пудры и кремы для лица, краска циферблатов наручных часов, средства для повышения тонуса и потенции.
Радиоактивные металлы: список
Полный перечень всех принадлежащих к рассматриваемой группе элементов может быть достаточно внушительным, ведь всего к ней относятся около 80 металлов. В первую очередь это все, стоящие в периодической системе после свинца, включая группу лантаноидов и актиноидов. То есть висмут, полоний, астат, радон, франций, радий, резерфордий и так далее по порядковым номерам.
Как отключить услугу меломания на мтс?
Выше обозначенной границы располагается множество представителей, каждый из которых также имеет изотопы.
При этом некоторые из них могут быть как раз радиоактивными. Поэтому важно, какие разновидности имеет химический элемент.
Радиоактивный металл, точнее одна из его изотопных разновидностей, есть практически у каждого представителя таблицы. Например, их имеют:
- кальций;
- селен;
- гафний;
- вольфрам;
- осмий;
- висмут;
- индий;
- калий;
- рубидий;
- цирконий;
- европий;
- радий и другие.
Таким образом, очевидно, что элементов, проявляющих свойства радиоактивности, очень много — подавляющее большинство. Часть из них безопасна из-за слишком длинного периода полураспада и содержится в природе, другая же создана искусственно человеком для различных нужд в науке и технике и является крайне опасной для организма людей.
Свойства и характеристики
Знание характеристик радиоактивных металлов поможет выявить уникальные свойства этих элементов, понять, где их лучше применять.
Уран
Свойства:
Госуслуги. Что-то пошло не так
- В свободном состоянии — светло-серый металл.
- Плотность — 18700 кг/м3.
- Атомный номер — 92.
- Электросопротивление — 29,0•10-4 (Ом•м).
- Температура плавления — 1135°C.
- Теплоемкость — 27,66 Дж/(моль•К).
- Температура кипения — 3818°C.
- Теплопроводность — 22,5 Вт/(м•К).
- Степень окисления — до +6.
- Коэффициент линейного расширения — 10,7•10-6 К-1.
Уран растворяется в азотной и соляной кислоте, не взаимодействует с щелочами.
При нагревании может вступать в реакции с азотом, фосфором.
 Химический элемент уран
Химический элемент уран
Радий
Характеристики:
- В нормальном состоянии — серебристо-белый металл.
- Показатель плотности — 5500 кг/м3.
- Атомный номер — 88.
- Показатель теплоемкости — Cp0 29 Дж/(моль•К).
- Температура плавления — 969°C.
- Степень окисления — +2.
- Температура кипения — 1500°C.
По химической активности радий можно сравнить с барием. На воздухе быстро окисляется. При соединении с водой возникает бурная реакция с нагреванием жидкости.
Плутоний
Характеристики:
- При нормальном состоянии — серебристо-белый металл.
- Показатель плотности — 19,82 (25°C, г/см3).
- Атомный норме — 94.
- Удельное электрическое сопротивление — 150 мкОм·см (при +22 °C).
- Температура плавления — 640°C.
- Температура кипения — 3235°C.
Вступает в реакцию с водой.
 Окисленный плутоний ( Instagram / thoisoi)
Окисленный плутоний ( Instagram / thoisoi)
Биологическое воздействие
Радий проникает в живые организмы:
- В растительном мире его больше в стволах деревьев.
- Организм животных и человека получает его с водой, пищей.
- Четыре пятых поступившего радия оседает в костях.
- Концентрация вещества определяется пищевым рационом и районом проживания.
По стандартам РФ, кубический метр воздуха не должен содержать более 0,000001 мкг радия.
Нанодозы вещества полезны, превышение чревато онкологией. Поэтому критически важно видеть барьер, после которого достоинства материала становятся недостатками.
Теги
газообразный радон ио радоне При распаде тот
Радиоактивные металлы
Радиоактивные металлы
Уран, радий, торий, нептуний, плутоний , берклий, франций, эйнштейний, технеций и многие другие – все это радиоактивные металлы. Это такие металлы, которые обладают способностью превращаться в другие химические элементы, получая при этом гамма-кванты.
Уран
Уран (устар. ура́ний) — металл светло-серого цвета, легко поддается обработке, сравнительно мягкий, на воздухе темнеет, покрываясь пленкой оксида, химический элемент с атомным номером 92 в периодической системе, атомная масса 238,029; обозначается символом U (лат. Uranium), относится к семейству актиноидов. Уран широко распространён в природе.
Кларк урана составляет 0,0003 % (вес.), концентрация в морской воде 3 мкг/л. Количество урана в слое литосферы толщиной 20 км оценивается в 1,3×1014 т. Основная масса урана находится в кислых породах с высоким содержанием кремния. Значительная масса урана сконцентрирована в осадочных породах, особенно обогащённых органикой.
В больших количествах как примесь уран присутствует в ториевых и редкоземельных минералах
История: Ещё в древнейшие времена (I век до нашей эры) природная окись урана использовалась для изготовления жёлтой глазури для керамики.
Исследования урана развивались, и в 1789 году немецкий натурфилософ и химик Мартин Генрих Клапрот восстановил извлечённую из саксонской смоляной руды золотисто-жёлтую «землю» до чёрного металлоподобного вещества (которое было названо в честь самой далёкой тогда известной планеты «Уран»). Пятьдесят лет уран Клапрота числился металлом. Только в 1841 г.
французский химик Эжен Мелькиор Пелиго доказал, что, несмотря на характерный металлический блеск, уран Клапрота не элемент, а оксид UO2. В 1840 г. Пелиго удалось получить настоящий уран — тяжёлый металл серо-стального цвета — и определить его атомный вес. В 1899 г.
Резерфорд обнаружил, что излучение урановых препаратов неоднородно, что есть два вида излучения — альфа — и бета-лучи. Они несут различный электрический заряд; далеко не одинаковы их пробег в веществе и ионизирующая способность. Чуть позже, в мае 1900 г., Поль Вийар открыл третий вид излучения — гамма-лучи. Эрнест Резерфорд провёл в 1907 г.
первые опыты по определению возраста минералов при изучении радиоактивных урана и тория. В 1939—1940 гг. Ю. Б. Харитон и Я. Б. Зельдович впервые теоретически показали, что при небольшом обогащении природного урана ураном-235 можно создать условия для непрерывного деления атомных ядер, то есть придать процессу цепной характер.
Свойства: Уран — очень тяжёлый, серебристо-белый глянцеватый металл. В чистом виде он немного мягче стали, ковкий, гибкий, обладает небольшими парамагнитными свойствами.
Уран имеет три аллотропные формы: альфа-U (призматическая, стабильна до 667,7 °C), бета-U (четырёхугольная, стабильна от 667,7 °C до 774,8 °C), гамма-U (с объёмно центрированной кубической структурой, существующей от 774,8 °C до точки плавления).
- Уран может проявлять
степени окисления от +III до +VI. Соединения урана(III) образуют неустойчивые растворы красного цвета и являются сильными восстановителями: - 4UCl3 + 2H2O → 3UCl4 + UO2 + H2↑
- Соединения урана(IV) являются наиболее устойчивыми и образуют водные растворы зелёного цвета.
- Соединения урана(V) неустойчивы
и легко диспропорционируют в
водном растворе: - 2UO2Cl → UO2Cl2 + UO2
Химически уран очень активный металл. Быстро окисляясь на воздухе, он покрывается радужной пленкой
оксида. Мелкий порошок урана самовоспламеняется на воздухе, он зажигается при температуре 150—175 °C, образуя U3O8. При 1000 °C уран соединяется
с азотом, образуя жёлтый нитрид урана.
Вода способна разъедать металл, медленно при низкой температуре, и быстро при высокой, а также при мелком измельчении порошка урана. Уран растворяется в соляной, азотной и других кислотах, образуя четырёхвалентные соли, зато не взаимодействует со щелочами.
Уран вытесняет водород из неорганических кислот и солевых растворов таких металлов, как ртуть, серебро, медь, олово, платина и золото. При сильном встряхивании металлические частицы урана начинают светиться. Уран имеет четыре степени окисления — III—VI.
Шестивалентные соединения включают в себя триокись урана (окись уранила) UO3 и хлорид уранила (уранилхлорид) UO2Cl2. Тетрахлорид урана UCl4 и диоксид урана UO2 — примеры четырёхвалентного урана.
Вещества, содержащие четырёхвалентный уран, обычно нестабильны и обращаются в шестивалентные при длительном пребывании на воздухе. Ураниловые соли, такие как уранилхлорид, распадаются в присутствии яркого света или органики.
Изотопы: Природный уран состоит из смеси трёх изотопов: 238U (изотопная распространённость 99,2745 %, период полураспада T1/2 = 4,468×109 лет), 235U (0,7200 %, T1/2 = 7,04×108 лет) и 234U (0,0055 %, T1/2 = 2,455×105 лет)[8]. Последний изотоп является не первичным, а радиогенным, он входит в состав радиоактивного ряда 238U.
Радиоактивность природного урана обусловлена в основном изотопами 238U и 234U, в равновесии их удельные активности равны. Удельная активность изотопа 235U в природном уране
в 21 раз меньше активности 238U.
На данный момент известно 23 искусственных радиоактивных изотопа
урана с массовыми числами
от 217 до 242. Наиболее долгоживущий из них
— 233U (T1/2 = 1,59×105лет) получается при облучении
тория-232 нейтронами и способен к
делению под воздействием тепловых нейтронов.
Изотопы урана 238U и 235U являются родоначальниками двух радиоактивных
рядов. Конечными элементами этих рядов
являются изотопы свинца 206Pb и 207Pb.
В природных условиях распространены в основном изотопы 234U: 235U : 238U = 0,0054 : 0,711 : 99,283. Половина радиоактивности
природного урана обусловлена изотопом 234U. Изотоп 234U образуется за счёт распада 238U.
Применение:
-Ядерное топливо
Наибольшее применение имеет
изотоп урана 235U, в котором возможна самоподдерживающаяся цепная ядерная
реакция. Поэтому этот изотоп используется как топливо в ядерных реакторах, а также в ядерном оружии. Выделение
изотопа U235 из природного урана —
сложная технологическая проблема (см. разделение изотопов).
- Изотоп U238 способен делиться под влиянием бомбардировки высокоэнергетическими
нейтронами, эту его особенность
используют для увеличения мощности термоядерного оружия (используются нейтроны, порождённые термоядерной реакцией). - В результате захвата нейтрона с последующим β-распадом 238U может
превращаться в 239Pu, который затем
используется как ядерное топливо. - Уран-233, искусственно получаемый в реакторах из тория (торий-232 захватывает
нейтрон и превращается в торий-233, который распадается в протактиний-233 и затем в уран-233), может в
будущем стать распространённым ядерным топливом для атомных
электростанций (уже сейчас существуют реакторы, использующие этот нуклид в
качестве топлива, например KAMINI в Индии) и производства атомных бомб (критическая
масса около 16 кг). - Уран-233 также является наиболее перспективным топливом для газофазных ядерных ракетных двигателей.
- -Тепловыделяющая способность урана
- 1 тонна обогащенного урана
по тепловыделяющей способности
равна 1 миллиону 350 тоннам нефти
или природного газа. - -Геология
- -Небольшая добавка урана
придаёт красивую жёлто-зелёную флуоресценцию стеклу ( Урановое стекло) - -Уранат натрия Na2U2O7 использовался как жёлтый пигмент в живописи.
- -Соединения урана применялись как краски для живописи по фарфору и для керамических глазурей и эмалей (окрашивают в цвета: жёлтый, бурый, зелёный и чёрный, в зависимости от степени окисления).
- -Некоторые соединения урана светочувствительны.
- -В начале XX века уранилнитрат широко применялся для усиления негативов и окрашивания (тонирования) позитивов (фотографических отпечатков) в бурый цвет.
- -Карбид урана-235 в сплаве с карбидом ниобия и карбидом циркония применяется в качестве топлива для ядерных реактивных двигателей (рабочее тело — водород + гексан).
- -Сплавы железа и обеднённого урана (уран-238) применяются как мощные магнитострикционные материалы.
— в качестве сердечников для бронебойных снарядов. Большая плотность (в три раза тяжелее стали), делает закалённую урановую болванку чрезвычайно эффективным средством для пробивания брони, аналогичным по эффективности более дорогому и ненамного более тяжёлому вольфраму. Тяжёлый урановый наконечник также изменяет распределение масс в снаряде, улучшая его аэродинамическую устойчивость.
Радий
Радий — элемент главной подгруппы второй группы, седьмого периода периодической системы химических элементов Д. И. Менделеева, с атомным номером 88. Обозначается символом Ra (лат. Radium).
Простое вещество радий — блестящий щёлочноземельный металл серебристо-белого цвета, быстро тускнеющий на воздухе. Обладает высокой химической активностью. Радиоактивен; наиболее устойчив нуклид 226Ra (период полураспада около 1600 лет). Радий довольно редок.
За прошедшее с момента его открытия время — более столетия — во всём мире удалось добыть всего только 1,5 кг чистого радия. Одна тонна урановой смолки, из которой супруги Кюри получили радий, содержит лишь около 0,0001 г радия-226.
Весь природный радий является радиогенным — возникает при распаде урана-238, урана-235 или тория-232; из четырёх найденных в природе наиболее распространённым и долгоживущим изотопом (период полураспада 1602 года).
История: Французские ученые Пьер и Мария Кюри обнаружили, что отходы, остающиеся после выделения урана из урановой руды (урановая смолка, добывавшаяся в городе Иоахимсталь, Чехия), более радиоактивны, чем чистый уран. Из этих отходов супруги Кюри после нескольких лет интенсивной работы выделили два сильно радиоактивных элемента: полоний и радий.
Свойства: Радий при нормальных условиях представляет собой блестящий белый металл, на воздухе темнеет (вероятно, вследствие образования нитрида радия). Реагирует с водой. Ведёт себя подобно барию и стронцию, но более химически активен. Обычная степень окисления — +2. Гидроксид радия Ra(OH)2 — сильное, коррозионное основание. Сульфат радия практически не растворим в воде.
Изотопы: Известны 25 изотопов радия. Изотопы 223Ra, 224Ra, 226Ra, 228Ra встречаются в природе, являясь членами радиоактивных рядов. Остальные изотопы могут быть получены искусственным путём. Радиоактивные свойства некоторых изотопов радия.
Свойства: Радий при нормальных условиях представляет собой блестящий белый металл, на воздухе темнеет (вероятно, вследствие образования нитрида радия). Реагирует с водой. Ведёт себя подобно барию и стронцию, но более химически активен. Обычная степень окисления — +2. Гидроксид радия Ra(OH)2 — сильное, коррозионное основание. Сульфат радия практически не растворим в воде.
Применение:
В настоящее время радий
иногда используют в компактных источниках нейтронов, для этого небольшие
его количества сплавляются с
бериллием. Под действием альфа-излучения (ядер гелия-4) из бериллия выбиваются нейтроны: 9Be + 4He → 12C + 1n.
В медицине радий используют как источник радона для приготовления
радоновых ванн (хотя в настоящее
время их полезность оспаривается). Кроме того, радий применяют для
кратковременного облучения при
лечении злокачественных заболеваний
кожи, слизистой оболочки носа, мочеполового тракта.
Однако в настоящее
время существует множество более
подходящих для этих целей радионуклидов
с нужными свойствами, которые
получают на ускорителях или в
ядерных реакторах, например, 60Co (T1/2 = 5,3 года), 137Cs (T1/2 = 30,2 года), 182Ta (T1/2 = 115 сут.), 192Ir (T1/2 = 74 сут.), 198Au (T1/2 = 2,7 сут.) и т. д.
Отопление радием: камин 21 века. Французская карточка 1910 года
До 70-х годов XX века радий
часто использовался для изготовления светящихся красок постоянного свечения (для разметки циферблатов авиационных
и морских приборов, специальных
часов и других приборов), однако сейчас его обычно заменяют менее
опасными изотопами: тритием (T1/2 = 12,3 года) или 147Pm (T1/2 = 2,6 года). Опасность таких
приборов состоит в том что
они не содержали предупреждающей
маркировки, выявить их можно только дозиметрами. Радий чрезвычайно радиотоксичен. В организме он ведёт себя подобно кальцию — около 80 % поступившего в организм радия накапливается в костной ткани. Большие концентрации радия вызывают остеопороз, самопроизвольные переломы костей и злокачественные опухоли костей и кроветворной ткани. Опасность представляет также радон — газообразный радиоактивный продукт распада радия.
Преждевременная смерть Марии
Кюри произошла вследствие хронического отравления радием, так как в то время опасность облучения ещё
не была осознана.
Торий
Торий — элемент III группы таблицы Менделеева, принадлежащий к актиноидам; тяжёлый слаборадиоактивный металл. Открыт в 1815 г. Берцелиусом. Торий был назван его первооткрывателем по имени бога грома Тора в скандинавской мифологии.
- Изотопы: На данный момент известны 30 изотопов тория и еще 3 возбуждённых изомерных состояния некоторых его нуклидов.
- Только один из нуклидов тория (торий-232) обладает достаточно большим
периодом полураспада по отношению
к возрасту Земли, поэтому практически
весь природный торий состоит
только из этого нуклида. Некоторые
из его изотопов могут определяться в природных образцах в следовых количествах, так как входят в
радиоактивные ряды радия, актиния
и тория: - -радиоактиний 227Th
- -радиоторий 228Th
- -ионий 230Th
- -уран Y 231Th
- -уран X1 234Th
- Наиболее стабильными
изотопами являются 232Th (период полураспада
составляет 14,05 миллиардов лет), 230Th (75 380 лет), 229Th (7 340 лет), 228Th (1,9116 года). Оставшиеся изотопы имеют периоды полураспада
менее 30 дней (большинство из них
имеют периоды полураспада менее 10 минут)
Свойства: Серебристо-белый пластичный металл, образует сплавы со многими металлами. Температура плавления – 1750° С, температура кипения – 4200° С, плотность – 7,24 г/см3, при температуре ниже 1,4 К становится сверхпроводником.
Торий весьма реакционноспособен – быстро тускнеет на воздухе, в
кипящей воде покрывается пленкой ThO2. Мелкодисперсный металлический
торий вспыхивает на воздухе из-за энергичного окисления. Торий растворим
в разбавленных минеральных кислотах: соляной, азотной, серной; концентрированной
азотной кислотой он пассивируется, не реагирует со щелочами.
Наиболее устойчивая степень окисления у Th(IV), есть и соединения с более
низкой степенью окисления: Th(II)I2 и Th(III)I3. При участии ионов щелочных металлов соединения тория легко образуют двойные соли K2[Th(NO3)6], Na2[Th(SO4)3], а также
смешанные оксиды К2ТhO3.
В водных растворах ионы тория образуют гидрокса-ионы [Th(OH)3]+, [Th2(OH)2]6+, [Th4(OH)12]4+
Радиоактивные металлы
Радиоактивные металлы
Впервые радиоактивный металл радий был открыт французским физиком Пьером Кюри (1859-1906) в 1898 году. Ученый носил пробирку со своим «открытием» в нагрудном кармане, получил роковую дозу облучения и рано умер. За свое открытие вместе с женой Марией Склодовской-Кюри (1867-1934) и ученым Антуаном Анри Беккерелем (1852-1908) Пьер Кюри получил Нобелевскую премию. Это было в 1903 году.
Итак, что такое радиоактивные металлы, к которым принадлежат уран, радий, торий и нептуний? Это такие металлы, которые обладают способностью превращаться в другие химические элементы, испуская при этом различные частицы. Ученые называют их гамма-квантами.
Невероятную силу радиоактивных элементов люди узнали после взрывов ядерных бомб в японских городах Хиросима и Нагасаки в 1945 году. За считанные минуты было убито и ранено более 200 тысяч человек.
Итальянский городок Орвието однажды облетела сенсационная весть: местные специалисты обнаружили, что внутри католического собора, который был построен в XIII-XIV веках, радиоактивность повышена в 15 раз по сравнению с естественной. «Что такое? Почему? — заволновались жители Орвието.
— Куда же нам теперь ходить молиться?» «Все в тот же собор, — ответили ученые. — Ничего страшного с вами не случится, вы же находитесь в соборе не круглые сутки, а довольно короткое время, пока длится служба. Во всем же виноват мрамор, из которого построили в свое время собор.
Он содержит много радиоактивных элементов: урана, тория и других…»
Уран — металл с удивительными свойствами, ключ к раскрытию тайн атомной энергии. Это естественный источник радиоактивного излучения, которое широко используется в медицине, сельском хозяйстве, промышленности.
Внешне слитки чистого урана очень напоминают слитки серебра или стали. Но уран очень тяжелый металл, один из самых тяжелых химических элементов в природе. Один кубический сантиметр урана весит 19 граммов.
Отличительные свойства урана таковы. Во-первых, это радиоактивный металл, а значит, в нем постоянно протекают определенные структурные изменения, сопровождающиеся выделением энергии в виде радиоактивного излучения.
Некоторые атомы урана подвержены процессу распада, то есть атомы могут расщепляться на две части, высвобождая огромное количество энергии.
Процесс распада атомов урана лежит в основе работы ядерных электростанций, ядерного оружия.
Во-вторых, уран — химически активный элемент. Он вступает в реакцию со многими химическими элементами. Если уран соприкасается с воздухом, то на его поверхности быстро образуется черная пленка. Она состоит Из соединений урана и кислорода.
В небольших количествах уран достаточно часто встречается в природе, но не в чистом виде. Процесс получения чистого урана из урановой руды длительный и трудоемкий.
Из тонны переработанной руды получают всего лишь несколько граммов урана. Сначала урановую руду дробят, просеивают и обрабатывают различными химическими веществами, для того чтобы очистить ее от посторонних примесей.
Затем руду в несколько этапов очищают до получения желтой, похожей на пластилин массы.
В одном килограмме урана потенциально заложено столько же энергии, сколько в трех миллионах килограммов угля. В ядерных реакторах в результате цепной реакции распада атомов урана выделяется огромное количество энергии, которая приводит в движение турбины — основные звенья в электрических генераторах.






