- Железо
- Медь
- Соединения меди I
- Соединения меди (II)
- Переходные элементы: медь, хром, железо — Умскул Учебник
- Физические свойства
- Хром и его соединения
- Некоторые важнейшие соединения хрома
- Химические свойства
- 1. Взаимодействие с O2
- 2. Взаимодействие с другими неметаллами
- 3. Взаимодействие с разбавленными растворами HCl и H2SO4
- 4. Действие концентрированных HNO3, H2SO4 и «царской водки» на хром
- 5. Вытеснение малоактивных Me из водных р-ров солей
- 6. Взаимодействие с солями, разлагающимися с образованием кислорода
- Соединения Cr (II)
- Способы получения
- Химические свойства
- Химические свойства
- Соли Сr2+
- Способы получения:
- Химические свойства
- Соединения Сr(III)
- Способы получения
- Химические свойства
- Сr(ОН)3 — гидроксид хрома (III)
- Химические свойства
- Соли Cr3+
- Химические свойства
- Соединения Cr(VI)
- CrO3 — оксид хрома (VII) триоксид хрома, хромовый ангидрид
- Химические свойства
- Хромовые кислоты — Н2СrO4, Н2Сr2O7
- Химические свойства
- Способы получения
- Химические свойства
- Химические свойства
- Примеры ОВР с участием дихроматов в качестве окислителей
- Металл для кальяна. Сплавы и марки. Все о кальянах и табаках
- Общие физические свойства металлов
- Оптимальная толщина металла
- Общие химические свойства металлов
- I. Реакции металлов с неметаллами
- II. Реакции металлов с кислотами
- III. Взаимодействие металлов с водой
- IV. Вытеснение более активными металлами менее активных металлов из растворов их солей:
- Коррозия металлов
- Общие способы получения металлов в промышленности:
- ТОП-10 самых прочных металлов в мире
- Середина мая 2020: рост золота и паника на биржах
- Штиль перед цунами, или чего ожидать на рынках и золоте
- Не стоит забывать о серебре
- TD Securities: золото на пути к 2000$ за унцию
- EB Tucker: в 2020 году золото установит новый рекорд
- SP Angel: цена золота готова для продолжения роста
- Добыча золота в США по итогам января 2020
- Май 2020: спрос на золото в Китае
- США: чистый экспорт золота 40 месяцев подряд
- Опередит ли Австралия Китай по добыче золота?
- Что такое обезличенные металлические счета?
- Динамика
Твердый металл голубовато-белого цвета. Этимология слова «хром» берет начало от греч. χρῶμα — цвет, что связано с большим разнообразием цветов соединений хрома. Массовая доля этого элемента в земной коре составляет 0.02% по массе.

Для хрома характерны степени окисления +2, +3 и +6. У соединений, где хром принимает степень окисления +2, свойства основные, +3 — амфотерные, +6 — кислотные.
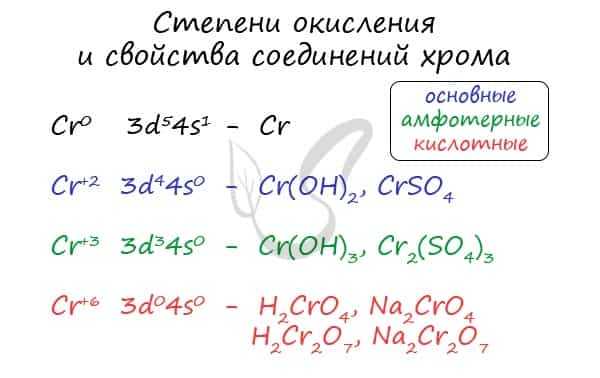
В природе хром встречается в виде следующих соединений.
- Fe(CrO2)2 — хромистый железняк, хромит
- (Mg, Fe)Cr2O4 — магнохромит
- (Fe, Mg)(Cr, Al)2O4 — алюмохромит

Получение
В промышленности хром получают прокаливанием хромистого железняка с углеродом. Также применяют алюминотермию для вытеснения хрома из его оксида.
- Fe(CrO2)2 + C = Fe + Cr + CO
- Cr2O3 + Al = Al2O3 + Cr
- Химические свойства
- Реакции с неметаллами
- Cr + O2 = (t) Cr2O3
- Cr + S = (t) Cr2S3
- Cr + N2 = (t) CrN
- Cr + C = Cr2C3
- Реакция с водой
- Реакции с кислотами
- Реакции с солями менее активных металлов
Уже на воздухе вступает в реакцию с кислородом: на поверхности металла образуется пленка из оксида хрома (III) — Cr2O3 — происходит пассивирование. Реагирует с неметаллами при нагревании.

Протекает в раскаленном состоянии. Cr + H2O = (t) Cr(OH)3 + H2↑
Cr + HCl = CrCl2 + H2↑  Cr + H2SO4(разб.) = CrSO4 + H2↑ С холодными концентрированными серной и азотной кислотой реакция не идет. Она начинается только при нагревании. Cr + H2SO4 = (t) Cr2(SO4)3 + SO2↑ + H2O
Cr + H2SO4(разб.) = CrSO4 + H2↑ С холодными концентрированными серной и азотной кислотой реакция не идет. Она начинается только при нагревании. Cr + H2SO4 = (t) Cr2(SO4)3 + SO2↑ + H2O
Хром способен вытеснить из солей металлы, стоящие в ряду напряжений правее него. Cr + CuSO4 = CrSO4 + Cu
Соединения хрома (II)
Соединение хрома (II) носят основный характер. Оксид хрома (II) окисляется кислородом воздуха до более устойчивой формы — оксида хрома (III), реагирует с кислотами, кислотными оксидами.

- CrO + O2 = Cr2O3
- CrO + H2SO4 = CrSO4 + H2O
- CrO + SO3 = CrSO4
- Гидроксид хрома (II), как нерастворимый гидроксид, легко разлагается при нагревании на соответствующий оксид и воду, реагирует с кислотами, кислотными оксидами.

- Cr(OH)2 = (t) CrO + H2O
- Cr(OH)2 + HCl = CrCl2 + H2O
- Cr(OH)2 + SO3 = CrSO4 + H2O
- Соединения хрома (III)
Это наиболее устойчивые соединения, которые носят амфотерный характер. К ним относятся оксид хрома (III) гидроксид хрома (III).

Оксид хрома (III) реагирует как с щелочами, так и с кислотами. В реакциях с щелочами при нормальной температуре (в растворе) образуются комплексные соли, при прокаливании — смешанные оксиды. С кислотами оксид хрома (III) образует различные соли.
- H2O + NaOH + Cr2O3 → Na3[Cr(OH)6] (в растворе, гексагидроксохромат натрия)
- Cr2O3 + Ba(OH)2 → (t°) Ba(CrO2)2 + H2O (прокаливание, хромит бария)
- Cr2O3 + 2NaOH → (t°) 2NaCrO2 + H2O (прокаливание, хромит натрия)
- Cr2O3 + HCl = CrCl3 + H2O (сохраняем степень окисления Cr+3)

- Оксид хрома (III) реагирует с более активными металлами (например, при алюминотермии).
- Cr2O3 + Al = Al2O3 + Cr
- При окислении соединение хрома (III) получают соединения хрома (VI) (в щелочной среде).
- K3[Cr(OH)6] + H2O2 = K2CrO4 + KOH + H2O
- Cr2O3 + 8NaOH + O2 = (t) Na2CrO4 + H2O
- Соединения хрома (VI)
В этой степени окисления хром проявляет кислотные свойства. К ним относится оксид хрома (VI) — CrO3, и две кислоты, находящиеся в растворе в состоянии равновесия: хромовая — H2CrO4 и дихромовая кислоты — H2Cr2O7.
Принципиально важно помнить окраску хроматов и дихроматов (часто она бывает дана в заданиях в качестве подсказки). Хроматы окрашивают раствор в желтый цвет, а дихроматы — в оранжевый цвет.

Хроматы переходят в дихроматы с увеличением кислотности среды (часто в реакциях с кислотами). Цвет раствора меняется с желтого на оранжевый.
- Na2CrO4 + H2SO4 = Na2Cr2O7 + Na2SO4 + H2O
- Если же оранжевому раствору дихромата прилить щелочь, то он сменит свой цвет на желтый — образуется хромат.
- Na2Cr2O7 + NaOH = Na2CrO4 + H2O
- Разложение дихромата аммония выглядит очень эффектно и носит название «вулканчик» ?
- (NH4)2Cr2O7 = (t) Cr2O3 + N2↑ + H2O
В степени окисления +6 соединения хрома проявляют выраженные окислительные свойства.
K2Cr2O7 + HCl = CrCl3 + KCl + Cl2↑ + H2O
Железо
Является одним из самых распространенных элементов в земной коре (после алюминия), составляет 4,65% ее массы.
Для железа характерны две основные степени окисления +2, +3, +6.
В природе железо встречается в виде следующих соединений:
- Fe2O3 — красный железняк, гематит
- Fe3O4 — магнитный железняк, магнетит
- Fe2O3*H2O — бурый железняк, лимонит
- FeS2 — пирит, серый или железный колчедан
- FeCO3 — сидерит
Получение
Получают железо восстановлением из его оксида — руды. Восстанавливают с помощью угарного газа, водорода.
CO + Fe2O3 = Fe + CO2↑
H2 + Fe2O3 = Fe + H2O
Основными сплавами железа являются чугун и сталь. В стали содержание углерода менее 2%, меньше содержится P, Mn, Si, S. Чугун отличается бо́льшим содержанием углерода (2-6%), содержит больше P, Mn, Si, S.
Химические свойства
- Реакции с неметаллами
- Fe + S = FeS (t > 700°C)
- Fe + S = FeS2 (t < 700°C)
- Fe + O2 = Fe3O4 (при горении железа образуется железная окалина — Fe3O4 — смесь двух оксидов FeO*Fe2O3)
- При нагревании железо взаимодействует с галогенами, азотом, фосфором, углеродом, кремнием и другими.
- Fe + Cl2 = (t) FeCl3
- Fe + P = (t) FeP
- Fe + C = (t) Fe3C
- Fe + Si = (t) FeSi
- Реакции с кислотами
- Железо активнее водорода, способно вытеснить его из кислот.
- Fe + HCl = FeCl2 + H2↑
- На воздухе железо покрывается пленкой оксида, из-за чего пассивируется во многих реакциях, в том числе с концентрированными холодными серной и азотной кислотами.
- Fe + H2SO4(разб.) = FeSO4 + H2↑
- Реакции с солями
- Восстановительные свойства
- Железо способно восстанавливать соединения железа +3 до +2.
- Fe + Fe2O3 = (t) FeO
- Fe + FeCl3 = (t) FeCl2
Реакция с концентрированными кислотами идет только при нагревании. В холодных серной и азотной кислотах железо пассивируется.
Fe + H2SO4(конц.) = Fe2(SO4)3 + SO2↑ + H2O
Железо способно вытеснить из солей металлы, стоящие в ряду напряжений правее железа.
CuCl2 + Fe = FeCl2 + Cu
Соединения железа (II) проявляют основные свойства. Реагируют c кислотами. При разложении гидроксид железа (II) распадается на соответствующий оксид и воду.
- FeO + H2SO4 = FeSO4 + H2O
- Fe(OH)2 + HCl = FeCl2 + H2O
- Fe(OH)2 = (t) FeO + H2O
При хранении на открытом воздухе соли железа (II) приобретают коричневый цвет из-за окисления до железа +3.
FeCl2 + H2O + O2 = Fe(OH)Cl2
Качественной реакцией на ионы Fe2+ в растворе является реакция с красной кровяной солью — K3[Fe(CN)6] — гексацианоферратом (III) калия. В результате реакции образуется берлинская лазурь (прусский синий).
FeCl2 + K3[Fe(CN)6] = KFe[Fe(CN)6] + KCl
Качественной реакцией на ионы Fe2+ также является взаимодействие с щелочью (гидроксидом натрия). В результате выпадает осадок зеленого цвета.
FeCl2 + NaOH = Fe(OH)2 + NaCl
Соединения железа (III) проявляют амфотерные свойства. Оксид и гидроксид железа (III) реагирует и с кислотами, и с щелочами.
- Fe(OH)3 + H2SO4 = Fe2(SO4)3 + H2O
- Fe(OH)3 + KOH = K3[Fe(OH)6] (гексагидроксоферрат калия)
- При сплавлении комплексные соли не образуются из-за испарения воды.
- Fe(OH)3 + KOH = (t) KFeO2 + H2O
Гидроксид железа (III) — ржавчина, образуется на воздухе в результате взаимодействия железа с водой в присутствии кислорода. При нагревании легко распадается на воду и соответствующий оксид.
Fe + H2O + O2 = Fe(OH)3
Fe(OH)3 = (t) Fe2O3 + H2O
Качественной реакцией на ионы Fe3+ является взаимодействие с желтой кровяной солью K4[Fe(CN)6]. В результате реакции образуется берлинская лазурь (прусский синий).
- FeCl3 + K4[Fe(CN)6] = KFe[Fe(CN)6] + KCl
- Реакция хлорида железа (III) с роданидом калия также является качественной, в результате нее образуется характерный раствор ярко красного цвета.
- FeCl3 + KCNS = Fe(CNS)3 + KCl
И еще одна качественная реакция на ионы Fe3+ — взаимодействие с щелочью (гидроксидом натрия). В результате выпадает осадок бурого цвета.
FeCl3 + NaOH = Fe(OH)3 + NaCl
Соединения железа (VI) — ферраты — соли несуществующей в свободном виде железной кислоты. Обладают выраженными окислительными свойствами.
- Ферраты можно получить в ходе электролизом щелочи на железном аноде, а также действием хлора на взвесь Fe(OH)3 в щелочи.
- Fe + KOH + H2O = (электролиз) K2FeO4 + H2↑
- Fe(OH)3 + Cl2 + KOH = K2FeO4 + KCl + H2O
Медь
Один из первых металлов, освоенных человеком вследствие низкой температуры плавления и доступности получения руды.
Основные степени окисления меди +1, +2.
Медь встречается в самородном виде и в виде соединений, наиболее известные из которых:
- CuFeS2 — медный колчедан, халькопирит
- Cu2S — халькозин
- Cu2CO3(OH)2 — малахит
- Получение
- Пирометаллургический метод получения основан на получении меди путем обжига халькопирита, который идет в несколько этапов.
- CuFeS2 + O2 = Cu2S + FeS + SO2↑
- Cu2S + O2 = Cu2O + SO2
- Cu2O + Cu2S = Cu + SO2
- Гидрометаллургический метод заключается в растворении минералов меди в разбавленной серной кислоте и дальнейшем вытеснении меди более активными металлами, например — железом.
- CuSO4 + Fe = Cu + FeSO4
- Медь, как малоактивный металл, выделяется при электролизе солей в водном растворе на катоде.
- CuSO4 + H2O = Cu + O2 + H2SO4 (медь — на катоде, кислород — на аноде)
- Химические свойства
- Реакции с неметаллами
- Во влажном воздухе окисляется с образованием основного карбоната меди.
- Cu + CO2 + H2O + O2 = (CuOH)2CO3
- При нагревании реагирует с кислородом, селеном, серой, при комнатной температуре с: хлором, бромом и йодом.
- 4Cu + O2 = (t) 2Cu2O (при недостатке кислорода)
- 2Cu + O2 = (t) 2CuO (в избытке кислорода)
- Реакции с кислотами
- Cu + H2SO4(конц.) = (t) CuSO4 + SO2↑ + H2O
- Cu + HNO3(конц.) = Cu(NO3)2 + NO2↑ + H2O
- Cu + HNO3(разб.) = Cu(NO3)2 + NO↑ + H2O
- С оксидами неметаллов
- Медь способна восстанавливать неметаллы из их оксидов.
- Cu + SO2 = (t) CuO + S
- Cu + NO2 = (t) CuO + N2↑
- Cu + NO = (t) CuO + N2↑
Cu + Se = (t) Cu2Se
Cu + S = (t) Cu2S
Медь способна реагировать с концентрированными серной и азотной кислотами. С разбавленной серной не реагирует, с разбавленной азотной — реакция идет.
Реагирует с царской водкой — смесью соляной и азотной кислот в соотношении 1 объем HNO3 к 3 объемам HCl.
Cu + HCl + HNO3 = CuCl2 + NO + H2O
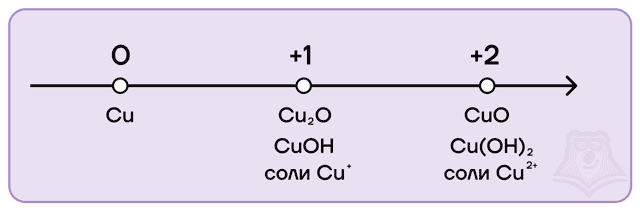
Соединения меди I
В степени окисления +1 медь проявляет основные свойства. Соединения меди (I) можно получить путем восстановления соединений меди (II).
- CuCl2 + Cu = CuCl
- CuO + Cu = Cu2O
- Оксид меди (I) можно восстановить до меди различными восстановителями: угарным газом, алюминием (алюминотермией), водородом.
- Cu2O + CO = (t) Cu + CO2
- Cu2O + Al = (t) Cu + Al2O3
- Cu2O + H2 = (t) Cu + H2O
- Оксид меди (I) окисляется кислородом до оксида меди (II).
- Cu2O + O2 = (t) CuO
- Оксид меди (I) вступает в реакции с кислотами.
- Cu2O + HCl = CuCl + H2O
- Гидроксид меди CuOH неустойчив и быстро разлагается на соответствующий оксид и воду.
- CuOH → Cu2O + H2O
Соединения меди (II)
Степень окисления +2 является наиболее стабильной для меди. В этой степени окисления у меди есть оксид CuO и гидроксид Cu(OH)2. Данные соединения проявляют преимущественно основные свойства.
- Оксид меди (II) получают в реакциях термического разложения гидроксида меди (II), реакцией избытка кислорода с медью при нагревании.
- Cu(OH)2 = (t) CuO + H2O
- Cu + O2 = (t) CuO
- Химические свойства
- Реакции с кислотами
- Разложение
- Восстановление
- CuO + CO = Cu + CO2
- CuO + C = Cu + CO
- CuO + H2 = Cu + H2O
CuO + H2SO4 = CuSO4 + H2O CuO + HCl = CuCl2 + H2O
CuO = (t) Cu2O + O2
Гидроксид меди (II) — Cu(OH)2 — получают в реакциях обмена между растворимыми солями меди и щелочью.
CuSO4 + KOH = K2SO4 + Cu(OH)2↓
- Разложение
- Реакции с кислотами
- Реакции с щелочами
- Реакции с кислотными оксидами
- Cu(OH)2 + CO2 = (CuOH)2CO3 + H2O (дигидроксокарбонат меди (II) — (CuOH)2CO3)
- Обратите особое внимание на реакцию взаимодействия соли меди (II) — сульфата меди (II), карбоната натрия и воды.
- CuSO4 + Na2CO3 + H2O = (CuOH)2CO3 + Na2SO4 + CO2
При нагревании гидроксид меди (II), как нерастворимое основание, легко разлагается на соответствующий оксид и воду. Cu(OH)2 = (t) CuO + H2O
Cu(OH)2 + HNO3 = Cu(NO3)2 + H2O Cu(OH)2 + HCl = CuCl2 + H2O
Как сказано выше, гидроксид меди (II) носит преимущественно основный характер, однако способен проявлять и амфотерные свойства. В растворе концентрированной щелочи он растворяется, образуя гидроксокомлпекс. Cu(OH)2 + LiOH = Li2[Cu(OH)4]
Переходные элементы: медь, хром, железо — Умскул Учебник
- Что такое переходные металлы;
- Основные характеристики меди, хрома и железа;
- Их физические и химические свойства.
К переходным элементам относятся такие, которые расположены в побочных подгруппах больших периодов периодической системы Д.И. Менделеева. К ним принадлежат d– и f–элементы.
Название «переходные» связано с тем, что переходные элементы расположены между s– и р–элементами.
Мы рассмотрим три металла: железо, хром и медь.
Железо — металл VIIIB-группы четвёртого периода. Его особенностью, как и особенностью других переходных металлов, является наличие валентных электронов как на внешнем (4s), так и на предвнешнем (3d) подуровнях.
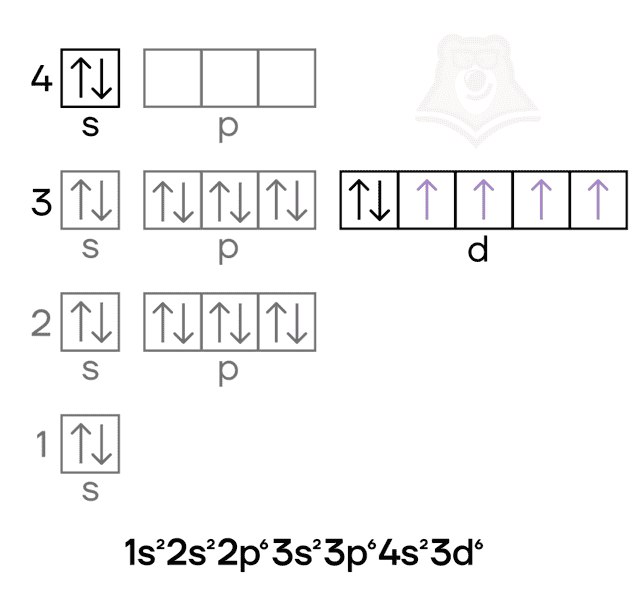
Хром — металл VIB-группы четвёртого периода. Как и железо, это d-элемент, у которого валентные электроны находятся и на внешнем слое и на предвнешнем подуровне. Помимо этого, в атоме хрома в основном состоянии происходит провал электрона.
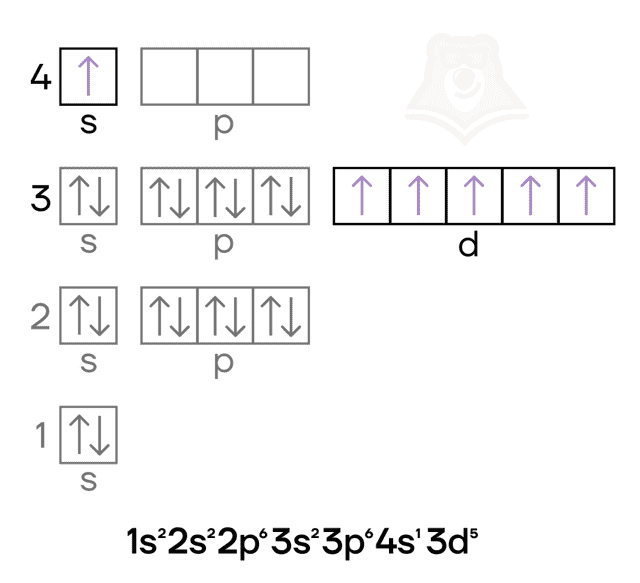
Железо и хром имеют идентичный набор степеней окисления, а также возможных оксидов и гидроксидов: 0, +2, +3, +6.
Медь — металл IB-группы четвёртого периода. Как и в случае других элементов побочных подгрупп, особенностью для неё является наличие валентных электронов как на внешнем (4s), так и на предвнешнем (3d) подуровнях. Как и у хрома, у меди в электронной конфигурации наблюдается провал электрона.
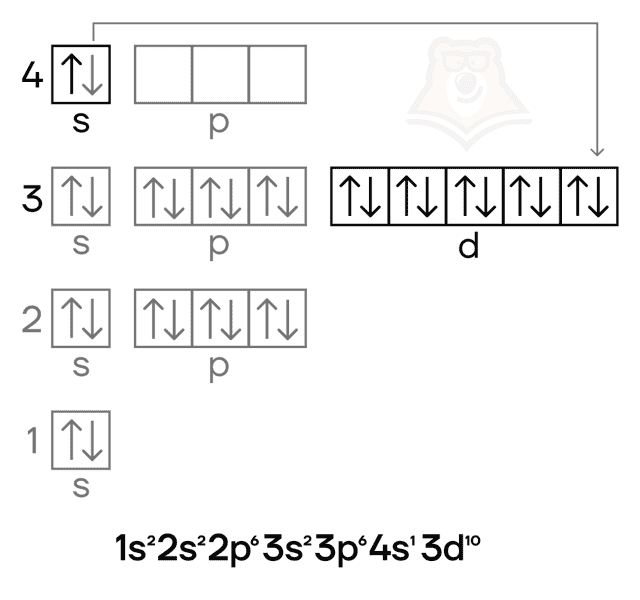
Степени окисления меди следующие:
- низшая степень окисления равна 0, как и у всех металлов;
- высшая равна +2;
- промежуточная равна +1.
Физические свойства
По физическим свойствам железо и хром — совершенно типичные металлы серебристо-белого цвета, которые не растворяются в воде, а на воздухе покрываются прочной оксидной плёнкой.
Особенностью железа является его быстрая коррозия (то есть окисление) кислородом во влажном воздухе, а особенностью хрома — высокая твёрдость: он является одним из самых твёрдых металлов.
Медь же — металл красного цвета, один из четырёх металлов, имеющих явную цветовую окраску, которая отлична от серой или серебристой.
Хром и его соединения
Кларк в земной коре 3,5-1% по массе. Основная хромовая руда — FeO • Cr2O3 (хромистый железняк). Был открыт в составе руды РbСrO4(крокоит). Хром в переводе с греч. означает «цвет, краска» (многие природные и синтетические соединения Сr имеют яркую разнообразную окраску).
Чистый хром — очень твердый тугоплавкий металл голубовато-серебристого цвета. Имеет самую большую твердость из всех применяемых в промышленности металлов. Т. пл. 1890°С, плотность 7,19 г/см.
- 24Cr [Ar]3d54s1
- Изотопы:
- 50Cr (4.35 %)
- 52Cr (83,79 %)
- 53Cr (9.50 %)
- 54Cr (2.36 %)
- ЭО 1,6
- E°Cr0/Cr3+ -0,74 В
При образовании соединений с другими элементами хром может использовать от 1 до 6 валентных электронов. Наибольшую устойчивость и практическую значимость имеют соединения, в которых атомы Сг находятся в степенях окисления +2, +3, +6.
С повышением степени окисления атомов Сг в оксидах и гидроксидах их основный характер ослабевает,а кислотный — усиливается. В этом же направлении происходит замена восстановительной активности на окислительную.
Некоторые важнейшие соединения хрома
| Cr+2 | Cr+3 | Cr+6 | |||
| Оксиды | CrOосновный | Cr2O3амфотерный | CrO3кислотный | ||
| Гидроксиды | Cr(OH)2слабое основание | Cr(OH)3 ↔ HCrO2 + H2Oамфотерный гидроксид | 2H2CrO4 ↔ H2Cr2O7 + H2O сильные кислоты | ||
| Соли | CrCl2,CrSO4,Cr(NO3)2,CrS | Тип ICrCl3,Cr(SO4)3,Cr(NO3)3 | Тип IIKCrO2,Ca(CrO2)2,Fe(CrO2)2хромиты | хроматыK2CrO4,Na2(CrO4)2,BaCrO4,PbCrO4 | дихроматыK2Cr2O7,Na2Cr2O7,(NH4)2Cr2O7 |
| Окислительно-восстановительная функция | Сильные восстановители | Окислители и восстановители | Сильные окислители |
- 1. Алюминотермический: Сr2O3 + 2Al = Аl2O3 + 2Сr
- 2. Силикотермический: 2Сr2O3 + 3Si = 3SiO2 + 4Cr
- 3. Электролитический: 2CrCl3 = 2Сr + 3Cl2
Химические свойства
Поверхностная оксидная пленка является причиной инертности хрома при обычной температуре, благодаря чему этот металл не подвергается атмосферной коррозии (в отличие от железа).
При нагревании хром проявляет свойства довольно активного металла, что соответствует его положению в электрохимическом ряду напряжений.
1. Взаимодействие с O2
Тонкоизмельченный хром интенсивно горит в токе кислорода. На воздухе реакция с O2 происходит лишь на поверхности металла.
4Сr + 3O2 = 2Сr2O3
При осторожном окислении амальгамированного хрома образуется низший оксид CrO.
2. Взаимодействие с другими неметаллами
- (Сr не взаимодействует с Н2, но поглощает его в больших количествах)
- 2Cr + 3Cl2 = 2CrCl3
- Cr + S = CrS
- CrCl3 и CrS — ионные соединения.
- 2Cr + N2 = 2CrN
- Cr + C → CrxCy
- CrN и rxCy — ковалентные тугоплавкие инертные вещества, по твердости сравнимы с алмазом.
3. Взаимодействие с разбавленными растворами HCl и H2SO4
Сr + 2HCl = СrСl2 + Н2↑
Сr + H2SO4 = CrSO4 + Н2↑
4. Действие концентрированных HNO3, H2SO4 и «царской водки» на хром
Эти кислоты не растворяют хром при обычной температуре, они переводят его в «пассивное» состояние.
Пассивацию можно частично снять сильным нагреванием, после чего хром начинает очень медленно растворяться в кипящих конц. HNO3, H2SO4, «царской водке».
- Сr + 6HNO3 = Cr(NO3)3 + 3NO2↑ + 3H2O
- 2Сr + 6H2SO4 = Cr2(SO4)3 + 3SO2↑ + 6H2O
- Царская водка — смесь концентрированных HNO33 и НСl (1:3), растворяет золото и платиновые металлы (Pd,Os,Ru).
5. Вытеснение малоактивных Me из водных р-ров солей
Сr + CuSO4 = CrSO4 + Сu
Сr + Pb(NO3)2 = Cr(NO3)2 + Pb
6. Взаимодействие с солями, разлагающимися с образованием кислорода
2Сr + KIO3 = Сr2O3 + KCl
2Сr + 3NaNO3 = Сr2O3 + 3NaNO2
Соединения Cr (II)
СrO — оксид хрома (II). Твердое черное вещество, н. р. в Н2O.
Способы получения
- 1) медленное окисление хрома, растворенного в ртути
- 2Сr + O2 = 2СrO
- 2) обезвоживание Сr(ОН)2 в восстановительной атмосфере:
- Сr(ОН)2 = СrO + H2O
Химические свойства
СrO — неустойчивое вещество, легко окисляется при небольшом нагревании до Сr2O3; при более высоких Т диспропорционирует:
3СrО = Сr + Сr2O3
СrO — типичный основный оксид, проявляет характерные для этого класса свойства. Реакции необходимо проводить в восстановительной среде.
Сr(OН)2 — гидроксид хрома (II) твердое желтое вещество, н. р. в Н2O.
Получают обменными реакциями из солей Сr2+:
CrCl2 + 2NaOH = Сr(ОН)2 + 2NaCl
Химические свойства
- Неустойчивое вещество, разлагается при нагревании; на воздухе быстро окисляется с образованием зеленого гидроксида хрома (III);
- 4Сr(ОН)2 + O2 + 2Н2O = 4Сr(ОН)3
- желтый → зеленый
Соли Сr2+
Наиболее важные: CrCl2, CrSO4, (СН3СОО)2Сr. Гидратированный ион Сr2+ имеет бледно-голубую окраску.
Способы получения:
- 1. Сr + неметалл (S, Hal2)
- Сr + 2HCl(r) = CrCl2 + Н2
- 2. Восстановление солей Сr3+:
- 2СrСl3 + Н2 = 2CrCl2 + 2HCl
Химические свойства
- 1. Соли Сr2+ — сильные восстановители, так как очень легко окисляются до солей Сr3+
- 4CrCl2 + 4HCl + O2 = 4СrСl3 + 2Н2О
- 2.
Раствор CrSO4 в разбавленной H2SO4 — превосходный поглотитель кислорода:
- 4CrSO4 + O2 + 2H2SO4 = 2Cr2(SO4)3 + 2Н2О
- 3.
С аммиаком соли Сr2+ образуют комплексные соли — аммиакаты:
- CrCl2 + 6NH3 = [Cr(NH3)6]Cl2
- Для Сr2+ характерно образование двойных сульфатов, например: K2Cr(SO4)2• 6Н2O
Соединения Сr(III)
Сr2О3 — оксид хрома (III), важнейшее природное соединение хрома. Сr2О3, полученный химическими методами, представляет собой темно-зеленый порошок.
Способы получения
- 1. Синтез из простых веществ:
- 4Сr + 3O2 = 2Сr2О3
- 2. Термическое разложение гидроксида хрома (III) или дихромата аммония:
- 2Сr(ОН)3 = Сr2O3 + 3Н2O
- (NH4)2Cr2O7 = Сr2O3 + N2 + 4Н2O
- 3. Восстановление дихроматов углеродом или серой:
- К2Сr2O7 + S = Сr2O3 + K2SO4
- Сr2O3 используется для изготовления краски «хромовая зеленая», обладающей термо- и влагоустойчивостью.
Химические свойства
- Сr2O3 — типичный амфотерный оксид
- В порошкообразном виде реагирует с сильными кислотами и сильными щелочами, в кристаллическом виде — химически инертное вещество.
- К наиболее практически важным реакциям относятся следующие:
- 1.
Восстановление с целью получения металлического хрома:
- Сr2O3 + 2Al = 2Сr + Аl2O3
- 2. Сплавление с оксидами и карбонатами активных металлов:
- Сr2O3 + МgО = Мg(СrO2)2
- Сr2O3 + Na2CO3 = 2NaCrO2 + CO2
- Образующиеся метахромиты являются производными метахромистой кислоты НСrO2.
- 3.
Получение хлорида хрома (III):
- Сr2O3 + ЗС + 3Cl2 = 2СrСl3 + ЗСО
- Сr2O3 + ЗССl4 = 2СrСl3 + ЗСОСl2
Сr(ОН)3 — гидроксид хрома (III)
- Образуется в виде синевато-серого осадка при действии щелочей на соли Сr3+:
- СrСl3 + 3NaOH = Сr(ОН)3 + 3NaCl
- Практически нерастворимый в воде гидроксид может существовать в виде коллоидных растворов.
В твердом состоянии гидроксид хрома (III) имеет переменный состав Сr2O3• nН2O. Теряя молекулу воды, Сr(ОН)3 превращается в метагидроксид СrО(ОН).
Химические свойства
- Сr(ОН)3 — амфотерный гидроксид, способный растворяться как в кислотах, так и в щелочах:
- Cr(OH)3 + 3HCl = СrСl3 + ЗН2O
- Сr(ОН)3 + ЗН+ = Сr3+ + ЗН2O
- Сr(ОН)3 + 3NaOH = Na3(Cr(OH)6]
- Сr(ОН)3 + ЗОН- = [Cr(OH)6]3-гексагидроксохромитанион
- При сплавлении с твердыми щелочами образуются метахромиты:
- Сr(ОН)3 + NaOH = NaCrO2 + 2Н2O
Соли Cr3+
Растворением осадка Сr(ОН)3 в кислотах получают нитрат Cr(NO3)3, хлорид СrСl3, сульфат Cr2(SO4)3 и другие соли. В твердом состоянии чаще всего содержат в составе молекул кристаллизационную воду, от количества которой зависит окраска соли.
- Самой распространенной является двойная соль КСr(SO4)2• 12H2O — хромокалиевые квасцы (сине-фиолетовые кристаллы).
- Хромиты, или хроматы (III) — соли, содержащие Сr3+ в составе аниона. Безводные хромиты получают сплавлением Сr2O3 с оксидами двухвалентных металлов:
- Сr2O3 + МеО = Ме(СrO2)2 метахромиты
- В водных растворах хромиты существуют в виде гидроксокомплексов.
Химические свойства
- К наиболее характерным свойствам солей Cr(III) относятся следующие:
- 1. Осаждение катиона Сг3+ под действием щелочей:
- Сr3+ + ЗОН- = Сr(ОН)3
- Характерный цвет осадка и его способность растворяться в избытке щелочи используется для отличия ионов Сг3+ от других катионов.
- 2.
Легкая гидролизуемость в водных растворах, обусловливающая сильнокислый характер среды:
- Сr3+ + Н2O = СrОН2+ + Н+
- Соли Сr (III) с анионами слабых и летучих кислот в водных растворах не существуют; так как подвергаются необратимому гидролизу, например:
- Cr2S3 + 6Н2O = 2Сr(ОН)3 + 3H2S
- 3.
Окислительно-восстановительная активность:
- а) окислитель: соли Cr(III) → соли(VI)
- см. «Получение солей Cr(VI)»
- б) восстановительь: соли Cr(III) → соли(II)
- см. «Получение солей Cr(II)»
- 4.
Способность к образованию комплексных соединений — аммиакатов и аквакомплексов, например:
- СrСl3 + 6NH3 = [Cr(NH3)6]Cl3
Соединения Cr(VI)
CrO3 — оксид хрома (VII) триоксид хрома, хромовый ангидрид
Кристаллическое вещество темно-красного цвета, очень гигроскопичное, легко растворимое в воде. Основной способ получения:
К2Сr2O7(кр.) + H2SO4 = 2CrO3 + K2SO4 + Н2O
Химические свойства
- СrО3 — кислотный оксид, активно взаимодействует с водой и щелочами, образуя хромовые кислоты и хроматы.
- Хромовый ангидрид — чрезвычайно энергичный окислитель. Например, этанол воспламеняется при соприкосновении с СrO3:
- С2Н6ОН + 4СrO3 = 2CO2 + ЗН2O + 2Сr2O3
- Продуктом восстановления хромового ангидрида, как правило, является Сr2O3.
Хромовые кислоты — Н2СrO4, Н2Сr2O7
Химические свойства
- При растворении CrO3 в воде образуются 2 кислоты:
- CrO3 + Н2O = Н2СrO4 хромовая
- 2CrO3 + Н2O = Н2Сr2O7 дихромовая
- Обе кислоты существуют только в водных растворах.
Между ними устанавливается равновесие:
- 2Н2СrO4 = Н2Сr2O7 + Н2O
- Обе кислоты очень сильные, по первой ступени диссоциированы практически полностью:
- Н2СrO4 = Н+ + НCrO4-
- Н2Сr2O7 = Н+ + НСr2O7-
Хроматы (VI) — соли, содержащие анионы хромовой кислоты CrO42-. Почти все имеют желтую окраску (реже — красную).
В воде хорошо растворяются только хроматы щелочных металлов и аммония. Хроматы тяжелых металлов н. р. в Н2O. Наиболее распространены: Na2CrO4, К2CrO4, РЬCrO4 (желтый крон).
Способы получения
- 1. Сплавление CrO3 с основными оксидами, основаниями:
- CrO3 + 2NaOH = Na2CrO4 + Н2O
- 2. Окисление соединений Cr(III) в присутствии щелочей:
- 2К3[Сr(ОН)6]+ ЗВr2+ 4КОН = 2К2СrO4 + 6КВr + 8Н2O
- 3. Сплавление Сr2O3 со щелочами в присутствии окислителя:
- Сr2О3 + 4КOН + КClO3 = 2К2СrO4 + KCl + 2Н2O
Химические свойства
- Хроматы существуют только в разбавленных щелочных растворах, которые имеют желтую окраску, характерную для анионов СrO42-. При подкислении раствора эти анионы превращаются в оранжевые дихромат-анионы:
- 2СrO42- + 2Н+ = Сr2O72- + Н2O Это равновесие мгновенно сдвигается в ту или иную сторону при изменении рН растворов.
- Хроматы — сильные окислители.
- При нагревании хроматы тяжелых металлов разлагаются; например:
- 4Нg2СrO4 = 2Сr2O3 + 8Нg + 5O2
- Дихроматы (VI) — соли, содержащие анионы дихромовой кислоты Сr2O72-
В отличие от монохроматов имеют оранжево-красную окраску и обладают значительно лучшей растворимостью в воде. Наиболее важные дихроматы — К2Сr2O7, Na2Cr2O7, (NH4)2Cr2O7.
Их получают из соответствующих хроматов под действием кислот, даже очень слабых, например:
2Na2CrO4 + 2СO2 + Н2O → Na2Cr2O7 + 2NaHCO3
Химические свойства
Водные растворы дихроматов имеют кислую среду вследствие устанавливаемого равновесия с хроматанионами (см. выше). Окислительные свойства дихроматов наиболее сильно проявляются в подкисленных растворах:
Сr2O72- + 14Н+ + 6e- = 2Сr3+ + 7Н2O
При добавлении восстановителей к кислым растворам дихроматов окраска резко изменяется от оранжевой до зеленой, характерной для соединений Сг3+.
Примеры ОВР с участием дихроматов в качестве окислителей
- K2Cr2O7 + 14HCl = 2CrCl3 + 3Cl2↑ + 2KCl +7Н2О
- K2Cr2O7 + 3H2S + 4H2SO4 = Cr2(SO4)3 + 3S↓ + K2SO4
- K2Cr2O7 + 3SO2 + H2SO4 = Cr2(SO4)3 + K2SO4 + H2O
- Эта реакция используется для получения хромокалиееых квасцов KCr(SO4)2 • 12H2O
- K2Cr2O7 + 6HI + 4H2SO4 = Cr2(SO4)3 + 3I2↓ + K2SO4 + 7H2O
- K2Cr2O7 + 6FeSO4 +7H2SO4 = 3Fe2(SO4)3 + Cr2(SO4)3 + K2SO4 + 7H2O
- K2Cr2O7 + H2O2 + 4H2SO4 = Cr2(SO4)3 + K2SO4 + 3O2↑ + 7H2O
- 2K2Cr2O7 + 3CH3OH + 8H2SO4 = Cr2(SO4)3 + 3HCOOH + 2K2SO4 + 11H2O
- 8K2Cr2O7 + 3C12H22O11 + 32H2SO4 = 8Cr2(SO4)3 + 12CO2↑ + 8K2SO4 + 43H2O
- Сплавление:
- Na2Cr2O7 + 2C = Cr2O3 + Na2CO3 + CO↑
- Очень сильным окислителем является «хромовая смесь» — насыщенный раствор K2Cr2O7 или Na2Cr2O7 в концентрированной H2SO4.
Металл для кальяна. Сплавы и марки. Все о кальянах и табаках
- Электрохимический ряд напряжений металлов
- Электролиз
- Коррозия металлов
Ou brille l’ardent metal!.. — Люди гибнут за металл! Наверняка, многие слышали эту фразу из куплетов Мефистофеля (опера Гуно «Фауст»). Трудно не согласиться с автором, ведь металлы действительно играют чрезвычайно важную роль в жизни человека.
Большинство, известных современной науке, химических элементов являются металлами (их более 80). Металлы входят в большинство неорганических соединений.
Наибольшую химическую активность проявляют щелочные и щелочноземельные металлы, которые образуют наиболее типичные для металлов химические соединения.
Еще одним существенным нюансом является тот факт, что соединения некоторых металлов Ia и IIa групп (литий, калий, магний, кальций) принимают участие во многих химико-биологических процессах, протекающих в клетках живых организмов.
Общие физические свойства металлов
Благодаря наличию свободных электронов («электронного газа») в кристаллической решетке все металлы проявляют следующие характерные общие свойства:
Сварочные аппараты из подручных материалов
1) Пластичность — способность легко менять форму, вытягиваться в проволоку, прокатываться в тонкие листы.
2) Металлический блеск и непрозрачность. Это связано со взаимодействием свободных электронов с падающими на металл светом.
3) Электропроводность. Объясняется направленным движением свободных электронов от отрицательного полюса к положительному под влиянием небольшой разности потенциалов. При нагревании электропроводность уменьшается, т.к. с повышением температуры усиливаются колебания атомов и ионов в узлах кристаллической решетки, что затрудняет направленное движение «электронного газа».
4) Теплопроводность. Обусловлена высокой подвижностью свободных электронов, благодаря чему происходит быстрое выравнивание температуры по массе металла. Наибольшая теплопроводность — у висмута и ртути.
5) Твердость. Самый твердый – хром (режет стекло); самые мягкие – щелочные металлы – калий, натрий, рубидий и цезий – режутся ножом.
6) Плотность. Она тем меньше, чем меньше атомная масса металла и больше радиус атома. Самый легкий — литий (ρ=0,53 г/см3); самый тяжелый – осмий (ρ=22,6 г/см3). Металлы, имеющие плотность менее 5 г/см3 считаются «легкими металлами».
7) Температуры плавления и кипения. Самый легкоплавкий металл – ртуть (т.пл. = -39°C), самый тугоплавкий металл – вольфрам (t°пл. = 3390°C). Металлы с t°пл. выше 1000°C считаются тугоплавкими, ниже – низкоплавкими.
Оптимальная толщина металла
Выбрать материал для мангала – половина дела. Не менее важно не промахнуться с толщиной металла. Все жаровни делят на две категории:
- Тонкостенные. Чаще всего к ним относятся переносные модели. Небольшая толщина (2-3 мм) позволяет значительно облегчить вес. Такие мангалы менее долговечны, но их вполне хватает на несколько сезонов. В мангалах с тонкими стенками нельзя готовить угли. Долгий жар приведет к быстрому прогоранию корпуса. Угли придется брать покупные или делать заблаговременно на костре. Также в этом варианте можно сжечь мясо;
- Толстостенные. Чаще используются стационарно. Такие варианты принято изготавливать из листа 4 мм толщины. Они ощутимо тяжелее, дороже, но и уверенно служат много лет. Шашлык в толстостенном устройстве прожаривается равномернее, хорошо сохраняет сочность.
Разобравшись в конструкции мангала, можно самостоятельно изготовить смешанный вариант. Сочетание металла разной толщины позволит достигнуть компромисса веса с прочностью.
Оптимальным решением станет жаровня с днищем из стали 4 мм, стенками 2-3 мм. Боковины соединяются ребрами из четверки. Винтовые отверстия при этом делают овальными с учетом расширения металла при нагреве.
Такое сочетание снизит вес изделия, но убережет стенки от деформации. Мясо будет равномерно прожариваться, если шампур вовремя переворачивать.
Общие химические свойства металлов
Сильные восстановители: Me0 – nē → Men+
Ряд напряжений характеризует сравнительную активность металлов в окислительно-восстановительных реакциях в водных растворах.
I. Реакции металлов с неметаллами
1) С кислородом: 2Mg + O2 → 2MgO
В чем отличия импульсного паяльника от обычного
- 2) С серой: Hg + S → HgS
- 3) С галогенами: Ni + Cl2 –t°→ NiCl2
- 4) С азотом: 3Ca + N2 –t°→ Ca3N2
- 5) С фосфором: 3Ca + 2P –t°→ Ca3P2
- 6) С водородом (реагируют только щелочные и щелочноземельные металлы): 2Li + H2 → 2LiH
- Ca + H2 → CaH2
II. Реакции металлов с кислотами
- 1) Металлы, стоящие в электрохимическом ряду напряжений до H восстанавливают кислоты-неокислители до водорода:
- Mg + 2HCl → MgCl2 + H2
- 2Al+ 6HCl → 2AlCl3 + 3H2
- 6Na + 2H3PO4 → 2Na3PO4 + 3H2
- 2) С кислотами-окислителями:
- При взаимодействии азотной кислоты любой концентрации и концентрированной серной с металлами водород никогда не выделяется!
- Zn + 2H2SO4(К) → ZnSO4 + SO2 + 2H2O
- 4Zn + 5H2SO4(К) → 4ZnSO4 + H2S + 4H2O
Как выбрать редуктор на газовый баллон?
- 3Zn + 4H2SO4(К) → 3ZnSO4 + S + 4H2O
- 2H2SO4(к) + Сu → Сu SO4 + SO2 + 2H2O
- 10HNO3 + 4Mg → 4Mg(NO3)2 + NH4NO3 + 3H2O
- 4HNO3(к) + Сu → Сu (NO3)2 + 2NO2 + 2H2O
III. Взаимодействие металлов с водой
- 1) Активные (щелочные и щелочноземельные металлы) образуют растворимое основание (щелочь) и водород:
- 2Na + 2H2O → 2NaOH + H2
- Ca+ 2H2O → Ca(OH)2 + H2
- 2) Металлы средней активности окисляются водой при нагревании до оксида:
- Zn + H2O –t°→ ZnO + H2
- 3) Неактивные (Au, Ag, Pt) — не реагируют.
IV. Вытеснение более активными металлами менее активных металлов из растворов их солей:
- Cu + HgCl2 → Hg+ CuCl2
- Fe+ CuSO4 → Cu+ FeSO4
- В промышленности часто используют не чистые металлы, а их смеси — сплавы
, в которых полезные свойства одного металла дополняются полезными свойствами другого.
Так, медь обладает невысокой твердостью и малопригодна для изготовления деталей машин, сплавы же меди с цинком (латунь ) являются уже достаточно твердыми и широко используются в машиностроении.
Алюминий обладает высокой пластичностью и достаточной легкостью (малой плотностью), но слишком мягок.
На его основе готовят сплав с магнием, медью и марганцем — дуралюмин (дюраль), который, не теряя полезных свойств алюминия, приобретает высокую твердость и становится пригодным в авиастроении. Сплавы железа с углеродом (и добавками других металлов) — это широко известные
чугун
и
сталь.
Металлы в свободном виде являются восстановителями.
Однако реакционная способность некоторых металлов невелика из-за того, что они покрытыповерхностной оксидной пленкой , в разной степени устойчивой к действию таких химических реактивов, как вода, растворы кислот и щелочей.
Например, свинец всегда покрыт оксидной пленкой, для его перехода в раствор требуется не только воздействие реактива (например, разбавленной азотной кислоты), но и нагревание. Оксидная пленка на алюминии препятствует его реакции с водой, но под действием кислот и щелочей разрушается. Рыхлая оксидная пленка (ржавчина
- ), образующаяся на поверхности железа во влажном воздухе, не мешает дальнейшему окислению железа.
- Под действием концентрированных
- кислот на металлах образуетсяустойчивая оксидная пленка. Это явление называется
- пассивацией
- серной кислоте
- При взаимодействии с окислителями в кислых растворах большинство металлов переходит в катионы, заряд которых определяется устойчивой степенью окисления данного элемента в соединениях (Nа+, Са2+,А13+,Fе2+ и Fе3+)
. Так, в концентрированной пассивируются (и после этого не реагируют с кислотой) такие металлы, как Ве, Вi, Со, Fе, Мg и Nb, а в концентрированной азотной кислоте — металлы А1, Ве, Вi, Со, Сг, Fе, Nb, Ni, РЬ, Тh и U.
Восстановительная активность металлов в кислом растворе передается рядом напряжений. Большинство металлов переводится в раствор соляной и разбавленной серной кислотами, но Сu, Аg и Нg — только серной (концентрированной) и азотной кислотами, а Рt и Аи — «царской водкой».
Коррозия металлов
Нежелательным химическим свойством металлов является их коррозия, т. е. активное разрушение (окисление) при контакте с водой и под воздействием растворенного в ней кислорода (кислородная коррозия).
Например, широко известна коррозия железных изделий в воде, в результате чего образуется ржавчина, и изделия рассыпаются в порошок.
Коррозия металлов протекает в воде также из-за присутствия растворенных газов СО2 и SО2; создается кислотная среда, и катионы Н+ вытесняются активными металлами в виде водорода Н2 (водородная коррозия
Устройство и принцип работы газовых горелок
).
Особенно коррозионно-опасным может быть место контакта двух разнородных металлов (контактная коррозия).
Между одним металлом, например Fе, и другим металлом, например Sn или Сu, помещенными в воду, возникает гальваническая пара. Поток электронов идет от более активного металла, стоящего левее в ряду напряжений (Ре), к менее активному металлу (Sn, Сu), и более активный металл разрушается (корродирует).
Именно из-за этого ржавеет луженая поверхность консервных банок (железо, покрытое оловом) при хранении во влажной атмосфере и небрежном обращении с ними (железо быстро разрушается после появления хотя бы небольшой царапины, допускающей контакт железа с влагой). Напротив, оцинкованная поверхность железного ведра долго не ржавеет, поскольку даже при наличии царапин корродирует не железо, а цинк (более активный металл, чем железо).
Сопротивление коррозии для данного металла усиливается при его покрытии более активным металлом или при их сплавлении
; так, покрытие железа хромом или изготовление сплава железа с хромом устраняет коррозию железа. Хромированное железо и сталь, содержащая хром (нержавеющая сталь ), имеют высокую коррозионную стойкость.
Общие способы получения металлов в промышленности:
• электрометаллургия
, т. е. получение металлов электролизом расплавов (для наиболее активных металлов) или растворов солей;
• пирометаллургия
, т. е. восстановление металлов из руд при высокой температуре (например, получение железа в доменном процессе);
• гидрометаллургия
, т. е. выделение металлов из растворов их солей более активными металлами (например, получение меди из раствора СuSO4 действием цинка, железа или алюминия).
В природе иногда встречаются самородные металлы (характерные примеры — Аg, Аu, Рt, Нg), но чаще металлы находятся в виде соединений (металлические руды
). По распространенности в земной коре металлы различны: от наиболее распространенных — Аl, Nа, Са, Fе, Мg, К, Тi) до самых редких — Вi, In, Аg, Аu, Рt, Rе.
ТОП-10 самых прочных металлов в мире
Популярное
Середина мая 2020: рост золота и паника на биржах
Инвесторы разного уровня стали понимать, что «коронавирусный кризис» будет ещё долго ослаблять мировую экономику, хотя многие надеялись на скорейшее возвращение к прежней жизни. На этом фоне цена золота растёт.
Штиль перед цунами, или чего ожидать на рынках и золоте
Период консолидации приближается к завершению и рынки готовятся к следующей фазе сверхвысокой волатильности — похожей на то, что мы видели в марте 2020 г. Какие золотые монеты лучше всего покупать в России?
Не стоит забывать о серебре
Лучше всего покупать серебро, когда его курс серьёзно уступает котировкам золота. Нужный момент можно определить, посмотрев на соотношение их стоимости. Данный показатель недавно достиг рекордного максимума.
TD Securities: золото на пути к 2000$ за унцию
Аналитики банка TD Securities считают, что после длительной стагнации на отметке 1700$ за унцию у золота появляется шанс на возобновление роста до 2000$, так как на рынке наблюдается рост интереса к золоту.
EB Tucker: в 2020 году золото установит новый рекорд
Рост цены золота до отметки 1500$ за унцию в прошлом году стал неожиданностью для многих инвесторов. С тех пор перспективы золота только улучшились. Инвесторы направляют свои капиталы в акции ETF-фондов.
SP Angel: цена золота готова для продолжения роста
Цена золота, судя по всему, готова продолжить восходящий тренд на фоне опасений по поводу возможного начала второй волны распространения COVID-19. Рынок золота будет получать поддержку от притока капитала в ETF-фонды.
Добыча золота в США по итогам января 2020
Добыча золота в США по итогам января 2020 года застыла на отметке 17 т., что считается очень низким объёмом по сравнению с лучшими временами. Спад производства происходит на фоне роста мировой цены драгметалла.
Май 2020: спрос на золото в Китае
Спрос на физическое золото в Китае начинает снова расти, так как частные инвесторы используют каждое снижение цен, чтобы увеличить свои инвестиции. В других странах спрос на драгметалл остаётся сдержанным.
США: чистый экспорт золота 40 месяцев подряд
Соединённые Штаты Америки продолжают вот уже 40 месяцев подряд экспортировать больше золота за границу, чем его импортировать. Однако, эта тенденция была сломлена на короткий срок из-за карантина.
Опередит ли Австралия Китай по добыче золота?
Золотодобывающая отрасль развивается в целом хорошо в условиях эпидемии коронавируса, в то время как другие отрасли экономики пострадали в значительной степени. Об этом говорится в обзоре Resources Monitor.
Что такое обезличенные металлические счета?
Под обезличенным металлическим счетом понимается специальный счет, отражающий количество драгметалла, которое принадлежит клиенту банка.
Важной его особенностью выступает отсутствие информации о конкретном производителе металла, его пробе или номере слитка.
При этом клиенту предоставляется возможность приобрести или реализовать металл банку без излишних формальностей в виде проверки слитков или их физической передачи из рук в руки.
Другими словами, ОМС представляет собой право обладания драгоценным металлом, которое не сопровождает необходимостью его поиска на рынке, получения, хранения, проверки состояния и других достаточно обременительных и специфических функций. Все перечисленные обязанности берет на себя банк, что удобно и выгодно обеим сторонам. Клиент получает надежный вариант инвестиций и сбережения средств, а банк – возможность привлечения дополнительных финансовых ресурсов.
Динамика
Особенности рынка драгоценных металлов и изменения цен на нем хорошо показывает сравнение в динамике двух ключевых параметров – цены тройской унции золота (традиционная мера веса для этого металла, равная 31,1035 грамма) и биржевого индекса отечественной ММВБ. Для получения более объективной картины целесообразно рассмотреть достаточно длительный период – с 1998 по текущий год. Первый показатель указывается в долларах США, второй – в традиционных пунктах.
Анализ диаграммы наглядно демонстрирует несколько важных моментов:
- при стабильной финансово-экономической ситуации в стране динамика стоимости золота практически не уступает росту биржевого индекса;
- при наступлении любого кризиса – 2 из них (в 1998 и в 2008 году) показаны на диаграмме, третий (в 2014 году) не отмечен, но также четко прослеживается – рост цен на золото стремительно обгоняет индекс, который не менее быстро обваливается;
- огромная разница в динамике во время кризисов позволяет золоту с легкостью компенсировать незначительное отставание во времена роста экономики.
Исходя из проведенного анализа, можно сделать несколько очевидных выводов:
- золото (как и остальные драгоценные металлы, динамика которых в целом аналогична) – это намного более надежный актив, чем акции фондового рынка;
- при прогнозировании кризисных явлений целесообразно переводить активы именно в драгоценные металлы;
- при стабильно растущей экономике России разумно сохранять часть активов в золоте и других металлах, что обеспечит так называемую подушку безопасности и сохранность средств при любом развитии событий. Тем более, что предсказывать кризисы удается далеко не всем;
- независимо от ситуации на финансовых рынках и в экономике, вложение в золото – самый гарантированный актив, надежно сохраняющий средства владельца и часто позволяющий ему заработать.
Общий вывод, с которым согласны большинство экспертов заключается в следующем. Золото и другие драгметаллы в виде ОМС Сбербанка далеко не всегда позволяют заработать много, но гарантируют достаточно стабильный доход. При этом они точно исключат потерю накоплений владельца.
( 2 оценки, среднее 4 из 5 )






