- 1.4.8 Реакции окислительно-восстановительные. Коррозия металлов и способы защиты от неё
- Реакции окислительно-восстановительные. Коррозия металлов и способы защиты от нее
- Понятие о степени окисления (С.О.)
- Сущность окислительно-восстановительных реакций
- Типичные окислители
- Типичные восстановители
- Разновидности ОВР
- Составление ОВР методом электронного баланса
- Коррозия металлов
- Защита от коррозии
- Значение ОВР
- 1.4.8. Реакции окислительно-восстановительные. Коррозия металлов и способы защиты от нее
- Виды окислительно-восстановительных реакций
- Межмолекулярные ОВР
- Внутримолекулярные ОВР
- Реакции диспропорционирования
- Расстановка коэффициентов в окислительно-восстановительных реакциях
- Метод электронного баланса
- Окислители
- Восстановители
- Коррозия металлов и способы защиты от нее
- Способы защиты металлов от коррозии
Новости Библиотека Таблица эл-тов Биографии Карта сайтов Ссылки О сайте
Изделия из металлов и их сплавов, кроме золота и платины, под действием воздуха, дождей, почвенной влаги могут разрушаться, образуя соединения, устойчивые к окружающей среде.
Особенно сильному химическому воздействию подвергаются металлы в аппаратах химической промышленности: здесь на металл действуют кислород, кислоты, щелочи и другие вещества, часто при высоких температурах и повышенных давлениях.
Разрушение металлов и сплавов вследствие химического взаимодействия с окружающей средой называется коррозией (от латинского слова «корродере» — разъедать).
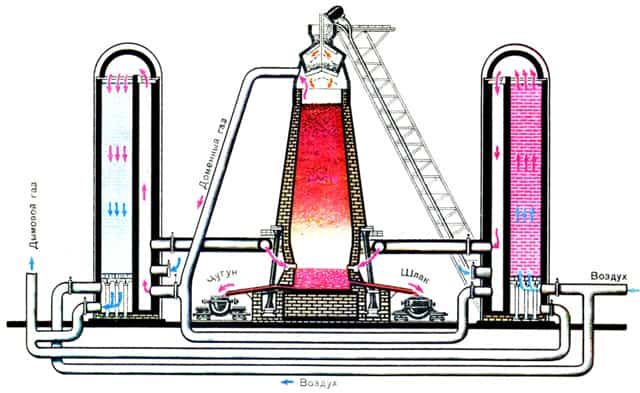 Доменное производство
Доменное производство
В результате коррозии качество изделия и сооружений ухудшается. Они могут стать даже совершенно непригодными к использованию.
При громадном и все возрастающем количестве 1 машин и металлических сооружений, применяемых в промышленности, в сельском хозяйстве и на транспорте, огромное значение имеет предохранение их от коррозии.
Удлинение срока службы машин и сооружений увеличивает мощь нашего социалистического государства, ускоряет его продвижение по пути к коммунизму. Поэтому постоянная борьба с коррозией представляет собой исключительно важную задачу. Но чтобы бороться с коррозией, нужно знать, как она протекает.
- Коррозия металлов — это окислительно-восстановительный процесс, при котором атомы металла окисляются и переходят в ионы, например:
- Fe — 2 = Fe2+
- Сu — 2 = Сu2+
Что способствует и что препятствует коррозии? Выяснцм эти вопросы путем опытов, привлекая те сведения о ржавлении железа, которые вы получили ранее.
Коррозия железа происходит, как нам известно, при участии кислорода и воды. Поместим железный гвоздь в пробирку, наполним ее доверху водой и опрокинем, зажав отверстие пальцем, в сосуд с водой, после чего вытесним воду из пробирки кислородом.
Таким же образом заготовим другие пробирки с такими же гвоздями, но вместо воды в пробирки и сосуды, в которые они будут опрокинуты, нальем раствор поваренной соли. В одном случае к этому раствору добавим немного раствора едкого натра. К одному из гвоздей заранее прикрутим медную проволоку, к другому — полоску цинка.
Спустя примерно сутки мы увидим картину, представленную на рисунке 64. На нем указано, что погружено (железо, находящееся в контакте с цинком, с медью) и в какой раствор погружено (в воду, в раствор поваренной соли, без добавки или с добавкой едкого натра).
О том, как протекала коррозия в каждом случае, вы можете судить по количеству израсходованного кислорода, т. е. по поднятию уровня жидкости в пробирке и по характеру осадившегося в воде продукта коррозии.
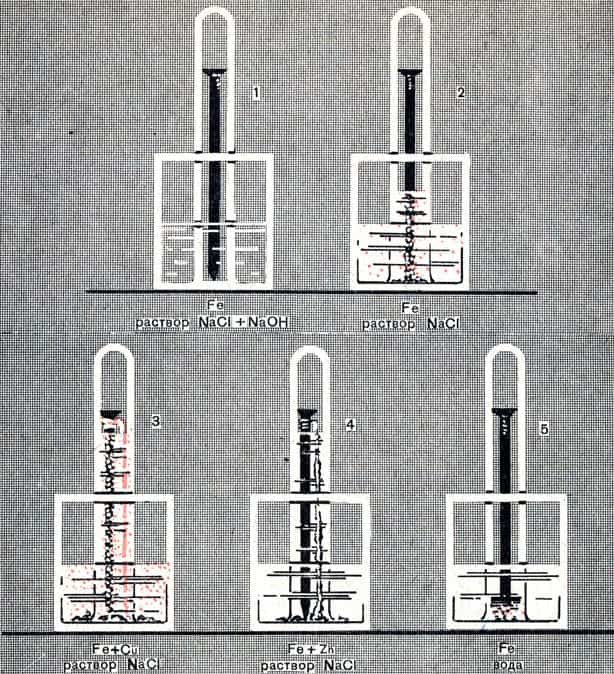 Рис. 64. Коррозия металлов
Рис. 64. Коррозия металлов
Сравним результаты опытов 2 и 3. В обоих случаях железо находилось в одном и том же растворе, но в одном случае оно соприкасалось с медью, а в другом — нет. И там и здесь произошла коррозия и осадился бурый осадок гидроокиси железа (III).
Но в опыте 2 ржавчины получилось мало, а в опыте 3 — много. Соответственно этому и расход кислорода в опыте 2 был мал — уровень раствора в пробирке поднялся невысоко, в опыте 3 — велик.
Таким образом, коррозия, или ржавление железа резко усиливается, когда оно соприкасается с медью.
Сравним теперь результаты опытов 2 и 4. В обоих случаях железо находилось в одном и том же растворе, но в одном случае оно соприкасалось с цинком, а в другом — нет. Наблюдается сильная коррозия: много израсходовалось кислорода и получился обильный осадок.
Но в опыте 2 осадок бурого цвета, это ржавчина. А в опыте 4 осадок получился чисто-белого цвета. Белый осадок — это гидроокись цинка. Следовательно, в опыте 4 корродировало не железо, а цинк.
Таким образом, железо практически не корродирует, если оно соприкасается с цинком.
Усиление коррозии в первом случае и прекращение во втором объясняется возникновением гальванических элементов.
Так, при соприкосновении железа с цинком возникает гальванический элемент, в котором цинк, как более активный металл, будет окисляться, переходя в ионы Zn2+, а отщепляющиеся от его атомов электроны будут перетекать на поверхность железа и восстанавливать ионы водорода, содержащиеся в омывающем металл растворе. Водород на поверхности железа либо выделяется в свободном виде, либо его атомы, не успев сцепиться в молекулы, окисляются растворенным в воде кислородом в воду. Обычно происходит последнее.
При соприкосновении железа с медью тоже возникает гальванический элемент, но в нем будет окисляться в качестве более активного металла железо. На поверхности обоих металлов и в соприкасающемся с ними слое раствора происходят следующие реакции:
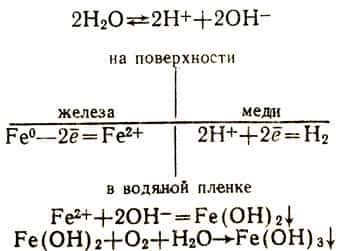
Коррозия металла резко усиливается, если он соприкасается с каким-либо другим менее активным металлом, т. е. расположенным в электрохимическом ряду напряжений правее его. Но коррозия резко ослабляется, если металл соприкасается с другим металлом, расположенным левее в электрохимическом ряду напряжений, т. е. более активным.
Сравним результаты опытов 1 и 2. Добавка к воде поваренной соли усилила коррозию железа — получилось много ржавчины и много израсходовалось кислорода. Добавка к раствору поваренной соли едкого натра, как видно из опыта 5, наоборот, ослабила коррозию — ржавчины получилось мало и кислорода израсходовалось немного.
Таким образом, скорость коррозии данного металла зависит, во-первых, от того, соприкасается или нет этот металл с каким-нибудь другим металлом и каким именно, а во-вторых, от состава омывающей металл среды
Одни составные части омывающей металл среды, в частности ионы хлора, усиливают коррозию металлов, другие составные части могут ослаблять коррозию. Так, коррозия железа ослабляется в присутствии ионов гидроксила.
В приморских местностях коррозия металлических сооружений идет энергичнее, чем вдали от моря. Это объясняется присутствием в морской воде ионов хлора. Брызги морской воды, испаряясь, выделяют в воздух кристаллики растворенных в морской воде солей, а эти кристаллики, растворяясь в водяной пленке на металлах, доставляют в нее ионы хлора.
Теперь мы можем понять широко используемые на практике способы предупреждения коррозии, борьбы с нею.
Чем больше разнятся друг от друга по химической активности два соприкасающихся металла, тем сильнее корродирует o более активный из них и тем надежнее защищен от коррозии второй, менее активный металл.
Поэтому недопустимо, например, наличие в конструкции из алюминиевого сплава деталей из меди и ее сплавов (см. положение алюминия и меди в электрохимическом ряду напряжений).
Если же таких вредных контактов в конструкции нельзя избежать, то стараются обезвредить эти контакты, например, нанесением на них лакокрасочных покрытий.
Защитным действием более активных металлов на менее активные пользуются для предохранения от коррозии подземных трубопроводов и корпусов судов. К трубопроводам присоединяют, а с борта судна при длительных стоянках опускают в воду слитки из сплавов металлов, расположенных близко к началу ряда напряжений — магния или цинка.
Для предохранения металлических изделий от коррозии их изолируют от внешней среды, покрывая лаками, красками, смазками, защитными слоями других металлов. Покрытие должно быть стойким в данной среде, достаточно плотным и иметь хорошее сцепление с металлом.
В некоторых случаях скорость коррозии можно значительно снизить, введя в действующую жидкую среду в небольшом количестве вещества, способствующие образованию на поверхности металла защитной пленки. Такие вещества называют ингибиторами — замедлителями коррозии. Наибольшее применение нашли органические замедлители коррозии.
Введение их, например, в соляную кислоту позволяет хранить и перевозить ее в стальной таре вместо хрупких стеклянных бутылей. Соляная кислота с добавкой ингибитора нашла применение для очистки котлов от накипи и очистки поверхности металлов от ржавчины и окалины. Окислы металлов в ней растворяются, а металл не растворяется.
Воду, поступающую в паровые котлы, обезвреживают, удаляя из нее растворенный кислород.
- Как изменится течение коррозии в опыте 4, если в пробирку будет помещена такая же полоска цинка, но не связанная с железом? Ответ мотивируйте.
- Перечислите известные вам способы борьбы с коррозией металлов.
Составьте опись предметов, обслуживающих вас дома, в которых применены металлы и сплавы. В каждом случае укажите, как связано данное применение металла с его физическими свойствами. Не забудьте включить в перечень такие предметы, как зеркало, медицинский термометр, электрическую лампочку. Отметьте случаи коррозии этих предметов, если они наблюдались.
1.4.8 Реакции окислительно-восстановительные. Коррозия металлов и способы защиты от неё
- Видеоурок: Окислительно-восстановительные реакции
- Лекция: Реакции окислительно-восстановительные. Коррозия металлов и способы защиты от неё
- Реакции окислительно-восстановительные
Наиболее распространенными среди химических реакций являются окислительно – восстановительные. Без них не была бы возможна сама жизнь, поскольку дыхание, обмен веществ, нервная деятельность и многие другие процессы являются окислительно – восстановительными. Важнейшие процессы на планете, а именно круговороты веществ сопровождаются данным типом реакций. В быту мы часто пользуемся данными реакциями, к примеру, для отбеливания и дезинфекции. Важнейшее значение окислительно – восстановительные реакции играют в промышленности, в частности металлургии. Как вам известно, металлы в природе встречаются в виде руды. И восстановление металлов из руды происходит как раз с помощью данных реакций. Также с помощью них получают лекарственные препараты. Значение окислительно – восстановительных реакций очень велико.
Прежде чем перейти к изучению сущности окислительно – восстановительных реакций вспомните, что такое степень окисления. Окислительно – восстановительные реакции в обязательном порядке протекают с изменением степени окисления элементов.
К данному типу реакции можно отнести все химические реакции замещения, а также реакции соединения, разложения, в которых обязательно принимает участие одно какое — либо простое вещество. Все химические реакции обмена протекают без изменения степени окисления.
Окисление — это определенный процесс отдачи электронов, приводящий к повышению степени окисления.
Химические вещества, атомы или ионы которых отдают электроны, именуют восстановителями. При отдаче электронов они окисляются, а их степень окисления повышается.
Например: H20 — 2ē → 2H+; Fe+2 — ē → Fe+3.
Типичные окислители:
| Галогены | |
| Перманганат калия | KMnO4 |
| Манганат калия | K2MnO4 |
| Оксид марганца (IV) | MnO2 |
| Дихромат калия | K2Cr2O7 |
| Хромат калия | K2CrO4 |
| Азотная кислота | HNO3 |
| Серная кислота | H2SO4 (конц) |
| Оксид меди(II) | CuO |
| Оксид свинца(IV) | PbO2 |
| Оксид серебра | Ag2O |
| Пероксид водорода | H2O2 |
| Хлорид железа(III) | FeCl3 |
| Бертоллетова соль | KClO3 |
| Анод при электролизе |
Восстановление — это такой химический процесс, при котором присоединяются электроны.
Данный процесс всегда приводит к понижению степени окисления. Вещества, атомы или ионы которых присоединяют электроны, именуют окислителями. Окислитель, при присоединении электронов, восстанавливается. Количество электронов, отданных восстановителем, всегда равно числу электронов, которые принял окислитель.
Например: S0 + 2ē → S-2; Mn+4 + 2ē → Mn+2.
Типичные восстановители:
| Металлы | |
| Водород | Н |
| Уголь | С |
| Оксид углерода (II) | CO |
| Сероводород | H2S |
| Оксид серы (IV) | SO2 |
| Сернистая кислота и ее соли | H2SO3 |
| Катионы металлов в низших степенях окисления | SnCl2, FeCl2, MnSO4, Cr2(SO4)3 |
| Азотистая кислота | HNO2 |
| Аммиак | NH3 |
| Оксид азота(II) | NO |
| Катод при электролизе |
В каких случаях вещество проявит себя окислителем, а в каких восстановителем? Для того, чтобы понять это, необходимо обратиться к Периодической таблице. При движении по таблице слева направо окислительные свойства веществ увеличиваются, а восстановительные уменьшаются и наоборот. А при движении сверху вниз увеличиваются восстановительные и уменьшаются окислительные свойства.
Есть и другой способ определения свойств вещества. Обращайте внимание на количество электронов внешнего энергетического уровня. Если в нем 1,2,3 или 4 электрона, то это восстановитель, он отдает свои электроны, а если 5,6,7 электронов – окислитель, который принимает чужие электроны.
По – разному ведут себя элементы в разных степенях окисления. Только окислителями являются элементы с высшей степенью окисления. Только восстановителями, элементы в низшей степени окисления. Возьмём, к примеру, соединения азота: HN+5O3 – окислитель; N-3Н3 – восстановитель.
Вещества, содержащие атомы в промежуточных положительных степенях окисления, могут и отдавать, и принимать электроны. Поэтому они являются восстановителями при действии более сильного окислителя, а окислителями становятся при действии более активного восстановителя. Сюда можно отнести KNO2, SO2, H2O2, Na2SO3.
Таким образом, вещества по окислительно-восстановительным свойствам подразделяются на:
- окислители;
- восстановители;
- окислители – восстановители.
Коррозия металлов и способы защиты от неё
Коррозия – это разрушение металлов и сплавов, впоследствии воздействия на них окружающей среды.
Коррозия – процесс окислительно – восстановительный. По механизму протекания различают два типа коррозии:
- химическую,
- электрохимическую.
Химическая обусловлена взаимодействием металлов с газами или жидкостями при высокой t. Наиболее сильный газовый окислитель – это кислород. Рассмотрим химическую коррозию железа. При взаимодействии кислорода с поверхностью железа образуется оксидная пленка – ржавчина:
- 3Fe + 2O2 → Fe3O4 (FeO•Fe2O3)
- Образовавшаяся рыхлая оксидная пленка легко пропускает газы и влагу, что способствует дальнейшей коррозии. Уравнение реакции коррозии железа в присутствии влаги выглядит так:
- 4Fe + 3O2 + 6H2O → 4Fe(OH)3

Электрохимическая коррозия – это разрушение металла в среде электролита с возникновением электрического тока. Начинается данный процесс с образованием гальванических (коррозийных) элементов при соприкосновении двух металлов, один из которых анод, а второй катод.
Данный тип коррозии отличен тем, что проходит в токопроводящей среде, под воздействием таких компонентов окружающей среды, как Н+, ОН-, О2, Cl-, Na+. Электрохимической коррозии подвергаются металлы в грунте, подводные части судов, трубопроводы и др.
В результате образуется ржавчина различной окраски. Какие именно окисли металла образуются зависит от давления, температуры, влажности, длительности процесса.
Рассмотрим пример электрохимической коррозии на паре железо – медь.
В любой паре разрушается металл, находящийся левее в ряду напряженности металлов. В названной паре левее расположено железо, оно и разрушается. А медь в данном случае не корродирует.
А в паре железо – цинк, разрушается цинк, поскольку он имеет больший отрицательный потенциал. Поэтому цинк может защитить железо от коррозии.
Коррозия приносит существенный вред человеку. И он всегда боролся с ней. Существует несколько методов, для защиты металлов от воздействия коррозии:
- Использование специальных защитных покрытий – изделие сверху покрывают другим металлом. То есть производят никелирование, хромирование или лужение. Металлические изделия обрабатывают лаками, красками, или эмалями.
- Использование легированных сплавов, обладающих стойкостью к коррозии.
- Применение электрохимической защиты металлических предметов. Это использование заклёпок, изготовленных из активного металла; прикрепление специальных пластин, изготовленных из более активного металла; нейтрализация тока, который возникает при коррозии, пропускаемый в обратном направлении.
- Так же можно изменить состав среды (например, добавить ингибиторы).
- Заменить коррозирующий металл, на какие — либо другие материалы. Например, на керамику, или пластмассу.
- Отшлифовать поверхности изделия, поддающегося коррозии.
| Предыдущий урок | Следующий урок |
Реакции окислительно-восстановительные. Коррозия металлов и способы защиты от нее
Реакции окислительно-восстановительные. Коррозия металлов и способы защиты от нее добавить в закладки
Среди тысяч химических превращений, которыми овладел человек, особое и самое большое место занимают окислительные и восстановительные процессы.
Они – суть самой жизни. В круговороте веществ на нашей планете, в осуществлении фотосинтеза, дыхания и метаболизма живыми организмами – всюду протекают взаимосвязанные реакции окисления и восстановления (ОВР).
Понятие о степени окисления (С.О.)
С.О. – основная характеристика состояния химических элементов.
Она условно обозначает заряд атома в химическом веществе, приобретенный этим атомом в процессе отдачи или принятия электронов от других элементов.
У элемента, отдавшего электрон, появляется положительная С.О., у принявшего электрон – отрицательная.
Важно помнить. В веществах молекулы электронейтральны, и сумма С.О. всех входящих в эти молекулы атомов будет всегда нулевой.
Это позволяет находить С.О. по формулам соединений.
Сущность окислительно-восстановительных реакций
Взаимодействия веществ с изменением С.О. атомов составляющих их элементов называют окислительно-восстановительными реакциями.
- В этой трансформации заключается их главный и характерный признак
- Ещё одно определение ОВ-реакций – это химическое преобразование, протекающее с переносом электронов от одних частиц (восстановителей) к другим (окислителям).
- 2Na0 + Cl20 = 2Na+Cl-
- Приведенный пример ОВР умозрительно можно представить состоящим из двух полуреакций:
2Na0 – 2e- = 2Na+ – здесь идёт отдача электроотрицательных частиц (электронов) от атома натрия, являющимся в данном случае восстановителем. Происходит окисление.
Во втором полупроцессе Cl2 + 2e- = 2Cl- – окислитель хлор, принимая электрон, участвует в восстановлении.
Усвоению этих процессов и обозначающих их терминов может помочь схема:

Советы для избежания путаницы в этих понятиях:
- Составить аббревиатуру по первым буквам терминов:
Окислитель – взял е- — восстановился → ОВВ Восстановитель – отдал е- — окислился → ВОО
- Выучить стихотворение:
Восстановитель — это тот, кто электроны отдает. Сам отдает грабителю, злодею-окислителю. Отдает — окисляется, сам восстановителем является.
Типичные окислители
- Сильными окислителями являются неметаллы в свободном состоянии: фтор F2, хлор Cl2, бром Br2, йод I2, кислород O2, озон O3, сера S и другие.
- группа кислородсодержащих кислот, в их числе: азотная HNO3, концентрированная серная Н2SO4, хромовая H2CrO4, а также соответствующие им оксиды N2O5, Mn2O7, CrO3.
- к менее сильным окислителям относятся соли вышеназванных кислородосодержащих кислот, например, KMnO4 (Mn+7), K2Cr2O7 (Cr+7).
- Положительно заряженные частицы металлов в самой высокой степени окисления меди Cu2+, олова Sn4+, железа Fe3+, ртути Hg2+, свинца Pb4+.
Типичные восстановители
- Простые вещества группы металлов, например, железо Fe0, цинк Zn0, алюминий Al0 и др.
- Положительно заряженные частицы металлов в самой низкой С.О., например, олова Sn2+, железа Fe2+, свинца Pb2+ и др.
- кислородсодержащие кислоты со своими окислами, в которых кислотообразующий элемент находится в низшей степени окисления, к примеру, сернистая кислота H2SO3, азотистая кислота HNO2 и т.д.
- группа бескислородных кислот и их солей: иодистовородная кислота НI, иодид калия KI, сероводород Н2S, сульфид натрия Na2S и т.д.
У веществ, содержащих атомы элементов с промежуточной С.О., может возникать окислительно-восстановительная двойственность.
Так, азотистокислый натрий будет восстановителем относительно сильных окислителей (K2Cr2O7) и окислителем относительно типичного восстановителя KI.
Разновидности ОВР
- Межмолекулярные. К ним относят ОВ-реакции, в которых С.О. меняются у атомов разных соединений.
C0 + O20 = C+4CO2-2; N20 + 3H20 = 2N-3H3+1.
- Внутримолекулярные. В этом случае и окислитель, и восстановитель являются атомами одного элемента:
2H2O2-1 = 2H2O-2 + O20; 2H2+1O2-2 = 2H20 +O20;
- Диспропорционирование. Другое название ОВ-реакция самоокисления-самовосстановления. В процессе её один и тот же элемент в одном и том же веществе выступает и как окислитель, и как восстановитель:
Cl20 + H2+O-2 = H+Cl- + H+Cl+O-2
Хлор Cl2 здесь и окисляющий и восстанавливающий элемент.
Составление ОВР методом электронного баланса
При написании ОВ-реакций важно соблюдать не только закон сохранения масс веществ до и после взаимодействия, но и равенство (баланс) электрических зарядов исходных реагентов и полученных продуктов.
При способе электронного баланса производится сравнение С.О.в левой и правой части уравнения. При этом необходимо знать формулы получаемых веществ.
Правило. В уравнении ОВР слева сначала записывается восстановитель, отдающий электроны, потом окислитель, их принимающий. Справа, в первую очередь пишут продукт окисления, потом восстановления, после все остальные вещества.
Пример составления уравнения ОВР углерода (С) с алюминием (Al).
Al + C → Al4C3
- Сначала следует определить элементы, изменившие свои С.О.
Al0 + C0 → Al4+3C3-4
- Алюминий, отдав три электрона, сменил С.О. с 0 до +3
Al0 → Al+3 1Al0 — 3e- → 1Al+3
- Углерод, приняв четыре электрона, сменил свою С.О. с 0 на – 4
C0 → C+4 1C0 + 4e- → 1C-4
- Далее уравнение нужно сбалансировать, подбирая множители. Число отданных Al электронов подставить в полуреакцию углерода C, а число принятых углеродом электронов записать в схему полуреакции алюминия:
4| 1Al0-3e- → 1Al+3
3| 1C0+4e- → 1C-4
В результате алюминий лишился 4×3 = 12 электронов, а углерод принял 3×4 = 12 электронов.
- Последний этап – уравнивание количества атомов слева и справа с помощью стехиометрических коэффициентов: реакцию вступило 4·1Al0=4Al0 атома алюминия и 3·1C0=3C0 атома углерода.
Окончательно уравнение выглядит так:
4Al0+3C0 = Al4+3C3-4
| ОКИСЛИТЕЛИ | |
|
|
Коррозия металлов
Разрушение металла от воздействий окружающей среды называется коррозией. По сути коррозия – химический окислительно-восстановительный процесс, зависящий от места, где он происходит.
Следует различать химическую (Х.К.) и электрохимическую (Э.Х.К.) коррозию.
- При химической коррозии металлы подвергаются деструкции от вредных влияний газов, жидкостей, не способных проводить электричество. Например, появление окалины на железе от контакта с кислородом при повышенных температурах. Или разрушение металлического оборудования, трубопроводов от воздействия сернистых соединений, содержащихся в нефтяных фракциях.
- Электрохимическая коррозия непосредственно связана с деструкцией металла в электролитном растворе под действием возникающего в нем электрического тока. Для возникновения разрушительных электрических токов необходим контакт металлов разной активности или наличие неоднородных участков на поверхности корродирующего металла. Таким электрохимическим разрушениям часто подвергаются морские корабли, котельное оборудование, заглублённые в почву металлические сооружения.
Справка. В мире ежегодно из-за коррозии теряется 25% произведённого человечеством железа!
Защита от коррозии
- Создание щадящих условий эксплуатации металлоконструкций и аппаратов. Размещение их в помещениях с пониженной влажностью, под навесами, защищающими от атмосферных воздействий.
- Нанесение защищающих неметаллических покрытий: красок, лаков, эмалей, полимерных плёнок (ПЭ, ПВХ).
- Обработка металлических изделий химическим способом для создания на них изолирующих оксидных, нитридных, фосфатных покрытий.
- Нанесение гальваническими технологиями защитных металлопокрытий: никелевых, хромовых, цинковых, кадмиевых.
- Оцинковывание железных листов термическим способом.
- Антикоррозионная защита электрохимическим методом:
- катодной защитой при подключении металлосооружения проводниками к катодному полюсу источника электротока или к куску более активного металла (протектору).
- Легирование металлов при их выплавке специальными добавками хрома, никеля, цинка (пример нержавеющей стали).
- Воздействие на агрессивную среду, в которой эксплуатируется металлический объект, например, добавлением в неё ингибиторов (замедлителей) коррозии или дегазацией – удаление газов, вызывающих разрушение.
Значение ОВР
В начале статьи говорилось о значении ОВ — процессов для жизни на Земле.
Люди научились применять их для своих нужд. Используют для получения металлов, необозримого количества веществ и материалов, для очистки окружающей среды от загрязняющих её продуктов своей жизнедеятельности.
Но познание глубин и тайн этих сложнейших явлений природы продолжается…
Смотри также:
1.4.8. Реакции окислительно-восстановительные. Коррозия металлов и способы защиты от нее
Окислительно-восстановительные реакции (ОВР) — такие реакции, которые протекают с изменением степеней окисления элементов.
Изменение степеней окисления происходит из-за полной или частичной передачи электронов от одних атомов к другим:
Поскольку электроны имеют заряд «-1» , следовательно, понижение степени окисления атома химического элемента происходит в результате приобретения им дополнительных электронов.
Процесс приобретения атомом дополнительных электронов называется восстановлением:
- Вещество, которое содержит восстанавливающиеся атомы, называют окислителем.
- В примере выше окислителем является азотная кислота HNO3.
- Аналогично повышение степени окисления происходит в том случае, когда атом элемента теряет некоторое количество своих электронов. Процесс потери атомом электронов называют окислением:
Химическое вещество, которое содержит окисляющиеся атомы, называют восстановителем. В указанном примере восстановителем является фосфин PH3.
Виды окислительно-восстановительных реакций
Межмолекулярные ОВР
Межмолекулярные окислительно-восстановительные реакции — такие реакции, в которых атомы окислителя и атомы восстановителя находятся в разных веществах. Например:
Внутримолекулярные ОВР
Внутримолекулярные окислительно-восстановительные реакции — такие реакции, в которых атомы восстановителя и атомы окислителя содержатся в одном веществе. Например:
Реакции диспропорционирования
Реакциями диспропорционирования называют такие реакции, в которых атомы одного химического элемента, являются окислителями и восстановителями и при этом находятся в одном веществе. Такие реакции также называют реакциями самоокисления-самовосстановления. Например, к таким реакциям относятся все реакции взаимодействия галогенов с растворами щелочей:
Расстановка коэффициентов в окислительно-восстановительных реакциях
Метод электронного баланса
Метод электронного баланса — метод расстановки коэффициентов в окислительно-восстановительной реакции, основанный на том, что количество электронов, отданных восстановителем, равно числу электронов, полученных окислителем.
Алгоритм расстановки коэффициентов данным методом выглядит следующим образом:
1) Следует записать схему реакции, указав формулы всех реагентов и продуктов. Например, при взаимодействии концентрированной серной кислоты с фосфором образуется фосфорная кислота, диоксид серы и вода:
2) Далее следует расставить все степени окисления и найти те элементы, у которых изменилось значение степени окисления.
3) После расстановки степеней окисления химических элементов находят те элементы, которые изменили свои степени окисления. Далее записывают уравнения полуреакций окисления и восстановления. В нашем случае они имеют вид:
4) Поскольку количество отдаваемых электронов восстановителем должно быть равно количеству принимаемых электронов окислителем, далее следует подобрать дополнительные множители к записанным полуреакциям:
- 5) Подобранные к полуреакциям множители переносятся в схему реакции:
- 6) Отталкиваясь от тех коэффициентов, которые уже известны из электронного баланса, оставшиеся коэффициенты расставляют методом подбора:
- Примечание:
- Следует отметить, что если в одной структурной единице какого-либо участника реакции содержится не один атом химического элемента, изменившего степень окисления, а 2 или больше, то это обязательно следует учитывать при записи уравнений полуреакций. Обратите внимание на составление электронного баланса для реакции горения этана в кислороде:
Как можно видеть в первом уравнении полуреакции, мы учли то, что в левой части уравнения уже сразу содержится не менее двух атомов углерода, поскольку одна формульная единица C2H6 содержит два атома C. По этой причине мы поставили коэффициент 2 перед атомами углерода в левой и правой частях полуреакции, а также удвоили количество «уходящих» электронов (14 вместо 7-ми).
Во второй полуреакции мы также учли, что в левой части уравнения реакции не может быть менее двух атомов кислорода, поскольку 2 атома O содержатся в одной молекуле O2. Однако как вы могли заметить, в случае простого вещества кислорода мы не стали писать 2O, а записали O2. Также следует поступать и в случае других простых молекулярных веществ, например, O2, F2, Cl2, N2, H2 и т.д.
Очевидно, что электронный баланс — не самая сложная часть в процессе составления уравнения окислительно-восстановительной реакции. Часто трудности возникают в том, какие продукты записывать в правой части схемы реакции.
Для того чтобы записывать уравнения ОВР, не нужно пытаться выучить все возможные реакции, тем более, что это невозможно в принципе. Надо учиться их составлять.
В первую очередь, что действительно следует выучить, так это формы существования окислителей и восстановителей до и после реакции в зависимости от среды раствора. Среда раствора определяется по наличию или отсутствию среди реагентов кислоты или щелочи.
Также всегда нужно помнить, что в качестве возможных продуктов не следует писать формулы веществ, реагирующих с остальными продуктами и/или со средой. Так, например, в продуктах не может быть кислоты, если изначально среда раствора щелочная и наоборот.
В общем, говоря более простыми словами, все продукты должны быть химически «безразличны» друг к другу, а также к среде раствора (исключение — электролиз).
Ниже представлены основные окислительно-восстановительные переходы окислителей и восстановителей в зависимости от среды. Во многих случаях указаны не целые формулы веществ, а формулы ионов, входящих в их состав.
В таком случае для записи уравнения реакции в молекулярном виде формулу иона требуется дополнить противоионами.
Катионы металлов, чаще всего, объединяют с кислотными остатками, если среда кислая, а анионы с катионами металлов (если среда щелочная) или водорода, если среда кислая или нейтральная.
Окислители
Восстановители
Коррозия металлов и способы защиты от нее
Коррозией металла называют процесс его самопроизвольного разрушения в результате контакта с окружающей средой.
Коррозия бывает химическая и электрохимическая.
Химическая коррозия — вид коррозии, при котором металл разрушается из-за его взаимодействия с газами или жидкостями, не проводящими электрический ток.
Так, например, к химической коррозии относится образование окалины при взаимодействии железа с кислородом при высоких температурах, а также разрушение металлического оборудования под действием нефтяных фракций, содержащих сернистые соединения.
Электрохимической коррозией называют разрушение металла в растворе электролита вследствие возникновения в данной системе электрических токов.
Электрические токи, способствующие коррозии, возникают в тех случаях, когда в растворе электролита изделие из металла контактирует с другим менее активным металлом.
Также такие токи могут появляться из-за химической неоднородности металлического материала, из которого выполнено изделие.
Так, например, из-за электрохимической коррозии страдают подводные части судов, паровые котлы, трубопроводы, металлические конструкции в почве и т.д.
Способы защиты металлов от коррозии
1) Контроль условий, в которых эксплуатируется металлическое оборудование. Например, хранение и использование изделий из стали на открытом воздухе нежелательно и этого, по возможности, следует избегать. Эксплуатация металлического оборудования в помещениях с низкой влажностью существенно продлит его срок службы.
2) Создание защитных покрытий, изолирующих металлоконструкцию от контакта с окружающей средой. Среди таких покрытий различают:
— неметаллические покрытия — всевозможные краски, лаки, эмали, а также пленки из таких полимеров, как полиэтилен, поливинилхлорид и т.д.;
— химические покрытия (оксидные, нитридные, фосфатные и т.д.) (Такие покрытия получают специальной химической обработкой поверхности металла.);
— металлические покрытия.
Металлические покрытия получают нанесением на защищаемую металлическую конструкцию тонкого слоя другого металла (чаще всего с помощью процесса электролиза).
При этом, если в качестве покрытия используется менее активный металл, то такое покрытие будет защищать металлоконструкцию только при условии его целостности. В случае, если целостность такого покрытия будет нарушена, защищаемый металл будет ускоренно корродировать.
Также широко используется покрытие металлоконструкций более активным металлом. Например, распространено использование так называемого оцинкованного железа.
Такое покрытие защищает металлические объекты даже при нарушении его целостности, поскольку пока практически полностью не исчезнет слой покрытия из более активного металла, коррозия металла, из которого сделан защищаемый объект, не начнется.
- 3) Электрохимические методы защиты:
- — катодная защита — вид защиты, при котором металлический объект подключается с помощью проводников к катоду внешнего источника тока либо же приводится в контакт с более активным металлом.
- Частный случай катодной защиты, при котором металлическая конструкция приводится в контакт с более активным металлом, называют протекторной защитой.
- 4) Изменение химических свойств среды, в которой эксплуатируется металлическое изделие, в частности:
- — добавление в среду веществ, замедляющих коррозию (ингибиторов коррозии).
- — дегазация среды (удаление растворенных в ней газов, в частности, кислорода). Например, такой метод работает для защиты от ржавления железа, поскольку в процессе ржавления железа активное участие принимает не только вода, но и кислород:
- 4Fe + 6H2O + 3O2 = 4Fe(OH)3






