- Сплавы
- Металлическая химическая связь — характеристика, способы образования и свойства
- Характерные кристаллические решетки
- Металлическая химическая связь
- Обсуждение: «Металлическая химическая связь»
- Общие физические и химические свойства металлов
- Общие химические свойства металлов
- 1. Реакции металлов с неметаллами
- 2. Реакции металлов с кислотами
- 3. Взаимодействие металлов с водой
- 4. Вытеснение более активными металлами менее активных металлов из растворов их солей:
- Коррозия металлов
- Металлическая связь
- Металлическая связь. Свойства металлической связи
- Механизм металлической связи
- Характерные кристаллические решётки
- Другие свойства
- Какие физические свойства металлов обуславливает металлическая связь
Как известно, все химические элементы и образуемые ими простые вещества делятся на металлы и неметаллы.
Так как в периодах и группах периодической системы Д.И.Менделеева существуют закономерности в изменении металлических и неметаллических свойств элементов, можно достаточно определенно указать положение элементов-металлов и элементов-неметаллов в периодической системе.
Если провести диагональ от бора к астату, то слева от этой диагонали в периодической системе все элементы являются металлами, а справа от нее элементы побочных подгрупп являются металлами, а элементы главных подгрупп – неметаллами.
Элементы, расположенные вблизи диагонали (например, Al, Ti, Ga, Ge, Sb, Te, As, Nb), обладают двойственными свойствами: в некоторых своих соединениях ведут себя как металлы, а в некоторых – проявляют свойства неметаллов.
Все s-элементы (кроме Н и Не), d-элементы (все элементы побочных подгрупп) и f-элементы (лантаноиды и актиноиды) являются металлами. Среди р-элементов есть и металлы, и неметаллы, число элементов-металлов увеличивается с увеличением номера периода.
 Самородки золота
Самородки золота
Атомы большинства металлов на внешнем электронном слое имеют от 1 до 3 электронов. Исключение: атомы германия, олова, свинца на внешнем электронном слое имеют четыре электрона, атомы сурьмы, висмута – пять, атомы полония – шесть.
Атомы металлов имеют меньший заряд ядра и больший радиус по сравнению с атомами неметаллов данного периода. Поэтому прочность связи внешних электронов с ядром в атомах металлов небольшая.
Атомы металлов легко отдают валентные электроны и превращаются в положительно заряженные ионы.
Простые вещества, которые образуют элементы-металлы, при обычных условиях являются твердыми кристаллическими веществами (кроме ртути).
Кристаллическая решетка металлов образуется за счет металлической связи.
Имеющиеся между узлами кристаллической решетки свободные электроны могут переносить теплоту и электрический ток, что является причиной главных физических свойств металлов – высокой электро- и теплопроводности.
- Все металлы – твердые вещества (кроме ртути).
- Для всех металлов характерны металлический блеск и непрозрачность.
- Все металлы – проводники теплоты и электрического тока. Металлы, характеризующиеся высокой электрической проводимостью, обладают и высокой теплопроводностью.
- Важными свойствами металлов являются их пластичность, упругость, прочность. Они способны под давлением изменять свою форму, не разрушаясь.
 Ртуть
Ртуть
По степени твердости металлы значительно отличаются друг от друга. Так, калий, натрий – мягкие металлы (их можно резать ножом); хром – самый твердый металл (царапает стекло).
Температуры плавления и плотности металлов также изменяются в широких пределах. Самый легкоплавкий металл – ртуть (tпл.= — 39 ̊ С), самый тугоплавкий – вольфрам (tпл.= 3380 ̊ С). Плотность лития – 0,59 г/см3, осмия – 22,48 г/см3.
- Металлы отличаются своим отношением к магнитным полям и делятся на три группы:
- — ферромагнитные металлы способны намагничиваться под действием слабых магнитных полей (железо, кобальт, никель, гадолиний);
- — парамагнитные металлы проявляют слабую способность к намагничиванию (алюминий, хром, титан, почти все лантаноиды);
- — диамагнитные металлы не притягиваются к магниту, даже слегка отталкиваются от него (олово, медь, висмут).
Атомы металлов не могут присоединять электроны. Поэтому они во всех химических реакциях являются восстановителями и в соединениях имеют только положительные степени окисления. Восстановительная активность различных металлов неодинакова. В периодах слева направо восстановительная активность металлов уменьшается; в главных подгруппах сверху вниз – увеличивается.
- Взаимодействие с простыми веществами – неметаллами:
- а) с галогенами металлы образуют соли – галогениды, например:
- Mg + Cl2 = MgCl2
- Zn + Br2 = ZnBr2
- б) с кислородом металлы образуют оксиды, например:
- 4Na + O2 = 2Na2O
- 2Cu + O2 = 2CuO
 Горение железа в кислороде
Горение железа в кислороде
- в) с серой металлы образуют соли – сульфиды, например:
- Fe + S = FeS
- г) с водородом самые активные металлы образуют гидриды, например:
- Ca + H2 = CaH2
- д) с углеродом многие металлы образуют карбиды, например:
- Ca + 2C = CaC2
- Взаимодействие со сложными веществами:
- а) металлы, находящиеся в начале ряда напряжений (от Li до Na), при обычных условиях вытесняют водород из воды и образуют щелочи, например:
- 2Na + 2H2O = 2NaOH + H2↑
- б) металлы, расположенные в ряду напряжений до водорода, взаимодействуют с разбавленными кислотами (HCl, H2SO4 и др.), в результате чего образуются соли и выделяется водород, например:
- 2Al + 6HCl = 2AlCl3 + 3H2↑
- в) металлы взаимодействуют с растворами солей менее активных металлов, в результате чего образуется соль более активного металла, а менее активный металл выделяется в свободном виде, например:
- Fe + CuSO4 = FeSO4 +Cu
Большинство металлов встречаются в природе в виде различных соединений (оксиды, сульфиды, сульфаты, хлориды, карбонаты и др.). Только наименее активные металлы встречаются в природе в свободном виде (самородные металлы) – золото, серебро, платина и др.
- Получение металлов из их соединений – это задача металлургии.
- Любой металлургический процесс является процессом восстановления ионов металла с помощью различных восстановителей, в результате которого получаются металлы в свободном виде.
- В зависимости от способа проведения металлургического процесса различают пирометаллургию, гидрометаллургию и электрометаллургию.
- Пирометаллургия – это получение металлов из их соединений при высоких температурах с помощью различных восстановителей: углерода, оксида углерода (II), водорода, металлов (алюминия, магния) и др.
- Гидрометаллургия – это получение металлов, которое состоит из двух процессов: 1) природное соединение металла (обычно оксид) растворяется в кислоте, в результате чего получается раствор соли металла; 2) из полученного раствора данный металл вытесняется более активным металлом.
Электрометаллургия – это получение металлов при электролизе растворов или расплавов их соединений. Роль восстановителя в данном процессе играет электрический ток.
Сплавы
Металлы в чистом виде применяют реже, чем их сплавы. Это объясняется тем, что сплавы часто обладают более высокими техническими свойствами, чем чистые металлы. Изготовление сплавов основано на свойстве металлов в расплавленном состоянии взаимно растворяться и смешиваться друг с другом.
По своему составу и строению сплавы бывают различными. Важнейшими из них являются:
- Механическая смесь металлов. Охлажденный расплав представляет собой смесь очень мелких кристаллов отдельных металлов (например, Pb + Sb)
- Твердые растворы. При охлаждении расплава образуются однородные кристаллы. В узлах их кристаллических решеток находятся атомы различных металлов (например, Cu + Ni).
- Интерметаллические соединения. При взаимном растворении металлов их атомы реагируют между собой, образуя химические соединения. В таких соединениях металлы чаще всего не проявляют валентность, характерную для них в соединениях с неметаллами (например, Cu3Zn, Zn3Mg, Ag2Zn5).
В состав сплавов могут входить и неметаллы (углерод, бор и др.)
 Бронза
Бронза
Способность металлов в расплавленном виде не только механически смешиваться, но и образовывать между собой (и атомами неметаллов) различные соединения – одна из главных причин, объясняющая, почему сплавы по физическим свойствам сильно отличаются от свойств составляющих их металлов.
Сплав полученный из монокарбида вольфрама и кобальта – «победит» — по твердости сравним с алмазом. В настоящее время в технике применяют большое число различных сплавов, обладающих заранее заданными свойствами.
Для их получения используют более 40 химических элементов в разнообразных сочетаниях и количественных соотношениях.
- Некоторые широко используемые сплавы
- Сталь – сплав железа и углерода, добавки: Mn, Cr, Ni, Si, P, S.
- Бронза – сплав меди с оловом, добавки: Zn, Pb, Al, Mn, P, Si.
- Латунь – сплав меди с цинком, добавки: Sn, Mn, Al, Pb, Si.
- Мельхиор – сплав меди с никелем.
- Дюралюминий – сплав алюминия с медью (3-5%), марганцем (1%), магнием (1%).
- Амальгамы – сплавы металлов, содержащие ртуть.
Металлическая химическая связь — характеристика, способы образования и свойства
Время на чтение: 11 минут
Металлическая химическая связь характерна для металлов и их сплавов в кристаллическом состоянии. Образуется за счет обобществления валентных электронов. Для этого типа строения вещества не характерно образование направленных структурированных связей.
Следует отличать различные типы связи элементов кристаллов — металлическую, ионную и водородную, свойственную кристаллам льда.
Механизм создания металлической связи предусматривает отрыв частично свободных электронов от атома с образованием катионов с положительным зарядом, формирующих “остов” кристаллической решетки и электронного облака. При этом металлический кристалл не приобретает положительного или отрицательного заряда.
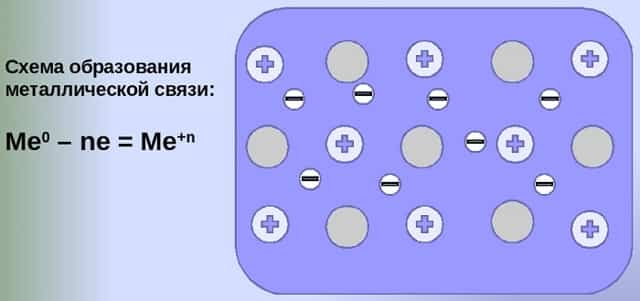
- Общий случай формирования связывания металлических атомов в химии, соответствующий данному выше определению:
- Me — ne⁻ ⇆ Me,
- здесь n — число электронов, участвующих в образовании связи, как правило, от 1 до 3.
- В левой части уравнения — атом металла, отдающий электроны, в правой — образовавшийся в результате ион.
- Формула показывает, что в кристалле постоянно происходит присоединение и отдача электронов.
- Схемы формирования связи на примере атомов различной валентности:
- K — e⁻ ⇆ K;
- Cu — 2e⁻ ⇆ Cu;
- Al — 3e⁻ ⇆ Al.
Отделяющиеся от атома электроны перемещаются на свободные валентные орбитали, которые обобществляются и позволяют всем электронам перемещаться в пределах кристалла. Отделение электронов выгодно атому с точки зрения энергетического баланса, так как позволяет сформировать электронно-стабильную оболочку.
Характерные кристаллические решетки
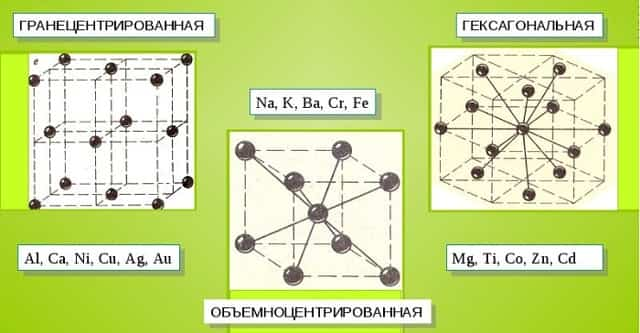
Металлические кристаллы подразделяются на 3 основных типа:
- Объемно-центрированную кубическую решетку, в которой, помимо размещения атомов в четырех вершинах куба, один из них размещается в центре объемной фигуры. Такой тип организации твердого вещества характерен для ряда металлов, включая K, Na и Li, вольфрам, хром, ниобий и др.
- Гранецентрированная кубическая решетка характеризуется расположением атомов в центре граней. Всего в ячейке задействовано 10 атомов, 4 в вершинах и 6 на гранях. Такая решетка встречается у меди, драгметаллов (серебра и золота) и металлов платиновой группы: Pd, Pt.
- Гексагональное строение решетки предполагает размещение атомов в углах и внутри 6-гранной призмы. Ячейка состоит из 15 атомов и свойственна магнию, кальцию, осмию, бериллию и ряду других металлических элементов.
Общими свойствами всех решеток являются высокая симметрия и плотная упаковка составляющих их атомов. Некоторые элементы периодической таблицы формируют уникальную структуру, например, элементарная ячейка In имеет тетрагональное строение.
Для сплавов, являющихся химическими соединениями, также характерно образование кристаллов перечисленных видов, при этом атомы каждого металла занимают определенное место в структуре.
Например, в сплаве никеля и алюминия атомы Al размещаются по углам, а атом Ni — в центре ОЦК ячейки. Свойства сплава и его структура влияют на класс прочности изделия, изготовленного из этого материала.
Физические характеристики металлических кристаллов обусловлены способностью обобществленных электронов свободно перемещаться внутри кристалла.

Характеристики, отличающие подобные вещества:
- хорошая электропроводность, благодаря наличию условно свободного электронного облака;
- высокая проводимость тепла;
- низкая реакционная способность или инертность;
- пластичность — большинство металлов можно гнуть и ковать.
Высокий уровень организации вещества обусловливает металлический блеск. Следует иметь в виду, что повышение прочности при пластической деформации и легировании приводит к образованию частично ковалентной связи.
- При деформации могут возникать области повышенной прочности и низкими пластическими свойствами, похожие на вещества с ковалентной связью (например, алмаз).
- Помимо рассматриваемой, металлы могут образовывать другие виды связи, включая простую ионную.
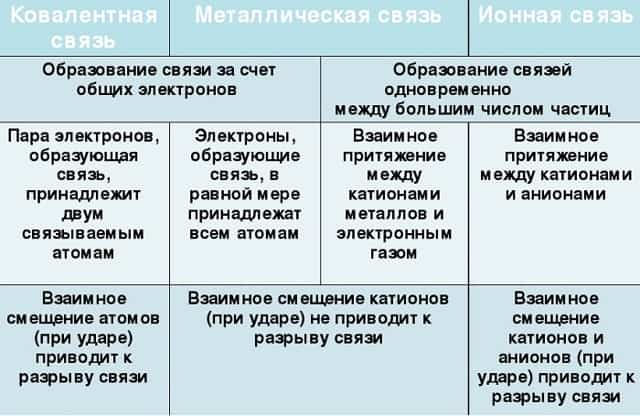
Их общие черты:
- участие металлов, при этом металлическая связь формируется исключительно атомами металла, а ионная образуется между металлическим и неметаллическим элементами;
- металл высвобождает электроны и становится катионом;
- соединения могут существовать в кристаллической форме.
Кристаллы с ионным характером соединения отличают следующие параметры:
- В узлах размещаются как положительно, так и отрицательно заряженные ионы. Каркас металлической решетки формируют исключительно катионы.
- Узлы удерживаются за счет электростатического взаимодействия.
- При низких температурах кристаллические вещества, образованные за счет ионного взаимодействия, проявляют свойства диэлектриков (не проводят ток).
- Переход электронов с атома металла происходит на орбиты атома неметалла.
Характерный пример кристалла с ионной связью — поваренная соль, решетка которой сформирована из ионов Na⁺ и Cl⁻. Такие кристаллические вещества не обладают пластичностью и блеском.
Металлическая химическая связь
Вы когда-нибудь задумывались — существует ли в природе отдельный атом металла?
Металл всегда существует в виде кристалла. Естественно, это обусловлено определенным строением и предполагает определенные физические и химические свойства.
Давайте представим, что у нас есть кусок какого-то металла. Например, нам дано железо (Fe). Из чего состоит этот кусок железа?
Он состоит из атомов железа, которые находятся в строго определенном порядке — в узлах кристаллической решетки.
У атома железа, как у любого металла, на последнем электронном слое небольшое число электронов, плюс к этому, большой радиус атома. На этом последнем слое электроны держатся достаточно слабо.
- Любой металл способен отдавать электроны, превращаясь в положительно заряженный ион.
- На примере железа:
- Fe0 -2e— = Fe2+
Куда направляются отделившиеся отрицательно заряженные частицы — электроны? Минус всегда притягивается к плюсу. Электроны притягиваются к другому иону (положительно заряженному) железа в кристаллической решетке:
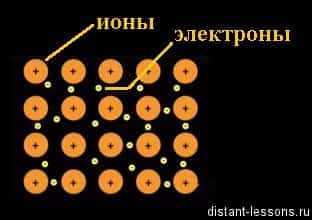
- Fe2+ +2e— = Fe0
- Ион становится нейтральным атомом.
- И такой процесс повторяется много раз.
Получается, что свободные электроны железа находятся в постоянном движении по всему объему кристалла, отрываясь и присоединяясь к ионам в узлах решетки. Другое название этого явления — делокализованное электронное облако. Термин «делокализованный» обозначает — свободный, не привязанный.
Это жестко зафиксированные в узлах кристаллической решетки ионы металла и свободно перемещающиеся по всему объему кристалла электроны.
В чем-то металлическая химическая связь похожа на ионную — в ней тоже присутствуют ионы (катионы), однако, существенное отличие в том, что:
- в ионной связи есть катионы (положительно заряженные частицы) и анионы (отрицательно заряженные ионы);
- в металлической химической связи есть катионы и электроны.
Кое в чем металлическая химическая связь похожа и на ковалентную — в ней тоже есть общие электроны, но:
- в ковалентной химической связи электроны принадлежат двум элементам (локализованы между ними);
- в металлической — они принадлежат абсолютно всем ионам.
Металлическая химическая связь— связь между положительными ионами в кристаллах металлов, осуществляемая за счет притяжения электронов, свободно перемещающихся по кристаллу.
- Добиться состояния одной молекулы металла можно только при очень высоких температурах — когда металл перейдет в газообразное состояние.
- Физические свойства металлической химической связи:

- теплопроводность (перенос теплоты частицами — в данном случае — электронами);
- электропроводность;
- все вещества — твердые (кроме некоторых щелочных металлов);
- высокие температуры плавления и кипения;
- характерный металлический блеск — он появляется за счет отражения лучей электронами; если металл растереть до порошкообразного состояния, металлический блеск пропадает — нет кристаллической решетки — нет свободно гуляющих электронов;
- высокая плотность вещества (кроме щелочных металлов);
- пластичность — это смещение слоев кристаллической решетки.
Обсуждение: «Металлическая химическая связь»
(Правила комментирования)
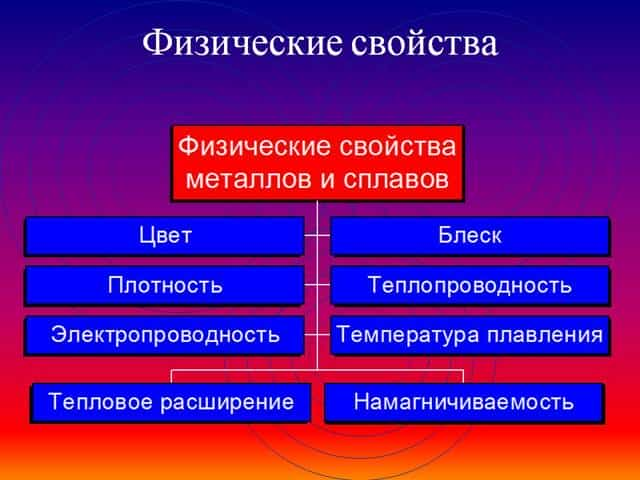
Общие физические и химические свойства металлов
Чтобы поделиться, нажимайте
Благодаря наличию свободных электронов (“электронного газа”) в кристаллической решетке все металлы проявляют следующие характерные общие свойства:
1) Пластичность – способность легко менять форму, вытягиваться в проволоку, прокатываться в тонкие листы.
2) Металлический блеск и непрозрачность. Это связано со взаимодействием свободных электронов с падающими на металл светом.
3) Электропроводность. Объясняется направленным движением свободных электронов от отрицательного полюса к положительному под влиянием небольшой разности потенциалов. При нагревании электропроводность уменьшается, т.к. с повышением температуры усиливаются колебания атомов и ионов в узлах кристаллической решетки, что затрудняет направленное движение “электронного газа”.
4) Теплопроводность. Обусловлена высокой подвижностью свободных электронов, благодаря чему происходит быстрое выравнивание температуры по массе металла. Наибольшая теплопроводность – у висмута и ртути.
5) Твердость. Самый твердый – хром (режет стекло); самые мягкие – щелочные металлы – калий, натрий, рубидий и цезий – режутся ножом.
6) Плотность. Она тем меньше, чем меньше атомная масса металла и больше радиус атома. Самый легкий – литий (ρ=0,53 г/см3); самый тяжелый – осмий (ρ=22,6 г/см3). Металлы, имеющие плотность менее 5 г/см3 считаются “легкими металлами”.
7) Температуры плавления и кипения. Самый легкоплавкий металл – ртуть (т.пл. = -39°C), самый тугоплавкий металл – вольфрам (t°пл. = 3390°C). Металлы с t°пл. выше 1000°C считаются тугоплавкими, ниже – низкоплавкими.
Общие химические свойства металлов
Сильные восстановители: Me0 – nē → Men+
Ряд напряжений характеризует сравнительную активность металлов в окислительно-восстановительных реакциях в водных растворах.
1. Реакции металлов с неметаллами
- 1) С кислородом:
2Mg + O2 → 2MgO - 2) С серой:
Hg + S → HgS - 3) С галогенами:
Ni + Cl2 –t°→ NiCl2 - 4) С азотом:
3Ca + N2 –t°→ Ca3N2 - 5) С фосфором:
3Ca + 2P –t°→ Ca3P2 - 6) С водородом (реагируют только щелочные и щелочноземельные металлы):
2Li + H2 → 2LiH - Ca + H2 → CaH2
2. Реакции металлов с кислотами
- 1) Металлы, стоящие в электрохимическом ряду напряжений до H восстанавливают кислоты-неокислители до водорода:
- Mg + 2HCl → MgCl2 + H2
- 2Al+ 6HCl → 2AlCl3 + 3H2
- 6Na + 2H3PO4 → 2Na3PO4 + 3H2
- 2) С кислотами-окислителями:
- При взаимодействии азотной кислоты любой концентрации и концентрированной серной с металлами водород никогда не выделяется!
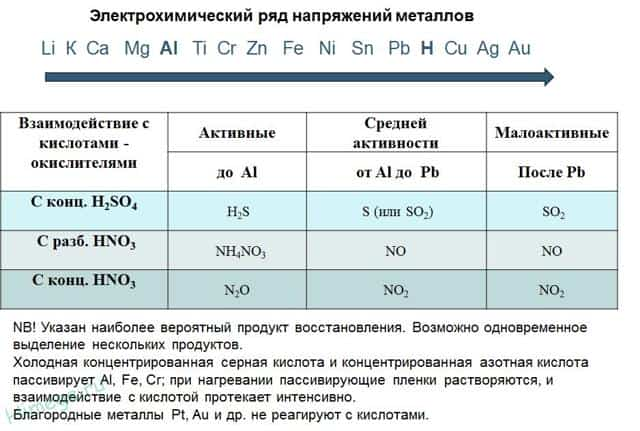
- Zn + 2H2SO4(К) → ZnSO4 + SO2 + 2H2O
- 4Zn + 5H2SO4(К) → 4ZnSO4 + H2S + 4H2O
- 3Zn + 4H2SO4(К) → 3ZnSO4 + S + 4H2O
- 2H2SO4(к) + Сu → Сu SO4 + SO2 + 2H2O
- 10HNO3 + 4Mg → 4Mg(NO3)2 + NH4NO3 + 3H2O
- 4HNO3(к) + Сu → Сu (NO3)2 + 2NO2 + 2H2O
3. Взаимодействие металлов с водой
- 1) Активные (щелочные и щелочноземельные металлы) образуют растворимое основание (щелочь) и водород:
- 2Na + 2H2O → 2NaOH + H2
- Ca+ 2H2O → Ca(OH)2 + H2
- 2) Металлы средней активности окисляются водой при нагревании до оксида:
- Zn + H2O –t°→ ZnO + H2
- 3) Неактивные (Au, Ag, Pt) – не реагируют.
4. Вытеснение более активными металлами менее активных металлов из растворов их солей:
- Cu + HgCl2 → Hg+ CuCl2
- Fe+ CuSO4 → Cu+ FeSO4
В промышленности часто используют не чистые металлы, а их смеси — сплавы, в которых полезные свойства одного металла дополняются полезными свойствами другого. Так, медь обладает невысокой твердостью и малопригодна для изготовления деталей машин, сплавы же меди с цинком (латунь) являются уже достаточно твердыми и широко используются в машиностроении. Алюминий обладает высокой пластичностью и достаточной легкостью (малой плотностью), но слишком мягок. На его основе готовят сплав с магнием, медью и марганцем – дуралюмин (дюраль), который, не теряя полезных свойств алюминия, приобретает высокую твердость и становится пригодным в авиастроении. Сплавы железа с углеродом (и добавками других металлов) – это широко известные чугун и сталь.
Металлы в свободном виде являются восстановителями. Однако реакционная способность некоторых металлов невелика из-за того, что они покрыты поверхностной оксидной пленкой, в разной степени устойчивой к действию таких химических реактивов, как вода, растворы кислот и щелочей.
Например, свинец всегда покрыт оксидной пленкой, для его перехода в раствор требуется не только воздействие реактива (например, разбавленной азотной кислоты), но и нагревание.
Оксидная пленка на алюминии препятствует его реакции с водой, но под действием кислот и щелочей разрушается.
Рыхлая оксидная пленка (ржавчина), образующаяся на поверхности железа во влажном воздухе, не мешает дальнейшему окислению железа.
Под действием концентрированных кислот на металлах образуется устойчивая оксидная пленка. Это явление называется пассивацией. Так, в концентрированной серной кислоте пассивируются (и после этого не реагируют с кислотой) такие металлы, как Ве, Вi, Со, Fе, Мg и Nb, а в концентрированной азотной кислоте – металлы А1, Ве, Вi, Со, Сг, Fе, Nb, Ni, РЬ, Тh и U.
При взаимодействии с окислителями в кислых растворах большинство металлов переходит в катионы, заряд которых определяется устойчивой степенью окисления данного элемента в соединениях (Nа+, Са2+,А13+,Fе2+ и Fе3+)
Восстановительная активность металлов в кислом растворе передается рядом напряжений. Большинство металлов переводится в раствор соляной и разбавленной серной кислотами, но Сu, Аg и Нg – только серной (концентрированной) и азотной кислотами, а Рt и Аи – «царской водкой».
Коррозия металлов
Нежелательным химическим свойством металлов является их коррозия, т. е. активное разрушение (окисление) при контакте с водой и под воздействием растворенного в ней кислорода (кислородная коррозия). Например, широко известна коррозия железных изделий в воде, в результате чего образуется ржавчина, и изделия рассыпаются в порошок.
Коррозия металлов протекает в воде также из-за присутствия растворенных газов СО2 и SО2; создается кислотная среда, и катионы Н+ вытесняются активными металлами в виде водорода Н2 (водородная коррозия).
Особенно коррозионно-опасным может быть место контакта двух разнородных металлов (контактная коррозия).
Между одним металлом, например Fе, и другим металлом, например Sn или Сu, помещенными в воду, возникает гальваническая пара.
Поток электронов идет от более активного металла, стоящего левее в ряду напряжений (Ре), к менее активному металлу (Sn, Сu), и более активный металл разрушается (корродирует).
Именно из-за этого ржавеет луженая поверхность консервных банок (железо, покрытое оловом) при хранении во влажной атмосфере и небрежном обращении с ними (железо быстро разрушается после появления хотя бы небольшой царапины, допускающей контакт железа с влагой). Напротив, оцинкованная поверхность железного ведра долго не ржавеет, поскольку даже при наличии царапин корродирует не железо, а цинк (более активный металл, чем железо).
Сопротивление коррозии для данного металла усиливается при его покрытии более активным металлом или при их сплавлении; так, покрытие железа хромом или изготовление сплава железа с хромом устраняет коррозию железа. Хромированное железо и сталь, содержащая хром (нержавеющая сталь), имеют высокую коррозионную стойкость.
Металлическая связь
Большинство металлов имеют общие свойства, которые отличны от свойств других простых или сложных веществ. Это такие свойства как:
- повышенные температуры плавления,
- значительные электро- и теплопроводность,
- способность отражать свет и
- способность прокатываться в листы
- характерный металлический блеск.
Эти свойства связаны с существованием в металлах металлической связи:
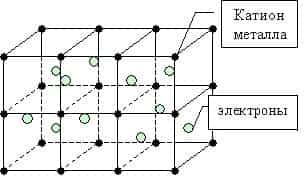
Металлическая связь — это связь между положительно заряженными ионами и атомами металлов и свободно движущимися по кристаллу электронами.
Простое вещество — металл существует в виде кристалла, имеющим металлическую кристаллическую решетку, в узлах которой находятся атомы или ионы металлов.
Валентные атомные орбитали каждого атома металла в кристалле перекрываются сразу с орбиталями нескольких близлежащих соседей, и число этих атомных орбиталей чрезвычайно велико. Поэтому число возникающих молекулярных орбиталей тоже велико.
Мы уже знаем, что число валентных электронов атомов металлов небольшое, к тому же они достаточно слабо связаны с собственными ядрами и могут легко отрываться. Поэтому электроны заполняют всю зону взаимодействующих орбиталей образуя металлическую связь. Т.о. в кристаллической решетке металла перемещение электронов происходит свободно.
 металлическая связь
металлическая связь
Такие особенности, как тепло- и электропроводность металлов связано с существованием свободно движущихся электронов в кристаллической решетке.
Отличие металлической связи от ковалентной
- Несмотря на то, что металлическая связь как и ковалентная связь образована посредством обобществления электронов, однако в металлической связи электроны принадлежат всему множеству ионов/атомов металлов, а в ковалентной только двум атомам неметаллов.
- Важное отличие металлической связи от ковалентной – это то, что здесь не существует направленности связи, т.к. электроны по кристаллу распределены почти равномерно.
- Прочность металлической связи также отличается: ее энергия в 3-4 раза меньше энергии ковалентной связи.
Отличие металлической связи от ионной
В образовании как ионной связи, так и металлической принимают участие ионы — катионы. Однако ионная связь — это связь между катионами и анионами, а в металлической связи анионы отсутствуют, зато имеются электроны, свободно движущиеся между катионами/атомами металлов.
- Если рассмотреть щелочные металлы, то наиболее активный среди них – цезий, легче всего будет отдавать свои валентные электроны, а труднее всего – рубидий, наименее активный среди щелочных металлов.
Чем легче атом металла переходит в состояние иона, т.е. отдает электроны, тем менее прочна его решетка, вследствие отталкивания положительно заряженных ионов.
В связи с этим металл будет обладать пониженной температурой плавления и становится более мягким.
- Чем больше валентных электронов имеет атом металла, тем более прочна его кристаллическая решетка, и тем выше его температуры кипения и плавления
Ниже приведена зависимость температуры плавления металлов от их положения в периодической таблице и числа валентных электронов.
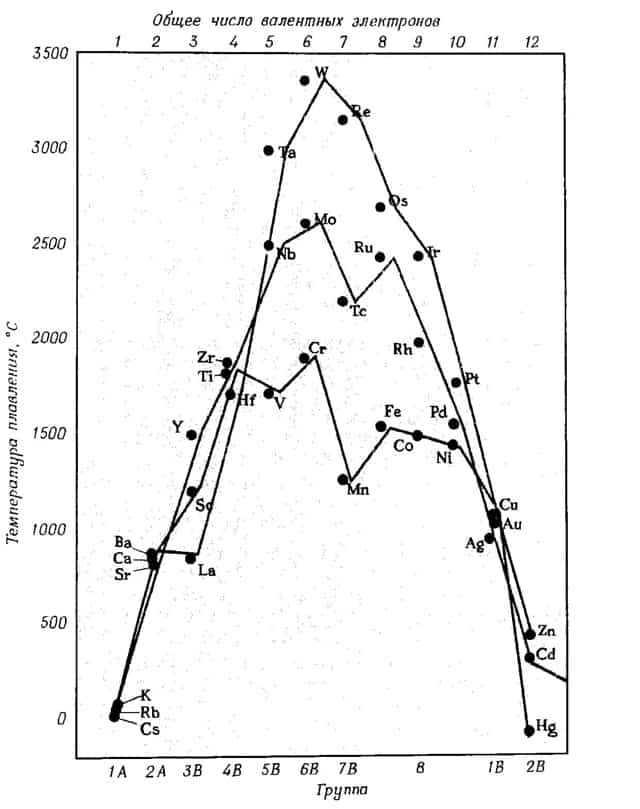 зависимость температуры плавления металлов от положения в периодической таблице и от числа валентных электронов
зависимость температуры плавления металлов от положения в периодической таблице и от числа валентных электронов
Металлическая связь. Свойства металлической связи
Металлическая связь — химическая связь, обусловленная наличием относительно свободных электронов. Характерна как для чистых металлов, так и их сплавов и интерметаллических соединений.
Механизм металлической связи
Во всех узлах кристаллической решётки расположены положительные ионы металла. Между ними беспорядочно, подобно молекулам газа движутся валентные электроны, отцепившиеся от атомов при образовании ионов.
Эти электроны играют роль цемента, удерживая вместе положительные ионы; в противном случае решётка распалась бы под действием сил отталкивания между ионами.
Вместе с тем и электроны удерживаются ионами в пределах кристаллической решётки и не могут её покинуть. Силы связи не локализованы и не направлены.
Поэтому в большинстве случаев проявляются высокие координационные числа (например, 12 или 8). Когда два атома металла сближаются, орбитали их внешних оболочек перекрываются, образуя молекулярные орбитали.
Если подходит третий атом, его орбиталь перекрывается с орбиталями первых двух атомов, что дает еще одну молекулярную орбиталь. Когда атомов много, возникает огромное число трехмерных молекулярных орбиталей, простирающихся во всех направлениях.
Вследствие многократного перекрывания орбиталей валентные электроны каждого атома испытывают влияние многих атомов.
Характерные кристаллические решётки
Большинство металлов образует одну из следующих высокосимметричных решёток с плотной упаковкой атомов: кубическую объемно центрированную, кубическую гранецентрированную и гексагональную.
В кубической объемно центрированной решётке (ОЦК) атомы расположены в вершинах куба и один атом в центре объёма куба. Кубическую объемно центрированную решётку имеют металлы: Pb, K, Na, Li, β-Ti, β-Zr, Ta, W, V, α-Fe, Cr, Nb, Ba и др.
В кубической гранецентрированной решётке (ГЦК) атомы расположены в вершинах куба и в центре каждой грани. Решётку такого типа имеют металлы: α-Ca, Ce, α-Sr, Pb, Ni, Ag, Au, Pd, Pt,Rh, γ-Fe, Cu, α-Co и др.
В гексагональной решётке атомы расположены в вершинах и центре шестигранных оснований призмы, а три атома — в средней плоскости призмы. Такую упаковку атомов имеют металлы: Mg, α-Ti, Cd, Re, Os, Ru, Zn, β-Co, Be, β-Ca и др.
Другие свойства
Свободно движущиеся электроны обусловливают высокую электро- и теплопроводность. Вещества, обладающие металлической связью, часто сочетают прочность с пластичностью, так как при смещении атомов друг относительно друга не происходит разрыв связей. Также важным свойством является металлическая ароматичность.
Металлы хорошо проводят тепло и электричество, они достаточно прочны, их можно деформировать без разрушения. Некоторые металлы ковкие (их можно ковать), некоторые тягучие (из них можно вытягивать проволоку). Эти уникальные свойства объясняются особым типом химической связи, соединяющей атомы металлов между собой – металлической связью.
Металлы в твердом состоянии существуют в виде кристаллов из положительных ионов, как бы “плавающих” в море свободно движущихся между ними электронов.
Металлическая связь объясняет свойства металлов, в частности, их прочность. Под действием деформирующей силы решетка металла может изменять свою форму, не давая трещин, в отличие от ионных кристаллов.
Высокая теплопроводность металлов объясняется тем, что если нагреть кусок металла с одной стороны, то кинетическая энергия электронов увеличится. Это увеличение энергии распространится в “ электронном море” по всему образцу с большой скоростью.
Становится понятной и электрическая проводимость металлов. Если к концам металлического образца приложить разность потенциалов, то облако делокализованных электронов будет сдвигаться в направлении положительного потенциала: этот поток электронов, движущихся в одном направлении, и представляет собой всем знакомый электрический ток.
Какие физические свойства металлов обуславливает металлическая связь
- ХИМИЯ МЕТАЛЛОВ
- Гальванотехника
- Гальванотехника – получение на поверхности изделия или основы (формы) слоев металлов из растворов солей под действием постоянного электрического тока.
В гальваностегии на поверхности катода (или формы) формируется тонкий слой (несколько десятков мкм) металла для придания изделию различных свойств (для повышения коррозионной стойкости, для декоративной отделки, для придания электрической проводимости).
Как правило, используются процессы цинкования, никелирования, меднения, хромирования, кадмирования, свинцевания, оловянирования (все – для повышения коррозионной устойчивости), золочение и серебрение.
Во всех случаях для осаждения металла используется электролит определенного состава (например, для никелирования NiSO4 140-200 г/л, NiCl2 30-40 г/л, H3BO3 25-40 г/л) и процесс проводят при определенной температуре и силе тока.
В гальванопластике на поверхность катода (формы) осаждают толстый (несколько мм) легко отделяющийся от основы слой металла. точно воспроизводящий рельеф основы. Восстанавливая металлы на катоде определенной формы удается получить точное негативное изображение катода.
Гальвонопластика используется для изготовления копий. Этим методом изготавливают печатные стереотипы, клише, валки для тиснения кож, тонкие металлические сетки, фольгу, копии скульптур, монеты, формы для литья.
Как правило, используют электролиты для осаждения Cu, Ni, Co, Fe, Ag, Au, Zn, Sn, Al.
Слово металл произошло от греческого слова metalloh, что в переводе означает «шахта». Важнейшим критерием для отнесения какого-либо элемента к металлам является наличие у него так называемых металлических свойств, а именно:
Какие свойства или явления демонстрируют птицы
- — способности хорошо отражать световые волны («металлического блеска»),
- — пластичности (ковкости),
- — высокой электропроводности,
- — высокой теплопроводности.
В настоящее время границу между металлами и неметаллами в Периодической системе элементов принято проводить по диагонали Be-B, Al-Si, Ge-As, Sb-Te, Po-At. Согласно этому делению к металлам относятся все s-элементы, все d-элементы, все f-элементы и часть p-элементов.
Однако резкой границы между металлами и неметаллами провести нельзя, поскольку некоторые элементы, расположенные вдоль условной разграничительной линии, проявляют в своем поведении определенную двойственность. Так, германий имеет металлический блеск, но одновременно обладает полупроводниковой проводимостью.
Свойства некоторых элементов сильно зависят от температуры, например, олово при высоких температурах — типичный металл, однако ниже -33°С переходит в полупроводниковую модификацию.
Характерной особенностью металлов является металлическая связь, характеризующаяся тем, что их кристаллическая решетка образована положительными ионами, а валентные электроны свободно перемещаются по всему объему решетки. Структуру металла можно представить в виде остова из положительных ионов, погруженного в «электронный газ» из делокализованных электронов, который компенсирует силы взаимного отталкивания положительных ионов.
С точки зрения зонной теории у металлов валентная зона и зона проводимости перекрываются. Число незанятых орбиталей в зоне проводимости велико.
Поскольку энергии орбиталей в зоне проводимости относительно мало отличаются друг от друга, электроны при очень незначительном воздействии легко переходят с одной орбитали на другую, обеспечивая тем самым высокую тепло- и электропроводность.
При повышении температуры все большее число электронов переходит в зону проводимости, что приводит к уменьшению числа вакантных орбиталей в зоне проводимости и соответственно снижению тепло- и электропроводности. Среди всех металлов наибольшую элетропроводность имеют серебро, медь, золото, алюминий, наименьшую — ртуть, марганец, ванадий, хром, стронций.
Классификация металлов
Существует несколько подходов к классификации металлов: по физическим свойствам, по использованию в технике и т.д. Наиболее часто используется техническая классификация металлов, согласно которой металлы делят на следующие группы:
- 1. Черные — Fe и сплавы на его основе,
- 2. Тяжелые цветные — Cu, Pb, Zn, Ni и Sn,
- 3. Младшие цветные — Co, Sb, Bi, Hg и Cd,
4. Легкие — Al, Mg, Ca и др.,
5. Драгоценные — Au, Ag, Pt, Pd, Os, Ir, Rh, Ru,
6. Легирующие — Mn, Cr, W, Mo, Nb, V и др.,
7. Редкие — Ce, Eu, Pm и др.,
8. Радиоактивные — U, Th, Pt и др.
Основным недостатком технической классификации является то, что некоторые металлы можно одновременно отнести к различным группам.
По температуре плавления металлы принято разделять на тугоплавкие, чья температура плавления (tпл.) выше 1500°С и легкоплавкие. К тугоплавким металлам относится вольфрам (tпл. = 3407°С), тантал (tпл. = 2997°С), молибден (tпл.
= 2620°С), железо (tпл. = 1535°С), хром (tпл. = 1857°С) и др. К легкоплавким металлам относятся ртуть (tпл. = -39°С), галлий (tпл. = 30°С), цинк (tпл. = 420°С), свинец (tпл. = 327°С), висмут (tпл.
= 271°С), щелочные и щелочноземельные металлы и др.
По плотности металлы принято делить на легкие, чья плотность меньше 5 г/см3, и тяжелые. К легким металлам относятся литий (r = 0.53 г/см3), магний (r = 1.74 г/см3), алюминий (r = 2.70 г/см3), титан (r = 4.54 г/см3), кальций (r = 1.55 г/см3) и др. Высокую плотность имеют осмий (r = 22.59 г/см3), иридий (r = 22.42 г/см3), платина (r = 21.45 г/см3), золото (r = 19.32 г/см3) и др.
- В химии все металлы разделяют в зависимости от строения внешней и предвнешней электронной оболочки на:
- 1. s-металлы (Li, Na, K, Rb, Cs, Fr, Be, Mg, Ca, Sr, Ba, Ra),
- 2. p-металлы (Al, Ga, In, Tl, Ge, Sn, Pb, Sb, Bi, Po),
- 3. d-металлы (все d-элементы),
4. f-металлы (все f-элементы).
В свою очередь из этих групп можно выделить более узкие семейства: щелочные металлы (Li, Na, K, Rb, Cs, Fr), щелочноземельные металлы (Ca, Sr, Ba, Ra), платиновые металлы (Pt, Pd, Os, Ir, Rh, Ru), редкоземельные элементы (Sc, Y, La и все f-металлы).






