- Классификация спиртов
- Номенклатура и изомерия спиртов
- Получение спиртов
- Химические свойства спиртов
- Химия. 10 класс
- Спирты — химические свойства, формулы и получение
- Классификация спиртов
- По количеству гидроксогрупп
- По типу атома углерода, с которым связана гидроксогруппа
- По строению углеводородного радикала
- Номенклатура спиртов
- По систематической номенклатуре ИЮПАК (IUPAC)
- Радикально-функциональная номенклатура
- Тривиальная номенклатура
- Структурная
- Межклассовая
- Пространственная (оптическая)
- Получение спиртов
- Гидролиз галогенопроизводных алканов
- Гидратация алкенов
- Восстановление альдегидов и кетонов
- Реакция Канниццаро
- Гидролиз сложных эфиров
- Синтез Гриньяра
- Получение метанола из синтез-газа
- Получение этанола
- Реакция Вагнера
- Гидролиз жиров
- Физические свойства спиртов
- Температуры кипения спиртов
- Кислотно-основные свойства
- Замещение гидроксогруппы
- Реакция с использованием реактива Лукаса
- Дегидратация спиртов
- Реакция этерификации — получение сложных эфиров
- Взаимодействие с аммиаком
- Окисление
- Химические свойства многоатомных спиртов
- Кислотные свойства
- Взаимодействие со свежеосажденным гидроксидом меди (II)
- Окисление йодной кислотой и ее солями
- Образование эфиров с азотной кислотой
- Вопросы для самопроверки
- 3.5. Характерные химические свойства предельных одноатомных и многоатомных спиртов, фенола
- Химические свойства спиртов
- Одноатомные спирты
- Реакции замещения
- Замещение атома водорода в гидроксильной группе
- Замещение гидроксильной группы
- Реакции элиминирования (отщепления)
- Дегидратация
- Дегидрирование спиртов
- Реакции окисления
- Горение
- Неполное окисление
- ПРЕДЕЛЬНЫЕ МНОГОАТОМНЫЕ СПИРТЫ
- Замещение атомов водорода гидроксильных групп
- Замещение гидроксильных групп
- Химические свойства фенолов
- Реакции с участием гидроксильной группы
- Кислотные свойства
- Реакции замещения в ароматическом ядре
- Галогенирование
- Нитрование
- Реакции присоединения
Спирты — кислородсодержащие органические соединения, функциональной группой которых является гидроксогруппа (OH) у насыщенного атома углерода.
Спирты также называют алкоголи. Первый член гомологического ряда — метанол — CH3OH. Общая формула их гомологического ряда — CnH2n+1OH.
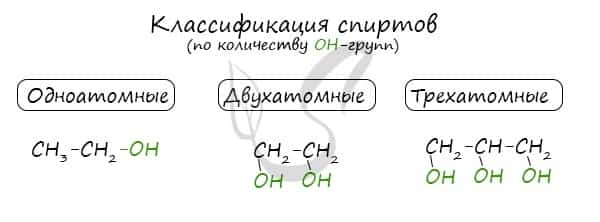
Классификация спиртов
По числу OH групп спирты бывают одноатомными (1 группа OH), двухатомными (2 группы OH — гликоли), трехатомными (3 группы OH — глицерины) и т.д.
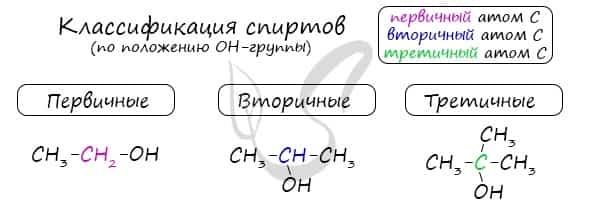
Одноатомные спирты также подразделяются в зависимости от положения OH-группы: первичные (OH-группа у первичного атома углерода), вторичные (OH-группа у вторичного атома углерода) и третичные (OH-группа у третичного атома углерода).
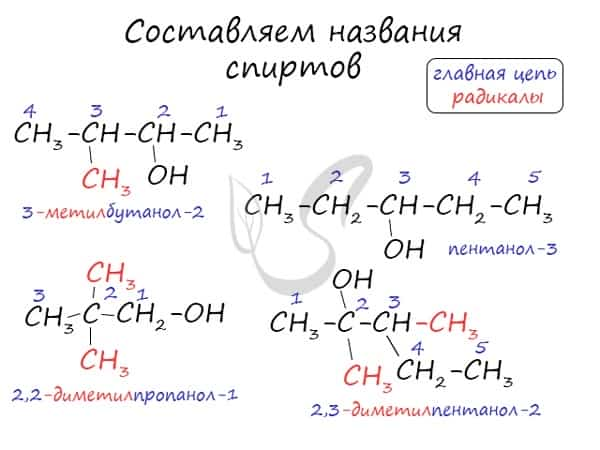
Номенклатура и изомерия спиртов
Названия спиртов формируются путем добавления суффикса «ол» к названию алкана с соответствующим числом атомов углерода: метанол, этанол, пропанол, бутанол, пентанол и т.д.
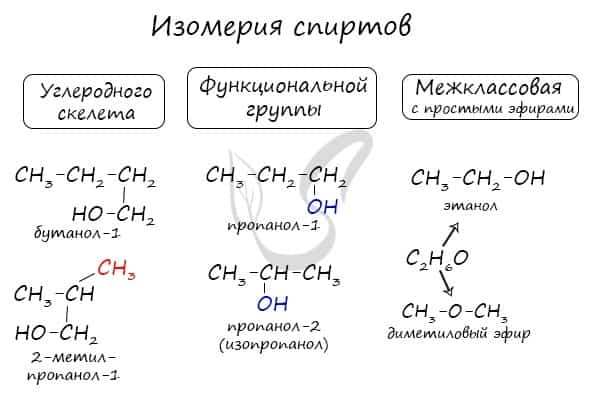
Для спиртов характерна изомерия углеродного скелета (начиная с бутанола), положения функциональной группы и межклассовая изомерия с простыми эфирами, которых мы также коснемся в данной статье.
Получение спиртов
- Гидролиз галогеналканов водным раствором щелочи
- Гидратация алкенов
- Восстановление карбонильных соединений
- Получение метанола из синтез-газа
- Получение этанола брожением глюкозы
- Окисление алкенов KMnO4 в нейтральной (водной) среде
Помните, что в реакциях галогеналканов со сПИртовым раствором щелочи получаются Пи-связи (π-связи) — алкены, а в реакциях с водным раствором щелочи образуются спирты. 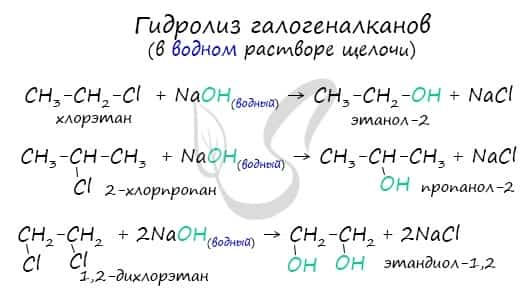
Присоединения молекулы воды (HOH) протекает по правилу Марковникова. Атом водорода направляется к наиболее гидрированному атому углерода, а гидроксогруппа идет к соседнему, наименее гидрированному, атому углерода. 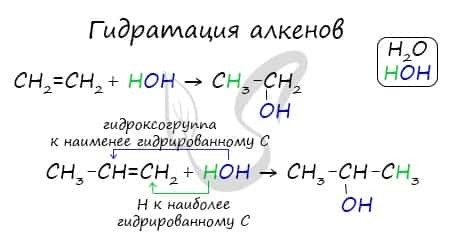
В результате восстановления альдегидов и кетонов получаются соответственно первичные и вторичные спирты. 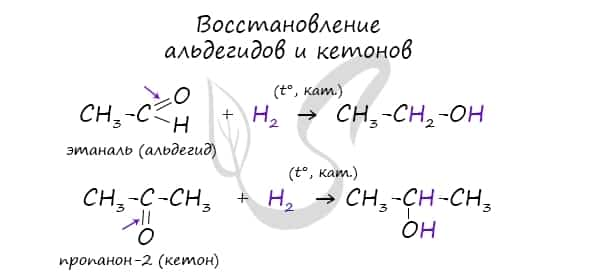
Синтез газом в промышленности называют смесь угарного газа и водорода, которая используется для синтеза различных химических соединений, в том числе и метанола. CO + 2H2 → (t,p,кат.) CH3-OH
В ходе брожения глюкозы выделяется углекислый газ и образуется этанол. 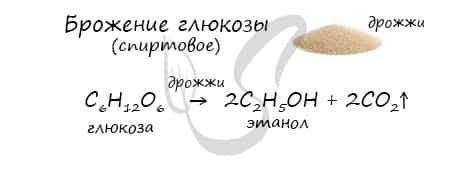
В результате такой реакции у атомов углерода, прилежащих к двойной связи, формируются гидроксогруппы — образуется двухатомный спирт (гликоль). 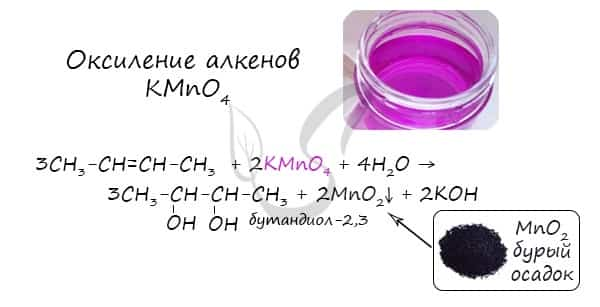
Химические свойства спиртов
Предельные спирты (не содержащие двойных и тройных связей) не вступают в реакции присоединения, это насыщенные кислородсодержащие соединения. У спиртов проявляются новые свойства, которых мы раньше не касались в органической химии — кислотные.
- Кислотные свойства
- Реакция с галогеноводородами
- Реакции с кислотами
- Дегидратация спиртов
- Диметиловый эфир — CH3-O-CH3
- Метилэтиловый эфир — CH3-O-C2H5
- Диэтиловый эфир — C2H5-O-C2H5
- Окисление спиртов
- Качественная реакция на многоатомные спирты
- Кислотные свойства многоатомных спиртов
Щелочные металлы (Li, Na, K) способны вытеснять водород из спиртов с образованием солей: метилатов, этилатов, пропилатов и т.д. 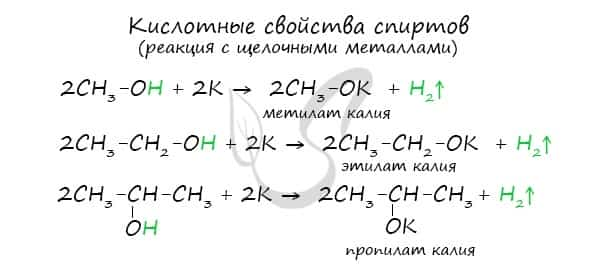 Необходимо особо заметить, что реакция с щелочами (NaOH, KOH, LiOH) для предельных одноатомных спиртов невозможна, так как образующиеся алкоголяты (соли спиртов) сразу же подвергаются гидролизу.
Необходимо особо заметить, что реакция с щелочами (NaOH, KOH, LiOH) для предельных одноатомных спиртов невозможна, так как образующиеся алкоголяты (соли спиртов) сразу же подвергаются гидролизу.
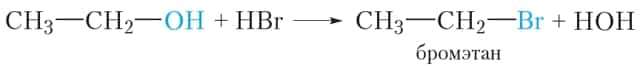
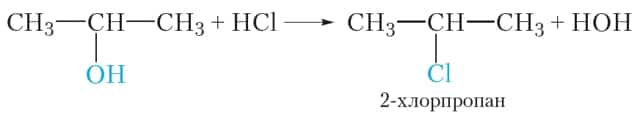
Реакция с галогеноводородами протекают как реакции обмена: атом галогена замещает гидроксогруппу, образуется молекула воды.
В результате реакций спиртов с кислотами образуются различные эфиры.
Дегидратация спиртов (отщепление воды) идет при повышенной температуре в присутствии серной кислоты (водоотнимающего) компонента. Возможен межмолекулярный механизм дегидратации (при t < 140°С), в результате которого образуются простые эфиры. При более высокой температуре (t > 140°С) механизм дегидратации становится внутримолекулярный — образуются алкены. Названия простых эфиров формируются проще простого — по названию радикалов, входящих в состав эфира. Например:
Качественной реакцией на спирты является взаимодействие с оксидом меди II. В ходе такой реакции раствор приобретает характерное фиолетовое окрашивание.
Замечу, что в обычных условиях третичные спирты окислению не подвергаются. Для них необходимы очень жесткие условия, при которых углеродный скелет подвергается деструкции.
Вторичные и третичные спирты определяются другой качественной реакцией с хлоридом цинка II и соляной кислотой. В результате такой реакции выпадает маслянистый осадок.
Первичные спирты окисляются до альдегидов, а вторичные — до кетонов. Альдегиды могут быть окислены далее — до карбоновых кислот, в отличие от кетонов, которые являются «тупиковой ветвью развития» и могут только снова стать вторичными спиртами.
Такой реакцией является взаимодействие многоатомного спирта со свежеприготовленным гидроксидом меди II. В результате реакции раствор окрашивается в характерный синий цвет.
Важным отличием многоатомных спиртов от одноатомных является их способность реагировать со щелочами (что невозможно для одноатомных спиртов). Это говорит об их более выраженных кислотных свойствах.
Химия. 10 класс
- Многие химические свойства спиртов определяются наличием в их молекулах гидроксильной группы, поэтому гидроксильную группу называют функциональной.
- Рассмотрим химические свойства насыщенных одноатомных спиртов.
- 1. Взаимодействие со щелочными металлами
- Если в стаканчик с этиловым спиртом поместить кусочек натрия, начнётся бурная реакция, сопровождающаяся выделением водорода:
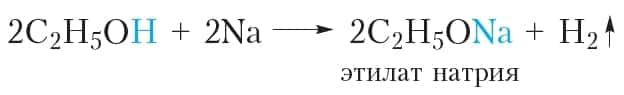
В этой реакции происходит замещение атома водорода гидроксильной группы атомом металла.
Так же реагируют с натрием и другие спирты. Приведём уравнение реакции пропанола-1 с натрием:
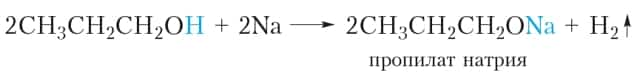
При взаимодействии с активными металлами спирты проявляют кислотные свойства. Кислотные свойства спиртов выражены очень слабо (слабее, чем у воды!), поэтому спирты не изменяют окраску индикаторов, не реагируют со щелочами и могут взаимодействовать только с самыми активными металлами, например со щелочными металлами натрием и калием.
Продукты замещения атома водорода гидроксильной группы спирта атомом металла называются алкоголятами. Приведём названия некоторых алкоголятов:
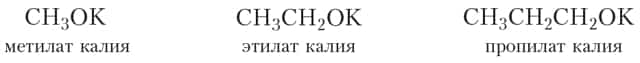
Алкоголяты представляют собой твёрдые солеподобные вещества. Они разлагаются водой с образованием спирта и щёлочи:
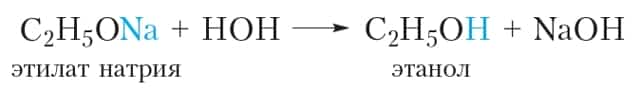
2. Взаимодействие с галогеноводородами
3. Дегидратация. Отщепление воды
При нагревании с сильными водоотнимающими средствами, такими как концентрированная серная кислота, от спиртов отщепляется молекула воды. Реакция отщепления молекулы воды называется реакцией дегидратации (§ 16).
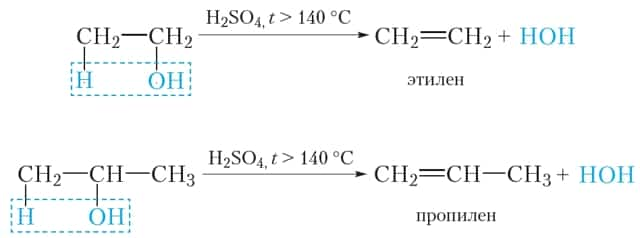
В данных реакциях от одной молекулы спирта отщепляется одна молекула воды. Такая реакция называется внутримолекулярнойдегидратацией.В результате внутримолекулярной дегидратации спиртов образуются алкены.
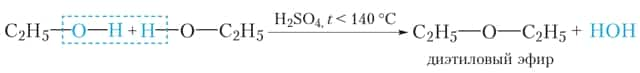
Эта реакция называется межмолекулярной дегидратацией.
В результате межмолекулярной дегидратации спиртов образуются простые эфиры. Строение простых эфиров можно выразить следующей формулой: R—O—R'. Углеводородные радикалы в молекуле простого эфира могут быть одинаковыми или различными. Простые эфиры изомерны спиртам (§ 22).
Продукт реакции межмолекулярной дегидратации этилового спирта — диэтиловый эфир — представляет собой бесцветную жидкость со специфическим запахом и низкой температурой кипения (tкип = 35 °С). Он используется в медицинской практике для наркоза и дезинфекции кожи при проведении инъекций.
Приведём уравнение реакции межмолекулярной дегидратации метанола:
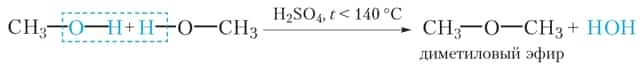
При этом образуется диметиловый эфир — газообразное при нормальных условиях вещество с температурой кипения –25 °С.
Обратите внимание, что температуры кипения простых эфиров намного ниже, чем изомерных спиртов. На рисунке 24.1 изображены шаростержневые модели молекул этанола и диметилового эфира и указаны их температуры кипения.
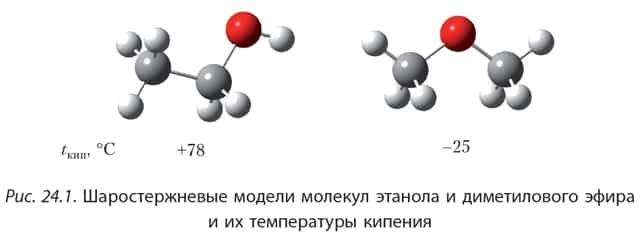
Этанол и диметиловый эфир являются изомерами, их молекулы имеют примерно одинаковые размеры, поэтому, казалось бы, температуры кипения должны быть близки. Тем не менее, температура кипения этанола более чем на 100° С выше температуры кипения диметилового эфира.
Напомним, что высокие температуры кипения спиртов объясняются образованием водородных связей между их молекулами. Водородная связь образуется между атомом водорода гидроксильной группы одной молекулы спирта и атомом кислорода другой молекулы.
Между молекулами простых эфиров водородные связи не образуются, так как в молекулах простых эфиров нет гидроксильных групп.
- 4. Окисление
- Спирты горят при поджигании, в этом мы можем убедиться, зажигая спиртовку:
В результате образуются углекислый газ и вода. Такая реакция называется полным окислением.
Видео 24.1.Окисление этанола
оксидом меди(II)
Возможно и неполное окисление спиртов. Его можно осуществить следующим образом. Нагреем в пламени спиртовки медную проволоку до красного каления. При этом блестящая поверхность проволоки покроется чёрным налётом оксида меди(II) вследствие окисления меди:
После этого раскалённую проволоку быстро поместим в стакан с небольшим количеством этилового спирта. Проволока при этом опять становится блестящей (видео 24.1). Это свидетельствует о том, что из чёрного оксида меди(II) образовалась медь. То есть произошло восстановление оксида меди(II). Восстановителем является этиловый спирт. В ходе реакции он окисляется до уксусного альдегида:
* Окислениевторичных спиртов
Уксусный альдегид имеет яблочный запах, который ощущается при проведении описанного эксперимента.
С окислением вторичных спиртов вы можете познакомиться, перейдя по ссылке в QR-коде.
Спирты — химические свойства, формулы и получение
Спирты — это большая группа химических соединений, производные углеводородов, у которых один или несколько атомов водорода замещены на гидроксильную группу ОН−.
Гидроксильная группа является функциональной группой спиртов.
Классификация спиртов
Спирты классифицируют по различным признакам: по количеству гидроксильных групп; по типу атома углерода, с которым связана гидроксогруппа; а также по строению углеводородного радикала.
По количеству гидроксогрупп
- По этому признаку выделяют одноатомные и многоатомные спирты.
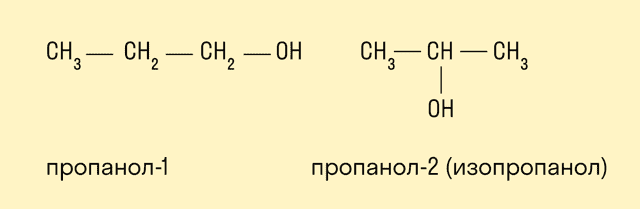
- У одноатомных спиртов одна группа ОН−. Пример — этиловый спирт (этанол):
- CH3—CH2—OH(C2H5OH).
- У многоатомных — несколько групп ОН−.
- Например, предельный двухатомный спирт этиленгликоль (этандиол):
- HO—CH—CH—OH.
Трехатомный спирт глицерин:
HO—CH2—CH(OH)—CH2—OH.
Современное название многоатомных спиртов — полиолы (диолы, триолы и т. д.).
По типу атома углерода, с которым связана гидроксогруппа
Выделяют первичные, вторичные и третичные спирты. Показали примеры каждого вида спиртов в таблице.

По строению углеводородного радикала
По строению углеводородного радикала спирты бывают:
- Предельные (этанол СН3—СН2—ОН);
- Непредельные (пропенол СН2=СН—СН2—ОН);
- Ароматические (фенилметанол С6Н5—СН2ОН).
Номенклатура спиртов
По систематической номенклатуре ИЮПАК (IUPAC)
Спиртам дают название по названию углеводорода с добавлением суффикса -ол и цифры, которая показывает положение гидроксильной группы. Для того, чтобы правильно определить, с каким по счету атомом углерода соединена гидроксильная группа, необходимо учитывать следующие правила:
-
Выбрать самую длинную углеводородную цепь, в состав которой входит гидроксильная группа. Таким образом устанавливают число атомов углерода и соответственно формируют название.
-
Нумерацию длинной цепи осуществляют с того края, к которому ближе расположена гидроксильная группа.
-
Местоположение гидроксогруппы в названии определяют написанием цифры после суффикса -ол.
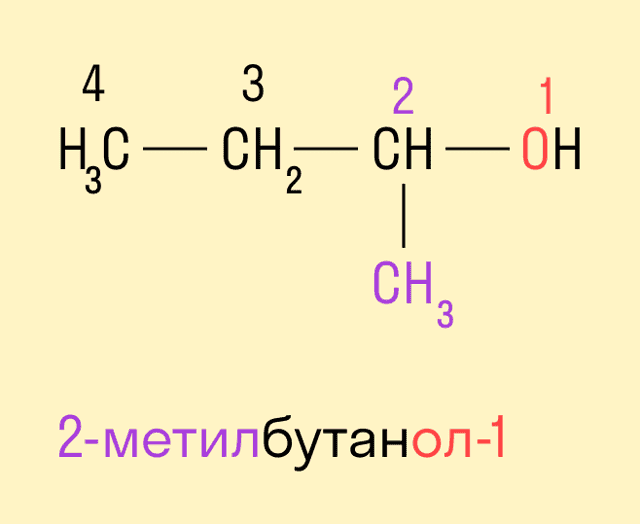
Если в составе спирта присутствуют другие функциональные группы, то нумерация углеродного скелета начинается с того края, где расположена старшая функциональная группа. В таком случае перед названием указывают цифрой, от какого атома углерода идет ответвление.
Радикально-функциональная номенклатура
По такому способу название спирта формируется от названия радикала с добавлением слова «спирт». Например:
- СH3—OH — метанол или метиловый спирт;
- C2H5OH — этанол или этиловый спирт;
- CH3—CH2—CH2—СН2—OH — бутанол или бутиловый спирт.
Тривиальная номенклатура
Тривиальные названия были даны спиртам по источнику природного получения. Например, метанол называют древесным спиртом, а этанол — винным спиртом. Показали некоторые тривиальные названия спиртов в таблице:
| CH3—OH | Метанол | Древесный спирт |
| CH3—CH2—OH | Этанол | Винный спирт |
| CH3—CH2—CH2—CH2—CH2—OH | Пентанол-1 | Амиловый спирт |
| Этандиол-1,2 | Этиленгликоль | |
| Пропантриол-1,2,3 | Глицерин |
Изомерия — это явление существования соединений, у которых одинаковый качественный и количественный состав, но различное строение, а значит, разные свойства.
Давайте рассмотрим виды изомерии, которые характерны для спиртов.
Структурная
-
Изомерия углеродного скелета характерна для спиртов, в состав которых входит четыре и более атомов углерода.
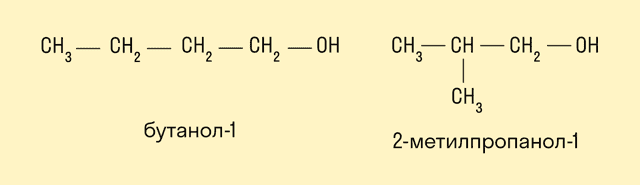
-
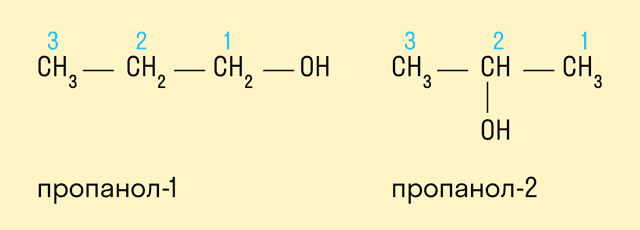
Изомерия положения гидроксильной группы.
Межклассовая
Межклассовые изомеры — это вещества, которые относятся к разным классам и имеют различное строение, но одинаковый состав.
Для спиртов межклассовыми изомерами являются простые эфиры. Общая формула спиртов и простых эфиров — CnH2n+2O.
Пространственная (оптическая)
Например, бутанол-2, в молекуле которого второй атом углерода соединен с четырьмя различными заместителями, существует в форме двух различных оптических изомеров.
Получение спиртов
Гидролиз галогенопроизводных алканов
Галогенпроизводные алканов реагируют с водным раствором щелочей, результатом реакции является образование спиртов. Атом галогена в галогеналкане замещается на гидроксогруппу.
Гидратация алкенов
Присоединение молекул воды происходит в присутствии минеральных кислот и при нагревании.
Если в реакцию вступают несимметричные алкены, то процесс гидратации подчиняется правилу Марковникова. Атом водорода присоединяется к наиболее гидрированному атому углерода, а гидроксогруппа соединяется с соседним атомом углерода, наименее гидрированным.
Восстановление альдегидов и кетонов
Восстановление проводят каталитическим гидрированием карбонильной группы. Катализаторами могут быть никель, платина, палладий. Первичные спирты образуются из альдегидов, вторичные — из кетонов.
- СН3—СНО + Н2 → CH3—CH2—OH
- CH3—C(O)—CH3 + H2 → CH3—CH(OH)—CH3
- Альдегиды и кетоны можно восстанавливать, действуя на них разными восстановителями, например, комплексным алюмогидридом лития LiAlH4.
Реакция Канниццаро
Это окислительно-восстановительная реакция диспропорционирования альдегидов в первичные спирты и карбоновые кислоты под действием оснований.
2СH3—CHO + NaOH → CH3—CH2—OH + CH3—COONa
Гидролиз сложных эфиров
Процесс гидролиза заключается в том, что под действием воды происходит расщепление сложных эфиров. Гидролиз может протекать в кислой и щелочной среде. Гидролиз в щелочной среде является процессом необратимым, так как происходит омыление, т. е. образование солей карбоновых кислот.
Синтез Гриньяра
Синтез с использованием реактива Гриньяра. Реактивы Гриньяра — магнийорганические соединения, содержащие ковалентную связь C—Mg. Чаще всего их получают из органилгалогенидов вида R—X, где X = Cl, Br, I и магния в безводной среде.
- Первичные спирты получают из муравьиного альдегида.
- Уксусный альдегид и другие альдегиды дают вторичные спирты.
- Кетоны и сложные эфиры образуют третичные спирты.
Получение метанола из синтез-газа
Основной промышленный метод получения метанола состоит из двух этапов:
-
Получение синтез-газа с помощью паровой, парокислородной или пароуглекислотной конверсии природного газа.
-
Синтез метанола путем восстановления оксида и диоксида углерода водородом на катализаторе.
Получение этанола
Этанол можно получить путем ферментативного брожения глюкозы (спиртовое брожение).
С6Н12О6 → 2C2H5OH + 2CO2
Реакция Вагнера
Окисление алкенов холодным раствором перманганатом калия в нейтральной среде (реакция Вагнера).
3CH2=CH2 + 2KMnO4 + 4H2O → HO—CH2—CH2—OH + 2MnO2 + 2KOH
Гидролиз жиров
Многоатомные спирты можно получить путем гидролиза жиров. При взаимодействии кислот с жирами происходит образование глицерина и карбоновых кислот.
Физические свойства спиртов
В основном все виды спиртов — это жидкости, имеющие относительно высокие температуры кипения. Температуры кипения выше у многоатомных спиртов и фенолов.
Температуры кипения спиртов
| Метанол | CH3—OH | 64 |
| Этанол | CH3—CH2—OH | 78 |
| Пропанол-1 | CH3—CH2—CH2—OH | 92 |
| Бутанол-1 | CH3—CH2—CH2—CH2—OH | 118 |
| Этандиол-1,2 (этиленгликоль) | 197 | |
| Пропантриол-1,2,3 (глицерин) | 290 |
Общая формула одноатомных предельных спиртов: CnH2n+1OH. В спиртах, одноатомных и многоатомных, помимо связи между углеродом и водородом (С—ОН), есть еще одна связь между кислородом и водородом (О—Н). Поэтому химические реакции проходят с разрывом одной из цепей:
- реакции восстановления проходят с отщеплением гидроксильной группы от молекулы спирта;
- реакции окисления — с отщеплением водорода.
Низшие спирты (метанол, этанол, пропанол, изопропанол, этиленгликоль и глицерин) смешиваются с водой в любых соотношениях.
Кислотно-основные свойства
Согласно теории Бренстеда-Лоури спирты — достаточно слабые кислоты. Кислотность спиртов уменьшается по мере усложнения углеродного скелета.
- Взаимодействие со щелочными металлами: 2С2Н5ОН + 2Na → 2C2H5ONa + H2.
- Взаимодействие со щелочами: С2H5OH + NaOH ⇄ C2H5ONa + H2O.
Спирты — более слабые кислоты, чем вода, поэтому невозможна реакция с водными растворами щелочей. Взаимодействие с твердыми щелочами возможно, реакция обратима. Равновесие сильно смещено влево.
Основность кислот увеличивается по мере увеличения углеродного скелета.
Замещение гидроксогруппы
Гидроксогруппа является плохо уходящей. Энергия разрыва связи С—О довольно высока, поэтому непосредственное замещение группы ОН на другую группу невозможно.
Для того, чтобы замещение было возможно, группу ОН превращают в хорошо уходящую, т. е. понижают энергию разрыва связи. Для этого:
- проводят реакцию в кислой среде;
- переводят гидроксигруппу в сульфогруппу применяя H2SO4;
- применяют кислоты Льюиса.
- R—OH + PCl5 → R—Cl + POCl3 + HCl
- R—OH + SOCl2 → R—Cl + SO2 + HCl
- R—OH + HCl → R—Cl + H2O
- R—OH + PBr → R—Br + H3PO3
- R—OH + KBr + H2SO4 → R—Br + KHSO4 + H2O
Реакция с использованием реактива Лукаса
Реактив Лукаса — это смесь ZnCl2 и HCl. Скорость реакции убывает при упрощении углеродного скелета. Внешним признаком реакции служит расслоение реакционной смеси в случае образования хлоруглеводорода R—Cl, представляющего собой маслообразное нерастворимое вещество.
- Быстрее всего реагируют третичные спирты, слой нерастворимого алкилгалогенида появляется фактически сразу же после смешения реагентов — меньше чем за минуту.
- Вторичные спирты вначале растворяются в реактиве, но затем раствор мутнеет, в течение 5 минут появляются капли алкилгалогенида.
- Растворы первичных спиртов остаются прозрачными, они образуют хлориды только при нагревании.
Дегидратация спиртов
При температуре &rt; 140°C и в присутствии серной кислоты происходит внутримолекулярная дегидратация. В результате реакции получается алкен.
При температуре < 140°C и в присутствии серной кислоты происходит межмолекулярная дегидратация. В результате образуется простой эфир.
Реакция этерификации — получение сложных эфиров
Предельные одноатомные спирты вступают в химические реакции с карбоновыми кислотами, продукты таких реакций — сложные эфиры.
Взаимодействие с аммиаком
Эта реакция происходит при нагревании и в присутствии катализатора. Гидроксогруппа замещается на аминогруппу. Продукт реакции — амин.
Окисление
-
Горение спиртов: C2H5OH + 3O2 → 2CO2 + 3H2O.
-
Жидкофазное окисление с применением хромовой смеси K2Cr2O7 + H2SO4: 3C2H5OH + K2Cr2O7 + 4H2SO4 → 3CH3COOH + K2SO4 + Cr2(SO4)3 + H2O.
-
Окисление оксидом меди (II) при нагревании: CH3—CH2—OH + CuO → CH3—CHO + Cu + H2O.
Первичные спирты при окислении образуют альдегиды, вторичные переходят в кетоны, третичные окисляются с разрушением углеродного скелета.
Химические свойства многоатомных спиртов
В целом многоатомные спирты сходны с одноатомными, но имеют особенности: проявляют более сильные кислотные свойства и вступают в специфические реакции.
Кислотные свойства
Многоатомные спирты взаимодействуют с щелочными металлами:
Взаимодействие со свежеосажденным гидроксидом меди (II)
Это качественная реакция на многоатомные спирты:
Окисление йодной кислотой и ее солями
Образование эфиров с азотной кислотой
Вопросы для самопроверки
-
Что такое спирты?
-
Что образуется при межмолекулярной дегидратации спиртов?
-
Какую качественную реакцию имеют многоатомные спирты?
-
Какой характерной реакцией можно получить этанол?
-
Напишите все виды изомерии для пентанола-1.
-
Как классифицируют спирты?
Учёба без слёз
Пошаговый гайд от Екатерины Мурашовой о том, как перестать делать уроки за ребёнка и выстроить здоровые отношения с учёбой
3.5. Характерные химические свойства предельных одноатомных и многоатомных спиртов, фенола
- В зависимости от типа углеводородного радикала, а также в некоторых случаях особенностей прикрепления группы -ОН к этому углеводородному радикалу соединения с гидроксильной функциональной группой разделяют на спирты и фенолы.
- Спиртами называют соединения, в которых гидроксильная группа соединена с углеводородным радикалом, но не присоединена непосредственно к ароматическому ядру, если таковой имеется в структуре радикала.
- Примеры спиртов:
Если в структуре углеводородного радикала содержится ароматическое ядро и гидроксильная группа, при том соединена непосредственно с ароматическим ядром, такие соединения называют фенолами.
Примеры фенолов:
Почему же фенолы выделяют в отдельный от спиртов класс? Ведь, например, формулы
очень похожи и создают впечатление веществ одного класса органических соединений.
Однако непосредственное соединение гидроксильной группы с ароматическим ядром существенно влияет на свойства соединения, поскольку сопряженная система π-связей ароматического ядра сопряжена также и с одной из неподеленных электронных пар атома кислорода. Из-за этого в фенолах связь О-Н более полярна по сравнению со спиртами, что существенно повышает подвижность атома водорода в гидроксильной группе. Другими словами, у фенолов значительно ярче, чем у спиртов выражены кислотные свойства.
Химические свойства спиртов
Одноатомные спирты
Реакции замещения
Замещение атома водорода в гидроксильной группе
1) Спирты реагируют со щелочными, щелочноземельными металлами и алюминием (очищенным от защитной пленки Al2O3), при этом образуются алкоголяты металлов и выделяется водород:
- Образование алкоголятов возможно только при использовании спиртов, не содержащих растворенной в них воды, так как в присутствии воды алкоголяты легко гидролизуются:
- CH3OK + Н2О = СН3ОН + KOH
- 2) Реакция этерификации
- Реакцией этерификации называют взаимодействие спиртов с органическими и кислородсодержащими неорганическими кислотами, приводящее к образованию сложных эфиров.
- Такого типа реакции являются обратимыми, поэтому для смещения равновесия в сторону образования сложного эфира, реакцию желательно проводить при нагревании, а также в присутствии концентрированной серной кислоты как водоотнимающего агента:
Замещение гидроксильной группы
1) При действии на спирты галогеноводородных кислот происходит замещение гидроксильной группы на атом галогена. В результате такой реакции образуются галогеналканы и вода:
2) При пропускании смеси паров спирта с аммиаком через нагретые оксиды некоторых металлов (чаще всего Al2O3) могут быть получены первичные, вторичные или третичные амины:
Тип амина (первичный, вторичный, третичный) будет в некоторой степени зависеть от соотношения исходного спирта и аммиака.
Реакции элиминирования (отщепления)
Дегидратация
- Дегидратация, фактически подразумевающая отщепление молекул воды, в случае спиртов различается на межмолекулярную дегидратацию и внутримолекулярную дегидратацию.
- При межмолекулярной дегидратации спиртов одна молекула воды образуется в результате отщепления атома водорода от одной молекулы спирта и гидроксильной группы — от другой молекулы.
- В результате этой реакции образуются соединения, относящиеся к классу простых эфиров (R-O-R):
Внутримолекулярная дегидратация спиртов протекает таким образом, что одна молекула воды отщепляется от одной молекулы спирта. Данный тип дегидратации требует несколько более жестких условий проведения, заключающихся в необходимости использования заметно более сильного нагревания по сравнению с межмолекулярной дегидратацией. При этом из одной молекулы спирта образуется одна молекула алкена и одна молекула воды:
Поскольку молекула метанола содержит только один атом углерода, для него невозможна внутримолекулярная дегидратация. При дегидратации метанола возможно образование только простого эфира (CH3-O-CH3).
Нужно четко усвоить тот факт, что в случае дегидратации несимметричных спиртов внутримолекулярное отщепление воды будет протекать в соответствии с правилом Зайцева, т.е. водород будет отщепляться от наименее гидрированного атома углерода:
Дегидрирование спиртов
- а) Дегидрирование первичных спиртов при нагревании в присутствии металлической меди приводит к образованию альдегидов:
- б) В случае вторичных спиртов аналогичные условия приведут у образованию кетонов:
в) Третичные спирты в аналогичную реакцию не вступают, т.е. дегидрированию не подвергаются.
Реакции окисления
Горение
Спирты легко вступают в реакцию горения. При этом образуется большое количество тепла:
2СН3-ОН + 3O2 = 2CO2 + 4H2O + Q
Неполное окисление
Неполное окисление первичных спиртов может приводить к образованию альдегидов и карбоновых кислот.
В случае неполного окисления вторичных спиртов возможно образование только кетонов.
Неполное окисление спиртов возможно при действии на них различных окислителей, например, таких, как кислород воздуха в присутствии катализаторов (металлическая медь), перманганат калия, дихромат калия и т.д.
При этом из первичных спиртов могут быть получены альдегиды. Как можно заметить, окисление спиртов до альдегидов, по сути, приводит к тем же органическим продуктам, что и дегидрирование:
Следует отметить, что при использовании таких окислителей, как перманганат калия и дихромат калия в кислой среде возможно более глубокое окисление спиртов, а именно до карбоновых кислот. В частности, это проявляется при использовании избытка окислителя при нагревании. Вторичные спирты могут в этих условиях окислиться только до кетонов.
ПРЕДЕЛЬНЫЕ МНОГОАТОМНЫЕ СПИРТЫ
Замещение атомов водорода гидроксильных групп
Многоатомные спирты так же, как и одноатомные реагируют со щелочными, щелочноземельными металлами и алюминием (очищенным от пленки Al2O3); при этом может заместиться разное число атомов водорода гидроксильных групп в молекуле спирта:
2. Поскольку в молекулах многоатомных спиртов содержится несколько гидроксильных групп, они оказывают влияние друг на друга за счет отрицательного индуктивного эффекта. В частности, это приводит к ослаблению связи О-Н и повышению кислотных свойств гидроксильных групп.
Большая кислотность многоатомных спиртов проявляется в том, что многоатомные спирты, в отличие от одноатомных, реагируют с некоторым гидроксидами тяжелых металлов. Например, нужно запомнить тот факт, что свежеосажденный гидроксид меди реагирует с многоатомными спиртами с образованием ярко-синего раствора комплексного соединения.
Так, взаимодействие глицерина со свежеосажденными гидроксидом меди приводит к образованию ярко-синего раствора глицерата меди:
Данная реакция является качественной на многоатомные спирты. Для сдачи ЕГЭ достаточно знать признаки этой реакции, а само уравнение взаимодействия уметь записывать необязательно.
3. Так же, как и одноатомные спирты, многоатомные могут вступать в реакцию этерификации, т.е. реагируют с органическими и кислородсодержащими неорганическими кислотами с образованием сложных эфиров.
Данная реакция катализируется сильными неорганическими кислотами и является обратимой.
В связи с этим при осуществлении реакции этерификации образующийся сложный эфир отгоняют из реакционной смеси, чтобы сместить равновесие вправо по принципу Ле Шателье:
- Если в реакцию с глицерином вступают карбоновые кислоты с большим числом атомов углерода в углеводородном радикале, получающиеся в результате такой реакции, сложные эфиры называют жирами.
- В случае этерификации спиртов азотной кислотой используют так называемую нитрующую смесь, представляющую собой смесь концентрированных азотной и серной кислот. Реакцию проводят при постоянном охлаждении:
Сложный эфир глицерина и азотной кислоты, называемый тринитроглицерином, является взрывчатым веществом. Кроме того, 1%-ный раствор данного вещества в спирте обладает мощным сосудорасширяющим действием, что используется при медицинских показаниях для предотвращения приступа инсульта или инфаркта.
Замещение гидроксильных групп
Реакции данного типа протекают по механизму нуклеофильного замещения. К взаимодействиям такого рода относится реакция гликолей с галогеноводородами.
Так, например, реакция этиленгликоля с бромоводородом протекает с последовательным замещением гидроксильных групп на атомы галогена:
Химические свойства фенолов
Как уже было сказано в самом начале данной главы, химические свойства фенолов заметно отличаются от химических свойств спиртов. Связано это с тем, что одна из неподеленных электронных пар атома кислорода в гидроксильной группе сопряжена с π-системой сопряженных связей ароматического кольца.
Реакции с участием гидроксильной группы
Кислотные свойства
- Фенолы являются более сильными кислотами, чем спирты, и в водном растворе в очень небольшой степени диссоциированы:
- Большая кислотность фенолов по сравнению со спиртами в плане химических свойств выражается в том, что фенолы, в отличие от спиртов, способны реагировать со щелочами:
- Однако, кислотные свойства фенола выражены слабее, чем даже у одной из самых слабых неорганических кислот – угольной. Так, в частности, углекислый газ, при пропускании его через водный раствор фенолятов щелочных металлов, вытесняет из последних свободный фенол как еще более слабую, чем угольная, кислоту:
- Очевидно, что любой другой более сильной кислотой фенол также будет вытесняться из фенолятов:
3) Фенолы являются более сильными кислотами, чем спирты, а спирты при этом реагируют с щелочными и щелочноземельными металлами. В связи с этим очевидно, что и фенолы будут реагировать с указанными металлами. Единственное, что в отличие от спиртов, реакция фенолов с активными металлами требует нагревания, так как и фенолы, и металлы являются твердыми веществами:
Реакции замещения в ароматическом ядре
Гидроксильная группа является заместителем первого рода, и это значит, что она облегчает протекание реакций замещения в орто- и пара-положениях по отношению к себе. Реакции с фенолом протекают в намного более мягких условиях по сравнению с бензолом.
Галогенирование
Реакция с бромом не требует каких-либо особых условий. При смешении бромной воды с раствором фенола мгновенно образуется белый осадок 2,4,6-трибромфенола:
Нитрование
При действии на фенол смеси концентрированных азотной и серной кислот (нитрующей смеси) образуется 2,4,6-тринитрофенол – кристаллическое взрывчатое вещество желтого цвета:
Реакции присоединения
Поскольку фенолы являются ненасыщенными соединениями, возможно их гидрирование в присутствии катализаторов до соответствующих спиртов:






