- Реакции с металлами
- Реакции с кислотами
- Реакции с другими солями
- Термическое разложение
- Химические свойства металлов
- 1. Взаимодействие металлов с неметаллами
- 2. Взаимодействие металлов с водой
- 3. Взаимодействие металлов с растворами солей
- 4. Взаимодействие металлов с растворами щелочей
- 5. Взаимодействие металлов с кислотами
- Химические свойства солей — реакции, определение и примеры
- Классификация и номенклатура солей
- Кислые соли
- Средние соли
- Основные соли
- Двойные соли
- Смешанные соли
- Комплексные соли
- Гидратные соли
- Получение солей
- Получение средних солей
- Получение кислых солей
- Получение основных солей
- Получение двойных солей
- Химические свойства солей
- Химические свойства средних солей
- Характерные химические свойства солей
- Классификация солей
- Химические свойства солей
- Характерные химические свойства солей: средних, кислых, основных, комплексных (на примере соединений алюминия и цинка)
- Взаимодействие средних солей с гидроксидами металлов
- Реакции средних солей с кислотами
- Реакции средних солей с другими средними солями
- Реакции термического разложения солей
- Разложение карбонатов
- Разложение нитратов
- Разложение солей аммония
- Химические свойства кислых солей
- Отношение кислых солей к щелочам и кислотам
- Термическое разложение кислых солей
- Химические свойства основных солей
- Химические свойства комплексных солей (на примере соединений алюминия и цинка)
Архив уроков › Химия 8 класс
В уроке 40 «Химические свойства солей» из курса «Химия для чайников» рассмотрим реакции солей с металлами, кислотами, со щелочами и другими солями.

Для большинства солей характерны реакции замещения и обмена, а для некоторых — еще и реакции разложения.
Реакции с металлами
Соли реагируют с металлами по общей схеме:

Образующиеся в этих реакциях менее активные металлы осаждаются на поверхности более активных металлов в виде рыхлой корочки. Если менее активным металлом является жидкая ртуть, она выделяется в виде сплошной блестящей пленки.
На этом ее свойстве основан очень интересный опыт «Серебрение монеты». В раствор соли ртути Hg(NO3)2опускают медную монету и практически сразу же ее поверхность становится блестящей, как серебро.
Этот блеск никак не связан с серебром, он обусловлен выделением блестящей ртути:
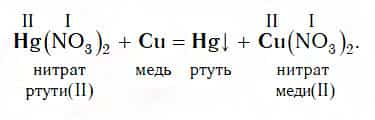
Следует помнить, что ртуть и ее соли сильно ядовиты! Поэтому данный опыт ни в коем случае нельзя пытаться выполнить самостоятельно.
Реакции с кислотами
Вы изучили химические свойства кислот и уже знаете, что в водных растворах они реагируют с солями, образуя новые кислоты и новые соли.
А можно ли сказать, что соли реагируют с кислотами с образованием тех же продуктов? Конечно, можно! Вы ведь уже хорошо знаете, как можно применить в химии математическое правило «от перемены мест слагаемых сумма не меняется».
Действительно, если кислоты реагируют с солями, то почему бы солям не реагировать с кислотами.
Итак, в водных растворах соли реагируют с кислотами по общей схеме:

Реакции этого типа относятся к реакциям обмена, поскольку участвующие в них исходные вещества обмениваются своими составными частями.
Изучив химические свойства оснований, вы узнали, что щелочи (растворимые основания) реагируют с солями, образуя новые основания и новые соли.
Будет совершенно правильным, если вы теперь скажете: «Эти же продукты образуются и при взаимодействии солей с основаниями».
Уже в который раз мы с вами убеждаемся в том, что из одних и тех же исходных веществ, независимо от порядка их смешивания, образуются одни и те же продукты.
Итак, соли реагируют с щелочами по общей схеме:

Реакции с другими солями
Соли в водных растворах вступают в реакции обмена с другими солями по общей схеме:

Термическое разложение
Соли некоторых кислородсодержащих кислот разлагаются с образованием основного и кислотного оксидов по общей схеме:
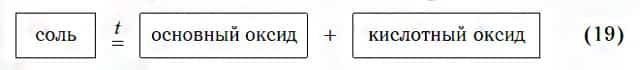
В ходе таких реакций всегда образуется газообразный кислотный оксид. Он соответствует той кислоте, остаток которой содержится в исходной соли. Вы помните, что угольной кислоте H2CO3 соответствует кислотный оксид CO2. Поэтому при разложении соли, содержащей остаток угольной кислоты, образуется указанный кислотный оксид:
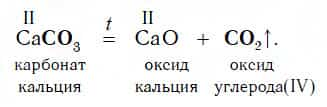
По приведенной схеме разлагаются и некоторые соли сернистой кислоты H2SO3, которой соответствует кислотный оксид SO2:
Краткие выводы урока:
- Соли реагируют с металлами, кислотами, основаниями и другими солями.
Надеюсь Урок 40 «Химические свойства солей» был понятным и познавательным. Если у вас возникли вопросы, пишите их в комментарии.
Химические свойства металлов
Металлы занимают в Периодической таблице левый нижний угол. Металлы относятся к семействам s-элементов, d-элементов, f-элементов и частично – р-элементов.
Самым типичным свойством металлов является их способность отдавать электроны и переходить в положительно заряженные ионы. Причём металлы могут проявлять только положительную степень окисления.
Ме – ne = Men+
1. Взаимодействие металлов с неметаллами
- а) Взаимодействие металлов с водородом.
- С водородом непосредственно реагируют щелочные и щелочноземельные металлы, образуя гидриды.
- Например:
- 2Na + H2 = NaH
- Ca + H2 = CaH2
- Образуются нестехиометрические соединения с ионной кристаллической структурой.
- б) Взаимодействие металлов с кислородом.
- Все металлы за исключением Au, Ag, Pt окисляются кислородом воздуха.
- Пример:
- 2Na + O2 = Na2O2 (пероксид)
- 4K + O2 = 2K2O
- 2Mg + O2 = 2MgO
- 2Cu + O2 = 2CuO
- в) Взаимодействие металлов с галогенами.
- Все металлы реагируют с галогенами с образованием галогенидов.
- Пример:
- 2Al + 3Br2 = 2AlBr3
- В основном это ионные соединения: MeHaln
- г) Взаимодействие металлов с азотом.
- С азотом взаимодействуют щелочные и щелочноземельные металлы.
- Пример:
- 3Ca + N2 = Ca3N2
- Mg + N2 = Mg3N2 – нитрид.
- д) Взаимодействие металлов с углеродом.
Соединения металлов и углерода – карбиды.
Они образуются при взаимодействии расплавов с углеродом. Активные металлы образуют с углеродом стехиометрические соединения:
4Al + 3C = Al4C3
Металлы – d-элементы образуют соединения нестехиометрического состава типа твердых растворов: WC, ZnC, TiC – используются для получения сверхтвёрдых сталей.
2. Взаимодействие металлов с водой
- Активные металлы более активно реагируют с водой, разлагая воду с выделением водорода.
- Na + 2H2O = H2↑ + 2NaOH
- Менее активные металлы медленно разлагают воду и процесс тормозится из-за образования нерастворимых веществ.
3. Взаимодействие металлов с растворами солей
Такая реакция возможна, если реагирующий металл активнее, чем находящийся в соли:
Zn + CuSO4= Cu0↓ + ZnSO4
= – 0,76 B., = + 0,34 B.
Металл, обладающий более отрицательным или менее положительным стандартным электродным потенциалом, вытесняет другой металл из раствора его соли.
4. Взаимодействие металлов с растворами щелочей
Со щелочами могут взаимодействовать металлы, дающие амфотерные гидрооксиды или обладающие высокими степенями окисления в присутствии сильных окислителей. При взаимодействии металлов с растворами щелочей, окислителем является вода.
- Пример:
- Zn + 2NaOH + 2H2O = Na2[Zn(OH)4] + H2↑
- 1 Zn0 + 4OH– – 2e = [Zn(OH)4]2– окисление
- Zn0 – восстановитель
- 1 2H2O + 2e = H2 + 2OH– восстановление
- H2O – окислитель
- Zn + 4OH– + 2H2O = [Zn(OH)4]2– + 2OH– + H2↑
- Металлы, обладающие высокими степенями окисления, могут взаимодействовать со щелочами при сплавлении:
- 4Nb +5O2 +12KOH = 4K3NbO4 + 6H2O
5. Взаимодействие металлов с кислотами
- Это сложные реакции, продукты взаимодействия зависят от активности металла, от вида и концентрации кислоты и от температуры.
- По активности металлы условно делятся на активные, средней активности и малоактивные.
- Кислоты условно делятся на 2 группы:
I группа – кислоты, обладающие невысокой окислительной способностью: HCl, HI, HBr, H2SO4(разб.), H3PO4, H2S, окислитель здесь H+. При взаимодействии с металлами выделяется кислород (H2↑).
С кислотами первой группы реагируют металлы, обладающие отрицательным электродным потенциалом.
II группа – кислоты, обладающие высокой окислительной способностью: H2SO4(конц.), HNO3(разб.), HNO3(конц.). В этих кислотах окислителями являются анионы кислоты: . Продукты восстановления аниона могут быть самыми разнообразными и зависят от активности металла.
- H2S↑ – c активными металлами
- 6+ +8е
- H2SO4 +6е S0↓ – с металлами средней активности
- SO2↑ – c малоактивными металлами
- NH3 ( NH4NO3 )– c активными металлами
- 5+ +8e
- HNO3 +4,5e N2O, N2 – с металлами средней активности
- разб.
- +3e
- NO – c малоактивными металлами
HNO3(конц.) – NO2↑ – c металлами любой активности.
Если металлы обладают переменной валентностью, то с кислотами I группы металлы приобретают низшую положительную степень окисления: Fe → Fe2+, Cr → Cr2+. При взаимодействии с кислотами II группы – степень окисления +3: Fe → Fe3+, Cr → Cr3+, при этом никогда не выделяется водород.
Некоторые металлы (Fe, Cr, Al, Ti, Ni и др.) в растворах сильных кислот, окисляясь, покрываются плотной оксидной плёнкой, которая защищает металл от дальнейшего растворения (пассивация), но при нагревании оксидная плёнка растворяется, и реакция идёт.
Малорастворимые металлы, обладающие положительным электродным потенциалом, могут растворяться в кислотах I группы, в присутствии сильных окислителей.
Химические свойства солей — реакции, определение и примеры
Соли — это сложные вещества, в состав которых входят катионы металла и анионы кислотного остатка. Иногда в состав солей входят водород или гидроксид-ион.
Классификация и номенклатура солей
Так как соли — это продукт полного или частичного замещения металлом атома водорода в кислоте, по составу их можно классифицировать следующим образом.
Кислые соли
Образованы неполным замещением атомов водорода на металл в кислоте.
В наименованиях кислых солей указывают количество водорода приставками «гидро-» или «дигидро-», название кислотного остатка и название металла. Если металл имеет переменную валентность, то в скобках указывают валентность.
Примеры кислых солей и их наименования:
- LiHCO3 — гидрокарбонат лития,
- NaHSO4 — гидросульфат натрия,
- NaH2PO4 — дигидрофосфат натрия.
Средние соли
Образованы полным замещением атомов водорода в кислоте на металл.
Наименования средних солей складываются из названий кислотного остатка и металла. При необходимости указывают валентность.
Примеры средних солей с названиями:
- CuSO4 — сульфат меди (II),
- CaCl2 — хлорид кальция.
Основные соли
- Продукт неполного замещения гидроксогрупп на кислотный остаток.
- В наименованиях основных солей указывают количество гидроксид-ионов приставкой «гидроксо-» или «дигидроксо-», название кислотного остатка и название металла с указанием валентности.
- Пример: Mg(OH)Cl — гидроксохлорид магния.
Двойные соли
- В состав входят два разных металла и один кислотный остаток.
- Наименование складывается из названия аниона кислотного остатка и названий металлов с указанием валентности (если металл имеет переменную валентность).
- Примеры двойных солей и их наименования:
- KNaSO4 — сульфат калия-натрия,
- KAl(SO4)2 — сульфат калия-алюминия.
Смешанные соли
- Содержат один металл и два разных кислотных остатка.
- Наименования смешанных солей складываются из названия кислотных остатков (по усложнению) и названия металла с указанием валентности (при необходимости).
- Примеры смешанных солей с наименованиями:
- CaClOCl — хлорид-гиполхорит кальция,
- PbFCl — фторид-хлорид свинца (II).
Комплексные соли
- Образованы комплексным катионом или анионом, связанным с несколькими лигандами.
- Называют комплексные соли по схеме: координационное число + лиганд с окончанием «-о» + комплексообразователь с окончанием «-ат» и указанием валентности + внешняя сфера, простой ион в родительном падеже.
- Пример: K[Al(OH)4] — тетрагидроксоалюминат калия.
Гидратные соли
- В состав входит молекула кристаллизационной воды.
- Число молекул воды указывают численной приставкой к слову «гидрат» и добавляют название соли.
- Пример: СuSO4∙5H2O — пентагидрат сульфата меди (II).
Получение солей
Получение средних солей
Средние соли можно образовать в ходе следующих реакций:
-
- Металл + неметалл:
- 2Na + Cl2 = 2NaCl
- Fe + S =FeS
- Так получают только соли бескислородных кислот.
-
Металл, стоящий левее H2 в ряду активности, с раствором кислоты:
Mg + 2HCl = MgCl2 + H2
-
Металл с раствором соли менее активного металла:
Fe + CuCl2 = FeCl2 + Cu
-
Основный оксид + кислотный оксид:
Na2O + CO2 = Na2CO3
-
Основный оксид и кислота:
CuO + H2SO4= CuSO4 + H2O
-
Основание с кислотным оксидом:
2NaOH + SO3 = Na2SO4 + H2O
-
Основание с кислотой (реакция нейтрализации):
Ca(OH)2 + 2HCl = CaCl2 + 2H2O
-
- Взаимодействие соли с кислотой:
- MgCO3 + 2HCl = MgCl2 + H2O + CO2
- BaCl2 + H2SO4 = BaSO4 + 2HCl
- Взаимодействие возможно, если одним из продуктов реакции будет нерастворимая соль, вода или газ.
-
Реакция раствора основания с раствором соли:
2NaOH + CuSO4 = Na2SO4 + Ba(OH)2
-
Взаимодействие растворов двух солей с образованием новых солей:
NaCl + AgNO3 = AgCl + NaNO3
Получение кислых солей
Кислые соли образуются при взаимодействии:
-
Кислот с металлами:
Zn + 2H2SO4 = H2 + Zn(HSO4)2
-
Кислот с оксидами металлов:
CaO + H3PO4 = CaHPO4 + H2O
-
Гидроксидов металлов с кислотами:
Ba(OH)2 + H3PO4 = BaHPO4 + 2H2O
-
Кислот с солями:
Ca3PO4 + 4H3PO4 = 3Ca(H2PO4)2
-
Аммиака с кислотами:
NH3 + H3PO4 = NH4H2PO4
- Получение кислых солей возможно, если кислота в избытке.
- Также кислые соли образуются в ходе реакции основания с избытком кислотного оксида:
- KOH + CO2 = KHCO3
- 2SO2 + Ca(OH)2 = Ca(HSO3)2
Получение основных солей
-
Взаимодействие кислоты с избытком основания:
Fe(OH)3 + HCl = Fe(OH)2Cl + H2O
-
Добавление (по каплям) небольших количеств щелочей к растворам средних солей металлов:
Cu(NO3)2 + NaOH = CuOHNO3 + NaNO3
-
Взаимодействие солей слабых кислот со средними солями:
2MgCl2 + 2Na2CO3 + H2O = [Mg(OH)]2CO3 + CO2 + 4NaCl
- Реакции солей с лигандами:
- AgCl + 2NH3 = [Ag(NH3)2]Cl
- FeCl3 + 6KCN = K3[Fe(CN)6] + 3KCl
- Zn(OH)2 + 2NaOH = Na2[Zn(OH)4]
- Al2O3 + 2NaOH +3H2O = 2Na[Al(OH)4]
-
Растворимые соли являются электролитами, следовательно, могут распадаться на ионы. Средние соли диссоциируют сразу:
NaCl → Na+ + Cl-
-
- Термическое разложение:
- CaCO3 = CaO + CO2
- Нитраты разлагаются в зависимости от активности металла соли:
Получение двойных солей
Двойные соли получают совместной кристаллизацией двух солей:
Cr2(SO4)3 + K2SO4 + 24H2O = 2[KCr(SO4) 2 • 12H2O]
Химические свойства солей
Химические свойства средних солей
Характерные химические свойства солей
Характерные химические свойства солей добавить в закладки
Соли –это сложные вещества, которые являются продуктами замещения атомов водорода в молекулах кислот атомами металлов.
Общим способом получения солей является взаимодействие оснований с кислотами:
NaOH + HCl = NaCl + H2O (так же эту реакцию называют реакцией нейтрализации, т.к. соли не имеют среды – она нейтральна)
Общая формула солей: Mex(Ac)y, где
- Me – металл,
- x и y – индексы,
- Ac – кислотный остаток.
Классификация солей
(III) Приставка «ди» используется, если в молекуле основной соли с одним атомом Me связаны с гидроксильными группами.
- Средние (нормальные) соли – это продукты полного замещения атомов водорода на металл.
Название средней соли = название Ac + название Me + валентность Me
- NaCl – хлорид натрия
- Fe(NO3)2 — нитрат железа (II)
- Кислые соли – это продукты неполного замещения атомов водорода на Me.
Название кислой соли = «Гидро» или «Дигидро» + название Ac + название Me + валентность Me
- NaHCO3 – гидрокарбонат натрия
- KH2PO4 – дигидрофосфат калия
- Основные соли – это соли, которые кроме ионов Me и Ac содержат гидроксогруппы.
Название основной соли = «Гидроксо-» или «Дигидроксо-» + название Ac + название Me + валентность Me
- CaOHCl – гидроксохлорид кальция
- Ca(OH)2SO4 – гидроксосульфат кальция
- Fe(OH)2NO3 – дигидроксонитрат железа
- Комплексные соли – соли, содержащие комплексный ион.
- [Ag(NH3)2]Сl – хлорид диаммин серебра (I)
- [Cu(NH3)4]SO4 – сульфат тетрааммин меди (II)
- K4[Fe(CN)6] – гексацианоферрат (II) калия
Химические свойства солей
I. Средние соли
- Растворимые соли в водных растворах диссоциируют на ионы – катионы Me и анионы Ac.
К примеру, хлорид калия в водном растворе распадается на катионы калия и анионы хлора.
KCl ↔ K— + Cl—
- Соли могут взаимодействовать с металлами, при этом каждый Me, стоящий левее в ряду напряжений Me, способен вытеснять Me, стоящие правее, из их солей.
- Щелочные и щелочноземельные металлы с солями реагировать не будут, так как вступают в реакцию с водой.
- Например, при взаимодействии сульфата меди с железом, происходит замещение меди железом, так как железо более активный металл, чем медь и находится в электрохимическом ряду напряжений левее водорода.
- CuSO4 + Fe → FeSO4 + Cu↓
При взаимодействии сульфида железа с цинком происходит тот же процесс, но в данной реакции более активным металлом является цинк. Цинк вытесняет железо из соединения, в результате происходит образование чистого железа.
FeS + Zn → ZnS + Fe↓
- Реакция растворов солей с растворами щелочей возможна в том случае, когда образующиеся основание или соль выпадают в осадок.
Взаимодействие хлорида железа (III) с раствором гидроксида калия является качественной реакцией на ионы Fe3+. Продуктом реакции будет гидроксид железа (III), который представляет собой бурый осадок с амфотерными свойствами.
FeCl3 + 3KOH → Fe(OH)3↓ + 3KCl
- При взаимодействии соли с кислотой, для того чтобы осуществилась реакция, необходимо образование более слабой кислоты или нерастворимой соли.
В представленной ниже реакции осуществляется взаимодействие между хлоридом бария и серной кислотой. Продуктами реакции являются нерастворимая соль и сильная кислота. Данная реакция является качественной на сульфаты, так как образуется сульфат бария – осадок белого цвета.
BaCl2 + H2SO4 → BaSO4↓ + 2HCl
- Для солей характерно взаимодействие между собой. В этом случае одним из продуктов реакции должна быть нерастворимая соль.
Взаимодействие нитрата серебра с хлоридом калия сопровождается выпадением осадка белого цвета – хлорида серебра. Эта реакция является качественной на хлорид-ионы.
AgNO3 + KCl → AgCl↓ + KNO3
- При нагревании разлагаются соли слабых кислот, соли аммония, а также образованные сильными окислителями или восстановителями.
- Все карбонаты при термическом разложении распадаются на основный оксид и углекислый газ.
- При разложении нитратов следует учитывать следующие условия:
- Если металл находится в ряду напряжений левее магния, то в результате реакции образуется нитрит и кислород. Реакция протекает по следующей схеме:
- Если металл расположен в электрохимическом ряду напряжений между магнием и медью, при этом будет происходить образование оксида металла, диоксида азота и кислорода.
- Если металл находится в ряду напряжений металлов правее меди, при этом наблюдается образование металла, оксида азота (IV) и кислорода.
- Разложение солей аммония также может протекать по-разному. Во многом это зависит от того, каким кислотным остатком она образована.
- Если в состав соли аммония входит кислотный остаток летучей кислоты, то в результате будет образовываться аммиак и летучая кислота.
- Если соль аммония образована нелетучей кислотой, то продуктами реакции будет аммиак и кислая соль.
- Если кислотный остаток соли проявляет окислительные свойства, то в результате разложения образуется молекулярный азот или оксид азота (I).
II. Кислые соли
- Растворимые соли в водных растворах диссоциируют на ионы – катионы Me и сложный анион Ac. Диссоциация протекает в две стадии. Первая стадия всегда необратима, по второй стадии протекает обратимая диссоциация.
KHSO4 → K— + HSO4— HSO4— ↔ H+ + SO42—
- Кислые соли могут взаимодействовать с металлами, стоящими левее водорода. Не стоит в таких реакциях использовать щелочные металлы, так как они прежде всего реагируют с водой. Реакция щелочных металлов с водой протекает бурно с выделением большого количества энергии, при таких условиях может произойти взрыв.
В результате данной реакции образуется средняя соль и водород. Гидросульфат калия при взаимодействии с магнием образует в качестве продуктов реакции молекулярный водород, сульфаты магния и калия.
2KHSO4 + Mg → H2↑ + MgSO4 + K2SO4
- При взаимодействии кислой соли с раствором щелочи образуется средняя соль и вода. Гидрокарбонат натрия способен вступать в реакцию с раствором щелочи, продуктами реакции будут сульфит натрия и вода.
NaHCO3 + NaOH → Na2SO3 + H2O
- При взаимодействии соли с кислотой, для того чтобы осуществилась реакция, необходимо образование более слабой или летучей кислоты. Этот процесс можно рассмотреть на примере реакции гидросульфида калия с серной кислотой. Продуктами реакции является летучая кислота – сероводородная, а также сульфат калия.
2KHS + H2SO4 → K2SO4 + 2H2S
- Для кислых солей характерно взаимодействие со средними солями. Однако, при такой реакции должны образоваться вода, газ или осадок. В противном случае взаимодействие происходить не будет. Очень хорошо это просматривается на примере взаимодействия гидросульфата калия и хлорида бария. Продуктами реакции будут сульфат бария – осадок белого цвета, сульфат калия и хлороводородная кислота.
2KHSO4 + BaSO4↓ + K2SO4 + 2HCl
- При нагревании некоторые соли разлагаются. Ярким примером может служить разложение гидрокарбонатов. В результате реакции образуется вода, углекислый газ и карбонат натрия.
- Реакции разложения гидрокарбонатов кальция и магния являются причиной образования накипи в водонагревательных приборах.
III. Основные соли
- Способны в водных растворах разлагаться на сложные катионы и анионы Ac. Диссоциация проходит в несколько ступеней, причем по первой ступени разложение проходит необратимо. Все последующие ступени протекают обратимо.
Al(OH)2CH3COO → Al(OH)2+ + CH3COO— Al(OH)2+ ↔ AlOH2+ + OH— Al(OH)2+ ↔ Al3+ + OH—
- Основные соли могут взаимодействовать с растворами щелочей с образованием нерастворимого основания и кислой соли. Гидроксонитрат железа (III) и раствор едкого калия при взаимодействии друг с другом образуют нитрат калия и гидрокисд железа (II) – осадок белого цвета.
Fe(OH)NO3 + KOH → Fe(OH)2↓ + KNO3
- При взаимодействии основной соли с кислотой, образуется средняя соль и вода. Взаимодействие гидроксохлорида меди (II) и соляной кислоты протекает с образованием хлорида меди (II) и воды.
CuOHCl + HCl → CuCl2 + H2O
- Характерно термическое разложение основных солей. При разложении дигидроксокарбоната меди (II) образуется оксид меди (II), углекислый газ и вода.
IV. Комплексные соли
- Комплексные соединения в водных растворах практически полностью диссоциируют на внешнюю и внутреннюю сферы, то есть как сильные электролиты (первичная диссоциация).
K4[Fe(CN)6] → 4K+ + [Fe(CN)6]4—
Комплексные ионы, в свою очередь, диссоциируют как слабые электролиты, многоступенчато и обратимо. Это — вторичная диссоциация комплексных ионов.
- [Fe(CN)6]3— ⟷ [Fe(CN)5]2— + CN— [Fe(CN)5]2— ⟷ [Fe(CN)4]— + CN— [Fe(CN)4]— ⟷ [Fe(CN)3] + CN— [Fe(CN)3] ⟷ [Fe(CN)2]+ + CN— [Fe(CN)2]+ ⟷ [Fe(CN)2]2+ + CN— [Fe(CN)]2+ ⟷ Fe3+ + CN—
- Данную многоступенчатую диссоциацию можно выразить суммарно в виде следующего уравнения:
- [Fe(CN)6]3— ⟷ Fe3+ + 6CN—
- Комплексные соли способны вступать в реакции обмена со средними солями. В результате такой реакции образуется две другие соли – комплексная и средняя.
FeCl3 + K4[Fe(CN)6] = Fe4[Fe(CN)6]↓ + 3KCl
Данная реакция является качественной реакции на ионы Fe3+. Нерастворимое соединение, образовавшееся в результате реакции, обладает ультрамариновым цветом и получило название «берлинской лазури» или гексацианоферрат(II) железа(III)-калия.
- При нагревании комплексных солей происходит их разложение.
Тетрагидроксоалюминат натрия распадается на алюминат натрия и воду.
Na[Al(OH)4] → NaAlO2 + 2H2O
- При взаимодействии комплексной соли со средней, происходит разрушение комплексов за счёт образования малорастворимых соединений.
2[Cu(NH3)2]Cl + K2S → CuS↓ + 2KCl + 4NH3↑
Смотри также:
- Номенклатура неорганических веществ
- Характерные химические свойства простых веществ – металлов: щелочных, щелочноземельных, магния, алюминия; переходных металлов (меди, цинка, хрома, железа)
- Характерные химические свойства простых веществ – неметаллов: водорода, галогенов, кислорода, серы, азота, фосфора, углерода, кремния
- Характерные химические свойства оксидов: оснóвных, амфотерных, кислотных
- Характерные химические свойства оснований и амфотерных гидроксидов
- Характерные химические свойства кислот
- Взаимосвязь различных классов неорганических веществ
Характерные химические свойства солей: средних, кислых, основных, комплексных (на примере соединений алюминия и цинка)
Реакция соли с металлом протекает в том случае, если исходный свободный металл более активен, чем тот, который входит в состав исходной соли. Узнать о том, какой металл более активен, можно, воспользовавшись электрохимическим рядом напряжений металлов.
Так, например, железо взаимодействует с сульфатом меди в водном растворе, поскольку является более активным, чем медь (левее в ряду активности):
В то же время железо не реагирует с раствором хлорида цинка, поскольку оно менее активно, чем цинк:
Следует отметить, что такие активные металлы, как щелочные и щелочноземельные, при их добавлении к водным растворам солей будут прежде всего реагировать не с солью, а входящей в состав растворов водой.
Взаимодействие средних солей с гидроксидами металлов
Оговоримся, что под гидроксидами металлов в данном случае понимаются соединения вида Me(OH)x.
Для того чтобы средняя соль реагировала с гидроксидом металла, должны одновременно (!) выполняться два требования:
- в предполагаемых продуктах должен быть обнаружен осадок или газ;
- исходная соль и исходный гидроксид металла должны быть растворимы.
Рассмотрим пару случаев, для того чтобы усвоить данное правило.
Определим, какие из реакций ниже протекают, и напишем уравнения протекающих реакций:
- 1) PbS + KOH
- 2) FeCl3 + NaOH
Рассмотрим первое взаимодействие сульфида свинца и гидроксида калия. Запишем предполагаемую реакцию ионного обмена и пометим ее слева и справа «шторками», обозначив таким образом, что пока не известно, протекает ли реакция на самом деле:
В предполагаемых продуктах мы видим гидроксид свинца (II), который, судя по таблице растворимости, нерастворим и должен выпадать в осадок.
Однако, вывод о том, что реакция протекает, пока сделать нельзя, так как мы не проверили удовлетворение еще одного обязательного требования – растворимости исходных соли и гидроксида.
Сульфид свинца – нерастворимая соль, а значит реакция не протекает, так как не выполняется одно из обязательных требований для протекания реакции между солью и гидроксидом металла. Т.е.:
Рассмотрим второе предполагаемое взаимодействие между хлоридом железа (III) и гидроксидом калия. Запишем предполагаемую реакцию ионного обмена и пометим ее слева и справа «шторками», как и в первом случае:
В предполагаемых продуктах мы видим гидроксид железа (III), который нерастворим и должен выпадать в осадок. Однако сделать вывод о протекании реакции пока еще нельзя. Для этого надо еще убедиться в растворимости исходных соли и гидроксида. Оба исходных вещества растворимы, значит мы можем сделать вывод о том, что реакция протекает. Запишем ее уравнение:
Реакции средних солей с кислотами
Средняя соль реагирует с кислотой в том случае, если образуется осадок или слабая кислота.
Распознать осадок среди предполагаемых продуктов практически всегда можно по таблице растворимости. Так, например, серная кислота реагирует с нитратом бария, поскольку в осадок выпадает нерастворимый сульфат бария:
Распознать слабую кислоту по таблице растворимости нельзя, поскольку многие слабые кислоты растворимы в воде. Поэтому список слабых кислот следует выучить. К слабым кислотам относят H2S, H2CO3, H2SO3, HF, HNO2, H2SiO3 и все органические кислоты.
Так, например, соляная кислота реагирует с ацетатом натрия, поскольку образуется слабая органическая кислота (уксусная):
Следует отметить, что сероводород H2S является не только слабой кислотой, но и плохо растворим в воде, в связи с чем выделяется из нее в виде газа (с запахом тухлых яиц):
Кроме того, обязательно следует запомнить, что слабые кислоты — угольная и сернистая — являются неустойчивыми и практически сразу же после образования разлагаются на соответствующий кислотный оксид и воду:
Выше было сказано, что реакция соли с кислотой идет в том случае, если образуется осадок или слабая кислота. Т.е. если нет осадка и в предполагаемых продуктах присутствует сильная кислота, то реакция не пойдет. Однако есть случай, формально не попадающий под это правило, когда концентрированная серная кислота вытесняет хлороводород при действии на твердые хлориды:
- Однако, если брать не концентрированную серную кислоту и твердый хлорид натрия, а растворы этих веществ, то реакция действительно не пойдет:
Реакции средних солей с другими средними солями
Реакция между средними солями протекает в том случае, если одновременно (!) выполняются два требования:
- исходные соли растворимы;
- в предполагаемых продуктах есть осадок или газ.
- Например, сульфат бария не реагирует с карбонатом калия, поскольку несмотря на то что в предполагаемых продуктах есть осадок (карбонат бария), не выполняется требование растворимости исходных солей.
- В то же время хлорид бария реагирует с карбонатом калия в растворе, поскольку обе исходные соли растворимы, а в продуктах есть осадок:
- Газ при взаимодействии солей образуется в единственном случае – если смешивать при нагревании раствор любого нитрита с раствором любой соли аммония:
- Причина образования газа (азота) заключается в том, что в растворе одновременно находятся катионы NH4+ и анионы NO2— , образующие термически неустойчивый нитрит аммония, разлагающийся в соответствии с уравнением:
Реакции термического разложения солей
Разложение карбонатов
- Все нерастворимые карбонаты, а также карбонаты лития и аммония термически неустойчивы и разлагаются при нагревании. Карбонаты металлов разлагаются до оксида металла и углекислого газа:
- а карбонат аммония дает три продукта – аммиак, углекислый газ и воду:
Разложение нитратов
Абсолютно все нитраты разлагаются при нагревании, при этом тип разложения зависит от положения металла в ряду активности. Схема разложения нитратов металлов представлена на следующей иллюстрации:
- Так, например, в соответствии с этой схемой уравнения разложения нитрата натрия, нитрата алюминия и нитрата ртути записываются следующим образом:
- Также следует отметить специфику разложения нитрата аммония:
Разложение солей аммония
- Термическое разложение солей аммония чаще всего сопровождается образованием аммиака:
- В случае, если кислотный остаток обладает окислительными свойствами, вместо аммиака образуется какой-либо продукт его окисления, например, молекулярный азот N2 или оксид азота (I):
Химические свойства кислых солей
Отношение кислых солей к щелочам и кислотам
- Кислые соли реагируют с щелочами.
При этом, если щелочь содержит тот же металл, что и кислая соль, то образуются средние соли:
- Также, если в кислотном остатке кислой соли осталось два или более подвижных атомов водорода, как, например, в дигидрофосфате натрия, то возможно образование как средней:
- так и другой кислой соли с меньшим числом атомов водорода в кислотном остатке:
- Важно отметить, что кислые соли реагируют с любыми щелочами, в том числе и теми, которые образованы другим металлом. Например:
- Кислые соли, образованные слабыми кислотами, реагируют с сильными кислотами аналогично соответствующим средним солям:
Термическое разложение кислых солей
Все кислые соли при нагревании разлагаются. В рамках программы ЕГЭ по химии из реакций разложения кислых солей следует усвоить, как разлагаются гидрокарбонаты. Гидрокарбонаты металлов разлагаются уже при температуре более 60 оС. При этом образуются карбонат металла, углекислый газ и вода:
Последние две реакции являются основной причиной образования накипи на поверхности водонагревательных элементов в электрических чайниках, стиральных машинах и т.д.
Гидрокарбонат аммония разлагается без твердого остатка с образованием двух газов и паров воды:
Химические свойства основных солей
- Основные соли всегда реагируют со всеми сильными кислотами.
При этом могут образоваться средние соли, если использовались кислота с тем же кислотным остатком, что и в основной соли, или смешанные соли, если кислотный остаток в основной соли отличается от кислотного остатка реагирующей с ней кислоты:
- Также для основных солей характерны реакции разложения при нагревании, например:
Химические свойства комплексных солей (на примере соединений алюминия и цинка)
- В рамках программы ЕГЭ по химии следует усвоить химические свойства таких комплексных соединений алюминия и цинка, как тетрагидроксоалюминаты и третрагидроксоцинкаты.
- Тетрагидроксоалюминатами и тетрагидроксоцинкатами называют соли, анионы которых имеют формулы [Al(OH)4]— и [Zn(OH)4]2- соответственно. Рассмотрим химические свойства таких соединений на примере солей натрия:
- Данные соединения, как и другие растворимые комплексные, хорошо диссоциируют, при этом практически все комплексные ионы (в квадратных скобках) остаются целыми и не диссоциируют дальше:
- Действие избытка сильной кислоты на данные соединения приводит к образованию двух солей:
- При действии же на них недостатка сильных кислот в новую соль переходит только активный металл. Алюминий и цинк в составе гидроксидов выпадают в осадок:
- Осаждение гидроксидов алюминия и цинка сильными кислотами не является удачным выбором, поскольку сложно добавить строго необходимое для этого количество сильной кислоты, не растворив при этом часть осадка. По этой причине для этого используют углекислый газ, обладающий очень слабыми кислотными свойствами и благодаря этому не способный растворить осадок гидроксида:
- В случае тетрагидроксоалюмината осаждение гидроксида также можно проводить, используя диоксид серы и сероводород:
- В случае тетрагидроксоцинката осаждение сероводородом невозможно, поскольку в осадок вместо гидроксида цинка выпадает его сульфид:
- При упаривании растворов тетрагидроксоцинката и тетрагидроксоалюмината с последующим прокаливанием данные соединения переходят соответственно в цинкат и алюминат:
С.И. Широкопояс https://scienceforyou.ru/






