- Химическая связь — основные виды, типы и характеристики
- Механизм образования химической ковалентной связи
- Основные типы химических связей
- Основные характеристики химической связи:
- Ковалентная связь
- Ионная связь
- Металлическая связь
- Водородная связь
- Водородная связь
- Образование водородной связи
- Виды водородной связи
- Характеристика водородной связи
- Конспект лекции по теме "Металлическая и водородная связь. Агрегатное состояние вещества" дисциплины ОУД.10 Химия, специальности 33.02.01 Фармация, СПО
- Атомы металлов
имеют ряд особенностей: - ·
На внешнем слое у них от одного до трёх электронов; - ·
У них сравнительно большие радиусы атомов; - ·
Атомы металлов имеют достаточное количество свободных орбиталей.
Например, у атома
натрия один электрон на третьем энергетическом уровне. А на третьем
энергетическом уровне всего девять орбиталей (одна эс, три пэ и пять дэ
орбиталей).
Когда атомы
металлов сближаются, то их свободные орбитали перекрываются и валентные
электроны одного атома могут перемещаться на свободные орбитали другого атома.
При этом, в кристалле металла постоянно идут два противоположных процесса:
атом, который отдал электроны превращается в катион, а
свободные электроны при этом, притягиваясь к положительным ионам металлов вновь
превращают их в нейтральные атомы.
Поэтому в
металлах постоянно идёт превращение атомов в ионы и наоборот, а частицы,
из которых состоят кристаллы металла, называют атом-ионами.
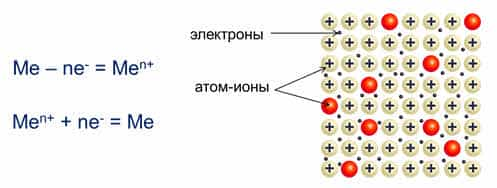
Поэтому в узлах
кристаллической решётки металлов находятся как нейтральные атомы, так и катионы
металла. Образовавшиеся при этом электроны перемещаются внутри кристалла
металла и являются общими для всех атомов и ионов металла, связывая их между
собой.
Таким образом, металлическая
связь – это химическая связь, между атомами в металлическом кристалле
посредством обобществления валентных электронов.
Металлическая связь
характерная для металлов и сплавов и объясняет ряд физических свойств металлов:
ковкость, пластичность, тепло- и электропроводность металлов, металлический
блеск.
Особенностью
этой химической связи является то, что она не имеет направленности в
пространстве, она является коллективной, как и ионная, потому что в ней
принимают участие все атомы металла.
Сходство
металлической связи с ковалентной заключается в том, что при её
образовании электроны обобществляются, но в металлической связи эти
электроны связывают все атомы металла в кристалле, а в
ковалентной связи связываются только находящиеся рядом атомы.
Водородная
связь осуществляется между положительно заряженным атомом водорода одной
молекулы и отрицательно заряженным атомом другой молекулы. Причем, чаще всего
отрицательно заряженным атомом являются наиболее электроотрицательные элементы:
фтор, кислород, азот, реже хлор и сера.
Схематично
водородную связь показывают тремя точками. Образование водородной связи
объясняется электростатическим взаимодействием между молекулами. При этом
возникает донорно-акцэпторное взаимодействие свободной орбитали атома водорода
и орбитали с неподелённой парой электронов электроотрицательного атома. Из-за
этого, водородная связь обладает направленностью.
Благодаря
водородной связи молекулы объединяются в ассоциаты, как, например, димеры
уксусной кислоты.
- Водородные связи
также определяют кристаллическую структуру льда, в которой каждый атом
кислорода связан с четырьмя атомами водорода – двумя ковалентными и двумя
водородными связями. - Кристаллическая
структура льда
Водородная связь
объясняет такое алхимическое правило, как «подобное растворяется в
подобном», когда возникают связи между молекулами растворителя и молекулами
растворённого вещества. Вещества метиловый спирт, этанол, уксусная кислота,
этиленгликоль, глицерин неограниченно растворимы в воде.
Водородная
связь в молекуле аммиака обуславливает его возможность легко сжижаться и вновь
переходить в газообразное состояние с поглощением теплоты. Поэтому аммиак
используют как хладагент в холодильных установках.
Водородная
связь слабее ковалентной, поэтому она характерна для веществ в
твёрдом и жидком состояниях.
Некоторые
аномальные свойства веществ объясняются наличием водородной связи. Например,
высокие температуры кипения воды, фтороводорода и аммиака по сравнению с
аналогичными веществами, образованными элементами этих же групп других
периодов, объясняются образованием ассоциатов за счёт водородных связей.
Водородная
связь наиболее распространена в природе. Эта связь объясняет аномальные
свойства воды, такие как высокие температуры кипения и плавления, высокую
теплоёмкость и диэлектрическую проницаемость. Благодаря своей структуре лёд
имеет меньшую плотность, чем жидкая вода, поэтому лёд находится на поверхности
воды и глубокие водоёмы не промерзают до дна.
Светло-голубой
цвет чистой воды и толстого льда также обусловлен водородными связями. Ещё водородная
связь объясняет образование кристаллов в виде изморози и снежинок.
Водородная
связь возникает и между атомами одной молекулы. Это так называемая внутримолекулярная
водородная связь. Она возникает в молекулах органических веществ,
которые имеют группы атомов: о-аш, эн-аш, эн-аш-два и другие.
Внутримолекулярная
водородная связь
Водородная связь
характерна для большинства органических соединений, например, для белков,
нуклеиновых кислот. Вторичная структура молекулы ДНК объясняется наличием
внутримолекулярной водородной связи. Благодаря ей полипептидная цепь закручена
в спираль, и её витки удерживаются от раскручивания.
Но водородная
связь непрочная, поэтому белки разрушаются – денатурируют. Денатурация
может быть обратимой и необратимой.
Обратимая
денатурация белков обусловлена влиянием механического воздействия.
Например, многие работники шахт, дорожных служб, горняки, стекловары,
металлурги, врачи-рентгенологи, работники химических производств постоянно
подвергаются какому-то механическому воздействию. Поэтому для компенсации
вредного воздействия условий труда на организм, им предоставляются определённые
льготы.
Необратимую
денатурацию вы можете наблюдать при варке яиц, мяса, рыбы и других белковых
продуктов. Например, если к раствору куриного яйца прилить этилового спирта или
соли тяжёлого металла, то можно будет наблюдать выпадение осадка вследствие
денатурации белка. Аналогичным действие обладает и никотин, который
воздействует на белковые молекулы.
- Денатурацию
белка вызывает этиловый спирт, соли тяжёлых металлов. - Таким образом,
молекулы могут взаимодействовать между собой и это взаимодействие называется
межмолекулярным. - Силы, которые
обеспечивают это взаимодействие, называются ван-дэр-ваальсовыми,
в честь голландского учёного Ван-дэр-Ваальса. - Межмолекулярное
взаимодействие, как и химическая связь, имеет электростатическую природу.
В молекуле возникают
противоположные полюса: положительные, где электронная плотность понижена и
отрицательные полюса, где электронная плотность повышена. Образовавшиеся
полярные молекулы притягиваются друг к другу.
Это межмолекулярное
взаимодействие может осуществляться между полярными молекулами,
между полярными и неполярными молекулами, а также
между неполярными молекулами.
Межмолекулярное
взаимодействие объясняет переход вещества из газообразного в жидкое, а затем и
в твёрдое. Межмолекулярное взаимодействие слабее, чем ковалентная связь,
поэтому связи между молекулами непрочные и легко разрываются. Из-за этого,
молекулярные вещества плавятся и кипят при низких температурах.
Энергия
межмолекулярного взаимодействия зависит от полярности молекулы и её размера.
Чем сильнее
межмолекулярное взаимодействие, тем выше у вещества температуры кипения и
плавления. Например, кислород из-за более прочного межмолекулярного
взаимодействия кипит при более высокой температуре, чем азот. Углеводороды с
большей молярной массой кипят при более высокой температуре, чем
низкомолекулярные углеводороды.
- Межмолекулярные
связи возникают между молекулами в молекулярной кристаллической решётке. - Например,
молекулярные кристаллические решётки имеют: водород, азот, кислород, сера, йод,
вода, углекислый газ, благородные газы и многие органические вещества. - Для веществ с
молекулярной кристаллической решёткой характерны низкие температуры плавления и
кипения, небольшая твёрдость и лёгкая сжижаемость.
Нагревание
некоторых молекулярных кристаллов, как йода, углекислого газа, приводит к переходу
вещества из твёрдого состояния в газообразное, минуя жидкую фазу.
Этот процесс называется возгонкой, или сублимацией.
- Многие
органические вещества вообще не плавятся, потому что прочность связей между
молекулами в сумме оказывается выше прочности связей внутри молекулы. - Если попробовать
расплавить такие вещества, как крахмал, цэллюлоза или вата, то они начнут
разрушать раньше, чем плавиться.
Реакционная
способность молекулярных веществ зависит от прочности внутримолекулярных
связей, потому что при химическом взаимодействии разрываются
внутримолекулярные связи. Парафин – непрочное вещество, связи между
молекулами слабые, но это вещество химически устойчиво.
Таким образом, металлическая
связь осуществляется за счёт обобществления электронов, межмолекулярное
взаимодействие осуществляется между любыми молекулами и объясняет переход
вещества из газообразного в жидкое, а затем в твёрдое. Водородная связь
осуществляется между положительно заряженным атомом водорода одной молекулы и
отрицательно заряженным атомом другой молекулы.
Химическая связь — основные виды, типы и характеристики
Все системы стремятся к равновесию и к уменьшению свободной энергии — так гласит один из постулатов химической термодинамики. Атомы, взаимодействующие в молекуле вещества, тоже подчиняются этому закону.
Они стремятся образовать устойчивую конфигурацию — 8-электронную или 2-электронную внешнюю оболочку.
Этот процесс взаимодействия называется химической связью, благодаря ему получаются молекулы и молекулярные соединения.
| Химическая связь — это взаимодействие между атомами в молекуле вещества, в ходе которого два электрона (по одному от каждого атома) образуют общую электронную пару либо электрон переходит от одного атома к другому. |
Как понятно из определения химической связи, при взаимодействии двух атомов один из них может притянуть к себе внешние электроны другого. Эта способность называется электроотрицательностью (ЭО). Атом с более высокой электроотрицательностью (ЭО) при образовании химической связи с другим атомом может вызвать смещение к себе общей электронной пары.
Существует несколько систем измерения ЭО, но пользоваться для расчетов можно любой из них. Для образования химической связи важно не конкретное значение ЭО, а разница между этими показателями у двух атомов.
Механизм образования химической ковалентной связи
Существует два механизма взаимодействия атомов:
- обменный — предполагает выделение по одному внешнему электрону от каждого атома и соединение их в общую пару;
- донорно-акцепторный — происходит, когда один атом (донор) выделяет два электрона, а второй атом (акцептор) принимает их на свою свободную орбиталь.
Независимо от механизма химическая связь между атомами сопровождается выделением энергии. Чем выше ЭО атомов, т. е. их способность притягивать электроны, тем сильнее и этот энергетический всплеск.
| Энергией связи называют ту энергию, которая выделяется при взаимодействии атомов. Она определяет прочность химической связи и по величине равна усилию, необходимому для ее разрыва. |
Также на прочность влияют следующие показатели:
- Длина связи — расстояние между ядрами атомов. С уменьшением этого расстояния растет энергия связи и увеличивается ее прочность.
- Кратность связи — количество электронных пар, появившихся при взаимодействии атомов. Чем больше это число, тем выше энергия и, соответственно, прочность связи.
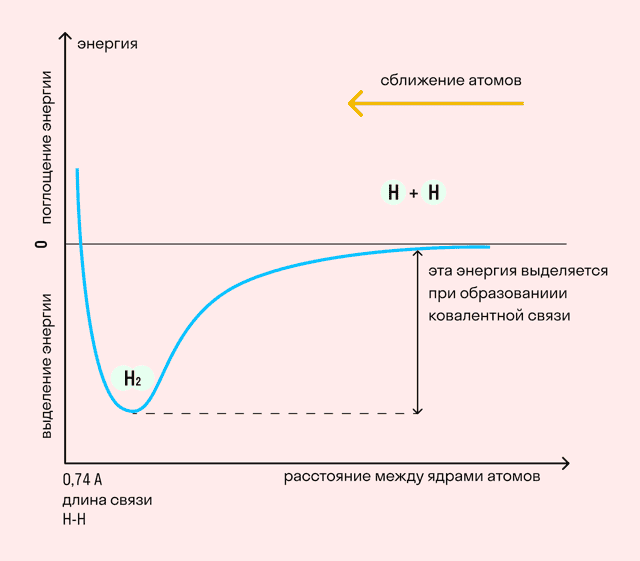
На примере химической связи в молекуле водорода посмотрим, как меняется энергия системы при сокращении расстояния между ядрами атомов. По мере сближения ядер электронные орбитали этих атомов начинают перекрывать друг друга, в итоге появляется общая молекулярная орбиталь.
Неспаренные электроны через области перекрывания смещаются от одного атома в сторону другого, возникают общие электронные пары. Все это сопровождается нарастающим выделением энергии.
Сближение происходит до тех пор, пока силу притяжения не компенсирует сила отталкивания одноименных зарядов.
Основные типы химических связей
Различают четыре вида связей в химии: ковалентную, ионную, металлическую и водородную. Но в чистом виде они встречаются редко, обычно имеет место наложение нескольких типов химических связей. Например, в молекуле фосфата аммония (NH4)3PO4присутствует одновременно ионная связь между ионами и ковалентная связь внутри ионов.
Также отметим, что при образовании кристалла от типа связи между частицами зависит, какой будет кристаллическая решетка. Влияя на тип кристаллической решетки, химическая связь определяет и физические свойства вещества: твердость, летучесть, температуру плавления и т. д.
Основные характеристики химической связи:
- насыщенность — ограничение по количеству образуемых связей из-за конечного числа неспаренных электронов;
- полярность — неравномерная электронная плотность между атомами и смещение общей пары электронов к одному из них;
- направленность — ориентация связи в пространстве, расположение орбиталей атомов под определенным углом друг к другу.
Ковалентная связь
Как уже говорилось выше, этот тип связи имеет два механизма образования: обменный и донорно-акцепторный. При обменном механизме объединяются в пару свободные электроны двух атомов, а при донорно-акцепторном — пара электронов одного из атомов смещается к другому на его свободную орбиталь.
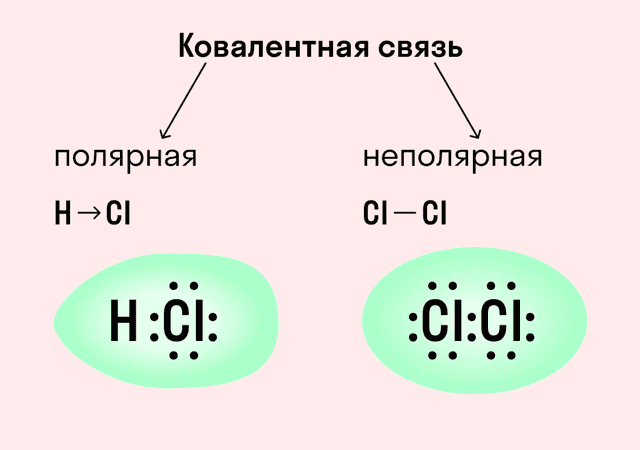
| Ковалентная связь — это процесс взаимодействия между атомами с одинаковыми или близкими радиусами, при котором возникает общая электронная пара. Если эта пара принадлежит в равной мере обоим взаимодействующим атомам — это неполярная связь, а если она смещается к одному из них — это полярная связь. |
Как вы помните, сила притяжения электронов определяется электроотрицательностью атома. Если у двух атомов она одинакова, между ними будет неполярная связь, а если один из атомов имеет большую ЭО — к нему сместится общая электронная пара и получится полярная химическая связь.
В зависимости от того, сколько получилось электронных пар, химические связи могут быть одинарными, двойными или тройными.
Ковалентная неполярная связь образуется в молекулах простых веществ, неметаллов с одинаковой ЭО: Cl2, O2, N2, F2 и других.
Посмотрим на схему образования этой химической связи. У атомов водорода есть по одному внешнему электрону, которые и образуют общую пару.
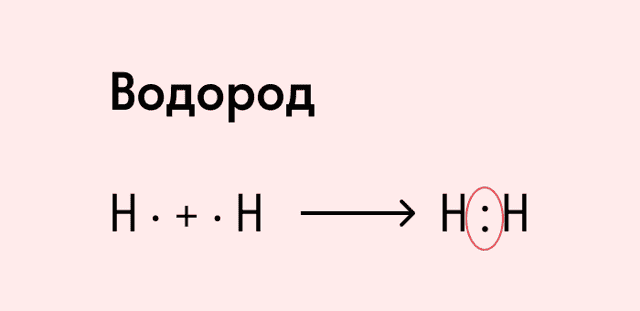
Ковалентная полярная связь характерна для неметаллов с разным уровнем ЭО: HCl, NH3,HBr, H2O, H2S и других.
Посмотрим схему такой связи в молекуле хлороводорода. У водорода имеется один свободный электрон, а у хлора — семь. Таким образом, всего есть два неспаренных электрона, которые соединяются в общую пару. Поскольку в данном случае ЭО выше у хлора, эта пара смещается к нему.
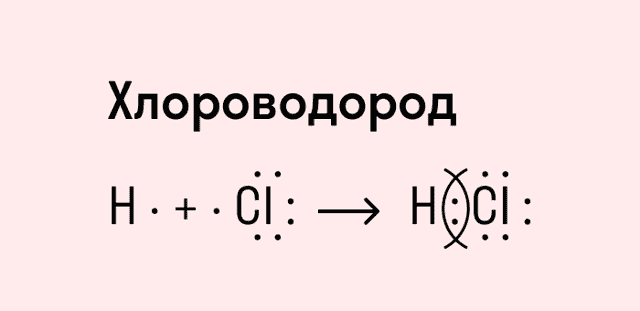
Другой пример — молекула сероводорода H2S. В данном случае мы видим, что каждый атом водорода имеет по одной химической связи, в то время как атом серы — две. Количество связей определяет валентность атома в конкретном соединении, поэтому валентность серы в сероводороде — II.
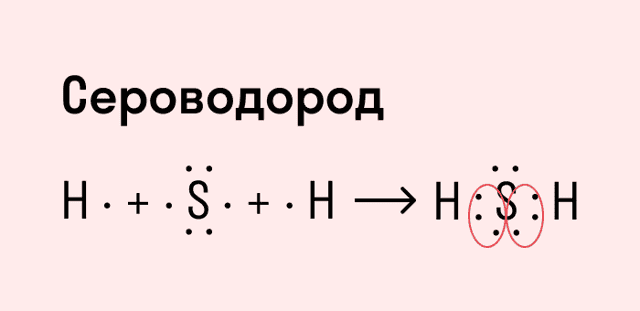
| Число связей, которые могут быть у атома в молекуле вещества, называется валентностью. |
Характеристики ковалентной связи:
- насыщена,
- направлена,
- имеет полярность.
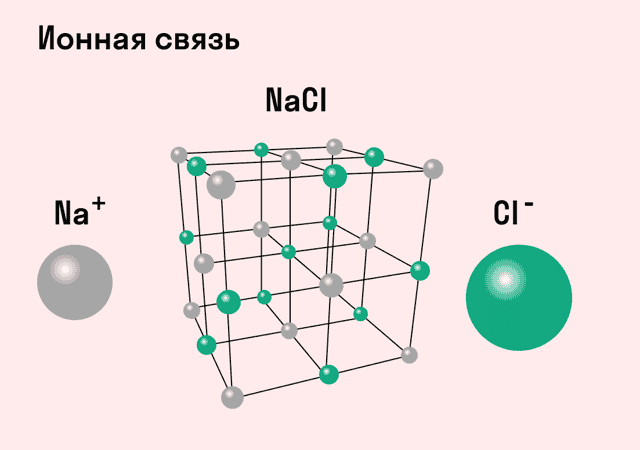
Ионная связь
Как понятно из названия, данный тип связи основан на взаимном притяжении ионов с противоположными зарядами. Он возможен между веществами с большой разницей ЭО — металлом и неметаллом.
Механизм таков: один из атомов отдает свои электроны другому атому и заряжается положительно. Второй атом принимает электроны на свободную орбиталь и получает отрицательный заряд.
В результате этого процесса образуются ионы.
| Ионная связь — это такое взаимодействие между атомами в молекуле вещества, итогом которого становится образование и взаимное притяжение ионов. |
Разноименно заряженные ионы стремятся друг к другу за счет кулоновского притяжения, которое одинаково направлено во все стороны. Благодаря этому притяжению образуются ионные кристаллы, в решетке которых заряды ионов чередуются. У каждого иона есть определенное количество ближайших соседей — оно называется координационным числом.
Обычно ионная связь появляется между атомами металла и неметалла в таких соединениях, как NaF, CaCl2, BaO, NaCl, MgF2, RbI и других. Ниже схема ионной связи в молекуле хлорида натрия.
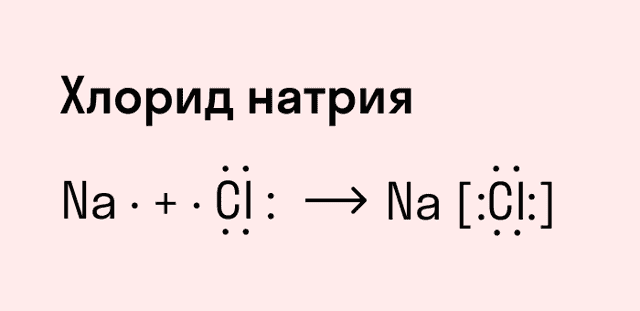 Все соли образованы с помощью ионных связей, поэтому в задачах, где нужно определить тип химической связи в веществах, в качестве подсказки можно использовать таблицу растворимости.
Все соли образованы с помощью ионных связей, поэтому в задачах, где нужно определить тип химической связи в веществах, в качестве подсказки можно использовать таблицу растворимости.
Характеристики ионной связи:
- ненасыщенна,
- не имеет направленности.
Ковалентная и ионная связь в целом похожи, и одну из них можно рассматривать, как крайнее выражение другой. Но все же между ними есть существенная разница. Сравним эти виды химических связей в таблице.
| Характеризуется появлением электронных пар, принадлежащих обоим атомам. | Характеризуется появлением и взаимным притяжением ионов. |
| Общая пара электронов испытывает притяжение со стороны обоих ядер атомов. | Ионы с противоположными зарядами подвержены кулоновскому притяжению. |
| Имеет направленность и насыщенность. | Ненасыщенна и не имеет направленности. |
| Количество связей, образуемых атомом, называется валентностью. | Количество ближайших соседей атома называется координационным числом. |
| Образуется между неметаллами с одинаковой или не сильно отличающейся ЭО. | Образуется между металлами и неметаллами — веществами со значимо разной ЭО. |
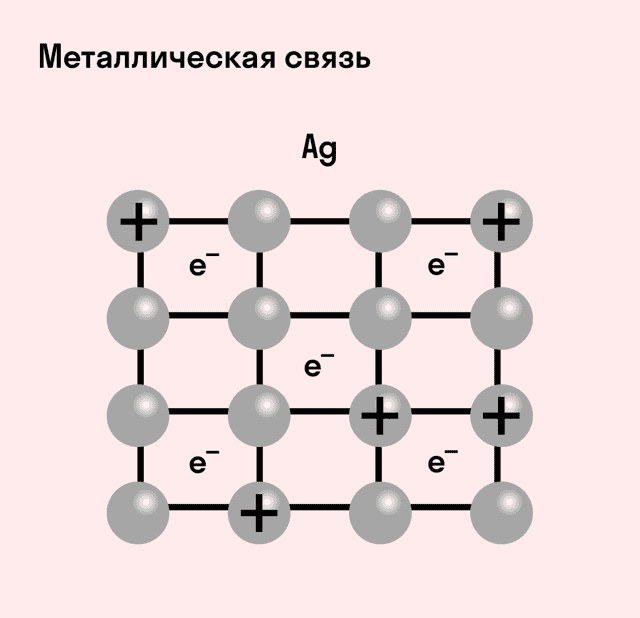
Металлическая связь
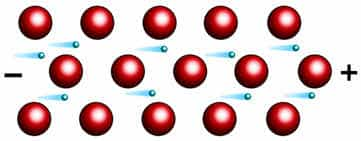
Отличительная особенность металлов в том, что их атомы имеют достаточно большие радиусы и легко отдают свои внешние электроны, превращаясь в положительно заряженные ионы (катионы). В итоге получается кристаллическая решетка, в узлах которой находятся ионы, а вокруг беспорядочно перемещаются электроны проводимости, образуя «электронное облако» или «электронный газ».
Свободные электроны мигрируют от одного иона к другому, временно соединяясь с ними и снова отрываясь в свободное плавание. Этот механизм по своей природе имеет сходство с ковалентной связью, но взаимодействие происходит не между отдельными атомами, а в веществе.
| Металлическая связь — это взаимодействие положительных ионов металлов и отрицательно заряженных электронов, которые являются частью «электронного облака», рассеянного по всему объему вещества. |
Наличие такого «электронного облака», которое может прийти в направленное движение, обусловливает электропроводность металлов. Другие их качества — пластичность и ковкость, объясняются тем, что ионы в кристаллической решетке легко смещаются. Поэтому металл при ударном воздействии способен растягиваться, но не разрушаться.
Характеристики металлической связи:
- ненаправленность,
- делокализованный характер,
- многоэлектронность.
Металлическая связь присуща как простым веществам — таким как Na, Ba, Ag, Cu, так и сложным сплавам — например, AlCr2, CuAl11Fe4, Ca2Cu и другим.
Схема металлической связи:
- M — металл,
- n — число свободных внешних электронов.
- К примеру, у железа в чистом виде на внешнем уровне есть два электрона, поэтому его схема металлической связи выглядит так:
Обобщим все полученные знания. Таблица ниже описывает кратко химические связи и строение вещества.
Водородная связь
Рассмотрим взаимодействия, возникающие между отдельными молекулами в веществе — межмолекулярные взаимодействия. Межмолекулярные взаимодействия — это такой вид взаимодействия между нейтральными атомами, при котором не образуются новые ковалентные связи.
Силы взаимодействия между молекулами обнаружены Ван-дер Ваальсом в 1869 году, и названы в честь него Ван-дар-Ваальсовыми силами. Силы Ван-дер-Ваальса делятся на ориентационные, индукционные и дисперсионные.
Энергия межмолекулярных взаимодействий намного меньше энергии химической связи.
Ориентационные силы притяжения возникают между полярными молекулами (диполь-диполь взаимодействие). Эти силы возникают между полярными молекулами. Индукционные взаимодействия — это взаимодействие между полярной молекулой и неполярной. Неполярная молекула поляризуется из-за действия полярной, что и порождает дополнительное электростатическое притяжение.
Особый вид межмолекулярного взаимодействия — водородные связи.
Водородные связи — это межмолекулярные (или внутримолекулярные) химические связи, возникающие между молекулами, в которых есть сильно полярные ковалентные связи — H-F, H-O или H-N. Если в молекуле есть такие связи, то между молекулами будут возникать дополнительные силы притяжения.
Механизм образования водородной связи частично электростатический, а частично — донорно–акцепторный. При этом донором электронной пары выступают атом сильно электроотрицательного элемента (F, O, N), а акцептором — атомы водорода, соединенные с этими атомами. Для водородной связи характерны направленность в пространстве и насыщаемость.
Водородную связь можно обозначать точками: Н ··· O. Чем больше электроотрицательность атома, соединенного с водородом, и чем меньше его размеры, тем крепче водородная связь. Она характерна прежде всего для соединений фтора с водородом, а также кислорода с водородом, в меньшей степени азота с водородом.
Водородные связи возникают между следующими веществами:
- фтороводород HF (газ, раствор фтороводорода в воде — плавиковая кислота),
- вода H2O (пар, лед, жидкая вода):
- раствор аммиака и органических аминов — между молекулами аммиака и воды;
- органические соединения, в которых есть связи O-H или N-H: спирты, карбоновые кислоты, амины, аминокислоты, фенолы, анилин и его производные, белки, растворы углеводов — моносахаридов и дисахаридов.
Водородная связь оказывает влияние на физические и химические свойства веществ. Так, дополнительное притяжение между молекулами затрудняет кипение веществ. У веществ с водородными связями наблюдается аномальное повышение тепературы кипения.
Например, как правило, при повышении молекулярной массы наблюдается повышение температуры кипения веществ. Однако в ряду веществ H2O-H2S-H2Se-H2Te мы не наблюдаем линейное изменение температур кипения.
А именно, у воды температура кипения аномально высокая — не меньше -61оС, как показывает нам прямая линия, а намного больше, +100 оС. Эта аномалия объясняется наличием водородных связей между молекулами воды. Следовательно, при обычных условиях (0-20оС) вода является жидкостью.
Водородная связь
Водородная связь весьма распространена и играет важную роль в биологических объектах. Рассмотрим ее образование подробнее.
Образование водородной связи
- При возникновении подходящих условий водородная связь возникает самопроизвольно.
- Какие же условия приводят к возникновению водородной связи?
- Можно предположить, что в любом ряду веществ с молекулами одинаковой формы и полярности температуры плавления и кипения должны повышаться прямо пропорционально возрастанию молекулярной массы, однако существуют некоторые несоответствия.
- На следующем рисунке приведены кривые зависимости температуры кипения гидридов элементов 6 группы от молекулярной массы.
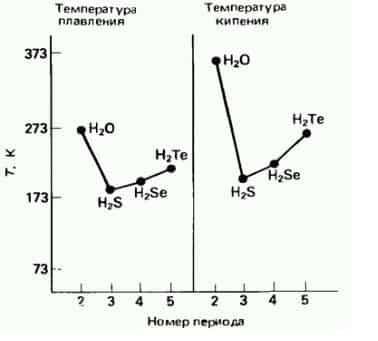 зависимость температуры кипения и температуры плавления от молекулярной массы соединений
зависимость температуры кипения и температуры плавления от молекулярной массы соединений
- Так, для гидридов элементов 6 группы наблюдается последовательное увеличение температур кипения и плавления с увеличением молекулярной массы (номера периода), но из этой закономерности выпадает вода.
- В 5 группе аномально высокие температуры кипения и плавления наблюдаются у аммиака NH3, а в 7 группе – у HF, по сравнению с гидридами элементов соответствующих групп.
- Почему вода, аммиак и фтороводород имеют аномально высокие температуры кипения и плавления?
- Это связано с присутствием в воде, аммиаке и фтороводороде водородных связей.
Водородная связь — это внутри- или межмолекулярная связь, которая образуется с соединениях между атомами водорода и атомами, имеющими большую электроотрицательность (N, O, F).
Механизм образования водородной связи, вследствие электростатического притяжения атомов — электростатический. Но частично он также носит донорно–акцепторный характер.
Образуемые соединения имеют большую полярность, возникает диполь. Атом водорода находится на положительном конце диполя. Этот диполь может взаимодействовать с неподеленной электронной парой кислорода (и азота, и фтора), который принадлежит другой или этой же молекуле. Таким образом, донором электронной пары являются атомы F, O или N, а акцептором — атомы водорода.
Графически, на рисунках, водородная связь обозначается тремя точками:
Виды водородной связи
- Межмолекулярная водородная связь образуется между различными молекулами веществ. Обязательным условием образования такого вида водородной связи — это наличие водорода в одной молекуле и одного из элементов с высокой электроотрицательностью в другой молекуле (например, F, O, N, Cl, S). Связь может возникать как между одинаковыми молекулами, так и между разными. Например, это могут быть молекулы аммиака, воды, фтороводорода, спиртов (например, метанол, этанол), карбоновых кислот (например, муравьиная, уксусная кислоты), аминокислот в молекуле белка:
- Внутримолекулярная водородная связь образуется внутри одной молекулы. Условие образования внутримолекулярной водородной связи — это наличие в одной молекуле и атомов водорода и атомы с высокой электроотрицательностью. Такая связь может возникнуть, например, у многоатомных спиртов (этиленгликоль, глицерин), белков, углеводов, оксикислот (салициловая кислота) и других органических соединений:
Характеристика водородной связи
Водородная связь характеризуется
- Направленностью в пространстве и насыщаемостью.
- Водородная связь оказывает большое влияние на свойства многих веществ, особенно в биологических системах. Например, водородная связь определяет довольно некомпактную упаковку молекул воды во льду, поэтому плотность льда меньше плотности жидкой воды. Наличие водородной связи в веществах способствует аномальному росту их температур кипения и плавления.
- Водородная связь — слабая связь. Величина энергии водородной связи обычно лежит в пределах от 4 до 25 кДж/моль, это всего несколько процентов от величины энергии обычной химической связи. Теперь предположим, что водородная связь возникает в результате электростатического взаимодействия между диполем связи X-H и неподеленной электронной порой на атоме Y. Тогда прочность водородной связи увеличивается в ряду:
N-H···Y ˂ O-H···Y ˂ F-H···Y
Т.е., связь тем прочнее, чем меньше размер атома с неподеленными парами — N, O, F и больше его электроотрицательность. Среди них более прочную водородную связь образует тот, неподеленная электронная пара которого менее сильно притягивается к своему ядру.
Конспект лекции по теме "Металлическая и водородная связь. Агрегатное состояние вещества" дисциплины ОУД.10 Химия, специальности 33.02.01 Фармация, СПО
Химия
Лекция
Тема: Металлическая
связь. Водородная связь. Агрегатное
состояние
вещества
План
1. Металлическая кристаллическая решетка и металлическая химическая связь.
Физические свойства металлов.
2. Агрегатные состояния веществ и водородная связь.
3. Твердое жидкое и газообразное состояния веществ.
1. Металлическая
связь – это связь между ионами металлов и относительно свободными
электронами, движущимися по всему объему кристалла. Она характерна для металлов
в твердом и жидком состояниях.
Атомы металлов имеют небольшое число валентных
электронов, но много свободных валентных орбиталей. Например, в атоме магния на
два валентных электрона приходится девять валентных орбиталей (одна 3s, три 3p и пять 3d).
Кроме
этого атомы металлов обладают большими радиусами, поэтому валентные электроны
слабо удерживаются в атоме и перемещаются по всему кристаллу.
В отличие от
ковалентной связи металлическая связь не имеет направленности и не обладает
насыщаемостью.
Особенности
металлической связи определяют физические и механические свойства металлов:
все металлы твердые вещества, кроме ртути (при н. у.), имеют металлический
блеск и непрозрачность, хорошую тепло- и электропроводность, ковкость и
пластичность.
Физические
свойства металлов. В обычных условиях все металлы, за
исключением ртути, являются твердыми веществами с металлической кристаллической
решеткой, особенности которой определяют их общие физические и механические
свойства.
Металлический
блеск и непрозрачность металлов – результат отражения световых лучей. Электро-
и теплопроводность обусловлены наличием в металлических решетках свободных
электронов.
С
повышением температуры электропроводность металлов уменьшается, а с понижением
температуры – увеличивается. Около абсолютного нуля для многих металлов
характерно явление сверхпроводимости.
Металлы
обладают ковкостью и пластичностью. По определению М.В. Ломоносова,
«металлоломом называется светлое тело, которое ковать можно». Металлы легко
прокатываются в листы, вытягиваются в проволоку, поддаются ковке, штамповке,
прессованию.
- По
отдельным физическим свойствам металлы подразделяют: - — по значению плотности
– на легкие (плотность меньше 5г/см3): Na,
Ca, Mg, Al, Ti — и тяжелые (плотность больше 5г/см3): Zn,
Cr, Sn, Mn, Ni, Cu, Ag, Pb, Hg, Au, W, Os. - — по значению
температуры плавления – на легкоплавкие (температура меньше 1000 градусов): Hg,
Na, Sn, Pb, Zn, Mg, Al, Ca, Ag – и тугоплавкие температура более 1000): Au,
Cu, Mn, Ni, Fe, Ti, Cr, Os, W. - Из металлов
самые мягкие – щелочные) их можно резать ножом), самый твердый – хром (царапает
стекло), самый тугоплавкий – вольфрам, самый тяжелый – осмий. - По
отношению к магнитным полям металлы подразделяются на три группы: - а)
ферромагнитные – способны намагничиваться под действием даже слабых магнитных
полей (Fe, Co, Ni); - б)
парамагнитные – проявляют слабую способность к намагничиванию даже в сильных
магнитных полях (Al, Cr, Ti); - в)
диамагнитные – не притягиваются к магниту (Sn, Cu,
Bi). - В заключении рассмотрим
влияние электронных конфигураций элементов на структуру и физические свойства
простых веществ, образованных ими.
| Период | Группа | ||||||
| I | II | III | IV | V | VI | VII | VIII |
| 1 | H2 | He | |||||
| 2 | Li Be | B C | N2 | O2 | F2 | Ne | |
| 3 | Na Mg Al | Si Ge | P4 | S8 | Cl2 | Ar | |
| 4 | K Ca Ga | As Se | Br2 | Kr | |||
| 5 | Rb Sr In Sn Sb | Te | I2 | Xe | |||
| Тип кристаллической решетки | металлическая | атомная | молекулярная |
Простые
вещества, образованные остальными элементами (кроме радона), имеют
металлическую решетку.
В
Периодической системе в начале периодов расположены химические элементы, атомы
которых содержат на внешнем уровне небольшое количество электронов, а
образованные ими простые вещества имеют металлическую решетку.
Далее
следуют элементы с большим числом электронов на внешнем уровне атома,
образующие простые вещества с атомной решеткой. И завершают периоды
элементы, атомы которых образуют простые вещества, имеющие молекулярную
решетку.
2. Водородная
связь. Образование водородной связи обусловлено спецификой водорода как
элемента, атом которого состоит из протона и электрона.
В соединениях водорода
с атомами более электроотрицательных элементов на атоме водорода возникает
частичный положительный заряд.
Такой атом может взаимодействовать с
неподеленными парами электронов атома электроотрицательного элемента соседней
молекулы, в результате между молекулами возникает дополнительная
межмолекулярная связь.
Водородная
связь – это связь, которая образуется между
положительно заряженным атомом водорода одной молекулы и отрицательно
заряженным атомом сильно электроотрицательного элемента другой молекулы.
Чем больше
электроотрицательность атома, с которым соединяется атом водорода, тем больше
энергия водородной связи.
Водородная связь
наиболее характерна для соединений фтора и кислорода, менее для соединений – азота.
Образование водородной связи приводит к ассоциации (соединению) молекул.
Рассмотрим
образование водородной связи между двумя молекулами воды.В молекуле
воды связь О-Н сильно полярная. На атоме кислорода сосредоточен отрицательный
заряд, а на атомах водорода – положительный. Это приводит к притяжению атома
водорода одной молекулы воды к атому кислорода другой молекулы – возникает
водородная связь.
В
кристаллах льда, снега каждая молекула воды связана водородными связями с
четырьмя соседними – за счет атомов водорода и двух неподеленных электронных
пар атома кислорода.
Следовательно, образование водородной связи обусловлено
как электростатическим, так и донорно-акцепторным взаимодействием. В результате
образуется ажурная (с большими пустотами) структура льда.
Из-за этого плотность
льда меньше, чем плотность воды.
Способностью
к ассоциации обладают молекулы как неорганических, так и органических
соединений (вода, аммиак, спирты и др.)
Водородная
связь как и ковалентная, имеют направленность в пространстве и насыщаемость.
Длина
водородной связи больше длины обычной ковалентной связи, энергия – в 10-20 раз
меньше. В связи с этим водородные связи малоустойчивы и довольно легко
разрываются (например, при таянии льда и кипении воды).
Но на разрыв
этих связей требуется дополнительная энергия, поэтому температуры плавления и
кипения веществ, в которых молекулы ассоциированы, оказываются выше, чем у
подобных веществ, но без водородных связей.
Например, между молекулами
фтороводорода и воды образуются водородные связи, а между молекулами
хлороводорода и сероводорода – практически нет.
Водородная
связь служит причиной некоторых важных особенностей воды – вещества, которое
играет огромную роль в процессах, протекающих в живой и неживой природе. Она в
значительной мере определяет свойства и таких биологически важных веществ, как
белки и нуклеиновые кислоты, а поэтому имеет большое значение в химии жизненных
процессов.
3.
Газообразные, жидкие и твердые вещества.
Из
курса физики и повседневной жизни вам известно, что в зависимости от условий
окружающей среды, и в первую очередь от температуры и давления, вещества могут
находиться в одном из трех основных агрегатных состояний: газообразном, жидком
и твердом. Каждое агрегатное состояние отличается от другого расположением
частиц друг относительно друга и характером их движения. При переходе вещества
из одного состояния в другое состав его частиц не изменяется, изменяется лишь
их взаимное расположение.
Газообразное
состояние. В
газообразном состоянии вещество не имеет собственной формы и объема. Оно занимает весь предоставленный ему объем и принимает
форму сосуда. Газы обладают большой сжимаемостью и образуют однородные смеси.
Эти свойства газов обусловлены тем, что расстояния между их молекулами в
десятки раз превышают размер самих молекул. На таком расстоянии практически
отсутствует межмолекулярное взаимодействие. Газообразное состояние
характеризуется полной неупорядоченностью расположения молекул друг
относительно друга.
Молекулы в газах движутся хаотически.
Если газы в смеси не
реагируют между собой, то они сохраняют свою химическую индивидуальность, и
поэтому многие физикохимические свойства таких систем могут быть выведены по правилу аддитивности:
суммированием характеристик образующих их газов с учетом их мольных долей.
Например, средняя молярная масса смеси газов X, Y,
Z определяется так:
- М(Х + Y
+ Z) = х(Х) • М(Х) + X(Y)
• М(Y) + *(Z) • М(Z), - где
х(Х), x(Y)> x(Z) — мольные доли газов X, Y, Z; - М(Х), М(Y),
М(Z) — молярные массы газов X, Y, Z. - Четвертое
агрегатное состояние — плазма,
которая представляет собой ионизированный газ. - Жидкое
состояние
В отличие
от газов, в жидкостях молекулы расположены ближе друг к другу и удерживаются
силами межмолекулярного взаимодействия (рис. 226). Это подтверждает, например,
тот факт, что один объем воды образуется в результате конденсации 1300 объемов
пара.
Расстояние между частицами в жидкостях невелико, поэтому жидкости обладают
незначительной сжимаемостью, при данной температуре им присущ определенный
объем. Чтобы заметно уменьшить их объем, требуется очень большое давление. В
то же время силы межмолекулярного притяжения в жидкостях недостаточно велики,
чтобы придать им определенную форму.
Молекулы в жидкости свободно перемещаются
друг относительно друга, поэтому жидкости обладают текучестью и приобретают
форму содержащего их сосуда.
Следовательно, жидкости
по структуре и свойствам занимают промежуточное положение между газообразными
и твердыми веществами. С повышением температуры жидкости усиливается беспорядок
во взаимном расположении частиц, что приближает их к газам. При понижении
температуры упорядоченность внутренней структуры возрастает, что сближает их с
твердыми веществами.
Твердое
состояние
В твердом
агрегатном состоянии среднее расстояние между образующими вещество частицами
сопоставимо с их размерами, а энергия взаимодействия значительно превышает их
среднюю кинетическую энергию.
Частицы, образующие твердое вещество, не могут
свободно перемещаться друг относительно друга, они лишь совершают колебательные
движения около положения равновесия. Этим объясняются наличие у твердых
веществ определенного объема и формы, их механическая прочность и
незначительная сжимаемость.
В зависимости от строения и физических свойств
твердые вещества подразделяют на аморфные и кристаллические.
Аморфное состояние
Вещества в
аморфном состоянии характеризуются некоторой упорядоченностью частиц,
расположенных только в непосредственной близости друг от друга (так
называемый ближний порядок), поэтому они изотропны, т. е. их физические
свойства не зависят от направления.
Проведем опыт. Нанесем на
поверхность стекла тонкий ело расплавленного воска и дадим ему застыть.
Коснемся застывшего вещества раскаленной иглой. Вокруг иглы воск расплавится.
При этом пятно расплавленного воска примет форму круга.
Следовательно, теплопроводность
стекла не зависит от направления.
Аморфные вещества не
имеют определенной температур плавления. При нагревании они постепенно
размягчаются, начинают растекаться и, наконец, становятся жидкими. При охлаж-
дении они так же постепенно затвердевают.
Аморфные
вещества по структуре представляют собой переохлажденные жидкости. Подобно
жидкостям они проявляют cвойства текучести, т. е. при длительном действии сравнительно не
больших сил постепенно изменяют свою форму.
Примерами веществ в
аморфном состоянии могут служить стекла, смолы, клеи, большинство полимеров и
т. д.
Кристаллическое состояние
Большинство
твердых веществ в окружающем нас мире являются кристаллическими. Для этого
состояния характерно строго определенное расположение частиц во всем объеме
кристалл (дальний порядок), поэтому в отличие от аморфных кристаллические
вещества обладают анизотропией, т.
е. их физические свойства (прочность,
теплопроводность и т. д.) неодинако вы в различных направлениях. Так, если
вышеописанный опыт проделать на гладкой поверхности гипса, то пятно
расплавленного воска примет форму эллипса. Значит, теплопроводность гипса в
одном направлении более высокая, чем в других.
Кристаллическое
вещество в отличие от аморфного плавите; при строго определенной температуре,
которую называют температурой плавления. Температура плавления — одно и
важнейших физических свойств вещества, измеряя ее, можно определить чистоту
данного вещества.






