- Общая характеристика
- Природные соединения
- Получение
- Химические свойства
- Оксиды щелочноземельных металлов
- Получение
- Химические свойства
- Гидроксиды щелочноземельных металлов
- Получение
- Химические свойства
- Жесткость воды
- Щёлочноземельные металлы — основные свойства, характеристика и список элементов
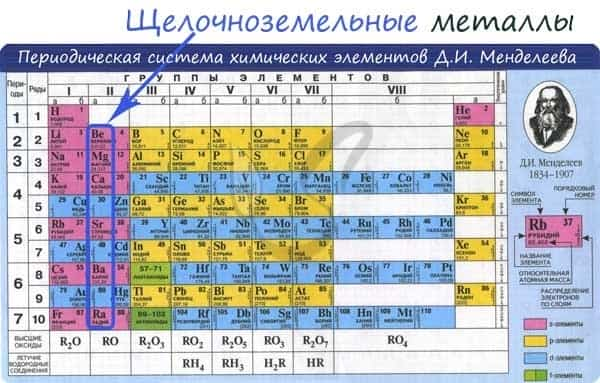
- Положение в периодической системе Менделеева
- Электронное строение и закономерности изменения свойств
- Физические свойства щелочноземельных металлов
- Химические свойства
- Нахождение в природе
- Способ получения
- Качественные реакции
- Применение щелочноземельных металлов
- Оксиды щелочноземельных металлов
- Щелочноземельные металлы в химии
- Физические свойства щелочноземельных металлов
- Получение щелочноземельных металлов
- Химические свойства щелочноземельных металлов
- Качественные реакции
- Примеры решения задач
- Щелочноземельные металлы
- Щёлочноземельные металлы | это… Что такое Щёлочноземельные металлы?
- Физические свойства
- Химические свойства
- Нахождение в природе
- См. также
- Ссылки
- Литература
- II группа главная подгруппа Периодической таблицы Менделеева (щелочноземельные металлы)
- Взаимодействие со сложными веществами
К щелочноземельным металлам относятся металлы IIa группы: бериллий, магний, кальций, стронций, барий и радий. Отличаются легкостью, мягкостью и сильной реакционной способностью.
Общая характеристика
От Be к Ra (сверху вниз в периодической таблице) происходит увеличение: атомного радиуса, металлических, основных, восстановительных свойств, реакционная способность. Уменьшается электроотрицательность, энергия ионизация, сродство к электрону.
Электронные конфигурации у данных элементов схожи, так как они находятся в одной группе (главной подгруппе!), общая формула ns2:
- Be — 2s2
- Mg — 3s2
- Ca — 4s2
- Sr — 5s2
- Ba — 6s2
- Ra — 7s2
Природные соединения
В природе щелочноземельные металлы встречаются в виде следующих соединений:
- Be — BeO*Al2O3*6SiO2 — берилл
- Mg — MgCO3 — магнезит, MgO*Al2O3 — шпинель, 2MgO*SiO2 — оливин
- Ca — CaCO3 — мел, мрамор, известняк, кальцит, CaSO4*2H2O — гипс, CaF2 — флюорит

Получение
Это активные металлы, которые нельзя получить электролизом раствора. С целью их получения применяют электролиз расплавов, алюминотермию и вытеснением их из солей другими более активными металлами.
- MgCl2 → (t) Mg + Cl2 (электролиз расплава)
- CaO + Al → Al2O3 + Ca (алюминотермия — способ получения металлов путем восстановления их оксидов алюминием)
- MgBr2 + Ca → CaBr2 + Mg

Химические свойства
- Реакции с водой
- Реакции с кислотами
- Реакции с неметаллами
- Mg + O2 → MgO (оксид магния)
- Ca + I2 → CaI2 (йодид кальция)
- При нагревании реагируют с серой, азотом, водородом и углеродом.
- Mg + S → (t) MgS (сульфид магния)
- Ca + N2 → (t) Ca3N2 (нитрид кальция)
- Ca + H2 → (t) CaH2 (гидрид кальция)
- Ba + C → (t) BaC2 (карбид бария)
- С оксидами других металлов
Все щелочноземельные металлы (кроме бериллия и магния) реагируют с холодной водой с образованием соответствующих гидроксидов. Магний реагирует с водой только при нагревании. Ca + H2O → Ca(OH)2 + H2↑ 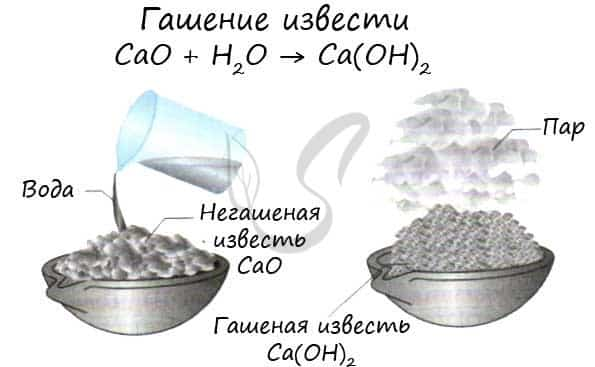
Щелочноземельные металлы — активные металлы, стоящие в ряду активности левее водорода, и, следовательно, способные вытеснить водород из кислот: Ba + HCl → BaCl2 + H2
Хорошо реагируют с неметаллами: кислородом, образуя оксиды состава RO, с галогенами (F, Cl, Br, I). Степень окисления у щелочноземельных металлов постоянная +2.

Ba + TiO2 → BaO + Ti (барий, как более активный металл, вытесняет титан)
Оксиды щелочноземельных металлов
Имеют общую формулу RO, например: MgO, CaO, BaO.
Получение
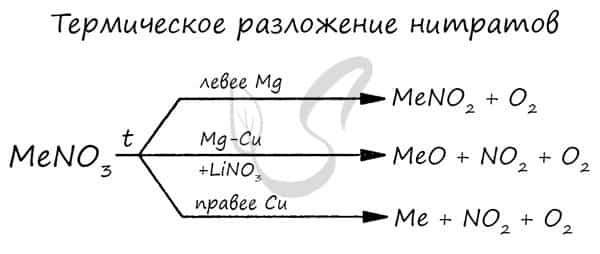
- Оксиды щелочноземельных металлов можно получить путем разложения карбонатов и нитратов:
- MgCO3 → (t) MgO + CO2
- Ca(NO3)2 → (t < 560°C) Ca(NO2)2 + O2
- Ca(NO3)2 → (t > 560°C) CaO + O2 + NO2
- Рекомендую взять на вооружение общую схему разложения нитратов:
Химические свойства
Проявляют преимущественно основные свойства, все кроме BeO — амфотерного оксида.
- Реакции с кислотами и кислотными оксидами
- BaO + HCl → BaCl2 + H2O
- CaO + H2SO4 → CaSO4 + H2O
- MgO + SO3 → MgSO4
- CaO + CO2 → CaCO3
- CaO + SiO2 → CaSiO3
- Реакция с водой
- В нее вступают все, кроме оксида бериллия.
- CaO + H2O → Ca(OH)2
- MgO + H2O → Mg(OH)2
- Амфотерный оксид бериллия
- BeO + HCl → BeCl2 + H2O
- BeO + NaOH + H2O → Na2[Be(OH)4] (тетрагидроксобериллат натрия)
- Если реакция проходит при высоких температурах (в расплаве) комплексная соль не образуется, так как происходит испарение воды:
- BeO + NaOH → Na2BeO2 + H2O (бериллат натрия)
- BeO + Na2O → Na2BeO2
Амфотерные свойства оксида бериллия требуют особого внимания. Этот оксид проявляет двойственные свойства: реагирует с кислотами с образованием солей, и с основаниями с образованием комплексных солей.
Гидроксиды щелочноземельных металлов
Проявляют основные свойства, за исключением гидроксида бериллия — амфотерного гидроксида.
Получение
Получают гидроксиды в реакции соответствующего оксида металла и воды (все кроме Be(OH)2)
CaO + H2O → Ca(OH)2
Химические свойства
- Основные свойства большинства гидроксидов располагают к реакциям с кислотами и кислотными оксидами.
- Ba(OH)2 + H2SO4 → BaSO4↓ + H2O
- Ca(OH)2 + 2CO2 → Ca(HCO3)2
- Ca(HCO3)2 + Ca(OH)2 → CaCO3 + H2O + CO2
- Ca(OH)2 + CO2 → CaCO3↓ + H2O

- Реакции с солями (и не только) идут в том случае, если соль растворимы и по итогам реакции выделяется газ, выпадает осадок или образуется слабый электролит (вода).
- Ba(OH)2 + Na2SO4 → BaSO4↓ + NaOH
- Гидроксид бериллия относится к амфотерным: проявляет двойственные свойства, реагируя и с кислотами, и с основаниями.
- Be(OH)2 + HCl → BeCl2 + H2O
- Be(OH)2 + NaOH → Na2[Be(OH)4]
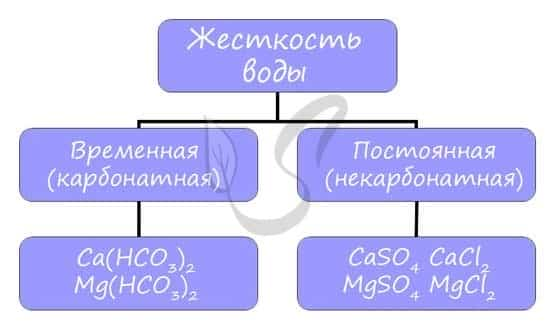
Жесткость воды
Жесткостью воды называют совокупность свойств воды, зависящую от присутствия в ней преимущественно солей кальция и магния: гидрокарбонатов, сульфатов и хлоридов.
Различают временную (карбонатную) и постоянную (некарбонатную) жесткость.
- Вероятно, вы часто устраняете жесткость воды у себя дома, осмелюсь предположить — каждый день. Временная жесткость воды устраняется обычным кипячением воды в чайнике, и известь на его стенках — CaCO3 — бесспорное доказательство устранения жесткости:
- Ca(HCO3)2 → CaCO3↓ + CO2 + H2O
- Также временную жесткость можно устранить, добавив Na2CO3 в воду:
- Ca(HCO3)2 + Na2CO3 → CaCO3↓ + NaHCO3
- С постоянной жесткостью бороться кипячением бесполезно: сульфаты и хлориды не выпадут в осадок при кипячении. Постоянную жесткость воды устраняют добавлением в воду Na2CO3:
- CaCl2 + Na2CO3 → CaCO3↓ + NaCl
- MgSO4 + Na2CO3 + H2O → [Mg(OH)]2CO3↓ + CO2↑ + Na2SO4
Жесткость воды можно определить с помощью различных тестов. Чрезмерно высокая жесткость воды приводит к быстрому образованию накипи на стенках котлов, труб, чайника.

Щёлочноземельные металлы — основные свойства, характеристика и список элементов
Щёлочноземельные металлы получили свое название за счет своих оксидов, которые сообщают воде щелочные реакции. Изучая химию, очень часто приходится взаимодействовать со сложными и непонятными названиями. Но если разобраться и понять что к чему, то изучать предмет легко и интересно.
Однако при написании формул стоит быть внимательным, не забывая про коэффициенты и признаки реакций.
Положение в периодической системе Менделеева
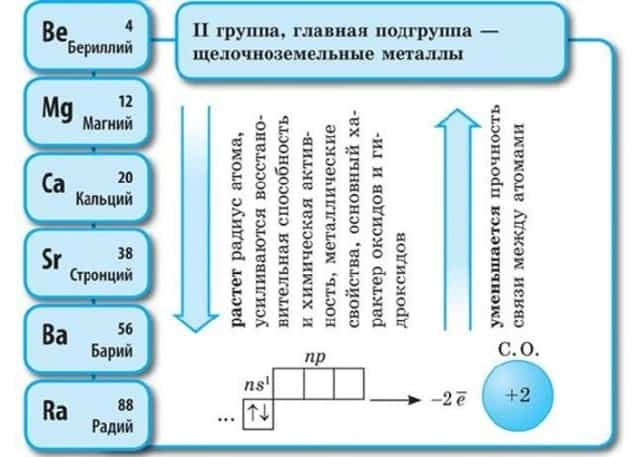
Щелочноземельные металлы – это химические элементы второй группы периодической системы химических элементов таблицы Менделеева:
- бериллий Be;
- магний Mg;
- кальций Ca;
- стронций Sr;
- барий Ba;
- радий Ra.
Электронное строение и закономерности изменения свойств
Атомы данных металлов на внешнем энергетическом уровне имеют 2 s-электрона. Отсюда следует, что максимальная степень окисления +2.
- Также могут иметь нулевую степень окисления, но не отрицательную, так как металлы не могут иметь данную степень.
- Общая конфигурация внешнего энергетического уровня nS2:

В периоде от Be до Ra металлические свойства, восстановительные, электроотрицательные увеличиваются, а неметаллические, окислительные свойства и радиус атома уменьшается.
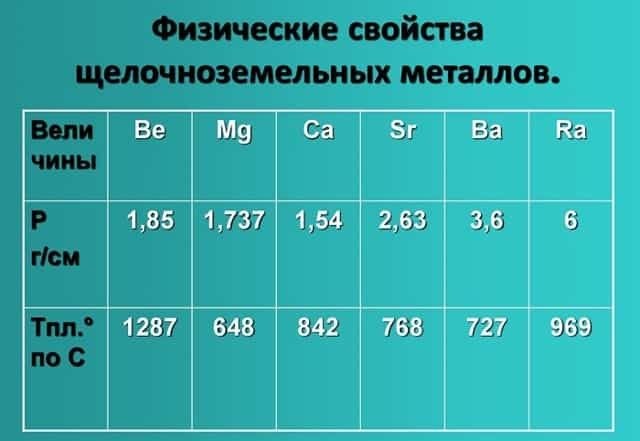
Физические свойства щелочноземельных металлов
- Физические свойства данной группы имеют следующие характеристики: светло-серый — темно-серый цвет, твердые вещества, не растворимые и нелетучие, без запаха, тепло-электропроводимые, имеют характерный металлический блеск.
- Показатели плотности и температуры плавления представлены в таблице:
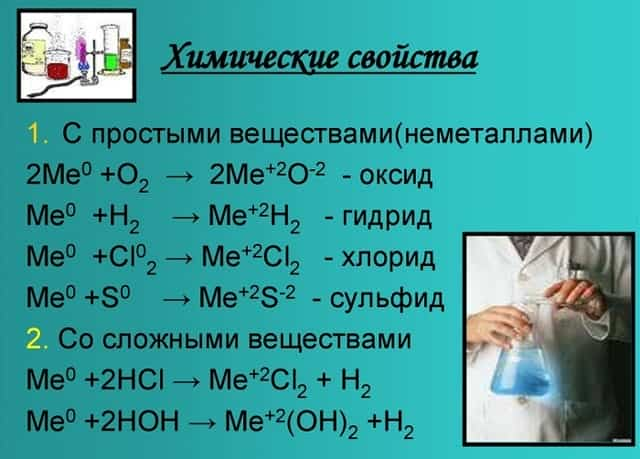
Химические свойства
Оксиды и гидроксиды щёлочноземельных металлов усиливают основные свойства при движении вниз по второй группе. Следовательно, бериллий имеет меньшие основные свойства, чем радий.
- Эти вещества взаимодействуют с любыми растворами кислот от сильной до слабой, а также с образованием солей, образуя белый осадок.
- 4Ca + 5H2SO4 (конц) = 4CaSO4 + H2S + 4H2O.
- С кислородом образуют реакцию горения и оксид:
- 2Mg + O2 = 2MgO.
- Металлы, стоящие в главной подгруппе второй группы (кроме бериллия) реагируют с водой. При проведении данных реакций выделяется водород (H2):
- Mg + 2H2O = Mg(OH)2 + H2,
- Вa + 2H2O = Вa(OH)2 + H2.
- Также реагируют с неметаллами:
- Bа + Cl2 = BаCl2 — хлорид бериллия;
- Ca + Br2 = CaBr2 — бромид кальция;
- Sr + H2 = SrH2 — гидрид стронция.
- Химические свойства щелочноземельных металлов показаны на картинке:
Нахождение в природе
Все металлы данного типа встречаются на земле, но не в чистом виде. Часто они представлены в виде минеральных солей. Самый распространённый считается кальций, магний немного уступает, затем идет барий и стронций.
Бериллий и радий являются самыми редкими, однако последний металл в больших количествах находится в урановых рудах.

Способ получения
- Магний, кальций и стронций получают электролизом расплавов солей.
- Барий получают с помощью восстановления оксида.
- При нагревании фторида бария получают сам металл.
Качественные реакции
- Одна из качественных реакций-окрашивание пламени.
- Список возможных цветов пламени при нагревании данных элементов:
- Ca — темно-оранжевый;
- Sr — насыщенный красный;
- Ba — светло-зеленый или классический зеленый.

Металлы данного типа при взаимодействии с щелочами, оксидами или растворами солей выпадают в белый осадок.
Применение щелочноземельных металлов
Бериллий из-за своей прочности добавляют в различные сплавы металлов, также препятствует коррозии. Используется в изготовлении рентгеновских аппаратов.
Магний и кальций активно использует для лекарственных средств, поскольку данные металлы играют большую роль в жизнедеятельности организма. Также в медицине используют радий, но для облучения кожи и злокачественных образований.
Стронций и барий добавляют в различный сплавы, которые работают в агрессивной среде и имеют сверхсильную проводимость.
Данные металлы играют огромную роль в жизни человека, выполняют различные функции и имеют ряд определенных свойств. Они содержатся в земной коре, поэтому довольно широко используются. Однако это не говорит о том, что их нужно расходовать безгранично.
Оксиды щелочноземельных металлов
НАХОЖДЕНИЕ В ПРИРОДЕ
В земной коре содержится бериллия — 0,00053%, магния — 1,95%, кальция — 3,38%, стронция — 0,014%, бария — 0,026%, радий — искусственный элемент.
Встречаются в природе только в виде соединений — силикатов, алюмосиликатов, карбонатов, фосфатов, сульфатов и т.д.
- ПОЛУЧЕНИЕ
- 1. Бериллий получают восстановлением фторида:
- BeF2 + Mg t˚C→ Be + MgF2
- 2. Барий получают восстановлением оксида:
- 3BaO + 2Al t˚C→ 3Ba + Al2O3
- 3. Остальные металлы получают электролизом расплавов хлоридов:
Т.к. металлы данной подгруппы сильные восстановители, то получение возможно только путем электролиза расплавов солей. В случае Са обычно используют CaCl2 (c добавкой CaF2 для снижения температуры плавления)
CaCl2=Ca+Cl2↑
ФИЗИЧЕСКИЕ СВОЙСТВА
Щелочноземельные металлы (по сравнению со щелочными металлами) обладают более высокими t°пл. и t°кип, плотностями и твердостью.
ПРИМЕНЕНИЕ
| Бериллий (Амфотерен) | Магний | Ca, Sr, Ba, Ra |
| 1. Изготовление теплозащитных конструкций для косм. кораблей (жаропрочность, теплоёмкость бериллия) 2. Бериллиевые бронзы (лёгкость, твёрдость, жаростойкость, антикоррозионность сплавов, прочность на разрыв выше стали, можно прокатывать в ленты толщиной 0,1 мм) 3. В атомных реакторах, рентгенотехнике, радиоэлектронике 4. Сплав Be, Ni, W- в Швейцарии делают пружины для часов Но Be –хрупок, ядовит и очень дорогой | 1. Получение металлов – магнийтермия (титан, уран, цирконий и др) 2. Для получения сверхлёгких сплавов (самолётостроение, производство автомобилей) 3. В оргсинтезе 4. Для изготовления осветительных и зажигательных ракет. | 1. Изготовление свинцово-кадмиевых сплавов, необходимых при производстве подшипников. 2. Стронций – восстановитель в производстве урана. Люминофоры — соли стронция. 3. Используют в качестве геттеров, веществ для создания вакуума в электроприборах. Кальций Получение редких металлов, входит в состав сплавов. Барий Газопоглотитель в электронно-лучевых трубках. Радий Рентгенодиагностика, исследовательские работы. |
ХИМИЧЕСКИЕ СВОЙСТВА
1. Очень реакционноспособны, сильные восстановители. Активность металлов и их восстановительная способность увеличивается в ряду: Be–Mg–Ca–Sr–Ba
2. Обладают степенью окисления +2.
3. Реагируют с водой при комнатной температуре (кроме Be) с выделением водорода.
4. С водородом образуют солеобразные гидриды ЭH2.
5. Оксиды имеют общую формулу ЭО. Тенденция к образованию пероксидов выражена слабее, чем для щелочных металлов.
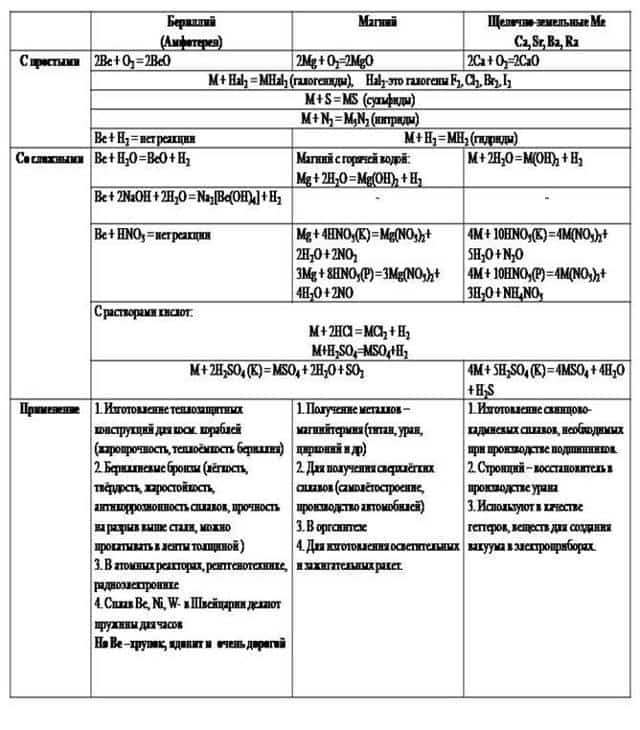
- Реакция с водой.
- В обычных условиях поверхность Be и Mg покрыты инертной оксидной пленкой, поэтому они устойчивы по отношению к воде, но с горячей водой магний образует основание Mg(OH)2.
- В отличие от них Ca, Sr и Ba растворяются в воде с образованием гидроксидов, которые являются сильными основаниями:
- Ве + H2O → ВеO+ H2
- Ca + 2H2O → Ca(OH)2 + H2
- Реакция с кислородом.
- Все металлы образуют оксиды RO, барий образует пероксид – BaO2:
- 2Mg + O2 → 2MgO
- Ba + O2 → BaO2
- 3. С другими неметаллами образуются бинарные соединения:
- Be + Cl2 → BeCl2 (галогениды)
- Ba + S → BaS (сульфиды)
- 3Mg + N2 → Mg3N2 (нитриды)
- Ca + H2 → CaH2 (гидриды)
- Ca + 2C → CaC2 (карбиды)
- 3Ba + 2P → Ba3P2 (фосфиды)
- Бериллий и магний сравнительно медленно реагируют с неметаллами.
- 4. Все металлы растворяются в кислотах:
- Ca + 2HCl → CaCl2 + H2
- Mg + H2SO4(разб.) → MgSO4 + H2
- Бериллий также растворяется в водных растворах щелочей:
- Be + 2NaOH + 2H2O → Na2[Be(OH)4] + H2
- 5. Качественная реакция на катионы щелочноземельных металлов – окрашивание пламени в следующие цвета:
- Ca2+ — темно-оранжевый
- Sr2+- темно-красный
- Ba2+ — светло-зеленый
- Катион Ba2+ обычно открывают обменной реакцией с серной кислотой или ее солями:
- BaCl2 + H2SO4 → BaSO4↓ + 2HCl
- Ba2+ + SO42- → BaSO4↓
- Сульфат бария – белый осадок, нерастворимый в минеральных кислотах.
- Оксиды щелочноземельных металлов
- Получение
- 1) Окисление металлов (кроме Ba, который образует пероксид)
- 2) Термическое разложение нитратов или карбонатов
- CaCO3 t˚C→ CaO + CO2
- 2Mg(NO3)2 t˚C→ 2MgO + 4NO2 + O2
- Химические свойства
- Типичные основные оксиды. Реагируют с водой (кроме BeO и MgO), кислотными оксидами и кислотами
- СаO + H2O → Са(OH)2
- 3CaO + P2O5 → Ca3(PO4)2
- BeO + 2HNO3 → Be(NO3)2 + H2O
- BeO — амфотерный оксид, растворяется в щелочах:
- BeO + 2NaOH + H2O → Na2[Be(OH)4]
- Гидроксиды щелочноземельных металлов R(OH)2
- Получение
- Реакции щелочноземельных металлов или их оксидов с водой:
- Ba + 2H2O → Ba(OH)2 + H2
- CaO (негашеная известь) + H2O → Ca(OH)2(гашеная известь)
- Химические свойства
- Гидроксиды R(OH)2 — белые кристаллические вещества, в воде растворимы хуже, чем гидроксиды щелочных металлов (растворимость гидроксидов уменьшается с уменьшением порядкового номера; Be(OH)2 – нерастворим в воде, растворяется в щелочах). Основность R(OH)2 увеличивается с увеличением атомного номера:
- Be(OH)2 – амфотерный гидроксид
- Mg(OH)2 – слабое основание
- Са(OH)2 — щелочь
- остальные гидроксиды — сильные основания (щелочи).
- 1) Реакции с кислотными оксидами:
- Ca(OH)2 + СO2 → CaСO3↓ + H2O ! Качественная реакция на углекислый газ
- Ba(OH)2 + SO2 → BaSO3↓ + H2O
- 2) Реакции с кислотами:
- Ba(OH)2 + 2HNO3 → Ba(NO3)2 + 2H2O
- 3) Реакции обмена с солями:
- Ba(OH)2 + K2SO4 → BaSO4↓+ 2KOH
- 4) Реакция гидроксида бериллия со щелочами:
- Be(OH)2 + 2NaOH → Na2[Be(OH)4]
- Жесткость воды
Природная вода, содержащая ионы Ca2+ и Mg2+, называется жесткой. Жесткая вода при кипячении образует накипь, в ней не развариваются пищевые продукты; моющие средства не дают пены.
- Карбонатная (временная) жесткость обусловлена присутствием в воде гидрокарбонатов кальция и магния, некарбонатная (постоянная) жесткость – хлоридов и сульфатов.
- Общая жесткость воды рассматривается как сумма карбонатной и некарбонатной.
- Удаление жесткости воды осуществляется путем осаждения из раствора ионов Ca2+ и Mg2+
- 1) кипячением:
- Сa(HCO3)2 t˚C→ CaCO3↓+ CO2 + H2O
- Mg(HCO3)2 t˚C→ MgCO3↓+ CO2 + H2O
- 2) добавлением известкового молока:
- Ca(HCO3)2 + Ca(OH)2 → 2CaCO3↓ + 2H2O
- 3) добавлением соды:
- Ca(HCO3)2 + Na2CO3 →CaCO3↓+ 2NaHCO3
- CaSO4 + Na2CO3 → CaCO3↓ + Na2SO4
- MgCl2 + Na2CO3 → MgCO3↓ + 2NaCl
Поиск на сайте:
Щелочноземельные металлы в химии
К щелочноземельным металлам относятся металлы IIA группы Периодической системы Д.И. Менделеева – кальций (Ca), стронций (Sr), барий (Ba) и радий (Ra). Кроме них в главную подгруппу II группы входят бериллий (Be) и магний (Mg).
На внешнем энергетическом уровне щелочноземельных металлов находится два валентных электрона. Электронная конфигурация внешнего энергетического уровня щелочноземельных металлов – ns2. В своих соединениях они проявляют единственную степень окисления равную +2.
В ОВР являются восстановителями, т.е. отдают электрон.
С увеличением заряда ядра атомов элементов, входящих в группу щелочноземельных металлов, энергия ионизации атомов уменьшается, а радиусы атомов и ионов увеличиваются, металлические признаки химических элементов усиливаются.
Физические свойства щелочноземельных металлов
В свободном состоянии Be – металл серо-стального цвета, обладающий плотной гексагональной кристаллической решеткой, достаточно твердый и хрупкий. На воздухе Be покрывается оксидной пленкой, что придает ему матовый оттенок и снижает его химическую активность.
Магний в виде простого вещества представляет собой белый металл, который, также, как и Be, при нахождении на воздухе приобретает матовый оттенок за счет образующейся оксидной пленки. Mg мягче и пластичнее бериллия. Кристаллическая решетка Mg – гексагональная.
Ca, Ba и Sr в свободном виде – серебристо-белые металлы. При нахождении на воздухе мгновенно покрываются желтоватой пленкой, которая представляет собой продукты их взаимодействия с составными частями воздуха. Кальций – достаточно твердый металл, Ba и Sr – мягче.
Ca и Sr имею кубическую гранецентрированную кристаллическую решетку, барий – кубическую объемоцентрированную кристаллическую решетку.
Все щелочноземельные металлы характеризуются наличием металлического типа химической связи, что обуславливает их высокую тепло- и электропроводность. Температуры кипения и плавления щелочноземельных металлов выше, чем щелочных металлов.
Получение щелочноземельных металлов
- Получение Be осуществляют по реакции восстановления его фторида. Реакция протекает при нагревании:
- BeF2 + Mg = Be + MgF2
- Магний, кальций и стронций получают электролизом расплавов солей, чаще всего – хлоридов:
- CaCl2 = Ca + Cl2↑
- Причем, при получении Mg электролизом расплава дихлорида для понижения температуры плавления в реакционную смесь добавляют NaCl.
- Для получения Mg в промышленности используют металло- и углетермические методы:
- 2(CaO×MgO) (доломит) + Si = Ca2SiO4 + Mg
- Основной способ получения Ba – восстановление оксида:
- 3BaO + 2Al = 3Ba + Al2O3
Химические свойства щелочноземельных металлов
Поскольку в н.у. поверхность Be и Mg покрыта оксидной пленкой – эти металлы инертны по отношению к воде. Ca, Sr и Ba растворяются в воде с образованием гидроксидов, проявляющих сильные основные свойства:
- Ba + H2O = Ba(OH)2 + H2↑
- Щелочноземельные металлы способны реагировать с кислородом, причем все они, за исключением бария, в результате этого взаимодействия образуют оксиды, барий – пероксид:
- 2Ca + O2 = 2CaO
- Ba + O2 = BaO2
- Оксиды щелочноземельных металлов, за исключением бериллия, проявляют основные свойства, Be – амфотерные свойства.
- При нагревании щелочноземельные металлы способны к взаимодействию с неметаллами (галогенами, серой, азотом и др.):
- Mg + Br2 =2MgBr
- 3Sr + N2 = Sr3N2
- 2Mg + 2C = Mg2C2
- Ca +S = CaS
- 2Ba + 2P = Ba3P2
- Ba + H2 = BaH2
- Щелочноземельные металлы реагируют с кислотами – растворяются в них:
- Ca + 2HCl = CaCl2 + H2↑
- Mg + H2SO4 = MgSO4 + H2↑
- Бериллий реагирует с водными растворами щелочей – растворяется в них:
- Be + 2NaOH + 2H2O = Na2[Be(OH)4] + H2↑
Качественные реакции
- Качественной реакцией на щелочноземельные металлы является окрашивание пламени их катионами: Ca2+ окрашивает пламя в темно-оранжевый цвет, Sr 2+ — в темно-красный, Ba2+ — в светло-зеленый.
- Качественной реакцией на катион бария Ba2+ являются анионы SO42-, в результате чего образуется белый осадок сульфата бария (BaSO4), нерастворимый в неорганических кислотах.
- Ba2+ + SO42- = BaSO4↓
Примеры решения задач
| Понравился сайт? Расскажи друзьям! |
Щелочноземельные металлы
Свойства щелочноземельных металлов
| Атомный номер | Название | Атомная масса | Электронная конфигурация | r г/см3 | t°пл. °C | t°кип. °C | ЭО | Степень окисления | |
| 4 | Бериллий Be | 9,01 | [He] 2s2 | 1,86 | 1283 | 2970 | 1,5 | 0,113 | +2 |
| 11 | Магний Mg | 24,3 | [Ne]3s2 | 1,74 | 649,5 | 1120 | 1,2 | 0,16 | +2 |
| 19 | Кальций Ca | 40,08 | [Ar] 4s2 | 1,54 | 850 | 1487 | 1,0 | 0,2 | +2 |
| 27 | Стронций Sr | 87,62 | [Kr] 5s2 | 2,67 | 770 | 1367 | 1,0 | 0,213 | +2 |
| 55 | Барий Ba | 137,34 | [Xe] 6s2 | 3,61 | 710 | 1637 | 0,9 | 0,25 | +2 |
| 87 | Радий Ra | 226 | [Rn] 7s2 | ~6 | ~700 | 1140 | 0,9 | – | +2 |
Физические свойства Щелочноземельные металлы (по сравнению со щелочными металлами) обладают более высокими t°пл. и t°кип., потенциалами ионизации, плотностями и твердостью. Химические свойства 1. Очень реакционноспособны. 2. Обладают положительной валентностью +2. 3. Реагируют с водой при комнатной температуре (кроме Be) с выделением водорода.
4. Обладают большим сродством к кислороду (восстановители). 5. С водородом образуют солеобразные гидриды ЭH2. 6. Оксиды имеют общую формулу ЭО. Тенденция к образованию пероксидов выражена слабее, чем для щелочных металлов.
Нахождение в природе Be3BeO • Al2O3 • 6SiO2 – берилл MgMgCO3 – магнезитCaCO3 • MgCO3 – доломитKCl • MgSO4 • 3H2O – каинитKCl • MgCl2 • 6H2O – карналлит CaCaCO3 – кальцит (известняк, мрамор и др.
)Ca3(PO4)2 – апатит, фосфоритCaSO4 • 2H2O – гипсCaSO4 – ангидритCaF2 – плавиковый шпат (флюорит) SrSrSO4 – целестинSrCO3 – стронцианит BaBaSO4 – баритBaCO3 – витерит Получение Бериллий получают восстановлением фторида: BeF2 + Mg –t°® Be + MgF2 Барий получают восстановлением оксида: 3BaO + 2Al –t°® 3Ba + Al2O3 Остальные металлы получают электролизом расплавов хлоридов: CaCl2 ® Ca + Cl2катод: Ca2+ + 2e ® Ca0анод: 2Cl- – 2e ® Cl02 Металлы главной подгруппы II группы — сильные восстановители; в соединениях проявляют только степень окисления +2. Активность металлов и их восстановительная способность увеличивается в ряду: ––Be–Mg–Ca–Sr–Ba® 1. Реакция с водой. В обычных условиях поверхность Be и Mg покрыты инертной оксидной пленкой, поэтому они устойчивы по отношению к воде. В отличие от них Ca, Sr и Ba растворяются в воде с образованием гидроксидов, которые являтся сильными основаниями: Mg + 2H2O –t°® Mg(OH)2 + H2 Ca + 2H2O ® Ca(OH)2 + H2 2. Реакция с кислородом. Все металлы образуют оксиды RO, барий-пероксид – BaO2: 2Mg + O2 ® 2MgO Ba + O2 ® BaO2 3. С другими неметаллами образуются бинарные соединения: Be + Cl2 ® BeCl2(галогениды)Ba + S ® BaS(сульфиды)3Mg + N2 ® Mg3N2(нитриды)Ca + H2 ® CaH2(гидриды)Ca + 2C ® CaC2(карбиды)3Ba + 2P ® Ba3P2(фосфиды) Бериллий и магний сравнительно медленно реагируют с неметаллами. 4. Все металлы растворяются в кислотах: Ca + 2HCl ® CaCl2 + H2Mg + H2SO4(разб.) ® MgSO4 + H2 Бериллий также растворяется в водных растворах щелочей: Be + 2NaOH + 2H2O ® Na2[Be(OH)4] + H2 5. Качественная реакция на катионы щелочноземельных металлов – окрашивание пламени в следующие цвета: Ca2+ — темно-оранжевыйSr2+- темно-красныйBa2+ — светло-зеленый Катион Ba2+ обычно открывают обменной реакцией с серной кислотой или ее солями:Сульфат бария – белый осадок, нерастворимый в минеральных кислотах. Оксиды щелочноземельных металлов Получение 1) Окисление металлов (кроме Ba, который образует пероксид) 2) Термическое разложение нитратов или карбонатов CaCO3 –t°® CaO + CO22Mg(NO3)2 –t°® 2MgO + 4NO2 + O2 Химические свойства Типичные основные оксиды. Реагируют с водой (кроме BeO), кислотными оксидами и кислотами MgO + H2O ® Mg(OH)23CaO + P2O5 ® Ca3(PO4)2BeO + 2HNO3 ® Be(NO3)2 + H2O BeO — амфотерный оксид, растворяется в щелочах: BeO + 2NaOH + H2O ® Na2[Be(OH)4] Гидроксиды щелочноземельных металлов R(OH)2 ПолучениеРеакции щелочноземельных металлов или их оксидов с водой:Ba + 2H2O ® Ba(OH)2 + H2CaO(негашеная известь) + H2O ® Ca(OH)2(гашеная известь) Химические свойства Гидроксиды R(OH)2 — белые кристаллические вещества, в воде растворимы хуже, чем гидроксиды щелочных металлов (растворимость гидроксидов уменьшается с уменьшением порядкового номера; Be(OH)2 – нерастворим в воде, растворяется в щелочах). Основность R(OH)2 увеличивается с увеличением атомного номера: Be(OH)2 – амфотерный гидроксидMg(OH)2 – слабое основание остальные гидроксиды — сильные основания (щелочи). 1) Реакции с кислотными оксидами: Ca(OH)2 + SO2 ® CaSO3 + H2OBa(OH)2 + CO2 ® BaCO3¯ + H2O 2) Реакции с кислотами: Mg(OH)2 + 2CH3COOH ® (CH3COO)2Mg + 2H2OBa(OH)2 + 2HNO3 ® Ba(NO3)2 + 2H2O 3) Реакции обмена с солями: Ba(OH)2 + K2SO4 ® BaSO4¯+ 2KOH 4) Реакция гидроксида бериллия со щелочами: Be(OH)2 + 2NaOH ® Na2[Be(OH)4] Жесткость воды Природная вода, содержащая ионы Ca2+ и Mg2+, называется жесткой. Жесткая вода при кипячении образует накипь, в ней не развариваются пищевые продукты; моющие средства не дают пены.Карбонатная (временная) жесткость обусловлена присутствием в воде гидрокарбонатов кальция и магния, некарбонатная (постоянная) жесткость – хлоридов и сульфатов.Общая жесткость воды рассматривается как сумма карбонатной и некарбонатной.Удаление жесткости воды осуществляется путем осаждения из раствора ионов Ca2+ и Mg2+: 1) кипячением:Сa(HCO3)2 –t°® CaCO3¯ + CO2 + H2OMg(HCO3)2 –t°® MgCO3¯ + CO2 + H2O 2) добавлением известкового молока: Ca(HCO3)2 + Ca(OH)2 ® 2CaCO3¯ + 2H2O 3) добавлением соды: Ca(HCO3)2 + Na2CO3 ® CaCO3¯+ 2NaHCO3CaSO4 + Na2CO3 ® CaCO3¯ + Na2SO4MgCl2 + Na2CO3 ® MgCO3¯ + 2NaCl 4) пропусканием через ионнообменную смолу а) катионный обмен: 2RH + Ca2+ ® R2Ca + 2H+ б) анионный обмен: 2ROH + SO42- ® R2SO4 + 2OH- (где R — сложный органический радикал) Для удаления временной жесткости используют все четыре способа, а для
постоянной — только два последних.
Щёлочноземельные металлы | это… Что такое Щёлочноземельные металлы?
Щё́лочноземе́льные мета́ллы — химические элементы 2-й группы[1] периодической таблицы элементов: бериллий, магний, кальций, стронций, барий и радий[2][3]. Названы так потому, что их оксиды — «земли» (по терминологии алхимиков) — сообщают в воде щелочную реакцию. Соли щёлочноземельных металлов, кроме радия, широко распространены в природе в виде минералов. Происхождение этого названия связано с тем, что их гидроксиды являются щелочами, а оксиды по тугоплавкости сходны с оксидами алюминия и железа, носившими ранее общее название «земли
Физические свойства
Все щёлочноземельные металлы — серые, твёрдые при комнатной температуре вещества. В отличие от щелочных металлов, они существенно более твёрдые, и ножом преимущественно не режутся (исключение — стронций).
Плотность щёлочноземельных металлов с порядковым номером растёт, хотя явно рост наблюдается только начиная с кальция, который имеет минимальную среди них плотность (ρ = 1,55 г/см³), самый тяжёлый — радий, плотность которого примерно равна плотности железа.
Химические свойства
Щёлочноземельные металлы имеют электронную конфигурацию внешнего энергетического уровня ns², и являются s-элементами, наряду с щелочными металлами. Имея два валентных электрона, щёлочноземельные металлы легко их отдают, и во всех соединениях имеют степень окисления +2 (очень редко +1).
Химическая активность щёлочноземельных металлов растёт с ростом порядкового номера.
Бериллий в компактном виде не реагирует ни с кислородом, ни с галогенами даже при температуре красного каления (до 600 °C, для реакции с кислородом и другими халькогенами нужна ещё более высокая температура, фтор — исключение).
Магний защищён оксидной плёнкой при комнатной температуре и более высоких (до 650 °C) температурах и не окисляется дальше.
Кальций медленно окисляется и при комнатной температуре вглубь (в присутствии водяных паров), и сгорает при небольшом нагревании в кислороде, но устойчив в сухом воздухе при комнатной температуре. Стронций, барий и радий быстро окисляются на воздухе, давая смесь оксидов и нитридов, поэтому их, так же и как щелочные металлы (и кальций), хранят под слоем керосина.
Оксиды и гидроксиды щёлочноземельных металлов имеют тенденцию к усилению основных свойств с ростом порядкового номера: Be(OH)2 — амфотерный, нерастворимый в воде гидроксид, но растворим в кислотах (а также проявляет кислотные свойства в присутствии сильных щелочей), Mg(OH)2 — слабое основание, нерастворимое в воде, Ca(OH)2 — сильное, но малорастворимое в воде основание, Sr(OH)2 — лучше растворимо в воде, чем гидроксид кальция, сильное основание (щёлочь) при высоких температурах, близких к точке кипения воды (100 °C), Ba(OH)2 — сильное основание (щёлочь), по силе не уступающее KOH или NaOH, и Ra(OH)2 — одна из сильнейших щелочей, очень коррозионное вещество.
Нахождение в природе
Все щёлочноземельные металлы имеются (в разных количествах) в природе. Ввиду своей высокой химической активности все они в свободном состоянии не встречаются.
Самым распространённым щёлочноземельным металлом является кальций, количество которого равно 3,38 % (от массы земной коры). Немногим ему уступает магний, количество которого равно 2,35 % (от массы земной коры).
Распространены в природе также барий и стронций, которых соответственно 0,05 и 0,034 % от массы земной коры. Бериллий является редким элементом, количество которого составляет 6·10−4% от массы земной коры.
Что касается радия, который радиоактивен, то это самый редкий из всех щёлочноземельных металлов, но он в небольшом количестве всегда содержится в урановых рудах. В частности, он может быть выделен оттуда химическим путём. Его содержание равно 1·10−10% (от массы земной коры)[4].
См. также
Ссылки
- http://enc.mail.ru/article/74002900
Литература
II группа главная подгруппа Периодической таблицы Менделеева (щелочноземельные металлы)
- К щелочноземельным металлам относят химические элементы: двувалентные металлы, составляющие IIА группу:
- Бериллий Be
- магний Mg
- кальций Ca,
- стронций Sr,
- барий Ba и
- радий Ra.
- Хотя бериллий Be по свойствам больше похож на алюминий, а магний Mg проявляет некоторые свойства щелочноземельных металлов, но в целом отличается от них.
- Все щелочноземельные металлы — вещества серого цвета и гораздо более твердые, чем щелочные металлы.
Бериллий Be устойчив на воздухе. Магний и кальций (Mg и Ca) устойчивы в сухом воздухе. Стронций Sr и барий Ba хранят под слоем керосина.
От Be к Ra (сверху вниз в периодической таблице) происходит увеличение:
- атомного радиуса,
- металлических, основных, восстановительных свойств,
- реакционной способности.
Уменьшается
- электроотрицательность,
- энергия ионизация,
- сродство к электрону.
- Электронные конфигурации у данных элементов схожи, все они содержат 2 электрона на внешнем уровне ns2:
- Be — 2s2
- Mg —3s2
- Ca — 4s2
- Sr — 5s2
- Ba — 6s2
- Ra — 7s2
Как правило, щелочноземельные металлы в природе присутствуют в виде минеральных солей: хлоридов, бромидов, йодидов, карбонатов, нитратов и др.
Основные минералы, в которых присутствуют щелочноземельные металлы:
Магний
- Магний получают электролизом солей, чаще всего хлоридов: расплавленного карналлита (KCl·MgCl26H2O) или хлорида магния с добавками хлорида натрия при 720–750°С:
MgCl2 → Mg + Cl2
- восстановлением прокаленного доломита в электропечах при 1200–1300°С:
- 2(CaO · MgO) + Si → 2Mg + Ca2SiO4
- Кальций
- Кальций получают электролизом расплавленного хлорида кальция с добавками фторида кальция:
- CaCl2 → Ca + Cl2
- Барий
- Барий получают алюмотермическим способом — восстановление оксида бария алюминием в вакууме при 1200 °C:
- 4BaO+ 2Al → 3Ba + Ba(AlO2)2
Качественные реакции
- Окрашивание пламени солями щелочных металлов
Цвет пламени:
- Ca — кирпично-красный
- Sr — карминово-красный (алый)
- Ba — яблочно-зеленый
- Взаимодействие с веществами:
- С кислородом
- С кислородом взаимодействуют при нагревании с образованием оксидов
- 2Сa + O2 → 2CaO
- Видео Горение кальция
- С галогенами
- (F, Cl, Br, I)
- Щелочноземельные металлы реагируют с галогенамипри нагревании с образованием галогенидов .
- Сa + Cl2→ 2СaCl2
- С водородом
- Щелочноземельные металлы реагируют с водородом при нагревании с образованием гидридов:
- Сa + H2 СaH2
- Бериллий с водородом не взаимодействует.
- Магний реагирует только при повышенном давлении:
- Mg + H2 → MgH2
- С серой
- Щелочноземельные металлы при нагревании взаимодействуют с серой с образованием сульфидов сульфидов:
- Сa + S СaS
- Ca + 2C → CaC2 (карбиды)
- С азотом
- При комнатной температуре с азотом взаимодействует только магний с образованием нитрида:
- 6Mg + 2N2 → 2Mg3N2
- Остальные щелочноземельные металлы реагируют с азотом при нагревании.
- С углеродом
- Щелочноземельные металлы реагируют с углеродом с образованием карбидов, преимущественно ацетиленидов:
- Ca + 2C → CaC2
- Бериллий при нагревании с углеродом с образует карбид — метанид:
- 2Be + C → Be2C
- С фосфором
- Щелочноземельные металлы при нагревании взаимодействуют с фосфором с образованием фосфидов:
- 3Сa + 2P Сa3 P2
Взаимодействие со сложными веществами
- С водой
- Кальций, стронций и барий взаимодействуют с водой при комнатной температуре с образованием щелочи и водорода:
- Sr + 2H2O → Sr(OH)2 + H2↑,
- Магний реагирует с водой при кипячении, а бериллий с водой не реагирует.
- С кислотами
- С растворами HCl, H2SO4, H3PO4 щелочноземельные металлы взаимодействуют с образованием соли и выделением водорода:Са + H2SO4(разб)= СаSO4 + H2
- С кислотами-окислителями (HNO3 и конц. H2SO4):
- с концентрированной серной:
- 4Ca + 10H2SO4(конц) → 4CaSO4 + H2S↑ + 5H2O;
- с разбавленной и концентрированной азотной:
- 4Sr + 10HNO3(конц) → 4Sr(NO3)2 + N2O +5H2O
- С водными растворами щелочей
- В водных растворах щелочей растворяется только бериллий:
- Be + 2NaOH + 2H2O → Na2[Be(OH)4] + H2
- С солями
- В расплаве щелочноземельные металлы могут взаимодействовать с некоторыми солями:
- Ca + CuCl2 → CaCl2 + Cu
Запомните! В растворе щелочноземельные металлы взаимодействуют с водой, а не с солями других металлов.
- С оксидами
- Щелочноземельные металлы могут восстанавливать из оксидов такие неметаллы как кремний, бор, углерод:
- 2Ca + SiO2 → 2CaO + Si
- Магний сгорает в атмосфере углекислого газа с образованием оксида магния и сажи (С):
- 2Mg + CO2 → 2MgO + C






