- Оксиды
- Основания
- Кислоты
- Соли
- Оксиды металлов: свойства, номенклатура, использование и примеры
- Видео: Оксиды металлов: свойства, номенклатура, использование и примеры
- Содержание:
- Свойства неметаллических оксидов
- Амфотеризм
- Номенклатура
- Традиционная номенклатура
- Систематическая номенклатура
- Номенклатура акций
- Расчет числа валентности
- Как они сформированы?
- Прямая реакция металла с кислородом
- Реакция солей металлов с кислородом
- Приложения
- Примеры
- Оксиды железа
- Оксиды щелочных и щелочноземельных металлов
- Оксиды группы IIIA (13)
- Ссылки
- Таблица оксидов
- Таблица оксидов (1 часть):
- Таблица оксидов (2 часть):
- Таблица оксидов (3 часть):
Неорганическая химия — раздел химии, изучающий строение и химические свойства неорганических веществ.
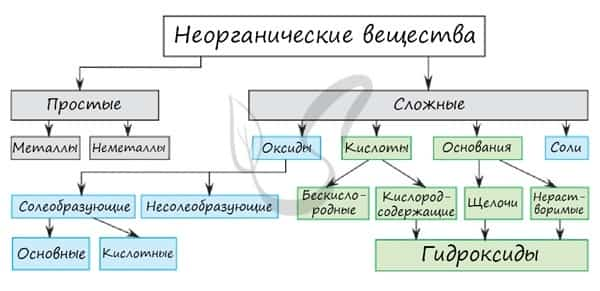
Среди простых веществ выделяют металлы и неметаллы. Среди сложных: оксиды, основания, кислоты и соли. Классификация неорганических веществ построена следующим образом:
Большинство химических свойств мы изучим по мере продвижения по периодической таблице Д.И. Менделеева. В этой статье мне хотелось бы подчеркнуть ряд принципиальных деталей, которые помогут в дальнейшем при изучении химии.
Оксиды
Все оксиды подразделяются на солеобразующие и несолеобразующие. Солеобразующие имеют соответствующие им основания и кислоты (в той же степени окисления (СО)!) и охотно вступают в реакции солеобразования. К ним относятся, например:
- CuO — соответствует основанию Cu(OH)2
- Li2O — соответствует основанию LiOH
- FeO — соответствует основанию Fe(OH)2 (сохраняем ту же СО = +2)
- Fe2O3 — соответствует основанию Fe(OH)3 (сохраняем ту же СО = +3)
- P2O5 — соответствует кислоты H3PO4
Солеобразующие оксиды, в свою очередь, делятся на основные, амфотерные и кислотные.
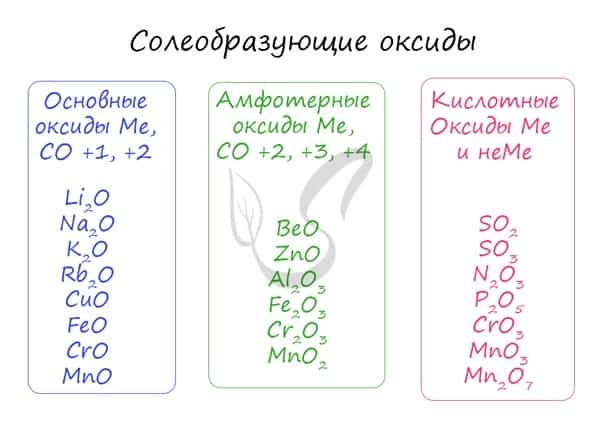
- Основные
- Амфотерные (греч. ἀμφότεροι — двойственный)
- Кислотные
- SO2 — H2SO3
- SO3 — H2SO4
- P2O5 — H3PO4
- N2O5 — HNO3
- NO2 — HNO2, HNO3
- Mn2O7 + H2O → HMnO4 (сохраняем СО марганца +7)
- SO3 + H2O → H2SO4 (сохраняем СО серы +6)
- SO2 + H2O → H2SO3 (сохраняем СО серы +4)
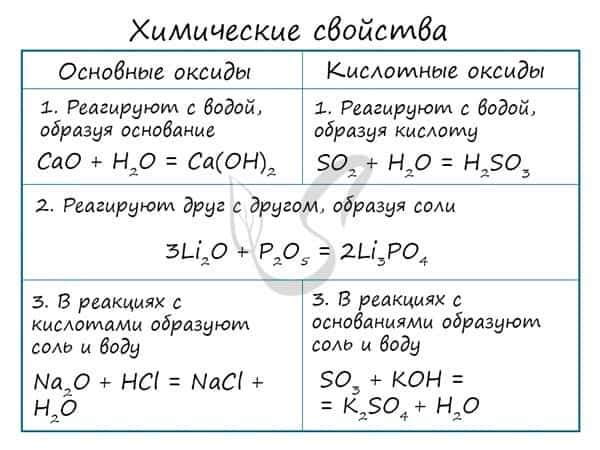
Основным оксидам соответствуют основания в той же СО. В химических реакциях основные оксиды проявляют основные свойства, образуются исключительно металлами. Примеры: Li2O, Na2O, K2O, Rb2O CaO, FeO, CrO, MnO. Основные оксиды взаимодействуют с водой с образованием соответствующего основания (реакцию идет, если основание растворимо) и с кислотными оксидами и кислотами с образованием солей. Между собой основные оксиды не взаимодействуют. Li2O + H2O → LiOH (основный оксид + вода → основание) Li2O + P2O5 → Li3PO4 (осн. оксид + кисл. оксид = соль) Li2O + H3PO4 → Li3PO4 + H2O (осн. оксид + кислота = соль + вода) Здесь не происходит окисления/восстановления, поэтому сохраняйте исходные степени окисления атомов.
Эти оксиды действительно имеют двойственный характер: они проявляют как кислотные, так и основные свойства. Примеры: BeO, ZnO, Al2O3, Fe2O3, Cr2O3, MnO2, PbO, PbO2, Ga2O3. С водой они не взаимодействуют, так как продукт реакции, основание, получается нерастворимым. Амфотерные оксиды реагируют как с кислотами и кислотными оксидами, так и с основаниями и основными оксидами. Fe2O3 + K2O → (t) KFeO2 (амф. оксид + осн. оксид = соль) ZnO + KOH + H2O → K2[Zn(OH)4] (амф. оксид + основание = комплексная соль) ZnO + N2O5 → Zn(NO3)2 (амф. оксид + кисл. оксид = соль; СО азота сохраняется в ходе реакции) Fe2O3 + HCl → FeCl3 + H2O (амф. оксид + кислота = соль + вода; обратите внимание на то, что СО Fe = +3 не меняется в ходе реакции) 
Проявляют в ходе химических реакций кислотные свойства. Образованы металлами и неметаллами, чаще всего в высокой СО. Примеры: SO2, SO3, P2O5, N2O3, NO2, N2O5, SiO2, MnO3, Mn2O7. Каждому кислотному оксиду соответствует своя кислота. Это особенно важно помнить при написании продуктов реакции: следует сохранять степени окисления. Некоторым кислотным оксидам соответствует сразу две кислоты.
Кислотные оксиды вступают в реакцию с основными и амфотерными, реагируют с основаниями. Реакции между кислотными оксидами не характерны.
SO2 + Na2O → Na2SO3 (кисл. оксид + осн. оксид = соль; сохраняем СО S = +4)
SO3 + Li2O → Li2SO4 (кисл. оксид + осн. оксид = соль; сохраняем СО S = +6)
P2O5 + NaOH → Na3PO4 + H2O (кисл. оксид + основание = соль + вода)
При реакции с водой кислотный оксид превращается в соответствующую ему кислоту. Исключение SiO2 — не реагирует с водой, так как продукт реакции — H2SiO3 является нерастворимой кислотой.
- Несолеобразующие оксиды — оксиды неметаллов, которые не имеют соответствующих им гидроксидов и не вступают в реакции солеобразования. К таким оксидам относят:
- Реакции несолеобразующих оксидов с основаниями, кислотами и солеобразующими оксидов редки и не приводят к образованию солей. Некоторые из несолеобразующих оксидов используют в качестве восстановителей:
- FeO + CO → Fe + CO2 (восстановление железа из его оксида)

Основания
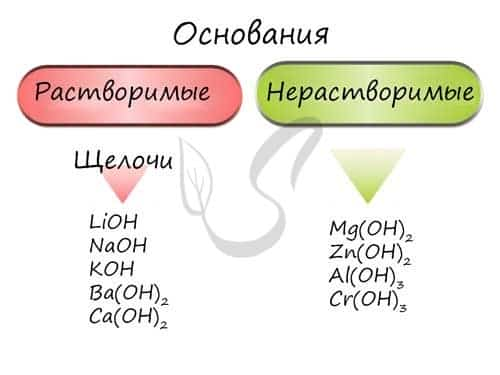
Основания — химические соединения, обычно характеризуются диссоциацией в водном растворе с образованием гидроксид-анионов. Растворимые основания называются щелочами: NaOH, LiOH, Ca(OH)2, Ba(OH)2.
Гидроксиды щелочных металлов (Ia группа) называются едкими: едкий натр — NaOH, едкое кали — KOH.
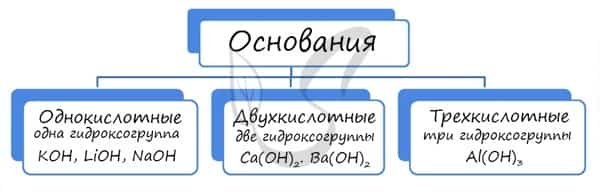
Основания классифицируются по количеству гидроксид-ионов в молекуле на одно-, двух- и трехкислотные.
Так же, как и оксиды, основания различаются по свойствам. Все основания хорошо реагируют с кислотами, даже нерастворимые основания способны растворяться в кислотах. Также нерастворимые основания при нагревании легко разлагаются на воду и соответствующий оксид.
NaOH + HCl → NaCl + H2O (основание + кислота = соль + вода — реакция нейтрализации)
Mg(OH)2 → (t) MgO + H2O (при нагревании нерастворимые основания легко разлагаются)
Если в ходе реакции основания с солью выделяется газ, выпадает осадок или образуется слабый электролит (вода), то такая реакция идет. Нерастворимые основания с солями почти не реагируют.
- Ba(OH)2 + NH4Cl → BaCl2 + NH3 + H2O (в ходе реакции образуется нестойкое основание NH4OH, которое распадается на NH3 и H2O)
- LiOH + MgCl2 → LiCl2 + Mg(OH)2↓
- KOH + BaCl2 ↛ реакция не идет, так как в продуктах нет газа/осадка/слабого электролита (воды)
- В растворах щелочей pH > 7, поэтому лакмус окрашивает их в синий цвет.

Амфотерные оксиды соответствуют амфотерным гидроксидам. Их свойства такие же двойственные: они реагирую как с кислотами — с образованием соли и воды, так и с основаниями — с образованием комплексных солей.
- Al(OH)3 + HCl → AlCl3 + H2O (амф. гидроксид + кислота = соль + вода)
- Al(OH)3 + KOH → K[Al(OH)4] (амф. гидроксид + основание = комплексная соль)
- При нагревании до высоких температур комплексные соли не образуются.
- Al(OH)3 + KOH → (t) KAlO2 + H2O (амф. гидроксид + основание = (прокаливание) соль + вода — при высоких температурах вода испаряется, и комплексная соль образоваться не может)

Кислоты
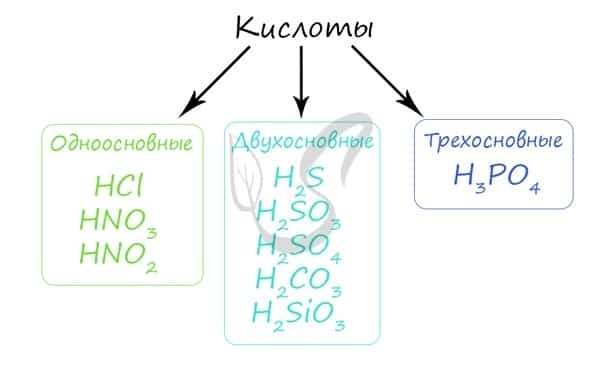
Кислота — химическое соединение обычно кислого вкуса, содержащее водород, способный замещаться металлом при образовании соли. По классификации кислоты подразделяются на одно-, двух- и трехосновные.
Основность кислоты определяется числом атомов водорода, которое способна отдать молекула кислоты, реагируя с основанием. Определять основность кислоты по числу атомов водорода в ней — часто верный способ, но не всегда: например, борная кислота H3BO3 является слабой одноосновной кислотой, фосфористая кислота H3PO3 — двухосновной кислотой.
Кислоты отлично реагируют с основными оксидами, основаниями, растворяя даже те, которые выпали в осадок (реакция нейтрализации). Также кислоты способны вступать в реакцию с теми металлами, которые стоят в ряду напряжений до водорода (то есть способны вытеснить его из кислоты).
- H3PO4 + LiOH → Li3PO4 + H2O (кислота + основание = соль + вода — реакция нейтрализации)
- Zn + HCl → ZnCl2 + H2↑ (реакция идет, так как цинк стоил в ряду активности левее водорода и способен вытеснить его из кислоты)
- Cu + HCl ↛ (реакция не идет, так как медь расположена в ряду активности правее водорода, менее активна и не способна вытеснить его из кислоты)
- Существуют нестойкие кислоты, которые в водном растворе разлагаются на кислотный оксид (газ) и воду — угольная и сернистая кислоты:
- H2CO3 → H2O + CO2↑
- H2SO3 → H2O + SO2↑
Записать эти кислоты в растворе в виде «H2CO3 или H2SO3» — будет считаться ошибкой. Пишите угольную и сернистую кислоты в разложившемся виде — виде газа и воды.
Все кислоты подразделяются на сильные и слабые. Напомню, что мы составили подробную таблицу сильных и слабых кислот (и оснований!) в теме гидролиз. В реакции из сильной кислоты (соляной) можно получить более слабую, например, сероводородную или угольную кислоту.
- Однако невозможно (и противоречит законам логики) получить из более слабой кислоты сильную, например из уксусной — серную кислоту. Природу не обманешь ?
- K2S + HCl → H2S + KCl (из сильной — соляной кислоты — получили более слабую — сероводородную)
- K2SO4 + CH3COOH ↛ (реакция не идет, так как из слабой кислоты нельзя получить сильную: из уксусной — серную)
Подчеркну важную деталь: гидроксиды это не только привычные нам NaOH, Ca(OH)2 и т.д., некоторые кислоты также считаются кислотными гидроксидами, например серная кислота — H2SO4. С полным правом ее можно записать как кислотный гидроксид: SO2(OH)2
В завершении подтемы кислот предлагаю вам вспомнить названия основных кислот и их кислотных остатков.
Соли
Соль — ионное соединение, образующееся вместе с водой при нейтрализации кислоты основанием (не единственный способ). Водород кислоты замещается металлом или ионом аммония (NH4). Наиболее известной солью является поваренная соль — NaCl.
По классификации соли бывают:
- Средние — продукт полного замещения атомов водорода в кислоте на металл: KNO3, NaCl, BaSO4, Li3PO4
- Кислые — продукт неполного замещения атомов водорода: LiHSO4, NaH2PO4 и Na2HPO4 (гидросульфат лития, дигидрофосфат и гидрофосфат натрия)
- Основные — продукт неполного замещения гидроксогрупп на кислотный остаток: CrOHCl (хлорид гидроксохрома II)
- Двойные — содержат два разных металла и один кислотный остаток (NaCr(SO4)2
- Смешанные — содержат один металл и два кислотных остатка MgClBr (хлорид-бромид магния
- Комплексные — содержат комплексный катион или анион — атом металла, связанный с несколькими лигандами: Na[Cr(OH)4] (тетрагидроксохромат натрия)
Растворы или расплавы солей могут вступать в реакцию с металлом, который расположен левее металла, входящего в состав соли. В этом случае более активный металл вытеснит менее активный из раствора соли. Например, железо способно вытеснить медь из ее солей:
Fe + CuSO4 → FeSO4 + Cu (железо стоит левее меди в ряду активности и способно вытеснить медь из ее солей)
Замечу важную деталь: исход реакции основание + кислота иногда определяет соотношение. Запомните, что если двух- или трехосновная кислота дана в избытке — получается кислая соль, если же в избытке дано основание — средняя соль.
NaOH + H2SO4 → NaHSO4 (кислота дана в избытке)
2NaOH + H2SO4 → Na2SO4 + H2O (основание дано в избытке)
Если в ходе реакции соли с кислотой, основанием или другой солью выпадает осадок, выделяется газ или образуется слабый электролит (вода), то такая реакция идет. Кислую соль также можно получить в реакции соли с соответствующей двух-, трехосновной кислотой.
- Na2CO3 + HCl → NaCl + H2O + CO2↑ (сильная кислота — соляная, вытесняет слабую — угольную)
- MgCl2 + LiOH → Mg(OH)2↓ + LiCl
- K2SO4 + H2SO4 → KHSO4 (средняя соль + кислота = кислая соль)
- Чтобы сделать из кислой соли — среднюю соль, нужно добавить соответствующее основание:
- KHSO4 + KOH → K2SO4 + H2O (кислая соль + основание = средняя соль)
Оксиды металлов: свойства, номенклатура, использование и примеры
Видео: Оксиды металлов: свойства, номенклатура, использование и примеры
Видео: Оксиды | Химия | TutorOnline
Содержание:
В оксиды металлов они представляют собой неорганические соединения, состоящие из катионов металлов и кислорода. Обычно они содержат огромное количество твердых ионных веществ, в которых оксид-анион (O2–) электростатически взаимодействует с частицами M+.
M+ Любой катион, происходящий из чистого металла, выглядит следующим образом: от щелочных и переходных металлов, за исключением некоторых благородных металлов (таких как золото, платина и палладий), до самых тяжелых элементов p-блока периодической таблицы ( вроде свинца и висмута).
На верхнем изображении показана поверхность железа, покрытая красноватыми корками. Эти «струпья» известны как ржавчина или ржавчина, которые, в свою очередь, представляют собой визуальное свидетельство окисления металла из-за условий окружающей среды. Химически ржавчина представляет собой гидратированную смесь оксидов железа (III).
Почему окисление металла приводит к деградации его поверхности? Это происходит из-за включения кислорода в кристаллическую структуру металла.
Когда это происходит, объем металла увеличивается, а исходные взаимодействия ослабевают, что приводит к разрыву твердого тела. Точно так же эти трещины позволяют большему количеству молекул кислорода проникать во внутренние металлические слои, полностью разъедая деталь изнутри.
Однако этот процесс происходит с разной скоростью и зависит от природы металла (его реакционной способности) и физических условий, которые его окружают. Следовательно, существуют факторы, ускоряющие или замедляющие окисление металла; два из них — наличие влажности и pH.
Зачем? Поскольку окисление металла с образованием оксида металла включает в себя перенос электронов. Они «перемещаются» от одного химического вещества к другому, если окружающая среда способствует этому, либо за счет присутствия ионов (H+, Na+, Mg2+, Cl–и т. д.), которые изменяют pH, или молекулами воды, которые обеспечивают транспортную среду.
Аналитически тенденция металла образовывать соответствующий оксид отражается в его потенциалах восстановления, которые показывают, какой металл реагирует быстрее по сравнению с другим.
Золото, например, имеет гораздо больший восстановительный потенциал, чем железо, поэтому оно сияет своим характерным золотым свечением без оксида, который его притупляет.
Свойства неметаллических оксидов
Свойства оксидов металлов различаются в зависимости от металла и того, как он взаимодействует с анионом O2–. Это означает, что некоторые оксиды имеют более высокую плотность или растворимость в воде, чем другие. Однако все они имеют общий металлический характер, что неизбежно отражается на их основности.
Другими словами: они также известны как основные ангидриды или основные оксиды.
Основность оксидов металлов можно проверить экспериментально с помощью кислотно-основного индикатора. Как? Добавление небольшого кусочка оксида в водный раствор с некоторым растворенным индикатором; Это может быть сжиженный сок пурпурной капусты.
Имея тогда диапазон цветов в зависимости от pH, оксид превратит сок в голубоватый цвет, соответствующий основному pH (со значениями от 8 до 10). Это связано с тем, что растворенная часть оксида высвобождает ионы ОН.– к среде, которые в указанном эксперименте ответственны за изменение pH.
- Таким образом, для оксида МО, который растворяется в воде, он превращается в гидроксид металла («гидратированный оксид») в соответствии со следующими химическими уравнениями:
- Пн + Ч2О => М (ОН)2
- М (ОН)2 M2+ + 2OH–
Второе уравнение — это равновесие растворимости гидроксида M (OH)2. Обратите внимание, что металл имеет заряд 2+, что также означает, что его валентность равна +2. Валентность металла напрямую связана с его склонностью приобретать электроны.
Таким образом, чем положительнее валентность, тем выше его кислотность. В случае, если M имеет валентность +7, то оксид M2ИЛИ7 он будет кислым, а не щелочным.
Амфотеризм
Оксиды металлов являются основными, однако не все они имеют одинаковый металлический характер. Откуда вы знаете? Найдите металл M на периодической таблице. Чем дальше вы находитесь от него и в периоды низкой активности, тем более металлическим он будет и, следовательно, тем более основным будет ваш оксид.
На границе между основными и кислыми оксидами (неметаллическими оксидами) находятся амфотерные оксиды. Здесь слово «амфотерный» означает, что оксид действует и как основание, и как кислота, что аналогично тому, как в водном растворе он может образовывать гидроксид или водный комплекс M (OH2)62+.
Водный комплекс — это не что иное, как координация п молекулы воды с металлическим центром M. Для комплекса M (OH2)62+, металл М2+ он окружен шестью молекулами воды и может рассматриваться как гидратированный катион. Многие из этих комплексов имеют интенсивную окраску, например, наблюдаемую для меди и кобальта.
Номенклатура
Как называются оксиды металлов? Это можно сделать тремя способами: традиционным, систематическим и стандартным.
Традиционная номенклатура
Чтобы правильно назвать оксид металла в соответствии с правилами, установленными IUPAC, необходимо знать возможные валентности металла M. Самому большому (наиболее положительному) присваивается суффикс -ico к названию металла, в то время как минор, приставка –oso.
Пример: учитывая валентность металла M +2 и +4, его соответствующие оксиды являются MO и MO.2. Если бы M был свинцом, Pb, то PbO был бы оксидом свинца.медведь, и PbO2 оксид свинцаico. Если металл имеет только одну валентность, его оксид обозначается суффиксом –ico. Итак, Na2Или это оксид натрия.
С другой стороны, префиксы гипо- и пер- добавляются, когда для металла доступны три или четыре валентности. Таким образом, Mn2ИЛИ7 это ржавчина наманганico, потому что у Mn валентность +7, самая высокая из всех.
Однако этот тип номенклатуры представляет определенные трудности и обычно используется меньше всего.
Систематическая номенклатура
Он учитывает количество атомов M и кислорода, которые составляют химическую формулу оксида. От них присваиваются соответствующие префиксы моно-, ди-, три-, тетра- и т.д.
Если взять в качестве примера три недавних оксида металлов, PbO представляет собой монооксид свинца; PbO2 диоксид свинца; и Na2Или оксид динатрия. В случае ржавчины Fe2ИЛИ3, его соответствующее название — триоксид дихирона.
Номенклатура акций
В отличие от двух других номенклатур, в этой более важна валентность металла. Валентность обозначается римскими цифрами в скобках: (I), (II), (III), (IV) и т. Д. Оксид металла тогда называют оксидом металла (n).
- Применяя номенклатуру акций для предыдущих примеров, мы имеем:
- -PbO: оксид свинца (II).
- -PbO2: оксид свинца (IV).
-На2О: оксид натрия. Поскольку он имеет уникальную валентность +1, он не указывается.
-Вера2ИЛИ3: оксид железа (III).
-Mn2ИЛИ7: оксид марганца (VII).
Расчет числа валентности
Но если у вас нет периодической таблицы с валентностями, как вы можете их определить? Для этого необходимо помнить, что анион O2– вносит два отрицательных заряда в оксид металла. Следуя принципу нейтральности, эти отрицательные заряды должны нейтрализоваться положительными зарядами металла.
Следовательно, если количество атомов кислорода известно из химической формулы, валентность металла может быть определена алгебраически, так что сумма зарядов равна нулю.
Mn2ИЛИ7 у него семь атомов кислорода, поэтому его отрицательные заряды равны 7x (-2) = -14. Чтобы нейтрализовать отрицательный заряд -14, марганец должен давать +14 (14-14 = 0). Поднимая математическое уравнение, мы получаем:
- 2X — 14 = 0
- Число 2 связано с наличием двух атомов марганца. Решение и решение для X, валентности металла:
- Х = 14/2 = 7
- Другими словами, каждый Mn имеет валентность +7.
Как они сформированы?
Влага и pH напрямую влияют на окисление металлов до соответствующих им оксидов. Наличие CO2Кислый оксид, он может быть растворен в воде, покрывающей металлическую часть, в достаточной степени, чтобы ускорить включение кислорода в анионной форме в кристаллическую структуру металла.
Эту реакцию также можно ускорить с повышением температуры, особенно когда желательно получить оксид за короткое время.
Прямая реакция металла с кислородом
- Оксиды металлов образуются в результате реакции между металлом и окружающим кислородом.
Это может быть представлено химическим уравнением ниже:
- 2M (s) + O2(г) => 2МО (т)
- Эта реакция протекает медленно, так как кислород имеет прочную двойную связь O = O и электронный перенос между ним и металлом неэффективен.
Однако он значительно ускоряется с увеличением температуры и площади поверхности. Это связано с тем, что необходимая энергия обеспечивается для разрыва двойной связи O = O, и, поскольку имеется большая площадь, кислород равномерно перемещается по металлу, одновременно сталкиваясь с атомами металла.
Чем больше количество реагирующего кислорода, тем выше валентность или степень окисления металла. Зачем? Потому что кислород забирает у металла все больше и больше электронов, пока не достигнет максимальной степени окисления.
Это можно увидеть, например, для меди. Когда кусок металлической меди реагирует с ограниченным количеством кислорода, образуется Cu.2O (оксид меди (I), оксид меди или оксид дикобра):
- 4Cu (ов) + O2(г) + Q (тепло) => 2Cu2O (s) (красный сплошной)
- Но когда он вступает в реакцию в эквивалентных количествах, получается CuO (оксид меди (II), оксид меди или монооксид меди):
- 2Cu (т) + O2(г) + Q (тепло) => 2CuO (s) (черное твердое вещество)
Реакция солей металлов с кислородом
- Оксиды металлов могут образовываться в результате термического разложения. Чтобы это стало возможным, из исходного соединения (соли или гидроксида) должны высвободиться одна или две небольшие молекулы:
- М (ОН)2 + Q => MO + H2ИЛИ
- MCO3 + Q => МО + СО2
- 2M (НЕТ3)2 + Q => МО + 4НО2 + O2
- Отметим, что H2O, CO2, НЕТ2 я2 высвобождающиеся молекулы.
Приложения
Из-за богатого состава металлов в земной коре и кислорода в атмосфере оксиды металлов обнаруживаются во многих минералогических источниках, из которых можно получить прочную основу для производства новых материалов.
Каждый оксид металла находит очень специфическое применение, от питательного (ZnO и MgO) до цементных добавок (CaO) или просто в качестве неорганических пигментов (Cr2ИЛИ3).
Некоторые оксиды настолько плотны, что контролируемый рост их слоев может защитить сплав или металл от дальнейшего окисления. Исследования даже показали, что окисление защитного слоя продолжается, как если бы это была жидкость, покрывающая все трещины или поверхностные дефекты металла.
- Оксиды металлов могут принимать удивительные структуры в виде наночастиц или крупных полимерных агрегатов.
- Этот факт делает их объектом исследований для синтеза интеллектуальных материалов из-за их большой площади поверхности, которая используется для разработки устройств, реагирующих на наименьшие физические воздействия.
- Точно так же оксиды металлов являются сырьем для многих технологических применений, от зеркал и керамики с уникальными свойствами для электронного оборудования до солнечных батарей.
Примеры
Оксиды железа
2Fe (ы) + O2(g) => 2FeO (s) оксид железа (II).
6FeO (ов) + O2(г) => 2Fe3ИЛИ4магнитный оксид (ы) железа.
Вера3ИЛИ4, также известный как магнетит, представляет собой смешанный оксид; Это означает, что он состоит из твердой смеси FeO и Fe.2ИЛИ3.
4Fe3ИЛИ4(s) + O2(г) => 6Fe2ИЛИ3оксид (ы) железа (III).
Оксиды щелочных и щелочноземельных металлов
- И щелочные, и щелочноземельные металлы имеют только одну степень окисления, поэтому их оксиды более «просты»:
- -На2О: оксид натрия.
- -Li2О: оксид лития.
- -K2O: оксид калия.
- -CaO: оксид кальция.
- -MgO: оксид магния.
- -BeO: оксид бериллия (амфотерный оксид)
Оксиды группы IIIA (13)
- Элементы IIIA группы (13) могут образовывать оксиды только со степенью окисления +3. Таким образом, они имеют химическую формулу M2ИЛИ3 и его оксиды следующие:
- -Для2ИЛИ3: оксид алюминия.
- -Ga2ИЛИ3: оксид галлия.
- -В2ИЛИ3: оксид индия.
- И наконец
- -Tl2ИЛИ3: оксид таллия.
Ссылки
- Уиттен, Дэвис, Пек и Стэнли. Химия. (8-е изд.). CENGAGE Learning, стр. 237.
- АлонсоФормула. Оксиды металлов. Взято с: alonsoformula.com
- Регенты Миннесотского университета (2018). Кислотно-основные характеристики оксидов металлов и неметаллов. Взято с: chem.umn.edu
- Дэвид Л. Чендлер. (3 апреля 2018 г.). Самовосстанавливающиеся оксиды металлов могут защитить от коррозии. Взято с: news.mit.edu
- Физические состояния и структура оксидов. Взято с: wou.edu
- Quimitube. (2012). Окисление железа. Взято с: quimitube.com
- Химия LibreTexts. Оксиды. Взято с сайта chem.libretexts.org
- Кумар М. (2016) Металлооксидные наноструктуры: рост и приложения. В: Хусейн М., Хан З. (ред.) Достижения в области наноматериалов. Расширенные структурированные материалы, том 79, Спрингер, Нью-Дели
Таблица оксидов
Оксиды: основные оксиды, кислотные оксиды, амфотерные оксиды:
Оксид (именуемые также окисел, окись) – это бинарное соединение химического элемента с кислородом в степени окисления −2, в котором сам кислород связан только с менее электроотрицательным элементом.
Химический элемент кислород по электроотрицательности находится на втором месте после фтора, поэтому к оксидам относятся почти все соединения химических элементов с кислородом. Исключение составляет, например, дифторид кислорода OF2.
В зависимости от химических свойств различают:
— солеобразующие оксиды:
- основные оксиды. К ним относятся оксиды металлов, степень окисления которых +1, + 2;
- кислотные оксиды. К ним относятся оксиды металлов со степенью окисления +5, + 6, + 7, и оксиды неметаллов;
- амфотерные оксиды. К ним относятся оксиды металлов со степенью окисления +3, +4, и оксиды-исключения: ZnO, BeO, SnO, PbO;
— несолеобразующие оксиды: оксид углерода (II) СО, оксид азота (I) N2O, оксид азота (II) NO, оксид кремния (II) SiO и оксид серы (II) SO.
В зависимости от количества атомов элементов в оксиде, кроме кислорода различают:
— простые, включающие в молекулу атомы одного элемента, кроме кислорода, и находящихся в в одной степени окисления. Например, оксид лития Li2O.
— сложные оксиды, включающие в молекулу атомы двух и более элементов, кроме кислорода. Например, оксид лития-кобальта (III) Li2O·Co2O3;
— двойные оксиды, в которые атомы одного и того же элемента входят в двух или более степенях окисления. Например, оксид марганца (II, IV) Mn5O8. Во многих случаях такие оксиды могут рассматриваться как соли кислородсодержащих кислот.
Таблица оксидов (1 часть):
| Атомный номер | Химический элемент | Символ | Оксиды |
| 1 | Водород | H | H2O (вода) |
| 2 | Гелий | He | нет |
| 3 | Литий | Li | Li2O (оксид лития) |
| 4 | Бериллий | Be | BeO (оксид бериллия) |
| 5 | Бор | B | B2O3 (оксид бора (III)) |
| 6 | Углерод | C | CO (оксид углерода (II), монооксид углерода, угарный газ),
|
| 7 | Азот | N | N2O (оксид азота (I), закись азота, оксонитрид азота, веселящий газ),
|
| 8 | Кислород | O | — |
| 9 | Фтор | F | нет |
| 10 | Неон | Ne | нет |
| 11 | Натрий | Na | Na2O (оксид натрия) |
| 12 | Магний | Mg | MgO (оксид магния) |
| 13 | Алюминий | Al | Al2O3 (оксид алюминия) |
| 14 | Кремний | Si | SiO (оксид кремния (II), монооксид кремния), SiO2 (оксид кремния (IV), диоксид кремния, кремнезём) |
| 15 | Фосфор | P | P4O (монооксид тетрафосфора),
|
| 16 | Сера | S | SO (оксид серы (II), монооксид серы, моноокись серы), SO2 (оксид серы (IV), диоксид серы, двуокись серы, сернистый газ, сернистый ангидрид), SO3 (оксид серы (VI), трёхокись серы, серный газ, ангидрид серной кислоты) |
| 17 | Хлор | Cl | Cl2O (оксид хлора (I), гемиоксид хлора, ангидрид хлорноватистой кислоты),
|
| 18 | Аргон | Ar | нет |
| 19 | Калий | K | K2O (оксид калия) |
| 20 | Кальций | Ca | CaO (оксид кальция, окись кальция, негашёная известь, в просторечии — кирабит, кипелка) |
| 21 | Скандий | Sc | Sc2O3 (оксид скандия, сесквиоксид скандия) |
| 22 | Титан | Ti | TiO (оксид титана (II)), Ti2O3 (оксид титана(III), трёхокись титана), TiO2 (оксид титана (IV), диоксид титана, двуокись титана, титановые белила) |
| 23 | Ванадий | V | VO (оксид ванадия (II), окись ванадия),
|
| 24 | Хром | Cr | CrO (оксид хрома (II), закись хрома),
|
| 25 | Марганец | Mn | MnO (оксид марганца (II), окись марганца, монооксид марганца),
|
| 26 | Железо | Fe | FeO (оксид железа (II), закись железа),
|
| 27 | Кобальт | Co | CoO (оксид кобальта (II), окись кобальта),
|
| 28 | Никель | Ni | NiO (оксид никеля (II), окись никеля, бунзенит), Ni2O3 (оксид никеля (III), окисел никеля; сесквиоксид никеля) |
| 29 | Медь | Cu | Cu2O (оксид меди (I), гемиоксид меди, оксид димеди, закись меди, куприт), CuO (оксид меди (II), окись меди), Cu2O3 (оксид меди (III), триоксид димеди) |
| 30 | Цинк | Zn | ZnO (оксид цинка, окись цинка) |
| 31 | Галлий | Ga | Ga2O (оксид галлия (I), закись галлия, гемиоксид галлия), Ga2O3 (оксид галлия (III)) |
| 32 | Германий | Ge | GeO (оксид германия (II), окись германия), GeO2 (оксид германия (IV), диоксид германия, двуокись германия) |
| 33 | Мышьяк | As | As2O3 (оксид мышьяка (III), триоксид мышьяка), As2O5 (оксид мышьяка (V), пентоксид мышьяка) |
| 34 | Селен | Se | SeO2 (оксид селена (IV), диоксид селена, двуокись селена, доунеит, селенолит), SeO3 (оксид селена (VI), триоксид селена, селеновый ангидрид) |
| 35 | Бром | Br | Br2O (оксид брома, оксид брома (I), окись брома, ангидрид бромноватистой кислоты) |
Таблица оксидов (2 часть):
| 36 | Криптон | Kr | нет |
| 37 | Рубидий | Rb | Rb2O (оксид рубидия, окись рубидия) |
| 38 | Стронций | Sr | SrO (оксид стронция, окись стронция) |
| 39 | Иттрий | Y | Y2O3 (оксид иттрия, сесквиоксид иттрия) |
| 40 | Цирконий | Zr | ZrO2 (оксид циркония (IV), оксид циркония, диоксид циркония) |
| 41 | Ниобий | Nb | NbO (оксид ниобия (II), окись ниобия),
|
| 42 | Молибден | Mo | Mo2O3 (оксид молибдена (III), окись молибдена),
|
| 43 | Технеций | Tc | TcO2 (оксид технеция (IV), окись технеция (IV)), Tc2O7 (оксид технеция (VII), окись технеция (VII)) |
| 44 | Рутений | Ru | Ru2O3 (оксид рутения (III), окись рутения (III), сесквиоксид рутения), RuO2 (оксид рутения(IV), окись рутения (IV)), RuO4 (оксид рутения(VIII), тетраоксид рутения) |
| 45 | Родий | Rh | RhO (оксид родия (II), окисел родия), Rh2O3 (оксид родия (III), сесквиоксид родия), RhO2 (оксид родия (IV), окисел родия) |
| 46 | Палладий | Pd | PdO (оксид палладия (II), окись палладия), Pd2O3•n H2O (оксид палладия (III), окисел палладия), PdO2 (оксид палладия (IV), окисел палладия) |
| 47 | Серебро | Ag | Ag2O (оксид серебра (I)), Ag+1Ag+3O2 или Ag2O2 (оксид серебра (I,III), оксид серебра (III)-серебра (I), монооксид серебра, диоксид дисеребра) |
| 48 | Кадмий | Cd | Cd2O (оксид кадмия (I)), CdO (оксид кадмия (II)) |
| 49 | Индий | In | In2O (оксид индия (I), окись индия (I), гемиоксид индия, закись индия), InO (оксид индия (II), окись индия (II)), In2O3 (оксид индия (III)) |
| 50 | Олово | Sn | SnO (оксид олова (I), монооксид олова, олово окись (II), олово закись, олово одноокись), SnO2 (оксид олова (IV), окись олова, двуокись олова, диоксид олова, касситерит), Sn3O4 |
| 51 | Сурьма | Sb | Sb2O3 (оксид сурьмы (III), сесквиоксид сурьмы, сурьмянистый ангидрид), Sb2O5 (оксид сурьмы (V), пятиокись сурьмы, сурмяный ангидрид), Sb2O4 или SbIIISbVO4 (тетраоксид сурьмы, диоксид сурьмы) |
| 52 | Теллур | Te | TeO2 (оксид теллура (IV), диоксид теллура, теллурит, двуокись теллура, ангидрид теллуристой кислоты),
|
| 53 | Йод | I | I+12O (монооксид дийода),
|
| 54 | Ксенон | Xe | |
| 55 | Цезий | Cs | |
| 56 | Барий | Ba | |
| 57 | Лантан | La | |
| 58 | Церий | Ce | |
| 59 | Празеодим | Pr | |
| 60 | Неодим | Nd | |
| 61 | Прометий | Pm | |
| 62 | Самарий | Sm | |
| 63 | Европий | Eu | |
| 64 | Гадолиний | Gd | |
| 65 | Тербий | Tb | |
| 66 | Диспрозий | Dy | |
| 67 | Гольмий | Ho | |
| 68 | Эрбий | Er | |
| 69 | Тулий | Tm | |
| 70 | Иттербий | Yb |