- Общие свойства металлов УМК ХИМИЯ Тема лекции
- Общие химические свойства металлов
- Конспект урока — исследования по химии в 11 классе «Химические свойства металлов и их соединений»
- Химические свойства металлов Урок химии в 11 классе Учитель химии: Киреева Марина Николаевна МКОУ «Тормосиновская СОШ» Чернышковского района Волгоградской. — презентация
Металлы Тренажёр
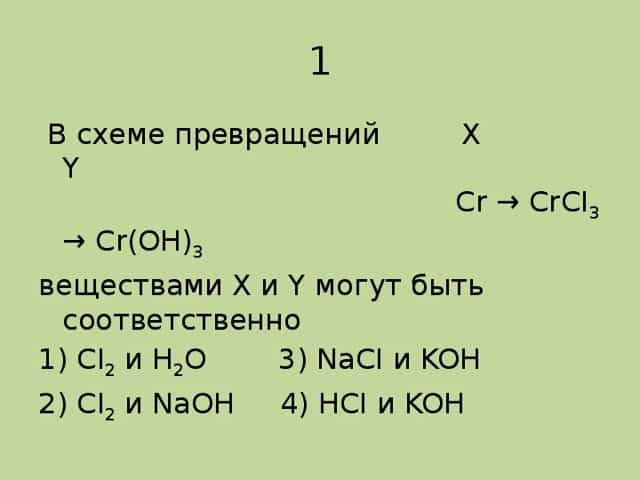
1 В схеме превращений X Y Cr → CrCI3 → Cr(OH)3
веществами X и Y могут быть соответственно
1) CI2 и H2O 3) NaCI и KOH
2) CI2 и NaOH 4) HCI и KOH

2
Распределение электронов по электронным слоям 2, 8, 8, 2 соответствует строению атома
1) хрома 2) кальция 3) алюминия 4) калия

3
Только восстановительные свойства 1) фосфор 2) бром 3) цинк проявляет
4) сера

4
Какую электронную конфигурацию имеет атом наименее активного металла? 1) 1s2 2s1 2) 1s2 2s22p6 3s1 3) 1s1 4) 1s2 2s22p6 3s23p6 4s1

5
С водой без нагревания реагирует
1) цинк 2) медь 3) железо 4) калий
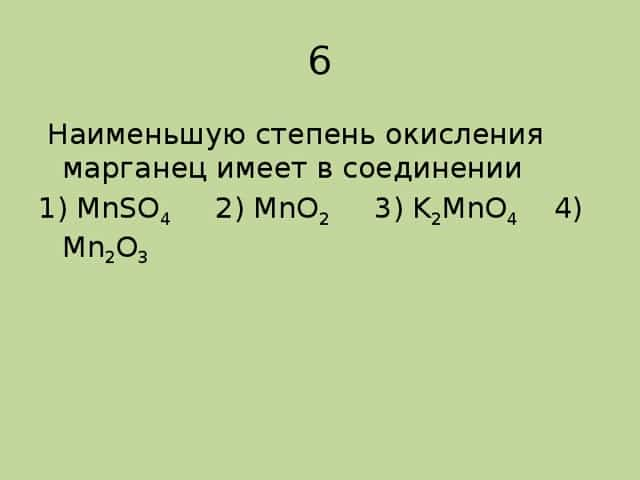
6 Наименьшую степень окисления марганец имеет в соединении
1) MnSO4 2) MnO2 3) K2MnO4 4) Mn2O3
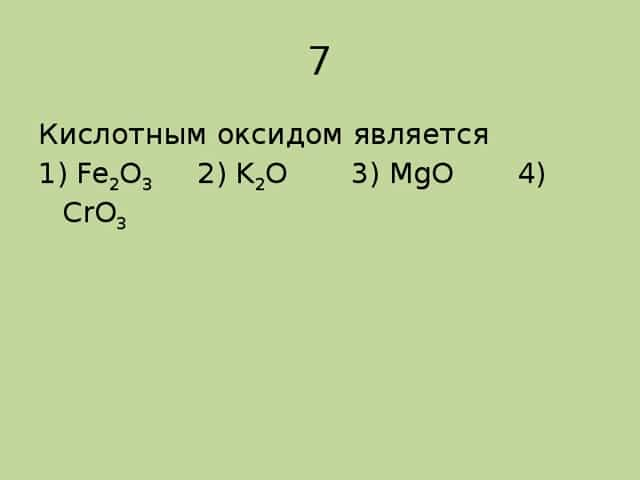
7
Кислотным оксидом является
1) Fe2O3 2) K2O 3) MgO 4) CrO3

8
В каком ряду простые вещества расположены в порядке уменьшения металлических свойств?
1) Ba, Sr, Ca 2) Li, Na, K 3) Be, Mg, Ca 4) AI, Mg, Na
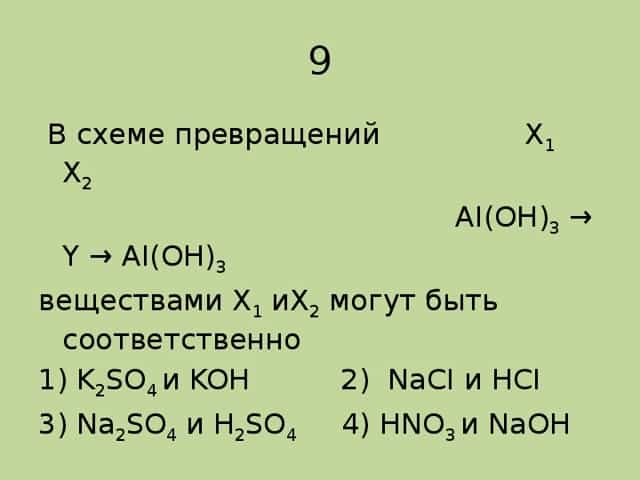
9 В схеме превращений X1 X2 AI(OH)3 → Y → AI(OH)3
веществами Х1 иХ2 могут быть соответственно 1) K2SO4 и KOH 2) NaCI и HCI 3) Na2SO4 и H2SO4 4) HNO3 и NaOH
Химический элемент, у которого распределение электронов в атоме по электронным слоям 2, 8, 8, 1 в периодической системе Д.И. Менделеева расположен 10
1) в 4 периоде, I группе 2) в 4 периоде, II группе 3) в 3 периоде, I группе 4) в 3 периоде, II группе
11
Восстановительные свойства железо проявляет в реакции:
1) Fe2O3 + 3H2SO4 = Fe2(SO4)3 + 3H2O
2) 2FeCI2 + CI2 = 2FeCI3
3) 2Fe(OH)3 = Fe2O3 + 3H2O
4) FeCI2 + 2KOH = Fe(OH)2 + 2KCI
12
Какую электронную конфигурацию имеет атом наиболее активного металла?
1) 1s2 2s22p1 2) 1s 22 s22 p6 3 s1 3) 1s2 2 s2 4) 1 s2 2 s22 p6 3 s23 p1
13
Какой из металлов не вытесняет водород из разбавленной серной кислоты? 1) железо 2) хром 3) медь 4) цинк
14
Степень окисления, равную +3, атом хрома имеет в соединении
1) CrCI2 2)K2Cr2O7 3)CrS 4) KCrO2
15
Амфотерным оксидом является
1) MgO 2) P2O5 3) Cr2O3 4) СO2
16
Верны ли следующие суждения о щелочных металлах:
А. Во всех соединениях они имеют степень окисления +3;
Б. С неметаллами они образуют соединения с ковалентной связью?
1) верно только А 2) верно только Б
3) верны оба суждения 4) оба суждения неверны
17
Установите соответствие между формулой вещества и продуктами электролиза его водного раствора на инертных электродах.
Формула вещества Продукты А) AI2(SO4)3 1) гидроксид металла, электролиза
кислота
Б) CsOH 2) металл, галоген
В) Hg(NO3)2 3) металл, кислород
Г)AuBr3 4) водород, галоген
5) водород, кислород
6) металл, кислота, кислород
18
Установите соответствие между формулой вещества и продуктом, который образуется на инертном аноде в результате электролиза его водного раствора
Формула вещества Продукт электролиза на аноде
А) NiSO4 1) CI2
Б) NiCI2 2) O2
В) NiF2 3) H2
Г) K2S 4) S
5) SO2
6) HF
Подумай ещё!!!
Подумай ещё!!!
Подумай ещё!!!
Подумай ещё!!!
Подумай ещё!!!
Подумай ещё!!!
Подумай ещё!!!
Подумай ещё!!!
Подумай ещё!!!
Подумай ещё!!!
Подумай ещё!!!
Подумай ещё!!!
Подумай ещё!!!
Подумай ещё!!!
Подумай ещё!!!
Подумай ещё!!!
Общие свойства металлов УМК ХИМИЯ Тема лекции







Химические свойства металлов содержание По своим химическим свойствам все металлы являются восстановителями Взаимодействие с простыми веществами с кислородом 4 Li + O 2 = 2 Li 2 O 4 Al + 3 O 2 = 2 Al 2 O 3 с серой Zn + S = Zn. S Hg + S = Hg. S с галогенами Cu + Cl 2 = Cu. Cl 2 Ni + Cl 2 = Ni. Cl 2 с водородом 2 Na + H 2 = 2 Na. H 2 Li + H 2 = 2 Li. H с азотом 3 Mg + N 2 = Mg 3 N 2 3 Ca + N 2 = Ca 3 N 2 с углеродом 4 Al + 3 C = Al 3 C 4 с фосфором 3 Ca + 2 P = Ca 3 P 2 интерметаллические соединения 3 Cu + Au = Cu 3 Au
Электрохимический ряд напряжений металлов содержание Электрохимический ряд напряжений металлов Li, K, Ca, Na, Mg, Al, Zn, Cr, Fe, Pb, H 2, Cu, Ag, Hg, Au Gо = — ∆Еоn. F где F — число Фарадея (96485 Кл); n — число электронов на один перенесенный ион. ∆Ео — разность стандартных потенциалов системы, В
Взаимодействие с кислотами содержание Н+ Окислитель Анион кислоты Взаимодействие металлов с кислотами зависит от 1. Величины стандартного электродного потенциала М; 2. Окислительной способности кислотного остатка; 3. Концентрации кислоты
содержание С концентрированной серной кислотой М активные М + H 2 SO 4 конц. Мn(SO 4)M + H 2 O + М ср. активн. H 2 S S М малоактивн. SO 2
С концентрированной азотной кислотой М + HNO 3 конц. М(NO 3)M + H 2 O + NO 2 3 Re + 7 HNO 3 = 3 HRe. O 4 + 7 NO + 2 H 2 O Au + HNO 3 + 4 HCl = H[Au. Cl 4 ] + NO + 2 H 2 O «царская водка» содержание
С разбавленной азотной кислотой содержание NO М малоактивн. М + HNO 3 разб. М(NO 3)M + H 2 O + М ср. активн. N 2 O, N 2 М активные NH 4 NO 3
Взаимодействие с водой при p. H = 7 M + H 2 O M(OH)n + H 2 окислитель Явление глубокого торможения окисления металла, обусловленное наличием на его поверхности защитных оксидных пленок, называется пассивацией. содержание
Взаимодействие с водными растворами щелочей при p. H = 14 окислитель в растворах щелочей растворяются металлы, потенциалы которых меньше -0, 83 В, склонные к образованию гидроксокомплексов типа [Me(OH)4 ]n- то есть металлы, чьи гидроксиды являются амфотерными: Ве(OH)2, (Al(OH)3, Zn(OH)2, Sn(OH)2, Рb(OH)2, Cr(OH)3 и др. содержание
Выводы и заключения n n содержание Химия металлов является важнейшей является частью неорганической химии. Знание законов Фарадея, а также понятие электродного потенциала позволяет охарактеризовать электрохимические процессы, проходящие с участием свободных металлов.
Список литературы n n n содержание 1. Ахметов Н. С. Общая и неорганическая химия. М. : Высшая школа. 2002. 2. О. М. Полторак, Л. М. Ковба. «Физико-химические основы неорганической химии» . М. : МГУ, 1994. 3. В. И. Горшков, И. А. Кузнецов. «Физическая химия» . М. : МГУ, 1993. 4. А. Джонсон.
Термодинамические аспекты в курсе неорганической химии. М. : Мир. 1985. 5. Анорганикум. Под ред. Л. Кольдица. М. Мир. 1984. Т. 1. 6. Хьюи Дж. Неорганическая химия. Строение вещества и реакционная способность. М. , Химия, 1987. 7. Фичини Ж. , Ламброзо-Бадер Н. , Депезе Ж. -К. Основы физической химии. М. Мир.
1972. стр. 276 -283. 8. Дж. Кемпбел. Современная общая химия. М. : Мир. 1975 г. Т. 2. стр. 90. гл. 20. , Т 3. 9. Дикерсон Р. , Грей Г. , Хейт Дж. Основные законы химии. М. : Мир, 1982. Т. 2. 10. Б. Б. Дамаскин, О. А. Петрий. Электрохимия. М: Высшая школа, 1987. 11. CRC Hand book of Chemistry and Physics.
82 издание. 2001 -2002
Общие химические свойства металлов
Химические
свойства металлов во многом зависят от строения его внешнего или предвнешнего
электронного слоя. Для металлов, расположенных в одной группе периодической
системы и имеющих одинаковое строение внешней электронной оболочки, следует
ожидать определённые сходства в химических свойствах.
В атоме
металлов на внешнем энергетическом уровне небольшое количество электронов и
очень большой радиус атома, что способствует быстрой отдаче электронов атомами
металлов в результат их взаимодействия с другими соединениями.
Металлы
окисляются, сами при этом выступают в роли восстановителя.
Кроме этого,
положение металла в ряду активности характеризует свойства металла и его
катионов в водных растворах и связано с его химической активностью.
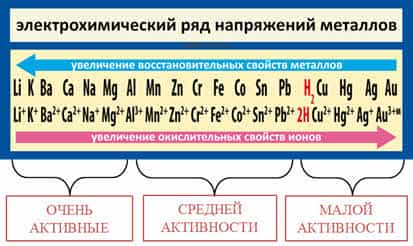
Как известно, самые
активные металлы расположены в начале ряда (слева), а самые
малоактивные – в конце (справа).
На основании
восстановительной способности металлов в ряду напряжений металлы условно можно
разделить на три группы: от лития до алюминия – очень активные
металлы, от алюминия до водорода – металлы средней
активности, от водорода до золота – малоактивные металлы.
Следует отметить,
что высокая электрохимическая активность металла не всегда означает его
химическую активность и наоборот. Обратите внимание на расположение лития и
натрия в ПС и в ряду активности металлов.
На основании положения в ПС натрий
активнее лития, так как радиус у натрия больше, на основании положения их в
ряду активности видно, что литий стоит левее натрия, то есть его восстановительная
способность выше, так как здесь учитывается не только радиус атома, но и
энергия отрыва электрона, энергия разрушения кристалла и энергия гидратации
ионов металла.
Например, с
кислородом активно при комнатной температуре реагируют только щелочные металлы,
при этом образуются оксиды или пероксиды. Так, в реакции лития с кислородом
образуется оксид лития, а в реакции натрия с кислородом – пероксид натрия.
4Li + O2 = 2Li2O
2Na + O2 = Na2O2
Металлы средней
активности реагируют с кислородом при нагревании. Например, проведём
эксперимент горения магния в кислороде. В результате данной реакции образуется
оксид магния, магний горит яркой вспышкой. Эта реакция сопровождается
выделением большого количества и света и ранее использовалась фотографами в
качестве вспышки при съёмке.
2Mg + O2 = 2MgO
Алюминий в
порошке также горит ослепительным пламенем с образованием оксида алюминия. Эта
способность используется в фейерверках, салютах, бенгальских огнях.

Такие металлы,
как Au, Pt не
реагируют с кислородом и поэтому на воздухе практически не изменяют своего
блеска.
Большинство
металлов, кроме Au, Pt реагируют при нагревании с серой, при этом образуются
соответствующие сульфиды.
Так, в реакции
цинка с серой образуется сульфид цинка, в реакции серебра с серой образуется
сульфид серебра (I).
Проведём
эксперимент, для этого на асбестовой сетке поместим цинк с серой, подожжём эту
смесь горящим магнием, в результате у нас образуется сульфид цинка.
Практически все
металлы реагируют с галогенами. Условия протекания этих реакций зависит от
активности металла и галогена.
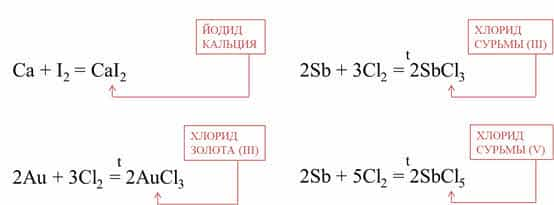
Например, кальций реагирует с йодом при
комнатной температуре, при этом образуется йодид кальция, а золото реагирует с
хлором при сильном нагревании, при это образуется хлорид золота (III).
Очень красиво горит сурьма в хлоре, при этом образуется
смесь хлоридов: хлорид сурьмы (III) и хлорид сурьмы (V).
С металлами
реагируют соединения всех классов – оксиды (в том числе вода), кислоты,
основания и соли.
При нагревании
металлы реагируют и с другими неметаллами. Так, в реакции алюминия с
азотом, образуется нитрид алюминия, в реакции кальция с форфором, образуется
фосфид кальция, в реакции алюминия с углеродом – карбид алюминия, в реакции
магния с кремнием – силицид магния.

С водородом
реагируют только активные металлы. Например, в реакции натрия с водородом
образуется гидрид натрия.
Так, активные
металлы бурно реагируют с водой при комнатной температуре. Например, в реакции
лития с водой образуется гидроксид лития и водород, в реакции бария с водой
образуется гидроксид бария и водород.
Проведём
эксперимент, для этого в воду добавим фенолфталеин и опустим туда кусочек
натрия. Натрий начинает бегать по поверхности из-за выделения водорода, раствор
приобретает малиновую окраску, вследствие образования щёлочи. Таким образом, в реакции
натрия с водой образуется щёлочь – гидроксид натрия и газ – водород.
Поверхность таких
металлов, как магний и алюминий, защищена плотной плёнкой соответствующего
оксида. Это препятствует протеканию реакции с водой.
Но если убрать
эту плёнку, то эти металлы активно будут вступать в реакцию. Например,
порошкообразный магний реагирует с горячей водой, при этом образуется гидроксид
магния и водород.
При повышенной
температуре с водой реагируют и менее активные металлы, но в данном случае
образуется окси д и водород. Например, в реакции цинка с водой образуется оксид
цинка и водород.
Металлы, стоящие
в ряду активности до водорода, реагируют с кислотами (кроме HNO3
любой концентрации и H2SO4
концентрированной) с образованием солей и водорода.
Активные металлы реагируют
с растворами кислот очень быстро.
Например, в реакции кальция с соляной
кислотой образуется соль – хлорид кальция и водород, в реакции алюминия с
разбавленной серной кислотой образуется соль – сульфат алюминия и водород.
Малоактивные
металлы часто практически не растворяются в кислотах. Это обусловлено
образованием на их поверхности плёнки нерастворимой соли. Например, свинец,
стоящий в ряду активности до водорода, практически не растворяется в
разбавленной серной и соляной кислотах вследствие образования на его
поверхности плёнки нерастворимых солей (PbCl2,
PbSO4).
В азотной кислоте
растворяются металлы, стоящие и до, и после водорода. При этом образуются
нитраты, а также различные продукты восстановления азотной кислоты.
Концентрированная
серная кислота также может вступать в реакции с металлами, расположенными в
ряду активности после водорода. Например, в реакции серебра с концентрированной
серной кислотой образуется сульфат серебра (I), сернистый
газ и вода, а в реакции магния с концентрированной серной кислотой образуется
сульфат магния, сероводород и вода.
Al,
Cr, Fe при
комнатной температуре не вступают в реакцию и с концентрированной серной
кислотой из-за образования на их поверхности оксидной плёнки. Это явление
называется пассивацией. Благодаря этому становится возможным транспортировать
концентрированную азотную серную кислоты в стальных цистернах.
- Проведём
эксперимент, поместим в четыре пробирки металлы: в первую – магний, во вторую –
цинк, в третью – железо, а в четвёртую – медь и прильём в каждую пробирку
соляной кислоты. - Интенсивнее всего
выделение наблюдается в первой пробирки, где находится цинк, кроме этого,
реакция сопровождается выделение теплоты, во второй и третье пробирке
интенсивность выделения водорода меньше, а в четвёртой пробирке водород вообще
не выделяется. - Mg + 2HCl = MgCl2
+ H2↑ + Q - Zn + 2HCl = ZnCl2
+ H2↑ - Fe + 2HCl = FeCl2
+ H2↑ - Cu + HCl ≠
Тоже самое
сделаем в другом опыте, но использовать здесь будем уксусную кислоту.
Получается, что при комнатной температуре с уксусной кислотой реагирует
только магний, цинк и железо реагирует с уксусной кислотой только при
нагревании, а медь не вступает во взаимодействие с уксусной кислотой.
- Mg + 2CH3COOH = (CH3COO)2 Mg + H2↑
- Zn + 2CH3COOH = (CH3COO)2 Zn + H2↑
- Fe + 2CH3COOH = (CH3COO)2 Fe + H2↑
- Cu + CH3COOH
≠ - Таким образом, металл
реагирует с раствором кислоты, если он стоит в ряду активности левее водорода,
при этом должна образоваться растворимая соль, концентрированная серная и
азотная кислота иначе реагируют с кислотами, щелочные металлы для данных
реакций лучше не использовать из-за их высокой химической активности. - Некоторые
металлы, такие, как Be, Zn, Al, легко растворяются в водных растворах щелочей с
образованием комплексных соединений. - Например, в
реакции бериллия с раствором гидроксида натрия образуется комплексная соль –
тетрагидроксобериллат натрия, а в реакции цинка с водным раствором гидроксида
калия образуется комплексная соль – тетрагидроксоцинкат калия. - Be + 2H2O + 2NaOH = Na2[Be(OH)4] +
H2↑ - Zn + 2H2O + 2KOH = K2[Zn(OH)4] + H2↑
Металлы, оксиды и
гидроксиды которых амфотерны, взаимодействуют также с расплавами щелочей при
нагревании. Например, в реакции цинка с расплавом гидроксида натрия образуется
соль – цинкат натрия и водород.
Zn + 2NaOH (тв.)
= Na2ZnO2
+ H2↑
Активные
металлы вытесняют малоактивные из растворов их солей. Так, в реакции железа
с хлоридом меди (II) железо замещает медь в его хлориде
и образуется хлорид железа (II) и медь, в реакции меди
с нитратом серебра (I) образуется соль – нитрат меди (II) и серебро.
- Fe + CuCl2 = FeCl2 + Cu↓
- Cu + 2AgNO3 = Cu (NO3)2 +
2Ag↓ - Проведём
эксперимент, опустим железный гвоздь в раствор сульфата меди (II),
через некоторое время на железном гвозде осела медь и раствор стал жёлтого
цвета, если опустить медную платину в раствор сульфата железа (II), то в данной случае признаков реакции не наблюдается,
ведь медь менее активный металл, чем железо. - Fe + CuSO4 = FeSO4 + Cu↓
- Cu + FeSO4 ≠
- В данных реакциях
нужно соблюдать следующие условия: щелочные металлы брать нельзя, так как они
будут взаимодействовать с водой, металл должен находится левее того металла,
который входит в состав соли, в данных реакциях должна образоваться растворимая
соль.
Металлы могут
реагировать и с органическими веществами. Например, в реакции фенола с натрием,
образуется фенолят натрия, в реакции этанола с натрием образуется этилат
натрия.
2C6H5OH + 2Na → 2C6H5ONa + H2↑
2C2H5OH + 2Na → 2C2H5ONa + H2↑
Кроме этого,
натрий вступает в реакцию Вюрца с галогеналканами. Так, в реакции хлорметана с
натрием образуется хлорид натрия и этан.
2H3CCl + 2Na C2H6
+ 2NaCl
Соединение Pb(C2H5)4
– тетраэтилсвинец – применяется как антидетонатор в моторном топливе. Это
сильно ядовитое соединение, если бензин содержит тетраэтилсвинец, тогда его
называют «этилированным».
Таким образом, о
химической активности металлов можно примерно судить по их расположению в
электрохимическом ряду напряжений металлов.
Чем левее расположен
металл, тем выше его химическая активность в водном растворе. Активные
металлы размещаются вначале вытеснительного ряда, а малоактивные – в конце.
Металлы
реагируют как с простыми веществами – неметаллами, так и со сложными: оксидами,
кислотами, основаниями и солями.
Конспект урока — исследования по химии в 11 классе «Химические свойства металлов и их соединений»
- Муниципальное общеобразовательное автономное учреждение
- «Средняя общеобразовательная школа № 5 города Соль – Илецка»
- Оренбургской области
- Конспект урока — исследования по химии в 11 классе
- «Химические свойства металлов и их соединений»
- Учитель химии
- Корикова Елена Александровна
- Соль – Илецк
- 2014 год
- Аннотация
Урок – исследование проводится в 11 классе после изучения металлов по теме «Вещества и их свойства». Урок является результатом усвоенных знаний по теме «Металлы», имеет связь с ранее изученными темами («Свойства основных классов веществ», «Гидролиз солей», «Окислительно – восстановительные реакции», «Металлы главных подгрупп», «Переходные металлы») и построен на основе теории проблемного обучения. Данный урок может быть проведен в классе, где учащиеся обладают высоким уровнем развития и сформированности учебных умений и навыков. Это позволяет провести урок в режиме самостоятельного поиска знаний. Форма организации работы в классе на основной части урока – групповая, группы созданы с учетом индивидуальных психологических особенностей и уровня умственного развития каждого учащегося.
- Тема урока: «Химические свойства металлов и их соединений»
- Цель урока: Научить учащихся самостоятельно добывать знания в ходе исследования и раскрывать особенности протекания химических реакций, определять проблемную ситуацию, находить пути ее решения, систематизировать и обобщать изученный материал; развивать умения прогнозировать, сравнивать, выделять главное, анализировать.
- Задачи:
- Образовательные:
- 1.Повторить свойства металлов и их соединений;
- 2.Сформировать понятия о химических свойствах металлов;
- Развивающие:
- 1.На основе межпредметных связей продолжить формирование умений устанавливать взаимосвязь между составом, строением и свойствами вещества;
- 2.Способствовать развитию исследовательских навыков;
- 3.Продолжить формирование умений работать в темпе, экономя время урока
- Форма проведения урока: урок – исследование
- Оборудование и реактивы:
- Растворы: хлорид магния, хлорид железа(2), хлорид меди(2), хлорид алюминия, карбонат натрия, нитрат меди (2), сульфат меди(2), хлорид железа (3), нитрат железа (3)
- Твердые вещества: литий, магний, алюминий, железо, медная проволока, серебро.
- Штативы с пробирками.
- Литература:
-
Махмутов М. И. Проблемное обучение: основные вопросы теории. М.: Педагогика, 1975;
-
Махмутов. М.И Организация проблемного обучения в школе. Книга для учителей. М.: Просвещение, 1977; Психологический словарь. Под ред. В.В. Давыдова. М.: Педагогика, 1983;
Фридман Л.М., Маху В.И Проблемная организация учебного процесса. Методическая разработка. М.: АПМ СССР, 1990;
Кудрявцев В.Т. Проблемное обучение: истоки, сущность, перспективы . М.: Знание, 1991;
Сиденко А.С. Технологизация опыта, возможна ли она? Народное образование, 1999, № 1,2;
Хуторской А.В. Технология эвристического обучения. Школьные технологии, 1998, № 4.
- Ход урока:
- 1 Орг. Момент
- Ориентировочно-мотивационный этап
Ставлю перед учащимися познавательные задачи для уточнения содержания основных понятий. Вопросы предполагают межпредметную связь с физикой, биологией внутрипредметную связь между основными темами. Фронтальная работа учащихся класса репродуктивного и частично- поискового характера готовит учащихся к активной учебно-познавательной деятельности.
Вопрос 1. Почему в земной коре не могут встречаться в свободном состоянии щелочные металлы, их оксиды и гидроксиды?
На этот вопрос ожидается получение однозначного ответа о высокой реакционной способности щелочных металлов, взаимодействиес водой и химических свойствах их соединений.
Учащиеся на основании положения щелочных металлов в периодической системе химических элементов делают вывод об их активности и высокой скорости протекания реакции с водой, а также о взаимодействия оксида и гидроксида щелочного металла с кислотными оксидами и кислотами. Учащиеся делают вывод о нахождении щелочных металлов в земной коре только в виде солей.
Вопрос 2. Смесь двух металлов второй группы главной подгруппы растворили в воде. Один из металлов в воде не растворился. Элементы, образующие эти металлы, называют «элементами жизни». Какие это металлы?
Ответ на данный вопрос предполагает сравнение активности металлов (магния и кальция), а также их соединений. Если учащиеся не отвечают на поставленный вопрос, то ещё раз уточняется условие взаимодействия металла с водой (металл реагирует с водой, образуя растворимое основание и водород).
Учитывая, что кальций при обычных условиях взаимодействует с водой с образованием малорастворимого гидроксида, а магний с холодной водой не реагирует, учащиеся приходят к выводу, что в воде не растворился магний.
Вопрос 3. новый цинковый бак, в котором приготовили раствор медного купороса для опрыскивания растений, вскоре прохудился. Объясните причину разрушения стенок бака.
Вопрос 4. Для тепловозов, имеющих двигатели с чугунным и стальными блоками, в системе охлаждения используется вода с рН=11/12,а для дизельных поездов, имеющих двигатели с алюминиевыми баками, вода с рН=7/8. Чем это вызвано?
Вопрос 5. Почему алюминиевую посуду нельзя мыть содой?
При поиске на последние три вопроса учащимся необходимо найти решение путём выявления противоречия в содержании. Для наглядности и лучшего понимания вопросы иллюстрированы схемами-рисунками.
При ответе на 3-й вопрос учащиеся сравнивают активность металлов в электрохимическом ряду напряжений и делают вывод о протекании реакции замещения более активным металлом (Zn) менее активного (Cu) в растворимой соли, вследствие чего происходит разрушение стенок бака.
При ответе на 4-ый вопрос необходимо учесть наличие разной среды растворов, а также проявление отдельными металлами свойств амфотерности.
При затруднении на этот вопрос учитель обращает внимание учащихся на стенд, на котором изображена шкала значений pH и ее соответствие среде раствора.
Анализируя значения pH, учащиеся делают вывод о невозможности нахождения алюминия в щелочной среде раствора, т.к. в этом случае будет протекать его взаимодействие со щелочью.
Ответ на 5-ый вопрос вытекает из предыдущего ответа. Учитывая, что алюминий и его соединения (оксидная пленка на поверхности металла) проявляют амфотерные свойства, а среда щелочная (устанавливают при рассмотрении реакции гидролиза), учащиеся делают вывод, что алюминиевую посуду мыть содой нельзя.
Вопрос 6. Какие из предложенных солей подвергаются гидролизу: хлорид натрия, хлорид магния, карбонат калия? Определите среду раствора соли.
Данный вопрос направлен на идентификацию среды раствора, образованной в результате гидролиза соли. Учащиеся демонстрируют знание процесса гидролиза и объясняют образование среды раствора солей.
- Проблемно-поисковый этап
- УЧИТЕЛЬ.
- Должны мы на уроке истину установить,
- При этом формулы, законы не забыть
- Эксперимент с начало проведем,
- Подумаем, помыслим и теорию учтём.
- Дерзая, споря, новое откроем
- И постепенно нужное усвоим.
Сообщаю, что необходимо провести исследование, предоставляется возможность самостоятельного приобретения знаний. Ученики класса разбиты на творческие группы, каждая из которых получает задание и необходимые реактивы для проведения эксперимента.
Учащиеся, получив задание, осмысливают содержание и последовательность его выполнения. В исследовании каждой из групп учителем созданы проблемные ситуации: противоречия теоретического материала и практически полученного в эксперименте результата.
Ученики в процессе работы заполняют протокол исследования (табл.)
- Протокол исследования
- Описание опыта
- Наблюдения
- Гипотеза
- Проверка гипотезы. Уравнения реакции
- Алгоритм протекания реакции
- Работа 1-ой группы
- Цель исследования: Изучение протекания химических реакций при взаимодействии щелочных металлов с растворами солей.
Опыт 1. В растворах хлоридов магния и железа осторожно помещают кусочек лития. Наблюдения заносят в протокол (бурно выделяется газ, выпадают осадки белого и бурого цвета).
Опыт 2. В раствор хлорида меди (2) помещают кусочек лития. Заносят наблюдения в протокол (выпадает осадок черного цвета).
Учащиеся предполагают (ошибочно) вытеснение активным металлом более слабого металла из его соли. Но практически проведенный эксперимент свидетельствуют о выделении газа и выпадении осадка. Учащиеся формулируют проблемный вопрос, выдвигают гипотезы для его решения и доказывают их.
Если выдвижение гипотезы о протекании реакции вызвало затруднение, то учитель обращает внимание учащихся на цвет осадков, их соответствие определенным соединениям и способам получения. При дальнейшем затруднении учащимся напоминают, что щелочной металл попадает в раствор, поэтому и происходит выделение газа.
Согласно доказанному в 1-ом опыте алгоритму взаимодействия щелочного металла с раствором соли, во 2–м опыте должен образоваться осадок гидроксида меди (2) синего цвета. Вновь создана ситуация противоречия, в которой учащиеся находят решение.
Обобщают полученные результаты, формулируют выводы, конструируют алгоритм протекания химической реакции.
При взаимодействии щелочных металлов с растворами солей протекают реакции:
-
взаимодействие щелочного металла и воды с образованием щелочи и водорода.
-
Взаимодействие щелочи и раствора соли с образованием другой соли и другого основания.
- К предложенному алгоритму во 2-ом опыте добавится реакция разложения нерастворимого основания.
- Работа 2-ой группы:
- Цель исследования: Изучить взаимодействие щелочноземельных металлов с растворами солей.
Опыт 1. В раствор хлорида алюминия поместите небольшое количество магния. В результате проведенного эксперимента происходит растворение магния, которое сопровождается бурным выделением бесцветного газа. Наблюдения учащиеся записывают в протокол.
Опыт 2. В раствор хлорида магния поместите небольшое количество магния. Учащиеся записывают наблюдения в протокол исследования(растворение магния в растворе своей соли и выделение газа).
На первом этапе урока при поиске ответа на 2 вопрос учащиеся теоретически доказали нерастворимость магния в воде. Создана ситуация противоречия теории и практики. Согласно теории протекает вытеснение активным металлом более слабого из раствора его соли с образованием металлического осадка.
Проведенный эксперимент свидетельствует о растворении магния и бурном выделении газа. Если выдвижение гипотезы учащимися вызывает затруднение, то я обращаю внимание на способность солей подвергаться гидролизу.
Активные действия с объектом изучения приводят учащихся к выявлению характера противоречия теории и практики, они формулируют проблему и выдвигают гипотезы для ее решения. Обобщают полученные результаты и формулируют выводы.
- Металл + раствор соли?
- 1.М + Н2О= реакция не протекает
- 2.растворимая соль + Н2О = гидролиз
- 3. М + кислот(среда раствора соли) = соль + Н2
- Взаимодействие магния с растворами солей подчиняется алгоритму:
-
растворимые соли, образованные слабым основанием и сильной кислотой, подвергаются гидролизу по катиону с образованием кислой среды;
-
кислота, полученная в результате гидролиза соли, действует на металл, образуя соль и водород.
Работа 3-ой группы:
Цель исследования: изучить протекание химических реакций при действии алюминия на растворы солей.
Опыт 1. В раствор карбоната натрия опустите гранулу алюминия. Выпадает белый осадок и выделяется газ. (наблюдения учащиеся заносят в протокол).
Опыт 2. В раствор хлорида меди (2) поместите гранулу алюминия. В результате эксперимента выделяется бесцветный газ и большой объем порошкообразной меди на поверхности алюминия.
Опыт 3. В раствор нитрата меди (2) поместите гранулу алюминия. Учащиеся фиксируют отсутствие видимых признаков реакции.
Данное исследование предполагает выяснение учащимися противоречия в образовании различных продуктов реакций в результате взаимодействия алюминия с солями и способности растворения оксидной пленки в различной среде раствора.
При затруднении выдвижения гипотезы, я обращаю их внимание на природу соли и возможность протекания гидролиза.
Учащиеся совершенствуют исследовательские навыки, обобщают полученные результаты проведенного эксперимента, выдвигают гипотезы растворения оксидной пленки алюминия в различных средах растворов солей и взаимодействия металла в данных условиях.
Учащиеся формулируют выводы и конструируют алгоритм взаимодействия алюминия с растворами солей:
-
гидролиз солей, образованных слабым основанием или слабой кислотой, с образованием кислой или щелочной среды;
-
оксидная пленка на поверхности алюминия растворяется (щелочью или соляной кислотой) в среде, образованной в результате гидролиза соли (азотной кислотой пленка на поверхности алюминия не разрушается);
-
взаимодействие алюминия с водой и средой раствора соли.
Работа 4-ой группы:
Цель исследования: Изучить протекание химических реакций при действии металлов побочных подгрупп на растворы солей.
Опыт 1. В раствор сульфата меди(2) опустите железные стружки. Учащиеся фиксируют выделение меди на поверхности железа.
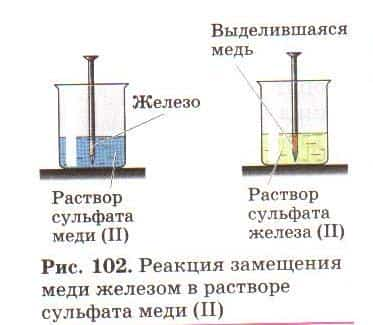
Опыт 2. В раствор хлорида железа (2) поместите небольшое количество меди. В результате эксперимента происходит растворение меди.
Опыт 3.В раствор нитрата серебра поместите небольшое количество меди. В результате эксперимента происходит осаждение серебра на медной проволоке.
Результаты первого опыта подтверждают вытеснение активным металлом более слабого из раствора его соли. Результаты второго и третьего опытов свидетельствует о протекании реакции между слабым металлом и раствором соли.
Учащиеся группы должны выявить противоречие проведенных опытов и найти решение в создавшейся ситуации. При затруднении учащихся в выдвижении гипотез обращаю внимание на способность железа иметь различные степени окисления.
Проведя качественный анализ продуктов реакции, учащиеся выдвигают гипотезу, проверяют ее истину.
- 1. М (сильнее) + растворимая соль = другая соль + другой М
- 2. М (слабее) + растворимая соль = другая соль + другая соль (реакция возможна, если
- +3 +2 +2 +1
- Fе = Fе или Сu = Сu)
- Учащиеся формулируют выводы:
-
более активный металл вытесняет менее активный из раствора его соли с образованием другого металла и другой соли;
-
взаимодействие менее активного металла с раствором соли, возможно, если металл в соли восстанавливается до промежуточной степени окисления.
- Этап рефлексии (презентация полученных результатов)
- Учащиеся докладывают о достижении поставленных целей, обмениваются с другими учащимися результатами выполненного исследования, развивая тем самым умения публичного выступления.
- Отчет групп учащихся поддерживается мультимедийной презентацией проведенного исследования.
- Подведение итогов:
Результатом данного урока является наличие положительного мотива к исследовательской деятельности. Учащиеся пробовали свои силы в решении проблемных вопросов и убедились, что могут их решить. Успешное достижений целей учащимися открывает перспективу для их исследовательской деятельности во внеурочное время.
Домашнее задание:
Повторить как реагируют металлы с растворами солей
Химические свойства металлов Урок химии в 11 классе Учитель химии: Киреева Марина Николаевна МКОУ «Тормосиновская СОШ» Чернышковского района Волгоградской. — презентация
1 Химические свойства металлов Урок химии в 11 классе Учитель химии: Киреева Марина Николаевна МКОУ «Тормосиновская СОШ» Чернышковского района Волгоградской области
2 Верите ли вы, что … 1.Металлы занимают верхний левый угол в ПСХЭ. 2.В кристаллах атомы металла связаны металлической связью. 3.Валентные электроны металлов прочно связаны с ядром. 4.У металлов, стоящих в главных подгруппах (А), на внешнем уровне обычно 2 электрона. 5.В группе сверху вниз происходит увеличение восстановительных свойств металлов.
- 3 Самопроверка тестов 5-6 правильных ответов – «5» 4 правильных ответа – «4» 3 правильных ответа – «3»
- 4
- 5 Почему алюминиевую посуду нельзя мыть содой? Na 2 CO 3
- 6 Цель урока: систематизировать и углубить знания о химических свойствах металлов, подчеркнув их функцию как восстановителей.
- 7 Задачи урока развивать умения пользоваться опорными знаниями, закреплять умения и навыки выполнения химического эксперимента; закреплять умения составлять уравнения реакций; сформировать понимание практического значения металлов в жизни человека; развивать познавательный интерес при выполнении теоретических и практических заданий.
8 Ме 0 – ne Me +n Ме 0 – восстановитель 1.Простые вещества (+О 2, Сl 2, S…) 2.Сложные вещества (Н 2 О, кислоты, растворы солей) (+ окислитель)
- 9 Ряд напряжений металлов
- 10 М + неметалл Е + вода Т + оксид А + кислота Л + соль Л + щёлочь Ы + органические вещества
- 11 Физминутка
12 Единственный путь, ведущий к знанию, — это деятельность. (Б. Шоу )
13 Чтобы жизнь свою не подвергать опасности, надо свято соблюдать все правила по технике безопасности!
14 Исследование химических свойств металлов 1 группа Металл + неметалл? 2 группа Металл + вода? Металл + оксид 3 группа Металл + кислота? 4 группа Металл + соль менее активного металла? Металл + щёлочь? 5 группа Металл + органические вещества? Металл + металл?
15
16 Жизнь человеческая подобна железу. Если употреблять его в дело, оно истирается; если же не употреблять, ржавчина его съедает. Так, Пусть ваш мозг истирается от работы мысли, а не пожирается ржавчиной от лени. Катон Старший сказал:
17 Домашнее задание: 1 ВАРИАНТ ЗАДАНИЯ: § 18, с , протокол исследования 2 ВАРИАНТ ЗАДАНИЯ: : Закончить уравнение реакции, написать уравнения электронного баланса: Сu + Hg(NO 3 ) 2 ТВОРЧЕСКОЕ ЗАДАНИЕ: ПРЕЗЕНТАЦИЯ О ПРИМЕНЕНИИ МЕТАЛЛОВ(ПО ЖЕЛАНИЮ)






