- Газовая коррозия
- Характеристики оксидной пленки
- Скорость развития коррозии
- Коррозия в жидкостях-неэлектролитах
- Способы защиты от коррозии
- Органосиликатные покрытия
- Виды коррозии металлов
- Коррозия металлов
- Коррозия металлов. Виды коррозии металлов
- Виды химической коррозии
- Фактор Пиллинга-Бэдворса
- Виды электрохимической коррозии
- Химические покрытия
- Электрохимическая защита
Химическая коррозия — это процесс, состоящий в разрушении металла при взаимодействии с агрессивной внешней средой. Химическая разновидность коррозийных процессов не имеет связи с воздействием электрического тока. При этом виде коррозии происходит окислительная реакция, где разрушаемый материал — одновременно восстановитель элементов среды.

Классификация разновидности агрессивной среды включает два вида разрушения металла:
- химическая коррозия в жидкостях-неэлектролитах;
- химическая газовая коррозия.
Газовая коррозия
Самая частая разновидность химической коррозии — газовая — представляет собой коррозийный процесс, происходящий в газах при повышенных температурах.
Указанная проблема характерна для работы многих типов технологического оборудования и деталей (арматуры печей, двигателей, турбин и т.д.).
Кроме того, сверхвысокие температуры используются при обработке металлов под высоким давлением (нагревание перед прокаткой, штамповкой, ковкой, термическими процессами и т.д.).
Особенности состояния металлов при повышенных температурах обуславливаются двумя их свойствами — жаропрочностью и жаростойкостью. Жаропрочность — это степень устойчивости механических свойств металла при сверхвысоких температурах.
Под устойчивостью механических свойств понимается сохранение прочности в течение продолжительного времени и сопротивляемость ползучести.
Жаростойкость — это устойчивость металла к коррозионной активности газов в условиях повышенных температур.

Скорость развития газовой коррозии обуславливается рядом показателей, в числе которых:
- температура атмосферы;
- компоненты, входящие в металл или сплав;
- параметры среды, где находятся газы;
- продолжительность контактирования с газовой средой;
- свойства коррозийных продуктов.
На коррозийный процесс больше влияние оказывают свойства и параметры оксидной пленки, появившейся на металлической поверхности. Образование окисла можно хронологически разделить на два этапа:
- адсорбция кислородных молекул на металлической поверхности, взаимодействующей с атмосферой;
- контактирование металлической поверхности с газом, в результате чего возникает химическое соединение.

Первый этап характеризуется появлением ионной связи, как следствие взаимодействия кислорода и поверхностных атомов, когда кислородный атом отбирает пару электроном у металла. Возникшая связь отличается исключительной силой — она больше, нежели связь кислорода с металлом в окисле.
Объяснение такой связи кроется в действии атомного поля на кислород.
Как только поверхность металла наполняется окислителем (а это происходит очень быстро), в условиях низких температур, благодаря силе Ван-дер-Ваальса, начинается адсорбция окислительных молекул.
Результат реакции — возникновение тончайшей мономолекулярной пленки, которая с течением времени становится толще, что усложняет доступ кислорода.
На втором этапе происходит химическая реакция, в ходе которой окислительный элемент среды отбирает у металла валентные электроны. Химическая коррозия — конечный результат реакции.
Характеристики оксидной пленки
Классификация оксидных пленок включает их три разновидности:
- тонкие (незаметны без специальных приборов);
- средние (цвета побежалости);
- толстые (видны невооруженным взглядом).
Появившаяся оксидная пленка имеет защитные возможности — она замедляет или даже полностью угнетает развитие химической коррозии. Также наличие оксидной пленки повышает жаростойкость металла.
Однако, действительно эффективная пленка должна отвечать ряду характеристик:
- быть не пористой;
- иметь сплошную структуру;
- обладать хорошими адгезивными свойствами;
- отличаться химической инертностью в отношении с атмосферой;
- быть твердой и устойчивой к износу.
Одно из указанных выше условий — сплошная структура имеет особенно важное значение. Условие сплошности — превышение объема молекул оксидной пленки над объемом атомов металла. Сплошность — это возможность окисла накрыть сплошным слоем всю металлическую поверхность.
При несоблюдении этого условия, пленка не может считаться защитной. Однако, из этого правила имеются исключения: для некоторых металлов, например, для магния и элементов щелочно-земельной групп (исключая бериллий), сплошность не относится к критически важным показателям.

Чтобы установить толщину оксидной пленки, используются несколько методик. Защитные качества пленки можно выяснить в момент ее образования. Для этого изучаются скорость окисления металла, и параметры изменения скорости во времени.
Для уже сформированного окисла применяется другой метод, состоящий в исследовании толщины и защитных характеристик пленки. Для этого на поверхность накладывается реагент. Далее специалисты фиксируют время, которое понадобится на проникновение реагента, и на основании полученных данных делают вывод о толщине пленки.
Обратите внимание! Даже окончательно сформировавшаяся оксидная пленка продолжает взаимодействовать с окислительной средой и металлом.
Скорость развития коррозии
Интенсивность, с какой развивается химическая коррозия, зависит от температурного режима. При высокой температуре окислительные процессы развиваются стремительнее. Причем снижение роли термодинамического фактора протекания реакции не влияет на процесс.
Немалое значение имеет охлаждение и переменный нагрев. Из-за термических напряжений в оксидной пленке появляются трещины. Через прорехи окислительный элемент попадает на поверхность. В результате образуется новый слой оксидной пленки, а прежний — отслаивается.

Не последнюю роль играют и компоненты газовой среды. Этот фактор индивидуален для разных видов металлов и согласуется с температурными колебаниями.
К примеру, медь быстро поддается коррозии, если она контактирует с кислородом, но отличается устойчивостью к этому процессу в среде оксида серы.
Для никеля же напротив, серный оксид губителен, а устойчивость наблюдается в кислороде, диоксиде углерода и водной среде. А вот хром проявляет стойкость ко всем перечисленным средам.
Обратите внимание! Если уровень давления диссоциации окисла превышает давление окисляющего элемента, окислительный процесс останавливается и металл обретает термодинамическую устойчивость.
На скорость окислительной реакции влияют и компоненты сплава. Например, марганец, сера, никель и фосфор никак не способствуют окислению железа. А вот алюминий, кремний и хром делают процесс более медленным. Еще сильнее замедляют окисление железа кобальт, медь, бериллий и титан.
Сделать процесс более интенсивным помогут добавки ванадия, вольфрама и молибдена, что объясняется легкоплавкостью и летучестью данных металлов. Наиболее медленно окислительные реакции протекают при аустенитной структуре, поскольку она наиболее приспособлена к высоким температурам.

Еще один фактор, от которого зависит скорость коррозии, — характеристика обработанной поверхности. Гладкая поверхность окисляется медленнее, а неровная — быстрее.
Коррозия в жидкостях-неэлектролитах
К неэлектропроводным жидким средам (т.е. жидкостям-неэлектролитам) относят такие органические вещества, как:
- бензол;
- хлороформ;
- спирты;
- тетрахлорид углерода;
- фенол;
- нефть;
- бензин;
- керосин и т.д.

Кроме того, к жидкостям-неэлектролитам причисляют небольшое количество неорганических жидкостей, таких как жидкий бром и расплавленная сера.
При этом нужно заметить, что органические растворители сами по себе не вступают в реакцию с металлами, однако, при наличии небольшого объема примесей возникает интенсивный процесс взаимодействия.
Увеличивают скорость коррозии находящиеся в нефти серосодержащие элементы. Также, усиливают коррозийные процессы высокие температуры и присутствие в жидкости кислорода. Влага интенсифицирует развитие коррозии в соответствии с электромеханическим принципом.
Еще один фактор быстрого развития коррозии — жидкий бром. При нормальных температурах он особенно разрушительно воздействует на высокоуглеродистые стали, алюминий и титан. Менее существенно влияние брома на железо и никель. Самую большую устойчивость к жидкому брому показывают свинец, серебро, тантал и платина.

Расплавленная сера вступает в агрессивную реакцию почти со всеми металлами, в первую очередь со свинцом, оловом и медью. На углеродистые марки стали и титан сера влияет меньше и почти совсем разрушает алюминий.
Защитные мероприятия для металлоконструкций, находящихся в неэлектропроводных жидких средах, проводят добавлением устойчивым к конкретной среде металлов (например, сталей с высоким содержанием хрома). Также, применяются особые защитные покрытия (например, в среде, где содержится много серы, используют алюминиевые покрытия).
Способы защиты от коррозии
Методы борьбы с коррозией включают:
- обработку основного металла защитным слоем (например, нанесение краски);

- использование ингибиторов (например, хроматов или арсенитов);
- внедрение материалов, устойчивых к коррозийным процессам.
Выбор конкретного материала зависит от потенциальной эффективности (в том числе технологической и финансовой) его использования.
Современные принципы защиты металла основываются на таких методиках:
- Улучшение химической сопротивляемости материалов. Успешно зарекомендовали себя химически стойкие материалы (высокополимерные пластики, стекло, керамика).
- Изолирование материала от агрессивной среды.
- Уменьшение агрессивности технологической среды. В качестве примеров таких действий можно привести нейтрализацию и удаление кислотности в коррозийных средах, а также использование всевозможных ингибиторов.
- Электрохимическая защита (наложение внешнего тока).
Указанные выше методики подразделяются на две группы:
- Повышение химической сопротивляемости и изолирование применяются до того, как металлоконструкция запускается в эксплуатацию.
- Уменьшение агрессивности среды и электрохимическая защита используются уже в процессе применения изделия из металла. Применение этих двух методик дает возможность внедрять новые способы защиты, в результате которых защита обеспечивается изменением эксплуатационных условий.
Один из самых часто применяемых способов защиты металла — гальваническое антикоррозийное покрытие — экономически нерентабелен при значительных площадях поверхностей. Причина в высоких затратах на подготовительный процесс.

Ведущее место среди способов защиты занимает покрытие металлов лакокрасочными материалами. Популярность такого метода борьбы с коррозией обусловлена совокупностью нескольких факторов:
- высокие защитные свойства (гидрофобность, отталкивание жидкостей, невысокие газопроницаемость и паропроницаемость);
- технологичность;
- широкие возможности для декоративных решений;
- ремонтопригодность;
- экономическая оправданность.
В то же время, использование широкодоступных материалов не лишено недостатков:
- неполное увлажнение металлической поверхности;
- нарушенное сцепление покрытия с основным металлом, что ведет к скапливанию электролита под антикоррозийным покрытием и, таким образом, способствует коррозии;
- пористость, приводящая к повышенной влагопроницаемости.
И все же, окрашенная поверхность защищает металл от коррозийных процессов даже при фрагментарном повреждении пленки, тогда как несовершенные гальванические покрытия способны даже ускорять коррозию.
Органосиликатные покрытия
Для качественной защиты от коррозии рекомендуется применение металлов с высоким уровнем гидрофобности, непроницаемости в водных, газовых и паровых средах. К числу таких материалов относятся органосиликаты.
Химическая коррозия практически не распространяется на органосиликатные материалы. Причины этого кроются в повышенной химической устойчивости таких композиций, их стойкости к свету, гидрофобных качествах и невысоком водопоглощении. Также органосиликаты устойчивы к низким температурам, обладают хорошими адгезивными свойствами и износостойкостью.
Проблемы разрушения металлов из-за воздействия коррозии не исчезают, несмотря на развитие технологий борьбы с ними. Причина в постоянном возрастании объемов производства металлов и все более сложных условий эксплуатации изделий из них. Окончательно решить проблему на данном этапе нельзя, поэтому усилия ученых сосредоточены на поисках возможностей по замедлению коррозионных процессов.
Виды коррозии металлов


Средняя оценка: 4.6
Всего получено оценок: 174.
Средняя оценка: 4.6
Всего получено оценок: 174.
Коррозия – саморазрушение металла под действием веществ окружающей среды. Выделяют несколько видов коррозии металлов в зависимости от признака.
С точки зрения химии коррозия – это окислительно-восстановительные процессы между металлом и коррозионной средой. Если металл попадает в щелочную, кислую, насыщенную кислородом или водородом среду, он начинает окисляться – ржаветь. Вместе с окислением металла происходит восстановление коррозионных элементов.
В результате на поверхности образуются оксиды, гидроксиды или соли металла. При дальнейшем воздействии окислительной среды металл полностью превращается в ржавчину.
Рис. 1. Ржавые металлические детали.
Коррозия поражает большинство металлов, в частности железо, которое используется для изготовления деталей, конструкций, корпусов машин и кораблей. Для продления срока службы в металлургии разработаны способы защиты металла от естественных повреждений. Специальные сплавы и покрытия отсрочивают возникновение коррозии на десятки лет.
Коррозия может происходить в присутствии электролитов и неэлектролитов. Поэтому основными видами коррозии металлов по механизму возникновения являются:
- химическая – возникает в отсутствии электролита в сухой или влажной среде;
- электрохимическая – происходит в присутствии электролита.
Химическая коррозия связана с неэлектролитами – веществами, не проводящими электрический ток в растворах или расплавах. К неэлетролитам относятся многие простые неорганические (кислород, водород) и органические (эфир, бензол) вещества.
Химическая коррозия может происходить в присутствии газов (водорода, кислорода, хлора), органических кислот и солей. Молекулы металла соединяются с химическими элементами, и на металлической поверхности возникают плёнки – оксиды, сульфиды, гидриды. Внешне это заметно по изменению цвета. Железо, соединяясь с кислородом, образует Fe2O3 – оксид железа (III) – рыжую ржавчину.
 Рис. 2. Оксид железа.
Рис. 2. Оксид железа.
Если в расплаве или в растворе присутствуют вещества, проводящие электрический ток (электролиты), то появляется электрохимическая коррозия.
Она возникает в присутствии солей, кислот, щелочей или при соприкосновении поверхностей двух металлов, между которыми находится влажная среда. Из-за разности окислительно-восстановительных потенциалов возникает гальванический элемент – источник электрического тока.
Металл выступает в роли анода (восстановителя), электролит – катода (окислителя). Анод, отдавая электроны, окисляется или коррозирует.
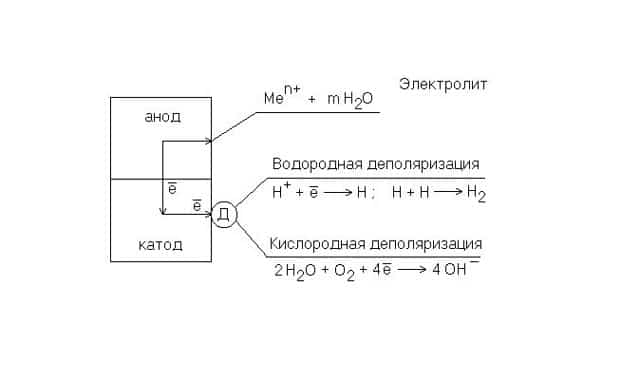 Рис. 3. Схема электрохимической коррозии.
Рис. 3. Схема электрохимической коррозии.
Классификация коррозии может проводиться по другим признакам. По очагу поражения коррозия бывает:
- местной;
- сплошной;
- точечной.
Коррозия может происходить в разных средах:
- газовой (безводной);
- атмосферной (влажной);
- жидкостной;
- грунтовой;
- радиационной.
Соль ускоряет процесс ржавления, поэтому корабли быстрее ржавеют в морской, чем в пресной воде.
Коррозия – окисление и разрушение металла под воздействием окружающей среды. Процесс окисления может происходить в присутствии или в отсутствии электролитов.
Коррозия, возникающая без воздействия электролитов, называется химической. На поверхности металлов возникают оксиды, гидроксиды, соли. Под действием электролитов возникает электрохимическая коррозия.
Окислению подвергается металл, выступающий в роли анода.
Чтобы попасть сюда — пройдите тест.
- Пока никого нет. Будьте первым!
Средняя оценка: 4.6
Всего получено оценок: 174.
А какая ваша оценка?
Гость завершил
Тест Белые ночи (9 класс)с результатом 8/10
Гость завершил
Тест «Мертвые души»с результатом 14/19
Гость завершил
Тест «Тёмные аллеи»с результатом 10/12
Гость завершил
Тест «Выстрел»с результатом 7/13
Гость завершил
Тест «Дубровский»с результатом 11/16
Гость завершил
Тест «Медный всадник»с результатом 8/11
Не подошло? Напиши в х, чего не хватает!
Коррозия металлов
Коррозия – это самопроизвольный окислительно-восстановительный процесс разрушения металлов и сплавов вследствие взаимодействия с окружающей средой.
Различают два вида коррозии – химическую и электрохимическую. Химическая коррозия обусловлена взаимодействием металлов с веществами, содержащимися в окружающей среде. В производственных условиях такими веществами, помимо О2, являются SO2, CO2, H2S, NH3 и др.
Химическую коррозию, обусловленную взаимодействием металлов с газами, называют газовой. Основной вклад в газовую коррозию металла вносит кислород воздуха. Различные металлы обладают различной устойчивостью по отношению к О2.
Некоторые металлы (Al, Cr, Zn, Pb, Sn) образуют на воздухе плотные пленки оксидов, не разрушающиеся при изгибе или нагревании.
Такие пленки защищают металл от дальнейшего доступа к нему газов и жидкостей, и процесс коррозии резко замедляется. Оксидные пленки других металлов (например, Fe) представляют собой рыхлые, пористые, механически непрочные образования.
Они не предохраняют металл от доступа к нему газов и жидкостей. Поэтому такие металлы корродируют особенно быстро.
- Процесс химической коррозии Fe схематически можно представить следующими уравнениями:
- 2Fe + O2=2FeO
- 4Fe + 3O2 = 2Fe2O3
- 3Fe + 2O2 =FeO · Fe2O3
- 4Fe + 3O2 +6H2O=4Fe(OH)3
- Fe(OH)3=t H2O+FeOOH (ржавчина)
Однако наибольший вред приносит не химическая, а электрохимическая коррозия, связанная с переходом электронов от одних участков металла к другим. Химическая коррозия сопровождает электрохимическую и усиливает ее.
Сущность электрохимической коррозии
Металлы обычно содержат примеси других металлов и неметаллов.
При соприкосновении таких металлов с электролитом (которым может служить Н2О, адсорбированная из воздуха, поскольку в ней как правило имеются ионы растворенных веществ) на поверхности металла возникает множество микрогальванических пар. В этих парах атомы более активного металла (обычно Fe) играют роль анода, а атомы менее активного – роль катода.
На катоде идет процесс восстановления молекул О2 в нейтральной и щелочной средах, или ионов Н+ – в кислой среде.
На аноде происходит окисление атомов металла, из которых состоит анод, с образованием катионов Men+.
Последние переходят в электролит (растворение анода) и соединяются с ионами ОН–, с образованием гидроксида Me(OH)n и других продуктов. Называемых ржавчиной. В результате металл, играющий роль анода, разрушается.
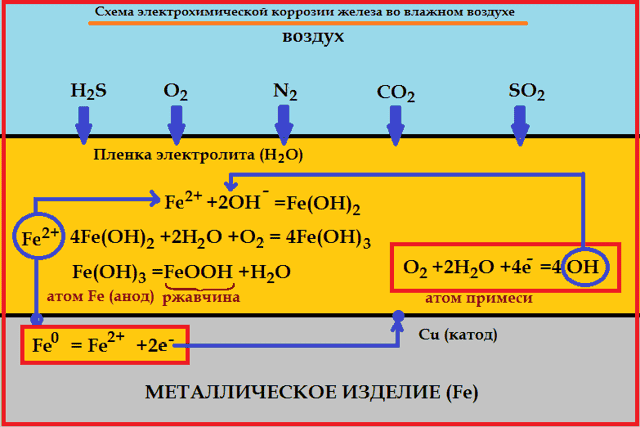
Скорость электрохимической коррозии тем больше, чем дальше друг от друга расположены металлы в ряду напряжений, и чем выше температура окружающей среды.
Чистые металлы устойчивы к коррозии.
Однако, так ка абсолютно чистым металлов нет, а также вследствие того, что гальваническая пара может быть образована отдельными участками одного и того же металла, находящимися в различных условиях (под разными электролитами или под одним и тем же электролитом разной концентрации), то электрохимическая коррозия имеет место всегда при соприкосновении металла с электролитом (атмосферной влагой).
Роль катода при электрохимической коррозии могут выполнять не только менее активные металлы, но и примеси неметаллов, способных принимать электроны.
Коррозия – процесс поверхностный и при отсутствии трещин внутри металла развиваться не может. Поэтому одним из способов защиты от коррозии является нанесение на поверхность металла металлических и неметаллических покрытий.
В качестве металлических покрытий используются пленки Au, Ag, Ni, Cr, Zn и других металлов, которые мало подвергаются коррозии из-за своей индифферентности или по причине образования прочных оксидных пленок. Некоторые из этих металлов (Au, Ag, Ni, Cr), помимо защитной, выполняют и эстетическую – придают изделиям приятный внешний вид.
Различают два вида металлических покрытий – анодное и катодное. Покрытие называется
- анодным, если оно изготовлено из металла более активного, чем защищаемый;
- катодным, если изготовлено из менее активного металла.
Примером анодных покрытий для изделий из железа являются пленки из Cr, Zn, примером катодных – пленки из Ni, Sn, Ag, Au. Катодные покрытия не защищают металлы в случае нарушения их целостности (трещины, царапины), так как при наличии электролита возникает гальваническая пара, роль растворимого анода в которой играет защищаемый металл.
Неметаллические покрытия также делятся на два вида: неорганические и органические. В качестве органических покрытий используются пленки лаков, красок, пластмасс, резины, битума, в качестве неорганических – эмали.
Протекторная защита заключается в соединении защищаемого изделия проводником с протектором – пластиной из более активного металла (Al, Mg, Zn). В процессе коррозии протектор служит анодом и разрушается, предохраняя от коррозии металлическое изделие или конструкцию.
Электрохимическая (катодная) защита заключается в соединении защищаемого изделия с катодом внешнего источника тока, вследствие чего изделие становится катодом. Анодом служит вспомогательный, обычно стальной, электрод (кусок металла), который и разрушается в процессе коррозии.
Метельский А.В. Источник: Метельский А.В., Химия в Экзаменационных вопросах и ответах, Минск, изд. «Беларуская энцыклапедыя», 1999 год Дата в источнике: 1999 год
Коррозия металлов. Виды коррозии металлов
- Материалы из металлов под химическим или электрохимическим воздействием окружающей среды подвергаются разрушению, которое называется коррозией.
- Коррозия металлов вызывается окислительно-восстановительными реакциями, в результате которых металлы переходят в окисленную форму и теряют свои свойства, что приводит в негодность металлические материалы.
- Можно выделить 3 признака, характеризующих коррозию:
- Коррозия – это с химической точки зрения процесс окислительно-восстановительный.
- Коррозия – это самопроизвольный процесс, возникающий по причине неустойчивости термодинамической системы металл – компоненты окружающей среды.
- Коррозия – это процесс, который развивается в основном на поверхности металла. Однако, не исключено, что коррозия может проникнуть и вглубь металла.
Наиболее часто встречаются следующие виды коррозии металлов:
- Равномерная – охватывает всю поверхность равномерно
- Неравномерная
- Избирательная
- Местная пятнами – корродируют отдельные участки поверхности
- Язвенная (или питтинг)
- Точечная
- Межкристаллитная – распространяется вдоль границ кристалла металла
- Растрескивающая
- Подповерхностная
Основные виды коррозии металлов
С точки зрения механизма коррозионного процесса можно выделить два основных типа коррозии: химическую и электрохимическую.
Химическая коррозия металлов — это результат протекания таких химических реакций, в которых после разрушения металлической связи, атомы металла и атомы, входящие в состав окислителей, образуют химическую связь.
Электрический ток между отдельными участками поверхности металла в этом случае не возникает. Такой тип коррозии присущ средам, которые не способны проводить электрический ток – это газы, жидкие неэлектролиты.
Виды химической коррозии
Химическая коррозия металлов бывает газовой и жидкостной.
Газовая коррозия металлов – это результат действия агрессивных газовых или паровых сред на металл при высоких температурах, при отсутствии конденсации влаги на поверхности металла.
Это, например, кислород, диоксид серы, сероводород, пары воды, галогены.
Такая коррозия в одних случаях может привести к полному разрушению металла (если металл активный), а в других случаях на его поверхности может образоваться защитная пленка (например, алюминий, хром, цирконий).
Жидкостная коррозия металлов– может протекать в таких неэлектролитах, как нефть, смазочные масла, керосин и др. Этот тип коррозии при наличии даже небольшого количества влаги, может легко приобрести электрохимический характер.
При химической коррозии скорость разрушения металла пропорциональна скорости химической реакции и той скорости с которой окислитель проникает сквозь пленку оксида металла, покрывающую его поверхность. Оксидные пленки металлов могут проявлять или не проявлять защитные свойства, что определяется сплошностью.
Фактор Пиллинга-Бэдворса
- Сплошность такой пленки оценивают величине фактора Пиллинга—Бэдвордса: (α = Vок/VМе) по отношению объема образовавшегося оксида или другого какого-либо соединения к объему израсходованного на образование этого оксида металла
- α = Vок/VМе = Мок·ρМе/(n·AMe·ρок),
- где Vок — объем образовавшегося оксида
- VМе — объем металла, израсходованный на образование оксида
- Мок – молярная масса образовавшегося оксида
- ρМе – плотность металла
- n – число атомов металла
- AMe — атомная масса металла
- ρок — плотность образовавшегося оксида
Оксидные пленки, у которых α < 1, не являются сплошными и сквозь них кислород легко проникает к поверхности металла. Такие пленки не защищают металл от коррозии. Они образуются при окислении кислородом щелочных и щелочно-земельных металлов (исключая бериллий).
- Оксидные пленки, у которых 1 < α < 2,5 являются сплошными и способны защитить металл от коррозии.
- При значениях α > 2,5 условие сплошности уже не соблюдается, вследствие чего такие пленки не защищают металл от разрушения.
- Ниже представлены значения сплошности α для некоторых оксидов металлов
| Металл | Оксид | α | Металл | Оксид | α |
| K | K2O | 0,45 | Zn | ZnO | 1,55 |
| Na | Na2O | 0,55 | Ag | Ag2O | 1,58 |
| Li | Li2O | 0,59 | Zr | ZrO2 | 1.60 |
| Ca | CaO | 0,63 | Ni | NiO | 1,65 |
| Sr | SrO | 0,66 | Be | BeO | 1,67 |
| Ba | BaO | 0,73 | Cu | Cu2O | 1,67 |
| Mg | MgO | 0,79 | Cu | CuO | 1,74 |
| Pb | PbO | 1,15 | Ti | Ti2O3 | 1,76 |
| Cd | CdO | 1,21 | Cr | Cr2O3 | 2,07 |
| Al | Al2O2 | 1,28 | Fe | Fe2O3 | 2,14 |
| Sn | SnO2 | 1,33 | W | WO3 | 3,35 |
| Ni | NiO | 1,52 |
Электрохимическая коррозия металлов – это процесс разрушения металлов в среде различных электролитов, который сопровождается возникновением внутри системы электрического тока.
При таком типе коррозии атом удаляется из кристаллической решетки результате двух сопряженных процессов:
- Анодного – металл в виде ионов переходит в раствор.
- Катодного – образовавшиеся при анодном процессе электроны, связываются деполяризатором (вещество — окислитель).
- Сам процесс отвода электронов с катодных участков называется деполяризацией, а вещества способствующие отводу – деполяризаторами.
- Наибольшее распространение имеет коррозия металлов с водородной и кислородной деполяризацией.
- Водородная деполяризация
- Водородная деполяризация осуществляется на катоде при электрохимической коррозии в кислой среде:
- 2H++2e— = H2 разряд водородных ионов
- 2H3O++2e— = H2 + 2H2O
- Кислородная деполяризация
- Кислородная деполяризация осуществляется на катоде при электрохимической коррозии в нейтральной среде:
- O2 + 4H++4e— = H2O восстановление растворенного кислорода
- O2 + 2H2O + 4e— = 4OH—
- Все металлы, по их отношению к электрохимической коррозии, можно разбить на 4 группы, которые определяются величинами их стандартных электродных потенциалов:
- Активные металлы (высокая термодинамическая нестабильность) – это все металлы, находящиеся в интервале щелочные металлы — кадмий (Е0 = -0,4 В). Их коррозия возможна даже в нейтральных водных средах, в которых отсутствуют кислород или другие окислители.
- Металлы средней активности (термодинамическая нестабильность) – располагаются между кадмием и водородом (Е0 = 0,0 В). В нейтральных средах, в отсутствии кислорода, не корродируют, но подвергаются коррозии в кислых средах.
- Малоактивные металлы (промежуточная термодинамическая стабильность) – находятся между водородом и родием (Е0 = +0,8 В). Они устойчивы к коррозии в нейтральных и кислых средах, в которых отсутствует кислород или другие окислители.
- Благородные металлы (высокая термодинамическая стабильность) – золото, платина, иридий, палладий. Могут подвергаться коррозии лишь в кислых средах при наличии в них сильных окислителей.
Виды электрохимической коррозии
Электрохимическая коррозия может протекать в различных средах. В зависимости от характера среды выделяют следующие виды электрохимической коррозии:
- Коррозия в растворах электролитов — в растворах кислот, оснований, солей, в природной воде.
- Атмосферная коррозия – в атмосферных условиях и в среде любого влажного газа. Это самый распространенный вид коррозии.
- Например, при взаимодействии железа с компонентами окружающей среды, некоторые его участки служат анодом, где происходит окисление железа, а другие – катодом, где происходит восстановление кислорода:
- А: Fe – 2e— = Fe2+
- K: O2 + 4H+ + 4e— = 2H2O
- Катодом является та поверхность, где больше приток кислорода.
- Почвенная коррозия – в зависимости от состава почв, а также ее аэрации, коррозия может протекать более или менее интенсивно. Кислые почвы наиболее агрессивны, а песчаные – наименее.
- Аэрационная коррозия — возникает при неравномерном доступе воздуха к различным частям материала.
- Морская коррозия – протекает в морской воде, в связи с наличием в ней растворенных солей, газов и органических веществ.
- Биокоррозия – возникает в результате жизнедеятельности бактерий и других организмов, вырабатывающих такие газы как CO2, H2S и др., способствующие коррозии металла.
- Электрокоррозия – происходит под действием блуждающих токов на подземных сооружениях, в результате работ электрических железных дорог, трамвайных линий и других агрегатов.
Основной способ защиты от коррозии металла – это создание защитных покрытий – металлических, неметаллических или химических.
Металлическое покрытие наносится на металл, который нужно защитить от коррозии, слоем другого металла, устойчивого к коррозии в тех же условиях.
Если металлическое покрытие изготовлено из металла с более отрицательным потенциалом (более активный) , чем защищаемый, то оно называется анодным покрытием.
Если металлическое покрытие изготовлено из металла с более положительным потенциалом (менее активный), чем защищаемый, то оно называется катодным покрытием.
Например, при нанесении слоя цинка на железо, при нарушении целостности покрытия, цинк выступает в качестве анода и будет разрушаться, а железо защищено до тех пор, пока не израсходуется весь цинк. Цинковое покрытие является в данном случае анодным.
Катодным покрытием для защиты железа, может, например, быть медь или никель. При нарушении целостности такого покрытия, разрушается защищаемый металл.
Такие покрытия могут быть неорганические (цементный раствор, стекловидная масса) и органические (высокомолекулярные соединения, лаки, краски, битум).
Химические покрытия
- В этом случае защищаемый металл подвергают химической обработке с целью образования на поверхности пленки его соединения, устойчивой к коррозии. Сюда относятся:
- оксидирование – получение устойчивых оксидных пленок (Al2O3, ZnO и др.
);
- фосфатирование – получение защитной пленки фосфатов (Fe3(PO4)2, Mn3(PO4)2);
- азотирование – поверхность металла (стали) насыщают азотом;
- воронение стали – поверхность металла взаимодействует с органическими веществами;
- цементация – получение на поверхности металла его соединения с углеродом.
Изменение состава технического металла также способствует повышению стойкости металла к коррозии. В этом случае в металл вводят такие соединения, которые увеличивают его коррозионную стойкость.
Изменение состава коррозионной среды (введение ингибиторов коррозии или удаление примесей из окружающей среды) тоже является средством защиты металла от коррозии.
Электрохимическая защита
Электрохимическая защита основывается на присоединении защищаемого сооружения катоду внешнего источника постоянного тока, в результате чего оно становится катодом. Анодом служит металлический лом, который разрушаясь, защищает сооружение от коррозии.
Протекторная защита – один из видов электрохимической защиты – заключается в следующем.
К защищаемому сооружению присоединяют пластины более активного металла, который называется протектором. Протектор – металл с более отрицательным потенциалом – является анодом, а защищаемое сооружение – катодом. Соединение протектора и защищаемого сооружения проводником тока, приводит к разрушению протектора.
Примеры задач с решениями на определение защитных свойств оксидных пленок, определение коррозионной стойкости металлов, а также уравнения реакций, протекающих при электрохимической коррозии металлов приведены в разделе Задачи к разделу Коррозия металлов