- Коррозия металлов — задачи с решениями и примерами
- Задача 75
- Задача 76
- Задача 77
- Задача 78
- Задача 79
- Задача 80
- Гдз учебник по химии 7 класс габриелян. практическая работа №6 номер 1
- Подробнее о работе:
- Оглавление
- Введение
- Коррозия
- Методическая разработка открытого урока по теме «Коррозия металлов и способы защиты от нее» | Химия | СОВРЕМЕННЫЙ УРОК

- Направление:Химия
- Выполнил: Турежанов А. 9д класс
- ОСШ №4 г.Акс ая
- Научный руководитель:Абдикаликова Гулмира Кереевна


- Выяснить, что влияет на коррозию железа
- Узнать, в каких средах металл корродирует быстрее Продолжить формировать навыки работы с реактивами и лабораторным оборудованием Продолжить учиться наблюдать, обобщать, делать выводы Продолжить учиться оформлять работы в виде докладов и компьютерных презентаций
- Узнать, в каких средах металл корродирует быстрее
- Продолжить формировать навыки работы с реактивами и лабораторным оборудованием
- Продолжить учиться наблюдать, обобщать, делать выводы
- Продолжить учиться оформлять работы в виде докладов и компьютерных презентаций

- 1. Введение
- 2. Коррозия металлов
- 3.Классификация видов коррозии
- 4.Сущность процессов коррозии
- 5. Борьба с коррозией
- 6. Экономический ущерб от коррозий
- 7. Практическая часть исследования
- 8. Выводы и предложения

Корро́зия (от лат. corrosio — разъедание) — это самопроизвольное разрушение металлов в результате химического или физико-химического взаимодействия с окружающей средой.
Кислородная коррозия железа в воде: 4Fe + 2Н 2 О + ЗО 2 = 2(Fe 2 O 3 +Н 2 О)

- газовая коррозия;
- атмосферная коррозия;
- коррозия в неэлектролитах;
- коррозия в электролитах;
- подземная коррозия;
- биокоррозия;
- коррозия под воздействием блуждающих токов .

Химическая коррозия — разрушение металла в результате химического взаимодействия металла с агрессивной (коррозионно-активной)средой. Например, образование окалины при взаимодействии материалов на основе железа при высокой температуре с кислородом:
4Fe + 3O 2 → 2Fe 2 O 3

- Из жизненного опыта мы знаем, что предметы, сделанные из железа, окисляются во влажном воздухе и ржавеют:
- Fe — 2ē Fe 2+
- Кислород является окислителем:
- 4Fe + 6Н 2 О + ЗО 2 = 4Fe(OH) 3
- Гидроксид железа ( ІІІ )присоединяет молекулы воды и образует бурое вещество:
- Fe(OH) 3 +xH 2 O- Fe(OH) 3 * xH 2 O
- Образовавшееся вещество- это и есть ржавчина, состав её постоянно меняется.


Разрушение металла под воздействием возникающих в коррозионной среде гальванических элементов называют электрохимической коррозией. При электрохимической коррозии (наиболее частая форма коррозии) всегда требуется наличие электролита (Конденсат, дождевая вода и т. д.) как, например, при ржавлении железа во влажной атмосфере:
4Fe + 3O 2 + 6H 2 O → 4FeO(OH)•H 2 O
- Замена металлов новыми конструкционными материалами
- Защита от коррозии
- Нанесение защитных покрытий:
- А) неметаллических
- Б) металлических
- Создание сплавов с антикоррозийными свойствами
- Электро – химические способы защиты
Газотермическое напыление – это процесс нагрева и переноса конденсированных частиц распыляемого материала газовым или плазменным потоком для формирования нужного материала. Распыление с помощью плазмы обычно называют газопламенным напылением . Электродуговое напыление энергетически более выгодно, однако позволяет напылять только металлические материалы.
- Каждый школьник знает, что серная кислота взаимодействует с железом в соответствии с уравнением
- Fe + H2SO 4 = FeSO 4 + H 2
- Несколько иначе идет реакция железа с HNO 3 :
- Fe + 4HNO 3 = Fe(NO 3 ) 3 + NO + 2H 2 O
Вероятно, многие обратили внимание на то, что серную и азотную кислоты перевозят по железной дороге в стальных цистернах. Об этом свидетельствуют надписи, например «Осторожно, серная кислота».
Как это согласуется с теми знаниями, которые отражены в школьных учебниках? Все дело в том, что по железной дороге перевозят не разбавленные, а концентрированные кислоты.
Зачем же перевозить воду? Разбавить кислоту можно и на месте потребления.
Оказывается, что в отличие от разбавленных концентрированная серная, так же как и концентрированная азотная кислоты, не взаимодействует с железом. Правильнее сказать, что кратковременное взаимодействие происходит, но оно быстро прекращается, потому что в крепких растворах этих кислот железо пассивируется.
Ингибиторы – это вещества, способные в малых количествах замедлять протекание химических процессов или останавливать их. Название ингибитор происходит от лат. inhibere, что означает сдерживать, останавливать. Ингибиторы взаимодействуют с промежуточными продуктами реакции или с активными центрами, на которых протекают химические превращения.
Одним из наиболее простых ингибиторов атмосферной коррозии металлов является нитрит натрия NaNO 2 .
На месторождениях и Карачаганак существует потенциальная возможность коррозионного разрушения оборудования под воздействием агрессивных сред со скоростями, соответственно: 4 и 3 мм/год, обусловленная высоким содержанием в продукции сероводорода, двуокиси углерода, серы и большими рабочими нагрузками, возникающими в элементах конструкций.
Для зашиты конструкций разработаны синтезированные на основе амидоаминов, имидазолинов и аминосолей ингибиторы коррозии: Нефтехим-1, Нефтехим-2, Нефтехим-3 эффективность которых подтверждена результатами лабораторных и промысловых испытаний, многолетней практикой их применения на промыслах. Скорость коррозии при использовании данных ингибиторов составляет 0,014…
0,042 мм/год при допустимой норме — 0,15 мм/год.
В настоящее время ингибитор Нефтехим-1 выпускается по ТУ 2415-001-0015181694 Стерлитамакским ЗАО «Каустик», Нефтехим-3 — по ТУ-38 УССР 201.479.89, г.
На месторождении Карачаганак ингибиторы применяются с 1997 года.
Как сделать машины и трубы долговечнее?
Российские учёные научились эффективно бороться с коррозией. Новые технологии теперь позволяют выпускать металл, который будет служить на порядок дольше современных образцов. Люди науки говорят, что они свою задачу почти выполнили. Теперь дело за производителями. Некоторые крупные предприятия уже сегодня используют в производстве разработки российских учёных.
Новое покрытие, созданное на основе нанотехнологий, защищает металл от вредного воздействия окружающей среды в десятки раз лучше, чем, например, обычная полимерная краска. Плёнка, которая покрывает металл, настолько тонкая, что её не увидишь невооруженным глазом. В лабораториях Института физической химии и электрохимии молодые учёные продолжают исследовать свойства новых материалов.
Экономические потери от коррозии металлов огромны. В США по последним данным NACE ущерб от коррозии и затраты на борьбу с ней составили 3,1 % от ВВП (276 млрд долларов). В Германии этот ущерб составил 2,8 % от ВВП.
По оценкам специалистов различных стран эти потери в промышленно развитых странах составляют от 2 до 4 % валового национального продукта.
При этом потери металла, включающие массу вышедших из строя металлических конструкций, изделий, оборудования, составляют от 10 до 20 % годового производства стали.
В России за год производят проката из черныхметаллов около 47 миллионов тонн. По данным Института физической химии РАН, каждая шестая домна работает «впустую»: коррозия съедает до 10 процентовпроизводимого металла. В денежном выражении потери составляют сотни миллионов рублей. Государство терпит огромные убытки, что, естественно,отрицательно влияет на экономические показатели страны.
Первую пробирку с водой плотно закроем и опустим в сосуд с водой горлышком вниз. Следующие три пробирки наполним раствором поваренной соли и опустим горлышком вниз в сосуды с водой. В последнюю пробирку нальём растворы поваренной соли, гидроксида натрия и опустим в пятый сосуд.
В каждую пробирку поместим одинаковые по размеру железные гвозди. Железный гвоздь в третьей пробирке обернём медной, а в четвёртой- цинковой проволокой. Из специального аппарата пропустим кислород так, чтобы он вытеснил воду и растворы солей из пробирок.
Во всех пробирках есть корродируемое железо и окисляющие его вещества- вода и кислород. Цель данного опыта- наблюдение за тем, как происходит коррозия железа в растворе соли, смеси растворов поваренной соли и гидроксида натрия, при соприкосновении железа с цинковой и медной проволоками.
В том, что коррозия происходит, можно убедиться по тому , как вода поднимается в пробирку вместо кислорода, а также по количеству образовавшегося осадка.
Сравнив первую и вторую пробирки, можно увидеть, что во второй пробирке уровень воды поднялся более высоко, образовалось большее количество осадка, следовательно, произошла сильная коррозия. Раствор поваренной соли(т.е. хлорид- ионы)ускоряет коррозию железа.
Этим объясняется то, что погружение в морскую воду часто судов быстрее других подвергается коррозий. Процесс коррозий ускоряет также другие ионы, находящиеся в морской воде.
Сравним вторую и пятую пробирки. В пятой пробирке коррозия не произошла, так как здесь имеются ионы OH — , которые ее замедляют.
- В результате эксперимента мы доказали, коррозия железа происходит во влажной среде
- В результате эксперимента мы доказали, коррозия железа происходит во влажной среде
- Быстро, если металл непосредственно соприкасается с жидкостью
- Интенсивно, если металл находится в растворе соли содержащей катион менее активного металла Если металл соприкасается с более активным металлом, то коррозия его замедляется (например железо с цинком) Если металл соприкасается с менее активным металлом, то коррозия его усиливается (например железо с медью)
- Интенсивно, если металл находится в растворе соли содержащей катион менее активного металла
- Если металл соприкасается с более активным металлом, то коррозия его замедляется (например железо с цинком)
- Если металл соприкасается с менее активным металлом, то коррозия его усиливается (например железо с медью)
- В две пробирки налить по нескольку мл воды, добавить в каждую из них 1- 2 мл раствора серной кислоты и несколько капелл красной кровяной соли К 3 ( Fe ( CN ) 6 ).
- В одну пробирку опустить канцелярскую скрепку, в которой зажат кусочек цинка, в другую- скрепку с кусочком олова. В одной из пробирок (там где было олово) раствор синеет: в этой
- пробирке идет разрушение железа (скрепки), так как образуется гальваническая пара Fe — Sn , в которой более активный металлом является железо; в другой пробирке раствор остаётся бесцветным, так как в гальванической паре Zn — Fe более активным является цинк, он разрушается, предохраняя железную скрепку.
В случае анодного покрытия при нарушении поверхностного слоя возникает гальваническая пара Zn — Fe , в которой разрушается более активный металл ( Zn ). В случае катодного покрытия при нарушений поверхностного слоя возникает гальваническая пара Sn — Fe , в которой первым разрушается железо. Поэтому анодное
покрытие более долговечно, чем катодное хотя последнее широко распространено в декоративных целях.
Разрушение металлов и сплавов можно применить как один из способов борьбы с космическим мусором.
Одним из направлений может быть ее применение для разрушения конструкций в труднодоступных местах .
Если бы железо, подобно серебру и золоту, не ржавело, то мы не существовали бы, и ни одно растение не зеленело бы на Земле. Растворённая в воде ржавчина составляет часть пищи растений и придаёт им зеленый цвет. Та же «ржавчина» снабжает железом нашу кровь и придаёт ей красный
11
Коррозия –это процесс произвольного разрушения металла при котором он становиться непригодным. Такой металл вторично обрабатывается при этом не теряя своих свойств. Лишь химически чистые металлы не подвергаются коррозий, а также благородные металлы (золото, серебро, платина и металлы платиновой группы (иридий, осмий, палладий, родий, рутений).
Ежегодно в мире ¼ произведённого Fe теряется из-за коррозий. Для замедления процесса ржавления применяют многие средства такие как: хромирование, никелирование, покраска, покрытие оловом, смешивание с благородными металлами и т.д.
Для сред с аномально высоким содержанием сероводорода и двуокиси углерода нужно применять наиболее эффективные ингибиторы и по возможности применять нанотехнологий.
Шлугeр М. А., Ажогин Ф. Ф., Ефимов М. А., Коррозия и зашита металлов, М., 1981; Коррозия. Справочник, под ред. Л. Л. Шрайера, пер. с англ., М.. 1981; Кeшe Г., Коррозия металлов, пер. с нем., М., 1984; Колотыркин Я. М., Металл и коррозия, М., 1985; Томашов Н. Д.. Чернова Г. П., Теория коррозии и коррозионно-стойкие конструкционные сплавы. М.. 1986. Л. И. Фрейман.
Коррозия металлов — задачи с решениями и примерами
Решение:
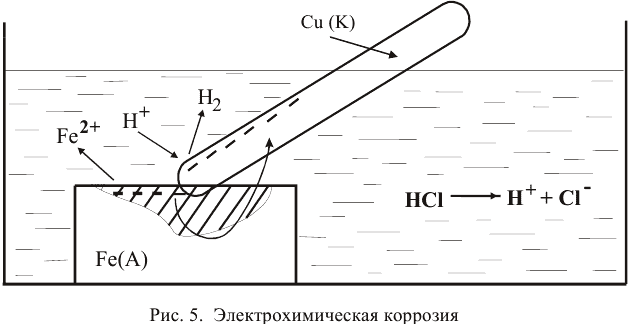
При касании железа медью образуется короткозамкнутый гальванический элемент, состоящий из железного и медного электродов, загруженных в раствор электролита. Медный электрод играет роль катода, так как он имеет более высокий электродный потенциал. На катоде должен протекать процесс восстановления, а на аноде — железной пластине — процесс окисления:
Таким образом, железо продолжает растворяться, причем скорость электрохимического процесса выше, чем скорость обычного окислительно-восстановительного процесса.
На катоде происходит деполяризация, т.е. процесс восстановления каких-либо частиц, называемых деполяризатором, избытком электронов.
В кислой среде роль деполяризатора играют катионы водорода:
Таким образом, водород выделяется с поверхности меди, несмотря на отсутствие взаимодействия с ней. Продукт коррозии — . Процессы, происходящие при электрохимической коррозии, представлены на рис. 5.
Задача 75
Две пластинки — одна железная, а другая магниевая -погружены раздельно в разбавленную соляную кислоту. Что изменится, если соединить обе пластинки?
Решение:
При объединении пластин образуется короткозамкнутый гальванический элемент, и протекает электрохимическая коррозия. Магний, будучи более активным металлом, играет роль анода. На аноде происходит процесс окисления:
На катоде — железной пластинке — будет происходить водородная деполяризация:
Таким образом, при соприкосновении двух пластин наблюдается усиление выделения водорода с поверхности железа, хотя разрушение железа резко уменьшается, а активизируется процесс разрушения магниевой пластины. Выделение водорода с поверхности магния резко сокращается.
Задача 76
Кладут в один стакан, содержащий солевой раствор, кусочек чистого железа, а в другой стакан, содержащий такой же солевой раствор, — кусочек железа, соединенный с кусочком свинца. В оба стакана есть доступ кислороду воздуха. Через несколько дней определяют содержание ионов железа в обоих стаканах. В каком из стаканов концентрация ионов железа будет больше ?
Решение:
Кислород растворяется в водном растворе. Железо, погруженное в солевой раствор, в присутствии растворенного кислорода будет подвергаться коррозии, хотя и медленно, так как оно чистое, а чистые металлы медленно корродируют (обычно присутствие примесей в железе (чугуне) резко увеличивает скорость коррозии).
Процесс коррозии чистого железа может быть представлен следующей схемой:
где , — один из компонентов ржавчины.
Железо в контакте с менее активным свинцом играет роль анода и подвергается электрохимической коррозии с кислородной деполяризацией на свинцовом катоде:
легко окисляется до . Таким образом, продуктом коррозии является :
Скорость электрохимической коррозии намного выше скорости химической коррозии, поэтому в стакане, содержащем железо, соединенное со свинцом, концентрация ионов железа будет выше, чем в стакане с чистым железом.
Задача 77
- Описать процессы электрохимической коррозии, протекающие на оцинкованном железе при наличии трещин в защитном слое:
- а) в кислой среде;
- б) в нейтральной среде в присутствии кислорода.
- Решение:
- Покрытие железа цинком относится к анодным покрытиям, так как металл покрытия более активный, чем защищаемый металл, а значит, в случае протекания электрохимической коррозии он играет роль анода.
В кислой среде на поверхности катода, т.е. на поверхности железа, протекает водородная деполяризация (рис.6):
В нейтральной среде в присутствии кислорода на поверхности катода (железа) протекает кислородная деполяризация (рис.7):
Продукт коррозии, образующийся по реакции
— гидроксид цинка.
Задача 78
- Описать процессы электрохимической коррозии,
- протекающей на хромированном железе при наличии трещин в защитном слое:
- а) в кислой среде;
- б) в нейтральной среде в присутствии кислорода.
- Решение:
- Покрытие железа хромом относится к катодным покрытиям, так как металл покрытия менее активный, чем защищаемый металл, а значит, в случае протекания электрохимической коррозии он играет роль катода.
Защищаемый металл играет роль анода, т.е. подвергается разрушению.
В кислой среде на поверхности катода, т.е. на поверхности хрома, протекает водородная деполяризация (рис.8):
В нейтральной среде в присутствии кислорода на поверхности катода (хрома) протекает кислородная деполяризация (рис.9):
Продукт коррозии, образующийся по реакции
на воздухе окисляется:
Задача 79
- Объяснить, почему в стальном сосуде застойная зона подвергается интенсивной коррозии (нейтральная среда в присутствии кислорода воздуха), тогда как в цинковом сосуде, наоборот, застойная зона подвергается коррозии в незначительной степени.
- Решение:
- Интенсивность (скорость) электрохимической коррозии зависит от ЭДС образующегося короткозамкнутого элемента: чем больше величина ЭДС, тем интенсивнее электрохимическая коррозия.
- Для электрохимической коррозии ЭДС рассчитывается аналогично расчету ЭДС гальванического элемента:
- где — электродный потенциал электродной полуреакции деполяризации;
- — электродный потенциал металла, подвергающегося разрушению.
- Для электродной полуреакции кислородной деполяризации
В зоне, подверженной воздействию кислорода, электродный потенциал катодных участков будет выше, чем в застойной зоне (концентрация кислорода в растворе находится в числителе).
Таким образом, в начальный момент ЭДС микрогальваноэлементов в зоне, подверженной воздействию кислорода, будет выше, чем ЭДС микрогальваноэлементов в застойной зоне, а значит, коррозия анодных участков в зонах, подверженных воздействию кислорода, будет значительной.
Эта коррозия в начальный момент приводит к накоплению анионов по реакции , а следовательно, к увеличению pH. Известно, что в щелочной среде железо пассивирует. Таким образом, в следующий момент коррозия в зонах, подверженных воздействию кислорода, прекращается, тогда как в застойных зонах (рис. 10) она продолжается. Вот почему застойные зоны стальных сосудов подвергаются интенсивной коррозии.
В сосуде из цинка коррозия зон, подверженных воздействию кислорода, всегда будет очень интенсивной, так как щелочная среда не пассивирует цинк, а наоборот, способствует его разрушению:
Поэтому застойная зона меньше подвергается коррозии, чем аэрируемая.
Задача 80
- Показать необходимыми расчетами, что платина в контакте с золотом никогда не подвергается электрохимической коррозии, тогда как медь в контакте в золотом подвергается электрохимической коррозии только в присутствии кислорода в щелочной среде.
- Решение:
- Для процесса кислородной деполяризации
электродный потенциал определяется по формуле Нернста:
В нейтральной среде
В щелочной среде
Для того, чтобы протекала электрохимическая коррозия, необходимо следующее:
Отсюда
Таким образом, электродный потенциал металла (анода) должен быть ниже 0 В в нейтральной среде или ниже 0,401 В в сильно щелочной среде (рН=14). Если находятся в контакте золото и платина, платина играет роль анода, но ее стандартный электродный потенциал .
Хотя в реальных условиях из-за низкой концентрации катионов платины электродный потенциал платины будет ниже, чем ее стандартный потенциал, однако он остается выше, чем 0,401 В, а значит, электрохимической коррозии с кислородной деполяризацией не будет.
- Медь в контакте с золотом может подвергаться электрохимической коррозии с кислородной деполяризацией, особенно в щелочной среде, так как , а это ниже 0,401 В.
- Остается показать отсутствие электрохимической коррозии с водородной деполяризацией для обоих случаев.
- Электродный потенциал водородной деполяризации выражается уравнением:
- В кислой среде
- В слабокислой среде
- Таким образом, металлы, имеющие электродный потенциал выше 0 В, в кислой среде не подвергаются электрохимической коррозии с водородной деполяризацией.
- Эти задачи взяты со страницы решения задач по неорганической химии:
- Задачи с решением по неорганической химии
- Возможно эти страницы вам будут полезны:
Гдз учебник по химии 7 класс габриелян. практическая работа №6 номер 1
Раздел:
Вам наверняка известен процесс коррозии (ржавления) железа. Под действием внешних условий на металле образуется ржавчина. В этой работе вы выясните, как влияют внешние условия на скорость коррозии железа.
Для проведения эксперимента вам понадобятся три пластиковые бутылки с крышками объемом 250—500 мл; три больших гвоздя длиной 5—10 см; мыло; наждачная бумага для зачистки гвоздей; кипяченая вода; водопроводная вода из−под крана; поваренная соль.
Гвозди нужно помыть с мылом, чтобы избавиться от слоя масла, который защищает их от ржавления.
Когда гвозди высохнут, зачистите их поверхность наждачной бумагой и промойте кипяченой водой.
Первую бутылку полностью заполните холодной кипяченой водой, положите туда гвоздь и плотно закройте крышкой.
Вторую бутылку заполните наполовину холодной водой из−под крана. Положите туда гвоздь. Крышкой бутылку закрывать не надо.
В третью бутылку сначала насыпьте две столовые ложки поваренной соли. Заполните ее наполовину холодной водой из−под крана, закройте крышкой и хорошо перемешайте. Когда вся соль растворится, поместите в бутылку третий гвоздь. Крышкой бутылку закрывать не надо.
Чтобы ничего не перепутать, с помощью фломастера пронумеруйте каждую бутылку.
Поставьте бутылки в укромное место. Если вода из второй и третьей бутылок будет испаряться, то просто доливайте в них воду из−под крана.
Если все сделано правильно, то через неделю на гвоздях должна образоваться ржавчина. Посмотрите, где ее больше, а где меньше.
Запишите свои наблюдения, расставив номера бутылок напротив соответствующих описаний, например:
ржавчины образовалось мало или ее практически не заметно;
ржавчина хорошо заметна, она крепко держится на гвозде;
ржавчины много, она не держится на гвозде, осыпается с него и образует на дне бутылки бурый осадок.
Сделайте выводы, как влияют на процесс коррозии состав раствора и доступ воздуха.
reshalka.com
Ход работы:
Гвозди помыл(а) с мылом, чтобы избавиться от слоя масла, который защищает их от ржавления. После высыхания гвоздей, зачистил(а) их поверхность наждачной бумагой и промыл(а) кипяченой водой.
Первую бутылку полностью заполнил(а) холодной кипяченой водой, положил(а) туда гвоздь и плотно закрыл(а) крышкой.
Вторую бутылку заполнил(а) наполовину холодной водой из−под крана и положил(а) туда гвоздь.
Крышкой бутылку не закрывал(а) В третью бутылку сначала насыпал(а) две столовые ложки поваренной соли, псоле чего заполнил(а) ее наполовину холодной водой из−под крана, закрыл(а) крышкой и хорошо перемешал(а).
Когда вся соль растворилась, поместил(а) в бутылку третий гвоздь, крышкой бутылку не закрывал(а).
Чтобы ничего не перепутать, с помощью фломастера пронумеровал(а) каждую бутылку.
Сосуд с кипяченой водой, герметично закупоренный − 1
Сосуд с водопроводной водой, открытый − 2
Сосуд с водопроводной водой, открытый, немного подсоленный − 3
Поставил(а) бутылки в укромное место.
Наблюдения:
Результаты работы по истечению недели:
Ржавчины образовалось мало или ее практически не заметно − сосуд номер 1
Ржавчина хорошо заметна, она крепко держится на гвозде − сосуд номер 2
Ржавчины много, она не держится на гвозде, осыпается с него и образует на дне бутылки бурый осадок − сосуд номер 3
Вывод:
В процессе работы над исследовательским проектом по физике «Коррозия металлов» учениками 8 класса была поставлена цель узнать, что такое коррозия, понять сущность данного процесса и его влияние на окружающий мир, попытаться выявить методы защиты металла от коррозии.
Подробнее о работе:
В исследовательской работе по физике «Коррозия металлов» изложена теоретическая информация об истории изучения коррозии металлов, изучены причины появления коррозии и рассмотрены ее виды, авторы также приводят практические советы по защите металлов от коррозии.
В предложенном проекте по физике «Коррозия металлов» авторами были проведены опыты с гвоздем, с помощью которых были выяснены причины и определены условия, при которых металл подвержен влиянию коррозии, а также проведено исследование по устранению коррозии с металлической поверхности подручными средствами.
Оглавление
Введение
1. История изучения коррозии металлов.
2. Причины и виды коррозии.
3. Методы защиты металлов от коррозии.
4. Получение эффекта коррозии (опыт с гвоздём).
5. Исследование способов защиты металла от коррозии.
- Заключение
- Приложения
Список используемой литературы
Введение
Люди издавна гадали:
Как металлы уберечь?
И теорию создали —
Вот о ней как раз и речь!
Окислительно-восстановительные процессы играют исключительно важную роль в современной технике. Например, получение электрической энергии с помощью химических источников тока, металлургические процессы, электролиз. Однако некоторые окислительно-восстановительные процессы приносят вред человечеству.
Одним из них является коррозия.
Коррозия разрушает различные наземные и подземные металлические сооружения, турбинные и ракетные двигатели, подводные части судов, паровые котлы, проложенные в земле трубопроводы, линии электропередач, железные дороги, нефтепроводы. В результате коррозии ухудшаются электрические и магнитные свойства металлов, изменяются размеры сделанных из них деталей, нарушается герметичность аппаратов.
Коррозионный процесс может полностью вывести из строя точные приборы — часы, аналитические весы и другие. Ежегодно потери металлов от коррозии составляют 10-15% от их выпуска и исчисляются миллиардами рублей.
Гибнет труд людей, затраченный на обработку металла и создание тех или иных машин и механизмов. Кроме того, снижается производительность и срок работы оборудования, повышается его аварийность, нарушаются технологические процессы.
В связи с этим исследование механизма процесса коррозии и разработка методов защиты от неё имеют больше значение.
Также мы обратили внимание, что ржавые изделия, детали, конструкции и прочие промышленные материалы встречаются и в повседневной жизни.
Так, нами был замечен эффект коррозии на автомобилях (приложение 1), металлических заборах (приложение 2), дорожных знаков (приложение 3).
Кроме того, мы наблюдали содержание ржавчины в водопроводной воде (приложение 4).
Проблемы коррозии постоянно обостряются из-за непрерывного роста производства металлов и ужесточения условий их эксплуатации.
Среда, в которой используются металлические конструкции, становится все более агрессивной, в том числе и за счет ее загрязнения .
Металлические изделия, используемые в технике, работают в условиях все более высоких температур и давлений, мощных потоков газов и жидкостей.
Поэтому вопросы защиты металлических материалов от коррозии становятся все более актуальными. Полностью предотвратить коррозию металлов невозможно, поэтому единственным путем борьбы с ней является поиск способов ее замедления. Поэтому, изучив процесс коррозии, условия его появления и последствия для окружающего мира, мы решили выяснить, как его можно предотвратить или замедлить.
- Цель работы: узнать, что такое коррозия, понять сущность данного процесса и влияние его на окружающий мир, и попытаться выявить методы защиты от коррозии.
- Гипотеза: если изучить процессы коррозии и разобраться в причинах её возникновения, то данное явления можно предотвратить и взять под контроль.
- Задачи:
- Ознакомиться с историей открытия и исследования коррозии.
- Изучить виды коррозии и причины ее возникновения.
- Провести ряд опыты по наблюдению появления ржавчины и способам защиты от неё.
Для решения поставленных задач были использованы следующие методы исследования:
- наблюдение
- изучение и обобщение
- эксперимент
- анализ
- фото- и видеосъемка
Перейти к разделу: 2. Коррозия металов
Коррозия
Коррозия металлов — чаще всего это окисление металла, например, кислородом воздуха или кислотами, содержащимися в растворах, с которыми контактирует металл. Особенно подвержены этому металлы, расположенные в ряду напряжений (ряду активности) левее водорода, в том числе железо.
Коррозия — это процесс самопроизвольного разрушения металлов вследствие химического или электрохимического их взаимодействия с окружающей средой. Для процесса коррозии следует применять термин «коррозионный процесс», а для результата процесса — «коррозионное разрушение».
Такое разрушение происходит под влияние кислорода воздуха, влаги, оксидов серы, азота и других химически активных веществ. Самое известное проявление коррозии — ржавчина на поверхности стальных и чугунных изделий.
Коррозии подвержены не только металлы и их сплавы, но и строительные материалы, в частности бетон.
Коррозийные разрушения бывают сплошными и местными, равномерными и неравномерными. Особенно опасна межкристаллическая коррозия, которая, не разрушая металл с поверхности, распространяется вглубь по границам составляющим металл частиц — кристаллитов.
Коррозия может быть вызвана как химическим, так и электрохимическим процессом. Соответственно, различают химическую и электрохимическую коррозию металлов.
В результате коррозии железо ржавеет. Этот процесс очень сложен и включает несколько стадий. Его можно описать суммарным уравнением:
4Fe+3 + 6H2+O-2(влага) + 3O2-2 (воздух) = 4Fe+3(OH)3-
Гидроксид железа (III) очень неустойчив, быстро теряет воду и превращается в оксид железа (III). Это соединение не защищает поверхность железа от дальнейшего окисления. В результате железный предмет может быть полностью разрушен.
Многие металлы, в том числе и довольно активные (например, алюминий) при коррозии покрываются плотной, хорошо скрепленной с металлами оксидной пленкой, которая не позволяет окислителям проникнуть в более глубокие слои и потому предохраняет металл от коррозии. При удалении этой пленки металл начинает взаимодействовать с влагой и кислородом воздуха.
- Алюминий в обычных условиях устойчив к воздействию воздуха и воды, даже кипящей, однако если на поверхность алюминия нанести ртуть, то образующаяся амальгама разрушает оксидную пленку — выталкивает ее с поверхности, и металл быстро превращается в белые хлопья метагидроксида алюминия:
- 4Al+3+ 2H2O-2 + 3O2-2 = 4Al+3O-2(OH)-
- Амальгамированный алюминий взаимодействует с водой с выделением водорода:
- 2Al+3 + 4H2+O-2 = 2Al+3O-2(OH)- + 3H2+
Коррозии подвергаются и некоторые малоактивные металлы. Во влажном воздухе поверхность меди покрывается зеленоватым налетом (патиной) в результате образования смеси основных солей.
Иногда при коррозии металлов происходит не окисление, а восстановление некоторых элементов, содержащихся в сплавах. Например, при высоких давлениях и температурах карбиды, содержащиеся в сталях, восстанавливаются водородом.
К коррозии металлов можно отнести также их растворение в жидких расплавленных металлах (натрий, свинец, висмут), которые используются, в частности, в качестве теплоносителей в ядерных реакторах.
При одновременном воздействии на металл внешней среды и механических напряжений все коррозионные процессы активизируются, поскольку при этом понижается термическая устойчивость металла, нарушаются оксидные пленки на поверхности металла, усиливаются электрохимические процессы в местах появления трещин и неоднородностей.
Методическая разработка открытого урока по теме «Коррозия металлов и способы защиты от нее» | Химия | СОВРЕМЕННЫЙ УРОК
- Фадеева Марина Михайловна
- Организация: ГАПОУ УТЭК
- Населенный пункт: Республика Башкортостан, г. Уфа
- Пояснительная записка
Металлы составляют одну из основ цивилизации на планете Земля. Их широкое внедрение в промышленное строительство и транспорт произошло на рубеже XVIII-XIX веков.
В XXI веке высокие темпы развития промышленности, интенсификация производственных процессов, повышение основных технологических параметров (температура, давление, концентрация реагирующих средств и др.
) предъявляют высокие требования к надежной эксплуатации технологического оборудования и строительных конструкций.
Особое место в комплексе мероприятий по обеспечению бесперебойной эксплуатации оборудования отводится надежной защите его от коррозии и применению в связи с этим высококачественных химически стойких материалов.
Основной ущерб от коррозии металла связан не только с потерей больших количеств металла, но и с порчей или выходом из строя самих металлических конструкций, так как вследствие коррозии они теряют необходимую прочность, пластичность, герметичность, тепло и электропроводность, отражательную способность и другие необходимые качества. Поэтому коррозия является одной из важнейших проблем, имеющей большое практическое значение.
- Данная методическая разработка урока предназначена для преподавателей первых курсов средних специальных учебных заведений.
- Цель – сформировать понятие о коррозии металлов, рассмотреть классификацию коррозионных процессов, способы защиты металлов от коррозии.
- Задачи – воспитывать осознанное отношение к приобретению знаний, прививать интерес к дисциплине химия; а так же к будущей профессии.
- Методическая карта урока
- Дисциплина: Химия
- Преподаватель: Фадеева Марина Михайловна
Дата: 11.02.2020г.
- Группа 1 Т
- Тема занятия: «Коррозия металлов и способы ее устранения»
- Тип занятия: изучение нового материала
- Цель занятия: сформировать понятие о коррозии металлов, рассмотреть классификацию коррозионных процессов, способы защиты металлов от коррозии.
- Задачи занятия:
- сформировать понятие о коррозии металлов
- рассмотреть классификацию коррозионных процессов
- познакомить со способами защиты металлов от коррозии
- формировать навыки овладения различными социальными ролями в коллективе через исследовательскую деятельность
- формировать навыки работы в группе
- вырабатывать личностные качества обучающихся: самостоятельность, ответственность, инициативность, точность
- воспитывать осознанное отношение к приобретению знаний
- прививать интерес к будущей профессии
- развивать умение сравнивать, обобщать, делать самостоятельные выводы, работать в группах
- формировать логическое, образное мышление
- активизировать познавательную деятельность
- развивать навыки самостоятельной работы с литературой.
Формируемые компетенции
ОК 1. Социально-личностные
- умение управлять своим временем и планировать, организовывать свою деятельность
- умение строить межличностные отношения и работать в группе
ОК 2. Инструментальные
- умение использовать современные информационные технологии для получения, хранения и обработки информации.
ОК 3. Системные
- Способность работать самостоятельно
- Способность к личностным коммуникациям
ОК 4. Профессиональные
- формирование профессиональных компетенций на уроке посредством связи материала с выбранной профессией «Технология воды, топлива и смазочных материалов на электрических станциях» на примере исследования качественного состава воды, почвы.
Методы обучения:
- словесный (рассказ, объяснение, беседа)
- наглядный
- информационно-коммуникативный ( видеофрагмент, презентация)
- частично-поисковый (проблемная ситуация)
- рефлексивный
Организация деятельности на занятии:
- групповая
- работа с источниками
- индивидуальная
Оснащение урока:
- мультимедийный проектор, компьютер
- презентация к уроку
- NaOH, NaCl, HCl, H2SO4, красная кровяная соль К3(Fe(CN)6), медная проволока, цинк, железные гвозди, пробирки.
Учебно-техническая документация
- Учебное пособие, тексты для самостоятельной работы
- Карточки-задания для самостоятельной работы
- таблица «Электрохимический ряд напряжения металлов»
- Кроссворд
Приборы и реактивы
План занятия
- Организационный момент
- Вступительное слово преподавателя (демонстрация видеоролика). Совместное формулирование темы урока
-
Изучение новой темы
- Введение понятия «коррозия» (рассказ с элементами беседы, демонстрация опыта)
- Виды коррозии (рассказ, просмотр видеоролика, беседа)
- Виды коррозии по механизму возникновения и ее сущности (самостоятельная работа в группах, составление схемы и ответы на вопросы)
- Сообщения студентов по итогам работы в группах у доски
- Влияние на процесс коррозии различных сред (демонстрация опыта, наблюдение, гипотезы, выводы)
- Способы защиты от коррозии (рассказ с элементами беседы)
-
Закрепление изученного материала
- Беседа
- Формулирование выводов
- Оценивание учащихся
- Рефлексия
- Выдача домашнего задания
Ход занятия
- Организационный момент
- Вступительное слово преподавателя. Совместное формулирование темы урока
- Сегодня нам предстоит познакомиться с давним и очень опасным врагом большинства применяемых в технике и быту металлов. Коварство его в том, что он остается всегда целым и невредимым, а металлы и сплавы несут огромные потери: примерно до 15% всех производимых в мире металлов становятся ежегодно жертвами этого врага. Борьба эта не прекращается ни на минуту.
- Вот несколько примеров:
в III веке до н.э. на острове Родос был построен маяк в виде огромной статуи Гелиоса. Колосс Родосский считался одним из чудес света, однако просуществовал всего 66 лет и рухнул…его бронзовая оболочка была смонтирована на железном каркасе… Под действием влажного, насыщенного солями, средиземноморского воздуха железный каркас разрушился…
- А это символ Парижа – Эйфелева башня. Она неизлечимо больна, ржавеет и разрушается… и только постоянная химиотерапия помогает бороться с этим смертельным недугом… ее красили 18 раз, отчего ее масса каждый раз увеличивалась на 70 тонн…
- В ноябре 2007 года в журнале «Огонек» была помещена заметка о происшествии в Керченском заливе. В ней сообщалось о том, что во время сильного шторма затонуло 12 судов. Все они были насквозь проржавевшими. Один из них — танкер «Волгонефть-139» даже разломился пополам. В результате этого происшествия в море вылилось 2000 т мазута, и несколько десятков километров береговой линии оказались загрязненными. Погибли тысячи птиц, а самое страшное, что погибли люди. Предварительный ущерб составил 30 млрд. рублей.
- Этот враг наносит большой экономический вред. Человечество несет огромные материальные потери в результате разрушения трубопроводов, деталей машин, судов, мостов, различного оборудования. Учитывая возможное разрушение, приходится завышать прочность некоторых изделий, например, деталей самолета, лопастей турбин, а значит, увеличивать расход материала, а это требует дополнительных затрат.
- Затраты на возмещение потерь связанных с разрушением металлов и конструкций, колоссальны, они составляют около 30% годового производства металлов во всем мире.
Что же это за враг? — Коррозия
Итак, тема сегодняшнего занятия «Коррозия металлов и способы защиты от нее».
- С коррозионными процессами мы встречаемся практически ежедневно, дома, на улице, в быту и на работе…
Сегодня на занятии мы постараемся ответить на вопрос: что такое коррозия, в чем ее сущность, каковы ее последствия и какие способы защиты металлов от коррозии существуют. К вопросам, связанным с коррозионными процессами вы будете возвращаться еще не раз, при изучении материаловедения, технической механики, т.к.
ваша профессия связана с эксплуатацией паровых котлов и другого теплоэнергетического оборудования. Оборудование ТЭС изготавливается в основном из металлов и сплавов, а эксплуатируется при высоких температурах, давлении, в агрессивных средах. Одной из проблем при эксплуатации оборудовании является отказ или разрушение узлов и агрегатов по причине коррозии.
Поэтому важно знать причины возникновения этого явления, а главное находить эффективные способы защиты от нее.
- Несколько дней назад я поместила в две пробирки железные гвозди и залила их водой. В первой пробирке вода обычная водопроводная, во второй вода кипяченая, обе пробирки плотно закрыты.
Демонстрация опыта.
- Что мы наблюдаем в данных пробирках? (Ответы) Мы знаем, что вода способствует появлению ржавчины. Но мы видим, что в первой пробирке гвоздь покрылся ржавчиной, а во второй нет. Почему? (ответы)
- Вывод: железо ржавеет не только в присутствии воды, но и в обязательном присутствии кислорода воздуха.
- При попадании металла в естественные условия происходит окисление металлов, они возвращаются в устойчивое для них состояние в виде ионов.
- Что же такое коррозия?
- Коррозия – это самопроизвольное разрушение металлов и их сплавов под воздействием окружающей среды.
Коррозии подвергаются практически все металлы. С чем это связано? С активностью металлов.
Основополагающим звеном для понимания электрохимических процессов является ряд напряжения металлов. Металлы можно расположить в ряд, который начинается с химически активных и заканчивается наименее активными благородными металлами.
- С точки зрения химии коррозия – это окислительно-восстановительный процесс, при котором происходит окисление металла:
- Ме0 – nē = Меn+ .
- Внешне это проявляется, как вы уже поняли и знаете, в виде ржавчины, оксидных плёнок и др.
- Различают несколько видов коррозии
- По площади и характеру поражения: сплошная и местная (точечная, язвенная, межкристаллитная).
По характеру разрушения металла различают коррозию сплошную и местную.
Сплошная коррозия распределяется равномерно по всей поверхности металла или сплава (например, процесс ржавления сплавов железа на воздухе или их взаимодействие с сильными кислотами).
При местной коррозии её очаги распределяются неравномерно – в виде коррозионных пятен или точек, что особенно опасно для промышленной химической аппаратуры.
- По природе агрессивных сред: в зависимости от среды, в которой она протекает, различают воздушную, газовую, почвенную, морскую коррозию.
- По механизму возникновения: химическая, электрохимическая.
Видеоролик
Какие виды коррозии в ролике представлены?
Задание:
|
- По итогам самостоятельной работы студенты от каждой группы выступают у доски
- Поняв, что такое химическая и электрохимическая коррозия, давайте рассмотрим, как влияют на процесс коррозии различные среды.
- Демонстрация опыта «Коррозия железа в различных средах»
- Перед вами пять пронумерованных пробирок:
- 1 пробирка: раствор соляной кислоты и железный гвоздь;
- 2 пробирка: раствор хлорида натрия и железный гвоздь;
- 3 пробирка: раствор хлорида натрия и железный гвоздь в контакте с цинком;
- 4 пробирка: раствор хлорида натрия и железный гвоздь в контакте с медной проволокой;
- 5 пробирка: раствор гидроксида натрия и железный гвоздь.
Что вы наблюдаете? В каких пробирках железный гвоздь прокорродировал, а в каких нет? Почему? Объясните, что происходит в каждой из пробирок. Объясните, что усиливает коррозию, а что её замедляет.
Ответы
Пробирка №1: протекает химическая коррозия. Скорость коррозии очень велика.
Пробирка №2: протекает химическая коррозия. Скорость коррозии очень велика.
Пробирка №3: протекает электрохимическая коррозия. Скорость коррозии очень велика. Коррозии подвергается железо
| А (+) на железе | К (–) на меди |
| Fe0–2ē→ Fe2+ | 2H++2ē→ H2 |
Пробирка №4: электрохимическая коррозия. Коррозии подвергается цинк.
| А (+) на цинке | К(–) на железе |
| Zn0–2ē→ Zn2+ | 2H++2ē→ О2 |
Пробирка №5: коррозия практически отсутствует. Следовательно, гидроксид натрия замедляет коррозию.
- Какой общий вывод можно сделать из рассмотренного опыта?
Коррозионный процесс протекает наиболее активно в растворах электролитов. Соли являются активаторами коррозии и приводят к ускоренному разрушению металлов.
В зависимости от активности металла, с которым контактирует железо, процесс коррозии может усиливаться или замедляться.
Если в гальваническом элементе в паре с железом более активный металл (цинк), то железо практически не корродирует, а если в паре с железом менее активный металл (медь), то разрушается само железо.
Это свойство широко используется как один из способов защиты металлов от коррозии.
- Какие еще способы защиты металлов от коррозии вы знаете?
Ответы с использованием слайдов и текста.
- Закрепление изученного материала
- Что такое коррозия?
- С какими видами коррозии мы познакомились? В чем их отличие
- Перед вами ряд металлов:
цинк, медь, алюминий, свинец, серебро, марганец, магний
Вопрос. В присутствии каких металлов скорость электрохимической коррозии железа будет замедляться, а в присутствии каких возрастать? Объясните, почему это происходит
Оценивая сегодняшнее занятие, как бы вы продолжили фразы:
- Сегодня я узнал…
- Было интересно…
- Я выполнял задания…
- Я понял, что…
- Я приобрел…
- Я научился…
- Меня удивило…
- Мне захотелось…
- Выдача домашнего задания.
Полный текст статьи см. в приложении.
Приложения:
- file1.pptx.zip.. 7,2 МБ
- file0.docx.. 478,3 КБ






