Химические
свойства металлов во многом зависят от строения его внешнего или предвнешнего
электронного слоя. Для металлов, расположенных в одной группе периодической
системы и имеющих одинаковое строение внешней электронной оболочки, следует
ожидать определённые сходства в химических свойствах.
В атоме
металлов на внешнем энергетическом уровне небольшое количество электронов и
очень большой радиус атома, что способствует быстрой отдаче электронов атомами
металлов в результат их взаимодействия с другими соединениями.
Металлы
окисляются, сами при этом выступают в роли восстановителя.
Кроме этого,
положение металла в ряду активности характеризует свойства металла и его
катионов в водных растворах и связано с его химической активностью.
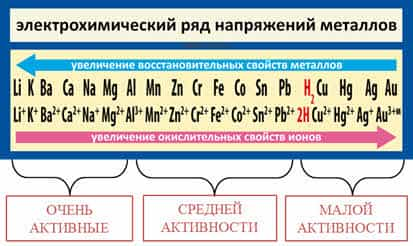
Как известно, самые
активные металлы расположены в начале ряда (слева), а самые
малоактивные – в конце (справа).
На основании
восстановительной способности металлов в ряду напряжений металлы условно можно
разделить на три группы: от лития до алюминия – очень активные
металлы, от алюминия до водорода – металлы средней
активности, от водорода до золота – малоактивные металлы.
Следует отметить,
что высокая электрохимическая активность металла не всегда означает его
химическую активность и наоборот. Обратите внимание на расположение лития и
натрия в ПС и в ряду активности металлов.
На основании положения в ПС натрий
активнее лития, так как радиус у натрия больше, на основании положения их в
ряду активности видно, что литий стоит левее натрия, то есть его восстановительная
способность выше, так как здесь учитывается не только радиус атома, но и
энергия отрыва электрона, энергия разрушения кристалла и энергия гидратации
ионов металла.
Например, с
кислородом активно при комнатной температуре реагируют только щелочные металлы,
при этом образуются оксиды или пероксиды. Так, в реакции лития с кислородом
образуется оксид лития, а в реакции натрия с кислородом – пероксид натрия.
4Li + O2 = 2Li2O
2Na + O2 = Na2O2
Металлы средней
активности реагируют с кислородом при нагревании. Например, проведём
эксперимент горения магния в кислороде. В результате данной реакции образуется
оксид магния, магний горит яркой вспышкой. Эта реакция сопровождается
выделением большого количества и света и ранее использовалась фотографами в
качестве вспышки при съёмке.
2Mg + O2 = 2MgO
Алюминий в
порошке также горит ослепительным пламенем с образованием оксида алюминия. Эта
способность используется в фейерверках, салютах, бенгальских огнях.

Такие металлы,
как Au, Pt не
реагируют с кислородом и поэтому на воздухе практически не изменяют своего
блеска.
Большинство
металлов, кроме Au, Pt реагируют при нагревании с серой, при этом образуются
соответствующие сульфиды.
Так, в реакции
цинка с серой образуется сульфид цинка, в реакции серебра с серой образуется
сульфид серебра (I).
Проведём
эксперимент, для этого на асбестовой сетке поместим цинк с серой, подожжём эту
смесь горящим магнием, в результате у нас образуется сульфид цинка.
Практически все
металлы реагируют с галогенами. Условия протекания этих реакций зависит от
активности металла и галогена.
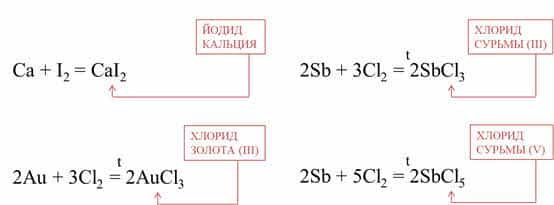
Например, кальций реагирует с йодом при
комнатной температуре, при этом образуется йодид кальция, а золото реагирует с
хлором при сильном нагревании, при это образуется хлорид золота (III).
Очень красиво горит сурьма в хлоре, при этом образуется
смесь хлоридов: хлорид сурьмы (III) и хлорид сурьмы (V).
С металлами
реагируют соединения всех классов – оксиды (в том числе вода), кислоты,
основания и соли.
При нагревании
металлы реагируют и с другими неметаллами. Так, в реакции алюминия с
азотом, образуется нитрид алюминия, в реакции кальция с форфором, образуется
фосфид кальция, в реакции алюминия с углеродом – карбид алюминия, в реакции
магния с кремнием – силицид магния.

С водородом
реагируют только активные металлы. Например, в реакции натрия с водородом
образуется гидрид натрия.
Так, активные
металлы бурно реагируют с водой при комнатной температуре. Например, в реакции
лития с водой образуется гидроксид лития и водород, в реакции бария с водой
образуется гидроксид бария и водород.
Проведём
эксперимент, для этого в воду добавим фенолфталеин и опустим туда кусочек
натрия. Натрий начинает бегать по поверхности из-за выделения водорода, раствор
приобретает малиновую окраску, вследствие образования щёлочи. Таким образом, в реакции
натрия с водой образуется щёлочь – гидроксид натрия и газ – водород.
Поверхность таких
металлов, как магний и алюминий, защищена плотной плёнкой соответствующего
оксида. Это препятствует протеканию реакции с водой.
Но если убрать
эту плёнку, то эти металлы активно будут вступать в реакцию. Например,
порошкообразный магний реагирует с горячей водой, при этом образуется гидроксид
магния и водород.
При повышенной
температуре с водой реагируют и менее активные металлы, но в данном случае
образуется окси д и водород. Например, в реакции цинка с водой образуется оксид
цинка и водород.
Металлы, стоящие
в ряду активности до водорода, реагируют с кислотами (кроме HNO3
любой концентрации и H2SO4
концентрированной) с образованием солей и водорода.
Активные металлы реагируют
с растворами кислот очень быстро.
Например, в реакции кальция с соляной
кислотой образуется соль – хлорид кальция и водород, в реакции алюминия с
разбавленной серной кислотой образуется соль – сульфат алюминия и водород.
Малоактивные
металлы часто практически не растворяются в кислотах. Это обусловлено
образованием на их поверхности плёнки нерастворимой соли. Например, свинец,
стоящий в ряду активности до водорода, практически не растворяется в
разбавленной серной и соляной кислотах вследствие образования на его
поверхности плёнки нерастворимых солей (PbCl2,
PbSO4).
В азотной кислоте
растворяются металлы, стоящие и до, и после водорода. При этом образуются
нитраты, а также различные продукты восстановления азотной кислоты.
Концентрированная
серная кислота также может вступать в реакции с металлами, расположенными в
ряду активности после водорода. Например, в реакции серебра с концентрированной
серной кислотой образуется сульфат серебра (I), сернистый
газ и вода, а в реакции магния с концентрированной серной кислотой образуется
сульфат магния, сероводород и вода.
Al,
Cr, Fe при
комнатной температуре не вступают в реакцию и с концентрированной серной
кислотой из-за образования на их поверхности оксидной плёнки. Это явление
называется пассивацией. Благодаря этому становится возможным транспортировать
концентрированную азотную серную кислоты в стальных цистернах.
- Проведём
эксперимент, поместим в четыре пробирки металлы: в первую – магний, во вторую –
цинк, в третью – железо, а в четвёртую – медь и прильём в каждую пробирку
соляной кислоты. - Интенсивнее всего
выделение наблюдается в первой пробирки, где находится цинк, кроме этого,
реакция сопровождается выделение теплоты, во второй и третье пробирке
интенсивность выделения водорода меньше, а в четвёртой пробирке водород вообще
не выделяется. - Mg + 2HCl = MgCl2
+ H2↑ + Q - Zn + 2HCl = ZnCl2
+ H2↑ - Fe + 2HCl = FeCl2
+ H2↑ - Cu + HCl ≠
Тоже самое
сделаем в другом опыте, но использовать здесь будем уксусную кислоту.
Получается, что при комнатной температуре с уксусной кислотой реагирует
только магний, цинк и железо реагирует с уксусной кислотой только при
нагревании, а медь не вступает во взаимодействие с уксусной кислотой.
- Mg + 2CH3COOH = (CH3COO)2 Mg + H2↑
- Zn + 2CH3COOH = (CH3COO)2 Zn + H2↑
- Fe + 2CH3COOH = (CH3COO)2 Fe + H2↑
- Cu + CH3COOH
≠ - Таким образом, металл
реагирует с раствором кислоты, если он стоит в ряду активности левее водорода,
при этом должна образоваться растворимая соль, концентрированная серная и
азотная кислота иначе реагируют с кислотами, щелочные металлы для данных
реакций лучше не использовать из-за их высокой химической активности. - Некоторые
металлы, такие, как Be, Zn, Al, легко растворяются в водных растворах щелочей с
образованием комплексных соединений. - Например, в
реакции бериллия с раствором гидроксида натрия образуется комплексная соль –
тетрагидроксобериллат натрия, а в реакции цинка с водным раствором гидроксида
калия образуется комплексная соль – тетрагидроксоцинкат калия. - Be + 2H2O + 2NaOH = Na2[Be(OH)4] +
H2↑ - Zn + 2H2O + 2KOH = K2[Zn(OH)4] + H2↑
Металлы, оксиды и
гидроксиды которых амфотерны, взаимодействуют также с расплавами щелочей при
нагревании. Например, в реакции цинка с расплавом гидроксида натрия образуется
соль – цинкат натрия и водород.
Zn + 2NaOH (тв.)
= Na2ZnO2
+ H2↑
Активные
металлы вытесняют малоактивные из растворов их солей. Так, в реакции железа
с хлоридом меди (II) железо замещает медь в его хлориде
и образуется хлорид железа (II) и медь, в реакции меди
с нитратом серебра (I) образуется соль – нитрат меди (II) и серебро.
- Fe + CuCl2 = FeCl2 + Cu↓
- Cu + 2AgNO3 = Cu (NO3)2 +
2Ag↓ - Проведём
эксперимент, опустим железный гвоздь в раствор сульфата меди (II),
через некоторое время на железном гвозде осела медь и раствор стал жёлтого
цвета, если опустить медную платину в раствор сульфата железа (II), то в данной случае признаков реакции не наблюдается,
ведь медь менее активный металл, чем железо. - Fe + CuSO4 = FeSO4 + Cu↓
- Cu + FeSO4 ≠
- В данных реакциях
нужно соблюдать следующие условия: щелочные металлы брать нельзя, так как они
будут взаимодействовать с водой, металл должен находится левее того металла,
который входит в состав соли, в данных реакциях должна образоваться растворимая
соль.
Металлы могут
реагировать и с органическими веществами. Например, в реакции фенола с натрием,
образуется фенолят натрия, в реакции этанола с натрием образуется этилат
натрия.
2C6H5OH + 2Na → 2C6H5ONa + H2↑
2C2H5OH + 2Na → 2C2H5ONa + H2↑
Кроме этого,
натрий вступает в реакцию Вюрца с галогеналканами. Так, в реакции хлорметана с
натрием образуется хлорид натрия и этан.
2H3CCl + 2Na C2H6
+ 2NaCl
Соединение Pb(C2H5)4
– тетраэтилсвинец – применяется как антидетонатор в моторном топливе. Это
сильно ядовитое соединение, если бензин содержит тетраэтилсвинец, тогда его
называют «этилированным».
Таким образом, о
химической активности металлов можно примерно судить по их расположению в
электрохимическом ряду напряжений металлов.
Чем левее расположен
металл, тем выше его химическая активность в водном растворе. Активные
металлы размещаются вначале вытеснительного ряда, а малоактивные – в конце.
Металлы
реагируют как с простыми веществами – неметаллами, так и со сложными: оксидами,
кислотами, основаниями и солями.
Химические свойства металлов — задачи с решениями и примерами
Решение:
Щелочные металлы стоят в начале ряда напряжений металлов. Являясь наиболее активными, они легко окисляются кислородом воздуха уже при обычных температурах. Однако для каждого из указанных металлов есть свои особенности. Литий уже при обычных температурах реагирует как с кислородом воздуха, так и со вторым компонентом воздуха — азотом, образуя, соответственно, оксид и нитрид лития:
При высоких температурах вместо оксида лития образуется пероксид лития:
Натрий: а) при обычной температуре —
б) при высоких температурах —
б) при высоких температурах —
Задача 82
Основываясь на знании общих химических свойств металлов, написать уравнения следующих химических реакций:
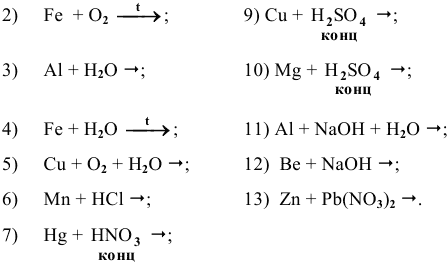
Решение:
5) Электрохимическая коррозия меди с кислородной деполяризацией:
- Задача 83
- С какими из следующих веществ может реагировать ртуть:
- Решение:
Задача 84
- Среди металлов: — найти наиболее и наименее сильный восстановитель:
- а) в водных средах;
- б) в неводных средах.
- Решение:
- В водных средах количественной характеристикой восстановительных свойств металла является величина его электродного потенциала.
Для изучаемых металлов величины стандартных электродных потенциалов следующие:
- Наиболее низкий электродный потенциал у кальция, значит, он наиболее сильный восстановитель в водных средах, а наиболее высокий электродный потенциал у цинка, значит, он наиболее слабый восстановитель среди перечисленных металлов.
- В неводных средах количественной характеристикой восстановительных свойств металла является величина его энергии ионизации.
- Величины энергий ионизации изучаемых металлов находим в справочнике:
Наиболее низкая энергия ионизации (ионизационный потенциал) у натрия — самого сильного восстановителя из перечисленных металлов, наиболее высокая энергия ионизации у цинка — самого слабого восстановителя.
Задача 85
- Составить и уравнять с помощью электронного баланса ОВ реакции.
- Решение:
- Ниже приводятся уравнения уже составленных и уравненных реакций:
Задача 86
- Каким методом может быть получен металлический магний?
- Решение:
- Магний — это очень активный металл, его электродный потенциал
Значит, магний может быть получен не электролизом водных растворов солей магния, а электролизом расплавов его солей, например электролизом расплава :
Магний также может быть получен металлотермией при использовании какого-либо металла, химическое сродство которого к атому, с которым он связан, выше, чем у магния, например:
Докажем возможность использования Na:
Так как , то реакция термодинамически возможна. Металлический натрий может быть использован для получения металлического магния из .
Задача 87
При смешивании расплавленных масс магния и свинца образуется интерметаллическое соединение, содержащее 81% РЬ. Какова его формула?
Решение:
— формула интерметаллического соединения в общем виде. Индексы х и у находим из следующих отношений:
Таким образом, формула интерметаллического соединения — .
Задача 88
Для определения процентного содержания серебра в старой монете растворили 0,3 г этой монеты в концентрированной . Затем из полученного раствора серебра осадили раствором соляной кислоты в виде осадка . Масса осадка равна 0,199 г. Каково содержание серебра в монете?
Решение:
Уравнения химических реакций, происходящих в ходе анализа, следующие:
Согласно уравнениям этих двух реакций, 1 моль образует 1 моль .
Рассчитаем массу серебра, соответствующую 0,199 г :
Вычислим процентное содержание серебра в монете:
- Эти задачи взяты со страницы решения задач по неорганической химии:
- Задачи с решением по неорганической химии
- Возможно эти страницы вам будут полезны:
Химические свойства металлов


Средняя оценка: 4.4
Всего получено оценок: 794.
Средняя оценка: 4.4
Всего получено оценок: 794.
Металлы – активные восстановители с положительной степенью окисления. Благодаря химическим свойствам металлы широко используются в промышленности, металлургии, медицине, строительстве.
В реакциях атомы металлов отдают валентные электроны и окисляются. Чем больше энергетических уровней и меньше электронов имеет атом металла, тем легче ему отдавать электроны и вступать в реакции. Поэтому металлические свойства увеличиваются сверху вниз и справа налево в таблице Менделеева.
Рис. 1. Изменение металлических свойств в таблице Менделеева.
Активность простых веществ показана в электрохимическом ряду напряжений металлов. Слева от водорода находятся активные металлы (активность увеличивается к левому краю), справа – неактивные.
Наибольшую активность проявляют щелочные металлы, находящиеся в I группе периодической таблицы и стоящие левее водорода в электрохимическом ряду напряжений. Они вступают в реакцию со многими веществами уже при комнатной температуре.
За ними идут щелочноземельные металлы, входящие во II группу. Они реагируют с большинством веществ при нагревании.
Металлы, находящиеся в электрохимическом ряду от алюминия до водорода (средней активности) требуют дополнительных условий для вступления в реакции.
 Рис. 2. Электрохимический ряд напряжений металлов.
Рис. 2. Электрохимический ряд напряжений металлов.
Некоторые металлы проявляют амфотерные свойства или двойственность. Металлы, их оксиды и гидроксиды реагируют с кислотами и основаниями. Большинство металлов реагирует только с некоторыми кислотами, замещая водород и образуя соль. Наиболее ярко выраженные двойственные свойства проявляют:
- алюминий;
- свинец;
- цинк;
- железо;
- медь;
- бериллий;
- хром.
Каждый металл способен вытеснять стоящий правее него в электрохимическом ряду другой металл из солей. Металлы, находящиеся слева от водорода, вытесняют его из разбавленных кислот.
Особенности взаимодействия металлов с разными веществами представлены в таблице химических свойств металлов.
| Реакция | Особенности | Уравнение |
| С кислородом | Большинство металлов образует оксидные плёнки. Щелочные металлы самовоспламеняются в присутствии кислорода. При этом натрий образует пероксид (Na2O2), остальные металлы I группы – надпероксиды (RO2). При нагревании щелочноземельные металлы самовоспламеняются, металлы средней активности – окисляются. Во взаимодействие с кислородом не вступают золото и платина |
|
| С водородом | При комнатной температуре реагируют щелочные, при нагревании – щелочноземельные. Бериллий не вступает в реакцию. Магнию дополнительно необходимо высокое давление |
|
| С азотом | Только активные металлы. Литий вступает в реакцию при комнатной температуре. Остальные металлы – при нагревании |
– 6Li + N2 → 2Li3N; – 3Ca + N2 → Ca3N2 |
| С углеродом | Литий и натрий, остальные – при нагревании |
– 4Al + 3C → Al3C4; – 2Li+2C → Li2C2 |
| С серой | Не взаимодействуют золото и платина |
|
| С фосфором | При нагревании | 3Ca + 2P → Ca3P2 |
| С галогенами | Не реагируют только малоактивные металлы, медь – при нагревании | Cu + Cl2 → CuCl2 |
| С водой | Щелочные и некоторые щелочноземельные металлы. При нагревании, в условиях кислой или щелочной среды реагируют металлы средней активности |
|
| С кислотами | Металлы слева от водорода. Медь растворяется в концентрированных кислотах |
|
| Со щелочами | Только амфотерные металлы | 2Al + 2KOH + 6H2O → 2K[Al(OH)4] + 3H2↑ |
| С солями | Активные замещают менее активные металлы | 3Na + AlCl3 → 3NaCl + Al |
Металлы взаимодействуют между собой и образуют интерметаллические соединения – 3Cu + Au → Cu3Au, 2Na + Sb → Na2Sb.
Общие химические свойства металлов используются для создания сплавов, моющих средств, применяются в каталитических реакциях. Металлы присутствуют в аккумуляторах, электронике, в несущих конструкциях.
Основные отрасли применения указаны в таблице.
| Отрасль | Производство | Металлы |
| Химическая промышленность | Катализаторы, соли, щёлочи | Pt, Fe, Ni, K |
| Пищевая промышленность | Поваренная соль (NaCl), сода (Na2CO3, NaHCO3) | Na, Ca, Ag |
| Металлургия | Сплавы, покрытия, детали разной формы, проволока, облицовка, строительные материалы и инструменты | Fe, Cr, Ni, W, Mo |
| Приборостроение | Микросхемы, фотоэлементы, датчики | Cs, Co, Ni, Cu |
| Ювелирная промышленность | Украшения | Au, Pt, Ag |
| Медицина | Протезы | Ti, Ni, Au |
 Рис. 3. Висмут.
Рис. 3. Висмут.
Из урока 9 класса химии узнали об основных химических свойствах металлов. Возможность взаимодействовать с простыми и сложными веществами определяет активность металлов. Чем активнее металл, тем легче он вступает в реакцию при обычных условиях.
Активные металлы реагируют с галогенами, неметаллами, водой, кислотами, солями. Амфотерные металлы взаимодействуют со щелочами. Малоактивные металлы не реагируют с водой, галогенами, большинством неметаллов. Кратко рассмотрели отрасли применения.
Металлы используются в медицине, промышленности, металлургии, электронике.
Чтобы попасть сюда — пройдите тест.
Средняя оценка: 4.4
Всего получено оценок: 794.
А какая ваша оценка?
Гость завершил
Тест Запятыес результатом 7/10
Гость завершил
Тест Простейшиес результатом 10/10
Гость завершил
Тест «Премудрый пескарь»с результатом 6/10
Гость завершил
Тест «Бедная Лиза»с результатом 7/11
Гость завершил
Тест «Старуха Изергиль»с результатом 10/11
Не подошло? Напиши в х, чего не хватает!
Общие химические свойства металлов
- Тема: «Металлы».
- Общие химические свойства металлов
- В химических реакциях металлы выступают в роли восстановителейи повышают степень окисления, превращаясь из простых веществ в катионы.
Химические свойства металлов различаются в зависимости от химической активности металла. По активности в водных растворах металлы расположены в ряд напряжений.

В этот ряд, составленный русским химиком Н.Н. Бекетовым, включен также неметалл водород. Активность металлов убывает слева направо:
Запомнить! Металлы, стоящие в ЭХ ряду после водорода, называют неактивными металлами.
- Металлы, расположенные в ЭХ ряду до алюминия называют сильноактивными или активными металлами.
- Общие химические свойства металлов
- 1) Многие металлы вступают в реакцию с типичными неметаллами – галогенами, кислородом, серой. При этом образуются соответственно хлориды, оксиды, сульфиды и другие бинарные соединения:
- с азотом некоторые металлы образуют нитриды, реакция практически всегда протекает при нагревании;
- с серой металлы образуют сульфиды – соли сероводородной кислоты;
- с водородом самые активные металлы образуют ионные гидриды (бинарные соединения, в которых водород имеет степень окисления -1);
- с кислородом большинство металлов образует оксиды – амфотерные и основные. Основной продукт горения натрия — пероксид Na2O2; а калий и цезий горят с образованием надпероксидов MeO2.
2) Следует обратить внимание на особенности взаимодействие металлов с водой:
- Активные металлы, находящиеся в ряду активности металлов до Mg (включительно), реагируют с водой с образованием щелочей и водорода:Ca+2H2O=Ca(OH)2+H2↑
- Активные металлы (например, натрий и литий), взаимодействуют с водой со взрывом.
- Металлы средней активности окисляются водой при нагревании до оксида:
6Cr+6H2O→t,∘C2Cr2O3+3H2↑
- Неактивные металлы (Au, Ag, Pt) — не реагируют с водой.
- →[Li……Mg]MOH+H2↑ активные металлы (до Al)
- H2O+M→[Al……PbMxOy+H2↑ среднеактивные металлы (от Al до H), только при нагревании
- →[Bi……Au]≠ неактивные металлы (после Н)
- Более подробно взаимодействие металлов с водой рассмотрено в темах, посвященных химии отдельных групп.
- 3) С разбавленными кислотами реагируют металлы, стоящие в ЭХР до водорода: происходит реакция замещения с образованием соли и газообразного водорода. При этом кислота проявляет окислительные свойства за счет наличия катиона водорода:
Mg+2HCl=MgCl2+H2
4) Взаимодействие азотной кислоты (любой концентрации) и концентрированной серной кислоты протекает с образованием других продуктов: кроме соли и водорода в этих реакциях выделяется продукт восстановления серной (или азотной) кислоты. Подробнее см.тему «Взаимодействие азотной кислоты с металлами и неметаллами.
Запомнить! Все металлы, стоящие в ряду левее водорода, вытесняют его из разбавленных кислот, а металлы, расположенные справа от водорода, с растворами кислот не реагируют (азотная кислота – исключение).
5) Активность металлов также влияет на возможность протекания простого вещества металлас оксидом или солью другого металла. Металл вытесняет из солей менее активные металлы, стоящие правее его в ряду напряжений.
Запомнить! Для протекания реакции между металлом и солью другого требуется, чтобы соли, как вступающие в реакцию, так и образующиеся в ходе нее, были растворимы в воде. Металл вытесняет из соли только более слабый металл.
- Например, для вытеснения меди из водного раствора сульфата меди подходит железо,
- CuSO4+Fe=FeSO4+Cu
- но не подходят свинец – так как он образует нерастворимый сульфат. Если опустить кусочек свинца в раствор сульфата меди, то с поверхности металла покроется тонким слоем сульфата, и реакция прекратится
- CuSO4+Pb=PbSO4↓+Cu
- Другой пример: цинк легко вытесняет серебро из раствора нитрата серебра, однако реакция цинка со взвесью сульфида серебра, нерастворимого в воде, практически не протекает.
- Общие химические свойства металлов обобщены в таблице:
| Уравнение реакции | Продукты реакции | Примечания |
| с простыми веществами — неметаллами | ||
| с кислородом | ||
| 4Li+O2=2Li2O | оксиды O−2 | |
| 2Na+O2=Na2O2 | пероксиды (O2)−2 | только натрий |
| K+O2=KO2 | надпероксиды (O2)−2 | надпероксиды при горении образуют K, Rb, Cs |
| с водородом | ||
| Ca+H2=CaH2 | гидриды | щелочные металлы 0 при комнатной температуре; остальные металлы — при нагревании |
| с галогенами | ||
| Fe+Cl2=Fe+3Cl3 | хлориды и др. | при взаимодействии с хлором и бромом (сильные окислители) железо и хром образуют хлориды в степени окисления +3 |
| с серой | ||
| Fe+S=FeS | сульфиды | при взаимодействии с серой и иодом железо приобретает степень окисления +2 |
| с азотом и фосфором | ||
| 3Mg+N2=Mg3N2 | нитриды | * при комнатной температуре с азотом реагируют только литий и магний |
| 3Ca+2P=Ca3P2 | фосфиды | |
| с углеродом | ||
| 4Al+3C=Al4C3 | карбиды | |
| с водой | ||
| 2Na0+2H2O=2NaOH+H2 | Основание + H2 | щелочные металлы |
| Zn0+H2O=ZnO+H2 | Оксид + H2 | среднеактивные металлы, при нагревании |
| Au,Ag,Pt+H2O/ne | не реагируют | неактивные металлы (после Н) |
| с окисдами менее активных металлов | ||
| 2Al+3ZnO=Al2O3+2Zn | др оксид + др.металл | |
| с солями менее активных металлов | ||
| Fe+CuSO4=Cu+FeSO4 | Др. соль + др. металл |
|
| Cu+AlCl3≠ | ||
| с кислотами | ||
| Fe+2HCl=FeCl2+H2 6Na+2H3PO4=2Na3PO4+3H2 | Др. соль +водород | Металлы, стоящие в электрохимическом ряду напряжений до H реагируют с разбавленными кислотами (кроме HNO3) |
Химические свойства металлов
Цель
работы:практически
ознакомиться с характерными химическими
свойствами металлов различной активности и их соединений; изучить особенности
металлов с амфотерными свойствами.
окислительно-восстановительные реакции
уравнять методом электронно-ионного
баланса.
Теоретическая часть
Физические
свойства металлов.Вобычных
условиях все металлы, кроме ртути, —
твердые вещества, резко отличающиеся
по степени твердости.
Металлы, являясь
проводниками первого рода, обладают
высокой электропроводностью и
теплопроводностью.
Эти свойства связаны
со строением кристаллической решетки,
в узлах которой находятся ионы металлов,
между которыми перемещаются свободные
электроны. Перенос электричества и
тепла происходит за счет движения этих
электронов.
Химические
свойства металлов.
Все
металлы являются восстановителями,
т.е. при химических реакциях они теряют
электроны и превращаются в положительно
заряженные ионы. Вследствие этого
большинство металлов реагирует с
типичными окислителями, например,
кислородом, образуя оксиды, которые в
большинстве случаев покрывают плотным
слоем поверхность металлов.
-
Mg°
+O2°=2Mg+2O-2 - Mg-2=Mg+2
- О2+4=2О-2
Восстановительная
активность металлов в растворах зависит
от положения металла в ряду напряжений
или от величины электродного потенциала
металла ( табл. ) Чем меньшей величиной
электродного потенциала обладает данный
металл, тем более активным восстановителем
он является. Все металлы можно разделить
на 3
группы:
-
Активные металлы – от начала ряда напряжений (т.е. от Li) до Mg;
-
Металлы средней активности от Mg до H;
-
Малоактивные металлы – от Н до конца ряда напряжений ( до Au).
-
Взаимодействие
металлов с водой -
С водой взаимодействуют
металлы 1 группы (сюда относятся
преимущественно щелочные и щелочноземельные
металлы); продуктами реакции являются
гидроксиды соответствующих металлов
и водород, например: - 2К°+2Н2О=2КОН+Н2О
- К°-=К+ | 2
- 2Н++2=Н2 | 1
-
Взаимодействие
металлов с кислотами
Все
бескислородные кислоты (соляная HCl,
бромистоводородная HBr и т.п.), а также
некоторые кислородсодержащие кислоты
(разбавленная серная кислота H2SO4,
фосфорная H3PO4, уксусная СН3СООН
и т.п.) реагируют с металлами 1 и 2 групп,
стоящими в ряду напряжений до водорода.
При этом образуется соответствующая
соль и выделяется водород:
-
Zn+H2SO4
=ZnSO4+H2 -
Zn
-2=Zn2+ | 1 - 2Н++2=Н2° | 1
-
Концентрированная
серная кислота окисляет металлы 1, 2 и
частично 3-ей группы (до Ag включительно)
восстанавливаясь при этом до SO2
— бесцветного газа с резковатым запахом,
свободной серы, выпадающей в виде белого
осадка или сероводорода H2S
— газа с запахом тухлых яиц. Чем более
активным является металл, тем сильнее
восстанавливается сера, например:
| 1
| 1
| 8
| 1
Азотная
кислота любой концентрации окисляет
практически все металлы, при этом
образуются нитрат соответствующего
металла, вода и продукт восстановления
N+5
(NO2
— бурый газ с резким запахом, NO
— бесцветный газ с резким запахом, N2O
— газ с наркотическим запахом, N2
-газ без запаха, NH4NO3 — бесцветный раствор). Чем более активным
является металл и чем более разбавленной
является кислота, тем сильнее
восстанавливается азот в азотной
кислоте.
Взаимодействие
металлов со щелочами
Со
щелочами взаимодействуют амфотерные
металлы,
относящиеся в основном ко 2 группе ( Zn,
Be,
Al,
Sn,
Pb
и др.). Реакция протекает сплавлением
металлов со щелочью:
-
Pb+2NaOH=Na2PbO2
+Н2 -
Pb
-2=Pb2+ | 1 - 2Н++2=Н2° | 1
-
или при взаимодействии
с крепким раствором щелочи: -
Be
+ 2NaOH + 2H2О
= Na2[Be(OH)4]
+ H2 - Ве°-2=Ве+2 | 1
- | 1
-
Амфотерные металлы
образуют амфотерные оксиды и,
соответственно, амфотерные гидроксиды
(взаимодействующие с кислотами и щелочами
с образованием соли и воды), например:
Практическая часть
Опыт№
1. Взаимодействие
металлов с водой.
Возьмите небольшой
кусочек щелочного или щелочноземельного
металла (натрий, калий, литий, кальций),
который хранится в банке с керосином,
тщательно осушите его фильтровальной
бумагой, внесите в фарфоровую чашку,
заполненную водой. По окончании опыта
добавьте несколько капель фенолфталеина
и определите среду образовавшегося
раствора.
При взаимодействии
магния с водой реакционную пробирку
подогрейте некоторое время на спиртовке.
Опыт№2.
Взаимодействие
металлов с разбавленными кислотами.
В три пробирки
налейте по 20 — 25 капель 2Н раствора
соляной, серной и азотной кислот. В
каждую пробирку опустите металлы в виде
проволоки, кусочков или стружки.
Наблюдайте происходящие явления.
Пробирки, в которых ничего не происходит,
подогрейте на спиртовке до начала
реакции. Пробирку с азотной кислотой
осторожно понюхайте для определения
выделяющегося газа.
Опыт
№3. Взаимодействие
металлов с концентрированными кислотами.
В две пробирки
налейте по 20 — 25 капель концентрированной
азотной и серной (осторожно!) кислот,
опустите в них металл, наблюдайте
происходящее. В случае необходимости
пробирки можно подогреть на спиртовке
до начала реакции. Для определения
выделяющихся газов пробирки осторожно
понюхайте.
Опыт№4.
Взаимодействие
металлов со щелочами.
В
пробирку налейте 20 — 30 капель
концентрированного раствора щелочи
(КОН или NaOH),
внесите металл. Пробирку слегка
подогрейте. Наблюдайте происходящее.
Опыт№5.
Получение
и
свойства гидроксидов металлов.
В пробирку налейте
15-20 капель соли соответствующего металла,
добавьте щелочь до выпадения осадка.
Осадок разделите на две части. К одной
части прилейте раствор соляной кислоты,
а к другой — раствор щелочи. Отметьте
наблюдения, напишите уравнения в
молекулярной, полной ионной и краткой
ионной формах, сделайте вывод о характере
полученного гидроксида.
Оформление работы
и выводы
К
окислительно-восстановительным реакциям
напишите уравнения электронно-ионного
баланса, ионообменные реакции напишите
в молекулярной и ионно-молекулярных
формах.
В выводах напишите,
к какой группе активности (1, 2 или 3-ей)
относится изученный вами металл и какие
свойства – основные или амфотерные –
проявляет его гидроксид. Выводы обоснуйте.
Лабораторная
работа № 11






