НОВОСТИ БИБЛИОТЕКА ССЫЛКИ О САЙТЕ
Соли тяжелых металлов оказывают противомикробный эффект, инактивируя ферменты, необходимые для жизнедеятельности микроорганизмов. Инактивация ферментов происходит путем взаимодействия ионов тяжелых металлов с сульфгидрильными группами (SH-группы) ферментов.
На кожу и слизистые оболочки соли тяжелых металлов оказывают выраженное местное действие. В зависимости от ряда условий местное действие этих веществ может быть вяжущим, раздражающим или прижигающим.
Механизм местного действия солей тяжелых металлов обусловлен их способностью реагировать с белками тканей. В результате такого взаимодействия белки свертываются и образуют с ионами металлов альбуминаты (соединения типа белковых солей металлов).
При этом, если происходит частичное свертывание белков только в самых поверхностных слоях тканей, наблюдается вяжущий или раздражающий эффект, имеющий обратимый характер.
В случае свертывания белков, охватывающего значительную массу тканевых клеток и вызывающего их гибель, возникает прижигающий эффект, при котором происходят необратимые изменения тканей в виде некроза.
По силе противомикробного и местного действия тяжелые металлы могут быть расположены в следующем порядке: Hg, Ag, Fe, Cu, Zn, Bi, Pb, где наиболее активными являются ионы ртути, а наименее активными — ионы свинца.
При применении солей тяжелых металлов для антисептики и дезинфекции необходимо учитывать, что сила их противомикробного действия значительно уменьшается в средах с высоким содержанием белка (например, в присутствии гноя, крови и т. п.), в связи с чем эти вещества непригодны для обеззараживания выделений.
В качестве антисептических средств применяют препараты ртути (ртути дихлорид), серебра (серебра нитрат, протаргол), цинка (цинка сульфат) и висмута (дерматол, ксероформ).
Ртути дихлорид (сулема) оказывает сильное противомикробное и местное раздражающее действие. Применяется для дезинфекции белья, предметов ухода за больными и т. п. Обладает высокой токсичностью для человека. Легко всасываясь через кожу и слизистые оболочки, может вызывать тяжелые отравления. В связи с этим при работе с препаратом следует соблюдать большую осторожность.
Другие соли ртути (ртути оксицианид, ртути окись желтая и т. д.), отличающиеся от ртути дихлорида меньшей токсичностью и менее выраженным раздражающим действием на кожу, применяются в качестве антисептических средств для лечения гнойно-воспалительных поражений кожи и слизистых оболочек при конъюнктивитах, кератитах, блефаритах и т. п.
Серебра нитрат (ляпис) наряду с противомикробными свойствами обладает в малых концентрациях (до 2%) вяжущим, а в больших (5% и более) прижигающим действием.
Применяется для лечения кожных язв, эрозий, а также при поражениях слизистых оболочек глаза (трахома, конъюнктивит) и гортани (ларингит). В акушерской практике серебра нитрат применяют для профилактики бленнореи у новорожденных.
В качестве прижигающего средства серебра нитрат используют для прижигания избыточных грануляций и бородавок.
Протаргол — недиссоциирующее органическое соединение серебра, обладающее антисептическими, вяжущими и противовоспалительными свойствами. Прижигающего действия на ткани не оказывает.
Растворы протаргола применяют для промывания мочевого пузыря и уретры, лечения гнойных конъюнктивитов и бленнореи, а также для смазывания слизистых оболочек верхних дыхательных путей при их воспалительных поражениях.
В качестве заменителя протаргола в практике часто используется колларгол, также являющийся недиссоциирующим соединением серебра. По основным свойствам и применению колларгол соответствует протарголу.
Цинка сульфат как антисептическое и вяжущее средство применяется в виде растворов главным образом при воспалительных поражениях слизистых оболочек глаза (конъюнктивит), гортани (ларингит) и мочеиспускательного канала (уретрит).
Дерматол и ксероформ относятся к органическим соединениям висмута. По сравнению с соединениями других тяжелых металлов они обладают относительно слабыми антисептическими и вяжущими свойствами.
Дерматол и ксероформ применяют наружно в виде присыпок и мазей для лечения воспалительных заболеваний кожи и слизистых оболочек.
Особенно благоприятный эффект указанные препараты дают при мокнущих поражениях кожи (в частности, при экземе, дерматитах), так как наряду с противомикробным и вяжущим одни оказывают подсушивающее действие, которое объясняется их адсорбирующими свойствами.
Отравления солями тяжелых металлов. Соединения большинства тяжелых металлов, за исключением солей ртути, плохо всасываются через кожу, слизистые оболочки и из желудочно-кишечного тракта.
Поэтому с практической точки зрения наибольший интерес представляют отравления соединениями ртути.
Особенно высокой токсичностью отличаются легкодиссоциирующие неорганические соли ртути, например ртути дихлорид.
Острые отравления, возникающие после приема препаратов ртути внутрь, характеризуются симптомами, которые обусловлены: а) раздражающим и прижигающим действием соединений ртути на желудочно-кишечный тракт; б) резорбтивным действием ионов ртути; в) действием ртути на путях выделения
Раздражающее и прижигающее действие препаратов ртути на слизистые оболочки желудочно-кишечного тракта развивается вскоре после приема препаратов внутрь.
При этом появляются металлический вкус и чувство жжения во рту, боли в животе, тошнота и рвота (нередко с примесью крови), усиление слюноотделения.
В первые часы отравления в связи с резким раздражением желудочно-кишечного тракта и возникновением в нем острых болей возможно развитие шока.
Резорбтивное действие ионов ртути развивается уже в первые часы отравления и проявляется признаками токсического влияния ионов ртути на ЦНС (вначале возбуждение ЦНС, судороги, затем ее угнетение), нарушениями деятельности сердечно-сосудистой системы (сердечная слабость, падение артериального давления, слабый и частый пульс) и функции почек (вначале усиление, затем уменьшение мочеотделения).
Действие ионов ртути на путях выделения развивается на 2-3-й сутки от момента приема яда. Ионы ртути выделяются преимущественно слизистыми оболочками пищеварительного тракта и почками, в связи с чем у пострадавших развивается стоматит, язвенный колит и поражение почек.
Помощь при острых отравлениях препаратами ртути сводится к следующему. Вначале предпринимают меры к удалению и предупреждению всасывания яда из желудочно-кишечного тракта.
С этой целью пострадавшему дают внутрь молоко, яичный белок (для связывания ртути белком), осторожно промывают желудок водой с активированным углем.
Затем назначают внутрь активированный уголь и солевое слабительное (магния сульфат).
Для предупреждения и купирования резорбтивного действия ионов ртути рекомендуется как можно раньше начать парентеральное введение антидотов. В качестве антидотов при отравлении ртутью используют унитиол и натрия тиосульфат.
Принцип действия унитиола заключается в том, что этот антидот, являясь веществом, содержащим SH-группы (сульфгидрильные группы), связывает ионы ртути и тем самым предупреждает блокирование ртутью SH-групп белков и ферментов организма (рис.
28).
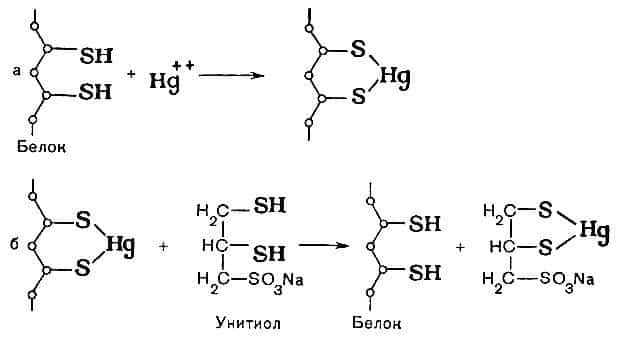 Рис. 28. Схема антитоксического действия унитиола при отравлениях солями тяжелых металлов. а — взаимодействие белка (фермента) с ионами ртути; б — защитное действие унитиола
Рис. 28. Схема антитоксического действия унитиола при отравлениях солями тяжелых металлов. а — взаимодействие белка (фермента) с ионами ртути; б — защитное действие унитиола
Действие натрия тиосульфата сводится к тому, что ионы ртути образуют с этим веществом неядовитые соли (сульфиты). Натрия тиосульфат при отравлениях препаратами ртути вводят внутривенно в виде 30% раствора по 5-10 мл. Наряду с указанными антидотами рекомендуется внутривенное введение растворов глюкозы.
Кроме того, при терапии отравлений препаратами ртути используют средства симптоматической терапии. Так, при сильных болях и шоке вводят анальгетики (морфин, промедол), при падении артериального давления — сосудосуживающие средства (эфедрин и др.) и т. д.
Отравления солями других тяжелых металлов (серебро, цинк, медь) проявляются теми же симптомами, что и отравления солями ртути.
Общие принципы помощи при отравлениях солями цинка и меди в основном аналогичны принципам терапии отравлений соединениями ртути.
Так как ионы серебра образуют с ионами хлора плохо растворимые соединения, при отравлениях солями серебра желудок промывают 1-2% раствором натрия хлорида, после чего в качестве слабительного назначают касторовое масло.
- Ионы серебра образуют с тиосульфатом натрия растворимые комплексы, в связи с чем тиосульфат натрия нельзя использовать в качестве антидота при отравлении солями серебра, так как в подобных случаях он почти неэффективен.
- Препараты
- Ртути дихлорид, Hydrargyri dichloridum — тяжелый белый порошок или белые кристаллы, растворимые в воде и спирте.
Применяют только наружно для дезинфекции в виде 0,1% (1:1000) или 0,2% (1:500) раствора. В связи с высокой токсичностью растворы препарата подкрашивают эозином в розовый цвет, чтобы отличать их от других применяемых растворов, а посуду, содержащую растворы, маркируют этикетками: «Яд», «Только для наружного применения», «Обращаться с осторожностью».
Формы выпуска: порошок; таблетки по 0,5 и 1 г, окрашенные эозином в розовый или красно-розовый цвет. Таблетки предназначены только для наружного Применения (для приготовления растворов).
Хранение: список А.
Серебра нитрат, Argenti nitras — бесцветные, прозрачные кристаллы в виде пластинок или белых кристаллических палочек. Легко растворим в воде. На свету темнеет. С галогенами (хлориды, йодиды, бромиды) выпадает в осадок.
Наружно в качестве антисептического и вяжущего средства применяют в виде 0,25-2% растворов и 1-2% мазей.
Как прижигающее средство используют в виде 5-10% растворов или per se в виде ляписных карандашей (Stillius Lapidis).
При хронических гастритах и язвенной болезни желудка серебра нитрат иногда назначают внутрь в виде 0,05-0,06% раствора по 1 столовой ложке 3 раза в день как вяжущее и противовоспалительное средство.
- Высшие дозы (для взрослых): внутрь — разовая 0,03 г, суточная 0,1 г.
- Хранение: список А; в защищенном от света месте.
- Протаргол, Protargolum — коричнево-желтый или коричневый порошок без запаха, слабогорького и слегка вяжущего вкуса, легко растворимый в воде.
- Применяют в виде растворов: для смазывания слизистых оболочек верхних дыхательных путей (1-5% раствор), промывания мочеиспускательного канала и мочевого пузыря (1-3% раствор) и в глазных каплях (1-3% раствор).
- Форма выпуска: порошок.
- Хранение: в защищенном от света месте.
Цинка сульфат, Zinci sulfas — бесцветные, прозрачные кристаллы или мелкокристаллический порошок вяжущего вкуса. Легко растворим в воде.
- Применяют наружно в виде 0,1-0,5% раствора (глазные капли, спринцевания).
- Формы выпуска: порошок; глазные капли (0,25% или 0,5% раствор цинка сульфата и борной кислоты 2%); тюбики-капельницы по 1,5 мл.
- Хранение: список Б.
Дерматол, Dermatolum — см. главу 1, 2 (препараты).
Ксероформ, Xeroformium — см. главу 1, 2 (препараты).
Примеры рецептов
Rp.: Solutionis Hydrargyri dichloridi 1:1000-1000 ml
D.S. Для дезинфекции.
Rp.: Solutionis Argenti nitratis 10% — 10 ml
D. in vitro nigro
S. Для прижигания грануляций.
Rp.: Dermatoli 0,2
Olei Cacao q.s.
ut f. suppositorium rectale
D.t.d.N. 10
S. По 1 свече 2 раза в день.
Rp.: Dermatoli 10,0
Zinci oxydi
Talci āā 25,0
M.f. pulvis
D.S. Присыпка.
Новое на atreya-ayurveda.ru средства от головной боли у индусов
девочки москвы
Опыт "Влияние тяжелых металлов на ферменты"
Аннотация
В
результате аварии на Чернобыльской АЭС 26 апреля 1986 года территория
Республики Беларусь была загрязнена радиоактивными элементами. На территории
нашей страны осели такие радиоактивные элементы, как плутоний-239, америция-241
стронций – 90, йод- 131.
Загрязнение
радионуклидами наземных и водных экосистем приводит к вовлечению этих элементов
в трофические (пищевые) цепи. Пищевые цепи представляют собой ряд
последовательных этапов, по которым осуществляется трансформирование вещества и
энергии в экосистеме. Все живые организмы связаны между собой, поскольку они
являются объектами питания.
При загрязнении одной из цепей радиоактивными веществами
осуществляется миграция и последовательное накопление нуклидов в других
элементах трофической цепи. Попадая в организм человека радионуклиды, вызывают
такие заболевания, как рак костей, лейкемию, нарушают структуру ДНК, влияют на
активность ферментов и т.д.
Влияние катионов тяжелых металлов на
активность фермента
Поступая в
биосферу, тяжелые металлы активно включаются в различные миграционные циклы
эко- и геосистем и представляют потенциальную опасность для всего живого.
Соединения тяжелых металлов способны сохранять токсичность практически
бесконечно, так как при их превращении металл остается без изменений.
Катионы
металлов, поступающие в организм человека или животного из окружающей среды,
образуют прочные связи с карбоксил-анионами и часто вызывают разрывы ионных
взаимодействий между ионизированными боковыми радикалами аминокислотных
остатков в глобуле, что приводит к потере активной структуры белка. Они снимают
электрическую поляризацию белка, уменьшая его растворимость.
Вследствие этого
находящийся в растворе белок выпадает в осадок. Такие токсичные элементы, как
Be, Cd, Sr, Cs, легко могут атаковать белки-ферменты, конкурируя с биогенными
элементами и вытесняя их.
Например, очень токсичный ион Cd2+ конкурирует
с ионом Zn2+, выполняющим в металлсодержащих ферментах роль кислоты
Льюиса и создающим локальный положительный заряд около активного центра
фермента. Замещение Zn2+ на Cd2+ приводит к дезактивации
ферментов. Свинец и все его соединения ядовиты.
Попадая в клетки, свинец, как и
многие другие тяжелые металлы, дезактивирует ферменты, взаимодействуя с SH —
группами белков — составляющих ферментов. Кадмий считается токсичнее свинца и
отнесен Всемирной организацией здравоохранения к числу наиболее опасных для
человека веществ. Не менее опасны эти металлы и для растений.
Поскольку
радиоактивные элементы (стронций, плутоний, америций), это тяжелые металлы, то
можно наглядно показать некоторые особенности их влияния на организм, на
примере свинца и кадмия.
Данная
работа может использоваться не только на уроках химии для развития общеучебных
компетенций, познавательного интереса, но и может являться структурным компонентом
исследовательской работы.
Данное исследование можно использовать как демонстрационный
опыт на уроке биологии, доказывающий, что грибы и ягоды, растущие вблизи дорог
категорически запрещается употреблять в пищу человеком.
Необходимость проверки
грибов и ягод на наличие в них радиоактивных элементов.
Описание опыта
Для изучения
влияния тяжелых металлов на ферменты можно использовать уреазу. Данный фермент
можно получить из растительных организмов.
Наибольшей активностью обладает
уреаза содержащаяся в семенах бобовых Для проведения эксперимента можно
использовать семечки кабачка, в них активность уреазы сохраняется в течение
одного года.
Уреаза катализирует гидролиз мочевины с образованием оксида
углерода(IV) и аммиака:
Метод определения
активности уреазы основан на тестировании выделяющегося аммиака фенолфталеином.
Наглядность данного опыта обеспечивается быстрым появлением интенсивной розовой
окраски индикатора.
- Реактивы и
оборудование: ступка
с пестиком, пробирки, пипетки, 1 % раствор мочевины, 0,02 % спиртовой раствор
фенолфталеина, дистиллированная вода, экстракт фермента, рабочие растворы
токсикантов. - Определение
активности уреазы - Приготовление
экстракта уреазы:
Очистить 3-4 кабачковых
семечки от кожуры и растереть ядра в ступке с 10 мл воды. Данный экстракт слить
в пробирку и использовать для проведения опытов.
Ход
опыта
Для опытов взять 2
мл суспензии ферментативного препарата. В пробирку добавить 1 мл воды или
токсиканта (солей тяжелых металлов), встряхнуть и добавить 2 мл раствора
мочевины. Следует подчеркнуть, что необходимо добавлять реагенты в той
последовательности, о которой сказано выше.
Затем в пробирку добавить 2-3 капли
спиртового раствора фенолфталеина, оставить при комнатной температуре на 3-5
мин. По интенсивности появляющейся окраски фенолфталеина судят об ингибировании
фермента.
Если окраска появляется, значит, уреаза сохраняет свою активность,
так как выделяется аммиак, а если окраска индикатора не появляется, значит,
реагент ингибирует фермент. В опытах используются различные концентрации
токсикантов. Готовить растворы солей и фенола необходимо с учетом разбавления
при проведении опыта.
Токсиканты в одних концентрациях ингибируют фермент, в
других нет. Исследовательский компонент эксперимента состоит в нахождении такой
концентрации фактора, при которой начинается ингибирование уреазы.
Опыт. Изучение
влияния солей тяжелых металлов на активность уреазы.
В качестве
токсиканта надо использовать растворы ацетатa свинца Pb(CH3COO)2
и нитрата кадмия Cd(NO3)2 в различных концентрациях
(10-6, 10-7, 10-8, 10-9 моль/л).
Эксперимент следует проводить по вышеприведенной методике.
Результаты опыта
занести в таблицу.
| Концентрация, моль/л | Cd(NO3)2 | Pb(CH3COO)2 | Контроль |
| 10-6 | |||
| 10-7 | |||
| 10-8 | |||
| 10-9 |
- В
таблице ставят знаки: - «+» — реагент
ингибирует фермент; - «-» — реагент не
ингибирует фермент.
ПОИСК
Активаторы. Ингибиторы. Глубокое исследование многих частных ферментативных реакций показало, что, кроме субстрата, фермента и иногда кофермента, для протекания реакции необходимо также участие других специфических веществ.
При этом было установлено, что, тогда как коферменты участвуют в реакции как реагенты, подобно тому как участвует в ней субстрат, существуют другие факторы, необходимые для реакции, играющие роль неносредственно в процессе активирования субстрата ферментом. Последние обычно называются активаторами.
К ним относятся многие ионы металлов. Химический механизм, посредством которого действуют активаторы, как правило, малоизучен. [c.803] Наибольшее значение имеют специфические ингибиторы, которые действуют на один фермент или на группу близких ферментов.
Механизм действия этих ингибиторов заключается в том, что они соединяются, блокируют активные группы, или активные центры, молекул ферментов, связывающих субстрат. Некоторые ингибиторы соединяются с металлами — активаторами ферментов. При этом частично или полностью подавляется активность фер.мента. [c.
48]
Функцию радиопротекторов выполняют сульфгидрильные соединения (глутатион, цистеин, цистеамин и др.
) и такие восстановители, как аскорбиновая кислота ионы металлов и элементы питания (бор, висмут, железо, калий, кальций, кобальт, магний, натрий, сера, фосфор, цинк) ряд ферментов и кофакторов (каталаза, пероксидаза, полифенолоксидаза, цитохром с, NAD) ингибиторы метаболизма (фенолы, хиноны) активаторы (ИУК, кинетин, гибберелловая кислота) и ингибиторы роста (абсцизовая кислота, кумарин) и др. [c.439]
Наконец, в-чеФвертых, следует предостеречь от слишком поспешных выводов такого рода, поскольку активация, как и рН-эффекты, действительно может быть связана с пространственной блокадой.
Она может объясняться просто удалением какой-то блокирующей группировки, скажем связанного ингибитора или одной из функциональных групп самого фермента, закрывающей активный центр и препятствующей тем самым образованию фермент-субстратного комплекса и каталитическому эффекту.
Подобный механизм неконкурентного поведения весьма вероятен, особенно в случае фермента типа аскорбатоксидазы, когда в активный центр входит ион металла, играющий существенную роль как в каталитическом эффекте, так и в связывании субстрата.
В подобном случае лиганд, связывающий ионы меди фермента, вполне может быть неконкурентным ингибитором, а другой лиганд, способный вытеснить первый, — неконкурентным активатором. Эти соображения не изменяют/синегмческой интерпретации, но влияют на выводы относительно химического механизма изучаемого процесса. [c.172]
Идеальным случаем анализа неорганических веществ было бы введение в раствор макромолекул, подобных ферментам. Молекулы при взаимодействии с неорганическими ионами могли бы образовать частицы с очень высокой каталитической активностью. А пока можно использовать уже готовые ферменты для определения микроконцентрации ионов металлов.
Многие из них сильно активируют ферменты, а некоторые, наоборот, дезактивируют их, выступая, таким образом, в роли ингибиторов. В роли активаторов и ингибиторов ферментов могут выступать самые разнообразные ионы, включая ионы щелочных и щелочноземельных металлов.
Некоторые ионы (уже теперь) определяют по их ингибирующему или активирующему действию на ферментативные реакции. [c.98]
Влияние на ферменты активаторов и ингибиторов впервые было обнаружено при изучении активаторов (стимулин) и ингибиторов (антиферменты) А. Я. Данилевским с сотр. еще в прошлом столетии. К числу агентов, повышающих активность ферментов, относятся ионы многих металлов и некоторые анионы. Особенно часто активаторами ферментов бывают [c.111]
Все рассматриваемые обычно типы угнетения реакции предусматривают прямое соединение фермента и ингибитора. Известны и иные виды торможения, когда ингибитор блокирует не фермент, а субстрат (или кофермент, или металл-активатор). При этом они становятся недоступными для взаимодействия с ферментом.
Естественно, что такое воздействие может произойти только тогда, когда концентрация (количество) ингибирующего вещества близка к концентрации субстрата или кофактора. Если увеличить количество субстрата или кофактора, то описываемое торможение будет снято.
Возможно и конкурентное торможение, при котором ингибитор конкурирует не с субстратом, а с коферментом или металлом, активирующим фермент. [c.63]
Интересна задача определения следов металлов, являющихся ингибиторами или активаторами ферментов. Аналитическая чувствительность таких реакций позволит определять 10- г/л металла [315]. [c.141]
Функции, которые выполняют ионы металлов в ферментативном катализе, проиллюстрированы на рис. 14.1, где Ь (лиганд) — субстрат, активатор или ингибитор фермента, М-«=+ — ион металла и Е — фермент. [c.444]
Скорость биохимических процессов, протекающих в клетках, определяется активностью ферментов, которая, в свою очередь, зависит от температуры, величины pH и присутствия в среде некоторых химических соединений.. Вещества, которые повышают активность ферментов, называются активаторами.
К их числу относятся многие витамины и некоторые катионы (Са, Mg, Мп). Соли тяжелых металлов, синильная кислота, антибиотики резко снижают активность ферментов и являются ингибиторами, которые блокируют активные центры фермента, препятствуя его реакции с субстратом. [c.
54]
Координационные соединения легких щелочных металлов имеют в основном электростатическую природу, поскольку у этих элементов не бывает частично заполненных р- и -орбиталей.
Из щелочноземельных металлов нас особенно интересуют кальций и магний, поскольку оба эти металла известны как активаторы ферментов, а в некоторых случаях как ингибиторы, подавляющие их действие. Ион Са + может иметь заполненные М- и 45-орбитали в этом случае он имеет координационное число 6 и образует октаэдрический комплекс.
Лиганды иона Mg2+ поставляют электроны 35-, Зр- и З -орбиталям с образованием октаэдрического комплекса зр д . Ингибирующее действие ионов Са2+ и можно наблюдать на примере р-метил-аспартазы [32]. [c.269]
Кристаллич. фосфоглюкомутаза из мышц кролика — белок, м. в. 62 ООО—74 ООО. В состав активного каталитич. центра этой Ф. входит остаток серина, оксигруппа к-рого непосредственно участвует в переносе остатка фосфорной к-ты, подвергаясь промежуточному фосфорилированию.
Последовательность расположения аминокислотных остатков в активном центре фермента -тре.-ал.-сер.-фосфо-гис.-асп. (или a n.-NHj)- рН-оптимум фермента 7,5 активатором фосфоглюкомутазы является Mg +.
Михаэлиса константа для этого катиона составляет 5-10 М, молекулярная активность фермента 5-10 /мин. Ингибиторами фосфоглюкомутазы являются п-хлор-меркурибензоат и ионы тяжелых металлов (Zn, u), что указывает на важную роль SH-групп в поддержании каталитич.
активности фермента металлосвязывающие агенты (гистидин, 8-оксихинолин и ди-фенилдитиокарбамат) активируют фосфоглюкомутазу. [c.241]
Большинство ферментов, переносящих фосфат, нуждаются для активности в ионах двухвалентных металлов. Эти ионы сравнительно легко удаляются из ферментов, что приводит к потере активности. При добавлении металлов она восстанавливается.
Поскольку единственными двухзарядными ионами, которые в физиологических условиях присутствуют в достаточном количестве, являются M.g + и Са +, то считают, что именно они выполняют биологическую функцию. Однако влияние ионов металлов на ферменты может быть разным.
Чаще всего наибольшей эффективностью обладает Mg2+. Некоторые металлы первого переходного ряда, особенно Мп +, могут заменять его, но активность фермента при этом несколько понижается.
Это же относится к Са +, однако иногда он ингибирует реакцию, тогда как в некоторых случаях Са + служит активатором, а Mg + — ингибитором. [c.634]
Активаторы и ингибиторы. Для ферментов характерна регуляция их активности специфическими низкомолекулярными веществами и ионами металлов, которые называют эффекторами, модуляторами или регуляторами ферментов.
Одни из них способны снижать активность фермента (ингибиторы), другие — повышать ее (активаторы). Такой механизм контроля активности ферментов широко изучается, поскольку имеет большое практическое значение. [c.
101]
Изменение конформации ферментов. Изменение конформации, т. е.
пространственного строения ферментного белка, происходит под действием неконкурентных ингибиторов и активаторов, которыми могут быть гормоны, промежуточные и конечные продукты ферментативных реакций, ионы металлов, лекарства (см. выше). Изменение конформации ферментов возможно и при изменении условий среды, например при повышении или снижении кислотности. [c.34]
Аллостерическая регуляция ферментативной активности. Аллостеричес-кий тип регуляции активности характерен для особой группы ферментов с четвертичной структурой, имеющих регуляторные центры для связывания аллостерических эффекторов (ингибиторов или активаторов). Механизм действия аллостерических эффекторов заключается в изменении конформации активного центра, затрудняющем или облегчающем превращение субстрата. Некоторые ферменты имеют несколько аллостерических центров, чувствительных к различным эффекторам. Роль аллосте-рического эффектора зачастую выполняют метаболиты, гормоны, ионы металлов, коферменты, а иногда и молекулы субстрата. Аллостерические ферменты отличаются от прочих ферментов особой S-образной кривой зависимости скорости ферментативной реакции от концентрации субстрата (рис. 2.9). Такой характер зависимости свидетельствует о том, что активные центры субъединиц функционируют кооперативно, т. е. сродство каждого следующего активного центра к субстрату определяется степенью насыщения предыдущих центров. [c.119]
И, наконец, соли тяжелых металлов, такие, как Ag, Си, РЬ, Hg, инактивируют ферменты благодаря своей способности денатурировать белки, т. е. их действие мало специфично к свойствам активного центра фермента.
Формально к ингибиторам можно отнести и вещества, способные реагировать с субстратом, коферментами или активаторами, например ионами металлов.
Ингибиторами можно считать и антитела, которые присоединяются к ферменту и лишают его каталитической активности, но мало специфичны к его адсорбционному и каталитическому центру. [c.72]
Mg-aктивиpyeмoй АТФазы, вероятно, Mg (или заменяющий его Мп) связывается фосфатной группой субстрата и, казалось бьг, не существенно, какой именно двухвалентный катион в этом участвует.
Однако при соединении, например, комплекса металл— АТФ с ферментом разные металлы действуют по-разному, связываясь с различными группами белков.
Поэтому N1, С(1, Со оказываются не активаторами (подобно Mg, Мп), но ингибиторами процесса. [c.413]
В глутамат и аммиак в присутствии арсената, Mg++ (или Мп++) и аденозиндифосфата [561]. Экспериментальные данные свидетельствуют о том, что реакции синтеза переноса и арсенолиза катализируются одним и тем же ферментом.
С этим выводом согласуется тот факт, что в ходе очистки фермента наблюдается параллельное повышение его активности в указанных трех реакциях и что при ультрацентрифугировании препаратов эти реакции оказываются связанными с одной и той же монодис-персной фракцией.
Кроме того, оказалось, что эти реакции нуждаются примерно в одних и тех же нуклеотидах и ионах металлов.
Описаны некоторые различия в действии ионов металлов, активаторов (например, р-меркаптоэтанола, цистеина) и ингибиторов (например, фторида) на реакции синтеза и переноса, но это не может служить доказательством различия ферментов. [c.271]
С точки зрения основной концепции этой книги -наиболее интересным представляется обязательное участие катионов двухвалентных металлов в киназных реакциях. Чаще всего это Mg +, который является, вероятно, самым типичным физиологическим активатором. Обычно магний можно заменить марганцем.
Возможно также участие и других ионов двухвалентных металлов — Со +, 2п + [2]. Многие киназные реакции активируются кальцием, однако для некоторых он является ингибитором. Такие различия, по-видимому, обусловлены разными типами взаимодействий с ионами Са +.
По классификации Кон [4, 5] (основанной на изучении спектров ЯМР), ферменты, активируемые кальцием, относятся к типу I. В этом случае металл связывается с ферментом не непосредственно, а через молекулу субстрата (Е—5—М).
При ингибировании кальцием он, скорее всего, присоединяется прямо к белку (тип И, Е—-М—5, ом. гл. 14). [c.661]
ЭФФЕКТОРЫ ФЕРМЕНТОВ, взмевягот скорость ферментативной р-ции. Различают ингибиторы (снижают скорость) и активаторы (повышают скорость). Конкурентные ингибиторы уменьшают константу Михаэлиса (см. Ферментативных реакций кинетика), неконкурентные — макс. скорость р-ции. Ингибиторы смет, типа действуют по обоим механизмам одновременно. Активаторы влияют, как правило, на макс.
скорость р-ции. Для ферментов, состоящих из неск. субъединиц, Э. ф. часто влияют на сродство фермента к субстрату (аллостерич. Э. ф.). Прн этом связывание Э. ф. на одной субъединице может повышать или понижать сродство к субстрату др. субъединицы.
Это проявляется в изменении характера зависимости скорости р-ции (или ф-ции насыщения фермента субстратом) от концентрации субстрата (появление З-образной или др. типов негипербо-лич. зависимости). Э. ф. могут быть аналоги субстратов (налр., производные.О-аминокислот — ингибиторы протеолитич. ферментов), ионы металлов, мн. анионы (Р , СЫ и др.). Формально Э. ф. является Н+, т. к.
изменение pH таеды влияет на скорость ферментативной р-ции. Эхинопсин (М-метил-4-хинолон), хиноли-новый алкалоид, содержащийся в семенах О [c.724]
Очень важны каталитические реакции в биохимическом анализе. Многочисленные химические реакции, получившие название энзиматических (ферментативных), катализируются энзимами (ферментами) — природными катализаторами процессов, протекающих в живых организмах.
Выделить эти природные катализаторы трудно, иногда невозможно, поэтому о концентрации их судят прежде всего по их каталитическому действию, по степени ускорения ими соответствующей химической реакции.
Механизм действия катализаторов такого типа очень сложен, но, по-видимому, стадия комплексообразования на одном или нескольких этапах энзиматических реакций все-таки обязательна.
Часто действие отдельных ионов металлов в биохимических реакциях близко к действию энзимов (сложные органические реакции декарбоксилирования щавелевой и уксусной кислот катализируются ферментами и ионами двухвалентных марганца, цинка, кадмия, никеля и др.).
Такие реакции могут быть использованы также для определения отдельных ионов металлов. Чувствительность их невелика, но они позволяют определять ионы с заполненной электронной рболочкой (кальций, цинк, кадмий и др.). Некоторые типы металлов действуют как активаторы или ингибиторы ферментативных реакций. Это свойство металлов тоже используется в аналитической химии. [c.46]
Влияние некоторых тяжелых металлов и микроэлементов на биохимические процессы в организме человека
Одними из наиболее вредных для биосферы Земли загрязнений, имеющих самые разнообразные вредные последствия, как для здоровья людей, так и для жизнедеятельности живых организмов, являются загрязнения тяжелым и металлами.
Наряду с пестицидами, диоксинами, нефтепродуктами, фенолами, фосфатами и нитратами тяжелые металлы ставят под угрозу саму существование цивилизации.
Увеличивающийся масштаб загрязнений окружающей среды оборачивается ростом генетических мутаций, раковых, сердечно-сосудистых и профессиональных заболеваний, отравлений, дерматозов, снижением иммунитета и связанных с этим болезней.
В подавляющем большинстве случаев первоисточником загрязнений является экологически безграмотная деятельность человека. Среди опасных для здоровья веществ тяжелые металлы и их соединения занимают особое место, та к как являются постоянными спутниками в жизни человека.
Очень часто многоэлементный анализ используют в медицине при выяснении причин острых и хронических отравлений, а так же при лечении профессиональных болезней, связанных с хроническим воздействием тяжелых металлов на организм в условиях реального производства и экологических особенностей.
В химико-токсикологическом анализе применяется метод минерализации при исследовании биологического материала (органов трупов, биологических жидкостей, растений, пищевых продуктов и др.
) на наличие та к называемых «металлических ядов».
Эти яды в виде солей, оксидов и других соединений в большинстве случаев поступают в организм через пищевой канал, в соответствующих отделах которого они всасываются в кровь и вызывают отравления.
Важнейшим и «металлическими ядами » являются соединения бария, висмута, кадмия, марганца, меди, ртути, свинца, серебра, таллия, хрома, цинка и соединения некоторых неметаллов (мышьяка, сурьмы).
Ряд перечисленных выше химических элементов, соединения которых являются токсичными. В небольших количествах содержатся в тканях организма как нормальная их составная часть, В виду незначительных количеств этих химических элементов.
Содержащихся в организме, их называют микроэлементами.
Установлены предельно-допустимые концентрации микроэлементов в организме.
| Наименование элемента | Kpoвь (mkg/ml) | Moчa (mkg/ml) |
|
|
|
Амплитуда содержания того или иного элемента у разных организмов может значительно выходить за пределы указанных концентраций. Фактор концентрации имеет определяющий характер для оценки физиологического действия элемента. Уже почти 85 лет известно, что:
- Каждый элемент имеет присущий ему диапазон безопасной экспозиции, который поддерживает оптимальные тканевые концентрации и функции;
- У каждого элемента имеется свой токсический диапазон, когда безопасная степень его экспозиции превышена [Mertz, 1982].
Правила Мертца особенно важны для токсикологической химии. Металлы с малыми значениями диапазона концентраций условно отнесены в разные группы по «степени опасности» (чем меньше диапазон, тем «опаснее»):
- As, Be, Cd, Hg, Pb, Tl, Zn;
- B, Co, Cr, Cu, Mo, Ni, Sb, Sc;
- Ba, Mn, Sr, V, W.
Общепризнанно, что наиболее опасными элементами для человека, да и вообще для теплокровных животных, являются кадмий, ртуть и свинец (Cd, Hg, Pb).
Кадмий вызывает отравление, описанное в Японии как болезнь «итаи-итаи» (ох-ох). Название болезни происходит от боли в спине и ногах, сопровождающей остеомаляцию (декальцификацию) костей, что приводит к ломкости костей. Хроническое отравление кадмием разрушает печень и почки, приводя к сильнейшему нарушению функции почек.
Избыток кадмия нарушает метаболизм металлов, особенно железа и кальция, нарушает действие цинковых и иных металло-ферментов, блокирует сульфгидрильные группы ферментов, нарушает синтез ДНК.
Кадмий легко замещает металлфлавопротеиновых комплексах, где главенствующую роль играют железо и молибден, нарушая двухстадийный процесс окисления.
Ртуть токсична в любой своей форме. Ртуть в природных условиях довольно быстро превращается в летучее токсическое соединение — хлорид метилртути. В организме ионы метилртути быстро попадают в эритроциты, печень и почки, оседают в мозге, вызывая серьезные необратимые кумулятивные нарушения ЦНС.
Это приводит, к конце концов, к общему и церебральному параличу, деформации конечностей, особенно пальцев, затрудненному глотанию, конвульсиям и смерти. Ртуть блокирует активность ряда важнейших ферментов, в частности карбоангидразы, карбоксипептидазы, щелочной фосфатазы.
Легко замещает кобальт в корриноидах, извращая метаболические реакции, связанные с витамином В12.
Повреждение механизма биосинтеза ДНК из-за недостаточности витамина В12 является причиной мегалобластических анемий и наиболее распространенной формы — пернициозной анемии, что приводит к дегенеративным изменениям нервной системы.
Свинец известен как токсическое вещество почти 5 тысяч лет среди греческих и арабских ученых.
В современных условиях наибольшим источником загрязнения свинцом среды обитания считаются выхлопы бензиновых двигателей автомашин, поскольку в бензин добавляется тетраэтилсвинец для повышения октанового числа.
Свинец препятствует одной из ступеней биосинтеза гема, считается сильнейшим нейротоксином, вызывает повышенную агрессивность. Хроническое отравление свинцом постепенно приводит к нарушениям функций почек, нервной системы, анемии.
Токсичность свинца увеличивается при недостатке в организме кальция и железа. Свинец блокирует SH-группы белков, образуя комплексы с фосфатными группами рибозы у нуклеотидов, особенно у цитидина, и тем самым быстро разрушает РНК, ингибирует ферменты, в частности карбоксипептидазу.
Мышьяк относится к числу наиболее сильных и опасных ядов. В присутствии кислорода быстро образует очень ядовитый мышьяковистый ангидрид.
При пероральном отравлении высокая концентрация мышьяка наблюдается в желудке, кишечнике, печени, почках и поджелудочной железе, при хроническом отравлении постепенно накапливается в коже, волосах и ногтях. Из-за ингибирования различных ферментов нарушает метаболизм.
В процессе отравления первыми страдают аксоны, что приводит к периферической нейропатии и параличу конечностей. Мышьяк считается канцерогенным для человека.
Таллий очень токсичен, зачастую его называют «химическим СПИДом». Таллий, проникая через клеточные мембраны, образует сильные комплексы, например, нерастворимый комплекс с рибофлавином.
Это приводит к нарушению метаболизма серы и разрушению иммунной системы. Отравление таллием приводит к гастроэнтеритам, периферической нефропатии, при большой абсорбции к смерти.
Через 2-3 недели после небольшого отравления у человека выпадают волосы.
Цинк в виде двухвалентного элемента входит в состав свыше 20 ферментов, включая участвующие в обмене НК. Большая часть цинка в теле человека находится в мышцах, а самая высокая концентрация — в простате. В крови он присутствует в эритроцитах как кофактор в карбоангидразе.
Избыток цинка может разбалансировать метаболические равновесия других металлов. Разбалансировка отношения цинк/медь является главным причинным фактором в развитии ишемической болезни сердца. Избыточное потребление солей цинка может приводить к острым кишечным отравлениям с тошнотой.
В общем, цинк не очень опасен, а возможность отравления, вероятнее всего зависит от совместного присутствия токсичного кадмия.
Медь является необходимым кофактором для нескольких важнейших ферментов, катализирующих разнообразные окислительно-восстановительные реакции, без которых нормальная жизнедеятельность невозможна. Медь входит в качестве необходимого элемента в состав цитохромоксидазы, тироназы и других белков.
Их биологическая роль связана с процессами гидроксилирования, переноса кислорода, электронов и окислительного катализа. В тканях здорового организма концентрация меди в течение всей жизн и поддерживается строго постоянной. В норме существует система, препятствующая непрерывному накоплению мед и в тканях путем ограничения ее абсорбции ил и стимуляции ее выведения.
Хронический избыток меди в тканях При соответствующих заболеваниях вызывают токсикоз : ведет к остановке роста, гемолизу, снижению содержания гемоглобина, к деградации тканей печени, почек, мозга. Около 95 % меди в организме присутствует в составе гликопротеина крови церулоплазмина.
Известен факт недостатка этого белка При болезни Вильсона-Коновалова — врожденном дефиците метаболизма (гепатолентикулярная дегенерация). Из-за генетического дефекта в синтезе церулоплазмина его содержание в крови резко снижено. В результате медь не связывается в комплекс с нормальной для организма константой устойчивости.
Это приводит к недостатк у мед и в цеп и реакций метаболизма, приводящей к естественному для здорового организма синтез у соединительной ткани. Для осуществления нормального процесса сшивки мономеров эластина и коллагена не хватает активной Си-лизолоксидазы.
С другой стороны «освободившиеся» ионы меди, лишившись по сути единственного нормального потребителя, откладываются в специфических тканях (печень, ядра мозга, почки, эндокринные железы, радужная оболочка глаз), где оказывают прямой токсический эффект. Создается парадоксальная ситуация избытка меди в специфических тканях при ее недостатке в нормальной цепи метаболизма.
Хром один из наименее токсичных элементов. При острых отравлениях накапливается во внутренних органах.
Считается, что трехвалентный хром в виде комплекса с никотиновой кислотой и алифатическим и аминокислотам и работает в организме в качестве «фактора толерантности к глюкозе».
Его действие заключается в усилении гипогликемического действия инсулина. В обычных условиях отрицательным является недостаток хрома в организме.
Сурьма — менее токсичный элемент, чем мышьяк. При отравлении накапливается в скелете, почках, селезенке.
Барий в виде двухвалентного катиона ядовит из-за его антагонизма с калием (но не с кальцием). У обоих ионные радиусы подобны. Барий является мускульным ядом. Абсорбированный барий откладывается в костях и в пигментной оболочке глаз.
Марганец — элемент почти нетоксичен, особенно в виде двухвалентного иона. В виде перманганат-иона токсичен из-за окислительной способности. Отравление происходит в случае вдыхания оксида в промышленном производстве.
Серебро. Элемент накапливается в печени и в меньших количествах, но равномерно, в остальных органах и тканях. Отложения серебра отмечено в клубочках почек и в субэпителиальных слоях кож и («аргироз» — голубоватое окрашивание кожи).
При различных патологиях имеет место изменение содержания микроэлементов в организме. Исследование сыворотки больных острым вирусным гепатитом, а также при постгепатитном циррозе показало, что у пациентов с острым гепатитом концентрация цинка почти не менялась, концентрация кадмия значительно увеличивалась.
Концентрация меди и марганца незначительно уменьшалась. При хроническом гепатите и постгепатитном циррозе содержание меди и цинка в сыворотке уменьшалось, а кадмия увеличивалось. Содержание марганца почти не менялось.
Выделение с мочой меди, превышающее 115 мкг/сутки и сопровождаемое низким содержанием в крови, свидетельствует о синдроме системного заболевания, например, болезни Вильсона-Коновалова.
Повышенное содержание в крови и моче алюминия, особенно у пожилых людей, может сопровождать энцефалопатию, болезнь Альцгеймера и другие формы слабоумия, а при почечной недостаточности также остеомаляцию и микроцитарную гипохромную анемию. Повышенное содержание в крови и моче лития характерно для больных с патологией мочевыделительной системы, нефропатиями.
Повышенное относительно ПДК содержание в биологических жидкостях отдельных тяжелых металлов может свидетельствовать о хроническом воздействии токсикантов на организм и перенапряжении работы почек и печени. Это требует мер по очистке организма от избытка тяжелых металлов, например, с помощью препаратов с полианионами (морская капуста) в незапущенных случаях.
Повышенное содержание в крови и моче наиболее токсичных тяжелых металлов (кадмия, ртути, свинца) требует энергичных мер по их выведению, поскольку их избыток разрушает нервную, сердечно-сосудистую и иммунную системы.
Повышенное содержание в крови и моче таллия и селена может пролить свет на причины облысения и плохое самочувствие таких больных.
Повышенное содержание в организме бора должно привлечь внимание к тяжелым металлам, содержание которых не превышает ПДК, т.к. он оказывает синергистское (усиливающее) влияние на их токсические свойства.
Токсичность «металлических ядов» объясняется связыванием их с соответствующими функциональными группами белковых и других жизненно важных соединений в организме. В результате нарушаются нормальные функции соответствующих клеток и тканей в организме, и наступает отравление, которое в ряде случае в заканчивается смертью.






