- ХИМИЯ
- Оксиды — что это такое? Химические свойства и классификация
- Виды оксидов
- Номенклатура оксидов
- Названия некоторых оксидов: таблица
- 2. Взаимодействие с кислотными оксидами и кислотами
- Химические свойства кислотных оксидов
- 1. Взаимодействие с водой
- 3. Взаимодействие с амфотерными оксидами и гидроксидами
- 2. Окисление простых веществ — неметаллов
- 3. Разложение гидроксидов
- 4. Окисление сложных веществ
- Урок 15. свойства оксидов неметаллов. свойства серной и азотной кислот. водородные соединения неметаллов — Химия — 11 класс — Российская электронная школа
- Неметаллические оксиды Как они образуются, Номенклатура, Свойства / химия
- Как они образовались?
- номенклатура
- Систематическая номенклатура с римскими цифрами
- Систематическая номенклатура с префиксами
- Традиционная номенклатура
- Сводные правила для названия неметаллических оксидов
- Первое правило
- Традиционная номенклатура
- Систематика с префиксами
- Систематика с римскими цифрами
- Второе правило
- Традиционная номенклатура
- Систематическая номенклатура с префиксами
- Систематическая номенклатура с римскими цифрами
- Третье правило
- Традиционная номенклатура
- Систематическая номенклатура с префиксами или римскими цифрами
- свойства
- приложений
- примеров
- Оксид хлора
- Оксид кремния
- Оксид серы
- ссылки
- ПОИСК
>>> Перейти на мобильный размер сайта >>>
Учебник для 11 класса
ХИМИЯ
В оксидах неметаллов связь между атомами ковалентная полярная. Среди оксидов молекулярного строения есть газообразные СO2, SO2, N2O, СО, NO и др., жидкие (летучие) SO3, N2O3, твердые (летучие) Р2O5, N2O5, SeO2. Твердый, очень тугоплавкий оксид SiO2 — вещество с атомной кристаллической решеткой.
Оксиды неметаллов делят на две группы: несолеобразующие и солеобразующие. К несолеобразующим оксидам относятся SiO, N2O, NO, NO2, CO. Все остальные оксиды неметаллов являются солеобразующими, кислотными.
При растворении их в воде образуются гидраты оксидов — гидроксиды, по своему характеру являющиеся кислотами.
Кислоты и кислотные оксиды в результате химических реакций образуют соли, в которых неметалл сохраняет степень окисления.
Например:
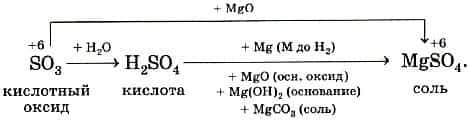
Кислотный оксид SiO2 нерастворим в воде, но ему также соответствует гидрат в виде кислоты H2SiO3 и соли:
Оксиды и соответствующие им гидроксиды — кислоты, в которых неметалл проявляет степень окисления, равную номеру группы, т. е. высшее ее значение, называют высшими. Рассматривая Периодический закон, мы уже характеризовали их состав и свойства, например:
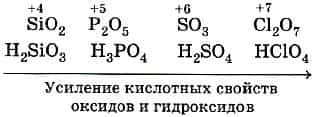
- В пределах одной главной подгруппы, например VI группы, действует следующая закономерность изменения свойств высших оксидов и гидроксидов.
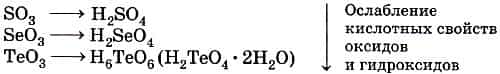
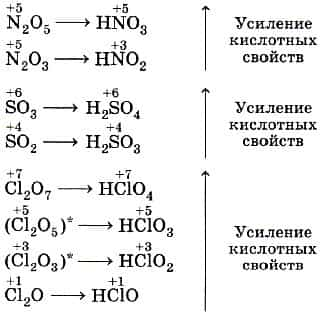
- Если неметалл образует два или более кислотных оксидов, а значит, и соответствующих кислородсодержащих кислот, то их кислотные свойства усиливаются с увеличением степени окисления неметалла.
-
!!! Оксиды такого состава неизвестны; НСlO2 даже в водном растворе быстро разлагается.
Оксиды и кислоты, в которых неметалл имеет высшую степень окисления, могут проявлять только окислительные свойства.
Особенности сильнейших окислителей азотной кислоты HNO3 и концентрированной серной кислоты H2SO4 проявляются в реакциях с металлами, неметаллами, органическими веществами. Эти их свойства мы рассмотрим в § 20.
Оксиды и кислоты, где неметалл имеет промежуточную степень окисления, могут проявлять и окислительные, и восстановительные свойства.
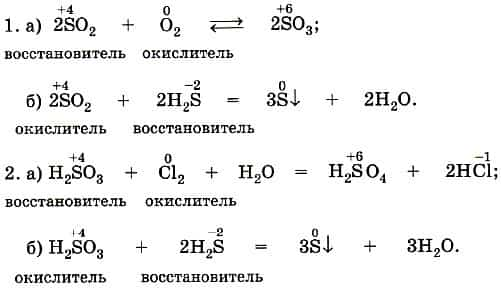
Оксиды — что это такое? Химические свойства и классификация
Оксиды — это сложные вещества, состоящие из двух химических элементов (т. е. бинарные соединения), один из которых — кислород в степени окисления −2.
Общая формула оксидов: ЭxOy, где Э – химический элемент, а x и y — индексы, определяемые степенью окисления химических элементов.
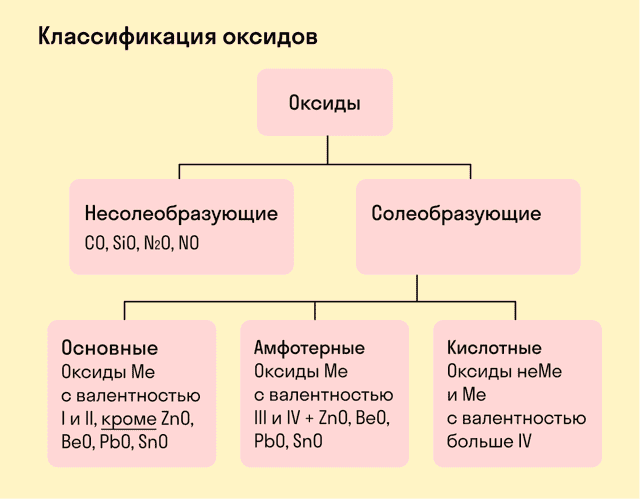
Виды оксидов
- Все оксиды делятся на солеобразующие и несолеобразующие.
- Несолеобразующие оксиды — это оксиды, которые не взаимодействуют с кислотами и щелочами, то есть не способны образовать соли.
- К несолеобразующим оксидам относят: CO, SiO, N2O, NO.
- Солеобразующие оксиды — это оксиды, которые взаимодействуют с кислотами и щелочами с образованием солей.
- Солеобразующие оксиды делятся на три группы:
-
Основные оксиды — это оксиды, образованные металлами со степенью окисления +1 или +2.
Примеры основных оксидов: Na+12O, Ca+2O, Ba+2O.
-
- Амфотерные оксиды — оксиды, образованные металлами со степенью окисления +3 или +4.
- К амфотерным оксидам относят также: ZnO, BeO, PbO, SnO.
- Несмотря на то, что эти металлы проявляют степень окисления +2 в данных соединениях, их оксиды проявляют амфотерные свойства.
- Примеры амфотерных оксидов: Al+32O3, Fe2+3O3.
-
Кислотные оксиды — оксиды, образованные металлами с валентностью V и более или неметаллами с любой валентностью (за исключением несолеобразующих оксидов, то есть CO, SiO, N2O, NO).
Примеры кислотных оксидов: S+6O3, N2+5O5, Mn2+7O7.
Если один и тот же химический элемент образовывает несколько оксидов, то с увеличением степени окисления основные свойства оксидов ослабевают и усиливаются кислотные.
Например:
- CrO (оксид хрома (II)) — проявляет основные свойства;
- Cr2O3 (оксид хрома (III)) — проявляет амфотерные свойства;
- CrO3 (оксид хрома (VI)) — проявляет кислотные свойства.
Закрепим знания о типах оксидов, изучив схему:
Номенклатура оксидов
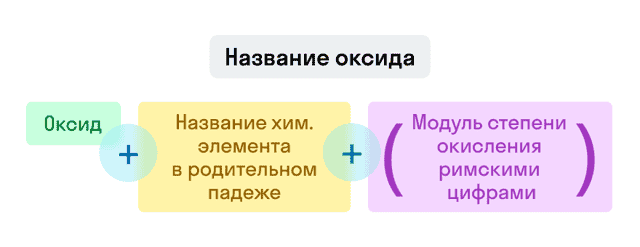
Названия оксидов строятся по систематической номенклатуре следующим образом:
-
Пишем слово «оксид».
-
Указываем название второго химического элемента в родительном падеже.
-
Если этот элемент имеет переменную валентность, то указываем валентность элемента в этом соединении в скобках римской цифрой.
Примеры названий оксидов:
- Fe2O3 — оксид железа (III). Читается: феррум два о три.
- Na2O — оксид натрия. Читается: натрия два о.
- SO3 — оксид серы (VI). Читается: эс о три.
До появления систематической номенклатуры вещества называли по присущим им специфическим свойства (цвету, запаху и т. д.). Такой способ названия веществ — тривиальная номенклатура. Некоторые названия используются и сейчас.
Названия некоторых оксидов: таблица
| H2O | Вода | Оксид водорода |
| CO2 | Углекислый газ | Оксид углерода (IV), диоксид углерода |
| CO | Угарный газ | Оксид углерода (II), монооксид углерода |
| SO3 | Серный газ | Оксид серы (VI), триоксид серы |
| SO2 | Сернистый газ | Оксиды серы (IV), диоксид серы |
| SiO2 | Кварц, горный хрусталь, песок кварцевый, речной и морской | Оксид кремния |
| Al2O3 | Глинозем | Оксид алюминия |
| Fe2O3 | Гематит (крокус) | Оксид железа (III) |
| CaO | Негашеная известь | Оксид кальция |
С водой способны реагировать оксиды тех металлов, которым соответствуют растворимые гидроксиды. То есть с водой реагируют только оксиды щелочных и щелочноземельных металлов.
Оксид магния взаимодействует с водой только при нагревании.
2. Взаимодействие с кислотными оксидами и кислотами
Основные оксиды, соответствующие щелочам, взаимодействуют со всеми кислотными оксидами и кислотами. Оксиды неактивных металлов взаимодействуют только с кислотными оксидами, соответствующими сильным кислотам, или с сильными кислотами.
В эту реакцию могут вступать только основные оксиды щелочных или щелочноземельных металлов. При сплавлении двух оксидов образуется соль.
Как составлять такие соли: металл в этой соли берем из основного оксида, а кислотный остаток из амфотерного оксида (они проявляют более кислотные свойства).
Химические свойства кислотных оксидов
1. Взаимодействие с водой
Кислотные оксиды взаимодействуют с водой с образованием соответствующих кислот. За исключением SiO2, которому соответствует нерастворимая кремниевая кислота.
Кислотные оксиды сильных кислот способны взаимодействовать с любыми основными оксидами или основаниями.
Кислотные оксиды, соответствующие слабым кислотам (такие как CO2, SO2), способны взаимодействовать с основными оксидами, соответствующим щелочам, а также с щелочами.
3. Взаимодействие с амфотерными оксидами и гидроксидами
С амфотерными оксидами в реакцию вступают кислотные оксиды — как правило, сильных кислот.
Амфотерные оксиды не взаимодействуют с водой — даже при нагревании!
Амфотерные оксиды взаимодействуют только с сильными и средними кислотами и их оксидами.
Амфотерные оксиды взаимодействуют только с теми оксидами, которые соответствуют щелочам. Реакция протекает только в расплаве, так как в растворе такие оксиды взаимодействуют преимущественно с водой с образованием щелочей.
Продукты взаимодействия амфотерных оксидов со щелочами зависят от условий проведения реакции. В растворе образуются комплексные соли, а при сплавлении – средние соли.
Почти все металлы окисляются кислородом до устойчивых степеней окисления.
Например: 4Al + 3O2 = 2Al2O3
Не взаимодействуют с кислородом: платина, золото и палладий.
- Металлы с переменной степенью окисления, как правило, образуют соединения в степени окисления +3:
- 4Cr + 3O2 = 2Cr2O3
- При взаимодействии щелочных металлов (элемента IA группы) образуются пероксиды Me2O2 или надпероксиды MeO2, где Ме — щелочной металл.
2. Окисление простых веществ — неметаллов
- При окислении неметаллов в избытке кислорода, как правило, образуются высшие оксиды (это оксиды, в которых неметалл проявляют высшую степень окисления):
- 4P + 5O2 (избыток) = 2P2O5
- При недостаточном количестве кислорода образуются оксиды неметаллов в промежуточной степени окисления:
- 4P + 3O2 (недостаток) = 2P2O3
- Существуют и исключения. Например, сера окисляется лишь до оксида серы (IV) даже в избытке кислорода:
- S + O2 = SO2
- Или азот, который взаимодействует с кислородом только при температуре 2 000̊С или под действием электрического разряда с образованием оксида азота (II):
- N2 + O2 = 2NO
Галогены (элементы VIIA группы) вовсе не взаимодействуют с кислородом, так же как и инертные газы (элементы VIIIA группы).
3. Разложение гидроксидов
- Некоторые кислоты и гидроксиды неустойчивы и самопроизвольно разлагаются по схеме:
- Гидроксид (кислота) = оксид + вода
- Например:
- H2SO3 = SO2↑ + H2O
- H2CO3 = CO2↑ + H2O
- Ag(OH) = Ag2O + H2O
- NH4OH = NH3↑ + H2O
- Оксиды тяжелых металлов (нерастворимые гидроксиды) и кремниевая кислота разлагаются при нагревании по той же самой схеме.
- Например:
4. Окисление сложных веществ
- Сложные бинарные (состоящие из двух химических элементов) соединения окисляются с образованием двух оксидов этих элементов в устойчивых степенях окисления.
- Например:
- 2H2S + 3O2 = 2SO2 + 2H2O
- 4NH3 + 5O2 = 4NO + 6H2O
Также оксиды получают разложением солей, например, карбонатов, нитратов сульфатов и т. д.
Например, Li2CO3 = Li2O + CO2↑
Мы узнали, какие вещества в химии называют оксидами, какие бывают оксиды, а также разобрали свойства каждого вида. Осталось подкрепить теорию практикой — а сделать это можно на курсах по химии в онлайн-школе Skysmart!
Летняя перезагрузка
Бесплатный телеграм-марафон для мам и пап. Узнайте, как провести семейное лето с пользой, и подготовьтесь к нему уже сейчас!

Урок 15. свойства оксидов неметаллов. свойства серной и азотной кислот. водородные соединения неметаллов — Химия — 11 класс — Российская электронная школа
Химия, 11 класс
Урок № 15. Свойства оксидов неметаллов. Свойства серной и азотной кислот. Водородные соединения неметаллов
Перечень вопросов, рассматриваемых в теме: урок посвящён изучению соединений неметаллов: оксидам неметаллов, кислородсодержащим кислотам и водородным соединениям неметаллов.
Глоссарий
Азотная кислота – HNO3 — представляет собой бесцветную «дымящуюся» на воздухе жидкость. Приобретает на воздухе желтоватый цвет из-за разложения на двуокись азота.
Аммиак – NH3 – бинарное химическое соединение азота с водородом, бесцветный токсичный газ с резким характерным запахом, 10%-ный раствор аммиака используют в медицине, называют нашатырным спиртом.
Высшие оксиды – оксиды, в которых элементы проявляют свою наибольшую валентность
Метан – CH4 — бинарное химическое соединение водорода и углерода. Бесцветный газ без запаха, основной компонент природного газа.
Серная кислота – H2SO4 – сильная двухосновная кислота. При обычных условиях концентрированная серная кислота — тяжёлая маслянистая жидкость без цвета и запаха. В технике серной кислотой называют её смеси как с водой, так и с серным ангидридом SO3.
Если молярное отношение SO3 : H2O < 1, то это водный раствор серной кислоты, если > 1 — раствор SO3 в серной кислоте (олеум). Мировое производство серной кислоты около 200 млн тонн в год.
Самый крупный потребитель серной кислоты — производство минеральных удобрений.
Сернистый газ – SO2 – оксид серы IV. В нормальных условиях представляет собой бесцветный газ с характерным резким запахом (запах загорающейся спички). Токсичен. Один из основных компонентов вулканических газов.
Серный газ – SO3 – оксид серы VI. В обычных условиях легколетучая бесцветная жидкость с удушающим запахом. Весьма токсичен. При температурах ниже 16,9 °C застывает с образованием смеси различных кристаллических модификаций твёрдого SO3.
Сероводород – SH2 – бинарное химическое соединение водорода и серы. Бесцветный газ со сладковатым вкусом, обеспечивающий запах протухших куриных яиц.
Силан – SiH4 — бинарное химическое соединение водорода и кремния. Бесцветный газ с неприятным запахом.
Угарный газ – CO – монооксид углерода, оксид углерода II, бесцветный чрезвычайно токсичный газ без вкуса и запаха. Горюч.
Так называемый «запах угарного газа» на самом деле представляет собой запах органических примесей.
Токсическое действие оксида углерода(II) обусловлено образованием карбоксигемоглобина — значительно более прочного карбонильного комплекса с гемоглобином, по сравнению с комплексом гемоглобина с кислородом.
Углекислый газ – CO2 – диоксид углерода, оксид углерода IV, бесцветный газ, почти без запаха, но в больших концентрациях приобретает кисловатый запах, знакомый нам по газировке. Является одним из парниковых газов.
Фосфин – PH3 — бинарное химическое соединение водорода и фосфора. Бесцветный ядовитый газ без запаха, однако примеси могут дать ему запах тухлой рыбы.
Основная литература: Рудзитис, Г. Е., Фельдман, Ф. Г. Химия. 10 класс. Базовый уровень; учебник/ Г. Е. Рудзитис, Ф. Г, Фельдман – М.: Просвещение, 2018. – 224 с.
Дополнительная литература:
1. Рябов, М.А. Сборник задач, упражнений и тестов по химии. К учебникам Г.Е. Рудзитис, Ф.Г. Фельдман «Химия. 10 класс» и «Химия. 11 класс»: учебное пособие / М.А. Рябов. – М.: Экзамен. – 2013. – 256 с.
2. Рудзитис, Г.Е. Химия. 10 класс : учебное пособие для общеобразовательных организаций. Углублённый уровень / Г.Е. Рудзитис, Ф.Г. Фельдман. – М. : Просвещение. – 2018. – 352 с.
Открытые электронные ресурсы:
- Единое окно доступа к информационным ресурсам [Электронный ресурс]. М. 2005 – 2018. URL: http://window.edu.ru/ (дата обращения: 01.06.2018).
ТЕОРЕТИЧЕСКИЙ МАТЕРИАЛ ДЛЯ САМОСТОЯТЕЛЬНОГО ИЗУЧЕНИЯ
Соединения неметаллов с кислородом и водородом
Неметаллы (углерод, кислород, азот, сера, галогены) могут образовывать соединения как с кислородом (оксиды), так и с водородом. Водородные соединения являются газами или жидкостями, например, вода, аммиак, сероводород, соляная кислота. Оксиды могут быть газами (углекислый или сернистый газ), жидкостями (оксид хлора(VI) и (VIII)) или твёрдыми телами (оксид фосфора(V)).
- Оксиды неметаллов
- Типичными примерами оксидов неметаллов являются:
- Сернистый газ (SO2), серный газ (SO3), угарный газ (CO), углекислый газ (CO2), оксид фосфора V (P2O5), оксид азота I (NO), оксид азота II (NO2).
- Оксиды неметаллов подразделяют на две группы – несолеобразующие (SiO, N2O, NO, CO, S2O, H2O) и солеобразующие (остальные).
- Несолеобразующих оксидов немного, их обыкновенно образуют одновалентные и двухвалентные неметаллы.
Солеобразующие оксиды неметаллов при взаимодействии с водой дают соответствующую им кислоту. Исключение составляет оксид кремния IV, который нерастворим в воде. Соответствующую ему кремниевую кислоту получают косвенным путём — взаимодействием растворимых силикатов щелочных металлов с кислотами.
Высшие оксиды – это оксиды, в которых неметалл проявляет степень окисления, равную номеру группы.
Кислотные свойства оксидов. В пределах одного периода с увеличением номера группы наблюдается увеличение кислотных свойств высших оксидов и соответствующих им кислот. Например, для неметаллов третьего периода, кремниевая кислота является слабой, а хлорная кислота является одной из самых сильных.
Такая закономерность вытекает из периодического закона Менделеева. В периоде радиус атома неметалла уменьшается с увеличением номера группы, а заряд неметалла при этом увеличивается. Поэтому при движении по периоду слева направо связь между неметаллом и кислородом упрочняется, а связь неметалл-водород ослабевает, что даёт увеличение диссоциации кислоты.
В пределах одной главной подгруппы происходит ослабление кислотных свойств оксидов и кислот с увеличением номера периода.
Соединения неметаллов с водородом
Кроме соединений с кислородом, неметаллы образуют соединения с водородом. Например, метан (CH4), аммиак (NH3), вода (H2O), плавиковая кислота (HF), соляная кислота (HCl). Эти соединения представляют собой газы или жидкости.
В периодах слева направо кислотные свойства водородных соединений неметаллов в водных растворах усиливаются. Это связано с тем, что в этом направлении у атомов элементов увеличивается заряд ядра и уменьшается радиус.
В группах сверху вниз, по мере увеличения атомного радиуса, отрицательно заряженные анионы неметаллов всё слабее притягивают положительно заряженные ионы водорода. Таким образом, отщепление ионов водорода происходит проще и кислотность увеличивается.
Кислородосодержащие кислоты
Некоторые из рассматриваемых соединений при взаимодействии с водой образуют кислородосодержащие кислоты, такие как серная, азотная, фосфорная кислоты.
Азотная кислота также относится к кислородосодержащим кислотам, но не образуется при растворении соответствующих оксидов в воде. Для синтеза этой кислоты требуется более сложный процесс: смесь оксидов азота реагируют с водой с поглощением кислорода.
ПРИМЕРЫ И РАЗБОР РЕШЕНИЙ ЗАДАЧ ТРЕНИРОВОЧНОГО МОДУЛЯ
- Решение задачи на определение участников реакции.
- Условие задания:
- Оксид с формулой XO2 прореагировал с 14 г CaO (оксид неметалла был взят в избытке), при этом образовалось 30 г соли CaXO3.
- 1) Укажите порядковый номер элемента X.
- 2) Какая масса (в граммах) оксида неметалла прореагировала?
- 3) Укажите степень окисления неметалла в оксиде XO2 (без знака)
- 4) Укажите максимальную степень окисления элемента X (без знака)
- Шаг первый:
- Составим уравнение реакции оксида неметалла с основным оксидом:
- XO2 + CaO → CaXO3
- Стехиометрическое соотношение CaO к CaXO3 – 1:1
- Шаг второй:
Определим количество вещества CaO: M(CaO) = 56 г/моль. Количество вещества n = m/M. n(CaO) = 14/56 = 0,25 моль.
Шаг третий
Определим молярную массу элемента X. Поскольку стехиометрическое соотношение CaO к CaXO3 – 1:1, то n(CaXO3) = 0,25 моль. Определим молярную массу соединения CaXO3. M = m/n. M(CaXO3) = 30/0,25 = 120 г/моль. Молярная масса CaXO3 слладывается из атомарных масс образующих соединение элементов. Получаем уравнение:
- M(Ca) + M(X) + 3*M(O) = 120
- 40 + M(X) + 48 = 120
- M(X) = 32 г/моль
- Шаг четвёртый
Определяем элемент X. Находим в таблице Менделеева элемент с молярной массой 32 г/моль. Это сера, элемент с порядковым номером 16.
- Шаг пятый
- Определяем массу прореагировавшего XO2. Исходя из материального баланса:
- m(XO2) + m(CaO) = m(CaXO3)
m(CaO) и m(CaXO3) известны из условия задачи. Определяем m(XO2).
m(XO2) = 30 – 14 = 16 г.
Шаг шестой
Определеяем степень окисления неметалла в оксиде XO2 (без знака). Степень окисления кислорода в оксидах = -2. Значит, степень окисления X = +4. Без знака: 4.
Шаг седьмой
Определяем максимальную степень окисления элемента X (без знака). Мы определили, что элемент X – это сера. Максимальную степень окисления элементы проявляют в высших оксидах. Высший оксид для серы это SO3. Степень окисления серы в нём = +6. Без знака: 6.
Ответ:
Порядковый номер элемента X – 16. Это сера.
m(XO2) = 16 г. Степень окисления неметалла в оксиде XO2 (без знака): 4. Максимальную степень окисления элемента X (без знака): 6.
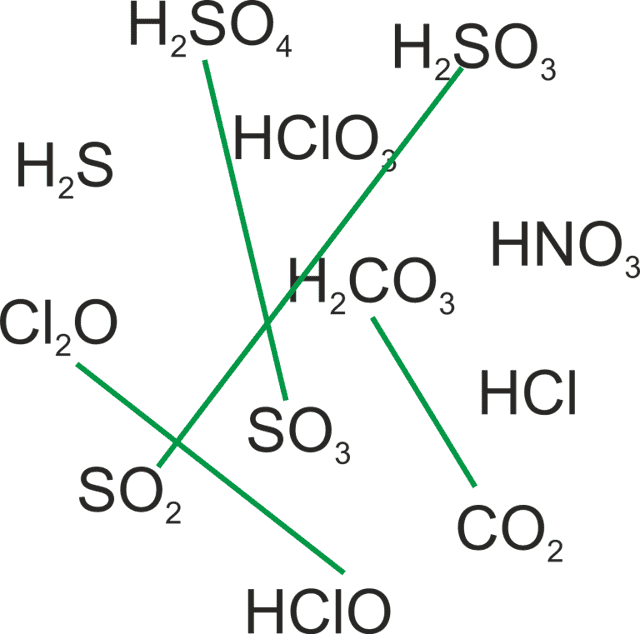
- Решение задачи на установление соответствия между оксидами неметаллов и соответствующим им кислотам.
Условие задания:
Соедините между собой оксиды неметаллов и кислородсодержащие кислоты, соответствующие им.
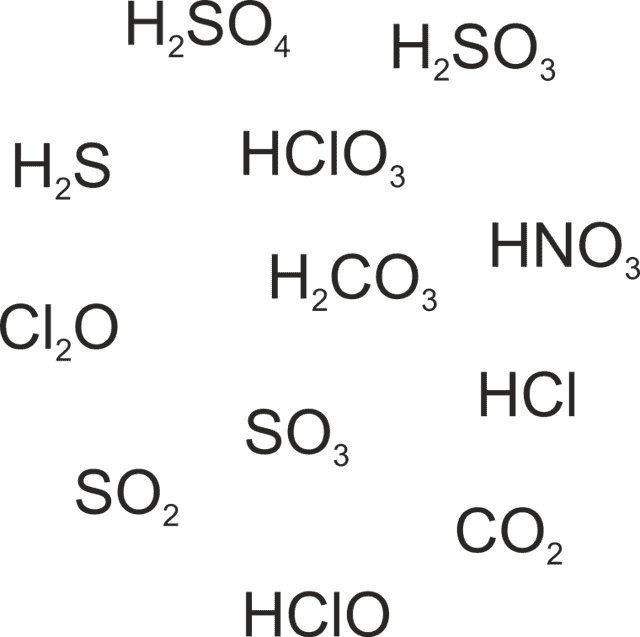
Шаг первый:
Определим среди предложенных соединений оксиды неметаллов. Это Cl2O, SO2, SO3, CO2. Остальные соединения не являются оксидами.
- Шаг второй:
- Определим соответствующие им кислоты. Такие кислоты получаются при взаимодействии оксидов с водой:
- Cl2O + H2O → 2 HClO
- SO2 + H2O → H2SO3
- SO3 + H2O → H2SO3
- CO2 + H2O → H2CO3
- Шаг четвёртый:
- Соединяем между собой оксиды неметаллов и кислородсодержащие кислоты, соответствующие им.
- Ответ:
Неметаллические оксиды Как они образуются, Номенклатура, Свойства / химия
неметаллические оксиды Их также называют кислотными оксидами, потому что они реагируют с водой с образованием кислот или оснований с образованием солей. Это можно наблюдать в случае таких соединений, как диоксид серы (SO)2) и оксид хлора (I), который реагирует с водой с образованием слабых кислот H2SW3 и HOCl соответственно.
Неметаллические оксиды являются ковалентными, в отличие от металлических, которые представляют собой оксиды ионного характера. Кислород обладает способностью образовывать связи с огромным количеством элементов благодаря своей электроотрицательной способности, что делает его отличной основой для большого разнообразия химических соединений..

Среди этих соединений существует вероятность того, что кислородный дианион связывается с металлом или неметаллом с образованием оксида. Оксиды представляют собой химические соединения, которые являются общими в природе и имеют свойство иметь по меньшей мере один атом кислорода, связанный с другим элементом, металлическим или неметаллическим..
Этот элемент представлен в состоянии твердого, жидкого или газообразного скопления, в зависимости от элемента, с которым связан кислород, и степени его окисления..
Между одним оксидом и другим, даже когда кислород связан с одним и тем же элементом, могут быть большие различия в его свойствах; для этого они должны быть полностью определены, чтобы избежать путаницы.
индекс
- 1 Как они образовались?
- 2 Номенклатура
- 2.1 Систематическая номенклатура с римскими цифрами
- 2.2 Систематическая номенклатура с префиксами
- 2.3 Традиционная номенклатура
- 2.4 Сводные правила по названию неметаллических оксидов
- 3 свойства
- 4 использования
- 5 примеров
- 5.1 Оксид хлора
- 5.2 Оксид кремния
- 5.3 Оксид серы
- 6 Ссылки
Как они образовались?
Как объяснялось выше, кислые оксиды образуются после связывания неметаллического катиона с кислородным дианионом (О2-).
Этот тип соединения наблюдается в элементах, расположенных справа от периодической таблицы (металлоиды обычно генерируют амфотерные оксиды), а также в переходных металлах в состояниях с высоким окислением.
Очень распространенным способом образования неметаллического оксида является разложение тройных соединений, называемых оксикислотами, которые образуются из неметаллического оксида и воды..
Именно по этой причине неметаллические оксиды также называют ангидридами, поскольку они представляют собой соединения, которые характеризуются потерей молекулы воды во время их образования..
- Например, в реакции разложения серной кислоты при высоких температурах (400 ° С) Н2SW4 он разлагается до такой степени, что полностью превращается в пар SO3 и H2Или, согласно реакции: H2SW4 + Жара → СО3 + H2О
- Другим способом образования неметаллических оксидов является прямое окисление элементов, как в случае диоксида серы: S + O2 → ТАК2
- Это также происходит при окислении углерода азотной кислотой с образованием диоксида углерода: C + 4HNO3 → CO2 + 4NO2 + 2H2О
номенклатура
Чтобы назвать неметаллические оксиды, необходимо принять во внимание несколько факторов, таких как числа окисления, которые может иметь элемент неметаллического типа, и его стехиометрические характеристики..
Его номенклатура похожа на таковую основных оксидов. Кроме того, в зависимости от элемента, с которым кислород соединяется для образования оксида, кислород или неметаллический элемент сначала будут записаны в его молекулярной формуле; однако это не влияет на правила именования для этих соединений.
Систематическая номенклатура с римскими цифрами
Чтобы назвать оксиды этого типа, используя старую номенклатуру запаса (систематически с римскими цифрами), элемент, который находится справа в формуле, назван первым.
Если это неметаллический элемент, то добавляется суффикс «uro», а затем предлог «de», и он заканчивается, называя элемент слева; если это кислород, он начинается с «оксида» и элемент называется.
Он завершается размещением состояния окисления каждого атома, за которым следует его имя без пробелов, римскими цифрами и между знаками скобок; в случае наличия только одного валентного числа это не указывается. Относится только к элементам с положительными показателями окисления.
Систематическая номенклатура с префиксами
При использовании систематической номенклатуры с префиксами используется тот же принцип, что и в стандартной номенклатуре, но римские цифры не указываются для обозначения степени окисления..
Вместо этого число атомов в каждом должно указываться префиксами «моно», «ди», «три» и т. Д .; Следует отметить, что если нет возможности спутать моноксид с другим оксидом, этот префикс опускается. Например, для кислорода «моно» в SeO (оксид селена) опускается.
Традиционная номенклатура
Когда используется традиционная номенклатура, сначала ставится общее название — в данном случае термин «ангидрид» — и продолжается в соответствии с числом состояний окисления, которыми обладает неметалл..
Когда он имеет только одну степень окисления, за ним следует предлог «из» плюс название неметаллического элемента.
С другой стороны, если этот элемент имеет два состояния окисления, окончание «медведь» или «ico» помещается, когда он использует свою более низкую или более высокую валентность, соответственно.
Если у неметалла есть три числа окисления, младший именуется с префиксом «hipo» и суффиксом «oso», промежуточный с окончанием «oso», а больший с суффиксом «ico»..
Когда у неметалла есть четыре степени окисления, наименьший из всех назван с префиксом «икота» и суффиксом «медведь», второстепенный промежуточный с окончанием «медведь», основной промежуточный с суффиксом «ico» и больше всего с префиксом «per» и суффиксом «ico».
Сводные правила для названия неметаллических оксидов
Независимо от используемой номенклатуры всегда наблюдайте окисление (или валентность) каждого элемента, присутствующего в оксиде. Правила их именования приведены ниже:
Первое правило
Если неметалл имеет уникальную степень окисления, как в случае с бором (B2О3), это соединение называется так:
Традиционная номенклатура
Ангидрид бора.
Систематика с префиксами
По количеству атомов каждого элемента; в этом случае триоксид дибория.
Систематика с римскими цифрами
Оксид бора (поскольку он имеет уникальную степень окисления, это опущено).
Второе правило
Если неметалл имеет две степени окисления, как в случае с углеродом (+2 и +4, которые образуют оксиды СО и СО)2, соответственно) приступим к названию их так:
Традиционная номенклатура
Термины «медвежий» и «ico» обозначают соответственно более низкую и более высокую валентность (углеродистый ангидрид для СО и диоксид углерода для СО)2).
Систематическая номенклатура с префиксами
Угарный газ и углекислый газ.
Систематическая номенклатура с римскими цифрами
Оксид углерода (II) и оксид углерода (IV).
Третье правило
Если неметалл имеет три или четыре степени окисления, он называется следующим образом:
Традиционная номенклатура
Если у неметалла три валентности, действуйте, как описано выше. В случае серы это будут гипосернистый ангидрид, диоксид серы и серный ангидрид соответственно.
Если неметалл имеет три степени окисления, его называют одинаково: хлорноватистый ангидрид, хлористый ангидрид, хлорный ангидрид и хлорный ангидрид соответственно.
Систематическая номенклатура с префиксами или римскими цифрами
Те же правила применяются к соединениям, в которых их неметаллы имеют две степени окисления, получая очень похожие названия.
свойства
— Их можно найти в различных агрегатных состояниях..
- — Неметаллы, из которых состоят эти соединения, имеют высокие степени окисления.
- — Неметаллические оксиды в твердой фазе обычно имеют хрупкую структуру.
- — В основном это молекулярные соединения, ковалентные по природе.
- — Они имеют кислую природу и образуют оксидные соединения.
- — Его кислотный характер увеличивается слева направо в периодической таблице.
- — Они не имеют хорошей электрической или теплопроводности.
- — Эти оксиды имеют относительно более низкие температуры плавления и кипения, чем их основные аналоги.
— Реакции с водой приводят к образованию кислотных соединений или щелочных соединений с образованием солей..
— Когда они реагируют с оксидами основного типа, они образуют соли оксоанионов.
— Некоторые из этих соединений, такие как оксиды серы или азота, считаются загрязнителями окружающей среды..
приложений
Неметаллические оксиды находят широкое применение как в промышленной сфере, так и в лабораториях и в различных областях науки..
Его использование включает в себя создание косметических продуктов, таких как эмали для век и ногтей, а также производство керамики.
Они также используются в улучшении красок, в производстве катализаторов, в составлении жидкости в огнетушителях или в газообразном топливе в пищевых продуктах в аэрозоле, и они даже используются в качестве анестезирующего средства в незначительных операциях.
примеров
Оксид хлора
Даны два типа оксида хлора. Оксид хлора (III) представляет собой твердое вещество коричневого цвета темного цвета, которое обладает взрывоопасными свойствами даже при температуре ниже точки плавления воды (0 ° К)..
С другой стороны, оксид хлора (VII) представляет собой газообразное соединение с коррозионными и легковоспламеняющимися свойствами, которое получается путем объединения серной кислоты с некоторыми перхлоратами..
Оксид кремния
Это твердое вещество, которое также известно как диоксид кремния и используется в производстве цемента, керамики и стекла.
Кроме того, он может образовывать различные вещества в зависимости от своего молекулярного порядка, образуя кварц, когда он образует упорядоченные кристаллы, и опал, когда его расположение аморфно..
Оксид серы
Диоксид серы является бесцветным газовым предшественником триоксида серы, в то время как триоксид серы является основным соединением при проведении сульфирования, что приводит к производству фармацевтических препаратов, красителей и моющих средств..
Кроме того, это очень важное загрязняющее вещество, так как оно присутствует в кислотных дождях..
ссылки
- Wikipedia. (Н.Д.). Кислотные оксиды. Получено с en.wikipedia.org
- Britannica, E. (s.f.). Неметаллические оксиды. Получено с сайта britannica.com
ПОИСК
Взаимодействием оксидов неметаллов и высших оксидов некоторых металлов с водой [c.46]
Кислотный оксид — оксид неметалла, образующий с водой кислоту, например диоксид углерода (углекислый газ) СО . [c.15]
Соединением оксида металла с оксидом неметалла [c.47]
Наибольшие количества ЗОг выбрасывают тепловые электростанции и предприятия цветной металлургии за счет окислительного обжига сульфидных руд. При растворении в капельках влаги тумана, дождя, облаков оксиды неметаллов (в основном ЗОг) образуют кислотные дожди. Это приводит к понижению pH осадков, вызывает рост кислотности водоемов, гибель их обитателей.
Из-за переноса воздушных масс на большие расстояния (трансграничные переносы) опасное повышение кислотности водоемов захватывает большие территории. Кислотные дожди вызывают коррозию металлов, нарушение лако-красочных покрытий. Под губительным действием оксидов серы и азота разрушаются строительные материалы, памятники архитектуры. [c.
217]
Оксиды неметаллов в большинстве случаев являются кислотообразующими оксидами, т. е. при их растворении в воде возникают растворы кислот. Некоторые оксиды неметаллов, например СО и NO, не относятся к кислотообразующим и индифферентны к воде. Обусловлено это исключительной прочностью их молекул. Например, гипотетическая реакция с образованием муравьиной кислоты [c.314]
При увеличении разности электроотрицательностей в оксидах неметаллов происходит изменение типа соединений [c.473]
Оксиды. Во всех оксидах кислород имеет степень окисления -2. По преимущественному виду химической связи выделяют, главным образом, ионные и ковалентные оксиды. Ионные соединения типичны для оксидов металлов, а ковалентные — для оксидов неметаллов. Классификацию оксидов по химическим свойствам см. в разд. 1.4. [c.342]
Рассматривая структуры оксидов неметаллов, обратим внимание на то, что для реализации координационной структуры при сохранении преимущественно ковалентного взаимодействия необходима заметная доля ионности связи. В противном случае образуются [c.61]
Кислотный ангидрид (разд. 21.1)-оксид, при растворении которого в воде образуется кислота растворимые оксиды неметаллов являются кислотными ангидридами. [c.331]
Однако фосфор и сера относятся к неметаллам, и поэтому оксид фосфора и диоксид серы являются оксидами неметаллов. Когда оксид фосфора или диоксид серы реагирует с водой, образуется. … Этот продукт вызывает изменение синей окраски лакмусовой бумаги на красную. [c.108]
Как правило, кислотные свойства проявляют оксиды неметаллов. Всем кислотным оксидам соответствует кислородсодержащая кислота, в которой неметалл проявляет ту же степень окисления, что и в оксиде. [c.150]
Действием оксида неметалла на основание [c.47]
Если в состав расплавов входят кислородсодержащие анионы, то при их электролизе на аноде выделяется кислород, так как при их окислении на аноде образуются неустойчивые частицы (SO , 0Н и т.д.), сразу же разлагающиеся иа устойчивые в условиях опыта — оксиды неметалла и кислород. Суммарное уравнение реакции [c.80]
Дается такое определение кислотные оксиды — это оксиды неметаллов. Согласны ли Вы с такой формулировкой Если нет, то приведите соответствующие доводы и примеры, подтверждающие неточность этого определения. [c.9]
Для получения оксидов неметаллов в лаборатории используют следующие реакции [c.157]
Оксиды неметаллов. Известны оксиды всех неметаллов, полученные непосредственно или косвенно, за исключением оксидов гелия, пеона и аргона. Поскольку разность ОЭО кислорода и неметаллов относительно невелика, природа химической связи в оксидах неметаллов преимущественно ковалентная. Поэтому в подавляющем большинстве случаев оксиды неметаллов — газы, легколетучие жидкости или легкоплавкие твердые вещества. В твердом состоянии, как правило, образуются молекулярные структуры из-за насыщаемости и направленности ковалентных связей. Однако при наличии заметной доли ионной составляющей связи возникают координационные решетки, например, в случае диоксида кремния. В оксидах неметаллов кислород чаще всего подвергается 5/ -гибридизации. Степень гибридизации зависит от физико-химической природы партнера. [c.314]
Благодаря очень малой летучести борного ангидрида, с одной стороны, и большому тепловому эффекту при образовании этого соединения из элементов (П71,1 кдж моль) — с другой, бор может восстанавливать как оксиды металлов, так и нелетучие оксиды неметаллов. [c.437]
Оксиды неметаллов и кислородсодержащие кислоты [c.131]
В 30-х годах XIX в. кислоты рассматривали как оксиды неметаллов, основания — как оксиды металлов, а соли — как соединения кислот и оснований. Участию воды в образовании кислот и оснований, а также ее выделению при нейтрализации большого значения не придавали. [c.162]
Краткая характеристика оксидов неметаллов и соответствующих им гидроксидов [c.329]
В химии обычно пользуются структурными формулами, памятуя, что атомы имеют пространственное расположение. Эти формулы применяют только для соединений с ковалентной связью, имеющих молекулярные кристаллические решетки. К последним относятся подавляющее большинство органических соединений, многие кислоты и некоторые оксиды неметаллов. [c.82]
К какому типу солеобразующих оксидов относятся оксиды неметаллов [c.331]
Вы уже знаете, что существуют металлы и неметаллы. Их оксиды соответственно называются оксиды металлов и оксиды неметаллов. [c.107]
В отличие от этого оксиды неметаллов при взаимодействии с водой образуют кислоты. [c.107]
Да. Оксид фосфора и диоксид серы при взаимодействии с водой образуют кислоты. (Если вы с первого же раза дали такой ответ, это означает, что вы усваиваете материал очень хорошо.) Как диоксид серы, так и оксид фосфора являются оксидами неметаллов. [c.118]
Оксиды неметаллов при взаимодействии с водой образуют кислоты. Вследствие большой реакционной способности натрия и калия оба этих металла никогда не обнаруживаются в природе в свободном (несвязанном) [c.118]
При взаимодействии воды с оксидами неметаллов экзотермически образуются гидраты, именуемые кислотами [c.22]
Оксиды металлов, например NejO, называются основными ангидридами, или основными оксидами, а оксиды неметаллов, как, например, SO3, называются кислотными ангидридами, или кислотными оксидами. (Термин ангидрид означает лишенный воды .) Многие оксиды нерастворимы в воде.
Тогда их кислотный или основной характер определяется способностью этих оксидов растворяться в кислотах или основаниях. Например, F jOj нерастворим в воде и в основных растворах, как, скажем, водный раствор NaOH, однако он растворяется в кислотах, реагируя с ними по уравнению [c.
284]
Физические свойства оксидов изменяются закономерно и соответственно изменению свойств элементов по периодам и группам. На рис. 80 представлена зависимость температуры плавления оксидов от порядкового номера элемента.
При обычной температуре оксиды металлов — твердые кристаллические вещества, оксиды неметаллов могут быть в газообразном (SO2, СО и др.), в жидком (Н2О и др.) и твердом (Р2О3, Р2О5, Si02 и др.) агрегатных состояниях. [c.
239]
Оксиды неметаллов и малоактивных металлов характеризуются ковалентной химической связью и обладают кислотным характером (СО2, SO3, Р2О5). При взаимодействии с водой образуют кислоты, например [c.257]
В главных подгруппах периодической системы химических элементов в направлении сверху вниз кислотные свойства высших оксидов неметаллов уменьшаются. Так, например, в главной подгруппе V группы оксид азота (V) обладает более сильными кислотными свойствами (образует одну из сильнейших кислот — азотную кислоту HNQ3).
чем оксид фосфора (V) Р2О5. Это объясняется тем, что атом фосфора имеет больший атомный радиус по сравнению с атомом азота. Поэтому действие положительных ионов фосфора на ионы кислорода и водорода слабее, чем соответствующее действие положительных ионов азота, размер которых значительно меньше. [c.
132]
Оксиды неметаллов делятся на две группы несолеобразующие и солеобразующие оксиды. К несолеобразующим оксидам относятся 510, МгО, N0, СО. Все остальные оксиды неметаллов являются солеобразующими.
Например Р2О5, С120г, ЗОз, 502. Солеобразующие оксиды неметаллов относятся к типу кислотных оксидов. Среди них есть газообразные вещества (СО2, 50г, N02 и др.), жидкие вещества (50з, ЫгОз и др.) и твёрдые (Р2О5, 5102 и др.).
[c.329]
Все характеристические оксиды, как известно, относятся к основным и кислотным. Первые являются оксидами металлов, вторые генетически связаны с неметаллами. Поскольку нет четкой границы между металлами и неметаллами, существует большая группа амфотерных оксидов. Амфотерность определяется не только положением элемента в периодической системе, но и зависит от его степени окисления. Ориентируясь на разность ОЭО, можно утверждать, что оксиды металлов должны быть преимущественно ионными, а оксиды неметаллов — преимущественно ковалентными. Поскольку для одного и того же элемента с увеличением степени окисления его электроотрицательность растет в этом направлении от низших к высшим оксидам растет ковалентный вклад. Вследствие этого наблюдается изменение свойств оксидов от основных к кислотным. Например, ОЭОсг(+2> = 1,4, ОЭОсп+з) = 1,6, ОЭОсг(+б>=2,4 и свойства оксидов закономерно изменяются [c.62]
Оксидные руды. В соединениях с кислородом встречаются многие металлы—железо, алюминий, хром, вольфрам, марганец, олово и ряд других.
Оксиды металлов могут образовать соединения между собой, если они находятся в различных степенях окисления, или с оксидами неметаллов, образуя соли.
Примером простых оксидных руд могут служить Р е20з — гематит, Р СзОз 1 0 — гетит, А1 зОд — боксит, Т Оа — рутил, МпОа — пиролюзит, МпзОд — браунит, ЗпОз — касситерит и многие другие. [c.284]
Получение. Большинство кислородных кислот получают при взаи-модействин оксидов неметаллов (в высокой степени окисления) с водой. Например [c.127]
Большинство кислотных оксидов являются оксидами неметаллов. Кислотными оксидами являются также оксиды некоторых металлов с высокой валентностью. Нгпример VI VII [c.34]
Встречающиеся в природе соединения оксидов металлов с оксидами неметаллов также представляют собой соли определенных кислот (например, СаО-СОг или СаСОз). [c.395]






