- Классификация оксидов
- Физические свойства оксидов
- Химические свойства оксидов
- Получение оксидов
- Применение оксидов
- Свойства, номенклатура, применение и примеры оксидов металлов / химия
- Свойства неметаллических оксидов
- основность
- амфотерность
- номенклатура
- Традиционная номенклатура
- Систематическая номенклатура
- Товарная номенклатура
- Расчет числа валентностей
- Как они образовались?
- Прямая реакция металла с кислородом
- Реакция солей металлов с кислородом
- приложений
- примеров
- Оксиды железа
- Щелочные и щелочноземельные оксиды
- Группа IIIA оксиды (13)
- ссылки
- Амфотерные металлы — список и свойства
- Что представляют собой амфотерные металлы?
- Какие элементы относятся к амфотерным?
- Где используются амфотерные металлы?
- Основания амфотерных металлов
- Химические свойства неметаллов
- Основания амфотерных металлов
- Физические и химические свойства оксидов
- Химические свойства несолеобразующих оксидов
- Химические свойства солеобразующих оксидов
- Физические свойства оксидов
- Получение оксидов
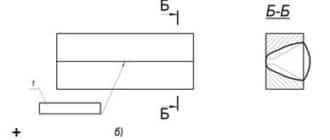
- Примеры решения задач
- Изучаем химию. 8 класс
- Page 2
Оксиды — это неорганические соединения, состоящие из двух химических элементов, одним из которых является кислород в степени окисления -2. Единственным элементом, не образующим оксид, является фтор, который в соединении с кислородом образует фторид кислорода. Это связано с тем, что фтор является более электроотрицательным элементом, чем кислород.
Данный класс соединений является очень распространенным. Каждый день человек встречается с разнообразными оксидами в повседневной жизни. Вода, песок, выдыхаемый нами углекислый газ, выхлопы автомобилей, ржавчина — все это примеры оксидов.
Классификация оксидов
Все оксиды, по способности образовать соли, можно разделить на две группы:
- Солеобразующие оксиды (CO2, N2O5,Na2O, SO3 и т. д.)
- Несолеобразующие оксиды(CO, N2O,SiO, NO и т. д.)
В свою очередь, солеобразующие оксиды подразделяют на 3 группы:
- Основные оксиды — (Оксиды металлов — Na2O, CaO, CuO и т д)
- Кислотные оксиды — (Оксиды неметаллов, а так же оксиды металлов в степени окисления V-VII — Mn2O7,CO2, N2O5, SO2, SO3 и т д)
- Амфотерные оксиды (Оксиды металлов со степенью окисления III-IV а так же ZnO, BeO, SnO, PbO)
Данная классификация основана на проявлении оксидами определенных химических свойств. Так, основным оксидам соответствуют основания, а кислотным оксидам — кислоты.
Кислотные оксиды реагируют с основными оксидами с образованием соответствующей соли, как если бы реагировали основание и кислота, соответствующие данным оксидам:Аналогично, амфотерным оксидам соответствуют амфотерные основания, которые могут проявлять как кислотные, так и основные свойства:Химические элементы проявляющие разную степень окисления, могут образовывать различные оксиды. Чтобы как то различать оксиды таких элементов, после названия оксиды, в скобках указывается валентность.
CO2 – оксид углерода (IV)
N2O3 – оксид азота (III)
Физические свойства оксидов
Оксиды весьма разнообразны по своим физическим свойствам. Они могут быть как жидкостями (Н2О), так и газами (СО2, SO3) или твёрдыми веществами (Al2O3, Fe2O3). Приэтом оснОвные оксиды, как правило, твёрдые вещества. Окраску оксиды также имеют самую разнообразную — от бесцветной (Н2О, СО) и белой (ZnO, TiO2) до зелёной (Cr2O3) и даже чёрной (CuO).
Химические свойства оксидов
- Некоторые оксиды реагируют с водой с образованием соответствующих гидроксидов (оснований):Основные оксиды реагируют с кислотными оксидами с образованием солей:Аналогично реагируют и с кислотами, но с выделением воды:Оксиды металлов, менее активных чем алюминий, могут восстанавливаться до металлов:
- Кислотные оксиды в реакции с водой образуют кислоты:Некоторые оксиды (например оксид кремния SiO2) не взаимодействуют с водой, поэтому кислоты получают другими путями.
- Кислотные оксиды взаимодействуют с основными оксидами, образую соли:Таким же образом, с образование солей, кислотные оксиды реагируют с основаниями:Если данному оксиду соответствует многоосновная кислота, то так же может образоваться кислая соль:Нелетучие кислотные оксиды могут замещать в солях летучие оксиды:
- Как уже говорилось ранее, амфотерные оксиды, в зависимости от условий, могут проявлять как кислотные, так и основные свойства. Так они выступают в качестве основных оксидов в реакциях с кислотами или кислотными оксидами, с образованием солей: И в реакциях с основаниями или основными оксидами проявляют кислотные свойства:
Получение оксидов
Оксиды можно получить самыми разнообразными способами, мы приведем основные из них.
Большинство оксидов можно получить непосредственным взаимодействием кислорода с химических элементом: При обжиге или горении различных бинарных соединений:Термическое разложение солей, кислот и оснований :Взаимодействие некоторых металлов с водой:
Применение оксидов
Оксиды крайне распространены по всему земному шару и находят применение как в быту, так и в промышленности. Самый важный оксид — оксид водорода, вода — сделал возможной жизнь на Земле. Оксид серы SO3 используют для получения серной кислоты, а также для обработки пищевых продуктов — так увеличивают срок хранения, например, фруктов.
Оксиды железа используют для получения красок, производства электродов, хотя больше всего оксидов железа восстанавливают до металлического железа в металлургии.
Оксид кальция, также известный как негашеная известь, применяют в строительстве. Оксиды цинка и титана имеют белый цвет и нерастворимы в воде, потому стали хорошим материалом для производства красок — белил.
Оксид кремния SiO2 является основным компонентом стекла. Оксид хрома Cr2O3 применяют для производства цветных зелёных стекол и керамики, а за счёт высоких прочностных свойств — для полировки изделий (в виде пасты ГОИ).
Оксид углерода CO2, который выделяют при дыхании все живые организмы, используется для пожаротушения, а также, в виде сухого льда, для охлаждения чего-либо.
Свойства, номенклатура, применение и примеры оксидов металлов / химия
оксиды металлов это неорганические соединения, образованные металлическими катионами и кислородом. Они обычно содержат огромное количество ионных твердых веществ, в которых оксид аниона (O2-) электростатически взаимодействует с видами М+.
M+ это любой катион, полученный из чистого металла: от щелочных и переходных металлов, за исключением некоторых благородных металлов (таких как золото, платина и палладий), до более тяжелых элементов блока p периодической таблицы ( как свинец и висмут).

Верхнее изображение показывает железную поверхность, покрытую красноватыми корками. Эти «корочки» — это то, что известно как ржавчина или ржавчина, которые, в свою очередь, представляют собой визуальный тест на окисление металла в зависимости от условий его окружающей среды. Химически ржавчина представляет собой гидратированную смесь оксидов железа (III).
Почему окисление металла приводит к деградации его поверхности? Это связано с включением кислорода в кристаллическую структуру металла.
Когда это происходит, объем металла увеличивается, а исходные взаимодействия ослабевают, что приводит к разрушению твердого тела. Кроме того, эти трещины позволяют большему количеству молекул кислорода проникать во внутренние металлические слои, поглощая весь кусок изнутри..
Однако этот процесс происходит на разных скоростях и зависит от природы металла (его реакционной способности) и физических условий, которые его окружают. Следовательно, существуют факторы, которые ускоряют или замедляют окисление металла; два из них — наличие влаги и pH.
Почему? Поскольку окисление металла с образованием оксида металла подразумевает перенос электрона. Они «путешествуют» от одного химического вида к другому, пока среда способствует этому, либо присутствием ионов (H+, не доступно+, мг2+, Cl-, и т. д.), которые изменяют рН, или молекулами воды, которые обеспечивают транспортные средства.
Аналитически тенденция металла образовывать соответствующий оксид отражается в его восстановительных потенциалах, которые показывают, какой металл реагирует быстрее по сравнению с другим.
Золото, например, имеет гораздо больший восстановительный потенциал, чем железо, поэтому оно сияет своим характерным золотым свечением без оксида, который его размывает..
индекс
- 1 Свойства неметаллических оксидов
- 1.1 Основность
- 1.2 Амфотеризм
- 2 Номенклатура
- 2.1 Традиционная номенклатура
- 2.2 Систематическая номенклатура
- 2.3 Товарная номенклатура
- 2.4 Расчет числа валентностей
- 3 Как они образовались?
- 3.1 Прямая реакция металла с кислородом
- 3.2 Реакция солей металлов с кислородом
- 4 использования
- 5 примеров
- 5.1 Оксиды железа
- 5.2 Щелочные и щелочноземельные оксиды
- 5.3 Группа IIIA оксидов (13)
- 6 Ссылки
Свойства неметаллических оксидов

Свойства оксидов металлов варьируются в зависимости от металла и того, как он взаимодействует с анионом О2-. Это влечет за собой то, что некоторые оксиды имеют более высокую плотность или растворимость в воде, чем другие. Однако все они имеют общий металлический характер, что неизбежно отражается на его основности..
Другими словами: они также известны как основные ангидриды или основные оксиды.
основность
Основность оксидов металлов может быть проверена экспериментально с использованием кислотно-основного индикатора. Как? Добавление небольшого куска оксида в водный раствор с небольшим количеством растворенного индикатора; это может быть сжиженный сок фиолетовой капусты.
Имея диапазон цветов в зависимости от pH, оксид превратит сок в голубоватый цвет, соответствующий базовому pH (со значениями от 8 до 10). Это потому, что растворенная часть оксида высвобождает ионы ОН- к окружающей среде, будучи в эксперименте ответственными за изменение pH.
- Таким образом, для оксида МО, который растворяется в воде, он превращается в гидроксид металла («гидратированный оксид») в соответствии со следующими химическими уравнениями:
- МО + Н2O => M (OH)2
- М (ОН)2 M2+ + 2OH-
Второе уравнение представляет собой баланс растворимости гидроксида М (ОН)2. Обратите внимание, что металл имеет заряд 2+, что также означает, что его валентность равна +2. Валентность металла напрямую связана с его тенденцией к получению электронов.
Таким образом, чем позитивнее валентность, тем выше ее кислотность. В случае, когда М имел валентность +7, тогда оксид М2О7 это было бы кислым и не основным.
амфотерность
Оксиды металлов являются основными, однако не все имеют одинаковый металлический характер. Как узнать? Расположение металла М в периодической таблице. Чем больше он находится слева от него и в более низкие периоды, тем более металлическим он будет и, следовательно, более основным будет его оксид.
На границе между основными и кислотными оксидами (неметаллическими оксидами) находятся амфотерные оксиды. Здесь слово «амфотерный» означает, что оксид действует и как основание, и как кислота, что так же, как в водном растворе, он может образовывать гидроксид или водный комплекс М (ОН2)62+.
Водный комплекс — не более чем координация N молекулы воды с металлическим центром М. Для комплекса М (ОН2)62+, металл М2+ Он окружен шестью молекулами воды и может рассматриваться как гидратированный катион. Многие из этих комплексов проявляют интенсивную окраску, такую как наблюдаемая для меди и кобальта.
номенклатура
Как называются оксиды металлов? Есть три способа сделать это: традиционный, систематический и фондовый.
Традиционная номенклатура
Чтобы правильно назвать оксид металла в соответствии с правилами, регулируемыми IUPAC, необходимо знать возможные валентности металла М. Самому большому (наиболее положительному) присваивается название металла суффикс -ico, тогда как минор, префикс -oso.
Пример: с учетом валентностей +2 и +4 металла М его соответствующими оксидами являются МО и МО2. Если бы М был свинцом, Pb, то PbO был бы оксидным отвесомнести, и PbO2 оксидная сливаICO. Если металл имеет только одну валентность, он называется его оксидом с суффиксом -ico. Итак, На2Или это оксид натрия.
С другой стороны, гипо- и префиксы добавляются, когда для металла доступно три или четыре валентности. Таким образом, Mn2О7 это оксид вМенгенICO, потому что Mn имеет валентность +7, самый высокий из всех.
Тем не менее, этот тип номенклатуры представляет определенные трудности и обычно используется наименее.
Систематическая номенклатура
Он учитывает количество атомов М и кислорода, составляющих химическую формулу оксида. Из них ему назначены соответствующие префиксы: моно-, ди-, три-, тетра- и т. Д..
На примере трех недавних оксидов металлов PbO является моноксидом свинца; PbO2 диоксид свинца; и Na2Или окись динатрия. Для случая ржавчины, Fe2О3, его соответствующее название является триоксидом дигеро.
Товарная номенклатура
В отличие от двух других номенклатур, в этом валентность металла имеет большее значение. Валентность указывается римскими цифрами в скобках: (I), (II), (III), (IV) и т. Д. Оксид металла тогда называют оксидом металла (n).
- Применяя номенклатуру запаса для предыдущих примеров, мы имеем:
- -PbO: оксид свинца (II).
- -PbO2: оксид свинца (IV).
-не доступно2О: оксид натрия. Поскольку он имеет уникальную валентность +1, он не указан.
-вера2О3: оксид железа (III).
-Миннесота2О7: оксид марганца (VII).
Расчет числа валентностей
Но если у вас нет периодической таблицы с валентностями, как вы можете их определить? Для этого мы должны помнить, что анион O2- он вносит два отрицательных заряда в оксид металла. Следуя принципу нейтральности, эти отрицательные заряды должны быть нейтрализованы положительными зарядами металла..
Поэтому, если число атомов кислорода известно по химической формуле, валентность металла может быть определена алгебраически, так что сумма зарядов дает ноль.
Mn2О7 имеет семь атомов кислорода, то его отрицательные заряды равны 7х (-2) = -14. Чтобы нейтрализовать отрицательный заряд -14, марганец должен обеспечить +14 (14-14 = 0). Положить математическое уравнение тогда:
- 2X — 14 = 0
- 2 происходит из-за того, что есть два атома марганца. Решаем и очищаем Х, валентность металла:
- X = 14/2 = 7
- То есть каждый Mn имеет валентность +7.
Как они образовались?
Влажность и рН напрямую влияют на окисление металлов в их соответствующих оксидах. Наличие СО2, Оксид кислоты может быть достаточно растворен в воде, которая покрывает металлическую часть, чтобы ускорить введение кислорода в анионной форме в кристаллическую структуру металла..
Эту реакцию также можно ускорить с повышением температуры, особенно когда желательно получить оксид за короткое время..
Прямая реакция металла с кислородом
- Оксиды металлов образуются как продукт реакции между металлом и окружающим кислородом.
Это может быть представлено с помощью химического уравнения ниже:
- 2M (s) + O2(г) => 2MO (s)
- Эта реакция медленная, так как кислород имеет сильную двойную связь O = O и электронный перенос между ним и металлом неэффективен.
Тем не менее, он значительно ускоряется с увеличением температуры и площади поверхности. Это связано с тем, что энергия, необходимая для разрыва двойной связи O = O, обеспечивается, и, поскольку существует большая площадь, кислород равномерно движется по всему металлу, одновременно сталкиваясь с атомами металла..
Чем больше количество реагента кислорода, тем больше валентность или степень окисления, возникающая для металла. Почему? Поскольку кислород захватывает все больше электронов из металла, пока он не достигнет максимальной степени окисления.
- Это можно увидеть, например, для меди. Когда кусок металлической меди реагирует с ограниченным количеством кислорода, образуется медь2O (оксид меди (I), оксид меди или двуокись диоксида):
- 4Cu (s) + O2(г) + Q (тепло) => 2Cu2O (s) (красное твердое вещество)
- Но когда он реагирует в эквивалентных количествах, получается CuO (оксид меди (II), оксид меди или оксид меди):
- 2Cu (s) + O2(г) + Q (нагрев) => 2CuO (s) (сплошной черный цвет)
Реакция солей металлов с кислородом
- Оксиды металлов могут образовываться в результате термического разложения.
Чтобы это было возможно, одна или две маленькие молекулы должны быть освобождены от исходного соединения (соли или гидроксида):
- М (ОН)2 + Q => МО + Н2О
- MCO3 + Q => MO + CO2
- 2 М (НЕТ3)2 + Q => МО + 4НО2 + О2
- Обратите внимание, что H2O, CO2, НЕТ2 и O2 высвобождаются ли молекулы.
приложений
Из-за богатого состава металлов в земной коре и кислорода в атмосфере оксиды металлов обнаруживаются во многих минералогических источниках, из которых можно получить твердую основу для производства новых материалов..
Каждый оксид металла находит очень специфическое применение: от пищевых (ZnO и MgO) до цементных добавок (CaO) или просто в виде неорганических пигментов (Cr).2О3).
Некоторые оксиды настолько плотны, что контролируемый рост их слоев может защитить сплав или металл от дальнейшего окисления. Даже исследования показали, что окисление защитного слоя происходит так, как если бы это была жидкость, покрывающая все трещины или поверхностные дефекты металла..
Оксиды металлов могут принимать захватывающие структуры в виде наночастиц или крупных полимерных агрегатов..
Этот факт делает их предметом исследований для синтеза интеллектуальных материалов из-за его большой площади поверхности, которая используется для разработки устройств, которые реагируют на наименьший физический стимул.
Аналогично, оксиды металлов являются сырьем для многих технологических применений, от зеркал и керамики с уникальными свойствами для электронного оборудования до солнечных батарей..
примеров
Оксиды железа
- 2Fe (s) + O2(г) => 2FeO (s) оксид железа (II).
- 6FeO (s) + O2(г) => 2Fe3О4(s) Магнитный оксид железа.
- Вера3О4, также известный как магнетит, это смешанный оксид; Это означает, что он состоит из твердой смеси FeO и Fe2О3.
- 4Fe3О4(s) + O2(г) => 6Fe2О3(s) оксид железа (III).
Щелочные и щелочноземельные оксиды
- Как щелочные, так и щелочноземельные металлы имеют одну степень окисления, поэтому их оксиды являются более «простыми»:
- -не доступно2O: оксид натрия.
- -Li2O: оксид лития.
- -К2O: оксид калия.
- -CaO: оксид кальция.
- -MgO: оксид магния.
- -BeO: оксид бериллия (амфотерный оксид)
Группа IIIA оксиды (13)
- Элементы группы IIIA (13) могут образовывать оксиды только с степени окисления +3. Таким образом, они имеют химическую формулу М2О3 и его оксиды следующие:
- -в2О3: оксид алюминия.
- -Джорджия2О3: оксид галлия.
- -в2О3: оксид индия.
- И наконец
-Т.Л.2О3: оксид таллия.
ссылки
- Уиттен, Дэвис, Пек и Стэнли. Химия. (8-е изд.). CENGAGE Learning, стр. 237.
- AlonsoFormula. Оксиды металлов. Взято из: alonsoformula.com
- Регенты Университета Миннесоты. (2018). Кислотно-основные характеристики оксидов металлов и неметаллов. Взято из: chem.umn.edu
- Дэвид Л. Чендлер. (3 апреля 2018 г.) Самовосстанавливающиеся оксиды металлов могут защитить от коррозии. Взято из: news.mit.edu
- Физические состояния и структуры оксидов. Взято из: wou.edu
- Quimitube. (2012). Окисление железа. Взято из: quimitube.com
- Химия LibreTexts. Оксиды. Взято с сайта chem.libretexts.org
- Кумар М. (2016) Наноструктуры оксидов металлов: рост и применение. В кн .: Хусаин М., Хан З. (ред.) Достижения в области наноматериалов. Advanced Structured Materials, том 79. Springer, Нью-Дели
Амфотерные металлы — список и свойства
Простые вещества сходные с металлическими элементами по структуре и ряду химических и физических параметров называют амфотерными, т.е. это те элементы, проявляющие химическую двойственность.
Надо отметить, что это не сами металли, а их соли или оксиды.
К, примеру, оксиды некоторых металлов могут обладать двумя свойствами, при одних условиях они могут проявлять свойства присущие кислотам, в других, они ведут себя как щелочи.
К основным амфотерным металлам относят алюминий, цинк, хром и некоторые другие.
Термин амфотерность был введен в оборот в начале XIX века. В то время химические вещества разделяли на основании их сходных свойств, проявляющиеся при химических реакциях.
Что представляют собой амфотерные металлы?
Список амфотерных металлов включает в себя множество наименований. Некоторые из них можно с уверенность назвать амфотерными, некоторые – предположительно, иные – условно. Если рассматривать вопрос масштабно, то для краткости можно назвать просто порядковые номера выше указанных металлов.
Эти номера: 4,13, с 22 до 32, с 40 до 51, с 72 до 84, со 104 до 109. Но есть металлы, которые вправе назваться основными. К ним относятся хром, железо, алюминий и цинк. Дополняют основную группу стронций и бериллий. Самым распространенным из всех перечисленных на данный момент является алюминий.
Именно его сплавы уже много столетий используются в самых разнообразных сферах и областях применения. Металл имеет отличную антикоррозийную стойкость, легко поддается литью и различным типам механической обработки.
Кроме того, популярность алюминия дополняется такими преимуществами, как высокая теплопроводность и хорошая электропроводность.
Бериллиевая бронза БрБ2
Алюминий — амфотерный металл, для которого свойственно проявлять химическую активность. Стойкость данного металла определяется прочной оксидной пленкой и, в обычных условиях окружающей среды, при реакциях химического направления, алюминий выступает восстановительным элементом.
Такое амфотерное вещество способно взаимодействовать с кислородом, в случае раздробления металла на мелкие частицы. Для такого взаимодействия необходимо влияние высокого температурного режима. Химическая реакция при соприкосновении с кислородной массой сопровождается огромным выделением тепловой энергии.
При температуре свыше 200 градусов взаимодействие реакций при соединении с таким веществом, как сера, образовывает сульфид алюминия.
Амфотерный алюминий не способен напрямую взаимодействовать с водородом, а при смешивании этого металла с другими металлическими компонентами возникают различные сплавы, содержащие соединения интерметаллического типа.
Железо — амфотерный металл, который является одной из побочных подгрупп группы 4 периода в системе элементов химического типа. Данный элемент выделяется как самое распространенное составляющее группы металлических веществ, в составе компонентов земной коры.
Железо классифицируется как простое вещество, среди отличительных свойств которого можно выделить его ковкость, серебристо-белую цветовую гамму.
Такой металл обладает способностью провоцировать возникновение повышенной химической реакции и быстро переходит в стадию корродирования при воздействии высокой температуры.
Помещенное в чистый кислород железо полностью перегорает, а доведенное до мелкодисперсного состояния может самовоспламеняться на простом воздухе. Находясь на воздухе металлическое вещество быстро окисляется вследствие чрезмерной влажности, то есть, ржавеет. При горении в кислородной массе образуется своеобразная окалина, которая называется оксидом железа.
Какие элементы относятся к амфотерным?
Амфотерными называют — соединения, которые проявляют химическую двойственность. Они делятся на 3 группы:
- Оксиды — Cu2O, Cr2O, PbO2, PbO, SnO
- Гидроксиды — Al(OH)3, Fe(OH)3, Zn(OH)2.
К третьей группе относятся металлы — алюминий, медь, железо, цинк, бериллий, свинец и т. д. Они занимают значительную часть в периодической таблице Менделеева и находятся под порядковыми номерами — 22–32, 40–51. Другие идут по отдельности.
Представители металлов:
- Железо. Относится к группе амфотерных. Представляет собой простое вещество. Характерные свойства — серебристо-белый цвет, ковкость, универсальность. Если поместить железо в чистый кислород, оно полностью перегорит, а если сделать его мелкодисперсным, может произойти самовозгорание на открытом воздухе. Оксид железа образуется при его горении в среде, насыщенной чистым кислородом. Он представляет собой окалину.
- Алюминий. На открытом воздухе покрывается прочной оксидной пленкой, которая защищает его от образования ржавчины. Если раздробить его до мелких частиц, начинает взаимодействовать с кислородом. При контакте с кислородом выделяется большое количество тепла. Если нагреть алюминий до 200°C, он начинает взаимодействовать серой. В результате такой реакции образуется сульфид алюминия.
Амфотерные металлы — простые элементы, которые являются аналогами группы веществ металлического типа. Сходства можно увидеть в химических, физических свойствах.
Свинец ( Instagram / dielektrikum)
Где используются амфотерные металлы?
Химические свойства щелочноземельных металлов. перечень щелочноземельных металлов Сферы применения:
- Изготовление деталей для сейсмических и скоростных датчиков, часовых механизмов, крутящего момента.
- Производство деталей для оборудования, которые будут взаимодействовать с агрессивными факторами.
- Армирование труб высокого давления.
- Кораблестроение, самолетостроение.
- Производство бытовых приборов, инструментов. К ним относятся столовые приборы, рулетки, бритвенные лезвия, посуда для кухни.
- Сборка видеозаписывающего оборудования.
С каждым годом появляется все больше химических соединений. Благодаря этому открываются новые амфотерные металлы. Их называют материалами будущего, но популярность их растет медленно. Связано это с высокой стоимостью, небольшими размерами готовых изделий.
https://youtube.com/watch?v=BZIhw3pQFQs
Основания амфотерных металлов
Гост 9012-59. металлы. метод измерения твердости по бринеллю (с изменениями n 1, 2, 3, 4, 5)
В нормальных условиях это вещества не растворяются в воде и их можно спокойно отнести к слабым электролитам. Такие вещества получают после проведения реакции солей металла и щелочи. Эти реакции довольно опасны для тех, кто их производит и поэтому, например, для получения гидроксида цинка в емкость с хлоридом цинка медленно и аккуратно, по капле надо вводить едкий натр.
Вместе тем, амфотерные — взаимодействуют с кислотами как основания. То есть при выполнении реакции между соляной кислотой и гидроксидом цинка, появится хлорид цинка. А при взаимодействии с основаниями, они ведут себя как кислоты.
Это занятие мы посвятим изучению амфотерных оксидов и гидроксидов. На нем мы поговорим о веществах, имеющих амфотерные (двойственные) свойства, и особенностях химических реакций, которые протекают с ними. Но сначала повторим, с чем реагируют кислотные и основные оксиды. После рассмотрим примеры амфотерных оксидов и гидроксидов.
Тема: Введение
Урок: Амфотерные оксиды и гидроксиды
Химические свойства неметаллов
Неметаллы проявляют окислительные свойства. Самый активный неметалл – фтор. Он бурно реагирует со всеми веществами, а некоторые реакции сопровождаются горением и взрывом. В атмосфере фтора горят даже вода и платина. Фтор окисляет кислород и образует фторид кислорода OF2.
- Неметаллы вступают в реакции со следующими веществами.
- 3 F + 2 Al → 2 AlF3 (нагревание)
- S + Fe →FeS (нагревание)
- 2 F2 + C → CF2 (нагревание)
- S + O2→ SO2(нагревание)
- 4 F2 + CH4→CH3F + HF
- 3 O2 + 4 NH3→ 2 N2 + 6 H2O
Меньшей активностью обладают такие неметаллы как бор, графит, алмаз. Они могут проявлять восстановительные свойства.
2 C + MnO2 → Mn + 2 CO
4 H2 + Fe3O2 → 3 Fe + 4 H2O
Основания амфотерных металлов
Металлы
В нормальных условиях это вещества не растворяются в воде и их можно спокойно отнести к слабым электролитам. Такие вещества получают после проведения реакции солей металла и щелочи. Эти реакции довольно опасны для тех, кто их производит и поэтому, например, для получения гидроксида цинка в емкость с хлоридом цинка медленно и аккуратно, по капле надо вводить едкий натр.
Вместе тем, амфотерные — взаимодействуют с кислотами как основания. То есть при выполнении реакции между соляной кислотой и гидроксидом цинка, появится хлорид цинка. А при взаимодействии с основаниями, они ведут себя как кислоты.
Физические и химические свойства оксидов
Исключение дифторид кислорода (OF2), поскольку электроотрицательность фтора выше, чем у кислорода и фтор всегда проявляет степень окисления «-1».
Оксиды, в зависимости от проявляемых ими химических свойств подразделяют на два класса – солеобразующие и несолеобразующие оксиды. Солеобразующие оксиды имеют внутреннюю классификацию. Среди них выделяют кислотные, основные и амфотерные оксиды.
Химические свойства несолеобразующих оксидов
Несолеобразующие оксиды не проявляют ни кислотных, ни основных, ни амфотерных свойств, не образуют соли. К несолеобразующим оксидам относятся оксиды азота (I) и (II) (N2O, NO), оксид углерода (II) (CO), оксид кремния (II) SiO и др.
- Несмотря на то, что несолеобразующие оксиды не способны к образованию солей при взаимодействии оксида углерода (II) с гидроксидом натрия образуется органическая соль – формиат натрия (соль муравьиной кислоты):
- CO + NaOH = HCOONa.
- При взаимодействии несолеобразующих оксидов с кислородом получают высшие оксиды элементов:
- 2CO + O2 = 2CO2;
- 2NO + O2 = 2NO2.
Химические свойства солеобразующих оксидов
- Среди солеобразующих оксидов различают основные, кислотные и амфотерные оксиды, первые из которых при взаимодействии с водой образуют основания (гидроксиды), вторые – кислоты, а третьи – проявляют свойства как кислотных, так и основных оксидов.
- Основные оксиды реагируют с водой с образованием оснований:
- CaO + 2H2O = Ca(OH)2 + H2↑;
- Li2O + H2O = 2LiOH.
- При взаимодействии основных оксидов с кислотными или амфотерными оксидами получаются соли:
- CaO + SiO2 = CaSiO3;
- CaO + Mn2O7 = Ca(MnO4)2;
- CaO + Al2O3 = Ca(AlO2)2.
- Основные оксиды реагируют с кислотами с образованием солей и воды:
- CaO + H2SO4 = CaSO4 + H2O;
- CuO + H2SO4 = CuSO4 + H2O.
- При взаимодействии основных оксидов, образованных металлами, стоящими в ряду активности после алюминия, с водородом, происходит восстановление металлов, входящих в оксида:
- CuO + H2 = Cu + H2O.
- Кислотные оксиды реагируют с водой с образованием кислот:
- P2O5 + H2O = HPO3 (метафосфорная кислота);
- HPO3 + H2O = H3PO4 (ортофосфорная кислота);
- SO3 + H2O = H2SO4.
- Некоторые кислотные оксиды, например, оксид кремния (IV) (SiO2), не вступают в реакцию взаимодействия с водой, поэтому, соответствующие этим оксидам кислоты получают косвенным путем.
- При взаимодействии кислотных оксидов с основными или амфотерными оксидами получаются соли:
- P2O5 + 3CaO = Ca3(PO4)2;
- CO2 + CaO = CaCO3;
- P2O5 +Al2O3 = 2AlPO4.
- Кислотные оксиды реагируют с основаниями с образованием солей и воды:
- P2O5 + 6NaOH = 3Na3PO4 + 3H2O;
- Ca(OH)2 + CO2 = CaCO3↓ + H2O.
- Амфотерные оксиды взаимодействуют с кислотными и основными оксидами (см. выше), а также с кислотами и основаниями:
- Al2O3 + 6HCl = 2AlCl3 + 3H2O;
- Al2O3 + NaOH + 3H2O = 2Na[Al(OH)4];
- ZnO + 2HCl = ZnCl2 + H2O;
- ZnO + 2KOH + H2O = K2[Zn(OH)4]4
- ZnO + 2KOH = K2ZnO2.
Физические свойства оксидов
Большинство оксидов – твердые вещества при комнатной температуре (CuO – порошок черного цвета, CaO – белое кристаллическое вещество, Cr2O3 – порошок зеленого цвета и т.д.).
Некоторые оксиды представляют собой жидкости (вода – оксид водорода – бесцветная жидкость, Cl2O7 – бесцветная жидкость) или газы (CO2 – газ без цвета, NO2 – газ бурого цвета).
Строение оксидов также различно, чаще всего молекулярное или ионное.
Получение оксидов
- Практически все оксиды можно получить по реакции взаимодействия конкретного элемента с кислородом, например:
- 2Cu + O2 = 2CuO.
- К образованию оксидов также приводит термическое разложение солей, оснований и кислот:
- CaCO3 = CaO + CO2↑;
- 2Al(OH)3 = Al2O3 + 3H2O;
- 4HNO3 = 4NO2 + O2 + 2H2O.
- Среди других способов получения оксидов выделяют обжиг бинарных соединений, например, сульфидов, окисление высших оксидов до низших, восстановление низших оксидов до высших, взаимодействие металлов с водой при высокой температуре и др.
Примеры решения задач
| Понравился сайт? Расскажи друзьям! |
Изучаем химию. 8 класс
Последнее изменение: Пятница, 11 сентября 2015, 13:51 Пропустить Навигация Пропустить Специальные возможности Пропустить Контакты
Page 2
Пропустить Навигация
- В начало
- Страницы сайта
- Теги
- Календарь
- Новости сайта
-
Курсы
- Региональные ЦОР
- Детский технопарк «Кванториум»
- IT квантум
- VR/AR квантум
- Промробоквантум
- Энерджиквантум
- Наноквантум
- Хайтек
- Математика
- Английский язык
- Шахматы
-
Русский язык
-
Математика
-
Иностранный язык
- Английский язык
- Французский язык
- Немецкий язык
-
Информатика
-
История и обществознание
-
Химия
-
Физика
-
Начальная школа
- Русский язык
- Математика
- Окружающий мир
- Внеклассное чтение
- Иностранный язык
- Информатика
- Умники и умницы
-
География
-
Литература
-
Биология
-
Дополнительное образование
-
Технология
-
Основы безопасности жизнедеятельности
-
СПО
- Детский технопарк «Кванториум»
-
ЦОР ОО
- Волжский район
- МОУ «СОШ № 10
- МОУ «СОШ №11»
- МОУ «Лицей прикладных наук»
- МОУ «СОШ №8»
- МАОУ «Гимназия № 4»
-
Заводской район
- МАОУ «Лицей № 15»
- МОУ «Гимназия №58»
- МОУ «СОШ №23»
- МОУ «СОШ № 5»
- МОУ «Гимназия № 5»
- ГБУ ДО «ДПМ»
- МКУ ДО «ЦВР»
- МУДО «Центр дополнительного образования»
- ГБУ ДО «Региональный центр допризывной подготовки …
-
Кировский район
- МОУ «СОШ №71»
- МОУ «СОШ №73»
- МОУ Гимназия № 31
- МОУ «СОШ № 93»
- МОУ «Прогимназия № 237 «Семицветик»
- МОУ «СОШ № 51»
- ЛМИ
- МОУ «СОШ № 67»
- МОУ «ООШ № 14»
- МАУДО ЦДТ “СОЗВЕЗДИЕ-К”
- ПК «Восход»
- ПК «Дельта»
- КВР «Островок»
- ПК «Ромашка»
- ПК «Ровесник»
- ПК «Дружба»
- ПК «Смена»
- ПК «Факел»
- ПК «Юность»
- Краткосрочные программы
-
МКУ ДО «ЦТДиМ»
-
Лицей «Солярис»
-
ГА ПОУ СО «СТПТиАС»
-
Ленинский район
- МОУ «Гимназия №89»
- МОУ «СОШ №46»
- МОУ «СОШ №55»
- МАОУ «Лицей № 36»
- МОУ «СОШ № 76»
- МОУ «СОШ №63 с УИП»
- МОУ «СОШ №41»
- МОУ «СОШ № 103»
- МОУ «СОШ № 48»
- МОУ «СОШ №57″
- МОУ «СОШ № 49»
- МАОУ «Гимназия №108»
- МОУ «СОШ №52»
- МБЛ
- МУ ДО «Центр детского творчества»
- МОУ «Лицей 56»
- МБЛ
- Олимпиада_Физика
- Олимпиада_Информатика и ИКТ
- Олимпиада_Математика
-
Октябрьский район
- МАОУ «Лицей №62»
- МАОУ «Лицей №3»
- Гимназия № 1
- МОУ «СОШ № 45»
- МАУ ДО «Центр дополнительного образования для детей»
-
Фрунзенский район
- МОУ «СОШ №18»
- МАОУ «Гимназия № 3»
- МОУ СОШ № 1
- ГБУ СОДО «ОЦЭКИТ»
- МАУДО «ДТДиМ»
- МАДОУ «ДС № 236 Лукоморье»
- МУДО «Детско-юношеский центр»
- МУДО «Центр детского творчества»
- МОУ СОШ № 77
-
ОУ городского подчинения и ГБУ
- МАОУ «ЛГН»
- МОУ «Гимназия №2»
- Ассоциация попечителей образования
- МАОУ «Физико-технический лицей № 1»
- ЛИЕН
- МУДО «Центр туризма, краеведения и морской подгото…
- МАУ ДО «Дворец творчества детей и молодежи»
-
Саратовская область
- Александрово — Гайский район
- МБОУ СОШ с. Новоалександровка им. Героя Советско…
- МБОУ СОШ№ 1 с.Александров-Гай Саратовской области
- МБОУ ДО «ЦДТ» с. Александров-Гай Александрово-Гайс…
-
Аткарский район
- МОУ — СОШ №1 г. Аткарска
- МОУ — СОШ №3 г. Аткарска
- МОУ-СОШ села Марфино Аткарского района
- МАУ ДО «Центр детского творчества города Аткарска …
-
Балаковский район
- МАОУ Гимназия № 1
- МАОУ Гимназия №2 г.Балаково
- МАОУ «СОШ №2»
- МАОУ «ООШ № 10» г. Балаково
- МАОУ СОШ №13 г. Балаково
- МАОУ «СОШ №16»
- МОУ «СОШ №19»
- МАОУ СОШ № 26
- СОШ № 28
- МАОУ «ООШ с. Еланка»
- МАУДО ЦДО г. Балаково
- ГАПОУ СО БПТ
-
Балашовский район
- МБУДО Центр «Созвездие» г. Балашов
-
Вольский район
- МОУ «СОШ с. Черкасское»
- МОУ «СОШ с. Терса»
- МОУ «СОШ №11» г. Вольск
- Гимназия № 1
- ГАПОУ СО «Вольский педагогический колледж им. Ф.И….
- МУДО ВМР «ЦДО «Радуга»
-
Воскресенский район
- МОУ «СОШ с. Воскресенское»
- МОУ «СОШ с. Синодское»
-
Дергачевский район
- МОУ СОШ № 1
- МОУ «ООШ с. Верхазовка»
- МОУ «СОШ п. Первомайский»
- МОУ «СОШ с. Демьяс»
- МОУ «СОШ № 2»
- МУДО «Дом детского творчества»
-
Духовницкий район
- МОУ «СОШ им. Г.И. Марчука р.п. Духовницкое»
- МОУ «СОШ имени Н.В. Грибанова с. Брыковка»
-
Екатериновский район
-
Ершовский район
- МОУ «СОШ №3»
- МОУ «СОШ №5»
- МОУ «СОШ № 2»
- СОШ п.Учебный
- МБОУ «Дом детского творчества»
-
Ивантеевский район
- МОУ «СОШ с. Ивантеевка»
- Гимназия
- МУ ДО «Дом детского творчества»
-
Калининский район
- ГАПОУ СО «КТА»
- МБУ ДО «Детско-юношеская спортивная школа г. Калин…
- МБОУ «СОШ с.Симоновка Калининского района Саратовс…
- МБУ ДО «Дом детского творчества г. Калининска Сара…
- МБОУ «СОШ с. Колокольцовка»
- МБОУ «СОШ с. Озерки»
- МБОУ «СОШ с.Симоновка»
-
Красноармейский район
- МБОУ СОШ № 2
- МОУ «СОШ № 3»
- МБОУ «СОШ № 11 с. Золотое»
- МБУДО «ЦТОТД и М г.Красноармейска»
- МОУ «СОШ № 8»
-
Краснокутский район
- МОУ «СОШ №3»
- МОУ «СОШ № 1»
- МОУ «СОШ с.Логиновка»
- МОУ — СОШ с. Лебедевка
- МОУ — СОШ №2
-
Краснопартизанский район
- МУ ДО «Районный Дом детского творчества р.п. Горный «
-
Лысогорский район
- МБОУ «СОШ № 2 р.п. Лысые Горы»
- МОУ «СОШ № 1 р.п. Лысые Горы»
- МБОУ «СОШ с. Широкий Карамыш»
- МБОУ «СОШ с. Большая Рельня»
- МБУ ДО «ЦДОД» р.п. Лысые Горы
- МБОУ «ООШ с. Юнгеровка»
- МБОУ «СОШ с. Двоенки»
- МБОУ «СОШ с. Атаевка»
- МБОУ «СОШ с. Бутырки»
- МБОУ «СОШ п. Яблочный»
- МБОУ «СОШ п. Октябрьский»
- МБОУ «СОШ с. Невежкино»
-
Марксовский район
- МОУ СОШ с. Подлесное
- МОУ «СОШ с. Павловка»
- МОУ «СОШ с. Кировское»
- МБОУ-СОШ №6 г. Маркса
- МОУ — СОШ п. Осиновский
- МОУ «СОШ c. Липовка»
- МОУ — СОШ с. Баскатовка
- МОУ — Лицей г. Маркса
- МОУ «СОШ № 4» г. Маркса
- МОУ СОШ с. Звонаревка
- МОУ-СОШ с Орловское
- МОУ — СОШ №1
- МУ ДО – Центр внешкольной работы
-
Новобурасский район
- МОУ «СОШ п. Динамовский
- МОУ «СОШ с. Гремячка»
- МОУ «СОШ №1»
- с. Тепловка
-
Новоузенский район
- МОУ СОШ № 8
- МУ ДО «ДДТ г. Новоузенска»
- ГАПОУ СО «Новоузенский агротехнологический техникум»
-
Озинский район
- МОУ «СОШ р.п. Озинки»
- Метапредметный курс «Биология + Химия»
-
МОУ «СОШ п. Сланцевый рудник»
-
МОУ «Школа с. Новочерниговка»
-
МБУДО «Дом детского творчества р.п. Озинки»
- МОУ «СОШ р.п. Озинки»
-
Перелюбский район
- СОШ с. Иваниха
- МБОУ «СОШ с. Н. Покровка»
- МБОУ «СОШ с.Натальин Яр»
- МБОУ «СОШ с.Грачев Куст»
- МБОУ «СОШ имени М.М. Рудченко»
-
Петровский район
- МОУ СОШ № 8
- МБОУ СОШ № 3
- МБУ ДО «Детско-юношеский центр» г. Петровск
- МБУДО «Детско-юношеская спортивная школа имени Т.В…
- МБУДО «ДОООЦ «ДЕЛЬФИН» г. Петровск
- МБОУ «СОШ № 2»
- МБОУ «ООШ № 5»
-
Питерский район
- МУ ДО «Дом детского творчества»
-
Пугачевский район
- МОУ «СОШ №14 г. Пугачёва им. П.А.Столыпина»
- МОУ СОШ с. Старая Порубёжка
- МОУ «СОШ с. Заволжский»
- МОУ «СОШ №2 г. Пугачева»
- МОУ «СОШ № 13 г. Пугачева Саратовской области имен…
- МБУ ДО «Центр развития творчества детей и юношеств…
-
Ровенский район
- МБОУ «СОШ с. Скатовка»
- МБУ ДО «Дом детского творчества р.п.Ровное»
-
Ртищевский район
- МОУ «СОШ № 7»
- СТЮТ г. Ртищево
- МОУ «Владыкинская СОШ» Ртищевского района
-
Саратовский район
- МОУ«СОШ с. Багаевка им. Н.В. Котлова»
- МОУ «СОШ с.Березина Речка»
- МОУ «СОШ п. Дубки»
- МОУ «СОШ с. Синенькие»
- МОУ «СОШ р.п. Соколовый»
- МОУ «СОШ с.Усть-Курдюм»
-
Самойловский район
- МУ ДО «ЦДТ р.п. Самойловка»
-
Советский район
- МБОУ «СОШ №1» р.п. Степное
- МБОУ «Лицей»
- МБОУ-ООШ с. Розовое
- МБОУ «СОШ р.п. Пушкино»
- МБУ ДО-РДДиЮ Советского района.
-
Татищевский район
- МОУ «СОШ с. Сторожевка»
- МОУ «СОШ с. Мизино-Лапшиновка
- МОУ «СОШ с. Ягодная Поляна»
- МОУ «Татищевский лицей»
- МОУ «СОШ с. Вязовка»
- МОУ «СОШ с. Октябрьский Городок»;
- МОУ «СОШ п. Садовый»
- МОУ «СОШ с. Идолга»
-
Хвалынский район
- МОУ СОШ № 1 г. Хвалынска
- МОУ ДО «ДДТ «Хвалынский»
- Звуковая культура речи
- Флористика
- 3-д моделирование
- ИКТ
- Трудовое обучение(технический труд)
- Краеведение
- ИЗО
- Лепка
- Цветоводство
- Лесничество
- Брейк-данс
- Волонтерство
- Логика
- Дизайн
- Философия
- Лесничество
-
п. Возрождение
-
МОУ «СОШ с. Апалиха
-
МОУ СОШ №2
- Русский язык
- Литература
- История, обществознание
- Математика
- Информатика, физика, астрономия
- Иностранный язык
- Музыка
- Химия, биология
- Начальная школа
-
Энгельсский район
- МОУ «СОШ №1»
- МБОУ ООШ № 2
- МОУ «СОШ № 3»
- МБОУ «СОШ №4»
- МБОУ «СОШ №9»
- МБОУ «ООШ №10»
- МОУ «СОШ №12»
- МБОУ «СОШ №15»
- МБОУ «СОШ №18»
- МОУ «СОШ №19»
- МБОУ « СОШ №20»
- МОУ «СОШ № 21»
- МБОУ «СОШ №24»
- МОУ ООШ №26
- МОУ «СОШ №30 им. П. М. Коваленко»
- МБОУ «СОШ №32»
- МБОУ «СОШ№33»
- МОУ «СОШ №42»
- МАУ ДО «Дворец творчества детей и молодежи»
- МУ ДО «Центр «Позитив»
- МОУ «СОШ п. Пробуждение им. Л. А. Кассиля»
- МБОУ «СОШ с. Генеральское»
- МОУ «СОШ «Патриот» с кадетскими классами»
- МОУ «СОШ с.Заветное»
- МОУ «СОШ с. Узморье им. Ю.А.Гагарина»
- МОУ «ООШ с. Квасниковка»
- МОУ «СОШ п. им. К Маркса»
- МОУ «ООШ с. Ленинское»
- МОУ «СОШ с.Широкополье»
- МОУ «СОШ с. Зеленый Дол»
- МОУ «ООШ с. Безымянное»
- МОУ «СОШ п.Бурный»
- МОУ «ООШ с. Титоренко»
- МБОУ «СОШ с Красный Яр
- МАОУ «Образовательный центр № 1» ЭМР
- ГАПОУ СО «Энгельсский политехникум»
- МБОУ «СОШ с. Старицкое»
- МОУ «СОШ п. Коминтерн»
- МОУ «СОШ с. Липовка»
- МОУ «СОШ с. Шумейка»
- МОУ «СОШ с.Воскресенка»
-
МОУ «СОШ №12 г. Шиханы»
-
Турковский район
-
ЗАТО «Светлый»
- МУ ДО ЗАТО Светлый
- МОУ СОШ №3 им. В.Н. Щеголева
- МОУ «СОШ №2 им. В.А. Коновалова»
-
Федоровский район
-
Балтайский район
- МБУ ДО «Дом детского творчества Балтайского района
- Александрово — Гайский район
-
СОИРО
- Проект 2021
- Проект 2020
- Проект 2019
- КОНКУРС_2022
- Семинар 7.10
- Волжский район
-
Дистанционное обучение детей-инвалидов
- О проекте
- МЦДОДИ
- Мероприятия для МЦДОДИ
-
О портале
-
Нормативные документы
-
Российские цифровые образовательные платформы
-
Видеоконференция
- Создание видеоконференции
- Конкурсы
-
Семинары
- 15-16.11.2021Семинар «Дистанционные формы обучения…
- Семинар 7 октября 2021
- Региональные ЦОР
- Страницы сайта