Серная кислота — сильная двухосновная кислота, при н.у. маслянистая жидкость без цвета и запаха.
Обладает выраженным дегидратационным (водоотнимающим) действием. При попадании на кожу или слизистые оболочки приводит к тяжелым ожогам.
Замечу, что существует олеум — раствор SO3 в безводной серной кислоте, дымящее жидкое или твердое вещество. Олеум применяется при изготовлении красителей, органическом синтезе и в производстве серной кислот.
Известны несколько способов получения серной кислоты. Применяется промышленный (контактный) способ, основанный на сжигании пирита, окислении образовавшегося SO2 до SO3 и последующим взаимодействием с водой.
- FeS2 + O2 → (t) Fe2O3 + SO2↑
- SO2 + O2 ⇄ (кат. — V2O5) SO3
- Нитрозный способ получения основан на взаимодействии сернистого газа с диоксидом азота IV в присутствии воды. Он состоит из нескольких этапов:
- Смесь газов подается в башни, орошаемые 75-ной% серной кислотой, здесь смесь оксидов азота поглощается с образованием нитрозилсерной кислоты:
- 2. NO + NO2 + 2H2SO4 = 2NO(HSO4) + H2O
- 3. NO(HSO4) + H2O = H2SO4 + HNO2
- NO2 + SO2 + H2O = H2SO4 + NO
- Кислотные свойства
- В водном растворе диссоциирует ступенчато.
- H2SO4 ⇄ H+ + HSO4-
- HSO4- ⇄ H+ + SO42-
- MgO + H2SO4 → MgSO4 + H2O
- KOH + H2SO4 = KHSO4 + H2O (гидросульфат калия, соотношение 1:1 — кислая соль)
- 2KOH + H2SO4 = K2SO4 + 2H2O (сульфат калия, соотношение 2:1 — средняя соль)
- Реакции с солями
- BaBr2 + H2SO4 → BaSO4↓ + 2HBr
- MgCO3 + H2SO4 → MgSO4 + CO2↑ + H2O
- Na2CO3 + H2SO4 → Na2SO4 + CO2↑ + H2O
- Реакция с неметаллами
- Серная кислота окисляет неметаллы — серу и углерод — соответственно до угольной кислоты (нестойкой) и сернистого газа.
- S + H2SO4 → SO2 + H2O
- C + H2SO4 → CO2 + SO2 + H2O
- Реакции с металлами
- Fe + H2SO4(разб.) → FeSO4 + H2↑
- Zn + H2SO4(разб.) → ZnSO4 + H2↑
- Cu + H2SO4(разб.) ⇸ (реакция не идет, медь не может вытеснить водород из кислоты)
- Na + H2SO4(конц.) → Na2SO4 + H2S + H2O
- Zn + H2SO4(конц.) → ZnSO4 + S + H2O
- Cu + H2SO4(конц.) → CuSO4 + SO2 + H2O
Сильная кислота. Реагирует с основными оксидами, основаниями, образуя соли — сульфаты.

С солями реакция идет, если в результате выпадает осадок, образуется газ или слабый электролит (вода). Серная кислота, как и многие другие кислоты, способна растворять осадки.

Реакции разбавленной серной кислоты с металлами не составляют никаких трудностей: она реагирует как самая обычная кислота, например HCl. Все металлы, стоящие до водорода, вытесняют из серной кислоты водород, а стоящие после — не реагируют с ней.
Подчеркну, что реакции разбавленной серной кислоты с железом и хромом не сопровождаются переходом этих элементов в максимальную степень окисления. Они окисляются до +2.

Концентрированная серная кислота ведет себя совершенно по-иному. Водород никогда не выделяется, вместо него с активными металлами выделяется H2S, с металлами средней активности — S, с малоактивными металлами — SO2.
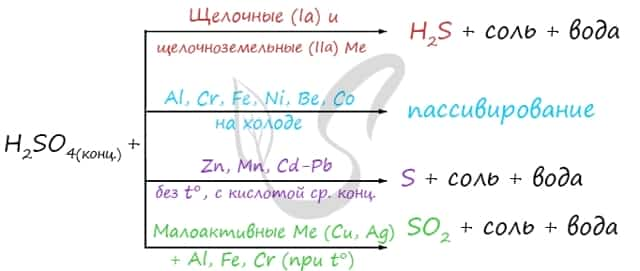

Холодная концентрированная серная кислота пассивирует Al, Cr, Fe, Ni, Be, Co. При нагревании или амальгамировании данных металлов реакция идет.
Обратите особое внимание, что при реакции железа, хрома с концентрированной серной кислотой достигается степень окисления +3. В подобных реакциях с разбавленной серной кислотой (написаны выше) достигается степень окисления +2.
Fe + H2SO4(конц.) → (t) Fe2(SO4)3 + SO2 + H2O
Cr + H2SO4(конц.) → (t) Cr2(SO4)3 + SO2 + H2O

Иногда в тексте задания даны подсказки. Например, если написано, что выделился газ с неприятным запахом тухлых яиц — речь идет об H2S, если же написано, что выделилось простое вещество — речь о сере (S).
Окислительные свойства серной кислоты | Дистанционные уроки
ОВР в статье специально выделены цветом. Обратите на них особое внимание. Эти уравнения могут попасться в ЕГЭ.
- Разбавленная серная ведет себя, как и остальные кислоты, окислительные свои возможности прячет:
- Zn + H2SO4 → ZnSO4 + H2↑
- Автор статьи — Саид Лутфуллин
И еще, что надо помнить про разбавленную серную кислоту: она не реагирует со свинцом. Кусок свинца, брошенный в разбавленную H2SO4 покрывается слоем нерастворимого (см. таблицу растворимости) сульфата свинца и реакция моментально прекращается.
Pb + H2SO4 ≠
Концентрированная серная кислота – тяжелая маслянистая жидкость, не летучая, не имеет вкуса и запаха
За счет серы в степени окисления +6(высшей) серная кислота приобретает сильные окислительные свойства.
Правило для задания 24 (по-старому А24) при приготовлении растворов серной кислоты никогда нельзя в нее лить воду. Концентрированую серную кислоту нужно тонкой струйкой вливать в воду, постоянно помешивая.
Взаимодействие концентрированной серной кислоты с металлами
Эти реакции строго стандартизированны и идут по схеме:
H2SO4(конц.) + металл → сульфат металла + H2O + продукт восстановленной серы.
Есть два нюанса:
1) Алюминий, железо и хром с H2SO4 (конц) в нормальных условиях не реагируют, из-за пассивации. Нужно нагреть.
2) С платиной и золотом H2SO4 (конц) не реагирует вообще.
Сера в концентрированной серной кислоте – окислитель
- значит, сама будет восстанавливаться;
- то, до какой степени окисления будет восстанавливаться сера, зависит от металла.
Рассмотрим диаграмму степеней окисления серы:
- До -2 серу могут восстановить только очень активные металлы — в ряду напряжений до алюминия включительно.
- Реакции будут идти вот так:
- 8Li + 5H2SO4(конц.) → 4Li2SO4 + 4H2O + H2S↑
- 4Mg + 5H2SO4(конц.) → 4MgSO4 + 4H2O + H2S↑
- 8Al + 15H2SO4(конц.) (t)→ 4Al2(SO4)3 + 12H2O + 3H2S↑
- при взаимодействии H2SO4 (конц) с металлами в ряду напряжений после алюминия, но до железа, то есть с металлами со средней активностью сера восстанавливается до :
- 3Mn + 4H2SO4(конц.) → 3MnSO4 + 4H2O + S↓
- 2Cr + 4H2SO4(конц.) (t)→ Cr2(SO4)3 + 4H2O + S↓
- 3Zn + 4H2SO4(конц.) → 3ZnSO4 + 4H2O + S↓
- все остальные металлы, начиная с железа в ряду напряжений (включая те, что после водорода, кроме золота и платины, конечно), могут восстановить серу только до +4. Так как это малоактивные металлы:
- 2Fe + 6H2SO4(конц.) (t)→ Fe2(SO4)3 + 6H2O + 3SO2↑
- (обратите внимание, что железо окисляется до +3, до максимально возможной, высшей степени окисления, так как оно имеет дело с сильным окислителем)
- Cu + 2H2SO4(конц.) → CuSO4 + 2H2O + SO2↑
- 2Ag + 2H2SO4(конц.) → Ag2SO4 + 2H2O + SO2↑

Конечно, все относительно. Глубина восстановления будет зависеть от многих факторов: концентрации кислоты (90%, 80%, 60%), температуры и т.д. Поэтому совсем уж точно предсказать продукты нельзя.
Приведенная выше таблица тоже имеет свой процент приблизительности, но пользоваться ей можно.
Еще необходимо помнить, что в ЕГЭ, когда продукт восстановленной серы не указан, и металл не отличается особой активностью, то, скорее всего, составители имеют в виду SO2. Нужно смотреть по ситуации и искать зацепки в условиях.
SO2 – это вообще частый продукт ОВР с участием конц. серной кислоты.
- H2SO4 (конц) окисляет некоторые неметаллы (которые проявляют восстановительные свойства), как правило, до максимальной — высшей степени окисления (образуется оксид этого неметалла). Сера при этом тоже восстанавливается до SO2:
- C + 2H2SO4(конц.) → CO2↑ + 2H2O + 2SO2↑
- 2P + 5H2SO4(конц.) → P2O5 + 5H2O + 5SO2↑
- Свежеобразованный оксид фосфора (V) реагирует с водой, получается ортофосфорная кислота. Поэтому реакцию записывают сразу:
- 2P + 5H2SO4(конц) → 2H3PO4 + 2H2O + 5SO2↑
- То же самое с бором, он превращается в ортоборную кислоту:
- 2B + 3H2SO4(конц) → 2H3BO3 + 3SO2↑
Очень интересны взаимодействие серы со степенью окисления +6 (в серной кислоте) с «другой» серой (находящейся в другом соединении). В рамках ЕГЭ рассматривается взаимодействиеH2SO4 (конц) с серой (простым веществом) и сероводородом.
Начнем с взаимодействия серы (простого вещества) с концентрированной серной кислотой. В простом веществе степень окисления 0, в кислоте +6. В этой ОВР сера +6 будет окислять серу 0. Посмотрим на диаграмму степеней окисления серы:
- Сера 0 будет окисляться, а сера +6 будет восстанавливаться, то есть понижать степень окисления. Будет выделяться сернистый газ:
- 2H2SO4(конц.) + S → 3SO2↑ + 2H2O
- Но в случае с сероводородом:
- Образуется и сера (простое вещество), и сернистый газ:
- H2SO4(конц.) + H2S → S↓ + SO2↑ + 2H2O
Этот принцип часто может помочь в определении продукта ОВР, где окислитель и восстановитель – один и тот же элемент, в разных степенях окисления. Окислитель и восстановитель «идут навстречу друг другу» по диаграмме степеней окисления.
- H2SO4 (конц) , так или иначе, взаимодействует с галогенидами. Только вот тут надо понимать, что фтор и хлор – «сами с усами» и с фторидами и хлоридами ОВР не протекает, проходит обычный ионно-обменный процесс, в ходе которого образуется газообразный галогеноводород:
- CaCl2 + H2SO4(конц.) → CaSO4 + 2HCl↑
- CaF2 + H2SO4(конц.) → CaSO4 + 2HF↑
А вот галогены в составе бромидов и иодидов (как и в составе соответствующих галогеноводородов) окисляются ей до свободных галогенов. Только вот сера восстанавливается по-разному: иодид является более cильным восстановителем, чем бромид. Поэтому иодид восстанавливает серу до сероводорода, а бромид до сернистого газа:
- 2H2SO4(конц.) + 2NaBr → Na2SO4 + 2H2O + SO2↑ + Br2
- H2SO4(конц.) + 2HBr → 2H2O + SO2↑ + Br2
- 5H2SO4(конц.) + 8NaI → 4Na2SO4 + 4H2O + H2S↑ + 4I2↓
- H2SO4(конц.) + 8HI → 4H2O + H2S↑ + 4I2↓
- Хлороводород и фтороводород (как и их соли) устойчивы к окисляющему действию H2SO4 (конц).
И наконец, последнее: для концентрированной серной кислоты это уникально, больше никто так не может. Она обладает водоотнимающим свойством.
Это позволяет использовать концентрированную серную кислоту самым разным образом:
Во-первых, осушение веществ. Концентрированная серная кислота забирает воду от вещества и оно «становится сухим».
- Во-вторых, катализатор в реакциях, в которых отщепляется вода (например, дегидратация и этерификация):
- H3C–COOH + HO–CH3 (H2SO4(конц.))→ H3C–C(O)–O–CH3 + H2O
- H3C–CH2–OH (H2SO4(конц.))→ H2C=CH2 + H2O
Обсуждение: «Окислительные свойства серной кислоты»
(Правила комментирования)
Серная кислота. Решение заданий Тестовой части ЕГЭ 2022
Задания по подготовке к ЕГЭ по химии 15 марта 2022 г., 9:47 
Все задания этого урока относятся к ЕГЭ по Химии 2022 года Тестовой части с использованием химических свойств серной кислоты.
Задание 1:В одну из пробирок с раствором вещества X добавили раствор вещества A и наблюдали образование белого осадка.
В другую пробирку, также содержащую раствор вещества X, добавили вещество Y и наблюдали выделение газа. Из предложенного перечня выберите вещества X и Y, которые могут вступать в описанную реакцию.
1) хлорид натрия; 2) нитрат бария; 3) соляная кислота; 4) карбонат кальция;
5) серная кислота.
Решение: В данном задании есть две реакции: в одной образовался осадок белого цвета, в другой – выделился газ. Единственное, что объединяет эти две реакции – вещество Х.
Для начала, вспомним несколько важных аспектов: 1) в ионно-обменных реакциях выделение газа происходит при взаимодействии солей слабых кислот с более сильными кислотами(например, соли угольной и сернистой кислот) 2) осадков белого цвета не так много, и одним из часто встречающихся в ЕГЭ является сульфат бария(соединения бария являются качественными на сульфат-анион) 3) все соли калия и натрия являются РАСТВОРИМЫМИ. Исходя из условия, ищем кислоту(так как выделился газ), это либо соляная, либо серная. Если возьмем соляную кислоту, то она дает белые осадки с солями серебра и свинца, а среди ответов таких солей нет. Поэтому берем серную кислоту (вещество Х). Она в реакции с нитратом бария(вещество А) дает белый осадок сульфат бария. Вторая реакция проходит с выделением газа, очевидно, что из вариантов подходит карбонат кальция(вещество Y): образуется угольная кислота, которая распадается на углекислый газ и воду. Ответ: 54
- Задание 2:
- Fe2O3 ( + Al) → X ( + H2SO4(конц.)) → Y
- 5) феррит железа.
Задана следующая схема превращений: Определите, какие из указанных веществ являются веществами X и Y. 1) сульфат железа(III) 2) сульфат железа(II) 3) железо 4) сульфид железа(III)
Решение: Первая реакция – это взаимодействие оксида железа(III) с алюминием, известный способ получения металлов из их оксидов с помощью алюминия при высокой t (алюминотермия). В результате образуется чистый металл железо. Вторая реакция проходит между железом и концентрированной серной кислотой с образованием сульфата железа(III), сернистого газа и воды. Ответ: 31
Задание 3: Установите соответствие между изменением степени окисления серы в реакции и формулами веществ, при взаимодействии которых происходит такое изменение: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
А) S +4 → S +6
Б) S -2 → S 0 В) S +6 → S +4
1) Cu и H2SO4(разб.) 2) H2S и O2 3) S и H2SO4(конц.) 4) SO2 и O2
Решение: 1) медь + разбавленная серная кислота; эта реакция НЕ идет, так как медь стоит в ряду активности ПОСЛЕ водорода и не вытесняет его.
2) сероводород + кислород; это процесс окисления, в результате которого образуются сера(S) и вода, степень окисления серы увеличивается S -2 → S 0.
3) сера + серная кислота; в этом взаимодействии образуются сернистый газ(SO2) и вода, степень окисления серы уменьшается S +6 → S +4. 4) сернистый газ + кислород; это окислительный процесс, в результате которого образуется высший оксид серы(серный ангидрид), степень окисления серы увеличивается S +4 → S +6. Ответ: 423
Задание 4: Установите соответствие между реагирующими веществами и продуктами, которые образуются при взаимодействии этих веществ: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой. Реагирующие вещества:
А) Zn и H2SO4(разб.)
Б) ZnO и H2SO4(разб.) В) Zn и H2SO4(конц.) Г) ZnS и O2
Продукты реакции: 1) ZnSO4 и H2O 2) ZnO и SO2 3) ZnSO4, H2S и H2O 4) ZnO и SO3 5) ZnSO4 и H2 6) ZnS, SO2 и H2O
Решение: Данное задание является относительно легким: цинк реагирует как с разбавленной, так и с концентрированной серной кислотой. В реакции с H2SO4(конц.
) он помимо сульфата цинка, выдает газ с неприятным запахом – сероводород. Процесс взаимодействия с H2SO4(разб.) это реакция замещения с выделением водорода.
Оксид цинка и серная кислота представляют ионно-обменную реакцию с образованием соли и воды. Сульфид цинка окисляется до оксида цинка и воды.
- Ответ: 5132
- Задание 5: Установите соответствие между реагирующими веществами и продуктами, которые преимущественно образуются при взаимодействии этих веществ: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой. Реагирующие вещества:
- А) Cl2 и NaOH(хол. р-р)
Б) C и H2SO4(конц.) В) C и FeO
- Г) Cu и H2SO4(конц.)
- Продукты реакции: 1) CuSO4, SO2 и H2O 2) NaCl, NaClO и H2O 3) FeO и CO
- 4) CuSO4 и H2
5) CO2, H2O и SO2 6) NaCl, NaClO3 и H2O
Решение: 1) Cl2 и NaOH(хол. р-р): здесь не просто так дан именно холодный раствор, потому что при взаимодействии с горячим раствором NaOH будут другие продукты реакции(NaCl, NaClO3 и H2O). В данном процессе образуются NaCl, NaClO и H2O. 2) C и H2SO4(конц.
): углерод реагирует только с концентрированной серной кислотой с образованием углекислого газа(а не кислоты, как с другими неметаллами), сернистого газа и воды(CO2, H2O и SO2). 3) C и FeO:в данной реакции восстановления образуются два оксида — FeO и CO.
4) Cu и H2SO4(конц.): медь реагирует с концентрированной серной кислотой с образованием сульфата меди(II), сернистого газа и воды(CuSO4, SO2 и H2O).
Ответ: 2531
Задание 6: Установите соответствие между реагирующими веществами и продуктами, которые преимущественно образуются при взаимодействии этих веществ: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой. Реагирующие вещества:
А) H2SO4(конц.) и C
Б) H2SO4(конц.) и S В) H2SO4(конц.) и Cu Г) H2SO4(конц.) и Ag
Продукты реакции: 1) CO2, H2O и SO2 2) Ag2SO4, SO2 и H2O 3) SO2 и H2O 4) CuSO4 и H2 5) CuSO4, SO2 и H2O 6) Ag2SO4 и H2
Решение: Для начала вспомним: в реакциях концентрированной серной кислоты с неметаллами образуются кислоты этих неметаллов, кроме серы и углерода(они образуют оксиды).
1) H2SO4(конц.) и C: образуются CO2, H2O и SO2 2) H2SO4(конц.) и S: образуются SO2 и H2O
В реакциях серной кислоты(конц.) с металлами, стоящими в ряду активности ПОСЛЕ водорода образуются соли, сернистый газ и вода(с разбавленной H2SO4 не реагируют). 3) H2SO4(конц.) и Cu: образуются CuSO4, SO2 и H2O 4) H2SO4(конц.) и Ag: образуются Ag2SO4, SO2 и H2O Ответ: 1352
- Задание 7: Задана следующая схема превращений:
- H2SO3 (X)→ H2SO4 (Y)→ NaHSO4
- 1) Br2
Определите, какие из указанных веществ являются веществами X и Y. 2) H2O 3) NaNO3 4) NaOH
- 5) SO2
- Решение: На первый взгляд, это задание кажется простым, однако, реакция образования серной кислоты из сернистой может вызвать сложности. Дело в том, что сернистую кислоту мы должны расписать на составные оксиды и тогда процесс пойдет:
- SO2 + Br2 + 2H2O → H2SO4(k.) + 2HBr
- Ответ: 14
- Задание 8: Установите соответствие между схемой реакции и формулой недостающего в ней вещества: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой. Схема реакции:
- А) FeS + O2 → Fe2O3 + …
Поэтому, первое вещество это бром. Во второй реакции все легко: серная кислота вступает в реакцию нейтрализации с гидроксидом натрия с образованием кислой соли гидросульфата натрия(недостаток щелочи). Б) H2SO4 + S → … + H2O В) H2SO4(разб.) + Al → Al2(SO4)3 + … Формула вещества:
1) H2S
2) SO2 3) S
4) H2
5) SO3
Решение: 1) FeS + O2 → Fe2O3 + …: эта реакция окислительно-восстановительная, железо здесь окисляется с +2 до +3, а кислород по очевидным причинам меняет степень окисления с 0 до -2; значит, сера степень не изменит и останется при +4. Получается, единственное соединение серы с такой степенью окисления – это SO2.
2) H2SO4 + S → … + H2O: данный процесс также ОВР, у серы до стрелки было +6 и 0, то есть эта реакция диспропорционирования(один и тот же элемент и окислитель, и восстановитель); нам нужно такое соединение серы, которое имеет степень окисления между выше указанными, это опять таки SO2. 3) H2SO4(разб.
) + Al → Al2(SO4)3 + …: тут все проще всего – разбавленная серная кислота ведет себя так же, как все кислоты, металл замещает водород и вытесняет его, ответ H2. Ответ: 224
- Задание 9: Задана следующая схема превращений:
- Cu (H2SO4) → X (KOH) → A(t) → Y
- 3) CuSO4
Определите, какие из указанных веществ являются веществами X и Y. 1) CuO 2) CuS 4) K2[Cu(OH)4] 5) CuSO3
- Решение: Схема превращений в этом задании не сложная: — медь с серной кислотой(конц.) образует сульфат меди(II) – ответ 3;
- — сульфат меди(II) в ионно-обменной реакции с гидроксидом калия дает нерастворимое основание Cu(OH)2;
- Ответ: 31
- Задание 10: Задана следующая схема превращений:
- Mg + X → Y + H2S + H2O
- 1) H2SO4(разб.)
— гидроксид меди(II), как и все нерастворимые основания при нагревании разлагается на соответствующий оксид(CuO) и воду, ответ 1. Определите, какие из указанных веществ являются веществами X и Y. 2) H2SO3 3) MgSO4 4) MgSO3 5) H2SO4(конц.)
Решение: Магний относится к тем активным металлам, которые при взаимодействии с концентрированной серной кислотой образуют S, SO2, H2S. В данном задании нужно расписать только одну химическую реакцию, причем, нам уже практически все известно: магний реагирует с конц. H2SO4 с образованием сульфата магния, сероводорода и воды. Ответ: 53
Задание 11: Установите соответствие между реагирующими веществами и продуктами, которые преимущественно образуются при взаимодействии этих веществ: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой. Реагирующие вещества:
А) Cu2O и H2SO4(конц.)
Б) CuS и HNO3 (конц.) В) CuO и H2SO4(конц.) Г) CuCl и H2SO4(конц.)
Продукты реакции: 1) CuSO4 и H2O 2) CuSO4, SO2, HCl и H2O 3) Cu(NO3)2 и H2S 4) Cu2SO4 и H2O 5) CuSO4, NO2 и H2O 6) CuSO4, SO2 и H2O
Решение: А) Cu2O и H2SO4(конц.): в результате этой реакции ОВР происходит окисление меди до сульфата меди(II), сернистого газа и воды(CuSO4, SO2 и H2O), пункт 6; Б) CuS и HNO3 (конц.
): так как азотная кислота концентрированная, то в этом процессе образуются не нитрат меди(II), а сульфат меди(II), а также диоксид азота и вода(CuSO4, NO2 и H2O), пункт 5; В) CuO и H2SO4(конц.): оксид меди(II) и серная кислота образуют сульфат меди с аналогичной валентностью и воду(CuSO4 и H2O), пункт 1; Г) CuCl и H2SO4(конц.
): эта реакция относится к окислительно-восстановительным, в результате происходит окисление хлорида меди(I) с образованием сульфата меди(II), сернистого газа, хлороводорода и воды, пункт 2. Ответ: 6512
Задание 12: Установите соответствие между реагирующими веществами и формулой газа, выделяющегося при взаимодействии этих веществ: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой. Реагирующие вещества: А) Zn и HCl
Б) Cu и H2SO4(конц.)
В) Mg и H2SO4(разб.) Г) Ag и HNO3(конц.)
Формула газа: 1) H2 2) NO
3) NO2
4) SO2 5) Cl2
Решение: А) Zn и HCl: это простая реакция замещения, которая, кстати, является одним из лабораторных способов получения чистого водорода, в результате он и выделяется, пункт 1;
Б) Cu и H2SO4(конц.): медь окисляется до сульфата меди(II) с образованием сернистого газа, пункт 4;
В) Mg и H2SO4(разб.): магний с серной кислотой выделяет чистый водород в процессе реакции замещения, пункт 1; Г) Ag и HNO3(конц.): серебро реагирует с концентрированной азотной кислотой с образованием нитрата серебра, диоксида азота и воды, пункт 3. Ответ: 1413
Задание 13: Из предложенного перечня выберите все внешние воздействия, которые не оказывают влияния на скорость реакции железа с серной кислотой. 1) измельчение железа 2) добавление сульфата железа(II) 3) понижение температуры 4) увеличение концентрации водорода
5) повышение давления
Решение: Для начала вспомним, какие факторы могут воздействовать на скорость химической реакции: — сами реагирующие вещества; — частота столкновения молекул(степень измельчения веществ, давление для газов и т.д); — температура; — катализаторы и ингибиторы(ускоряют и замедляют химическую реакцию соответственно). Теперь нам нужно понять сам химический процесс, для этого запишем его:
H2SO4(p.) + Fe = FeSO4 + H2↑
В данном вопросе нам необходимо выбрать те факторы, которые НЕ влияют на скорость химической реакции. 1) измельчение железа – это действие приведет к ускорению скорости, нам не подходит; 2) добавление сульфата железа(II) – этот фактор не приведет к изменению скорости реакции, так как добавление продуктов реакции только увеличат концентрацию этих веществ; 3) понижение температуры приведет к снижению скорости реакции, нам не подходит; 4) увеличение концентрации водорода – увеличение продукта реакции к изменению скорости не ведет, этот вариант подходит; 5) повышение давления – не приведет к изменению скорости химической реакции, так как исходные вещества в данном процессе не газы, подходит.
Ответ: 245
Задание 14: Установите соответствие между названием вещества и реагентами, с каждым из которых это вещество может взаимодействовать: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой. Название вещества: А) сера Б) серная кислота(конц.) В) серная кислота(разб.)
- Г) сульфид аммония
- Реагенты: 1) CaCl2, C, Pt 2) NaOH, HCl, H2O 3) Ag, KCl, S
- 4) H2SO4(конц.), LiOH, P
5) Pb, CuS, SiO2 6) Fe(н.у.), ZnS, CaCO3
Решение: А) сера – это неметалл, который реагирует с кислотами(серной(конц.), азотной), неметаллами, металлами, с щелочами, некоторыми солями, среди пунктов ответа нам подходит вариант 4; Б) серная кислота(конц.) – является одной из сильнейших в химическом плане кислот, реагирует со многими веществами(даже с другими кислотами), для нее здесь подходит вариант ответа 3. Почему именно 3?
- 1) с данным списком не подходит платина, она ни при каких условиях с H2SO4 не реагирует;
- Г) сульфид аммония((NH4)2S) – эта соль слабого основания и слабой кислоты, она подвергается гидролизу(реагирует с водой), вступает во взаимодействие с щелочами(с образованием аммиака и воды), а также реагирует с кислотами, подходит пункт 2.
- Задание 15: В пробирку, содержащую раствор соединения бария(вещество X), добавили вещество Y. В результате произошла реакция, которую описывает следующее сокращенное ионное уравнение:
- Ba2+ + SO42- → BaSO4
- Из предложенного перечня выберите вещества X и Y, которые могут вступать в описанную реакцию. 1) серная кислота 2) оксид серы(VI) 3) гидроксид бария 4) бромид бария
- 5) сульфит бария
2) здесь не подходит вода; 4) серная кислота сама с собой не реагирует; 5) здесь не подходит оксид кремния, он стоек к воздействию кислот, не считая плавиковой(HF); 6) в данном списке веществ не подходит железо, дано условие – н.у., стандартные условия, а при нормальной температуре серная кислота пассивирует железо и реакция не пойдет. В) серная кислота(разб.) – тут не подходят все пункты, кроме 6: — с железом при нормальных условиях происходит реакция замещения, — с сульфидом цинка и карбонатом кальция проходят обычные реакции обмена; Ответ: 4362
Решение: Для понимания этого задания нужно разбираться в ионно-обменных реакциях, и уметь составлять молекулярные, полные и сокращенные ионные уравнения. Здесь представлен катион бария, который при взаимодействии с анионом сульфата образует осадок белого цвета – сульфат бария.
Теперь нужно найти два соединения, которые содержат данные ионы и соответствуют вышеуказанному ионному уравнению.
1) серная кислота – пока подходит, она содержит анион сульфат; 2) оксид серы – тут не подходит никак, оксиды не распадаются на ионы; 3) гидроксид бария – он содержит ион бария, однако, в сокращенном ионном уравнении после стрелки должна быть вода, а в нашем задании ее нет, поэтому, не подходит; 4) бромид бария – подходит, так как выделится сульфат бария и бромоводород;
5) сульфит бария – не подходит, при взаимодействии с серной кислотой выделится сульфат бария и сернистая кислота, которая является слабой и распадется на сернистый газ и воду, и мы должны будем вписать их в сокращенное ионное уравнение, а у нас есть только BaSO4, не подходит.
Ответ: 41.
На этом все!
pangenes.ru © 2022

Решу егэ
Тип 15 № 9914
Установите соответствие между реагирующими веществами и органическим продуктом, который образуется при взаимодействии этих веществ: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
- РЕАГИРУЮЩИЕ ВЕЩЕСТВА
- А) бензойная кислота и раствор гидроксида натрия
- Б) бензойная кислота и избыток твёрдого гидроксида натрия (при нагревании)
- В) бензойная кислота и этанол (в присутствии серной кислоты)
- Г) бензойная кислота и азотная кислота (в присутствии серной кислоты)
- ОРГАНИЧЕСКИЙ ПРОДУКТ РЕАКЦИИ
Запишите в ответ цифры, расположив их в порядке, соответствующем буквам.
Решение.
Установим соответствие.
Б) Реакция декарбоксилирования карбоновых кислот заключается в отщеплении от молекулы карбоновой кислоты диоксида углерода.
Наиболее известны реакции декарбоксилирования уксусной и бензойной кислот, которые проводят нагреванием до высокой температуры смеси карбоновой кислоты и избытка щелочи.
Таким образом, в реакции бензойной кислоты с твердой щелочью образуется карбонат натрия и бензол под номером 4.
В) Реакция карбоновой кислоты со спиртом под действием серной кислоты называется реакцией этерификации, в ходе которой образуется сложный эфир. В конкретном случае это этиловый эфир бензойной кислоты под номером 3.
Ответ: 1435.
Ответ: 1435
Раздел кодификатора ФИПИ: 3.6 Характерные химические свойства альдегидов, карбоновых кислот, сложных эфиров
Лабораторный опыт 7 Взаимодействие металлов с кислотами
- Лабораторный
опыт 7 - Взаимодействие
металлов с кислотами - Цель
работы: исследовать особенности взаимодействия
растворов кислот с металлами на основания их положения в электрохимическом ряду
напряжений металлов. - Оборудование
и реактивы:пробирки, штатив для пробирок, спиртовка,
спички, пробиркодержатель,гранулы цинка, железные опилки, медные стружки или
кусочки медной проволоки, растворы соляной и серной кислоты. - Краткие
теоретические сведения
Кислоты
– электролиты диссоциирующие в воде на ионы водорода и ионы кислотного остатка.
H2SO4
↔ 2H+
+ SO42-Кислоты
обладают разнообразными химическими свойствами и взаимодействуют с металлами,
основаниями, солями и оксидами металлов.
Для
взаимодействия кислот с металлом должны выполняться некоторые условия (в
отличие от реакций кислот с основаниями и основными оксидами, которые идут
практически всегда). Во-первых, металл должен быть достаточно активным
(реакционноспособным) по отношению к кислотам.
Например, золото, серебро, медь,
ртуть и некоторые другие металлы с выделением водорода с кислотами не
реагируют. Такие металлы как натрий, кальций, цинк – напротив – реагируют очень
активно с выделением газообразного водорода и большого количества тепла.
HCl
+ Hg
= не образуется
H2SO4
+ Zn
= ZnSO4
+ H2
По
реакционной способности в отношении кислот все металлы располагаются в ряд
активности металлов. Слева находятся наиболее активные металлы, справа –
неактивные. Чем левее находится металл в ряду активности, тем интенсивнее он
взаимодействует с кислотами.
Во-вторых,
кислота должна быть достаточно сильной, чтобы реагировать с металлом. Под силой
кислоты понимают ее способность отдавать ионы водорода H+.
Например, кислоты растений (яблочная, лимонная, щавелевая и т.д.
) являются
слабыми кислотами и очень медленно реагируют с такими металлами как цинк, хром,
железо, никель, олово, свинец (хотя с основаниями и оксидами металлов они
способны реагировать).
Следует
помнить, что в реакциях кислот с металлами есть одно важное исключение. При
взаимодействии металлов с азотной кислотой водород не выделяется.
Концентрированные кислоты с металлами ведут себя иначе, чем разбавленные:
- Cu
+ 4 HNO3(конц.)
=Cu(NO3)2
+ 2 NO2 + 2 H2O - 3
Cu + 8HNO3(разб.) = 3 Cu(NO3)2
+ 2 NO + 4 H2O - 8
K + 5 H2SO4(конц.)
=
4 K2SO4 + H2S + 4 H2O
3
Zn + 4 H2SO4(конц.)
=
3 ZnSO4
+ S
+ 4 H2O.
Есть
металлы, которые реагируют с разбавленными кислотами, но не реагирует с
концентрированными (т.е. безводными) кислотами – серной кислотой и азотной
кислотой.
Эти металлы – Al, Fe,
Cr,
Ni
и некоторые другие – при контакте с безводными кислотами сразу же покрываются
продуктами окисления (пассивируются). Это обстоятельство используют в
промышленности.
Например, концентрированную серную кислоту хранят и перевозят в
железных бочках.
Порядок
работы
Задание
1.Проведите
реакции, подтверждающие, особенности взаимодействия растворов кислот с
металлами на основании их положения в электрохимическом ряду напряжений
металлов.
1.В
две пробирки положите гранулы цинка и прилейте в одну пробирку около 1 мл
раствора серной кислоты, в другую — столько же соляной кислоты.
2.В
другие две пробирки положите немного железных опилок и прилейте те же кислоты.
3.В
следующие две пробирки положите немного медных стружек или кусочков проволоки и
прилейте те же кислоты.
Если
в какой – либо пробирке не происходит реакции, слегка подогрейте содержимое
пробирки в пламени спиртовки.
Наблюдайте,
в каких пробирках происходит выделение газа. Определите, какой это газ? Все ли
металлы вытесняют водород из кислот.
| № пробирки | Чтоделали? | Чтонаблюдали? | Уравнение реакции В молекулярном и ионном виде |
| 1 | положили гранулы цинка в пробирку и прилили 1 мл раствора серной кислоты | Идет реакция растворения металла, с выделением прозрачного газа без запаха. |
|
| 2 | положили гранулы цинка в пробирку и прилили1 мл раствора соляной кислоты | Идет реакция растворения металла, с выделением прозрачного газа без запаха. |
|
| 3 | положилижелезные опилки в пробирку и прилили 1 мл раствора серной кислоты | Идет реакция растворения металла, с выделением прозрачного газа без запаха. |
|
| 4 | положилижелезные опилки в пробирку и прилили1 мл раствора соляной кислоты | Идет реакция растворения металла, с выделением прозрачного газа без запаха. |
|
| 5 | положилимедные опилки в пробирку и прилили 1 мл раствора серной кислоты | Признаков реакции не наблюдается | H2SO4+ Cu = реакция не идет |
| 6 | положилимедные опилки в пробирку и прилили1 мл раствора соляной кислоты | Признаков реакции не наблюдается | HCl + Cu = реакция не идет |
| Вывод: на практических опытах исследовали особенности взаимодействия растворов кислот с металлами на основания их положения в электрохимическом ряду напряжений металлов. |
- Содержание отчета
- Укажите номер лабораторного опыта, тему, цель, оборудование,
выполните задания методических указаний,результаты
наблюдений занесите в таблицу, сделайте вывод. Для вывода воспользуйтесь схемой: - Отношение
металлов к воде и к некоторым кислотам
| K, Ca, Na, Mg, Al | Cu, Hg, Ag, Pt, Au |
| Реагируют с растворами соляной и серной кислот с выделением водорода | Не реагируют с растворами соляной и серной кислот |
Вопросы
для вывода
1.Какой
из металлов, взятый для опытов, не реагирует с растворами с кислот?(Cu
–медь)
Какие
еще металлы не реагируют с этими кислотами?(Hg,
Ag,
Pt,
Au)
2.К
какому типу реакций относится взаимодействие кислоты с металлом? (Реакции
замещения)
Контрольные вопросы
1.С
какими из перечисленных веществ взаимодействует соляная кислота: Mg,
Cu,
Ca,
Fe?(Ca,
Fe,Mg)
- 2.При
помощи, каких реакций можно осуществить следующие превращения: - Zn
→ ZnS
→ ZnO
→ ZnCl2
→ Zn(OН)2 - Zn
+ S→ZnS - 2ZnS
+ 3O2→
2ZnO
+ 2SO2 - ZnO
+ 2HCl→
ZnCl2+H2O - ZnCl2
+ 2NaOН→
Zn(OН)2↓
+ 2NaCl - 3.Подобрать
коэффициенты в уравнении реакции, указать окислитель, восстановитель, процесс
окисления и восстановления: - Cu
+ Cl2®CuCl2
(Cu-востановитель,
Cl-окислитель) - Zn
+ 2HCl®ZnCl2
+ H2(Zn
-востановитель, H+-окислитель)






