- Активные металлы
- Положение в таблице Менделеева
- Алюминий
- Положение активных металлов в таблице Менделеева
- Свойства
- Тест по теме
- Оценка доклада
- Металлы наибольшей, средней и наименьшей активности: список
- Весь список активных металлов по периодической системе
- Список неактивных металлов в химии
- Электрохимический ряд активности металлов | это… Что такое Электрохимический ряд активности металлов?
- История
- Теоретические основы
- Практическое использование ряда напряжений
- Таблица электрохимических потенциалов металлов
- Ссылки
- Литература
- Примечания
- Электрохимический ряд напряжений металлов (ЭРН)
- Взаимодействие металлов с кислотами
- Взаимодействие металлов с водой
- Взаимодействие металлов с водными растворами солей
- Процесс термического распада нитратов
Новости Библиотека Таблица эл-тов Биографии Карта сайтов Ссылки О сайте
- Наиболее общее из общих химических свойств металлов заключается в том, что их атомы, отдавая валентные электроны, обращаются в положительно заряженные ионы:
- Na — = Na+; Сu — 2 = Сu2+
- Изучим это свойство металлов на примере реакций замещения металлов друг другом в солях.
Опустим кусок меди (медную монету, медную проволоку) в раствор какой-либо соли железа, например его сульфата FeSO4. Никакой реакции не происходит: медь не вытесняет железа из его солей. Поступим наоборот: опустим кусок железа — железный нож или гвоздь — в раствор какой-либо соли меди, например ее сульфата CuSO4.
Тотчас железо покрывается розовым слоем меди, а голубая окраска раствора, свойственная гидратированным ионам меди, постепенно исчезает, сменяясь зеленоватой окраской гидратированных ионов железа. Железо вытесняет медь из растворов ее солей. Сульфат меди (II) — сильный электролит.
В растворе он полностью расщеплен на ионы меди и ионы кислотного остатка, Поэтому ионное уравнение реакции выразится так:
Реакция сводится к перемещению электронов от атомов железа к ионам меди. Железо вытесняет медь потому, что его атомы легче отдают электроны, чем атомы меди. Чем легче атомы металла отдают электроны, тем металл химически активнее. Железо химически активнее, чем медь.
В раствор того же сульфата меди (II) бросим капельку ртути. Реакции не происходит: ртуть не вытесняет меди из растворов ее солей. Вновь поступим наоборот: опустим кусок меди, например медную монету, в раствор какой-либо соли ртути, например Hg(NO3)2.
Медная монета тотчас становится похожей по виду на серебряную: на ее поверхности выделяется металлическая ртуть. А бесцветный вначале раствор приобретает знакомую нам голубую окраску гидратированных ионов меди.
Медь вытесняет ртуть из растворов ее солей:
или
Реакция сводится к перемещению электронов от атомов меди к ионам ртути. Медь, будучи менее химически активным металлом, чем железо, оказывается более активной, чем ртуть.
Таким образом, реакции замещения металла металлом в солях заключаются в перемещении электронов от атомов замещающего — более активного — металла к ионам замещаемого менее активного металла. Такие реакции необратимы: если металл А вытесняет металл Б из раствора его солей, то металл Б не будет вытеснять металл А из растворов его солей.
В порядке убывания химической активности, проявляемой в реакциях вытеснения металлов друг другом из растворов их солей, русский химик Н. Н. Бекетов расположил металлы в ряд, называемый сейчас электрохимическим рядом напряжений. Вот этот ряд:
- Na, Са, Mg, Al, Zn, Сr, Fe, Pb, (Н), Сu, Hg, Ag, Au, Pt
- Каждый левее стоящий металл в ряду может вытеснять все следующие за ним металлы из растворов их солей, а сам может вытесняться лишь предшествующими ему металлами.
- В электрохимический ряд напряжений металлов включен водород как единственный неметалл, разделяющий с металлами общее свойство — образовывать положительно заряженные ионы. Поэтому водород тоже может замещать некоторые металлы в их солях и сам может замещаться многими металлами в кислотах, например:
- Zn + 2HCl = ZnCl2 + H2↑
- или в виде ионного уравнения:
Все металлы, стоящие в электрохимическом ряду напряжений до водорода, вытесняют его из растворов кислот, а все следующие за ним, например медь, не вытесняют.
Рис. 50. Схема гальванического элемента
Реакцию замещения металла металлом можно провести и не приводя в соприкосновение второй металл с раствором соли первого металла.
Для этого можно погрузить оба металла, например цинк и свинец, в растворы их собственных солей, разделенные пористой перегородкой, и соединить металлы проволокой, как представлено на рисунке 50.
Будет происходить та же самая реакция, как и при погружении цинка непосредственно в раствор соли свинца:
Zn0 + Pb2+ = Zn2+ + Pb0↓
В правом отделении цинк будет растворяться, т. е. переходить в раствор в виде ионов Zn2+. Отщепляющиеся при этом от атомов цинка электроны будут перемещаться по проволоке в свинцовую пластинку.
Ионы свинца, содержащиеся в растворе, притягиваясь к ней, будут захватывать прибывающие из цинка электроны и превращаться в электронейтральные атомы: свинцовая пластинка будет покрываться новыми слоями металлического свинца.
(При этом анионы кислотного остатка через пористую перегородку переходят из левого отделения, в котором катионы убывают, в правое, где катионы накапливаются.) Так как свинцовая пластинка в реакции не участвует, свинец может быть заменен любым другим металлом, не реагирующим с солями свинца, или же углем.
Не участвует в реакции и соль цинка. Поэтому она тоже может быть заменена любым другим электролитом, не реагирующим с цинком. Такие устройства, как вам известно из курса физики, называются гальваническими элементами.
Гальванический элемент можно построить из любой пары металлов, погруженных в растворы их солей. Напряжение на полюсах такого элемента будет тем больше, чем дальше удалены друг от друга оба металла в рассматриваемом нами ряду: поэтому он и назван электрохимическим рядом напряжений.
Гальванические элементы создаются и на основе других видов окислительно-восстановительных реакций, например на основе реакции соединения водорода с кислородом:
- Даны металлы: алюминий, олово, медь, ртуть, серебро и растворы солей этих же металлов. Напишите в ионной форме уравнения осуществимых реакций между названными металлами и солями.
- В вашем распоряжении сосуд с пористой перегородкой, кусок цинка, кусок угля, медная проволока, соляная кислота и раствор хлорида цинка. Составьте по образцу рисунка схему гальванического элемента из этих материалов, напишите, в ионном виде уравнения реакций, происходящих в левом и правом отделении. В чем заключается разница между результатами проведения данной реакции в аппарате Киппа и в предложенном вами гальваническом элементе?
Активные металлы
Металлы, легко вступающие в реакции, называются активными металлами. К ним относятся щелочные, щелочноземельные металлы и алюминий.

Положение в таблице Менделеева
Металлические свойства элементов ослабевают слева направо в периодической таблице Менделеева. Поэтому наиболее активными считаются элементы I и II групп.
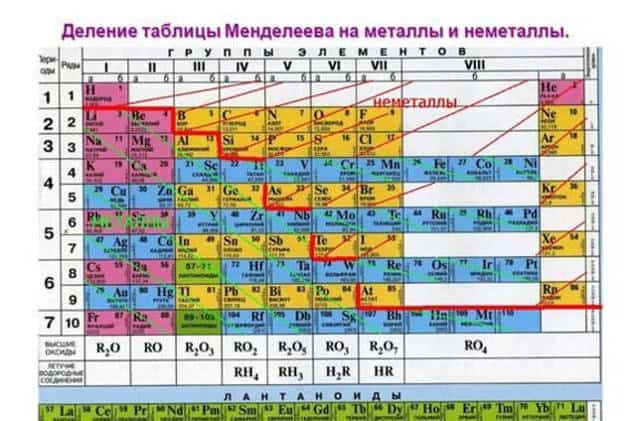
Рис. 1. Активные металлы в таблице Менделеева.
Все металлы являются восстановителями и легко расстаются с электронами на внешнем энергетическом уровне. У активных металлов всего один-два валентных электрона. При этом металлические свойства усиливаются сверху вниз с возрастанием количества энергетических уровней, т.к. чем дальше электрон находится от ядра атома, тем легче ему отделиться.
Наиболее активными считаются щелочные металлы:
- литий;
- натрий;
- калий;
- рубидий;
- цезий;
- франций.
К щелочноземельным металлам относятся:
- бериллий;
- магний;
- кальций;
- стронций;
- барий;
- радий.
Узнать степень активности металла можно по электрохимическому ряду напряжений металлов. Чем левее от водорода расположен элемент, тем более он активен. Металлы, стоящие справа от водорода, малоактивны и могут взаимодействовать только с концентрированными кислотами.

Рис. 2. Электрохимический ряд напряжений металлов.
К списку активных металлов в химии также относят алюминий, расположенный в III группе и стоящий левее водорода. Однако алюминий находится на границе активных и среднеактивных металлов и не реагирует с некоторыми веществами при обычных условиях.
Алюминий
Алюминий представляет собой серебристо-белого цвета. Основные физические свойства алюминия – легкость, высокая тепло- и электропроводность. В свободном состоянии при пребывании на воздухе алюминий покрывается прочной пленкой оксида Al2O3, которая делает его устойчивым к действию концентрированных кислот.
- Алюминий относится к металлам p-семейства. Электронная конфигурация внешнего энергетического уровня – 3s
- 2
- 3p
- 1
. В своих соединениях алюминий проявляет степень окисления равную «+3».
Алюминий получают электролизом расплава оксида этого элемента:
2Al2O3 = 4Al + 3O2↑
Однако из-за небольшого выхода продукта, чаще используют способ получения алюминия электролизом смеси Na3 и Al2O3. Реакция протекает при нагревании до 960С и в присутствии катализаторов – фторидов (AlF3, CaF2 и др.), при этом на выделение алюминия происходит на катоде, а на аноде выделяется кислород.
- Алюминий способен взаимодействовать с водой после удаления с его поверхности оксидной пленки (1), взаимодействовать с простыми веществами (кислородом, галогенами, азотом, серой, углеродом) (2-6), кислотами (7) и основаниями (8):
- 2Al + 6H2O = 2Al(OH)3 +3H2↑ (1)
- 2Al +3/2O2 = Al2O3 (2)
- 2Al + 3Cl2 = 2AlCl3 (3)
- 2Al + N2 = 2AlN (4)
- 2Al +3S = Al2S3 (5)
- 4Al + 3C = Al4C3 (6)
- 2Al + 3H2SO4 = Al2(SO4)3 + 3H2↑ (7)
- 2Al +2NaOH +3H2O = 2Na + 3H2↑ (8)
Положение активных металлов в таблице Менделеева
К активным металлам относятся три группы элементов:
- щелочные металлы;
- щелочноземельные металлы;
- алюминий.
Щелочные металлы находятся в первой группе таблицы Менделеева, то есть занимают в ней крайнее левое положение. В частности щелочными металлами являются:
- литий (Li);
- натрий (Na);
- калий (K);
- рубидий (Rb);
- цезий (Cs);
- франций (Fr).
Щелочноземельные металлы находятся во второй группе, то есть правее щелочных металлов. К ним относятся:
- бериллий (Be);
- магний (Mg);
- кальций (Ca);
- стронций (Sr);
- барий (Ba);
- радий (Ra).
В целом активные металлы отличаются тем, что имеют один или два валентных электрона, поэтому они легко отдают эти электроны в ходе химических реакций, выступая в качестве восстановителей.
Степень активности металла можно оценить по его расположению в электрохимическом ряде активности металлов. Чем левее там находится металл, тем сильнее выражены его восстановительные свойства. Крайнее левое положение в ряде занимает литий.
В вот крайне правое положение в ряду занимает золото, именно поэтому оно почти не окисляется кислотами.

Алюминий – это так называемый постпереходный металл, по своим свойствам он находится где-то между активными и среднеактивными металлами. Разные ученые придерживаются различного мнения о том, стоит ли считать алюминий активным металлом.
Активные металлы не встречаются в природе в чистом виде, так как они быстро вступают в химические реакции с другими элементами. Чаще всего в природе они присутствуют в виде оксидов. Например, даже если алюминий получен в чистом виде, то на воздухе он быстро покрывается оксидной пленкой.
Свойства
Активные металлы отличаются мягкостью (можно разрезать ножом), лёгкостью, невысокой температурой плавления.
Основные химические свойства металлов представлены в таблице.
| Реакция | Уравнение | Исключение |
| Щелочные металлы самовозгораются на воздухе, взаимодействуя с кислородом | K + O2 → KO2 | Литий реагирует с кислородом только при высокой температуре |
| Щелочноземельные металлы и алюминий на воздухе образуют оксидные плёнки, а при нагревании самовозгораются | 2Ca + O2 → 2CaO | |
| Реагируют с простыми веществами, образуя соли | – Ca + Br2 → CaBr2; – 2Al + 3S → Al2S3 | Алюминий не вступает в реакцию с водородом |
| Бурно реагируют с водой, образуя щёлочи и водород | – 2Na + 2H2O → 2NaOH + H2; – Ca + 2H2O → Ca(OH)2 + H2 | Реакция с литием протекает медленно. Алюминий реагирует с водой только после удаления оксидной плёнки |
| Реагируют с кислотами, образуя соли |
– Ca + 2HCl → CaCl2 + H2; – 2K + 2HMnO4 → 2KMnO4 + H2 |
|
| Взаимодействуют с растворами солей, сначала реагируя с водой, а затем с солью |
2Na + CuCl2 + 2H2O: – 2Na + 2H2O → 2NaOH + H2; – 2NaOH + CuCl2 → Cu(OH)2↓ + 2NaCl |
Активные металлы легко вступают в реакции, поэтому в природе находятся только в составе смесей – минералов, горных пород.

Рис. 3. Минералы и чистые металлы.
Тест по теме
Доска почёта
Чтобы попасть сюда — пройдите тест.
-
Александр Котков
5/5 -
Илья Ударцев
5/5 -
Инесса Медведева
4/5 -
Александр Котков
5/5 -
Лидия Маслова
5/5 -
Александр Котков
5/5 -
Сергей Ефремов
2/5 -
Дима Мухтаров
5/5 -
Сергей Макаров
5/5 -
Александр Просто
5/5
Оценка доклада
Средняя оценка: 4.4. Всего получено оценок: 705.
| Поделитесь в соц.сетях: |
Металлы наибольшей, средней и наименьшей активности: список
Существуют металлические элементы, легко вступающие в восстановительные реакции. Они могут быть активными, со средней активностью и неактивные. Рассмотрим полный список металлов разной активности в химии.

Весь список активных металлов по периодической системе
Список активных металлов в химии необходимо начинать рассматривать с его разделения на следующие 3 подгруппы элементов:
- Щелочные.
- Щелочноземельные.
- Алюминий.
Щелочные расположены в первой группе периодической системы химических элементов Д. И. Менделеева. То есть, располагаются в крайнем левом положении. Максимально активные щелочные металлические элементы представлены:
- литием;
- калием;
- рубидием;
- натрием;
- францием;
- цезием.
Щелочноземельные входят во 2-ю группу и соответственно располагаются правее, чем щелочные. Следовательно, по периодической системе список менее активных металлов заполнен:
- бериллием;
- магнием;
- кальцием;
- стронцием;
- барием;
- радием.
Это список металлов средней активности. В перечень активных металлических элементов входит Al, располагающийся в третьей группе (слева от водорода). Но, его место на рубеже активных элементов и со средней активностью, и в обычных условиях не вступит в реакцию с определёнными элементами.

Список неактивных металлов в химии
Список неактивных металлов включает:
- ртуть;
- медь;
- серебро;
- золото;
- платину.
В общем понимании отличие активных металлов заключается в том, что они обладают одно- или двухвалентными электронами, поэтому могут легко их отдавать во время химических реакций, выступая в роли восстановителя.

Степень активности металлического элемента оценивается по его расположению в электрохимическом ряду. Чем он левее размещен, тем более сильно выражены у него свойства восстановления. Крайне левое расположение в ряду у лития. Самое же правое занимает золото, поэтому оно входит в список малоактивных металлов и не подвергается окислению кислотами.
В природе в чистом виде активные металлические элементы не встречаются. Поскольку, они обладают способностью быстро вступать в химические реакции с другими веществами.
В большинстве случаев, в природе металлические элементы различной активности присутствуют в форме оксидов.
К примеру, при получении алюминия в чистом виде при взаимодействии с воздухом происходит его быстрое покрытие оксидной пленкой.

Подводя итоги, можно отметить, что активные металлические элементы – это 1-я и 2-я группа периодической системы Менделеева. Они состоят из щелочных, щелочноземельных веществ и Al. Высокая активность обуславливается особым строением атома, предполагающим легкое отделение небольшого количества электронов с энергоуровня.
Эти металлы отличаются лёгкостью, мягкостью и быстрым реагированием на различной сложности вещества. В результате образуются соли, оксиды и гидроксиды. Al располагается близко с водородом и для его реакции с другими представителями периодической системы требуется создание определенных условий.
Электрохимический ряд активности металлов | это… Что такое Электрохимический ряд активности металлов?
Электрохимический ряд активности (ряд напряжений, ряд стандартных электродных потенциалов) металлов — последовательность, в которой металлы расположены в порядке увеличения их стандартных электрохимических потенциалов φ0, отвечающих полуреакции восстановления катиона металла Men+: Men+ + nē → Me
Ряд напряжений характеризует сравнительную активность металлов в окислительно-восстановительные реакциях в водных растворах.
История
Последовательность расположения металлов в порядке изменения их химической активности в общих чертах была известна уже алхимикам[1]. Процессы взаимного вытеснения металлов из растворов и их поверхностное осаждение (например, вытеснение серебра и меди из растворов их солей железом) рассматривались как проявление трансмутации элементов.
Поздние алхимики вплотную подошли к пониманию химической стороны взаимного осаждения металлов из их растворов.
Так, Ангелус Сала в работе «Anatomia Vitrioli» (1613) пришёл к выводу, что продукты химических реакций состоят из тех же «компонентов», которые содержались в исходных веществах.
Впоследствии Роберт Бойль предложил гипотезу о причинах, по которым один металл вытесняет другой из раствора на основе корпускулярных представлений[2].
В 1793 году Алессандро Вольта, конструируя гальванический элемент («Вольтов столб»), установил относительную активность известных тогда металлов: Zn, Pb, Sn, Fe, Cu, Ag, Au. «Сила» гальванического элемента оказывалась тем больше, чем дальше стояли друг от друга металлы в этом ряду («ряд напряжений»). Однако Вольта не связал этот ряд с химическими свойствами металлов.
В 1798 году Иоганн Вильгельм Риттер указал, что ряд Вольта эквивалентен ряду окисления металлов (т. е. последовательности уменьшения их сродства с кислородом). Таким образом, Риттер высказал гипотезу о возникновении электрического тока вследствие протекания химической реакции[3].
В эпоху становления классической химии способность элементов вытеснять друг друга из соединений стала важным аспектом понимания реакционной способности. Й. Берцелиус на основе электрохимической теории сродства построил классификацию элементов, разделив их на «металлоиды» (сейчас применяется термин «неметаллы») и «металлы» и поставив между ними водород.
Последовательность металлов по их способности вытеснять друг друга, давно известная химикам, была в 1860-е и последующие годы особенно основательно и всесторонне изучена и дополнена Н. Н. Бекетовым. Уже в 1859 году он сделал в Париже сообщение на тему «Исследование над явлениями вытеснения одних элементов другими».
В эту работу Бекетов включил целый ряд обобщений о зависимости между взаимным вытеснением элементов и их атомным весом, связывая эти процессы с «первоначальными химическими свойствами элементов – тем, что называется химическим сродством»[4].
Открытие Бекетовом вытеснения металлов из растворов их солей водородом под давлением и изучение восстановительной активности алюминия, магния и цинка при высоких температурах (металлотермия) позволило ему выдвинуть гипотезу о связи способности одних элементов вытеснять из соединений с их плотностью: более лёгкие простые вещества способны вытеснять более тяжёлые («вытеснительный ряд Бекетова»).
Не отрицая значительных заслуг Бекетова в становлении современных представлений об ряде активности металлов, следует считать ошибочным бытующее в отечественной популярной и учебной литературе представление о нём как единственном создателе этого ряда.[5][6].
Многочисленные экспериментальные данные, полученные в конце XIX века, опровергали гипотезу Бекетова. Так, Уильям Одлинг описал множество случаев «обращения активности».
Например, медь вытесняет олово из концентрированного подкисленного раствора SnCl2 и свинец — из кислого раствора PbCl2; она же способна к растворению в концентрированной соляной кислоте с выделением водорода.
Медь, олово и свинец находятся в ряду правее кадмия, однако могут вытеснять его из кипящего слабо подкисленного раствора CdCl2.
Бурное развитие теоретической и экспериментальной физической химии указывало на иную причину различий химической активности металлов. С развитием современных представлений электрохимии (главным образом в работах Вальтера Нернста) стало ясно, что эта последовательность соответствует «ряду напряжений» – расположению металлов по значению стандартных электродных потенциалов.
Таким образом, вместо качественной характеристики — «склонности» металла и его иона к тем или иным реакциям — Нерст ввёл точную количественную величину, характеризующую способность каждого металла переходить в раствор в виде ионов, а также восстанавливаться из ионов до металла на электроде, а соответствующий ряд получил название ряда стандартных электродных потенциалов.
Теоретические основы
Значения электрохимических потенциалов являются функцией многих переменных и поэтому обнаруживают сложную зависимость от положения металлов в периодической системе. Так, окислительный потенциал катионов растёт с увеличением энергии атомизации металла, с увеличением суммарного потенциала ионизации его атомов и с уменьшением энергии гидратации его катионов.
В самом общем виде ясно, что металлы, находящиеся в начале периодов характеризуются низкими значениями электрохимических потенциалов и занимают места в левой части ряда напряжений. При этом чередование (щелочных и щёлочноземельных металлов отражает явление диагонального сходства.
Металлы, расположенные ближе к серединам периодов, характеризуются большими значениями потенциалов и занимают места в правой половине ряда.
Последовательное увеличение электрохимического потенциала (от −3,395 В у пары Eu2+/Eu[источник не указан 228 дней] до +1,691 В у пары Au+/Au) отражает уменьшение восстановительной активности металлов (свойство отдавать электроны) и усиление окислительной способности их катионов (свойство присоединять электроны). Таким образом, самым сильным восстановителем является металлический европий, а самым сильным окислителем — катионы золота Au+.
В ряд напряжений традиционно включается водород, поскольку практическое измерение электрохимических потенциалов металлов производится с использованием стандартного водородного электрода.
Практическое использование ряда напряжений
Ряд напряжений используется на практике для сравнительной оценки химической активности металлов в реакциях с водными растворами солей и кислот и для оценки катодных и анодных процессов при электролизе:
- Металлы, стоящие левее, являются более сильными восстановителями, чем металлы, расположенные правее: они вытесняют последние из растворов солей. Например, взаимодействие Zn + Cu2+ → Zn2+ + Cu возможно только в прямом направлении.
- Металлы, стоящие в ряду левее водорода, вытесняют водород при взаимодействии с водными растворами кислот-неокислителей; наиболее активные металлы (до алюминия включительно) — и при взаимодействии с водой.
- Металлы, стоящие в ряду правее водорода, с водными растворами кислот-неокислителей при обычных условиях не взаимодействуют.
- При электролизе металлы, стоящие правее водорода, выделяются на катоде; восстановление металлов умеренной активности сопровождается выделением водорода; наиболее активные металлы (до алюминия) невозможно при обычных условиях выделить из водных растворов солей.
Таблица электрохимических потенциалов металлов
| Li | Li+ | -3,0401 | реагирует с водой | выделяется водород |
| Cs | Cs+ | -3,026 | ||
| Rb | Rb+ | -2,98 | ||
| K | K+ | -2,931 | ||
| Ra | Ra2+ | -2,912 | ||
| Ba | Ba2+ | -2,905 | ||
| Fr | Fr+ | -2,92 | ||
| Sr | Sr2+ | -2,899 | ||
| Ca | Ca2+ | -2,868 | ||
| Eu | Eu2+ | -2,812 | ||
| Na | Na+ | -2,71 | ||
| Sm | Sm2+ | -2,68 | ||
| Md | Md2+ | -2,40 | реагирует с кислотами | |
| La | La3+ | -2,379 | ||
| Y | Y3+ | -2,372 | ||
| Mg | Mg2+ | -2,372 | ||
| Ce | Ce3+ | -2,336 | ||
| Pr | Pr3+ | -2,353 | ||
| Er | Er3+ | -2,331 | ||
| Ho | Ho3+ | -2,33 | ||
| Nd | Nd3+ | -2,323 | ||
| Tm | Tm3+ | -2,319 | ||
| Sm | Sm3+ | -2,304 | ||
| Pm | Pm3+ | -2,30 | ||
| Fm | Fm2+ | -2,30 | ||
| Dy | Dy3+ | -2,295 | ||
| Tb | Tb3+ | -2,28 | ||
| Lu | Lu3+ | -2,28 | ||
| Gd | Gd3+ | -2,279 | ||
| Es | Es2+ | -2,23 | ||
| Ac | Ac3+ | -2,20 | ||
| Dy | Dy2+ | -2,2 | ||
| Pm | Pm2+ | -2,2 | ||
| Cf | Cf2+ | -2,12 | ||
| Sc | Sc3+ | -2,077 | ||
| Am | Am3+ | -2,048 | ||
| Cm | Cm3+ | -2,04 | ||
| Pu | Pu3+ | -2,031 | ||
| Er | Er2+ | -2,0 | ||
| Pr | Pr2+ | -2,0 | ||
| Eu | Eu3+ | -1,991 | ||
| Lr | Lr3+ | -1,96 | ||
| Cf | Cf3+ | -1,94 | ||
| Es | Es3+ | -1,91 | ||
| Th | Th4+ | -1,899 | ||
| Fm | Fm3+ | -1,89 | ||
| Np | Np3+ | -1,856 | ||
| Be | Be2+ | -1,847 | ||
| U | U3+ | -1,798 | ||
| Al | Al3+ | -1,700 | ||
| Md | Md3+ | -1,65 | ||
| Ti | Ti2+ | -1,63 | конкурирующие реакции: и выделение водорода, и выделение металла в чистом виде | |
| Hf | Hf4+ | -1,55 | ||
| Zr | Zr4+ | -1,53 | ||
| Pa | Pa3+ | -1,34 | ||
| Ti | Ti3+ | -1,208 | ||
| Yb | Yb3+ | -1,205 | ||
| No | No3+ | -1,20 | ||
| Ti | Ti4+ | -1,19 | ||
| Mn | Mn2+ | -1,185 | ||
| V | V2+ | -1,175 | ||
| Nb | Nb3+ | -1,1 | ||
| Nb | Nb5+ | -0,96 | ||
| V | V3+ | -0,87 | ||
| Cr | Cr2+ | -0,852 | ||
| Zn | Zn2+ | -0,763 | ||
| Cr | Cr3+ | -0,74 | ||
| Ga | Ga3+ | -0,560 | ||
| Ga | Ga2+ | -0,45 | ||
| Fe | Fe2+ | -0,441 | ||
| Cd | Cd2+ | -0,404 | ||
| In | In3+ | -0,3382 | ||
| Tl | Tl+ | -0,338 | ||
| Co | Co2+ | -0,28 | ||
| In | In+ | -0,25 | ||
| Ni | Ni2+ | -0,234 | ||
| Mo | Mo3+ | -0,2 | ||
| Sn | Sn2+ | -0,141 | ||
| Pb | Pb2+ | -0,126 | ||
| H2 | H+ | |||
| W | W3+ | +0,11 | низкая реакционная способность | выделение металла в чистом виде |
| Ge | Ge4+ | +0,124 | ||
| Sb | Sb3+ | +0,240 | ||
| Ge | Ge2+ | +0,24 | ||
| Re | Re3+ | +0,300 | ||
| Bi | Bi3+ | +0,317 | ||
| Cu | Cu2+ | +0,338 | ||
| Po | Po2+ | +0,37 | ||
| Тс | Тс2+ | +0,400 | ||
| Ru | Ru2+ | +0,455 | ||
| Cu | Cu+ | +0,522 | ||
| Te | Te4+ | +0,568 | ||
| Rh | Rh+ | +0,600 | ||
| W | W6+ | +0,68 | ||
| Tl | Tl3+ | +0,718 | ||
| Rh | Rh3+ | +0,758 | ||
| Po | Po4+ | +0,76 | ||
| Hg | Hg22+ | +0,7973 | ||
| Ag | Ag+ | +0,799 | ||
| Pb | Pb4+ | +0,80 | ||
| Os | Os2+ | +0,850 | ||
| Hg | Hg2+ | +0,851 | ||
| Pt | Pt2+ | +0,963 | ||
| Pd | Pd2+ | +0,98 | ||
| Ir | Ir3+ | +1,156 | ||
| Au | Au3+ | +1,498 | ||
| Au | Au+ | +1,691 |
Ссылки
Литература
- Корольков Д.В. Основы неорганической химии. — М.:Просвещение, 1982. — 271 с.
Примечания
- ↑ Рабинович В. Л. Алхимия как феномен средневековой культуры. — М.: Наука, 1979
- ↑ Пути познания / Головнер В.Н. Взгляд на мир глазами химика
- ↑ Штрубе В. Пути развития химии: в 2-х томах. Том 2. От начала промышленной революции до первой четверти XX века
- ↑ Беляев А.И. Николай Николаевич Бекетов – выдающийся русский физико-химик и металлург. М., 1953
- ↑ Леенсон И. А. Ряд активности металлов Бекетова: миф или реальность? // Химия в школе. — 2002. — № 9. — С. 90-96.
- ↑ Мчедлов-Петросян Н. О.Труды Н. Н. Бекетова и ряд активности металлов // Вестник Харьковского национального университета. — 2003. — № 596. — Химия. Вып. 10 (33). — С. 221-225.
Электрохимический ряд напряжений металлов (ЭРН)
| Li | K | Ba | Ca | Na | Mg | Al | Mn | Zn | Cr | Fe | Ni | Sn | Pb | H | Cu | Hg | Ag | Pt | Au |
Ряд напряжений металлов широко используется в неорганической химии. В частности, результаты многих реакций и даже возможность их осуществления зависят от положения некоторого металла в ЭРН. Обсудим этот вопрос подробнее.
Взаимодействие металлов с кислотами
Металлы, находящиеся в ряду напряжений левее водорода, реагируют с кислотами — неокислителями. Металлы, расположенные в ЭРН правее Н, взаимодействуют только с кислотами — окислителями (в частности, с HNO3 и концентрированной H2SO4).
- Пример 1. Цинк расположен в ЭРН левее водорода, следовательно, способен реагировать практически со всеми кислотами:
- Zn + 2HCl = ZnCl2 + H2
- Zn + H2SO4 = ZnSO4 + H2
- Пример 2. Медь находится в ЭРН правее Н; данный металл не реагирует с «обычными» кислотами (HCl, H3PO4, HBr, органические кислоты), однако вступает во взаимодействие с кислотами-окислителями (азотная, концентрированная серная):
- Сu + 2HCl ≠
- Cu + 4HNO3(конц.) = Cu(NO3)2 + 2NO2 + 2H2O
- Cu + 2H2SO4(конц.) = CuSO4 + SO2 + 2H2O
Обращаю внимание на важный момент: при взаимодействии металлов с кислотами-окислителями выделяется не водород, а некоторые другие соединения. Подробнее об этом можно почитать здесь!
Взаимодействие металлов с водой
- Металлы, расположенные в ряду напряжений левее Mg, легко реагируют с водой уже при комнатной температуре с выделением водорода и образованием раствора щелочи.
- Пример 3.
Натрий, калий, кальций легко растворяются в воде с образованием раствора щелочи:
- 2Na + 2H2O = 2NaOH + H2
- 2K + 2H2O = 2KOH + H2
- Ca + 2H2O = Ca(OH)2 + H2
Металлы, расположенные в ряду напряжений от водорода до магния (включительно), в ряде случаев взаимодействуют с водой, но реакции требуют специфических условий. Например, алюминий и магний начинают взаимодействие с Н2О только после удаления оксидной пленки с поверхности металла. Железо не реагирует с водой при комнатной температуре, но взаимодействует с парами воды. Кобальт, никель, олово, свинец практически не взаимодействуют с H2O не только при комнатной температуре, но и при нагревании.
Металлы, расположенные в правой части ЭРН (серебро, золото, платина) не реагируют с водой ни при каких условиях.
Взаимодействие металлов с водными растворами солей
- Речь пойдет о реакциях следующего типа:
- металл (*) + соль металла (**) = металл (**) + соль металла (*)
- Хотелось бы подчеркнуть, что звездочки обозначают в данном случае не степень окисления, не валентность металла, а просто позволяют различить металл № 1 и металл № 2.
- Для осуществления подобной реакции необходимо одновременное выполнение трех условий:
- соли, участвующие в процессе, должны растворяться в воде (это легко проверить, пользуясь таблицей растворимости);
- металл (*) должен находиться в ряду напряжений левее металла (**);
- металл (*) не должен реагировать с водой (что тоже легко проверяется по ЭРН).
- Пример 4. Рассмотрим несколько реакций:
- Zn + CuSO4 = ZnSO4 + Cu
- Fe + CuS ≠
- Pb + FeSO4 ≠
- K + Ni(NO3)2 ≠
- Первая реакция легко осуществима, все перечисленные выше условия выполнены: сульфат меди растворим в воде, цинк находится в ЭРН левее меди, Zn не реагирует с водой.
Вторая реакция невозможна, т. к. не выполнено первое условие (сульфид меди (II) практически не растворяется в воде). Третья реакция неосуществима, поскольку свинец — менее активный металл, нежели железо (находится правее в ЭРН). Наконец, четвертый процесс НЕ приведет к осаждению никеля, поскольку калий реагирует с водой; образовавшийся гидроксид калия может вступить в реакцию с раствором соли, но это уже совершенно другой процесс.
Процесс термического распада нитратов
Напомню, что нитраты — это соли азотной кислоты. Все нитраты разлагаются при нагревании, но вот состав продуктов разложения может быть разным. Состав определяется положением металла в ряду напряжений.
- Нитраты металлов, расположенных в ЭРН левее магния, при нагревании образуют соответствующий нитрит и кислород:
- 2KNO3 = 2KNO2 + O2
- В ходе термического разложения нитратов металлов, расположенных в ряду напряжений от Mg до Cu включительно, образуются оксид металла, NO2 и кислород:
- 2Cu(NO3)2 = 2CuO + 4NO2 + O2
- Наконец, при разложении нитратов наименее активных металлов (расположенных в ЭРН правее меди) образуются металл, диоксид азота и кислород:
- Hg(NO3)2 = Hg + 2NO2 + O2






