- Общая характеристика металлов
- Общие физические свойства металлов
- Общие химические свойства металлов
- I. Реакции металлов с неметаллами
- II. Реакции металлов с кислотами
- III. Взаимодействие металлов с водой
- IV. Вытеснение более активными металлами менее активных металлов из растворов их солей:
- Коррозия металлов
- Общие способы получения металлов в промышленности:
- Общая характеристика металлов IА–IIIА групп
Классификация свойств металлов и сплавов
Свойства металлов и сплавов делятся на 4 основные группы:
- физические,
- химические,
- механические,
- технологические.
Физические свойства металлов и сплавов.
К физическим свойствам металлов и сплавов относятся цвет, плотность (удельный вес), плавкость, тепловое расширение, теплопроводность, теплоемкость, электропроводность и способность их намагничиваться.
Эти свойства называют физическими потому, что обнаруживаются в явлениях, которые не сопровождаются изменением химического состава вещества, т. е. металлы и сплавы остаются неизмененными по составу при нагревании, прохождении через них тока, тепла, а также при их намагничивании и плавлении.
Многие из указанных физических свойств имеют установленные единицы измерения, по которым судят о свойствах металла.
Цвет.
Металлы и сплавы не прозрачны. Даже тонкие слои металлов и сплавов не способны пропускать лучи, но они имеют в отраженном свете внешний блеск, причем каждый из металлов и сплавов имеет свой особый оттенок блеска или, как говорят, цвет. Например, медь имеет розово-красный цвет, цинк — серый, олово — блестяще-белый и т. д.
Удельный вес—это вес 1 см3 металла, сплава или любого другого вещества в граммах. Например, удельный вес чистого железа равен 7,88 г/см3.
Плавление — способность металлов и сплавов переходить из твердого состояния в жидкое, характеризуется температурой плавления. Металлы, имеющие высокую температуру плавления, называют тугоплавкими (вольфрам, платина, хром и т.д.). Металлы, имеющие низкую температуру плавления, называют легкоплавкими (олово, свинец и т.д.).
Тепловое расширение — свойство металлов и сплавов увеличиваться в объеме при нагревании, характеризуется коэффициентами линейного и объемного расширения.
Коэффициент линейного расширения — отношение приращения длины образца металла при нагревании на 1° к первоначальной длине образца.
Коэффициент объемного расширения — отношение приращения объема металла при нагревании на 1° к первоначальному объему. Объемный коэффициент принимают равным утроенному коэффициенту линейного расширения.
Различные металлы имеют различные коэффициенты линейного расширения. Например, коэффициент линейного расширения стали равен 0,000012, меди — 0,000017, алюминия— 0,000023. Зная коэффициент линейного расширения металла, можно определить его величину удлинения:
- определим, насколько удлинится стальной трубопровод длиной 5000 м при его нагреве до 20°С:
5000·0,000012·20 = 1,2 м
- определим, насколько удлинится медный трубопровод длиной 5000 м при его нагреве до 20°С:
5000·0,000017·20= 1,7 м
- определим, насколько удлинится алюминиевый трубопровод длиной 5000 м при его нагреве до 20°С:
5000·0,000023·20=2,3 м
(Во всех трех случаях расчета не принимался во внимание коэффициент трения от собственного веса.) На основании приведенных выше расчетов цветные металлы при нагревании расширяются в большей степени, чем сталь, что необходимо учитывать в процессе сварки.
Теплопроводность —способность металлов и сплавов проводить тепло. Чем больше теплопроводность, тем быстрее тепло распространяется по металлу или сплаву при нагревании.
При охлаждении металлы и сплавы, обладающие большой теплопроводностью, быстрее отдают тепло. Теплопроводность красной меди в 6 раз выше теплопроводности железа.
При сварке металлов и сплавов, имеющих большую теплопроводность, требуется предварительный, а иногда и сопутствующий подогрев.
Теплоемкость — количество тепла, потребное для нагревания единицы веса на 1°.
Удельная теплоемкость — количество тепла в ккал (килокалориях), необходимое для нагрева 1 кг вещества на 1°. Низкую удельную теплоемкость имеют платина и свинец.
Удельная теплоемкость стали и чугуна примерно в 4 раза выше удельной теплоемкости свинца.
Электропроводность — способность металлов и сплавов проводить электрический ток. Хорошей электропроводностью обладают медь, алюминий и их сплавы.
- Магнитные свойства — способность металлов намагничиваться, которые проявляются в том, что намагниченный металл притягивает к себе металлы, обладающие магнитными свойствами.
- Химические свойства металлов и сплавов.
- Под химическими свойствами металлов и сплавов понимают их способность вступать в соединения с различными веществами и в первую очередь с кислородом. К химическим свойствам металлов и сплавов относят:
- стойкость против коррозии на воздухе,
- кислотостойкость,
- щелочестойкость,
- жаростойкость.
Стойкостью металлов и сплавов на воздухе называют способность последних противостоять разрушающему действию кислорода, находящемуся в воздухе.
Кислотостойкостью называют способность металлов и сплавов противостоять разрушающему действию кислот. Например, соляная кислота разрушает алюминий и цинк, а свинец не разрушает; серная кислота разрушает цинк и железо, но почти не действует на свинец, алюминий и медь.
Щелочестойкостью металлов и сплавов называют способность противостоять разрушающему действию щелочей. Щелочи особенно сильно разрушают алюминий, олово и свинец.
Жаростойкостью называют способность металлов и сплавов противостоять разрушению кислородом при нагреве. Для повышения жаростойкости вводят специальные примеси в металл, как, например, хром, ванадий, вольфрам и т. д.
Старение металлов — изменение свойств металлов во времени вследствие внутренних процессов, обычно протекающее замедленно при комнатной температуре и более интенсивно при повышенной температуре.
Старение стали обусловлено выделением по границам зерен карбидов и нитридов, что приводит к повышению прочности и снижению пластичности стали.
К элементам, уменьшающим склонность к старению стали, относятся алюминий и кремний, а способствующим старению — азот и углерод.
Механические свойства металлов и сплавов.
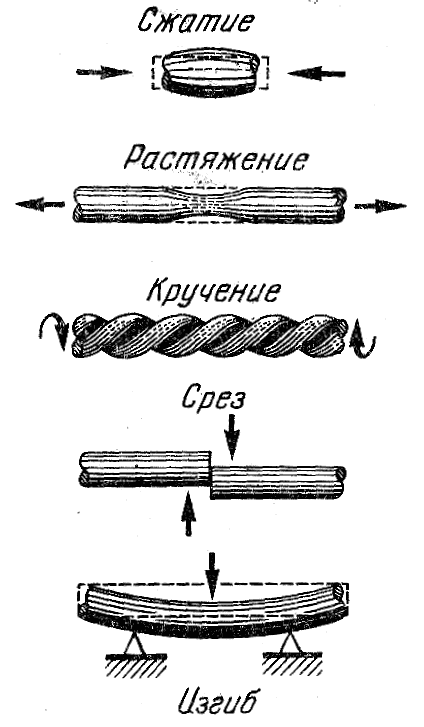
Рис. 1
К основным механическим свойствам металлов и сплавов относятся
- прочность,
- твердость,
- упругость,
- пластичность,
- ударная вязкость,
- ползучесть,
- усталость.
Прочностью называют сопротивление металла или сплава деформации и разрушению под действием механических нагрузок. Нагрузки могут быть сжимающими, растягивающими, скручивающими, срезающими и изгибающими (рис. 1).
Твердостью называют способность металла или сплава оказывать сопротивление прониканию в него другого более твердого тела.
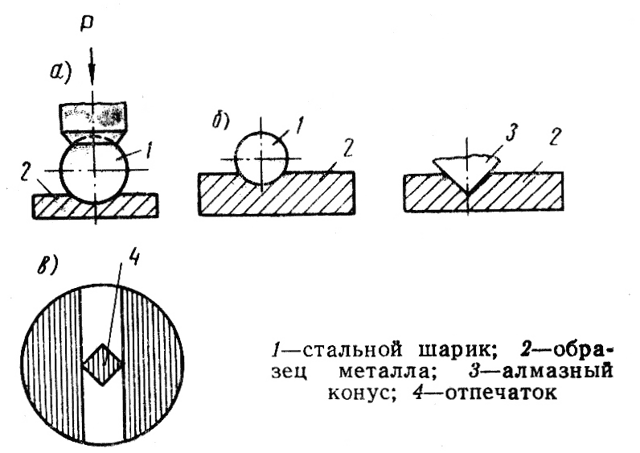
Рис. 2
В технике наибольшее применение получили следующие способы испытания твердости металлов и сплавов:
- вдавливание в материал стального шарика диаметром 2,5; 5 и 10 мм — испытание твердости по Бринелю (рис. 2,а);
- вдавливание в материал стального шарика диаметром 1,588 мм или алмазного конуса — испытание твердости по Роквеллу (рис. 2,б)
- вдавливание в материал правильной четырехгранной алмазной пирамиды — испытание по Виккерсу (рис. 2,в).
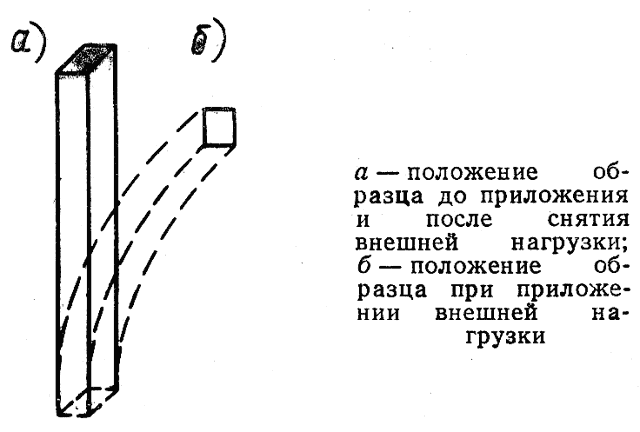
Рис. 3
Упругостью называют способность металла или сплава изменять свою первоначальную форму под действием внешней нагрузки и восстанавливать ее после прекращения действия нагрузки (рис. 3).
Пластичностью называют способность металла или сплава, не разрушаясь, изменять форму под действием нагрузки и сохранять эту форму после ее снятия. Пластичность характеризуется относительным удлинением и относительным сужением.
- где Δl = l1-l0 — абсолютное удлинение образца при разрыве;
- δ— относительное удлинение;
- l1—длина образца в момент разрыва;
- l0—первоначальная длина образца;
- где Ψ—относительное сужение при разрыве;
- F0 — первоначальная площадь поперечного сечения образца;
- F — площадь образца после разрыва
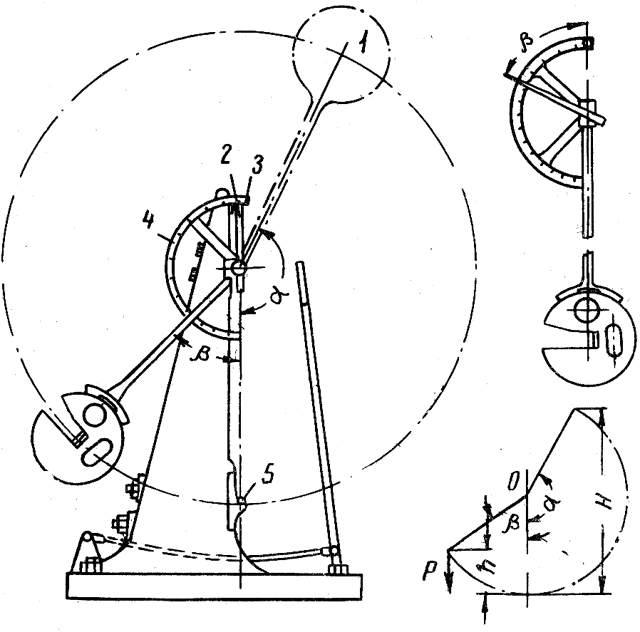
Рис 4
Ударной вязкостью называют способность металла или сплава сопротивляться действию ударных нагрузок. Испытания производятся на маятниковом костре (рис. 4). Перед испытанием маятник 1 отводят на угол подъема α, в этом положении закрепляют защелкой.
Стрелку 2, укрепленную на оси качания маятника, отводят до упора 3, расположенного у нулевого деления шкалы 4.
Маятник, освобожденный от защелки, падает, разрушает образец 5 и, (продолжая двигаться то инерции, поднимается на другую сторону станины, на некоторый угол β.
При обратном движении маятника стрелка 2 отклоняется от нулевого деления и при вертикальном положении маятника указывает величину β— наибольшего угла подъема маятника после разрушения образца. Разность углов α—β характеризует работу излома образца.
- Для определения ударной вязкости вначале вычисляют работу А, которая затрачена грузом маятника на разрушение образца
- А = Р (Н — h) кгс • м
- где Н — высота подъема маятника до удара в м
- h —высота подъема маятника после удара в м
- Р — ударная сила.
- Затем определяют ударную вязкость
- где ан—ударная вязкость в кГс·м/см2
- F — площадь поперечного сечения образца в см2.
- Ползучестью называют свойство металла или сплава медленно и непрерывно пластически деформироваться под действием постоянной нагрузки (особенно при повышенных температурах).
- Усталостью называют постепенное разрушение металла или сплава при большом числе повторно-переменных нагрузок, а свойство выдерживать эти нагрузки называют выносливостью.
Испытания образцов металлов и сплавов на растяжение осуществляют при пониженных, нормальных и повышенных температурах.
Испытания при пониженных температурах производят в соответствии с ГОСТ 11150—65 —100°С и при температуре кипения технического жидкого азота.
Испытания при нормальных температурах осуществляют по Г ОСТ 1497—61 при температуре 20±10°С.
Испытания при повышенных температурах производят по ГОСТ 9651—61 при температуре до 1200°С.
При испытании образцов на растяжение определяют предел прочности — σв, предел текучести (физический)—σт, предел текучести условный (технический) —σо,2, истинное сопротивление разрыву—Sк и относительное удлинение — δ.
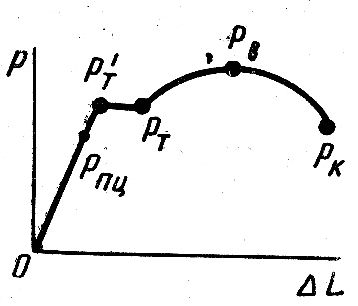
Рис. 5
Для усвоения указанных выше величин рассмотрим диаграмму, представленную на рис. 5. По вертикальной оси 0—Р отсчитываем приложенную нагрузку Р в килограммах (чем выше точка по оси, тем больше нагрузка), а по горизонтальной оси абсолютное удлинение— Δl.
Рассмотрим участки диаграммы:
- начальный прямолинейный участок 0-Рпц, на котором сохраняется пропорциональность между удлинением материала и нагрузкой (Рпц—нагрузка при пределе пропорциональности)
- точка резкого перегиба кривой Р’т называется нагрузкой при верхнем пределе текучести
- участок Р’т — Рт, параллельный горизонтальной оси 0—Δl (площадка текучести), в пределах которого удлинение образца происходит при постоянной нагрузке Рт, носящей название нагрузки при пределе текучести
- точка Рв, отмечающая наибольшую растягивающую силу — нагрузку при пределе прочности
- точка Рк —сила в момент разрушения образца.
- Предел прочности при растяжении (временное сопротивление) σв— напряжение, отвечающее наибольшей нагрузке, предшествовавшей разрушению образца:
- где F0 — площадь поперечного сечения образца перед испытанием в мм2
- Pв— наибольшая растягивающая сила в кгс.
- Предел текучести (физический) σт—наименьшее напряжение, при котором происходит деформация испытуемого образца без увеличения нагрузки (нагрузка не увеличивается, а образец удлиняется),
- Предел текучести условный (технический) σо,2 — напряжение, при котором остаточная деформация образца достигает 0,2%:
- Предел пропорциональности σпц— условное напряжение, при котором отступление от линейной зависимости между напряжениями и деформациями достигает определенной степени, устанавливаемой техническими условиями:
- Истинное сопротивление разрыву Sк—напряжение в шейке растягиваемого образца, определяемое как отношение растягивающей силы, действующей на образец непосредственно перед его разрывом, к площади поперечного сечения образна в шейке (F):
- Технологические свойства металлов и сплавов.
- К технологическим свойствам металлов и сплавов относятся:
- обрабатываемость резанием,
- ковкость,
- жидкотекучесть,
- усадка,
- свариваемость,
- прокаливаемость и т.д.
Обрабатываемостью резанием называют способность металлов и сплавов поддаваться механической обработке режущим инструментом.
Ковкостью называют способность металлов и сплавов принимать необходимую форму под действием внешних сил как в холодном, так и в горячем состоянии.
Жидкотекучестью называют способность металлов и сплавов заполнять литейные формы. Высокой жидкотекучестью обладает фосфористый чугун.
Усадкой называют способность металлов и сплавов при остывании уменьшать свой объем при затвердевании из жидкого состояния, охлаждении, спекании спрессованных порошков или сушке.
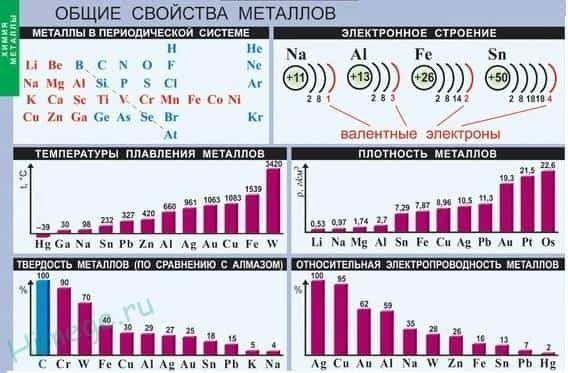
Общая характеристика металлов
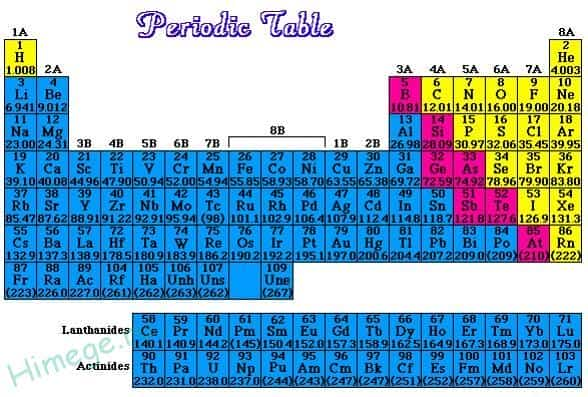 Если в периодической таблице элементов Д.И.Менделеева провести диагональ от бериллия к астату, то слева внизу по диагонали будут находиться элементы-металлы (к ним же относятся элементы побочных подгрупп, выделены синим цветом), а справа вверху – элементы-неметаллы (выделены желтым цветом). Элементы, расположенные вблизи диагонали – полуметаллы или металлоиды (B, Si, Ge, Sb и др.), обладают двойственным характером (выделены розовым цветом).
Если в периодической таблице элементов Д.И.Менделеева провести диагональ от бериллия к астату, то слева внизу по диагонали будут находиться элементы-металлы (к ним же относятся элементы побочных подгрупп, выделены синим цветом), а справа вверху – элементы-неметаллы (выделены желтым цветом). Элементы, расположенные вблизи диагонали – полуметаллы или металлоиды (B, Si, Ge, Sb и др.), обладают двойственным характером (выделены розовым цветом).
Как видно из рисунка, подавляющее большинство элементов являются металлами.
По своей химической природе металлы – это химические элементы, атомы которых отдают электроны с внешнего или предвнешнего энергетического уровней, образуя при этом положительно заряженные ионы.
Практически все металлы имеют сравнительно большие радиусы и малое число электронов (от 1 до 3) на внешнем энергетическом уровне. Для металлов характерны низкие значения электроотрицательности и восстановительные свойства.
Наиболее типичные металлы расположены в начале периодов (начиная со второго), далее слева направо металлические свойства ослабевают. В группе сверху вниз металлические свойства усиливаются, т.
к увеличивается радиус атомов (за счет увеличения числа энергетических уровней).
Это приводит к уменьшению электроотрицательности (способности притягивать электроны) элементов и усилению восстановительных свойств (способность отдавать электроны другим атомам в химических реакциях).
Типичными металлами являются s-элементы (элементы ИА-группы от Li до Fr. элементы ПА-группы от Мг до Ра). Общая электронная формула их атомов ns 1-2 . Для них характерны степени окисления + I и +II соответственно.
Небольшое число электронов (1-2) на внешнем энергетическом уровне атомов типичных металлов предполагает легкую потерю этих электронов и проявление сильных восстановительных свойств, что отражают низкие значения электроотрицательности. Отсюда вытекает ограниченность химических свойств и способов получения типичных металлов.
Характерной особенностью типичных металлов является стремление их атомов образовывать катионы и ионные химические связи с атомами неметаллов.
Соединения типичных металлов с неметаллами — это ионные кристаллы «катион металлаанион неметалла», например К + Вг — , Сa 2+ О 2-.
Катионы типичных металлов входят также в состав соединений со сложными анионами — гидроксидов и солей, например Мg 2+ (OН — ) 2 , (Li + )2СO 3 2-.
Металлы А-групп, образующие диагональ амфотерности в Периодической системе Ве-Аи-Ге-Сб-Ро, а также примыкающие к ним металлы (Га, In, Ти, Sn, Рб, Ви) не проявляют типично металлических свойств.
Общая электронная формула их атомов ns 2 np 0-4 предполагает большее разнообразие степеней окисления, большую способность удерживать собственные электроны, постепенное понижение их восстановительной способности и появление окислительной способности, особенно в высоких степенях окисления (характерные примеры — соединения Тl III , Рb IV , Вi v ). Подобное химическое поведение характерно и для большинства (d-элементов, т. е. элементов Б-групп Периодической системы (типичные примеры — амфотерные элементы Сr и Zn).
Это проявление двойственности (амфотерности) свойств, одновременно металлических (основных) и неметаллических, обусловлено характером химической связи. В твердом состоянии соединения нетипичных металлов с неметаллами содержат преимущественно ковалентные связи (но менее прочные, чем связи между неметаллами).
В растворе эти связи легко разрываются, а соединения диссоциируют на ионы (полностью или частично).
Например, металл галлий состоит из молекул Ga 2 , в твердом состоянии хлориды алюминия и ртути (II) АиСи 3 и НgСl 2 содержат сильно ковалентные связи, но в растворе АиСи 3 диссоциирует почти полностью, а НгСи 2 — в очень малой степени (да и то на ионы НгСи + и Сl — ).
Общие физические свойства металлов
Благодаря наличию свободных электронов («электронного газа») в кристаллической решетке все металлы проявляют следующие характерные общие свойства:
1) Пластичность — способность легко менять форму, вытягиваться в проволоку, прокатываться в тонкие листы.
2) Металлический блеск и непрозрачность. Это связано со взаимодействием свободных электронов с падающими на металл светом.
3) Электропроводность . Объясняется направленным движением свободных электронов от отрицательного полюса к положительному под влиянием небольшой разности потенциалов. При нагревании электропроводность уменьшается, т.к. с повышением температуры усиливаются колебания атомов и ионов в узлах кристаллической решетки, что затрудняет направленное движение «электронного газа».
4) Теплопроводность. Обусловлена высокой подвижностью свободных электронов, благодаря чему происходит быстрое выравнивание температуры по массе металла. Наибольшая теплопроводность — у висмута и ртути.
5) Твердость. Самый твердый – хром (режет стекло); самые мягкие – щелочные металлы – калий, натрий, рубидий и цезий – режутся ножом.
6) Плотность. Она тем меньше, чем меньше атомная масса металла и больше радиус атома. Самый легкий — литий (ρ=0,53 г/см3); самый тяжелый – осмий (ρ=22,6 г/см3). Металлы, имеющие плотность менее 5 г/см3 считаются «легкими металлами».
7) Температуры плавления и кипения. Самый легкоплавкий металл – ртуть (т.пл. = -39°C), самый тугоплавкий металл – вольфрам (t°пл. = 3390°C). Металлы с t°пл. выше 1000°C считаются тугоплавкими, ниже – низкоплавкими.
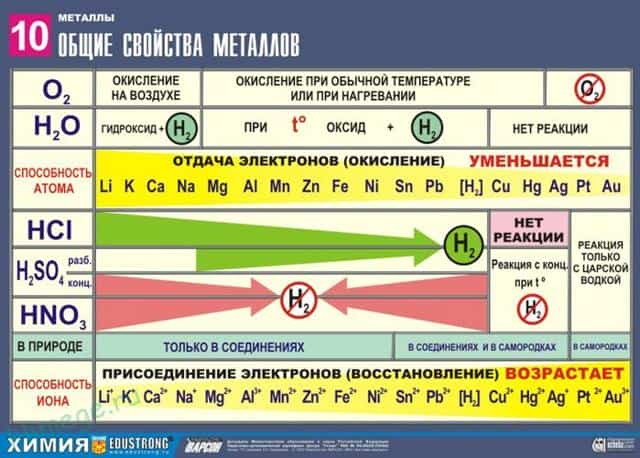
Общие химические свойства металлов
Сильные восстановители: Me 0 – nē → Me n +
Ряд напряжений характеризует сравнительную активность металлов в окислительно-восстановительных реакциях в водных растворах.

I. Реакции металлов с неметаллами
- 1) С кислородом: 2Mg + O 2 → 2MgO
- 2) С серой: Hg + S → HgS
- 3) С галогенами: Ni + Cl 2 – t° → NiCl 2
- 4) С азотом: 3Ca + N 2 – t° → Ca 3 N 2
- 5) С фосфором: 3Ca + 2P – t° → Ca 3 P 2
- 6) С водородом (реагируют только щелочные и щелочноземельные металлы): 2Li + H 2 → 2LiH
- Ca + H 2 → CaH 2
II. Реакции металлов с кислотами
- 1) Металлы, стоящие в электрохимическом ряду напряжений до H восстанавливают кислоты-неокислители до водорода:
- Mg + 2HCl → MgCl 2 + H 2
- 2Al+ 6HCl → 2AlCl 3 + 3H 2
- 6Na + 2H 3 PO 4 → 2Na 3 PO 4 + 3H 2
- 2) С кислотами-окислителями:
- При взаимодействии азотной кислоты любой концентрации и концентрированной серной с металлами водород никогда не выделяется!
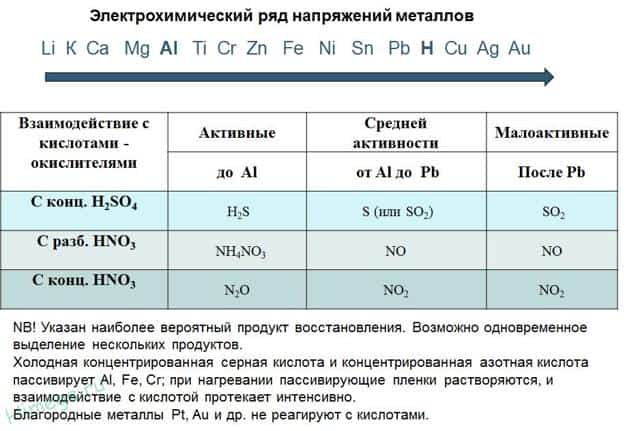
- Zn + 2H 2 SO 4(К) → ZnSO 4 + SO 2 + 2H 2 O
- 4Zn + 5H 2 SO 4(К) → 4ZnSO 4 + H 2 S + 4H 2 O
- 3Zn + 4H 2 SO 4(К) → 3ZnSO 4 + S + 4H 2 O
- 2H 2 SO 4(к) + Сu → Сu SO 4 + SO 2 + 2H 2 O
- 10HNO 3 + 4Mg → 4Mg(NO 3 ) 2 + NH 4 NO 3 + 3H 2 O
- 4HNO 3 (к ) + Сu → Сu (NO 3 ) 2 + 2NO 2 + 2H 2 O
III. Взаимодействие металлов с водой
- 1) Активные (щелочные и щелочноземельные металлы) образуют растворимое основание (щелочь) и водород:
- 2Na + 2H 2 O → 2NaOH + H 2
- Ca+ 2H 2 O → Ca(OH) 2 + H 2
- 2) Металлы средней активности окисляются водой при нагревании до оксида:
- Zn + H 2 O – t° → ZnO + H 2
- 3) Неактивные (Au, Ag, Pt) — не реагируют.
IV. Вытеснение более активными металлами менее активных металлов из растворов их солей:
- Cu + HgCl 2 → Hg+ CuCl 2
- Fe+ CuSO 4 → Cu+ FeSO 4
-
В промышленности часто используют не чистые металлы, а их смеси — сплавы , в которых полезные свойства одного металла дополняются полезными свойствами другого. Так, медь обладает невысокой твердостью и малопригодна для изготовления деталей машин, сплавы же меди с цинком ( латунь ) являются уже достаточно твердыми и широко используются в машиностроении. Алюминий обладает высокой пластичностью и достаточной легкостью (малой плотностью), но слишком мягок. На его основе готовят сплав с магнием, медью и марганцем — дуралюмин (дюраль), который, не теряя полезных свойств алюминия, приобретает высокую твердость и становится пригодным в авиастроении. Сплавы железа с углеродом (и добавками других металлов) — это широко известные чугун и сталь.
Металлы в свободном виде являются восстановителями. Однако реакционная способность некоторых металлов невелика из-за того, что они покрыты поверхностной оксидной пленкой , в разной степени устойчивой к действию таких химических реактивов, как вода, растворы кислот и щелочей.
Например, свинец всегда покрыт оксидной пленкой, для его перехода в раствор требуется не только воздействие реактива (например, разбавленной азотной кислоты), но и нагревание.
Оксидная пленка на алюминии препятствует его реакции с водой, но под действием кислот и щелочей разрушается.
Рыхлая оксидная пленка (ржавчина ), образующаяся на поверхности железа во влажном воздухе, не мешает дальнейшему окислению железа.
Под действием концентрированных кислот на металлах образуется устойчивая оксидная пленка. Это явление называется пассивацией .
Так, в концентрированной серной кислоте пассивируются (и после этого не реагируют с кислотой) такие металлы, как Ве, Ви, Со, Фе, Мг и Nb, а в концентрированной азотной кислоте — металлы А1, Ве, Ви, Со, Сг, Фе, Nb, Ni, РЬ, Тх и U.
При взаимодействии с окислителями в кислых растворах большинство металлов переходит в катионы, заряд которых определяется устойчивой степенью окисления данного элемента в соединениях (На + , Са 2+ ,А1 3+ ,Fе 2+ и Fе 3+ )
Восстановительная активность металлов в кислом растворе передается рядом напряжений. Большинство металлов переводится в раствор соляной и разбавленной серной кислотами, но Сu, Аg и Нg — только серной (концентрированной) и азотной кислотами, а Рt и Аи — «царской водкой».
Коррозия металлов
Нежелательным химическим свойством металлов является их коррозия , т. е. активное разрушение (окисление) при контакте с водой и под воздействием растворенного в ней кислорода (кислородная коррозия). Например, широко известна коррозия железных изделий в воде, в результате чего образуется ржавчина, и изделия рассыпаются в порошок.
Коррозия металлов протекает в воде также из-за присутствия растворенных газов СО 2 и SО 2 ; создается кислотная среда, и катионы Н + вытесняются активными металлами в виде водорода Н 2 ( водородная коррозия ).
Особенно коррозионно-опасным может быть место контакта двух разнородных металлов ( контактная коррозия).
Между одним металлом, например Фе, и другим металлом, например Sn или Су, помещенными в воду, возникает гальваническая пара.
Поток электронов идет от более активного металла, стоящего левее в ряду напряжений (Ре), к менее активному металлу (Sn, Су), и более активный металл разрушается (корродирует).
Именно из-за этого ржавеет луженая поверхность консервных банок (железо, покрытое оловом) при хранении во влажной атмосфере и небрежном обращении с ними (железо быстро разрушается после появления хотя бы небольшой царапины, допускающей контакт железа с влагой). Напротив, оцинкованная поверхность железного ведра долго не ржавеет, поскольку даже при наличии царапин корродирует не железо, а цинк (более активный металл, чем железо).
Сопротивление коррозии для данного металла усиливается при его покрытии более активным металлом или при их сплавлении ; так, покрытие железа хромом или изготовление сплава железа с хромом устраняет коррозию железа. Хромированное железо и сталь, содержащая хром ( нержавеющая сталь ), имеют высокую коррозионную стойкость.
Общие способы получения металлов в промышленности:
• электрометаллургия , т. е. получение металлов электролизом расплавов (для наиболее активных металлов) или растворов солей;
• пирометаллургия , т. е. восстановление металлов из руд при высокой температуре (например, получение железа в доменном процессе);
• гидрометаллургия , т. е. выделение металлов из растворов их солей более активными металлами (например, получение меди из раствора СuSO 4 действием цинка, железа или алюминия).
В природе иногда встречаются самородные металлы (характерные примеры — Аg, Аu, Рt, Нg), но чаще металлы находятся в виде соединений ( металлические руды ). По распространенности в земной коре металлы различны: от наиболее распространенных — Аи, На, Са, Фе, Мг, К, Ти) до самых редких — Ви, In, Аг, Ау, Рт, Ре.
Общая характеристика металлов IА–IIIА групп
Кодификатор ЕГЭ. Раздел 1.2.2. Общая характеристика металлов IА–IIIА групп в связи с их положением в Периодической системе химических элементов Д.И. Менделеева и особенностями строения их атомов.
Атомы элементов IА–IIIА групп имеют сходство в строении электронных оболочек и закономерностях изменения свойств, что приводит к некоторому сходству их химических свойств и свойств их соединений.
Металлы IA (первой группы главной подгруппы) также называются «щелочные металлы«. К ним относятся литий, натрий, калий, рубидий, цезий. Франций – радиоактивный элемент, в природе практически не встречается. У всех металлов IA группы на внешнем энергетическом уровне, на s-подуровне в основном состоянии есть один неспаренный электрон:
… ns1 — электронное строение внешнего энергетического уровня щелочных металлов
Металлы IA группы — s-элементы. В химических реакциях они отдают один валентный электрон, поэтому для них характерна постоянная степень окисления +1.
Рассмотрим характеристики элементов IA группы:
| Название | Атомная масса, а.е.м. | Заряд ядра | ЭО по Полингу | Мет. радиус, нм | Энергия ионизации, кДж/моль | tпл, оС | Плотность, г/см3 |
| Литий | 6,941 | +3 | 0,98 | 0,152 | 520,2 | 180,6 | 0,534 |
| Натрий | 22,99 | +11 | 0,99 | 0,186 | 495,8 | 97,8 | 0,968 |
| Калий | 39,098 | +19 | 0,82 | 0,227 | 418,8 | 63,07 | 0,856 |
| Рубидий | 85,469 | +37 | 0,82 | 0,248 | 403,0 | 39,5 | 1,532 |
| Цезий | 132,905 | +55 | 0,79 | 0,265 | 375,7 | 28,4 | 1,90 |
Все щелочные металлы — сильные восстановители. Это самые активные металлы, которые могут непосредственно взаимодействовать с неметаллами.
С ростом порядкового номера и уменьшением энергии ионизации металлические свойства элементов усиливаются. Щелочные металлы образуют с кислородом оксиды Э2О.
Оксиды щелочных металлов реагируют с водой с образованием основания (щелочи):
Э2О + Н2О = 2ЭОН
Водородные соединения щелочных металлов — это гидриды с общей формулой ЭН. Степень окисления водорода в гидридах равна -1.
Металлы IIA (второй группы главной подгруппы) — щелочноземельные. Раньше к щелочноземельным металлам относили только кальций, стронций, барий и радий, но по решению ИЮПАК бериллий и магний также называются щелочноземельными.
У щелочноземельных металлов на внешнем энергетическом уровне расположены два электрона. В основном состоянии это два спаренных электрона на s-подуровне:
… ns2 — электронное строение внешнего энергетического уровня элементов IIA группы
Щелочноземельные металлы — s-элементы. Отдавая два валентных электрона, они проявляют постоянную степень окисления +2. Все элементы подгруппы бериллия — сильные восстановители, но восстановительные свойства выражены слабее, чем у щелочных металлов.
Характеристики элементов IIA группы:
| Название | Атомная масса, а.е.м. | Заряд ядра | ЭО по Полингу | Мет. радиус, нм | Энергия ионизации, кДж/моль | tпл, оС | Плотность, г/см3 |
| Бериллий | 9,012 | +4 | 1,57 | 0,169 | 898,8 | 1278 | 1,848 |
| Магний | 24,305 | +12 | 1,31 | 0,245 | 737,3 | 650 | 1,737 |
| Кальций | 40,078 | +20 | 1,00 | 0,279 | 589,4 | 839 | 1,55 |
| Стронций | 87,62 | +38 | 0,95 | 0,304 | 549,0 | 769 | 2,54 |
| Барий | 137,327 | +56 | 0,89 | 0,251 | 502,5 | 729 | 3,5 |
Металлы подгруппы бериллия довольно активны. На воздухе они легко окисляются, образуя основные оксиды с общей формулой ЭО. Этим оксидам соответствуют гидроксиды Э(ОН)2.
Первый элемент IIA группы, бериллий, по большинству свойств гораздо ближе к алюминию (диагональное сходство). Это проявляется в свойствах бериллия. Например, он не взаимодействует с водой. Магний взаимодействует с водой только при нагревании. Кальций, стронций и барий — это типичные металлы. Они реагируют с водой при обычных условиях.
- Элементам IIA группы соответствуют гидриды с общей формулой ЭН2.
- Элементы IIIA (третьей группы главной подгруппы) — это бор, алюминий, галлий, индий, таллий и нихоний. В основном состоянии содержат на внешнем энергетическом уровне три электрона, которые распределены по s- и р-подуровням:
- … ns2nр1 — электронное строение внешнего энергетического уровня элементов IIIA группы
Все элементы подгруппы бора относятся к р-элементам. В химических соединениях проявляются степень окисления +3. Хотя для таллия более устойчивая степень окисления +1.
Характеристики элементов IIA группы:
| Название | Атомная масса, а.е.м. | Заряд ядра | ЭО по Полингу | Радиус атома, нм | Энергия ионизации, Э → Э3+, эВ |
Степень окисления в соединениях | Валентные электроны |
| Бор | 10,811 | +5 | 2,01 | 0,091 | 71,35 | +3, -3 | 2s22p1 |
| Алюминий | 26,982 | +13 | 1,47 | 0,143 | 53,20 | +3 | 3s23p1 |
| Галлий | 69,723 | +31 | 1,82 | 0,139 | 57,20 | +3 | 4s24p1 |
| Индий | 114,818 | +49 | 1,49 | 0,116 | 52,69 | +3 | 5s25p1 |
| Таллий | 204,383 | +81 | 1,44 | 0,171 | 56,31 | +1, +3 | 6s26p1 |
Металлические свойства у элементов подгруппы бора выражены слабее, чем у элементов IIA подгруппы. Элмент бор относится к неметаллам. Энергия ионизации атома у бора наибольшая среди элментов IIIA подгруппы.
Алюминий относится к типичным металлам, но оксид и гидроксид алюминия проявляют амфотерные свойства. У таллия более сильно выражены металлические свойства, в степени окисления +1 он близок по свойствам к щелочным металлам.
Наибольшее практическое значение среди элементов IIIA подгруппы имеет алюминий.
В общем металлы IА–IIIА подгрупп характеризуются:
- небольшим количеством электронов на внешнем энергетическом уровне:
- сравнительно сильными восстановительными свойствами;
- низкими значениями электроотрицательности;
- сравнительно большими атомными радиусами (относительно радиусов других атомов в периодах, в которых расположены соответствующие металлы);
- металлической кристаллической решеткой;
- высокой электро- и теплопроводностью;
- твердым фазовым состоянием при нормальных условиях.