- СТРУКТУРА
- СВОЙСТВА
- МОРФОЛОГИЯ
- ПРОИСХОЖДЕНИЕ
- ПРИМЕНЕНИЕ
- КЛАССИФИКАЦИЯ
- Физические свойства
- Оптические свойства
- Кристаллографические свойства
- Мышьяк
- Что такое мышьяк
- История элемента
- Мышьяк в природе
- Физические свойства
- Модификации
- Химические свойства
- Получение мышьяка
- Применение
- Аллотропия мышьяка
- Соединение мышьяка с другими элементами
- Арсин
- Соединения мышьяка с кислородом и водой
- Мышьяк в зубе
- Мышьяк
- Этимология
- Нахождение в природе
- Изотопы
- Получение
- Применение
- Биологическая роль и физиологическое действие
- Токсичность
- Токсикология
- В традиционной медицине
- В судебной медицине
- Жизнь на основе мышьяка
- Загрязнения мышьяком
- Химические свойства мышьяка
- МЫШЬЯК
- Материал подготовил П.А.КОШЕЛЬ
 Мышьяк — минерал из класса самородных элементов, полуметалл, химическая формула As. Обычны примеси Sb, S, Fe, Ag, Ni; реже Bi и V. Содержание As в самородном мышьяке достигает 98%. Химический элемент 15-й группы (по устаревшей классификации — главной подгруппы пятой группы) четвёртого периода периодической системы; имеет атомный номер 33. Мышьяк (неочищенный мышьяк) представляет собой твердое вещество, извлекаемое из природных арсенопиритов. Он существует в двух основных формах: обыкновенный, так называемый “металлический” мышьяк, в виде блестящих кристаллов стального цвета, хрупких, не растворимых в воде и желтый мышьяк, кристаллический, довольно неустойчивый. Мышьяк используется в производстве дисульфида мышьяка, крупной дроби, твердой бронзы и различных других сплавов (олова, меди и т.п.)
Мышьяк — минерал из класса самородных элементов, полуметалл, химическая формула As. Обычны примеси Sb, S, Fe, Ag, Ni; реже Bi и V. Содержание As в самородном мышьяке достигает 98%. Химический элемент 15-й группы (по устаревшей классификации — главной подгруппы пятой группы) четвёртого периода периодической системы; имеет атомный номер 33. Мышьяк (неочищенный мышьяк) представляет собой твердое вещество, извлекаемое из природных арсенопиритов. Он существует в двух основных формах: обыкновенный, так называемый “металлический” мышьяк, в виде блестящих кристаллов стального цвета, хрупких, не растворимых в воде и желтый мышьяк, кристаллический, довольно неустойчивый. Мышьяк используется в производстве дисульфида мышьяка, крупной дроби, твердой бронзы и различных других сплавов (олова, меди и т.п.)
СТРУКТУРА
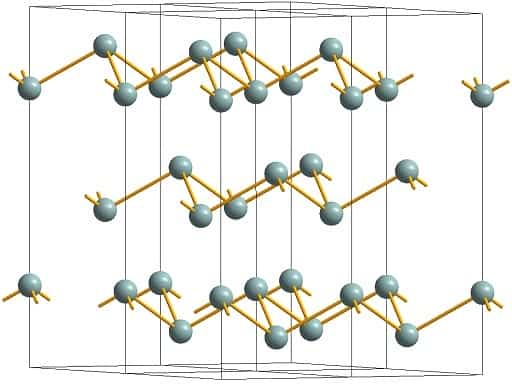 Кристаллическая структура мышьяка дитригонально-скаленоэдрическая симметрия. Сингония тригональная, в. с. L633L23PC. Кристаллы крайне редки, имеют ромбоэдрический или псевдокубический габитус.
Кристаллическая структура мышьяка дитригонально-скаленоэдрическая симметрия. Сингония тригональная, в. с. L633L23PC. Кристаллы крайне редки, имеют ромбоэдрический или псевдокубический габитус.
Установлено несколько аллотропных модификаций мышьяка. В обычных условиях устойчив металлический, или серый мышьяк (альфа-мышьяк). Кристаллическая решетка серого мышьяка ромбоэдрическая, слоистая, с периодом а=4,123 А, угол а = 54° 10′.
Плотность (при температуре 20° С) 5,72 г/см3; температурный коэфф. линейного расширения 3,36 • 10 град ; удельное электрическое сопротивление (температура 0° С) 35 • 10—6 ом • см; НВ = ж 147; коэфф. сжимаемости (при температуре 30° С) 4,5 х 10-6cm2/кг.
Температура плавления альфа-мышьяка 816° С при давлении 36 атмосфер.
Под атм. давлением мышьяк возгоняется при температуре 615° С не плавясь. Теплота сублимации 102 кал/г. Пары мышьяка бесцветны, до т-ры 800° С состоят из молекул As4, от 800 до 1700° С — из смеси As4 и As2, выше температуры 1700° С — только из As2.
При быстрой конденсации паров мышьяк на поверхности, охлаждаемой жидким воздухом, образуется желтый мышьяк— прозрачные мягкие кристаллы кубической системы с плотностью 1,97 г/см3.
Известны также другие метастабильные модификации мышьяка: бета-мышьяк — аморфная стеклообразная, гамма-мышьяк — желто-коричневая и дельта-мышьяк — коричневая аморфная с плотностями соответственно 4,73; 4,97 и 5,10 г/см3. Выше температуры 270° С эти модификации переходят в серый мышьяк.
СВОЙСТВА
 Цвет на свежем изломе цинково-белый, оловянно-белый до светло-серого, быстро тускнеет за счет образования тёмно-серой побежалости; чёрный на выветрелой поверхности. Твёрдость по шкале Мооса 3 – 3,5. Плотность 5,63 – 5,8 г/см3. Хрупкий. Диагностируется по характерному запаху чеснока при ударе. Спайность совершенная по {0001} и менее совершенная по {0112}. Излом зернистый. Уд. вес 5,63-5,78. Черта серая, оловянно-белая. Блеск металлический, сильный (в свежем изломе), быстро тускнеет и становится матовым на окислившейся, почерневшей с течением времени поверхности. Является диамагнетиком.
Цвет на свежем изломе цинково-белый, оловянно-белый до светло-серого, быстро тускнеет за счет образования тёмно-серой побежалости; чёрный на выветрелой поверхности. Твёрдость по шкале Мооса 3 – 3,5. Плотность 5,63 – 5,8 г/см3. Хрупкий. Диагностируется по характерному запаху чеснока при ударе. Спайность совершенная по {0001} и менее совершенная по {0112}. Излом зернистый. Уд. вес 5,63-5,78. Черта серая, оловянно-белая. Блеск металлический, сильный (в свежем изломе), быстро тускнеет и становится матовым на окислившейся, почерневшей с течением времени поверхности. Является диамагнетиком.
МОРФОЛОГИЯ
 Мышьяк обычно наблюдается в виде корок с натечной почковидной поверхностью, сталактитов, скорлуповатых образований, в изломе обнаруживающих кристаллически-зернистое строение. Самородный мышьяк довольно легко узнается по форме выделений, почерневшей поверхности, значительному удельному весу, сильному металлическому блеску в свежем изломе и совершенной спайности. Под паяльной трубкой улетучивается, не плавясь (при температуре около 360°), издавая характерный чесночный запах и образуя белый налет As2О3 на угле. В жидкое состояние переходит лишь при повышенном внешнем давлении. В закрытой трубке образует зеркало мышьяка. При резком ударе молотком издает чесночный запах.
Мышьяк обычно наблюдается в виде корок с натечной почковидной поверхностью, сталактитов, скорлуповатых образований, в изломе обнаруживающих кристаллически-зернистое строение. Самородный мышьяк довольно легко узнается по форме выделений, почерневшей поверхности, значительному удельному весу, сильному металлическому блеску в свежем изломе и совершенной спайности. Под паяльной трубкой улетучивается, не плавясь (при температуре около 360°), издавая характерный чесночный запах и образуя белый налет As2О3 на угле. В жидкое состояние переходит лишь при повышенном внешнем давлении. В закрытой трубке образует зеркало мышьяка. При резком ударе молотком издает чесночный запах.
ПРОИСХОЖДЕНИЕ

В литературе имеются указания на вторичное происхождение мышьяка в зонах выветривания месторождений мышьяковистых руд, что, вообще говоря, мало вероятно, если учесть, что в этих условиях он очень неустойчив и, быстро окисляясь, разлагается полностью. Черные корочки состоят из тонкой смеси мышьяка и арсенолита (As2О3). В конце концов образуется чистый арсенолит.
В земной коре концентрация мышьяка невелика и составляет 1,5 промилле. Он встречается в почве и минералах и может попасть в воздух, воду и грунт благодаря ветровой и водной эрозии.
Кроме того, элемент поступает в атмосферу из других источников. В результате извержения вулканов в воздух выделяется около 3 тыс. т мышьяка в год, микроорганизмы образуют 20 тыс.
т летучего метиларсина в год, а в результате сжигания ископаемого топлива за тот же период выделяется 80 тыс. т.
На территории СССР самородный мышьяк был встречен в нескольких месторождениях. Из них отметим Садонское гидротермальное свинцово-цинковое месторождение, где он неоднократно наблюдался в виде почковидных масс на кристаллическом кальците с галенитом и сфалеритом.
Крупные почкообразные скопления самородного мышьяка с концентрически-скорлуповатым строением были встречены на левом берегу р. Чикоя (Забайкалье). В парагенезисе с ним наблюдался лишь кальцит в виде оторочек на стенках тонких жил, секущих древние кристаллические сланцы. В виде обломков (рис.
76) мышьяк был найден также в районе ст. Джалинда, Амурской ж. д. и в других местах.
В ряде месторождений Саксонии (Фрейберг, Шнееберг, Аннаберг и др.) самородный мышьяк наблюдался в ассоциации с мышьяковистыми соединениями кобальта, никеля, серебра, самородным висмутом и др. Все эти и другие находки этого минерала практического значения не имеют.
ПРИМЕНЕНИЕ

Сульфидные соединения мышьяка — аурипигмент и реальгар — используются в живописи в качестве красок и в кожевенной отрасли промышленности в качестве средств для удаления волос с кожи. В пиротехнике реальгар употребляется для получения «греческого», или «индийского», огня, возникающего при горении смеси реальгара с серой и селитрой (при горении образует ярко-белое пламя).
Некоторые элементоорганические соединения мышьяка являются боевыми отравляющими веществами, например, люизит.
В начале XX века некоторые производные какодила, например, сальварсан, применяли для лечения сифилиса, со временем эти препараты были вытеснены из медицинского применения для лечения сифилиса другими, менее токсичными и более эффективными, фармацевтическими препаратами, не содержащими мышьяк.
Многие из мышьяковых соединений в очень малых дозах применяются в качестве препаратов для борьбы с малокровием и рядом других тяжелых заболеваний, так как оказывают клинически заметное стимулирующее влияние на ряд специфических функций организма, в частности, на кроветворение. Из неорганических соединений мышьяка мышьяковистый ангидрид может применяться в медицине для приготовления пилюль и в зубоврачебной практике в виде пасты как некротизирующее лекарственное средство. Этот препарат в обиходе и жаргонно называли «мышьяк» и применяли в стоматологии для локального омертвления зубного нерва. В настоящее время препараты мышьяка редко применяются в зубоврачебной практике из-за их токсичности. Сейчас разработаны и применяются другие методы безболезненного омертвления нерва зуба под местной анестезией.
Мышьяк (англ. Arsenic) – As
КЛАССИФИКАЦИЯ
Физические свойства
Оптические свойства
Кристаллографические свойства
Мышьяк
Мышьяк это химический элемент, простое вещество, соединения очень ядовиты, поэтому известны со времен алхимиков.
Все соединения мышьяка ядовиты . Арсенаты и арсениты кальция и натрия используют как инсектициды.
Применяется в производстве инсектицидов, добавляется в виде добавок в металлургии, а также в электронике и в медицине.

Что такое мышьяк
(Arsenicum), As — химический элемент 15-й группы ( по устаревшей V группы ) периодической системы элементов, ат. н. 33, ат. м. 74,9216. Кристаллы серо-стального цвета.
В соединениях мышьяк проявляет степени окисления — 3, + 3 и +5. Природный мышьяк состоит из стабильного изотопа As.
Получены 14 радиоактивных изотопов, из них наиболее важны 75As, 74As и 78As с периодами полураспада соответственно 76 дней, 17,5 дней и 26,8 ч.
История элемента
Соединения мышьяка были известны еще в Древнем Египте, где использовались для получения красок, лекарств и ядов. Получение свободного, т. н. металлического мышьяка обычно приписывают немец, алхимику Альберту Великому (около 1250).
Проверь хорошо ли Вы знаете науки
Вопрос
Ваш ответ:
Правильный ответ:
Ты получил {{SCORE_CORRECT}} снаружи {{SCORE_TOTAL}}
В 1789 франц. химик А. Лавуазье включил мышьяк в список химических элементов. Содержание мышьяка в земной коре 1,7 • 10-4%. Свободный (самородный) мышьяк встречается редко.
Мышьяк в природе
В природе мышьяк находится преим. в виде сульфидов. Известно около 120 минералов, содержащих мышьяк.
Наиболее распространены из них мышьяковый колчедан (миспикель, арсенопирит) FeAsS (46,0% As), мышьяковистый колчедан (леллингит) FeAs2 (72,8% As), реальгар As4S4 (70,1% As) и аурипигмент As2S3 (61,0% As). Установлено несколько аллотропных модификаций мышьяка.
Природный мышьяк на 100% состоит из стабильного изотопа 75As .
В литосфере его около 0,0005 масс.% . Мышьяк распространен в виде сульфидов : аурипигмента ( золотистый краситель ) As2S2 и мышьяковистого колчедана FeAsS изредка встречается в свободном виде.
Физические свойства
В обычных условиях устойчив металлический, или серый мышьяк (альфа-мышьяк). Кристаллическая решетка серого мышьяка ромбоэдрическая, слоистая, с периодом а =4,123 Å, угол а = 54° 10′.
Плотность (т-ра 20° С) 5,72 г/см3; температурный коэфф. линейного расширения 3,36 • 10 град ; удельное электрическое сопротивление (т-ра 0° С) 35 • 10-6 ом • см; НВ = ж 147; коэфф. сжимаемости (т-ра30° С) 4,5 х 10-6cm2/kг.
Мышьяк диамагнитен. Т-ра плавления альфа-мышьяка 816° С при давлении 36 ат.
Под атм. давлением мышьяк возгоняется при т-ре 615° С не плавясь. Теплота сублимации 102 кал/г. Пары М. бесцветны, до т-ры 800° С состоят из молекул As4, от 800 до 1700° С — из смеси As4 и As2, выше т-ры 1700° С — только из As2.
При быстрой конденсации паров мышьяк на поверхности, охлаждаемой жидким воздухом, образуется желтый мышьяк— прозрачные мягкие кристаллы кубической системы с плотностью 1,97 г/см3.
Модификации
Известны также другие метастабильные модификации М.: бета-мышьяк — аморфная стеклообразная, гамма-мышьяк — желтокоричневая и дельта-мышьяк — коричневая аморфная с плотностями соответственно 4,73; 4,97 и 5,10 г/см3.
Выше т-ры 270° С эти модификации переходят в серый мышьяк.
Химические свойства
При нагревании на воздухе мышьяк легко окисляется в As2O3. Измельченный мышьяк быстро сгорает ярким голубоватым пламенем, выделяя белый дым As2O3.
Азотная к-та и «царская водка» окисляют его в мышьяковую к-ту H3AsO4, при нагревании к-рой получают As2O6. С галогенами мышьяк соединяется непосредственно с образованием галогенидов: в обычных условиях AsF5 — газ; AsF3, AsCl3 и AsBr3 —бесцветные легко летучие жидкости; As2I4 и As2I3 — красные кристаллы.
При нагревании с серой получены сульфиды As4S4 (оранжево-красный) и As2S3 (лимонно-желтый). При пропускании H2S в охлаждаемый льдом раствор мышьяковой к-ты (или ее солей) получают бледно-желтый сульфид As2S5.
При сплавлении со многими металлами мышьяк образует арсениды. В большинстве случаев наблюдается небольшая его растворимость в твердых металлах.
Непрерывные твердые растворы мышьяк дает только с сурьмой. В сплавах железа, содержащих мышьяк, качество металла ухудшается с увеличением содержания углерода
Взаимодействием М. или его соединений с водородом в момент выделения получают весьма ядовитый газ — мышьяковистый водород, или арсин AsH3. Он образуется также при разложении арсенидов разбавленными к-тами.
Исходным материалом для получения мышьяка и его соединений служит трехокись As2O3, к-рая образуется при окислительном обжиге руд мышьяка и полиметаллических сульфидных руд, содержащих соединения М. как примесь.
Получение мышьяка
Мышьяк получают восстановлением трехокиси As2O3 углеродом и окисью углерода, а также разложением мышьякового колчедана FeAsS при нагревании. В процессе последующего охлаждения паров мышьяк конденсируется в виде кристаллов.
Его рафинируют г возгонкой и перекристаллизацией при нагревании в стальных ретортах до т-ры 650° С. Соединения М. отличаются значительной , токсичностью.
Металлический мышьяк в чистом виде не вызывает отравления, но может оказаться ядовитым вследствие окисления в As2O3.
При работе с М. и его соединениями необходима эффективно действующая вентиляция, соблюдение мер предосторожности (пользование противогазами, респираторами, чистой спецодеждой и др.), частый медицинский контроль.
Применение
Недопустимо привлечение к работе с М. женщин и подростков. Металлический мышьяк применяют только как добавку в некоторые сплавы.
Так, в свинец, используемый для производства дроби, добавляют 0,5—1,6% As, что способствует образованию дробинок сферической формы. Особо чистый мышьяк используют в полупроводниковой технике для получения арсенидов галлия и индия.
Более широкое применение находят соединения М. Так, As2O3 применяют для осветления стекла, в пиротехнике и др.; швейнфуртскую зелень (парижскую зелень) Cu(CH3COO)2 X 3Cu (AsО2)2 используют как краситель и инсектицид; арсенат Mg3(AsО4)2 — в качестве люминофора при изготовлении люминесцентных ламп.
Аллотропия мышьяка
У мышьяка три аллотропических видоизменения : альфа — мышьяк ( металлический или серый ) , бета — мышьяк ( чёрный , аморфный ) и гамма мышьяк ( жёлтый ) . В обычных условиях наиболее устойчив альфа — мышьяк.
Это серое вещество с тусклым металлическим блеском , проводит электричество и тепло , имеет четырёхатомные молекулы As4 , при нагревании возгоняется , выделяя пары с чесночным запахом, в воде нерастворим .
Хотя он уже имеет металлические признаки , он всё — таки не может быть причислен к металлам , а остаётся элементом с преобладанием неметаллических свойств .
Соединение мышьяка с другими элементами
- При обычных температурах сравнительно малоактивен , но при нагревании взаимодействует с водородом и кислородом , другими не металлами.
- В атмосфере хлора мышьяк сгорает , образует трихлорид AsCl3 :
- 2As + 3Cl2 = AsCl3
- С некоторыми металлами он образует соединения — арсениды , например арсенид кальция Ca3As2 и меди Cu3As .
- В соединении с кислородом мышьяк проявляет степень окисления +3 и +5 , а в водородных соединениях -3 .
Арсин
- У него несколько водородных соединений , из которых важнее — арсин , или мышьяковистый водород AsH3 .
Арсин получают при действии кислот ( серная кислота ) на арсениды :
- Zn3As2 + 3H2SO4 = 2AsH3 + 6ZnSO4
- Это бесцветный ядовитый газ с чесночным запахом образуется и при восстановлении мышьяковистых соединений атомарным водородом , суммарное уравнение реакции имеет следующий вид :
- As2O3 + 6Zn + 6H2SO4 = 2AsH3 + 6ZnSO4 + 3H2O
- но арсин неустойчив и при нагревании разлагается :
- 2AsH3 = 2As + 3H2
- Орсин AsH3 отличается от аммиака NH3 ещё больше , чем фосфин PH3 , так как он не взаимодействует с водой и кислотами и из трёх этих соединений арсин наименее прочен.
Соединения мышьяка с кислородом и водой
С кислородом мышьяк образует два оксида . Оксид мышьяка (III) As2O3 получают при горении его и имеет вид белого , малорастворимого в воде порошка ( белый мышьяк ) .
- При взаимодействии с водой , он образует ортомышьяковистую кислоту H3AsO3 :
- As2O3 + 3H2O = 2H3AsO3
- которая известна только в водных растворах и находится в равновесии с метамышьяковистой HAsO2 :
- H3AsO3 ⇄ HAsO2 + H2O
Соли этих кислот называются ортоарсенитами и метаарсенитами . У ортомышьяковистой кислоты имеются не только средние ортоарсениты Na3AsO3 , Ca( AsO3 )3, но также гидроарсениты Na2HAsO3 , CaHAsO3 и дигидроарсениты NaH2AsO3 , Ca( H2AsO3 )2 .
- Хотя оксиду мышьяка ( III ) и соответствуют кислоты , он проявляет аморфные свойства , взаимодействует как с основаниями :
- As2O3 + 6NaOH = 2Na3AsO3 + 3H2O
- так и с кислотами :
- As2O3 + 6HCl = 2AsCl3 + 3H2O
Все соединения мышьяка со степенью окисления +3 проявляют восстановительные свойства .
Оксид мышьяка ( V ) As2O5 — белая кристаллическая масса , расплывающаяся на воздухе .
- Этот оксид получают обезвоживанием ортомышьяковой кислоты H3AsO4 . При растворении As2O5 в воде получается ортомышьяковая кислота , однако чаще её получают окислением соединений мышьяка в степени окисления +3 концентрированной азотной кислотой :
- 3As2O3 + 4HNO3 + 7H2O = 6H3AsO3 + 4NO
- Ортомышьяковая кислота — белое кристаллическое вещество , хорошо растворимо в воде , не уступает по степени диссоциации ортофосфорной кислоте .
Как трёх основная кислота она имеет три ряда солей : арсениты Na3AsO4 , Ca3( AsO4 )2 , гидроарсениты Na2HAsO4 , CaHAsO4 , дигидроарсенаты NaH2AsO4 , Ca( H2AsO4 )2 . В кислой среде ортомышьяковая кислота и арсенаты ведут себя как окислители .
- Помимо H2AsO4 кислоты , существует метамышьяковая HAsO3 и двумышьяковая H4AsO7 а , также их соли. Свободный мышьяк является компонентом ряда сплавов ( ружейная дробь , некоторые сплавы меди )
- Представляют интерес сульфиды мышьяка . При пропускании сероводорода через солянокислый раствор ортомышьяковистой кислоты выпадает жёлтый осадок сульфида мышьяка ( III ) As2S3 :
- H2AsO3 + 3HCl ⇄ AsCl3 + 3H2O ,
- 2AsCl3 + 3H2S = As2S3 + 6HCl
- Из солянокислых растворов ортомышьяковой кислоты сероводород осаждает сульфид мышьяка ( V ) As2S5 :
- H3AsO4 + 5HCl ⇄ AsCl5 + 4H2O ,
- 2AsCl5 + 5H2S = As2S5 + 10HCl
- Для сульфидов мышьяка ( как и сульфидов сурьмы ) характерно свойство образовывать с сульфидами щелочных металлов и аммония растворимые в воде соли тиомышьяковой ( H3AsS4 ) и тиомышьяковистой ( H3AsS3 ) кислот .
- Эти кислоты рассматривают как производные ортомышьяковой и ортомышьяковистой кислот , в которых все атомы кислорода замещены атомами серы.
- Соли этих кислот называют соответственно тиоарсенатами и тиоарсенитами .
- Таким образом , при взаимодействии сульфида мышьяка ( V ) с сульфидом натрия получается тиоарсенат натрия Na3AsS4 :
- As2S5 + 3Na2S = 2Na3AsS4
- а при взаимодействии сульфида мышьяка ( III ) с сульфидом натрия образуется тиоарсенит натрия Na3AsS3 :
- As2S3 + 3Na2S = 2Na3AsS3
Мышьяк в зубе
Когда болит зуб, следует обратиться к дантисту, а не заниматься самолечением. В запущенных случаях стоматология предлагает пациентам экстирпацию пульпы. Чтобы провести такое лечение, нужно умертвить нерв.
Мышьяк в зуб ставят именно для этой цели. Вещество это токсичное. Однако, при грамотном подходе к процедуре, а также при соблюдении длительности терапии, данное средство эффективно и безопасно. Его ложат в определенном количестве.
От этого нарушается дыхание клеток и денатурация белков, что приводит к остановке кровоснабжения пульпы. В таком состоянии передача импульсов блокируется, клетки погибают.
Удаление зуба в данном состоянии, то есть при отсутствии нервных окончаний, больные переносят легче. Выглядит мышьяк как вещество со стальным цветом, вкрапления имеют зеленоватый оттенок. Выраженного вкуса паста не имеет.
С мышьяком в зубе можно ходить один-двое суток иногда больше, но данную процедуру может назначать только доктор, любые действия с соединениями мышьяка ядовиты.
Лит.: Габриелова М. Г., Морозов а М. А. Производство неорганических ядохимикатов
Статья на тему мышьяк
Мышьяк
| 33 | Мышьяк |
| 3d104s24p3 |
Мышьяк (лат. Arsenicum, химический символ — As) — химический элемент 15-й группы (по устаревшей классификации — главной подгруппы пятой группы) четвёртого периода периодической системы; имеет атомный номер 33. Простое вещество представляет собой хрупкий полуметалл стального цвета с зеленоватым оттенком (в серой аллотропной модификации). Яд и канцероген.
Мышьяк является одним из древнейших элементов, используемых человеком. Сульфиды мышьяка As2S3 и As4S4, так называемые аурипигмент («арсеник») и реальгар, были знакомы римлянам и грекам. Эти вещества ядовиты.
Мышьяк является одним из элементов, встречающихся в природе в свободном виде. Его можно сравнительно легко выделить из соединений. Поэтому история не знает, кто впервые получил в свободном состоянии элементарный мышьяк. Многие приписывают роль первооткрывателя алхимику Альберту Великому.
В трудах Парацельса также описано получение мышьяка в результате реакции арсеника с яичной скорлупой. Многие историки науки предполагают, что металлический мышьяк был получен значительно раньше, но он считался разновидностью самородной ртути. Это можно объяснить тем, что сульфид мышьяка был очень похож на ртутный минерал.
Выделение из него было очень легким, как и при выделении ртути. Элементарный мышьяк был известен в Европе и в Азии ещё со средних веков. Китайцы получали его из руд. В отличие от европейцев, они могли диагностировать смерть от отравления мышьяком. Но этот метод анализа не дошёл до настоящих времён.
Европейцы научились определять наступление смерти при отравлении мышьяком гораздо позже, это впервые сделал Джеймс Марш. Данная реакция используется и в настоящее время.
Мышьяк иногда встречается в оловянных рудах. В китайской литературе средних веков описаны случаи смерти людей, которые выпивали воду или вино из оловянных сосудов, из-за наличия в них мышьяка. Сравнительно долго люди путали сам мышьяк и его оксид, принимая их за одно вещество.
Это недоразумение было устранено Георгом Брандтом и Антуаном Лораном Лавуазье, которые и доказали, что это разные вещества, и что мышьяк — самостоятельный химический элемент. Оксид мышьяка долгое время использовался для уничтожения грызунов. Отсюда и происхождение русского названия элемента.
Оно происходит от слов «мышь» и «яд».
Этимология
Название мышьяка в русском языке происходит от слова «мышь», в связи с употреблением его соединений для истребления мышей и крыс. Греческое название ἀρσενικόν происходит от персидского زرنيخ (zarnik) — «жёлтый аурипигмент». Народная этимология возводит к др.-греч. ἀρσενικός — мужской.
Латинское название arsenicum является прямым заимствованием греческого ἀρσενικόν. В 1789 году А. Лавуазье включил мышьяк в список химических элементов под названием arsenic.
Нахождение в природе
Мышьяк — рассеянный элемент. Содержание в земной коре 1,7⋅10−4 % по массе. В морской воде 0,003 мг/л. Этот элемент иногда встречается в природе в самородном виде, минерал имеет вид металлически блестящих серых скорлупок или плотных масс, состоящих из мелких зёрнышек.
Известно около 200 мышьяковосодержащих минералов. В небольших концентрациях часто сопутствует свинцовым, медным и серебряным рудам. Довольно распространены два природных минерала мышьяка в виде сульфидов (бинарных соединений с серой): оранжево-красный прозрачный реальгар AsS и лимонно-жёлтый аурипигмент As2S3.
Минерал, имеющий промышленное значение для получения мышьяка — арсенопирит (мышьяковый колчедан) FeAsS или FeS2·FeAs2 (46 % As), также перерабатывают мышьяковистый колчедан — лёллингит (FeAs2) (72,8 % As), скородит FeAsO4 (27—36 % As).
Большая часть мышьяка добывается попутно при переработке мышьяковосодержащих золотых, свинцово-цинковых, медноколчеданных и других руд.
Главный промышленный минерал мышьяка — арсенопирит FeAsS.
Крупные медно-мышьяковые месторождения есть в Грузии, Средней Азии и Казахстане, в США, Швеции, Норвегии и Японии, мышьяково-кобальтовые — в Канаде, мышьяково-оловянные — в Боливии и Англии.
Кроме того, известны золото-мышьяковые месторождения в США и Франции. Россия располагает многочисленными месторождениями мышьяка в Якутии, на Урале, в Сибири, Забайкалье и на Чукотке.
Изотопы
Основная статья: Изотопы мышьяка
Известны 33 изотопа и, по крайней мере, 10 возбуждённых состояний ядерных изомеров. Из этих изотопов стабилен только 75As, и природный мышьяк состоит только из этого изотопа. Наиболее долгоживущий радиоактивный изотоп 73As имеет период полураспада 80,3 дня.
Получение
Открытие способа получения металлического мышьяка (серого мышьяка) приписывают средневековому алхимику Альберту Великому, жившему в XIII в. Однако гораздо ранее греческие и арабские алхимики умели получать мышьяк в свободном виде, нагревая «белый мышьяк» (триоксид мышьяка) с различными органическими веществами.
Существует множество способов получения мышьяка: сублимацией природного мышьяка, способом термического разложения мышьякового колчедана, восстановлением мышьяковистого ангидрида и др.
В настоящее время для получения металлического мышьяка чаще всего нагревают арсенопирит в муфельных печах без доступа воздуха. При этом освобождается мышьяк, пары которого конденсируются и превращаются в твёрдый мышьяк в железных трубках, идущих от печей, и в особых керамических приёмниках.
Остаток в печах потом нагревают при доступе воздуха, и тогда мышьяк окисляется в As2O3. Металлический мышьяк получается в довольно незначительных количествах, и главная часть мышьякосодержащих руд перерабатывается в белый мышьяк, то есть в триоксид мышьяка — мышьяковистый ангидрид As2O3.
Основной способ получения — обжиг сульфидных руд с последующим восстановлением оксида углём (углеродом):
2As2S3 + 9O2 →toC 6SO2↑ + 2As2O3 As2O3 + 3C →toC 2As + 3CO↑
Применение
- Мышьяк используется для легирования сплавов свинца, идущих на приготовление дроби, так как при отливке дроби башенным способом капли сплава мышьяка со свинцом приобретают строго сферическую форму, и кроме того, прочность и твёрдость свинца существенно возрастают.
- Мышьяк особой чистоты (99,9999 %) используется для синтеза ряда полезных и важных полупроводниковых материалов — арсенидов (например, арсенида галлия) и других полупроводниковых материалов с кристаллической решёткой типа цинковой обманки.
- Сульфидные соединения мышьяка — аурипигмент и реальгар — используются в живописи в качестве красок и в кожевенной отрасли промышленности в качестве средств для удаления волос с кожи.
- В пиротехнике реальгар употребляется для получения «греческого» огня или «индийского» (бенгальского) огня, возникающего при горении смеси реальгара с серой и селитрой (при горении образует ярко-белое пламя).
- Некоторые элементоорганические соединения мышьяка являются боевыми отравляющими веществами, например, люизит.
- В начале XX века некоторые производные какодила, например, сальварсан, применяли для лечения сифилиса, со временем эти препараты были вытеснены из медицинского применения для лечения сифилиса другими, менее токсичными и более эффективными, фармацевтическими препаратами, не содержащими мышьяк.
Многие из мышьяковых соединений в очень малых дозах применяются в качестве препаратов для борьбы с малокровием и рядом других тяжёлых заболеваний, так как оказывают клинически заметное стимулирующее влияние на ряд специфических функций организма, в частности, на кроветворение.
Из неорганических соединений мышьяка мышьяковистый ангидрид может применяться в медицине для приготовления пилюль и в зубоврачебной практике в виде пасты как некротизирующее лекарственное средство. Этот препарат в обиходе и жаргонно называли «мышьяк» и применяли в стоматологии для локального омертвления зубного нерва (см. пульпит). В настоящее время (2015 г.) препараты мышьяка редко применяются в зубоврачебной практике из-за их токсичности. Сейчас разработаны и применяются другие методы безболезненного омертвления нерва зуба под местной анестезией.
Биологическая роль и физиологическое действие
Токсичность
Токсикология
Мышьяк и все его соединения ядовиты и канцерогенны. Неорганические соединения мышьяка относятся к 1 категории канцерогенов по МАИР, арсенобетаин и другие органические соединения, не метаболизируемые в организме человека — к 3 группе. Смертельная доза мышьяка для человека составляет 50-170 мг (1,4 мг/кг массы тела).
При остром отравлении мышьяком наблюдаются рвота, боли в животе, понос, угнетение центральной нервной системы. Сходство симптомов отравления мышьяком с симптомами холеры длительное время позволяло маскировать использование соединений мышьяка (чаще всего, триоксида мышьяка, т. н. «белого мышьяка») в качестве смертельного яда.
Во Франции порошок триоксида мышьяка за высокую эффективность получил обиходное название «наследственный порошок» (фр. poudre de succession). Существует предположение, что соединениями мышьяка был отравлен Наполеон на острове Святой Елены.
В 1832 году появилась надёжная качественная реакция на мышьяк — проба Марша, значительно повысившая эффективность диагностирования отравлений.
На территориях, где в почве и воде избыток мышьяка, он накапливается в щитовидной железе у людей и вызывает эндемический зоб.
Помощь и противоядия при отравлении мышьяком: приём водных растворов тиосульфата натрия Na2S2O3, промывание желудка, приём молока и творога; специфическое противоядие — унитиол. ПДК в воздухе для мышьяка 0,5 мг/м³.
Работают с мышьяком в герметичных боксах, используя защитную спецодежду. Из-за высокой токсичности соединения мышьяка использовались как отравляющие вещества в Первую мировую войну.
Недавно широкую огласку получила техногенная экологическая катастрофа на юге Индии — из-за чрезмерного отбора воды из водоносных горизонтов мышьяк стал поступать в питьевую воду. Это вызвало токсическое и онкологическое поражение у десятков тысяч людей.
Считалось, что при длительном потреблении небольших доз мышьяка у организма вырабатывается иммунитет. Этот факт установлен как для людей, так и для животных. Известны случаи, когда привычные потребители мышьяка принимали сразу дозы, в несколько раз превышающие смертельную, и оставались здоровыми. Опыты на животных показали своеобразие этой привычки.
Оказалось, что животное, привыкшее к мышьяку при его употреблении, быстро погибает, если значительно меньшая доза вводится в кровь или под кожу. Однако такое «привыкание» носит очень ограниченный характер, в отношении т. н. «острой токсичности», и не защищает от новообразований.
Тем не менее, в настоящее время исследуется влияние микродоз мышьяксодержащих препаратов в качестве противоракового средства.
Как органические, так и неорганические соединения мышьяка токсичны для живых организмов.
Тем не менее, в малых дозах некоторые соединения мышьяка способствуют обмену веществ, укреплению костей, оказывают положительное влияние на кроветворную функцию и имунную систему, увеличивают усвоение азота и фосфора из пищи.
С растениями, наиболее заметный эффект мышьяка — замедление обмена веществ, что снижает урожайность, но мышьяк также стимулирует фиксацию азота.
Отмечалось, что для растущего организма у человека и животных микродозы мышьяка способствуют росту костей в длину и толщину, а в отдельных случаях рост костей под воздействием микродозам мышьяка отмечался и в период окончания роста.
Некоторые авторы рассматривают мышьяк, как жизненно важный микроэлемент и причисляют его к ультрамикроэлементам — микроэлементам, необходимым в особо малых концентрациях (подобно селену, ванадию, хрому и никелю). Необходимая суточная доза для человека составляет 10-15 мкг.
В традиционной медицине
В западных странах мышьяк был известен преимущественно как сильный яд, в то же время в традиционной китайской медицине он почти на протяжении двух тысяч лет использовался для лечения сифилиса и псориаза.
Мышьяк в малых дозах канцерогенен, его использование в качестве лекарства, «улучшающего кровь» (так называемый «белый мышьяк», например, «Таблетки Бло с мышьяком», и др.) продолжалось до середины 1950-х гг., и внесло свой весомый вклад в развитие онкологических заболеваний.
Соединение мышьяка сальварсан (также известен как «препарат 606» и арсфенамин) — исторически первое эффективное и в то же время относительно безвредное этиотропное лекарство от сифилиса, созданное химиком Паулем Эрлихом. К настоящему времени сальварсан вышел из употребления и заменён другими, гораздо более эффективными и безопасными средствами.
В судебной медицине
Метод обнаружения мышьяка в теле человека, трупах и продуктах питания при подозрениях на отравления был разработан в начале XIX в. английским химиком Джеймсом Маршем.
Жизнь на основе мышьяка
Основная статья: Жизнь на основе мышьяка
Известны экстремофильные бактерии, которые способны выживать при высоких концентрациях арсената в окружающей среде. Было высказано предположение, что в случае штамма GFAJ-1 мышьяк замещает фосфор в биохимических реакциях, в частности, входит в состав ДНК, однако это предположение не подтвердилось.
Загрязнения мышьяком
На территории Российской Федерации в городе Скопине Рязанской области вследствие многолетней работы местного металлургического комбината СМК «Металлург» в могильниках предприятия было захоронено около полутора тысяч тонн пылеобразных отходов с высоким содержанием мышьяка. Мышьяк является характерным сопутствующим элементом многих месторождений золота, что приводит к дополнительными экологическим проблемам в золотодобывающих странах, таких как, например, Румыния.
Химические свойства мышьяка
Мышьяк является неметаллом, образует соединения, подобные по его химическим свойствам. Однако, наряду с неметаллическими свойствами, мышьяк проявляет и металлические. На воздухе при обычных условиях мышьяк слегка окисляется с поверхности. Ни в воде, ни в органических растворителях мышьяк и его аналоги нерастворимы.
Мышьяк химически активен. На воздухе при нормальной температуре даже компактный (плавленый) металлический мышьяк легко окисляется, при нагревании порошкообразный мышьяк воспламеняется и горит голубым пламенем с образованием оксида As2O3. Известен также термически менее устойчивый нелетучий оксид As2O5.
При нагревании (в отсутствие воздуха) As возгоняется (температура возгонки 615оС). Пар состоит из молекул As4 с ничтожной (порядка 0,03%) примесью молекул As2.
Мышьяк относится к группе элементов окислителей-восстановителей. При действии сильных восстановителей он проявляет окислительные свойства. Так, при действии металлов и водорода в момент выделения он способен давать соответствующие металлические и водородистые соединения:
- 6Ca +As4 = 2Ca3As2
- При действии сильных окислителей мышьяк переходит в трех- или пятивалентное состояние. Например, при накаливании на воздухе мышьяк, окисляясь кислородом, сгорает и образует белый дым – оксид мышьяка (III) As2O3:
- As4 + 3O2 =2As2O3
Устойчивые формы оксида мышьяка в газовой фазе – сесквиоксид (мышьяковистый ангидрид) As2O3 и его димер As4O6. До 300оС основная форма в газовой фазе – димер, выше этой температуры он заметно диссоциирован, а при температурах выше 1800оС газообразный оксид состоит практически из мономерных молекул As2O3.
Газообразная смесь As4O6 и As2O3 образуется при горении As в кислороде, при окислительном обжиге сульфидных минералов As, например арсенопирита, руд цветных металлов и полимерных руд.
При конденсации пара As2O3 (As4O6) выше 310оС образуется стекловидная форма As2O3. При конденсации пара ниже 310оС образуется бесцветная поликристаллическая кубическая модификация арсенолит. Все формы As2O3 хорошо растворимы в кислотах и щелочах.
Оксид As(V) (мышьяковый ангидрид) As2O5 – бесцветные кристаллы ромбической сингонии. При нагревании As2O5 диссоциирует на As4O6 (газ) и О2. Получают As2O5 обезвоживанием концентрированных растворов H3AsO4 с последующим прокаливанием образующихся гидратов.
Известен оксид As2O4, получаемый спеканием As2O3 и As2O5 при 280оС в присутствии паров воды. Известен также газообразный монооксид AsO, образующийся при электрическом разряде в парах триоксида As при пониженном давлении.
- При растворении в воде As2O5 образует существующие только в растворе ортомышьяковистую H3AsO3, или As(OH)3, и метамышьяковистую HAsO2, или AsO(OH), кислоты, обладающие амфотерными, преимущественно кислыми, свойствами.
- По отношению к кислотам мышьяк ведет себя следующим образом:
- — с соляной кислотой мышьяк не реагирует, но в присутствии кислорода образуется трихлорид мышьяка AsCl3:
- 4As +3O2 +12HCl = 4AsCl3 +6H2O
- — разбавленная азотная кислота при нагревании окисляет мышьяк до ортомышьяковистой кислоты H3AsO3, а концентрированная азотная кислота – до ортомышьякой кислоты H3AsO4:
- 3As + 5HNO3 + 2H2O = 3H2AsO4 +5NO
Ортомышьяковая кислота (мышьяковая кислота) H3AsO4*0.
5H2O – бесцветные кристаллы; температура плавления – 36оС (с разложением); растворима в воде (88% по массе при 20оС); гигроскопична; в водных растворах – трехосновная кислота; при нагревании около 100оС теряет воду, превращаясь в пиромышьяковую кислоту H4As5O7, при более высоких температурах переходит в метамышьяковую кислоту HAsO3. Получают окислением As или As2O3 концентрированной HNO3. Она легкорастворимая в воде и по силе приблизительно равна фосфорной.
- Окислительные свойства мышьяковой кислоты заметно проявляются лишь в кислой среде. Мышьяковая кислота способна окислить HI до I2 по обратимым реакциям:
- H3AsO4 + 2HI = H3AsO3 + I2 + H2O
- Ортомышьяковистая кислота (мышьяковистая кислота) H3AsO3 существует только в водном растворе; слабая кислота; получают растворением As2O3 в воде; промежуточный продукт при получении арсенитов (III) и других соединений.
- — концентрированная серная кислота реагирует с мышьяком по следующему уравнению c образованием ортомышьяковистой кислоты:
- 2As + 3H2SO4 = 2H3AsO3 +3SO2
— растворы щелочей в отсутствие кислорода с мышьяком не реагируют. При кипячении мышьяка со щелочами он окисляется в соли мышьяковистой кислоты H3AsO3. При сплавлении со щелочами образуется арсин (мышьяковистый водород) AsH3 и арсенаты (III). Применяют AsH3
- для легирования полупроводниковых материалов мышьяком, для получения As высокой чистоты.
- Известны неустойчивые высшие арсины: диарсин As2H4, разлагается уже при -100оС; триарсин As3H5.
- Металлический мышьяк легко взаимодействует с галогенами, давая летучие галогениды AsHal3:
- As +3Cl2 = 2AsCl3
- AsCl3 – бесцветная маслянистая жидкость, дымящаяся на воздухе, при застывании образует кристаллы с перламутровым блеском.
- C F2 образует также и AsF5 — пентафторид – бесцветный газ, растворимый в воде и растворах щелочей (с небольшим количеством тепла), в диэтиловом эфире, этаноле и бензоле.
- Порошкообразный мышьяк самовоспламеняется в среде F2 и Cl2.
- С S, Se и Te мышьяк образует соответствующие халькогениды:
сульфиды — As2S5, As2S3 ( в природе – минерал аурипигмент), As4S4 (минерал реальгар) и As4S3 (минерал диморфит); селениды – As2Se3 и As4Se4; теллурид – As2Te3. Халькогениды мышьяка устойчивы на воздухе, не растворимы в воде, хорошо растворимы в растворах щелочей, при нагревании – в HNO3. Обладают полупроводниковыми свойствами, прозрачны в ИК области спектра.
С большинством металлов дает металлические соединения – арсениды. Галлия арсенид и индия арсенид – важные полупроводниковые соединения.
Известны многочисленные мышьякорганические соединения. Мышьякорганические соединения содержат связь As-C. Иногда к мышьякорганическим соединениям относят все органические соединения, содержащие As, например эфиры мышьяковистой кислоты (RO)3As и мышьяковой кислоты (RO)3AsO.
Наиболее многочисленная группа мышьякорганических соединений – производные As с координационным числом 3.
К ней относятся органоарсины RnAsH3-n, тетраорганодиарсины R2As-AsR2, циклические и линейные полиарганоарсины (RAs)n, а также органоарсонистые и диарганоарсинистые кислоты и их производные RnAsX3-n (X= OH, SH, Hal, OR’, NR2’ и др.).
Большинство мышьякорганических соединений – жидкости, полиорганоарсины и органические кислоты As – твердые вещества, CH3AsH2 и CF3AsH2 – газы. Эти соединения, как правило, растворимы в органических растворителях, ограничено растворимы в воде, в отсутствие кислорода и влаги сравнительно устойчивы. Некоторые тетраорганодиарсины на воздухе воспламеняются.
МЫШЬЯК
| О ЧЕМ НЕ ПИШУТ В УЧЕБНИКАХ |
Свойства мышьяка. Мышьяк – очень интересное вещество. Подобно фосфору, сере, углероду и многим другим элементам, он может быть получен в разных видах. Самым обыкновенным его видоизменением является металлический, или серый, мышьяк.
Это кристаллическая масса, по своему цвету похожая на сталь. Она блестит, как металл, и в 2,5 раза лучше ртути проводит электрический ток. Вместе с тем серый мышьяк хрупок. При нагревании до 615 °С он, не расплавляясь, превращается в бесцветные пары.
Для того чтобы получить мышьяк в расплавленном виде, его надо нагревать под давлением. При быстром охлаждении паров мышьяка получаются мягкие прозрачные кристаллики желтого цвета. Это желтый мышьяк.
Он напоминает желтый фосфор и подобно ему растворяется в сероуглероде, быстро окисляется на воздухе и при этом светится.
Желтый мышьяк очень неустойчив. Стоит немного нагреть его или оставить (в закрытом сосуде) на свету – и перед вами уже блестит серый мышьяк.
Если быстро нагревать последний в струе водорода или пропускать соединение мышьяка с водородом АsН3 через раскаленную стеклянную трубку, то получается черный мышьяк.
Этот его вид не окисляется на воздухе, но при 360 °С снова превращается в обыкновенный серый мышьяк.
Если нагреть серый мышьяк на воздухе до 400 °С, он воспламенится. Его пламя синеватого цвета. Горящий мышьяк распространяет вокруг себя облако очень ядовитого белого дыма, сильно пахнущего чесноком, состоящего из частичек триоксида мышьяка Аs2О3. В кислороде мышьяк сгорает, образуя ослепительно блестящее пламя. Мышьяк, особенно в виде порошка, моментально сгорает в хлоре.
И сам мышьяк, и большинство его соединений очень ядовиты. Особенной ядовитостью обладают растворимые соединения мышьяка и газообразный мышьяковистый водород АsН3.
По своему ядовитому действию соединения мышьяка располагаются в следующем порядке: наиболее ядовито газообразное соединение – мышьяковистый водород, за ним следует мышьяковистый ангидрид и соли мышьяковистой кислоты, далее мышьяковая кислота со своими солями. Завершают этот ряд веществ сульфидные соединения.
Люди, позвоночные животные, насекомые, растения, бактерии отравляются и гибнут под действием мышьяка и его соединений.
Ядовитое действие соединений мышьяка на животных и человека объясняется тем, что эти вещества нарушают деятельность частей мозга, управляющих органами кровообращения, и вызывают паралич дыхательного центра.
Мышьяк в природе. Содержание мышьяка в земной коре очень невелико – всего около одной десятитысячной доли процента. Однако его малые количества могут быть найдены почти всюду в природе: в растениях, каменном угле, морской воде, воде многих источников, в органах животных и человека.
В земной коре это вещество иногда встречается в самородном состоянии, имеет вид металлически блестящих серых скорлупок или плотных масс, состоящих из маленьких зернышек. В России такой мышьяк встречается на Урале.
Гораздо чаще можно найти минералы, представляющие собой соединения мышьяка.
Довольно часто встречаются два природных соединения мышьяка с серой: оранжево-красный прозрачный реальгар АsS и лимонно-желтый аурипигмент Аs2S3.
Одна из наиболее распространенных руд мышьяка – мышьяковый колчедан (арсенопирит) – представляет собой минерал FeS2•FeAs2, или FeAsS. Иногда арсенопирит содержит серебро и золото, и его месторождения разрабатываются для добычи этих металлов.
Краткая история мышьяка. Знакомство человечества с веществами, содержащими в своем составе мышьяк, началось очень давно. Мы точно не знаем, когда люди впервые познакомились со свойствами соединений мышьяка.
Известно, что уже в глубокой древности его природные соединения использовали для приготовления красок и лечебных снадобий. В Китае с давних времен соединения мышьяка применялись для уничтожения вредных насекомых и грызунов.
Упоминание о реальгаре, который был тогда известен под названием сандарака, находим в сочинениях древнегреческого ученого Аристотеля и его ученика Теофраста. Там же мы узнаем об арсениконе (по-гречески «арсен» – сильный), названном так из-за сильной ядовитости. Древние римляне назвали этот минерал аурипигмент, т.к.
он имеет золотистый цвет (по-латыни «аурум» – золото, «пигментум» – краска). Греческий врач Диоскорид в I в. н. э. описал способ получения триоксида мышьяка Аs2O3 путем обжигания аурипигмента.
Золотистый цвет аурипигмента привлек внимание средневековых алхимиков в их настойчивых поисках веществ, из которых они надеялись добыть золото. Продукт прокаливания сульфидных руд мышьяка также был известен алхимикам. Они дали ему название «белый мышьяк», которое используется до сих пор для обозначения триоксида мышьяка.
Открытие так называемого металлического мышьяка (серого мышьяка) приписывают знаменитому средневековому алхимику Альберту Великому, жившему в XIII в. Однако гораздо ранее греческие и арабские алхимики умели получать мышьяк в свободном виде, нагревая «белый мышьяк» с различными органическими веществами.
Алхимики знали, конечно, и о ядовитых свойствах мышьяковистых соединений.
Известный своеобразными чертами своего характера, оригинальными взглядами, многочисленностью и разнообразием своих сочинений, а также своей изменчивой судьбой, Парацельс положил начало применению соединений мышьяка в медицинской практике.
Несмотря на то, что металлический мышьяк был известен уже Альберту Великому и даже до него, прошли века, прежде чем выяснилось, что это простое вещество, а «белый мышьяк» представляет собой соединение мышьяка с кислородом. Доказал это в 1789 г. А.Л.Лавуазье, присвоивший веществу латинское название «арсеникум».
Получение и применение мышьяка из его соединений. Для получения металлического мышьяка чаще всего нагревают арсенопирит в муфельных печах без доступа воздуха.
При этом освобождается мышьяк, пары которого превращаются в твердый мышьяк в железных трубках, идущих от печей, и в особых керамиковых приемниках. Остаток в печах потом нагревают при доступе воздуха, и тогда мышьяк превращается в Аs2O3.
Металлический мышьяк получается в довольно незначительных количествах, и главная часть мышьякоcодержащих руд перерабатывается в белый мышьяк, т.е. в триоксид мышьяка – мышьяковистый ангидрид Аs2О3.
- Мышьяковая кислота Н3AsO4 и ее соли значительно менее ядовиты по сравнению с Аs2O3 и солями мышьяковистой кислоты. Мышьяковая кислота получается путем окисления различными способами триоксида мышьяка:
- Аs2О3 + 2O + 3H2O = 2Н3АsO4.
- Она применяется в некоторых случаях в химической лабораторной практике при получении органических соединений и в промышленности – для изготовления красителей и в качестве протравы при крашении.
Сульфидные соединения мышьяка – аурипигмент и реальгар – используются в живописи в качестве красок и в кожевенной отрасли промышленности в качестве средств для удаления волос с кожи. В пиротехнике реальгар употребляется для получения «греческого», или «индийского», огня, возникающего при горении смеси реальгара с серой и селитрой (ярко-белое пламя).
Уже со времени Парацельса известно, что очень небольшие количества соединений мышьяка могут оказывать благоприятное влияние на те живые организмы, которые под действием более значительных доз этих веществ испытывают повреждения и даже гибнут.
Лошади, получающие в пище небольшие количества соединений мышьяка, оказываются более других способными к усиленной работе и лучше выглядят. Известно также, что люди, привыкшие к восприятию мышьяковых соединений, отличаются здоровьем и телесной крепостью.
В качестве примера часто приводят жителей северо-западной части Штирии, работающих в районе расположения мышьяковых руд.
Это обстоятельство находит свое объяснение в том, что небольшие количества соединений мышьяка усиливают работу кроветворных органов и способствуют повышению усвоения азота и фосфора.
Многие из мышьяковых соединений применяются в качестве лекарств для борьбы с малокровием и рядом тяжелых заболеваний. Из неорганических соединений мышьяка мышьяковистый ангидрид применяется в медицине для приготовления пилюль и в зубоврачебной практике в виде пасты как некротизирующее лекарственное средство.






