- Общая характеристика
- Природные соединения
- Получение
- Химические свойства
- Оксиды щелочноземельных металлов
- Получение
- Химические свойства
- Гидроксиды щелочноземельных металлов
- Получение
- Химические свойства
- Жесткость воды
- Металлы II группы главной подгруппы (Be, Mg, Ca, Sr, Ba)
- Бериллий (Beryllium)
- Магний (Magnesium)
- Щелочноземельные элементы
- Радий
- Общие химические свойства
- II группа главная подгруппа Периодической таблицы Менделеева (щелочноземельные металлы)
- Взаимодействие со сложными веществами
- Открытый урок по теме металлы 2 группы
- 2.2.2. Химические свойства металлов IIA группы
- Взаимодействие с простыми веществами
- с кислородом
- с галогенами
- с неметаллами IV–VI групп
- с водородом
- Взаимодействие со сложными веществами
- с водой
- c кислотами-неокислителями
- c кислотами-окислителями
- − разбавленной азотной кислотой
- − концентрированной азотной кислотой
- − концентрированной серной кислотой
- с щелочами
- с оксидами
К щелочноземельным металлам относятся металлы IIa группы: бериллий, магний, кальций, стронций, барий и радий. Отличаются легкостью, мягкостью и сильной реакционной способностью.
Общая характеристика
От Be к Ra (сверху вниз в периодической таблице) происходит увеличение: атомного радиуса, металлических, основных, восстановительных свойств, реакционная способность. Уменьшается электроотрицательность, энергия ионизация, сродство к электрону.
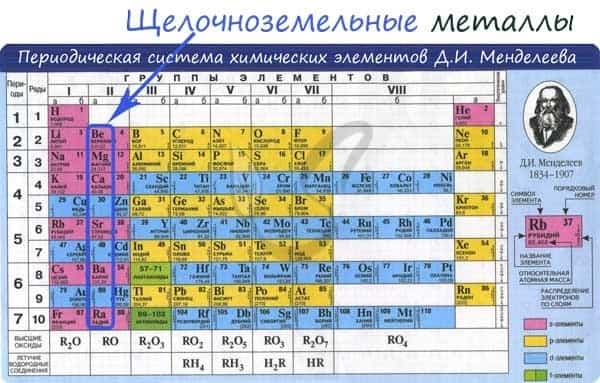
Электронные конфигурации у данных элементов схожи, так как они находятся в одной группе (главной подгруппе!), общая формула ns2:
- Be — 2s2
- Mg — 3s2
- Ca — 4s2
- Sr — 5s2
- Ba — 6s2
- Ra — 7s2
Природные соединения
В природе щелочноземельные металлы встречаются в виде следующих соединений:
- Be — BeO*Al2O3*6SiO2 — берилл
- Mg — MgCO3 — магнезит, MgO*Al2O3 — шпинель, 2MgO*SiO2 — оливин
- Ca — CaCO3 — мел, мрамор, известняк, кальцит, CaSO4*2H2O — гипс, CaF2 — флюорит

Получение
Это активные металлы, которые нельзя получить электролизом раствора. С целью их получения применяют электролиз расплавов, алюминотермию и вытеснением их из солей другими более активными металлами.
- MgCl2 → (t) Mg + Cl2 (электролиз расплава)
- CaO + Al → Al2O3 + Ca (алюминотермия — способ получения металлов путем восстановления их оксидов алюминием)
- MgBr2 + Ca → CaBr2 + Mg

Химические свойства
- Реакции с водой
- Реакции с кислотами
- Реакции с неметаллами
- Mg + O2 → MgO (оксид магния)
- Ca + I2 → CaI2 (йодид кальция)
- При нагревании реагируют с серой, азотом, водородом и углеродом.
- Mg + S → (t) MgS (сульфид магния)
- Ca + N2 → (t) Ca3N2 (нитрид кальция)
- Ca + H2 → (t) CaH2 (гидрид кальция)
- Ba + C → (t) BaC2 (карбид бария)
- С оксидами других металлов
Все щелочноземельные металлы (кроме бериллия и магния) реагируют с холодной водой с образованием соответствующих гидроксидов. Магний реагирует с водой только при нагревании. Ca + H2O → Ca(OH)2 + H2↑ 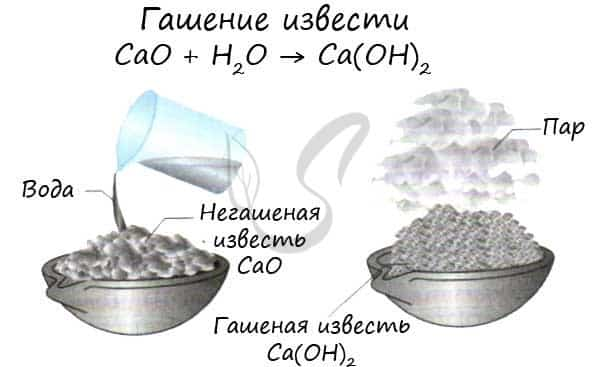
Щелочноземельные металлы — активные металлы, стоящие в ряду активности левее водорода, и, следовательно, способные вытеснить водород из кислот: Ba + HCl → BaCl2 + H2
Хорошо реагируют с неметаллами: кислородом, образуя оксиды состава RO, с галогенами (F, Cl, Br, I). Степень окисления у щелочноземельных металлов постоянная +2.

Ba + TiO2 → BaO + Ti (барий, как более активный металл, вытесняет титан)
Оксиды щелочноземельных металлов
Имеют общую формулу RO, например: MgO, CaO, BaO.
Получение
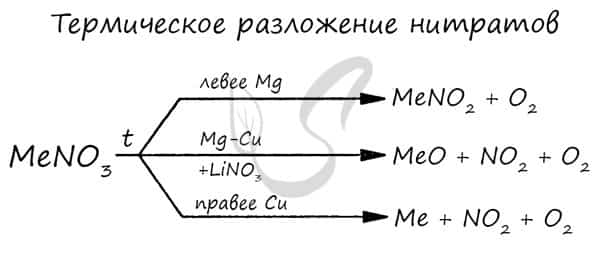
- Оксиды щелочноземельных металлов можно получить путем разложения карбонатов и нитратов:
- MgCO3 → (t) MgO + CO2
- Ca(NO3)2 → (t < 560°C) Ca(NO2)2 + O2
- Ca(NO3)2 → (t > 560°C) CaO + O2 + NO2
- Рекомендую взять на вооружение общую схему разложения нитратов:
Химические свойства
Проявляют преимущественно основные свойства, все кроме BeO — амфотерного оксида.
- Реакции с кислотами и кислотными оксидами
- BaO + HCl → BaCl2 + H2O
- CaO + H2SO4 → CaSO4 + H2O
- MgO + SO3 → MgSO4
- CaO + CO2 → CaCO3
- CaO + SiO2 → CaSiO3
- Реакция с водой
- В нее вступают все, кроме оксида бериллия.
- CaO + H2O → Ca(OH)2
- MgO + H2O → Mg(OH)2
- Амфотерный оксид бериллия
- BeO + HCl → BeCl2 + H2O
- BeO + NaOH + H2O → Na2[Be(OH)4] (тетрагидроксобериллат натрия)
- Если реакция проходит при высоких температурах (в расплаве) комплексная соль не образуется, так как происходит испарение воды:
- BeO + NaOH → Na2BeO2 + H2O (бериллат натрия)
- BeO + Na2O → Na2BeO2
Амфотерные свойства оксида бериллия требуют особого внимания. Этот оксид проявляет двойственные свойства: реагирует с кислотами с образованием солей, и с основаниями с образованием комплексных солей.
Гидроксиды щелочноземельных металлов
Проявляют основные свойства, за исключением гидроксида бериллия — амфотерного гидроксида.
Получение
Получают гидроксиды в реакции соответствующего оксида металла и воды (все кроме Be(OH)2)
CaO + H2O → Ca(OH)2
Химические свойства
- Основные свойства большинства гидроксидов располагают к реакциям с кислотами и кислотными оксидами.
- Ba(OH)2 + H2SO4 → BaSO4↓ + H2O
- Ca(OH)2 + 2CO2 → Ca(HCO3)2
- Ca(HCO3)2 + Ca(OH)2 → CaCO3 + H2O + CO2
- Ca(OH)2 + CO2 → CaCO3↓ + H2O

- Реакции с солями (и не только) идут в том случае, если соль растворимы и по итогам реакции выделяется газ, выпадает осадок или образуется слабый электролит (вода).
- Ba(OH)2 + Na2SO4 → BaSO4↓ + NaOH
- Гидроксид бериллия относится к амфотерным: проявляет двойственные свойства, реагируя и с кислотами, и с основаниями.
- Be(OH)2 + HCl → BeCl2 + H2O
- Be(OH)2 + NaOH → Na2[Be(OH)4]
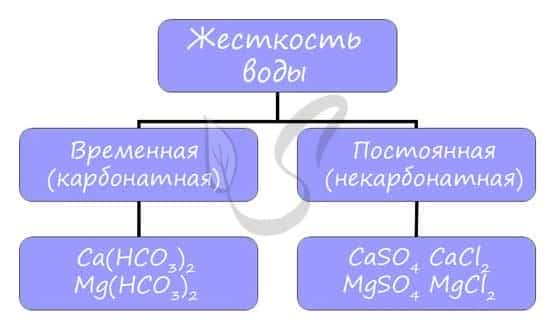
Жесткость воды
Жесткостью воды называют совокупность свойств воды, зависящую от присутствия в ней преимущественно солей кальция и магния: гидрокарбонатов, сульфатов и хлоридов.
Различают временную (карбонатную) и постоянную (некарбонатную) жесткость.
- Вероятно, вы часто устраняете жесткость воды у себя дома, осмелюсь предположить — каждый день. Временная жесткость воды устраняется обычным кипячением воды в чайнике, и известь на его стенках — CaCO3 — бесспорное доказательство устранения жесткости:
- Ca(HCO3)2 → CaCO3↓ + CO2 + H2O
- Также временную жесткость можно устранить, добавив Na2CO3 в воду:
- Ca(HCO3)2 + Na2CO3 → CaCO3↓ + NaHCO3
- С постоянной жесткостью бороться кипячением бесполезно: сульфаты и хлориды не выпадут в осадок при кипячении. Постоянную жесткость воды устраняют добавлением в воду Na2CO3:
- CaCl2 + Na2CO3 → CaCO3↓ + NaCl
- MgSO4 + Na2CO3 + H2O → [Mg(OH)]2CO3↓ + CO2↑ + Na2SO4
Жесткость воды можно определить с помощью различных тестов. Чрезмерно высокая жесткость воды приводит к быстрому образованию накипи на стенках котлов, труб, чайника.

Металлы II группы главной подгруппы (Be, Mg, Ca, Sr, Ba)
В главную подгруппу второй группы периодической системы элементов наряду с семейcтвом щёлочноземельных металлов (оно включает близкие по свойствам кальций, стронций, барий и радий) входят два типических элемента – бериллий и магний.
Если магний по свойствам во многом тяготеет к щёлочноземельным элементам, то бериллий стоит как бы особняком. Кажется, что он попал в эту группу, лишь подчиняясь правилу валентности, поскольку, как и другие элементы группы, в своих соединениях двухвалентен.
По свойствам же бериллий гораздо ближе к алюминию, расположенному по диагонали от него в третьей группе. Химики так и говорят: диагональное сходство двух элементов. Причём сходство настолько сильное, что и встречаются эти элементы часто вместе, в одном соединении.
Бериллий (Beryllium)
 Бериллий
Бериллий
Многие минералы бериллия – берилл 3BeO∙Al2O3∙6SiO2, хризоберилл BeAl2O4 и их разновидности (изумруд, аквамарин, александрит) – известны очень давно; эти драгоценные камни упоминаются в произведениях античных авторов. На Руси берилл называли вируллионом, под таким именем он встречается в Изборнике Святослава (1073 г.). Ученые заинтересовались бериллом лишь в конце XVIII в. Французский химик Луи Никола Воклен установил, что в состав этого минерала входит новая «земля» (так в старину называли некоторые оксиды металлов), отличная от алюмины – оксида алюминия. Он же впервые получил ее соли – соли бериллия. Они оказались сладкими на вкус, поэтому новой земле Воклен дал имя глицина (от греч. «гликис» — «сладкий»), а элементу – глициний. Это название употреблялось во Франции вплоть до XIX в., пока немецкий химик Мартин Генрих Клапрот не добился переименования его в бериллий (Berillium) – в честь минерала берилла.
В виде простого вещества бериллий получили в 1828 г. немецкий ученый Фридрих Вёлер и французский химик Антуан Бюсси. Они действовали калием на безводный хлорид бериллия: BeCl2 + 2K = Be + 2KCl.
В настоящее время бериллий получают, восстанавливая его фторид магнием: BeF2 + Mg = Be + MgF2, либо электролизом расплава смеси хлоридов бериллия и натрия.
Исходные соли бериллия выделяют при переработке бериллиевой руды.
 Берилл
Берилл
Бериллий — тугоплавкий металл(tпл= 1287 ̊ С) светло-серого цвета, покрытый тончайшей пленкой оксида, которая защищает его от коррозии. Для него характерно уникальное в мире металлов сочетание легкости с высокой твердостью. Чистый бериллий пластичен, однако даже незначительные примеси делают его хрупким.
Обладая высокой химической активностью, бериллий легко вступает в реакции с галогенами, серой и азотом.
Вода на него не действует, зато он легко растворяется как в разбавленных кислотах: Be + 2HCl = BeCl2 + H2↑, так и в растворах щелочей: Be + 2NaOH + 2H2O = Na2[Be(OH)4] + H2↑ Образующийся тетрагидроксобериллат натрия долгое время рассматривали как соль бериллиевой кислоты H2BeO2.
На самом деле это комплексное соединение. Бериллаты более простого состава образуются при сплавлении оксида бериллия со щелочью или содой: Na2CO3 + BeO = Na2BeO2 + CO2↑. Здесь также проявляется сходство с алюминием.
Бериллий и его растворимые в воде соли ядовиты. Даже ничтожно малая их примесь в воздухе приводит к тяжелым заболеваниям. Несмотря на это, бериллий находит широкое применение в технике. Ещё в XIX в.
обнаружили, что добавка Ве к меди сильно повышает ее твердость, прочность, химическую стойкость, делает ее похожей на сталь. Сплавы на основе меди, содержащие от 0,005 до 3% бериллия, получили название бериллиевых бронз. Из них изготовляют пружины, рессоры, подшипники, наиболее ответственные узлы машин и механизмов.
В качестве легирующей добавки, значительно усиливающей прочность, бериллий вводят в состав сталей и некоторых других сплавов.
Основной потребитель бериллия – атомная энергетика, поскольку он обладает способностью отражать и замедлять нейтроны, образующиеся в ядерном реакторе. Отражатели нейтронов из бериллия отличаются высокой прочностью, химической стойкостью и легкостью. Потребность в этом металле и его добыча возрастает с каджым годом.
Магний (Magnesium)
 Магний
Магний
Магний весьма распространен в природе. В больших количествах он встречается в виде карбоната магния, образуя минералы магнезит MgCO3 и доломит MgCO3∙CaCO3. Сульфат и хлорид магния входят в состав калийных минералов – каинита KCl∙MgSO4∙3H2O и карналлита KCl∙MgCl2∙6H2O. Ион Mg2+ содержится в морской воде, придавая ей горький вкус. Общее количество магния в земной коре составляет около 2%.
Магний был открыт при анализе воды, взятой из минерального источника вблизи города Эпсом в Англии. Горькая на вкус, она привлекла внимание исследователей в конце XVII в.
При упаривании такой воды на стенках сосуда образовалась белая корка вещества, которое назвали горькой, или эпсомской, солью MgSO4∙7H2O. Её использовали в качестве слабительного. Примерно в то же время учёные заинтересовались и белой магнезией – карбонатом магния MgCO3.
При его нагревании образуется жженая магнезия – оксид MgO. Это вещество А.Л.Лавуазье ошибочно причислил к простым телам, которые уже не могут быть далее разложены.
Впервые магний был получен в 1808 г. Г.Дэви при электролизе влажной жжёной магнезии. По его предложению, элемент вначале назвали Magnium – чтобы подчеркнуть связь с магнезией и в то же время отличать его от марганца, который тогда называли Manganesium. Позже магний переименовали в Magnesium, а марганец — в Manganum. Однако в русском языке сохранилось первоначальное название элемента.
 Каинит
Каинит
В некотором смысле магний – противоположность бериллию. Он достаточно мягкий и пластичный, плавится при более низкой температуре (650̊ С). Но, как и бериллий, он обладает заметной химической активностью.
На воздухе стружка магния сгорает с ослепительной вспышкой с образованием белого порошка – смеси оксида и нитрида:2Mg + O2 = 2MgO; 3Mg + N2 = Mg3N2.
Недаром магниевую ленту фотографы использовали как фотовспышку.
При комнатной температуре магний, покрытый тончайшей пленкой оксида, достаточно инертен и не взаимодействует с водой. Лишь при кипячении он медленно восстанавливает воду с образованием белой взвеси гидроксида магния и выделением водорода: Mg + 2H2O = Mg(OH)2↓ + H2↑.
Магний легко взаимодействует не только с разбавленными кислотами, но и с раствором хлорида аммония, в котором из-за гидролиза этой соли присутствуют ионы Н+: Mg + 2NH4Cl = MgCl2 + 2NH3 + H2. В отличие от бериллия, со щелочами он не реагирует.
Магний — сильный восстановитель. Смеси его со многими окислителями, например пероксидом бария ВаО2, используют в пиротехнике. При поджигании такая смесь сгорает ярким зеленоватым пламенем:BaO2 + Mg = MgO + BaO. Магний присутствует в животных и растительных организмах. В теле человека его в среднем 19 г. Особенно он необходим растениям, так как является составной частью хлорофилла.
В технике магний применяется главным образом в виде сплавов с алюминием – магналия и электрона. Магналий содержит от 5 до 30% магния, а электрон помимо алюминия включает также, цинк, марганец, медь.
Эти сплавы очень прочные и намного тверже чистых алюминия и магния, легко обрабатываются и полируются. Их используют в автомобильной промышленности, авиационной и ракетной технике.
Некоторые соединения магния нашли применение в медицине: оксид магния служит средством понижения кислотности желудка, а кристаллогидрат сульфата магния – слабительным.
Щелочноземельные элементы
 Кальций
Кальций
К семейству щелочноземельных элементов относятся кальций, стронций, барий и радий. Д.И.Менделеев включал в это семейство и магний. Щелочноземельными они называются потому, что их гидроксиды, подобно гидроксидам щелочных металлов, растворимы в воде, т.е. являются щелочами.
Название «кальций» происходит от латинского calx – «известь». Так алхимики называли продукты обжига различных веществ. Древние римляне использовали известь для приготовления строительных растворов. Для этого мрамор или известняк подвергали обжигу, получая негашеную известь (оксид кальция). Производство этого вещества описал еще Плиний Старший в «Естественной истории».
По распространенности в земной коре кальций занимает пятое место (4,1% по массе), уступая лишь кислороду, кремнию, алюминию и железу.
В природе он встречается в виде гипса CaSO4∙2H2O, флюорита CaF2, апатита Ca5(PO4)3(OH) и кальцита CaCO3(карбоната кальция, образующего залежи мела, мрамора и известняка).
Кальцит сформировался из панцирей древних простейших и моллюсков (кораллов), поэтому неудивительно, что иногда в известняках находят ракушки или отпечатки животных.
 Гипс
Гипс
В организме человека содержится в среднем около 1 кг кальция, который в форме ортофосфата входит в состав костной ткани. Почти 80% потребности в этом элементе удовлетворяется за счёт молочных продуктов.
В них кальций присутствует в виде солей фосфорной и лимонной кислот. В литре молока или кефира как раз и содержится средняя суточная норма – 1,2 г кальция.
При его недостатке в организме врачи назначают его препараты, например глюконат кальция.
Металлический кальций был впервые получен Г.Дэви в 1808 г. при электролизе смеси влажной гашенной извести Са(ОН)2 с оксидом ртути HgO.
Стронций и барий распространены в природе значительно меньше, чем кальций. Стронций встречается в виде минерала целестина (от лат. caelestis – «небесный») – сульфата стронция SrSO4, образующего красивые розово-красные или бледно-голубые кристаллы, а барий – в виде барита (тяжелого шпата) BaSO4.
Стронций получил название от шотландской деревни Стронциан, близ которой в конце XVIII в. был найден редкий минерал стронцианит SrCO3.
 Стронций
Стронций
Годом открытия бария можно считать 1774 г., когда шведский химик Карл Вильгельм Шееле и его ученик Юхан Готлиб Ган установили, что в тяжелом шпате содержится новая земля. Она получила название «барит» (от греч. «барис» — «тяжелый»), а образующий ее элемент – «барий». В виде простых веществ барий и стронций были выделены Г.Дэви в 1808 г.
С пищей и питьевой водой человек ежедневно получает около 15-20 мг стронция. В большом количестве соединения этого элемента вредны для здоровья. Ионы стронция способны замещать в костях ионы кальция, что приводит к болезням.
Растворимые соединения бария еще более токсичны. Симптомы отравления ими появляются при приёме внутрь примерно 0,2 г растворимой соли. А доза 0,8-0,9 г уже смертельна. В случае отравления надо принимать 10-процентный раствор сульфата натрия или магния. При этом в организме образуется сульфат бария – нерастворимый и потому безопасный.
Кальций (tпл = 839̊ С), стронций (tпл = 768 ̊С) и барий (tпл = 727 ̊С) – пластичные металлы серебристо – белого цвета. Из-за недостаточной твёрдости их невозможно резать ножом, как натрий и калий.
 Минерал целестин
Минерал целестин
Щёлочноземельные металлы по химической активности уступают лишь щелочным. Они взаимодействуют с водой и растворами кислот с выделением водорода.
Если оксид бария выдерживать в атмосфере кислорода или на воздухе при температуре 500 ̊С то реакция будет протекать дальше:2Ва + О2 = 2ВаО2
Образовавшийся пероксид бария при 700 ̊С отщепляет избыточный кислород, вновь переходя в оксид.
Щёлочноземельные металлы выделяют либо алюмотермией: 4CaO + 2Al = CaAl2O4 + 3Ca, либо электролизом расплавов хлоридов.
Практическое значение из них имеет в основном кальций – он используется в металлургии в качестве раскислителя. Соединения кальция, стронция и бария применяются в разных отраслях промышленности, в строительстве.
Соединения стронция используются в производстве осветительных ракет, химического и термически устойчивого стекла. Оксид стронция входит в состав эмалей для защиты металлических предметов, а также служит катализатором при переработке нефти.
 Барий
Барий
Очень полезным веществом оказался сульфат бария. В конце XIX в. им разбавляли дорогие свинцовые белила, а ныне на основе BaSO4 разработана белая краска литопон, обладающая высокой кроющей способностью, что снижает ее расход. Сульфат бария также добавляют в бумагу дорогих сортов (для денежных знаков, документов).
Как и другие элементы с высоким порядковым номером, барий способен поглощать рентгеновское излучение. Поэтому BaSO4 используется при изготовлении защитных материалов для рентгеновских установок и при диагностике заболеваний желудочно-кишечного тракта.
Радий
Последним из щёлочноземельных металлов был открыт радий, для которого ещё Д.И.Менделеев выделил клетку в периодической системе. Радий обнаружили в 1898 г. в урановой смоляной руде.
Исследовавшие минерал супруги Пьер и Мария Кюри установили: некоторые образцы руды имеют большую радиоактивность, чем следовало ожидать, судя по количеству содержащегося в них урана. Учёные сделали вывод, что в состав урановой руды входит новый элемент, по радиоактивности превосходящий уран.
Вскоре удалось выделить его соединение. Элемент назвали радием, чтобы подчеркнуть его способность к радиоактивному распаду. Переработав почти тонну урановой руды, супруги Кюри выделили около 0,1 г соли радия, а металлический радий был получен в 1910 г. при электролизе раствора хлорида радия с ртутным катодом.
Радий представляет собой тяжелый и тугоплавкий металл серебристо-белого цвета. В свободном виде он, как и другие щелочноземельные металлы, обладает высокой химической активностью, энергично реагирует с водой с выделением водорода: Ra + 2H2O = Ra(OH)2 + H2↑.
Образующийся при этом гидроксид радия – сильное основание, хорошо растворимое в воде. При действии на него раствором сульфата натрия выпадает белый осадок сульфата радия, нерастворимый в кислотах.
Общие химические свойства
- По химическим свойствам щелочноземельные металлы очень похожи на щелочные металлы, а магний имеет существенные отличия.
- Во всех реакция магний и щелочноземельные металлы играют роль восстановителей и окисляются с образованием различных ионных соединений, содержащих ионы этих металлов с зарядом +2.
- Щелочноземельные металлы уже при обычных условиях окисляются кислородом воздуха, а магний сгорает на воздухе при нагревании до 600 ̊ С; в результате образуются оксиды:
- 2Ca + O2 = 2CaO; 2Mg + O2 = 2MgO
- Все рассматриваемые металлы при определенных условиях взаимодействуют с галогенами, серой, азотом, водородом:
- Ca + Cl2 = CaCl2 Mg + Cl2 = MgCl2
- Ca + S = CaS Mg + S = MgS
- 3Ca + N2 = Ca3N2 3Mg + N2 = Mg3N2
- Ca + H2 = CaH2 Mg + H2 = MgH2
- Щелочноземельные металлы активно реагируют с водой, а магний реагирует только с кипящей водой:
Реакция кальция с водой
- Ca + 2H2O = Ca(OH)2 + H2↑
- Mg + 2H2O = Mg(OH)2 + H2↑
- Щелочноземельные металлы и магний энергично вытесняют водород из кислот:
- Ca + 2HCl = CaCl2 + H2↑
- Mg + H2SO4 = MgSO4 + H2↑
II группа главная подгруппа Периодической таблицы Менделеева (щелочноземельные металлы)
- К щелочноземельным металлам относят химические элементы: двувалентные металлы, составляющие IIА группу:
- Бериллий Be
- магний Mg
- кальций Ca,
- стронций Sr,
- барий Ba и
- радий Ra.
- Хотя бериллий Be по свойствам больше похож на алюминий, а магний Mg проявляет некоторые свойства щелочноземельных металлов, но в целом отличается от них.
- Все щелочноземельные металлы — вещества серого цвета и гораздо более твердые, чем щелочные металлы.
Бериллий Be устойчив на воздухе. Магний и кальций (Mg и Ca) устойчивы в сухом воздухе. Стронций Sr и барий Ba хранят под слоем керосина.
От Be к Ra (сверху вниз в периодической таблице) происходит увеличение:
- атомного радиуса,
- металлических, основных, восстановительных свойств,
- реакционной способности.
Уменьшается
- электроотрицательность,
- энергия ионизация,
- сродство к электрону.
- Электронные конфигурации у данных элементов схожи, все они содержат 2 электрона на внешнем уровне ns2:
- Be — 2s2
- Mg —3s2
- Ca — 4s2
- Sr — 5s2
- Ba — 6s2
- Ra — 7s2
Как правило, щелочноземельные металлы в природе присутствуют в виде минеральных солей: хлоридов, бромидов, йодидов, карбонатов, нитратов и др.
Основные минералы, в которых присутствуют щелочноземельные металлы:
Магний
- Магний получают электролизом солей, чаще всего хлоридов: расплавленного карналлита (KCl·MgCl26H2O) или хлорида магния с добавками хлорида натрия при 720–750°С:
MgCl2 → Mg + Cl2
- восстановлением прокаленного доломита в электропечах при 1200–1300°С:
- 2(CaO · MgO) + Si → 2Mg + Ca2SiO4
- Кальций
- Кальций получают электролизом расплавленного хлорида кальция с добавками фторида кальция:
- CaCl2 → Ca + Cl2
- Барий
- Барий получают алюмотермическим способом — восстановление оксида бария алюминием в вакууме при 1200 °C:
- 4BaO+ 2Al → 3Ba + Ba(AlO2)2
Качественные реакции
- Окрашивание пламени солями щелочных металлов
Цвет пламени:
- Ca — кирпично-красный
- Sr — карминово-красный (алый)
- Ba — яблочно-зеленый
- Взаимодействие с веществами:
- С кислородом
- С кислородом взаимодействуют при нагревании с образованием оксидов
- 2Сa + O2 → 2CaO
- Видео Горение кальция
- С галогенами
- (F, Cl, Br, I)
- Щелочноземельные металлы реагируют с галогенамипри нагревании с образованием галогенидов .
- Сa + Cl2→ 2СaCl2
- С водородом
- Щелочноземельные металлы реагируют с водородом при нагревании с образованием гидридов:
- Сa + H2 СaH2
- Бериллий с водородом не взаимодействует.
- Магний реагирует только при повышенном давлении:
- Mg + H2 → MgH2
- С серой
- Щелочноземельные металлы при нагревании взаимодействуют с серой с образованием сульфидов сульфидов:
- Сa + S СaS
- Ca + 2C → CaC2 (карбиды)
- С азотом
- При комнатной температуре с азотом взаимодействует только магний с образованием нитрида:
- 6Mg + 2N2 → 2Mg3N2
- Остальные щелочноземельные металлы реагируют с азотом при нагревании.
- С углеродом
- Щелочноземельные металлы реагируют с углеродом с образованием карбидов, преимущественно ацетиленидов:
- Ca + 2C → CaC2
- Бериллий при нагревании с углеродом с образует карбид — метанид:
- 2Be + C → Be2C
- С фосфором
- Щелочноземельные металлы при нагревании взаимодействуют с фосфором с образованием фосфидов:
- 3Сa + 2P Сa3 P2
Взаимодействие со сложными веществами
- С водой
- Кальций, стронций и барий взаимодействуют с водой при комнатной температуре с образованием щелочи и водорода:
- Sr + 2H2O → Sr(OH)2 + H2↑,
- Магний реагирует с водой при кипячении, а бериллий с водой не реагирует.
- С кислотами
- С растворами HCl, H2SO4, H3PO4 щелочноземельные металлы взаимодействуют с образованием соли и выделением водорода:Са + H2SO4(разб)= СаSO4 + H2
- С кислотами-окислителями (HNO3 и конц. H2SO4):
- с концентрированной серной:
- 4Ca + 10H2SO4(конц) → 4CaSO4 + H2S↑ + 5H2O;
- с разбавленной и концентрированной азотной:
- 4Sr + 10HNO3(конц) → 4Sr(NO3)2 + N2O +5H2O
- С водными растворами щелочей
- В водных растворах щелочей растворяется только бериллий:
- Be + 2NaOH + 2H2O → Na2[Be(OH)4] + H2
- С солями
- В расплаве щелочноземельные металлы могут взаимодействовать с некоторыми солями:
- Ca + CuCl2 → CaCl2 + Cu
Запомните! В растворе щелочноземельные металлы взаимодействуют с водой, а не с солями других металлов.
- С оксидами
- Щелочноземельные металлы могут восстанавливать из оксидов такие неметаллы как кремний, бор, углерод:
- 2Ca + SiO2 → 2CaO + Si
- Магний сгорает в атмосфере углекислого газа с образованием оксида магния и сажи (С):
- 2Mg + CO2 → 2MgO + C
Открытый урок по теме металлы 2 группы
- Открытый урок по теме
- «Берилий,
Магний и Щелочноземельные металлы» - Класс
9 - Форма
проведения: урок усвоения нового материала - Тип
урока: - комбинированный.
- Цели
урока: - ·
Познакомить со свойствами элементов II группы, главной
подгруппы, их соединениями и основными областями применения.
·
Развивать умения анализировать, сравнивать, предполагать свойства
металлов, опираясь на знания об особенностях строения атомов химических
элементов. Расширять кругозор, обогащать словарный запас.
- ·
Воспитывать интерес к химии как науке, сознательное отношение к
химическим знаниям. - Технические средства :
- ·
карточки с тривиальными названиями химических веществ; - ·
компьютер, мультимедийный проектор - ·
учебные диски: «Виртуальная лаборатория», «Химия элементов»; - ·
образцы металлов (натрий, магний, кальций); - ·
задания к кроссворду на каждую парту по одному экземпляру. - Задачи:
- ·
Обеспечить усвоение учащимися на уровне восприятия, осмысления и
первичного запоминания состава, строения, свойств, применения углерода и его
соединений; закрепить знания учащихся об аллотропии. - ·
Формирование базовых компетентностей современного
человека:
– информационной (умение искать,
анализировать, преобразовывать, принимать информацию для решения проблем);
– самоорганизации (освоение новых видов
деятельности, приобретение собственного опыта оценивания);
– коммуникативной культуре (умению
сотрудничать). - Ход
урока: - I Этап
Организационный момент. - II Этап
Актуализация знаний. - Проверка
домашнего задания (два ученика у доски): - №1 а,
с.58 – решает 1 ученик;
№1 б,
с.58 – решает 2 ученик.
- Игра «
Найди пару» (работа с классом). - Соотнести
технические названия веществ с их формулами. - Формулы
выписаны в столбик на доске, а названия вразброс на карточках, прикрепляемых к
доске магнитами с обратной стороны. - На
доске формулы (записаны в столбик): NaOH; NaCl; Na2SO4*10H2O ;KOH; NaHCO3;Na2CO3*10H2O ;K2CO3. - На
карточках: едкий натр, едкий кали, поваренная соль, кристаллическая сода,
пищевая сода, глауберова соль, поташ. - Попутно,
по мере соотнесения формул и названий, необходимо называть область применения
данных веществ. - Итог:
- С
солями и гидроксидами каких металлов мы работали? - Что
общего в строении щелочных металлов? - Почему
их хранят под слоем керосина? - Перечислите
их физические свойства. - Как
они изменяются с увеличением порядкового номера? - Перечислите
основные химические свойства щелочных металлов.
Учитель демонстрирует образец металла
натрия; его взаимодействие с водой .Учащиеся обобщают знания о физических
свойствах и химической активности щелочных металлов .
III
Этап Изучение нового материала.
Самостоятельная
работа учащихся в рабочих тетрадях:
№2,
с.49.
- С
какими химическими элементами вы работали? - Где
они все располагаются? - Сообщение
темы. - Тема
нашего урока так и называется: «Бериллий, магний и щелочноземельные металлы». - Физические
свойства металлов II группы, главной подгруппы, нахождение в природе;
строение ЩЗМ, бериллия, магния. - Демонстрируются образцы металлов,
имеющиеся в лаборатории (магний и кальций)
Объяснение
учителя: казалось, все эти элементы находятся в одной группе, в
главной подгруппе, но по какой-то причине магний и бериллий к группе
щелочноземельных металлов (ЩЗМ) не относят?! Оказывается, если магний по
свойства во многом тяготеет к ЩЗМ, то бериллий стоит как бы особняком. По
свойствам он ближе к алюминию, расположенному по диаганали от него в III(А) группе.
По какой причине не относят к ЩЗМ магний мы узнаем сегодня чуть позже.
- Далее заслушиваются выступления учащихся
(заранее заготовленное домашнее задание) о физических свойствах данных металлов
их применении, истории открытия, нахождении в природе: - Бериллий
– встречается в природе в виде минералов: берилла, хризоберилла и их
разновидностей: изумруда, аквамарина, александрита – известных как драгоценные
камни. - Образец александрита показывается(слайд
6).
Бериллий
и его растворимые в воде соединения высокотоксичны (ядовиты). Даже ничтожно
малая примесь его в воздухе приводит к тяжёлым заболеваниям. Он находит широкое
применение в технике. Добавляя к меди он сильно повышает её твёрдость,
прочность, химическую стойкость, делает похожей на сталь. Основной потребитель бериллия
– атомная энергетика. Потребность в нём с каждым годом растёт.
Магний был
впервые получен Деви в 1808 году из белой магнезии (магнезит MqCO 3)
– минерала (слайд 5),найденного близ греческого города Магнезия. По
названию минерала и дали название простому веществу и химическому элементу.
Сульфат магния (одна из распространённых солей магния) называют ещё горькой
солью – она придаёт морской воде горьковатый вкус. Данная соль магния
используется в качестве слабительного средства.
Сплавы с магнием прочнее,
твёрже, легко полируются, обрабатываются и их используют в автомобильной
промышленности, авиационной, ракетной технике.
Как вы
думаете почему остальные металлы этой группы, главной подгруппы названы ЩЗМ?
Так
они именуются по той причине, что их гидроксиды, подобно гидроксидам ЩМ
растворимы в воде, то есть являются щелочами.
«Земельными
они названы потому, что в природе они встречаются в состоянии соединений,
образующих нерастворимую массу земли, и сами в виде оксидов имеют землистый
вид…» — Д.И.Менделеев.
Кальций занимает
пятое место по распространённости. Так же впервые получен Деви в 1808 году.
Название элемента происходит от латинского слова «кальс», что значит, «известь,
мягкий камень». Встречается в виде гипса, кальцита (слайд 5).
- Кальцит
образует залежи мела, мрамора, известняка. - Подумайте
как формируется кальцит? - Поэтому
неудивительно, что иногда в известняках находят ракушки или отпечатки животных.
Где он
применяется? (гипсовые слепки, карнизы, лепнина, штукатурка потолков, в
хирургии, бумажная промышленность).
Стронций встречается
реже в виде минерала целестина, что с латинского означает «небесный» — сульфат
стронция, образован розово-красными, бледно-голубыми кристаллами. Своё название
он (стронций) получил от названия шотландской деревни Стронциан, близ которой в
конце XVIII века найден редкий минерал стронцианит SrCO 3.
Барий встречается
в виде барита BaSO 4 («барис»- тяжёлый с латинского) (слайд
7). Применяется для изготовления радиоламп, в кожевенном деле (для удаления
шерсти), в сахарном производстве, для приготовления фотобумаги, выплавке
специальных окон.
Вспомните
внешний вид, агрегатное состояние металлов: бериллия, магния, кальция; обратите
внимание на зависимость температуры плавления, плотности простых веществ и
сделайте соответствующие выводы, используя таблицу (таблица может быть на
экране компьютера, либо на доске):
на
доске (слайд 9)
| Be | Мg | Ca | Sr | Ba | Ra | |
| RПлотность г/см | 1,85 | 1,737 | 1,54 | 2,63 | 3,6 | 6 |
| Температура плавления | 1287 | 648 | 842 | 768 | 727 | 969 |
- Выслушиваются
ответы учащихся, затем показ видеофрагмента «Физические свойства ЩЗМ, бериллия,
магния» с помощью диска «Виртуальная лаборатория». - Почему
металлический магний хранится на воздухе (показ стружки магния), ЩЗМ под слоем
керосина? (Очевидно, что активность магния ниже, чем у ЩЗМ) - ·
Сравните химическую активность ЩЗМ и ЩМ . - ·
Химические свойства ЩЗМ, бериллия, магния.
·
Предположите с чем могут взаимодействовать
металлы II группы, главной подгруппы?!
- Взаимодействие
с неметаллами - ·
Кислородом: - Показ
видеофрагмента «взаимодействие ЩЗМ с кислородом», диск «Виртуальная
лаборатория» - Записываем
уравнения на доске и в тетрадях (электронный баланс). - хлором,
серой, азотом, водородом: - Показываем
видеофрагмент «Взаимодействие ЩЗМ с неметаллами», - диск «Виртуальная лаборатория».
- ·
С водой: - Показываем
видеофрагмент: «Взаимодействие ЩЗМ, бериллия, магния с водой», диск
«Виртуальная лаборатория». - ·
Вопросы классу: - ·
Как элементы IIA группы взаимодействуют
с водой? - ·
Какие продукты образуются ? - ·
Какие основания они образуют? - ·
Магний при взаимодействии с водой даёт нерастворимое основание,
поэтому окраска фенолфталеина не изменяется, и по этой причине его не относят к
ЩЗМ. - ·
Записываем уравнения взаимодействия магния либо любого ЩЗМ с
водой на доске и в тетрадях, обращается внимание на тип реакции. - ·
С оксидами менее активных металлов (для магния, кальция):
·
Запись уравнения в тетради и на доске, с использованием учебника
п.12.
- ·
Этот способ получения металлов называют по аналогии с
алюминотермией (кальциетермия и магниетермия).(слайд 12) - ·
Заранее заготавливаются компьютерные слайды, выполненные в
программе MicrosjftPowerPoint с основными моментами, главными мыслями
изученной темы.(презентация) - ·
IV Этап Закрепление. - ·
Разгадывание кроссворда по теме: «Щелочноземельные металлы,
бериллий и магний». - ·
ПО ГОРИЗОНТАЛИ:
·
1.Минерал, содержащий карбонат кальция; является важным
строительным материалом.
·
7. Минерал, образующийся из остатков раковин древних животных.
·
8. Mg + N 2 = … .
·
ПО ВЕРТИКАЛИ:
·
2. CaSO 4 * 2H 2 O
·
3. Mg + …. = MgО
- ·
Группа металлов, в которую входит кальций, барий, стронций, радий. - ·
Щелочноземельный металл. - ·
…+ Н 2О=Са(ОН)2 +Н2 - ·
Степень окисления магния в соединениях.
V Этап
Информации о домашнем задании : п.12, №1;4;5.
VI. Рефлексия.
Учащиеся отвечают на вопросы рефлексии и сдают
учителю.
Рефлексия – самоосознание себя в деятельности.
| 1. Какое значение для тебя имеют знания и умения, полученные на уроке? | – не очень важны □ – важные○ – очень важны |
| 2. Как ты оцениваешь полученные сегодня знания? | – не осознанные □ – осознанные ○ – глубокие |
| 3. С каким настроением ты изучал этот материал? | – не интересно вообще □ – не очень интересно ○ – было интересно |
| 4. Как оцениваешь свою деятельность? | – удовлетворительно □ – хорошо ○ – отлично |
| 5. Как оцениваешь деятельность партнера? | – удовлетворительно □ – хорошо ○ – отлично |
2.2.2. Химические свойства металлов IIA группы
IIA группа содержит только металлы – Be (бериллий), Mg (магний), Ca (кальций), Sr (стронций), Ba (барий) и Ra (радий). Химические свойства первого представителя этой группы — бериллия — наиболее сильно отличаются от химических свойств остальных элементов данной группы.
Его химические свойства во многом даже более схожи с алюминием, чем с остальными металлами IIA группы (так называемое «диагональное сходство»). Магний же по химическим свойствами тоже заметно отличается от Ca, Sr, Ba и Ra, но все же имеет с ними намного больше сходных химических свойств, чем с бериллием.
В связи со значительным сходством химических свойств кальция, стронция, бария и радия их объединяют в одно семейство, называемое щелочноземельными металлами.
Все элементы IIA группы относятся к s-элементам, т.е. содержат все свои валентные электроны на s-подуровне. Таким образом, электронная конфигурация внешнего электронного слоя всех химических элементов данной группы имеет вид ns2 , где n – номер периода, в котором находится элемент.
Вследствие особенностей электронного строения металлов IIA группы, данные элементы, помимо нуля, способны иметь только одну единственную степень окисления, равную +2. Простые вещества, образованные элементами IIA группы, при участии в любых химических реакциях способны только окисляться, т.е. отдавать электроны:
Ме0 – 2e— → Ме+2
Кальций, стронций, барий и радий обладают крайне высокой химической активностью. Простые вещества, образованные ими, являются очень сильными восстановителями. Также сильным восстановителем является магний. Восстановительная активность металлов подчиняется общим закономерностям периодического закона Д.И. Менделеева и увеличивается вниз по подгруппе.
Взаимодействие с простыми веществами
с кислородом
Без нагревания бериллий и магний не реагируют ни с кислородом воздуха, ни с чистым кислородом ввиду того, что покрыты тонкими защитными пленками, состоящими соответственно из оксидов BeO и MgO.
Их хранение не требует каких-либо особых способов защиты от воздуха и влаги, в отличие от щелочноземельных металлов, которые хранят под слоем инертной по отношению к ним жидкости, чаще всего керосина.
- Be, Mg, Ca, Sr при горении в кислороде образуют оксиды состава MeO, а Ba – смесь оксида бария (BaO) и пероксида бария (BaO2):
- 2Mg + O2 = 2MgO
- 2Ca + O2 = 2CaO
- 2Ba + O2 = 2BaO
- Ba + O2 = BaO2
- Следует отметить, что при горении щелочноземельных металлов и магния на воздухе побочно протекает также реакция этих металлов с азотом воздуха, в результате которой, помимо соединений металлов с кислородом, образуются также нитриды c общей формулой Me3N2.
с галогенами
- Бериллий реагирует с галогенами только при высоких температурах, а остальные металлы IIA группы — уже при комнатной температуре:
- Мg + I2 = MgI2 – иодид магния
- Са + Br2 = СаBr2 – бромид кальция
- Ва + Cl2 = ВаCl2 – хлорид бария
с неметаллами IV–VI групп
Все металлы IIA группы реагируют при нагревании со всеми неметаллами IV–VI групп, но в зависимости от положения металла в группе, а также активности неметаллов требуется различная степень нагрева. Поскольку бериллий является среди всех металлов IIA группы наиболее химически инертным, при проведении его реакций с неметаллами требуется существенно большая температура.
Следует отметить, что при реакции металлов с углеродом могут образовываться карбиды разной природы. Различают карбиды, относящиеся к метанидам и условно считающимися производными метана, в котором все атомы водорода замещены на металл.
Они так же, как и метан, содержат углерод в степени окисления -4, и при их гидролизе или взаимодействии с кислотами-неокислителями одним из продуктов является метан. Также существует другой тип карбидов – ацетилениды, которые содержат ион C22-, фактически являющийся фрагментом молекулы ацетилена.
Карбиды типа ацетиленидов при гидролизе или взаимодействии с кислотами-неокислителями образуют ацетилен как один из продуктов реакции. То, какой тип карбида – метанид или ацетиленид — получится при взаимодействии того или иного металла с углеродом, зависит от размера катиона металла.
С ионами металлов, обладающих малым значением радиуса, образуются, как правило, метаниды, с ионами более крупного размера – ацетилениды. В случае металлов второй группы метанид получается при взаимодействии бериллия с углеродом:
Остальные металлы II А группы образуют с углеродом ацетилениды:
С кремнием металлы IIA группы образуют силициды — соединения вида Me2Si, с азотом – нитриды (Me3N2), фосфором – фосфиды (Me3P2):
с водородом
Все щелочноземельные металлы реагируют при нагревании с водородом. Для того чтобы магний прореагировал с водородом, одного нагрева, как в случае со щелочноземельными металлами, недостаточно, требуется, помимо высокой температуры, также и повышенное давление водорода. Бериллий не реагирует с водородом ни при каких условиях.
Взаимодействие со сложными веществами
с водой
Все щелочноземельные металлы активно реагируют с водой с образованием щелочей (растворимых гидроксидов металлов) и водорода.
Магний реагирует с водой лишь при кипячении вследствие того, что при нагревании в воде растворяется защитная оксидная пленка MgO.
В случае бериллия защитная оксидная пленка очень стойкая: с ним вода не реагирует ни при кипячении, ни даже при температуре красного каления:
c кислотами-неокислителями
Все металлы главной подгруппы II группы реагируют с кислотами-неокислителями, поскольку находятся в ряду активности левее водорода. При этом образуются соль соответствующей кислоты и водород. Примеры реакций:
- Ве + Н2SO4(разб.) = BeSO4 + H2↑
- Mg + 2HBr = MgBr2 + H2↑
- Ca + 2CH3COOH = (CH3COO)2Ca + H2↑
c кислотами-окислителями
− разбавленной азотной кислотой
- С разбавленной азотной кислотой реагируют все металлы IIA группы.
При этом продуктами восстановления вместо водорода (как в случае кислот-неокислителей) являются оксиды азота, преимущественно оксид азота (I) (N2O), а в случае сильно разбавленной азотной кислоты – нитрат аммония (NH4NO3):
- 4Ca + 10HNO3(разб.) = 4Ca(NO3)2 + N2O↑ + 5H2O
- 4Mg + 10HNO3(сильно разб.) = 4Mg(NO3)2 + NН4NO3 + 3H2O
− концентрированной азотной кислотой
Концентрированная азотная кислота при обычной (или низкой) температуре пассивирует бериллий, т.е. в реакцию с ним не вступает. При кипячении реакция возможна и протекает преимущественно в соответствии с уравнением:
Магний и щелочноземельные металлы реагируют с концентрированной азотной кислотой с образованием большого спектра различных продуктов восстановления азота.
− концентрированной серной кислотой
Бериллий пассивируется концентрированной серной кислотой, т.е. не реагирует с ней в обычных условиях, однако реакция протекает при кипячении и приводит к образованию сульфата бериллия, диоксида серы и воды:
- Be + 2H2SO4 → BeSO4 + SO2↑+ 2H2O
- Барий также пассивируется концентрированной серной кислотой вследствие образования нерастворимого сульфата бария, но реагирует с ней при нагревании, сульфат бария растворяется при нагревании в концентрированной серной кислоте благодаря его превращению в гидросульфат бария.
- Остальные металлы главной IIA группы реагируют с концентрированной серной кислотой при любых условиях, в том числе на холоду. Восстановление серы происходит преимущественно до сероводорода:
- 4Mg + 5H2SO4(конц.) = 4MgSO4 + H2S↑ + 4H2O
с щелочами
- Магний и щелочноземельные металлы со щелочами не взаимодействуют, а бериллий легко реагирует как растворами щелочей, так и с безводными щелочами при сплавлении.
При этом при осуществлении реакции в водном растворе в реакции участвует также и вода, а продуктами являются тетрагидроксобериллаты щелочных или щелочноземельных металлов и газообразный водород:
- Be + 2KOH + 2H2O = H2↑ + K2[Be(OH)4] — тетрагидроксобериллат калия
- При осуществлении реакции с твердой щелочью при сплавлении образуются бериллаты щелочных или щелочноземельных металлов и водород
- Be + 2KOH = H2↑+ K2BeO2 — бериллат калия
с оксидами
Щелочноземельные металлы, а также магний могут восстанавливать менее активные металлы и некоторые неметаллы из их оксидов при нагревании, например:
Метод восстановления металлов из их оксидов магнием называют магниетермией.






