Металлы
и сплавы имеют ряд ценных свойств и имеют широкое применение, но с течением
времени их свойства могут изменяться из-за отрицательного воздействия
окружающей среды.
Коррозия
(от. лат. corrosio – разъедание) – это
самопроизвольно протекающий процесс разрушения металлов в результате
взаимодействия их с окружающей средой.

- Коррозия
– это необратимый процесс, она наносит огромный ущерб экономике, потому что
в результате коррозии металлы становятся менее прочными и менее пластичными,
нарушается герметичность труб и аппаратов, что может привести к утечке нефти,
бензина, газа или к порче продуктов питания. - Все
металлы – восстановители, явление коррозии – это проявление
восстаногвительных свойств металлов.
Различают
два вида коррозии: химическую и электрохимическую. Химичекую
коррозию вызываю вещества-неэлекторлиты, она протекает в сухих газах при
повышенной температуре и не сопрровождается возникновением электрического тока.
Такой газовой коррозии подвергаются металлы при термической обработке. Например,
нагретые до высокой температуры детали из железа и его сплавов (вращающиеся
валы, шестерни и т.д.) могут реагировать с газообразными компон6ентами
атмосферы (O2, O3,
H2S, SO2, NO2).
При
этом возможны самые различные процессы химической коррозии железа:
- 2Fe + O2 = 2FeO
- 4Fe + 3O2 = 2Fe2O3
- 8Fe + 6NO2 = 4Fe2O3 + 3N2
- 2Fe + 2H2S
+ O2 = 2FeS + 2H2O - В
составе природного газа возможна примесь – сероводород, который вступает в
реакцию с металлической трубой, по которой транспортируют газ, сопла ракетных
двигателей взаимодействуют с окислителем топлива, детали нефтедобывающих
конструкций взаимодействуют с нефтью и продуктами её пераработки. - Наличие
в воздухе газообразных галогенов или галогенововдородов (например, на
химических производствах) ускоряет процесс химической коррозии железа и его
сплавов. - 2Fe + 3Cl2 = 2FeCl3
- Fe + 2HBr = FeBr2 + H2↑
- В
результате химической коррозии образуются, как правило, оксидные плёнки,
в тех местах, где было соприкосновение металла с агрессивной средой.

Например,
на поверхности щелочных и щелочноземельных металлов в процессе окисления
кислородо воздуха образуются толстые рыхлые оксидные плёнки, через которые
проникает кислород, поэтому они не защищают металл от коррозии. А на
поверхности таких металлов, как алюминий, цинк, хром, никель и других металлов,
образуются сплошные тонкие оксидные плёнки, которые защищают металл от
окружающей среды.
Поэтому
имеено такие металлы используют как легирующие добавки к сталям и для нанесения
защитных покрытий на изделия, работающие в условиях газовой коррозии.
Химичекая
коррозия протекает также в таких неэлектролитах, как бензин, керосин,
сероуглерод и других. Поэтому также наблюдается коррозия бензобаков,
нефтепроводов, нефтехимического оборудования.

Электрохимическая
коррозия протекает в растворах электролитов: кислоты, основания, соли,
морская и речная вода, влажная почва, и сопровождается возникновением
электрического тока.
Приведём
несколько примеров. Известно, что химически чистые металлы устойчивы к
воздействию внешней среды. Так, если враствор соляной кислоты поместить
химически чистый цинк, то сначала реакция протекает быстро, а потом
замедляется.
Это происходит из-за того, что ионы цинка переходят в раствор и
скапливаются на поверхности металла, препятствуя проникновению катионов
водорода к поверхности металла.
Кроме этого, в кристаллической решётке цинка
накапливаются электроны, которые затрудняют переод ионов цинка в раствор.
- Если
цинк будет находится в контакте с медью, то растворение цинка ускорится, так
как медь менее активный металл, чем цинк и с соляной кислотой не взаимодействует,
поэтому в кристаллической решётке меди электроны не накапливаются, при этом
свободные электроны цинка переходят на поверхность меди и восстанавливают ионы
водорода. - 2Н+
+ 2ē = Н2↑ - Поэтому
данная корозия и называется электрохимической, потому что наряду
с химическими процессами протекакют и электрические (перенос электронов от
одного металла к другому).
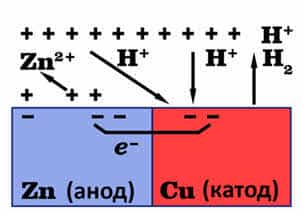
- В
результате концентрации избыточных электронов на поверхность меди цинк снова
окисляется и его ионы переходят в раствор. - Zn — 2ē = Zn2+
- Таким
образом, усиление коррозии цинка в контакте с медью объясняется возникновением гальваническго
элемента, в котором роль анода принадлежит цинку, а роль катода – меди. - Как
правило, роль анода выполняет более активный металл, на аноде происходит
окисление металла: - Me – nē = Men+
На
катоде, наоборот, частицы окислителя принимают электроны, которые поступают с
катода. Роль катода выполняют менее активные металлы или примесные включения.
- Например,
если частицы оксителя это ионы водорода, то на катоде идёт следующий процесс: - 2Н+
+ 2ē = Н2↑ - В
нейтральной среде в качестве окислителя выступает растворённый кислород: - О2
+ 4ē + 2Н2О = 4ОН- - Таким
образом, в кислой среде преобладает процесс восстановления водорода,
а если среда щелочная или нейтральная, то окислитель кислород.
Процесс
коррозии железа и его сплавов называется ржавлением. Чаще всего мы
встречаемся с атмосферной коррозией, вызванной присутствием кислорода и паров
воды. Продукт процесса коррозии железа – ржавчина – не имеет определённого состава.
- Под
действием окружающей среды разрушается не только железо и его сплавы, но и
другие металлы, как серебро и медь. - Всем
известно, что сос временем серебро темнеет, из-за образования чёрного сульфида
серебра (I), который образуется за счёт присутствия в
атмосфере даже следов сероводорода. - 2Ag + H2S = Ag2S↓ + H2↑
- 4Ag + 2H2S + O2 = 2Ag2S↓ + 2H2O
- Если
в атмосфере присутствуют следы озона, то серебрянные изделия также чернеют
из-за образования оксида серебра (I).

Все
типичные металлы в главных подгруппах I и II групп ПСХЭ Д.И. Менделеева
имеют малую коррозионную стойкость. Металлы побочной подгруппы I группы – стойкие. Это Cu, Ag, Au.
Металлы
побочной подгруппы II группы
более устойчивы, так как на их поверхности под действием кислорода внешней
среды образуются прочные оксидные плёнки, металлы III группы, главной подгруппы, как Al, защищён
оксидной плёнкой, которая обладает высокими защитными свойствами, однако может
разрушаться в кислотах и щелочах.
- Металлы
IV группы, главной подгруппы Sn и Pb
стойки к коррозии, покрыты прочной оксидной плёнкой. - Металлы
V, VI, VII,
VIII групп побочных подгрупп
способны к пассивации, обладают большой коррозионной стойкостью, но наибольшей
устойчивостью обладают металлы VIII группы,
побочной подгруппы Os, Ir, Pt. - То
есть, такие металлы, как золото и платина, являются малоактивными,
поэтому в меньшей мере подвержены коррозии, их так и называют – благородные
металлы, они не теряют свой блеск даже в агрессивной атмосфере.
Из
неблагородных металлов высокой коррозионной стойкостью обладает
титан и сплавы на его основе. Например, титановые изделия сохраняли свои
свойства в течении 10 лет пребывания в морской воде.
Материальные
потери, которые приносит коррозия очень велики. Ежегодно четверть выплавляемого
во всём мире железа уничтожается коррозией. Поэтому необходимы определённые
способы защиты от неё.
Существуют
различные способы защиты от коррозии. Один из распространённых способов – это легирование
металлов, то есть получение сплавов, устойчивых к коррозии, как
нержавеющая сталь.
Для
защиты от коррозии используются защитные покрытия.
Это могут быть
неметаллические покрытия (лаки, краски, эмали, плёнки из масел и нефтепродуктов),
химические (фосфатные, оксидные, нитридные), а также металлические
(оцинковывание, никелирование, хромирование, меднение, золочение, лужение –
покрытие оловом), проводят обработку среды (нагревание воды для уменьшения
растворимости газов, пропускание воды через железную стружку для удаления
кислорода или используя сульфит натрия), осуществляют химическое покрытие
(оксидирование, азотирование, науглероживание поверхности, добавление
ингибиторов коррозии: соли органических кислот, фосфаты, силикаты, карбонаты и
др.)
Например,
металл цинкуют в водной среде, в случае работы с серной кислотой металл
покрывают свинцом, белая жесть применяется для консервирования.
Различают
такие металлические покрытия, как катодные и анодные.
Если
защищаемый металл покрыт менее активным металлом, то это катодное
покрытие. Для железа катодным покрытием служит оловянное. При нарушении
целостности катодного покрытия железо разрушается, а олово остаётся защищённым.
- На
аноде происходит окисление атомов железа, а на катоде в кислой
среде происходит восстановление ионов водорода. - Fe — 2ē = Fe2+
- 2H+ + 2ē = H2↑
В
нейтральной среде (влажный воздух, вода) на аноде окисляются атомы железа,
а на катоде восстанавливается кислород. В растворе при этом образуется
гидроксид железа (II), который окисляется затем
кислородом до гидроксида железа (III).
- Fe — 2ē = Fe2+
- O2 + 4ē +2H2O = 4OH-
- Fe2+ + 2OH- = Fe(OH)2↓
- 4Fe(OH)2 + O2 + 2H2O = 4Fe(OH)3↓
При
высыхании продуктов коррозии образуется ржавчина – Fe2O3 · nH2O. Часто для разрушения окалины-ржавчины на оружейном металле
применяют «травильные супы» — раствор серной кислоты с добавлением пивных
дрожжей, крахмала, муки.
Анодное
покрытие – это покрытие защищаемого металла более активным металлом.
Для железа – это цинковое прокрытие. При нарушении этого анодного
покрытия анод – цинк разрушается, а катод – железо – остаётся защищённым. В
качестве активного металла используют магний, алюминий, цинк.
Протекторная
защита заключается в том, что к защищаемой металлической конструкции
присоединяют протекторы из более активного металла.
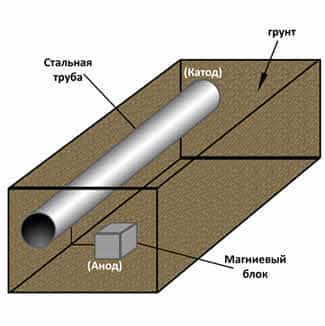
В
этом гальваническом элементе протектор выполняет рол анода, а защищаемый металл
– роль катода. Протектор разрушается и защищает тем самым металл. В качестве
протектора выступают цинк, магниевые сплавы. Протекторым способом защищают
трубопроводы и ёмкости, которые находятся по землёй, коруса морских судов и
карабельные винты.
Ещё
один способ защиты от коррозиии – это создание шлифованных поверхностей, чтобы
не задерживалась влага и лучше образовывалась оксидная плёнка, так как
поверхностный слой становится однородным. А такж используют такой метод, как
пассивация металлов, то есть изготовление сплавов с добавлением металлов: Ni, Al, Mn, Mo, W, V,
имеющих защитные оксидные плёнки.

Таким
образом, процесс взаимодействия металлов и сплавов с компонентами окружающей
среды, в результате которого происходит разрушение металлов, назвается
коррозией.
Различают
химическую и электрохимическую коррозию. В случае
электрохимической коррозии всегда образуется электрический ток, наблюдается
разрушение более активного металла, который выступает в роли анода, а менее
активный металл – в роли катода.
Скорость
коррозии зависит от от восстановительной способности контактирующих металлов.
Чем сильнее он6и отличаются по восстановительной способности, тем больше
скорость реакции. Существуют различные методы защиты от коррозии: использование
различных покрытий, а также использование металлов более активных, чем
защищаемый металл.
Видеоурок «Коррозия металлов»
Содержание:
§ 1 Коррозия. Сущность процесса коррозии
Изделия из металлов и их сплавов, кроме золота и платины, под действием воздуха, влаги постепенно разрушаются в результате химических реакций, протекающих между металлами и веществами, содержащимися в окружающей среде. Особенно сильное разрушительное действие на металлы оказывает кислород, растворенный в воде.
Процесс самопроизвольного разрушения металлов под влиянием окружающей среды называют коррозией.
Коррозия металлов наносит огромный вред экономике. Человечество несет большие убытки в результате коррозии трубопроводов, деталей машин, судов, мостов, технологического оборудования. Установлено, что потери металла от коррозии в мире уже составляют около 30% от его годового производства. Считается, что 10% прокоррозировавшего металла теряется (в основном в виде ржавчины) безвозвратно.
Коррозия металлов – это окислительно-восстановительный процесс, при котором атомы металла окисляются и переходят в ионы. Схему этого процесса можно изобразить так: М0 – ne– = Mn+
- Коррозии подвергаются различные металлы и сплавы, но наиболее часто корродирует железо и его различные сплавы. В общем виде процесс коррозии железа и его сплавов можно изобразить так:
- Fe0 – 2e– = Fe2+
- Fe2+ – e– = Fe3+
- В качестве окислителя обычно выступает кислород О2, а также ионы водорода H+ , образующиеся при диссоциации молекул воды и растворенных в воде оксида углерода (IV), оксида серы(IV), сероводорода и других соединений.
§ 2 Виды коррозии металлов
Химическая коррозия металлов – это разрушение металлов в результате их взаимодействия с веществами окружающей среды.
Наиболее распространенным видом химической коррозии является газовая коррозия. Она протекает в сухих газах при полном отсутствии влаги. Газы окружающей среды реагируют с металлом на поверхности изделия и образуют с ним соединения.
Если образующийся продукт взаимодействия нелетучий и образует плотную пленку, как у алюминия, то коррозия постепенно уменьшается и может совсем прекратиться.
Если же образуется рыхлая пленка (как ржавчина железа), то коррозия может привести к полному разрушению металла.
Электрохимическая коррозия – это разрушение металлов, которое сопровождается возникновением электрического тока. В результате данного вида коррозии вместе с химическими процессами протекают электрические процессы (перенос электронов от одного участка изделия к другому).
Если два разных металла, находящиеся в контакте между собой, опустить в водный раствор электролита, то более активный металл, расположенный в электрохимическом ряду напряжений левее, будет разрушаться, предохраняя менее активный металл от коррозии.
Например, при контакте железа с медью в водной среде более активное железо постепенно корродирует, переходя в воду в виде ионов железа. Электроны, высвободившиеся из атомов железа, перейдут к меди и на ее поверхности соединятся с ионами водорода, выделившимися из компонентов водной среды.
- Этот электрохимический процесс можно представить так:
- на железе Fe0 – 2e– = Fe2+
- на меди 2H+ +2e– = H20
- в ионном виде Fe0 + 2H+ = Fe2++ H20
При контакте железа с более активным металлом (цинком, алюминием, магнием) они разрушаются, защищая железо от коррозии.
Изучение сущности процессов коррозии помогает предвидеть методы борьбы с этим нежеланным явлением.
§ 3 Методы борьбы с коррозией
Для борьбы с коррозией существует много способов, рассмотрим некоторые из них.
Первый способ – нанесение защитных покрытий на поверхности корродирующего металла. Для этого часто используют масляные краски, эмали, лаки или покрывают металл слоем другого металла (золота, серебра, хрома, никеля, олова, цинка).
Например, для сохранения от коррозии знаменитой Эйфелевой башни в Париже, которая состоит из 18 000 металлических элементов и весит 7 300 тонн, используют покраску. Этот процесс занимает 18 месяцев и осуществляется командой из 25 высококвалифицированных рабочих. Всё сооружение окрашивается в два слоя. При этом расходуется около 60 тонн краски. Покраску осуществляют каждые 7 лет.
Для защиты изделия от коррозии их покрывают цинком, кадмием, оловом, свинцом, никелем, кобальтом.
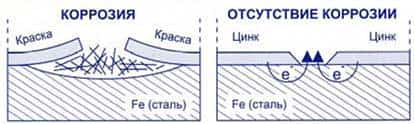
Например, никелевые покрытия нарядны, стойки, прочны. Ежегодно во всем мире никелируют миллионы квадратных метров поверхности различных изделий – от дверных ручек до бамперов автомобилей.
Один из самых старых способов – это лужение или покрытие железного листа оловом.
Лужению подвергают изделия, идущие для приготовления и хранения пищи (кастрюли, ведра, тазы, молочные бидоны, консервные банки, пастеризационные аппараты, части сепараторов и тому подобные).
Второй способ – получение сплавов, стойких к коррозии. Чтобы увеличить коррозионную стойкость сплавов железа, в их состав добавляют хром или никель, такие стали называют нержавеющие стали.
Сплавы, содержащие более 12-14% хрома, ведут себя как благородные металлы: они не ржавеют и не окисляются на воздухе, в воде, в ряде кислот, солей и щелочей.
В медицине для изготовления каркаса зубов используют кобальтохромовый сплав или никельхромовый сплав.
Третий способ – изменение состава среды. В среду, окружающую металлы, вводят специальные вещества, которые в десятки или сотни раз уменьшают агрессивность среды. Такие вещества называют ингибиторами коррозии. Ингибиторы вводят в нефтепроводы, в замкнутые системы охлаждения, для снижения коррозии труб.
Четвертый способ – электрохимический метод защиты. При использовании этого метода создают контакт с более активным металлом – протектором. Например, для защиты стальных корпусов морских судов или сооружений мостов используют цинк, который приваривают к конструкции.
§ 4 Краткие итоги по теме урока
Коррозией называют процесс самопроизвольного разрушения металлов под влиянием окружающей среды. В процессе коррозии атомы металла окисляются и переходят в ионы. Выделяют химическую и электрохимическую коррозию.
Для борьбы с коррозией применяют следующие способы: нанесение защитных покрытий на поверхности металла, получение сплавов, стойких к коррозии, изменение состава среды, электрохимический метод защиты.
Коррозия металлов наносит большой экономический вред.
Список использованной литературы:
- Габриелян О.С. Химия. 9 класс: учебник для общеобразовательных учреждений / М.: Дрофа, 2010.
- Химия. 9 класс: Настольная книга учителя / О.С. Габриелян, И.Г. Остроумов. – М.: Дрофа, 2003.
- Рудзитис Г.Е., Фельдман Ф.Г. Химия: Неорган. химия. Орган. химия: Учеб. для 9 кл. общеобразоват. учреждений. — М.: Просвещение, 1999.
- http://www.stroitelstvo-new.ru/zhestyanye-raboty/luzhenie-metalla.shtml
- http://parisweb.ru/dostoprimechatelnosti/ejfeleva-bashnya.html
Использованные изображения:
Коррозия металлов — что это такое? Виды и примеры
Коррозия металлов или ржавление в химии — это явление, которое возникает из-за взаимодействия металлической пластинки с веществами окружающей среды (кислородом воздуха или кислотами, с которыми может реагировать металлическое изделие).
Обычно окисляются металлы, включая железо, которые находятся левее водорода в ряду напряжений.

Чаще всего встречаются химическая и электрохимическая коррозии. Чтобы понять, чем они отличаются друг от друга, давайте сравним их по нескольким критериям в таблице ниже.
| Определение | Разрушение металлов в из-за взаимодействия с газами или растворами, которые не проводят электрический ток | Разрушение металла, при котором возникает электрический ток в воде или среде другого электролита |
| Агрессивные реагенты | O2, пары H2O, CO2, SO2, Cl2 | Растворы электролитов |
| Примеры | 3Fe + 2O2 → Fe3O4 |
|
Защитить металл от коррозии можно по-разному: покрытием защитными материалами, электрохимическими методами, шлифованием и т. д. Далее — подробно обо всем этом.
Что такое коррозия
Коррозия — это самопроизвольное разрушение элементов, чаще всего металлов, под действием химического или физико-химического влияния окружающей среды.
Иными словами, из-за химического воздействия железо начинает ржаветь. Это весьма сложный процесс, который состоит из несколько этапов. Но суммарное уравнение коррозии выглядит так:
4Fe + 6H2O (влага) + 3O2 (воздух) = 4Fe(OH)3.
Часто под коррозией понимают химическую реакцию между материалом и средой либо между их компонентами, которая протекает на границе раздела фаз. Обычно это окисление металла. Например:
3Fe + 2О2 = Fe3O4;
Fe + H2SO4 = FeSО4 + Н2.
Некоторые металлы, даже активные, покрываются плотной оксидной пленкой при коррозии. Это одна из их характерных черт. Оксидная пленка не дает окислителям проникнуть в более глубокий слой и поэтому защищает металл от коррозии.
Алюминий обычно устойчив при контакте с воздухом и водой, даже горячей. Тем не менее, если поверхность алюминия покрыть ртутью, то образуется амальгама.
Она разрушает оксидную пленку, и алюминий начинает быстро превращаться в белые хлопья метагидроксида алюминия:
4Al + 2H2O + 3O2 = 4AlO(OH).
Коррозии подвергаются и многие малоактивные металлы. Например, поверхность медного изделия покрывается патиной — зеленоватым налетом. Это происходит потому, что на ней образуются смеси основных солей.
Виды коррозии металлов
Химическая коррозия
Химическая коррозия — это процесс разрушения металла, который связан с реакцией между металлом и коррозионной средой.
Химическая коррозия протекает без воздействия электрического тока, и в результате этой реакции металлы окисляются. Этот вид коррозии можно разделить на два подвида:
- газовая коррозия — металл корродирует под воздействием различных газов при высоких температурах;
- коррозия в жидкостях — неэлектролитах.
Их них более распространенной считают газовую коррозию. Она протекает во время прямого контакта твердого тела с активным газом воздуха. Чаще всего это кислород.
В результате на поверхности тела образуется пленка продуктов химической реакции между веществом и газом. Дальше эта пленка мешает контакту корродирующего материала с газом. При высоких температурах газовая коррозия развивается интенсивно.
Возникшая при этом пленка называется окалиной, которая со временем становится толще.
Важную роль в процессе коррозии играет состав газовой среды. Но для каждого металла он индивидуален и изменяется с переменой температур.
Электрохимическая коррозия
Электрохимическая коррозия — это разрушение металла, которое протекает при его взаимодействии с окружающей средой электролита.
Этот вид коррозии считают наиболее распространенным.
Самым важным происхождением электрохимической коррозии является то, что металл неустойчив в окружающей среде с точки зрения термодинамики.
Вот несколько ярких примеров этой реакции: ржавчина в трубопроводе, на обшивке днища морского судна и на различных металлоконструкциях в атмосфере.
В механизме электрохимической коррозии обычно выделяют два направления: гомогенное и гетерогенное. Разберем их подробнее в таблице ниже.
| Поверхность металла рассматривается как однородный слой. | У твердых металлов поверхность неоднородна из-за структуры сплава, в котором атомы по-разному расположены в кристаллической решетке. |
| Растворение металла происходит из-за термодинамической возможности для катодного или анодного процессов. | Неоднородность можно наблюдать при наличии в сплаве каких-либо включений. |
| Скорость, с которой протекает электрохимическая коррозия, зависит от времени протекания процесса. |
В электрохимической коррозии протекает одновременно два процесса на аноде и на катоде, которые зависят друг от друга. Растворение основного металла происходит только на анодах. Анодный процесс заключается в том, что ионы металла отрываются и переходят в раствор:
Fe → Fe2+ + 2e.
В результате происходит реакция окисления металла. В данном случае анод заряжается отрицательно.
При катодном процессе избыточные электроны переходят в молекулы или атомы электролита, которые, в свою очередь, восстанавливаются. На катоде идет реакция восстановления. Он носит заряд положительного электрода.
O2 + 2H2O + 4e → 4OH-
2H+ + 2e → H2
Торможение одного процесса приводит к торможению и другого процесса. Окисление металла может происходить только в анодном процессе.
Как защитить металлы от коррозии
От коррозии можно и нужно защищаться. Чтобы уберечь металлы от этой реакции, их покрывают защитными материалами, обрабатывают электрохимическими методами, шлифованием и т. д. Рассмотрим все эти способы подробнее.
Способ № 1. Защитные покрытия.
Для защиты от коррозии металлические изделия покрывают другим металлом, т. е. производят никелирование, хромирование, цинкование, лужение и т. д. Еще один вариант защиты — покрыть поверхность металла специальными лаками, красками, эмалями.
Способ № 2. Легирование.
Легирование — это введение добавок, которые образуют защитный слой на поверхности металла. Например, при легировании железа хромом и никелем получают нержавеющую сталь.
Способ № 3. Протекторная защита.
Протекторная защита — это способ уберечь металл от коррозии, при котором металлическое изделие соединяют с более активным металлом. Этот второй металл в итоге и разрушается в первую очередь.
Способ № 4. Электрохимическая защита.
Чтобы защитить металлы от электрохимической коррозии, нейтрализуют ток, который возникает при ней. Это делают с помощью постоянного тока, который пропускают в обратном направлении.
Способ № 5. Изменение состава среды путем добавления ингибиторов.
Для защиты от коррозии используют специальные средства, которые ее замедляют — ингибиторы. Они изменяют состояние поверхности металла — образуют труднорастворимые соединения с катионами металла. Защитные слои, образованные ингибиторами, всегда тоньше наносимых покрытий.
Способ № 6. Замена корродирующего металла на другие материалы: керамику и пластмассу.
Способ № 7. Шлифование поверхностей изделия.
Проверьте себя
-
Что такое коррозия?
-
Где в повседневной жизни можно встретить ржавление железа и других металлов? Приведите примеры.
-
- Гидроксид железа Fe(OH)3 называют:
- а ржавчина;
- б) окалина;
- в) патина.
-
Что является причиной возникновения коррозии?
-
Чем отличаются химический и электрохимический типы коррозии?
-
Что такое коррозионная среда?
Узнайте все о коррозии металлов и разберитесь в других темах за 9 класс на онлайн-курсах по химии в Skysmart! Наши преподаватели помогут выяснить, где скрываются пробелы в знаниях, и восполнить их.
Никаких скучных задач и сухих лекций — только интерактивные упражнения, опыты и теория простым языком. Все это поможет разобраться даже в тех темах, которые не давались в школе.
Ждем на бесплатном вводном уроке!
Лекция. КОРРОЗИЯ МЕТАЛЛОВ
Коррозия (разъедание, разрушение) — это самопроизвольный процесс разрушения металлического изделия в результате его взаимодействия с веществами окружающей среды на границе раздела фаз и приводящий к потере функциональных свойств изделия.
Ущерб от коррозии составляет несколько процентов от годового валового национального дохода и их классифицируют на два вида.
Первичные потери (несколько процентов от общих потерь от коррозии) — обусловлены затратами связанными с изготовлением и заменой детали вышедшей из строя в результате коррозионного разрушения.
Вторичные потери значительно превосходят первичные и связаны с простоем оборудования, ухудшения качества продукции, в следствие загрязнения ее продуктами коррозии и некоторыми другими потерями.
Коррозионную стойкость металлов (скорость коррозии) можно оценивать по следующим показателям:
· по изменению массы (Dm) металла при коррозии, отнесенной к единице поверхности (S) и единице времени (t) (массовый показатель – используется при равномерной или сплошной коррозии):
- Кмасс = Dm/St;
- · по уменьшению толщины образца за единицу времени (мм/год):
- П = Кмасс 8760/1000r,
- где r — плотность металла, г/см3; 8760 – число часов в году.
- Для количественной оценке коррозионной стойкости может быть использовано любое свойство металла, в том числе и изменение механических характеристик металла, если коррозия не равномерная.
- Коррозионные процессы подразделяются на следующие виды: по механизму взаимодействия металла со средой; по виду коррозионной среды и по виду коррозионного разрушения.
- По механизму взаимодействия окружающей среды с металлами коррозия делится на два основных типа: химическая и электрохимическая коррозия.
К химической коррозии относятся процессы, протекающие при непосредственном химическом взаимодействии металла с веществами среды и не сопровождающиеся появлением электрического тока, т.е.
процесс взаимодействия материала детали с веществом происходит в один этап без разделения в пространстве и во времени.
К данному виду коррозии относится газовая коррозия, протекающая при высоких температурах, и коррозия в растворах неэлектролитов.
К электрохимической коррозии относятся коррозионные процессы, протекающие в водных растворах электролитов, в расплавах солей, в щелочах и во влажном воздухе, т.к. поверхность детали покрыта тонкой пленкой воды толщиной в несколько микрон до температуры 80-100 оС.
Разрушение металла происходит под действием возникающих гальванических пар.
Механизм электрохимической коррозии, определяемый разностью потенциалов пассивных (катодных) и активных (анодных) участков, сводится к работе гальванического элемента.
В результате электрохимической коррозии окисление металла может приводить как к образованию нерастворимых продуктов (ржавчина), так и к переходу атомов металла в раствор в виде ионов.
В растворе электролита: более активный металл посылает в раствор свой ионы, т.е. окисляется, а на менее активном металле идет процесс восстановления ионов водорода или молекул кислорода. Последние, всегда присутствуют в растворе поступая туда из воздуха.
В случае коррозии детали изготовленной из стали с анода в раствор переходят ионы железа: Fe ® Fe2+ + 2e.
Освободившиеся электроны переходят с анодных участков к поверхности катода, где соединяются с имеющимися в растворе ионами водорода, выделяя газообразный водород: 2H+ + 2e- ® H2.
В качестве материала катода в данном случае выступают примеси других металлов или карбид железа. Последняя реакция облегчает протекание реакции окисления железа. В электрохимии данный случай коррозии называется процессс водородной деполяризацией.
На катоде, помимо выделения водорода, могут протекать и другие реакции, например восстановление кислорода (коррозия):с кислородной деполяризациейO2 + 2H2O + 4e- ® 4OH- .
Эти два процесса снижают поляризацию катода и увеличивают скорость коррозии.
Примеси, имеющие, более положительный стандартный электродный потенциал, способствуют увеличению электрохимической коррозии. Если в железе имеются примеси, с более отрицательным стандартным электродным потенциалом (цинк, алюминий), то анодом будут служить примеси, а катодом — железо. При этом примеси будут растворяться, защищая железо от коррозии.
Короткозамкнутые гальванические элементы могут возникать и за счет разности потенциалов между участками различной механической обработки, структуры, состояния оксидной пленки на поверхности металла, различием состава раствора у отдельных участков его поверхности и при наличии контакта различных металлов.
По характеру изменения поверхности металла в результате коррозионных процессов коррозионные разрушения могут быть нескольких видов: сплошным или равномерным, неравномерная коррозия (коррозия пятнами и язвами, точечная коррозия и структурно-избирательная коррозия(межкристаллитная коррозия — разрушение по границам зерен)).
Избирательная коррозия наиболее опасна, т.к. при малой общей площади поражений в отдельных местах может создать резкую концентрацию механических напряжений, в свою очередь содействующих дальнейшему разрушению металла. Межкристаллитная коррозия, ослабляющая связь между металлическими зернами, приводит к развитию трещин.
По виду коррозионной среды различают коррозию в жидкостях-неэлектролитах, газовую, атмосферную, морскую и почвенную коррозию, коррозию под действием блуждающих токов и другие виды.
Атмосферная коррозия происходит во влажном воздухе при обычных температурах. На скорость атмосферной коррозии влияет влажность воздуха и содержание в нем газов, наличие на поверхности металла шероховатостей, микро щелей, пор, т.е. мест, облегчающих конденсацию влаги. Коррозия сталей может быть выражена следующими уравнениями:
- Fe0 ®Fe2+ + 2e – на анодных участках
- O2 + 2H2O + 4e- ® 4OH- — на катодных участках
- Fe2+ + 2OH- ® Fe(OH)2 – химическая реакция
- 2Fe(OH)2 + O2 + 2H2O®4Fe(OH)3. — окисление кислородом
Fe(OH)3 ®FeO(OH) + H2O. образование ржавчины.
Ржавчина является конечным продуктом атмосферной коррозии железа.
Почвенная коррозия приводит к разрушению проложенных под землей трубопроводов, оболочек кабелей, деталей строительных сооружений. Металл в этих условиях соприкасается с влагой грунта, содержащего растворенный воздух.
Коррозия при неравномерной аэрации наблюдается в тех случаях, когда деталь или конструкция находиться в растворе, но доступ растворенного кислорода к различным ее частям неодинаков. В этом случае восстановление кислорода протекает на более аэрируемых участках, а окисление металла — на менее аэрируемых участках поверхности.
Основные методы защиты металлов от коррозии можно сгруппировать по следующим направлениям: изоляция металла от коррозионной среды, электрохимические методы защиты (протекторная защита, электрозащита), изменение свойств коррозионной среды и изготовление детали из коррозионностойкого материала.
Изоляция металла от коррозионной средыосуществляется путем создания защитной пленки на его поверхности (окраска, нанесение смазки, создание неметаллические покрытия из неорганических веществ, покрытие слоем другого металла, практически не коррозирующего в тех же условиях — анодные (Zn, Cd, и др.)).
Цинковое покрытие является анодным по отношению к железу, т.к. стандартный электрохимический потенциал цинка более электроотрицателен, чем потенциал железа.
Следовательно, цинк будет растворяться Zn = Zn2+ + 2e, а на железе будут протекать реакции выделения водорода 2H+ + 2e- ® H2 или восстановления кислорода O2 + 2H2O + 4e- ® 4OH- , что зависит от состава водного раствора.
Эти процессы будут протекать до тех пор, пока не будет разрушен весь слой цинка.
Никелированное железо также представляет собой гальваническую пару, где катодом служит никель, а анодом железо. Последнее обусловлено тем фактом, что стандартный потенциал никеля положительнее стандартного потенциала железа.
В данном случае происходит растворение железа Fe0 ®Fe2+ + 2e, а на никеле, в зависимости от состава раствора, происходит реакции выделения водорода или восстановления кислорода. Т.е.
никелевое покрытие защищает железо только механически, а при его повреждении ускоряет процесс коррозии железа.
Оксидирование алюминиевых изделий (анодирование) производят с использованием окислительных процессов на аноде электролизера. При этом на поверхности детали формируется плотный слой из оксида алюминия, который и защищает деталь от коррозии.
В естественных условиях данный оксид формируется самопроизвольно, в частности, на изделиях изготовленных из алюминия.
Широко применяется процесс фосфатирования — отложения на поверхности защищаемой детали слоя солей состоящего из дигидрофосфатов железа Fe(H2HO4)2 и марганца Mn(H2PO4)2.
Придать металлу устойчивость к коррозии можно путем создания защитной пленки из высокомолекулярных соединений (лакокрасочные материалы) или путем нанесения смазки неокисляющимися маслами, которые хорошо смачивают металл при повышенной температуре в жидком виде и при застывании образуют на поверхности слой, изолирующий металл от окружающей среды.
Электрохимические методы защиты. В промышленности часто применяют так называемую протекторную защиту, пригодную в те случаях, когда защищаемая конструкция находится в среде электролита.
Для осуществления протекторной защиты изделие соединяют с металлом, имеющим более отрицательным потенциалом, чем потенциал металла защищаемой конструкции.
Последний будет разрушаться и тем самым предохранять от коррозии конструкцию.
Электрозащита. Защищаемая конструкция, находящаяся в среде электролита, присоединяется к катоду, а кусок старого металла, присоединяемый к аноду внешнего источника постоянного тока. Поддерживая постоянное оптимальное напряжение, специально подбираемое для каждого случая, предохраняют конструкцию от коррозии.
Изменение свойств коррозионной среды. Изменение свойств окружающей среды, осуществляется двумя путями — удаление агрессивного компонента среды или введение ингибитора.
Значительное снижение скорости коррозии наблюдается при удалении влаги (паров воды) из окружающей среды, что достигается изоляцией изделий от окружающей среды путем упаковки в полимерный материал и введением в ограниченный объем веществ, способных поглощать влагу (селикагель).
Вещества, способные при незначительных добавках их к коррозионной среде эффективно уменьшать коррозию металла или сплава, называют замедлителями (ингибиторами) коррозии.
Чаще всего применяют такие замедлители коррозии, добавки которых к раствору электролита вызывают заметное изменение потенциала металла в этом растворе, приближая его к потенциалу малоактивных металлов.
Анодные замедлители коррозии (Na2CO3, фосфаты, силикаты, хроматы, нитраты) способствуют уменьшению площади анодных участков на поверхности металла, уменьшая тем самым количество растворяющегося металла. Катодные замедлители коррозии (соли магния, цинка, никеля др.
) способствуют уменьшению площади катодных участков на поверхности металла, что ведет к уменьшению общей скорости коррозии за счет уменьшения количества водорода, выделяющегося на этих участках или за счет замедления диффузии кислорода, являющегося деполяризатором. Органические вещества — ингибиторы коррозии (тиомочевина, уротропин, производные аминов) также относят к катодным замедлителям.
Повышение коррозионной стойкости деталей, возможно, добиться путем изготовления их из коррозионностойких материалов, в частности из нержавеющей стали.
Нержавеющие стали это сплавы железа с хромом (11 — 18 %), с хромом (17 — 26 %) и никелем (8 до 11%) или с некоторыми другими металлами.
При таком содержании лигирующих металлов происходит пассивация материала, и изделие перестает подвергаться коррозионному разрушению. В некоторых случаях коррозионная стойкость повышается путем изготовления деталей из пластмасс.
Лекция по теме «коррозия металлов» Учебные вопросы
-
Основные характеристики коррозионных процессов
-
Химическая коррозия
-
Электрохимическая коррозия
Коррозия
– самопроизвольное разрушение металла
вследствие его окисления при взаимодействии
с окружающей средой.
Виды
коррозионных разрушений.Характер
разрушения поверхности металла или
изменения его физико-химических свойств
определяется в первую очередь свойствами
самого металла и свойствами коррозионной
среды.
Если разрушению подвергается
вся поверхность изделия, то такой вид
называют сплошной
коррозией,
если разрушаются отдельные участки
поверхности, то – локальной
(местной) коррозией.
Последняя более опасна, так как процесс
может проникать на большую глубину.
Сплошная коррозия бывает равномерной
и
неравномерной.
Имеются
и другие виды коррозионных разрушений,
сочетающие в себе воздействие коррозионной
среды и механические воздействия
(например, коррозионное растрескивание
– коррозия, развивающаяся в зоне
механических напряжений).
Виды
коррозионных сред.
Коррозионные среды подразделяются на
жидкие
и
газообразные,
токопроводящие
и неэлектролиты,
естественные
и искусственно
созданные. К
газообразным относятся газы, образующиеся
в результате сгорания топлива (в ракетах,
двигателей внутреннего сгорания и др.
)
и в различных производствах, а также
природная атмосфера. Жидкие коррозионные
среды – это жидкие неэлектролиты
(сернистая нефть, бензин, керосин и др.)
и токопроводящие (с высокой ионной
проводимостью) жидкости – водные
растворы кислот, щелочей, солей, в том
числе морская вода.
К естественным
коррозионным средам относятся, кроме
атмосферы, почва и вода.
-
Типы
коррозионных процессов. -
По
механизму протекания коррозионного
процесса, зависящему от характера
внешней среды, с которой взаимодействует
металл, различают химическую
и электрохимическую
коррозию. -
Химическая
коррозия
протекает в коррозионных средах, не
проводящих электрический ток.
Электрохимическая
коррозия характерна
для сред, имеющих ионную проводимость.
Этот вид коррозии наиболее распространен.
Причиной
химической и электрохимической коррозии
металлов и сплавов является их
термодинамическая неустойчивость в
различных средах при данных внешних
условиях, вследствие чего почти все они
встречаются в природе в окисленном
состоянии: в виде оксидов, сульфидов,
силикатов, алюминатов, сульфатов и т.д.
С
точки зрения термодинамики коррозия
металлов – самопроизвольный процесс,
сопровождающийся уменьшением энергии
Гиббса (<
0). Чем отрицательнее значение ,
тем выше термодинамическая возможность
коррозионного процесса.
Термодинамика
позволяет определить только возможность
или невозможность протекания коррозии,
но не дает принципиальных представлений
о скорости и механизме этого процесса. Поэтому при изучении процесса коррозии
важнейшее значение имеют также
кинетические закономерности.
Коррозия
протекает на границе двух фаз: металл
– окружающая среда, т.е. является
многостадийным гетерогенным процессом
и подчиняется законам химической
кинетики для гетерогенных реакций.
Всякий гетерогенный процесс состоит
из последовательно протекающих реакций:
-
диффузии частиц к поверхности металла;
-
их адсорбции;
-
поверхностной химической реакции;
-
десорбции продуктов с поверхности;
-
диффузии продуктов реакции в объем коррозионной среды.
Скорость
коррозии обычно определяется скоростью
самой медленной (лимитирующей) из
рассмотренных реакций.
Установление
лимитирующей стадии процесса – ключевой
вопрос кинетики коррозионных процессов,
так как зная эту стадию, можно воздействовать
на ее ход и тем самым затормозить
коррозионное разрушение.
Во многих
случаях продукты коррозии играют
решающую роль в торможении коррозионных
процессов, например, при образовании
на поверхности защитных пленок,
препятствующих дальнейшей диффузии
активных частиц коррозионной среды.






