- Общая характеристика элементов IVa группы
- Природные соединения
- Получение
- Химические свойства
- Оксид углерода II — СO
- Оксид углерода IV — CO2
- Угольная кислота
- Урок 3. Молекулы и простые вещества – HIMI4KA
- Что такое молекула?
- Простые вещества
- Металлы и неметаллы
- Названия простых веществ
- p-Элементы
- 2.3.4. Химические свойства углерода и кремния
- Восстановительные свойства углерода
- Взаимодействие углерода с оксидами неметаллов
- Окислительные свойства углерода
- Химические свойства кремния
- Взаимодействие кремния с простыми веществами
- неметаллами
- металлами
- Взаимодействие кремния со сложными веществами
- ХИМИ́ЧЕСКИЕ ЭЛЕМЕ́НТЫ
- Характерные химические свойства простых веществ-металлов
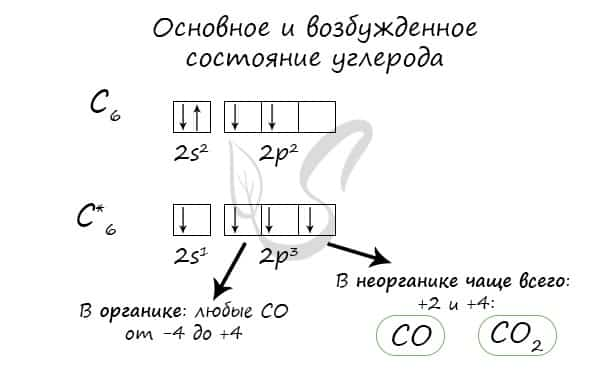
Углерод — неметаллический элемент IV группы периодической таблицы Д.И. Менделеева, является важнейшей частью всех органических веществ в природе.

Общая характеристика элементов IVa группы
От C к Pb (сверху вниз в периодической таблице) происходит увеличение: атомного радиуса, металлических, основных, восстановительных свойств. Уменьшается электроотрицательность, энергия ионизация, сродство к электрону.
Из элементов IVа группы углерод и кремний относятся к неметаллам, германий, олово и свинец — металлы.
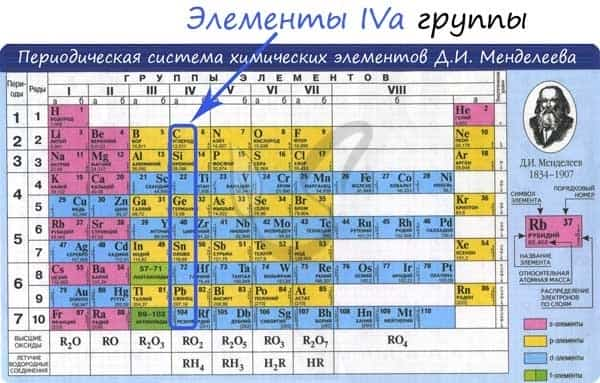
Электронные конфигурации у данных элементов схожи, так как они находятся в одной группе (главной подгруппе!), общая формула ns2np2:
- C — 2s22p2
- Si — 3s23p2
- Ge — 4s24p2
- Sn — 5s25p2
- Pb — 6s26p2
Природные соединения
В природе углерод встречается в виде следующих соединений:
- Аллотропных модификаций — графит, алмаз, фуллерен
- MgCO3 — магнезит
- CaCO3 — кальцит (мел, мрамор)
- CaCO3*MgCO3 — доломит

Получение
Углерод получают в ходе пиролиза углеводородов (пиролиз — нагревание без доступа кислорода). Также применяется получение углеродистых соединений: древесины и каменного угля.
C2H6 → (t) C + H2 (пиролиз этана)
Химические свойства
- Реакции с неметаллами
- При нагревании углерод реагирует со многими неметаллами: водородом, кислородом, фтором.
- C + H2 → (t) CH4 (метан)
- 2С + O2 → (t) 2CO (угарный газ — продукт неполного окисления углерода, образуется при недостатке кислорода)
- С + O2 → (t) CO2 (углекислый газ — продукт полного окисления углерода, образуется при достаточном количестве кислорода)
- С + F2 → (t) CF4
- Реакции с металлами
- Ca + C → CaC2 (карбид кальция, СО углерода = -1)
- Al + C → Al4C3 (карбид алюминий, СО углерода -4)
- Очевидно, что степень окисления углерода в соединении с различными металлами может отличаться.
- Восстановительные свойства
- Углерод — хороший восстановитель. С помощью него металлургическая промышленность справляется с задачей получения чистых металлов из их оксидов:
- Fe2O3 + C → Fe + CO2
- ZnO + C → Zn + CO
- FeO + C → Fe + CO
- Углерод восстанавливает не только металлы из их оксидов, но и неметаллы подобным образом:
- SiO2 + C → (t) Si + CO
- Может восстановить и собственный оксид:
- CO2 + C → CO
- Реакция с водой
- Реакции с кислотами
- В реакциях с кислотами углерод проявляет себя как восстановитель:
- C + HNO3(конц.) → (t) CO2 + NO2 + H2O
- C + HNO3 → CO2 + NO + H2O
- C + H2SO4(конц.) → CO2 + SO2 + H2O
При нагревании углерод реагирует с металлами, проявляя свои окислительные свойства. Напомню, что металлы могут принимать только положительные степени окисления.


Известная реакция взаимодействия угля с водяным паром, называемая также газификацией угля, торфа, сланца — крайне важна в промышленности:
C + H2O → CO↑ + H2↑
Оксид углерода II — СO
Оксид углерода II — продукт неполного окисления углерода. Несолеобразующий оксид. Это чрезвычайно опасное вещество часто образуется при пожарах в замкнутых помещениях, при прогревании машины в гараже.
Растворяясь в крови угарный газ (имеющий в 300 раз большее сродство к гемоглобину, чем кислород) легко выигрывает конкуренцию у кислорода и занимает его место в эритроцитах. Отравление угарным газом нередко заканчивается летальным исходом.
- Получение
- В промышленности угарный газ получают восстановлением оксида углерода IV или газификацией угля (t = 1000 °С).
- CO2 + C → (t) CO
- C + H2O → (t) CO + H2
- В лаборатории угарный газ получают при разложении муравьиной кислоты в присутствии серной:
- HCOOH → (H2SO4) CO + H2O
- Химические свойства
- Полностью окисляется до углекислого газа в реакции с кислородом, восстанавливает оксиды металлов.
- CO + O2 → CO2
- Fe2O3 + CO → Fe + CO2
- FeO + CO → Fe + CO2
- Образование карбонилов — чрезвычайно токсичных веществ.
- Fe + CO → (t) Fe(CO)5

Оксид углерода IV — CO2
Продукт полного окисления углерода. Относится к кислотным оксидам, соответствует угольной кислоте H2CO3. Бесцветный газ, без запаха.
- Получение
- В промышленности углекислый газ получают при разложении известняка, в ходе производства алкоголя, при спиртовом брожении глюкозы.
- CaCO3 → (t) CaO + CO2↑
- C6H12O6 → C2H5OH + CO2↑
- В лабораторных условиях используют реакцию мела (мрамора) с соляной кислотой.
- CaCO3 + HCl → CaCl2 + H2O + CO2↑
- Углекислый газ образуется при горении органических веществ:
- C3H8 + O2 → CO2 + H2O

Химические свойства
- Реакция с водой
- Реакции с основными оксидами и основаниями
- В ходе реакций с основаниями и основными оксидами углекислый газ образует соли угольной кислоты: средние — карбонаты (при избытке основания), кислые — гидрокарбонаты (при избытке кислотного оксида).
- 2KOH + CO2 → K2CO3 + H2O (соотношение основание — кислотный оксид 2:1)
- KOH + CO2 → KHCO3 (соотношение основание — кислотный оксид 1:1)
- Na2O + CO2 → Na2CO3
- Окислительные свойства
В результате реакции с водой образуется нестойкая угольная кислота, которая сразу же распадается на воду и углекислый газ. CO2 + H2O ⇄ H2CO3
При нагревании способен окислять металлы до их оксидов.
Zn + CO2 → (t) ZnO + CO
Угольная кислота
Слабая двухосновная кислота, существующая только в растворах, разлагается на воду и углекислый газ.
Химические свойства
- Качественная реакция
- Это можно легко объяснить, вспомнив про способность угольной кислоты образовывать кислые соли, которые растворимы.
- Ca(OH)2 + CO2 → CaCO3 (осадок выпадает)
- CaCO3 + H2O + CO2 → Ca(HCO3)2 (осадок растворяется)
- Средние и кислые соли
- Li2CO3 + CO2 + H2O → LiHCO3 (средняя соль + кислота = кислая соль)
- Чтобы вернуть среднюю соль, следует добавить к кислой соли щелочь.
- LiHCO3 + LiOH → Li2CO3 + H2O
- Нагревание солей угольной кислоты
- При нагревании карбонаты распадаются на соответствующий оксид металла и углекислый газ, гидрокарбонаты — на карбонат металла, углекислый газ и воду.
- MgCO3 → (t) MgO + CO2
- KHCO3 → (t) K2CO3 + CO2↑ + H2O
Определить наличие карбонат-иона можно с помощью кислоты: такая реакция сопровождается «закипанием» — появлением пузырьков бесцветного газа без запаха. MgCO3 + HCl → MgCl2 + CO2↑ + H2O Я не раз встречал описание реакций, связанных с этой кислотой, которое заслуживает нашего внимания. В задании было сказано, что при добавлении к раствору гидроксида кальция углекислого газа осадок появлялся, при дальнейшем пропускании углекислого газа — помутнение исчезало.
Чтобы сделать из средней соли (карбоната) — кислую соль (гидрокарбонат) нужно добавить угольную кислоту. Однако написать ее формулу H2CO3 — ошибка. Ее следует записать в виде воды и углекислого газа.
Урок 3. Молекулы и простые вещества – HIMI4KA
Архив уроков › Химия 8 класс
В уроке 3 «Молекулы и простые вещества» из курса «Химия для чайников» рассмотрим, что такое молекулы, простые вещества, а также металлы и неметаллы. Напоминаю, что в прошлом уроке «Относительная атомная масса химических элементов» мы рассмотрели разные способы выражения массы химических элементов.

Атомы химических элементов существуют в природе как в свободном, так и в связанном состоянии. Например, благородные газы — гелий He, неон Ne, аргон Ar, криптон Kr, ксенон Xe — находятся в воздухе в виде одиночных атомов.
Атомы всех остальных элементов в природе не существуют изолированно друг от друга. Они всегда стремятся соединиться, связаться с другими атомами за счет особых сил. Почему? Так они достигают более устойчивого состояния.
Это одна из иллюстраций всеобщего принципа природы — стремления к максимально устойчивому состоянию.
Что такое молекула?
Из курса физики вы уже немного знаете о молекулах — частицах вещества, состоящих обычно из двух и более атомов. Что же такое молекула?
Молекула — наименьшая частица вещества, способная существовать самостоятельно и сохраняющая его химические свойства.
Молекулы благородных газов одноатомны, а молекулы таких веществ, как кислород, водород, азот, хлор, бром, состоят из двух атомов (рис. 34). Молекула фосфора содержит четыре атома, а серы — восемь (рис. 35).
Простые вещества
Если вещества состоят из атомов одного вида, то они относятся к простым веществам.
Простыми называются вещества, которые образованы атомами одного химического элемента.
Простые вещества — одна из форм существования химических элементов в природе. Простые вещества, состоящие из молекул, относятся к веществам молекулярного строения. При обычных условиях среди них есть газы (водород, кислород, азот, фтор, хлор, благородные газы), жидкости (бром) и твердые вещества (сера, иод, фосфор).
Элемент кислород существует в виде двух простых веществ молекулярного строения: одно из них (просто кислород) состоит из двухатомных молекул, а второе (озон) — из трехатомных.
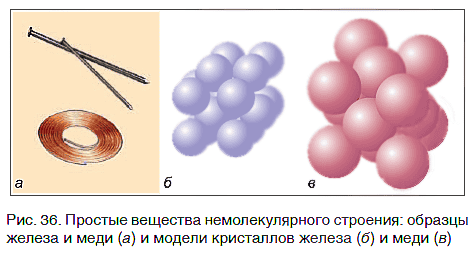
Связываясь друг с другом, атомы образуют не только молекулы. Гораздо больше простых веществ, которые имеют немолекулярное строение. Они обычно представляют собой твердые кристаллические вещества, построенные из атомов, например кристаллы алмаза, графита, меди, железа (рис. 36).
Металлы и неметаллы
Простые вещества по их свойствам делят на металлы и неметаллы.
Все металлы при комнатной температуре являются твердыми веществами (за исключением ртути), которые проводят электрический ток и теплоту, имеют характерный металлический блеск. Многие из металлов пластичны, т. е. меняют свою форму при механическом воздействии. Благодаря этому свойству металлы можно ковать, расплющивать, вытягивать в проволоку.
Большинство простых веществ — металлы, и все они имеют немолекулярное строение.
 Хотя простых веществ неметаллов гораздо меньше, по своим свойствам они различаются между собой значительно сильнее, чем металлы. Почти все они плохо проводят электрический ток и теплоту. Многие из неметаллов при обычных условиях являются хрупкими твердыми веществами (рис. 37), другие — газами (рис. 38), а бром — жидкостью (рис. 39). Большинство неметаллов существует в виде молекул, но некоторые имеют немолекулярное строение, например бор, углерод, кремний.
Хотя простых веществ неметаллов гораздо меньше, по своим свойствам они различаются между собой значительно сильнее, чем металлы. Почти все они плохо проводят электрический ток и теплоту. Многие из неметаллов при обычных условиях являются хрупкими твердыми веществами (рис. 37), другие — газами (рис. 38), а бром — жидкостью (рис. 39). Большинство неметаллов существует в виде молекул, но некоторые имеют немолекулярное строение, например бор, углерод, кремний.
Алмаз и графит — это простые вещества, состоящие из атомов одного и того же химического элемента — углерода.
Хотя они оба имеют немолекулярное строение, свойства этих веществ сильно отличаются: алмаз — прозрачное, самое твердое в природе вещество, а графит — темно-серое, непрозрачное, мягкое вещество (рис. 40).
Их свойства различны потому, что различно строение их кристаллов, хотя состоят эти кристаллы из одних и тех же атомов — атомов углерода.

Названия простых веществ
В настоящее время известно более 400 простых веществ, хотя элементов пока открыто только 118. Названия большинства простых веществ такие же, как и названия соответствующих химических элементов. Только у элемента углерода простые вещества (как вы уже знаете) имеют собственные названия, да еще у элемента кислорода есть простое вещество озон.
Необходимо различать понятия простое вещество и химический элемент, поскольку в большинстве случаев их названия совпадают.
Химический элемент — это определенный вид атомов. Поэтому название химического элемента — это то, что объединяет атомы данного вида. У всех таких атомов есть общие черты. Каждый химический элемент обозначается с помощью соответствующего химического знака.
В то же время понятие простое вещество обозначает конкретное химическое вещество, образованное атомами одного вида. Оно характеризуется определенными составом, строением, физическими и химическими свойствами.
- Например, если говорят о том, что в состав какого-то вещества входит азот, то имеют в виду атомы этого химического элемента, а когда говорят об азоте, который входит в состав воздуха, то, конечно, речь идет о простом веществе.
- Более подробно о различии понятий «простое вещество» и «химический элемент» вы узнаете в главах 2, 3.
- Краткие выводы урока:
- Молекула — наименьшая частица вещества, способная существовать самостоятельно и сохраняющая его химические свойства.
- Простые вещества состоят из атомов одного химического элемента.
- Простые вещества имеют молекулярное или немолекулярное строение.
- Простые вещества делят на металлы и неметаллы.
Надеюсь урок 3 «Молекулы и простые вещества» был понятным и познавательным. Если у вас возникли вопросы, пишите их в комментарии.
p-Элементы
К p-элементов периодической системы относятся элементы с валентным p-подуровнем. Эти элементы расположены в III, IV, V, VI, VII, VIII группах, главных подгруппах периодической системы Д.И.Менделеева. В периоде орбитальные радиусы атомов с увеличением атомного номера уменьшаются, а энергия ионизации в целом растет.
В подгруппах элементов с увеличением номера элемента, размеры атомов в общем увеличиваются, а энергия ионизации уменьшается.
p-Элементы III группы К p-элементов III группе относятся бор B, алюминий Al, галлий Ga, индий In и таллий Tl. По характеру этих элементов бор является типичным неметаллом, остальные — металлы.
В пределах подгруппы прослеживаются резкий переход от неметаллу к металлам.
Свойствами и поведением бор подобный кремния, что является результатом диагональной сродства элементов в периодической системе, согласно которой смещение в периоде вправо вызывает усиление неметаллического характера, а вниз по группе — металлического, поэтому аналогичные по свойствам элементы оказываются расположенными диагонально рядом, например Li и Mg, Ber и Al, B и Si.
Электронное строение валентных подуровней атомов p-элементов III группы в основном состоянии имеет вид ns2np1. В соединениях бор и трехвалентные алюминий, галлий и индий, кроме того, могут образовывать соединения со степенью окисления +1, а для таллия последний является довольно характерным.
Алюминий является одним из самых распространенных элементов природы, бор — достаточно распространенный, галлий, индий а таллий распространены мало и очень рассеяны, поэтому относятся к редким.
p-Элементы IV группы
К p-элементов IV группы относятся углерод C, кремний Si, германий Ge, олово Sn и свинец Pb. Общая электронная конфигурация валентных подуровней атомов p-элементов в основном состоянии ns2np2. Вследствие наличия 2-х неспаренных p-электронов в соединениях они могут проявлять степень окисления +2, причем эта тенденция усиливается в направлении к свинцу. Атомы могут переходить в возбужденное состояние с образованием четырех валентных электронов, что обусловливает возникновение соединений со степенью окисления +4. Это состояние является характерным для углерода и кремния, способность к выявлению степени окисления +4 ослабляется в направлении к свинцу. Характер изменения физических свойств элементов и соответствующих простых веществ свидетельствует о закономерное ослабление неметаллических и усиление металлических свойств в ряду C — Si — Ge — Pb.
Углерод и кремний — типичные неметаллы, образующие атомные кристаллические решетки с ковалентной связью. Их простые вещества характеризуются высокими твердостью, температурами плавления и кипения.
Для германия эти параметры остаются относительно большими, что вместе с хрупкостью характеризует его как алмазоподобный кристалл с ковалентным типом связи. В то же время в германию уже обнаружено некоторое взнос металлической связи.
На это указывает заметное уменьшение ширины запрещенной зоны и росту электропроводности. Для олова полупроводниковые свойства сохраняются лишь до температуры 13,2°С, при дальнейшем нагревании олово переходит в металлический состояние. Свинец — металл, который не проявляет полупроводниковых свойств.
Возрастание металлических свойств сопровождается постепенным уменьшением энергии ионизации элементов, их электроотрицательности и усилением восстановительной способности простых веществ.
p-Элементы V группы
К p-элементов V группы относятся азот N, фосфор P, мышьяк As, стибий Sb и висмут Bi, при чем азот и фосфор являются типичными элементами, а остальные элементы образуют подгруппу мышьяка. Электронная конфигурация валентных подуровней элементов в основном состоянии ns2np3.
На последнем энергетическом уровне атомы элементов этой подгруппы имеют по три одноэлектронные орбита ли, которые могут образовывать три ковалентные связи. В то же время в связывании могут принимать участие двухэлектронная орбиталь, а в случае элементов, размещенных после азота, — также свободные nd-орбитали.
Так, азот способен образовывать четвертая ковалентная связь по донорно-акцепторным механизмом с использованием своей неподеленной пары электронов. Примером может служить ион аммония NH4+ и его многочисленные производные.
Максимально возможная валентность азота в его соединениях равна 4, и каждая пара электронов четырех ковалентных связей занимает одну из четырех орбиталей.
- В отличие от азота остальное атомов p-элементов V группы имеют nd-подуровень, вакантные орбитали которого способны участвовать в образовании дополнительных ковалентных связей, за счет чего их ковалентность может расти до 5.
- Факторы увеличения радиусов атомов и уменьшение электроотрицательности в ряду N — P — As — Sb — Bi влияют на свойства простых веществ и соединений элементов: постепенно уменьшается стойкость неметаллических форм простых веществ и увеличивается устойчивость металоподобных (азот — типичный неметал с большой электронегативностью, а висмут — типичный металл, электроотрицательности которого лишь 1,70), ослабляются кислотные и усиливаются основные свойства бинарных соединений элементов, их гидроксидов и тому подобное.
- p-Элементы VI группы
К p-элементов VI группы относятся кислород O, сера S, селен Se, теллур Te и полоний Po. На валентных подуровням атомов p-Элементы VI группы размещено 6 электронов: электронная конфигурация валентных подуровней атомов в основном состоянии ns2np4.
За счет использования неспаренных электронов элементы в своих соединениях обнаруживают характерную для них валентность 2. Она может расти в случае образования донорно-акцепторных связей, в которых принимают участие двухэлектронные орбитали.
Например, в кислых водных растворах существуют ионы гидроксонию H3O+, в которых атом кислорода соединен с тремя атомами водорода ковалентными связями.
В отличие от кислорода атомы остальных p-элементов VI группы имеют свободный nd-подуровень, орбитали которого также способны принимать участие в образовании химических связей, в результате чего валентность серы, селена, теллура и полония может возрастать до 6.
Для атомов p-элементов VI группы характерно присоединение электронов для завершения np-подуровня и образования устойчивой электронной конфигурации следующего благородного газа ns2np6. Это определяет характерный для них степень окисления -2 в соединениях с менее электронегативными элементами.
С переходом к полонию наблюдается характерное для групп p-элементов уменьшение устойчивости высшей степени окисления. Для полония соединения со степенью окисления +6 очень неустойчивы. Это обусловлено сильным ростом энергетической разницы между ns-и np-подуровнями, что затрудняет участие ns-электронов в образовании химических связей.
В ряду O — S — Se — Te — Po возрастают радиусы атомов, что характерно для групп p-элементов, уменьшение энергии их ионизации и электроотрицательности.
Ослабление неметаллических свойств элементов проявляется также в уменьшении стойкости неметаллических форм простых веществ и в росте устойчивости металлических.
Это приводит к тому, что в отличие от предыдущих элементов подгруппы полоний уже имеет металлическую кристаллическую решетку и относится к металлам.
p-Элементы VII группы — галогены
К p-элементов VII группы относятся фтор F, хлор Cl, бром Br, йод I и астату At. Элементы имеют общее название галогены. Электронная конфигурация валентных подуровней атомов p-элементов VII группы соответствует формуле ns2np5.
На последнем энергетическом уровне атомы элементов имеют по семь электронов, один из которых является неспаренным. Этим объясняется сходство их свойств.
Наличие одноэлектронной орбитали определяет характерную для всех элементов валентность 1.
Одновременно галогены (кроме фтора) имеют вакантный nd-подуровень, орбитали которого также могут участвовать в образовании химических связей и увеличивать валентность атомов элементов до 7.
Молекулы галогенов двухатомные, неполярные. Все галогены являются неметаллами. В ряду F — Cl — Br — I — At ослабляются признаки неметаличности: фтор — самый типичный элемент-неметала, а астату обнаруживает некоторые свойства элемента-металла.
В пределах своих периодов галогены характеризуются малыми атомными радиусами, что обуславливает их высокие электроотрицательности и сродство к электрону, поэтому для них в сложных веществах самым стойким является степень окисления -1.
p-Элементы VIII группы
К p-элементов VIII группы относятся гелий He, неон Ne, аргон Ar, криптон Kr, ксенон Xe и радон Rh, которые составляют главную подгруппу. Атомы этих элементов имеют завершенные внешние электронные слои, поэтому электронная конфигурация валентных подуровней их атомов в основном состоянии имеет вид 1s2 (Не) и ns2np6 (остальные элементы). Благодаря очень высокой устойчивости электронных конфигураций они в целом характеризуются большими значениями энергий ионизации и химической инертностью, поэтому их называют благородными (инертными) газами. В свободном состоянии они существуют в виде атомов (одноатомных молекул). Атомы гелия (1s2), неона (2s22p6) и аргона (3s23p6) имеют особо устойчивую электронную структуру, поэтому соединения валентного типа для них неизвестны.
Криптон (4s24p6), ксенон (5s25p6) и радон (6s26p6) отличаются от предыдущих благородных газов большими размерами атомов и, соответственно, меньшими энергиями ионизации. Они способны образовывать соединения, которые зачастую имеют низкую стойкость.
2.3.4. Химические свойства углерода и кремния
Углерод способен образовывать несколько аллотропных модификаций. Это алмаз (наиболее инертная аллотропная модификация), графит, фуллерен и карбин.
Древесный уголь и сажа представляют собой аморфный углерод. Углерод в таком состоянии не имеет упорядоченной структуры и фактически состоит из мельчайших фрагментов слоев графита. Аморфный углерод, обработанный горячим водяным паром, называют активированным углем.
1 грамм активированного угля из-за наличия в нем множества пор имеет общую поверхность более трехсот квадратных метров! Благодаря своей способности поглощать различные вещества активированный уголь находит широкое применение как наполнитель фильтров, а также как энтеросорбент при различных видах отравлений.
С химической точки зрения аморфный углерод является наиболее активной его формой, графит проявляет среднюю активность, а алмаз является крайне инертным веществом. По этой причине, рассматриваемые ниже химические свойства углерода следует прежде всего относить к аморфному углероду.
Восстановительные свойства углерода
Как восстановитель углерод реагирует с такими неметаллами как, например, кислород, галогены, сера.
В зависимости от избытка или недостатка кислорода при горении угля возможно образование угарного газа CO или углекислого газа CO2:
При взаимодействии углерода со фтором образуется тетрафторид углерода:
При нагревании углерода с серой образуется сероуглерод CS2:
Углерод способен восстанавливать металлы после алюминия в ряду активности из их оксидов. Например:
Также углерод реагирует и с оксидами активных металлов, однако в этом случае наблюдается, как правило, не восстановление металла, а образование его карбида:
Взаимодействие углерода с оксидами неметаллов
Углерод вступает в реакцию сопропорционирования с углекислым газом CO2:
Одним из наиболее важных с промышленной точки зрения процессов является так называемая паровая конверсия угля. Процесс проводят, пропуская водяной пар через раскаленный уголь. При этом протекает следующая реакция:
При высокой температуре углерод способен восстанавливать даже такое инертное соединение как диоксид кремния. При этом в зависимости от условия возможно образование кремния или карбида кремния (карборунда):
- Также углерод как восстановитель реагирует с кислотами окислителями, в частности, концентрированными серной и азотной кислотами:
Окислительные свойства углерода
- Химический элемент углерод не отличается высокой электроотрицательностью, поэтому образуемые им простые вещества редко проявляют окислительные свойства по отношению к другим неметаллам.
- Примером таких реакций является взаимодействие аморфного углерода с водородом при нагревании в присутствии катализатора:
- а также с кремнием при температуре 1200-1300 оС:
Окислительные свойства углерод проявляет по отношению к металлам.
Углерод способен реагировать с активными металлами и некоторыми металлами средней активности. Реакции протекают при нагревании:
- Карбиды активных металлов гидролизуются водой:
- а также растворами кислот-неокислителей:
- При этом образуются углеводороды, содержащие углерод в той же степени окисления, что и в исходном карбиде.
Химические свойства кремния
Кремний может существовать, как и углерод в кристаллическом и аморфном состоянии и, также, как и в случае углерода, аморфный кремний существенно более химически активен, чем кристаллический.
Иногда аморфный и кристаллический кремний, называют его аллотропными модификациями, что, строго говоря, не совсем верно. Аморфный кремний представляет собой по сути конгломерат беспорядочно расположенных друг относительно друга мельчайших частиц кристаллического кремния.
Взаимодействие кремния с простыми веществами
неметаллами
- При обычных условиях кремний ввиду своей инертности реагирует только со фтором:
- С хлором, бромом и йодом кремний реагирует только при нагревании.
При этом характерно, что в зависимости от активности галогена, требуется и соответственно различная температура:
- Так с хлором реакция протекает при 340-420 оС:
- С бромом – 620-700 оС:
- С йодом – 750-810 оС:
- Все галогениды кремния легко гидролизуются водой:
- а также растворами щелочей:
- Реакция кремния с кислородом протекает, однако требует очень сильного нагревания (1200-1300оС) ввиду того, что прочная оксидная пленка затрудняет взаимодействие:
- При температуре 1200-1500 оС кремний медленно взаимодействует с углеродом в виде графита с образованием карборунда SiC – вещества с атомной кристаллической решеткой подобной алмазу и почти не уступающего ему в прочности:
- С водородом кремний не реагирует.
металлами
Ввиду своей низкой электроотрицательности кремний может проявлять окислительные свойства лишь по отношению к металлам. Из металлов кремний реагирует с активными (щелочными и щелочноземельными), а также многими металлами средней активности. В результате такого взаимодействия образуются силициды:
- Силициды активных металлов легко гидролизуются водой или разбавленными растворами кислот-неокислителей:
- При этом образуется газ силан SiH4 – аналог метана CH4.
Взаимодействие кремния со сложными веществами
- С водой кремний не реагирует даже при кипячении, однако аморфный кремний взаимодействует с перегретым водяным паром при температуре около 400-500оС. При этом образуется водород и диоксид кремния:
- Из всех кислот кремний (в аморфном состоянии) реагирует только с концентрированной плавиковой кислотой:
- Кремний растворяется в концентрированных растворах щелочей. Реакция сопровождается выделением водорода:
ХИМИ́ЧЕСКИЕ ЭЛЕМЕ́НТЫ
Авторы: Э. Г. Раков
ХИМИ́ЧЕСКИЕ ЭЛЕМЕ́НТЫ, совокупности атомов, ядра которых содержат одинаковое число протонов; имеют одинаковые заряды ядер и определённый порядковый (атомный) номер в периодической системе химических элементов. Каждый Х. э. имеет название на лат. и нац.
языках и буквенный символ из одной, двух или трёх (временно, до утверждения постоянного междунар. названия) лат. букв. Первое научно обоснованное определение понятия «Х. э.» сформулировано Р. Бойлем в 1661. Численное равенство заряда ядра атома и порядкового номера Х. э.
установлено в 1914 Г. Мозли.
Названия простых веществ и соответствующих им Х. э. часто совпадают (так, термин «хлор» относится к простому веществу и к элементу, который может быть составной частью химич. соединений).
Один Х. э. может существовать в виде нескольких простых веществ – аллотропных модификаций (напр., углерод выделяется в форме графита, алмаза, графена, карбина, нанотрубок и аморфной фазы).
Х. э. занимают ок. 4,6% вещества Вселенной (доля тёмной материи 22–27%, тёмной энергии 72–74%). Наиболее распространены во Вселенной водород (ок. 75% общей массы вещества) и гелий (чуть менее 25%); примеси др. Х. э. (в т. ч.
кислорода, углерода, неона, железа) незначительны. Синтез Х. э. (нуклеосинтез) постоянно протекает за счёт ядерных реакций слияния и разложения в звёздах и действия космич. излучений. Х. э.
распространяются во Вселенной при взрывах сверхновых звёзд и постепенно скапливаются, образуя планеты.
Атомы одного и того же Х. э., ядра которых имеют разл. число нейтронов, называют изотопами. В природе 21 Х. э. имеет по одному изотопу – изотопно-чистые; большинство Х. э. имеет по неск. изотопов – изотопно-смешанные (наибольшее число стабильных изотопов у олова – 10).
В коре Земли обнаружено 94 Х. э. Технеций и прометий, существующие в природе в ничтожных количествах и не имеющие стабильных изотопов, часто не включают в перечень природных, поскольку наряду с астатом, плутонием и Х. э.
с более высокими, чем у плутония, атомными номерами впервые получены искусственно в ядерных реакциях. Х. э., все изотопы которых нестабильны, называются радиоактивными; к ним относятся технеций, прометий, полоний и все элементы с более высокими, чем у полония, атомными номерами. Радиоактивные Х.
э. с более высокими, чем у урана, атомными номерами относят к трансурановым.
Открытие Х. э. происходило в течение длительного времени. С древности известны: углерод, сера, железо, медь, серебро, олово, золото, ртуть и свинец. В средние века получены: мышьяк, сурьма, висмут, цинк, в 17 в. – фосфор. В 18 в.
открыты азот, барий, бериллий, водород, вольфрам, иттрий, кислород, кобальт, марганец, молибден, никель, платина, стронций, теллур, титан, уран, фтор, хлор, хром, цирконий; в 19 в.
– актиний, алюминий, аргон, бор, бром, ванадий, гадолиний, галлий, гелий, германий, гольмий, диспрозий, индий, иод, иридий, иттербий, кадмий, калий, кальций, кремний, криптон, ксенон, лантан, литий, магний, натрий, неодим, неон, ниобий, осмий, палладий, полоний, празеодим, радий, родий, радон, рубидий, рутений, самарий, селен, скандий, таллий, тантал, тербий, тулий, цезий, эрбий, церий; в 20 в. – астат, гафний, европий, лютеций, протактиний, прометий, рений, технеций, торий, нептуний, плутоний, франций, америций, кюрий, берклий, калифорний, эйнштейний, фермий, менделевий, нобелий, лоуренсий, резерфордий, дубний, сиборгий, борий, хассий, мейтнерий, дармштадтий, рентгений, коперниций (элемент 112), флеровий, ливерморий (элемент 116); в 21 в. – элементы 113, 115, 117, 118.
В зависимости от того, на каком энергетич. уровне атома Х. э. находятся электроны, различают s- (элементы групп 1 и 2 длинной формы периодич. системы), p- (групп 13–17), d- (групп 3–12) и f- (лантаноиды и актиноиды) элементы; d-элементы (за исключением цинка, кадмия и ртути) называют также переходными элементами.
Х. э. по свойствам делятся на металлы и неметаллы, граница между которыми расплывчата.
В технологии элементы-металлы подразделяют на чёрные (железо; реже включают ванадий, хром, марганец), цветные (алюминий, медь, никель, титан, вольфрам и др.), благородные (золото, серебро, платина и др.
), лёгкие (литий, бериллий, алюминий, титан, магний), тяжёлые (медь, свинец, цинк и др.), тугоплавкие (вольфрам, молибден, тантал и др.).
В жизнедеятельности человека, животных и растений наибольшую роль играют неметаллы – углерод, азот, кислород и водород, меньшую – натрий, калий, магний, кальций, фосфор, сера и хлор, ещё меньшую – следовые количества хрома, молибдена, марганца, железа, кобальта, никеля, меди, цинка, селена, брома и иода. Роль лития, бора, ванадия, кремния, фтора и мышьяка до конца не выяснена. О функциях Х. э. в живых организмах см. в ст. Микроэлементы.
В геологии выделяют редкие (относительно малораспространённые в природе, с содержанием ниже 0,01% по массе – ниобий, тантал, молибден и др.) и рассеянные (не обладают способностью к концентрированию в земной коре и присутствуют как примеси в минералах – германий, индий, гафний, рений, селен, таллий и др.) химич. элементы.
Характерные химические свойства простых веществ-металлов
- Слайд 1
- Слайд 2
- Далее Задание Цель ресурса • Отработка выполнения задания № 6 ЕГЭ по химии в 2017 году; • Тест может быть использован для проведения текущего и тематического контроля по данной теме; • Пополнение банка электронных тестов для подготовки к ЕГЭ по химии.
- Слайд 3
мин.
20 Время тестирования Начать тестирование 15 Всего заданий Введите фамилию и имя 6. Характерные химические свойства простых веществ-металлов: щелочных, щелочноземельных, алюминия; переходных металлов: меди, цинка, хрома, железа.
Характерные химические свойства простых веществ-неметаллов: водорода, галогенов, кислорода, серы, азота, фосфора, углерода, кремния Межмуниципальный сетевой конкурс «Лучший тест для подготовки к ЕГЭ по химии» 2017 Тест выполнила Москвина Ирина Олеговна у ченица 10 класса А МАОУ СОШ№27 г.
Балаково
Далее Задание Инструкция по выполнению теста Тест состоит из 15 вопросов с выбором двух правильных ответов. В заданиях несколько правильных ответов . Цифры в ответах могут повторяться. Для ответа выберите нужный квадратик и щёлкните на него левой кнопкой мыши. Переход к новому заданию осуществляется по кнопке «Далее».
Можно вернуться к предыдущим слайдам по кнопке «Назад» и исправить ответ. В конце теста можно увидеть результат. Время выполнения теста 20 минут. Удачи!
- Слайд 4
- Далее Задание Источник • Решу ЕГЭ — 2017
- Слайд 5
Далее 1 Задание 1 бал. Выберите все правильные ответы! 1 2 3 4 5 1. Йод, в отличие от хлора, НЕ реагирует с алюминием железом бромидом магния бромидом натрия фторидом натрия
Слайд 6
Далее 2 Задание 1 бал. Выберите все правильные ответы! 1 2 3 4 5 2. С водой при обычной температуре взаимодействуют кислород и сера фтор и калий кремний и кальций железо и медь натрий и барий
Слайд 7
Далее 3 Задание 1 бал. Выберите все правильные ответы! 1 2 3 4 5 3. Только при высокой температуре с водой реагируют K Fe Zn Ag Sr
Слайд 8
Далее 4 Задание 1 бал. Выберите все правильные ответы! 1 2 3 4 5 4. С водой даже при нагревании не реагируют магний железо цинк серебро платина
Слайд 9
Далее 5 Задание 1 бал. Выберите все правильные ответы! 1 2 3 4 5 5 . При обычных условиях практически осуществима реакция между железом и серой ( тв .) сульфатом олова ( II) (p-p) серной кислотой ( конц .) нитратом меди ( II) ( р-р) нитратом цинка (р-р )
Слайд 10
Далее 6 Задание 1 бал. Выберите все правильные ответы! 1 2 3 4 5 6. Сера реагирует с каждым из двух веществ Fe и Al H 2 и HCl Cl 2 и NaCl HCl и NaOH Mg и O 2
Слайд 11
Далее 7 Задание 1 бал. Выберите все правильные ответы! 1 2 3 4 5 7. Только при нагревании вода реагирует с серебром медью цинком золотом железом
Слайд 12
Далее 8 Задание 1 бал. Выберите все правильные ответы! 1 2 3 4 5 8. Общим свойством меди и железа является их способность растворяться в воде царской водке серной кислоте (р-р) азотной кислоте ( конц .) растворе щёлочи
Слайд 13
Далее 9 Задание 1 бал. Выберите все правильные ответы! 1 2 3 4 5 9. При нормальных условиях и железо, и алюминий растворяются в H 2 O концентрированной H 2 SO 4 растворе KOH растворе HCl царской водке
Слайд 14
Далее 10 Задание 1 бал. Выберите все правильные ответы! 1 2 3 4 5 10. И сера, и азот реагируют с H 2 O Mg концентрированной H 2 SO 4 Li раствором KOH
Слайд 15
Далее 11 Задание 1 бал. Выберите все правильные ответы! 1 2 3 4 5 11. Выберите два вещества, при взаимодействии которых с водой образуется щёлочь алюминием магнием барием цинком натрием
Слайд 16
Далее 12 Задание 1 бал. Выберите все правильные ответы! 1 2 3 4 5 12 . С щелочами взаимодействуют алюминий кислород железо углерод сера
Слайд 17
Далее 13 Задание 1 бал. Выберите все правильные ответы! 1 2 3 4 5 13. С раствором гидроксида лития взаимодействуют соляная кислота золото медь цинк никель
Слайд 18
Далее 14 Задание 1 бал. Выберите все правильные ответы! 1 2 3 4 5 14. Как углерод, так и калий реагируют с алюминием водородом водой оксидом натрия оксидом углерода( II)
Слайд 19
Итоги 15 Задание 1 бал. Выберите все правильные ответы! 1 2 3 4 5 15. И с соляной кислотой, и с раствором гидроксида натрия могут реагировать алюминий магний свинец калий хлор
Слайд 20
Затрачено времени Выход Снова бал. Всего заданий Ошибки в выборе ответов на задания: Набранных баллов Правильных ответов Оценка Подождите! Идет обработка данных Результаты тестирования






