- Химия и электрический ток
- Ряд напряжений (активности) металлов
- Электролиз
- Коррозия металлов
- Взаимодействие металлов с кислотами
- Электрический ток в металлах
- Носители тока в металлах
- Потенциальный барьер. Движение электронов в кристаллической решетке
- Закон Ома
- Закон Джоуля-Ленца
- Сопротивление металлического проводника
- Электрический ток в металлах: подробное объяснение (формулы)
- Важно знать
- Классическая модель проводимости
- Выводы простым языком
Содержание:
Химический источник тока (аббр. ХИТ) — источник ЭДС, в котором энергия протекающих в нём химических реакций непосредственно превращается в электрическую энергию. Первый химический источник тока был изобретён итальянским учёным Алессандро Вольта в 1800 году.
На странице -> решение задач по химии собраны решения задач и заданий с решёнными примерами по всем темам химии.
Химия и электрический ток
Химические источники тока — это устройства и приборы которые в процессе химической окислительно-восстановительной реакции выделяют напряжение. Также они называются электрохимическими, гальваническими элементами.
Основной принцип действия их основан на взаимодействии химических реагентов которые вступая, в реакцию друг с другом вырабатывают электроэнергию, в виде постоянного тока. Этот процесс происходит без механического или теплового воздействия, что является основными факторами играющими превосходящую роль среди других генераторов постоянного напряжения.
Химические источники тока, сокращённо ХИТ, уже давно нашли применение не только в быту, но и на производстве.
Ряд напряжений (активности) металлов
Если расположить металлы по их способности вытеснять из растворов солей другие металлы, то можно составить ряд относительной тельной активности металлов:
Этот ряд характеризует восстановительную способность металлов только при следующих условиях; металл опускается в раствор соли другого металла. Например,
Иными словами, процесс перехода электронов возможен при наличии соответствующего восстановителя и окислителя. Окислительная способность ионов может быть отражена рядом, аналогичным! ряду напряжений
Это два взаимосвязанных ряда. При составлении ряда окислителей учтен также и другой фактор, который мы принимали во внимание, изучая окислительно-восстановительные процессы, — роль концентрации. Растворы электролитов должны быть равной концентрации (например, однонормальные растворы). Приведем пример, поясняющий сказанное.
В воде концентрация ионов водорода незначительна , тогда как в однонормальном растворе кислоты (при а= 100%) она равна 1 г-ион/л. Водород из воды вытесняют только самые активные металлы (по алюминий включительно), а из кислоты — почти все металлы, кроме Си, Ag, Au, Pt и Hg.
Если бы мы стали изучать способность различных металлов вытеснять другие из расплавов солей, то мы получили бы другой ряд активности металлов и т. д.
Еще раз подчеркнем, что ряд напряжений металлов характеризует относительную активность металлов. Тем не менее, рассматриваемый нами ряд выделяется из всех других благодаря широкой практической применимости. Многие процессы идут именно при таких условиях: металл погружен в раствор электролита.
В частности, непосредственное отношение к рассматриваемому имеет вопрос о гальванических элементах (химических источниках тока). Разве в цинково-медном гальваническом элементе химическое изменение происходит не в результате процесса, аналогичного описанному выше?
Правда, для получения электрического тока пришлось отделить окислитель от восстановителя. Прямой контакт для этих целей не годился. Так, цинково-медный гальванический элемент состоит из двух электродов: цинковой пластины, погруженной в раствор ZnSO4, и медной пластины, погруженной в раствор CuSO4.
Если соединить металлические пластины и растворы солей (электролитическим ключом), начнется движение электронов от цинковой пластины на медную: окислитель и восстановитель начали «работать».
Надо заметить, что измерение электродвижущих сил гальванических элеменгов позволило оценить с количественной стороны ряд напряжений или активности металлов. Если измерить э. д. с. различных гальванических элементов, приняв один из электродов за стандартный (им выбран водородный электрод), то можно вычислить относительные величины потенциалов других электродов.
Таким образом, при работе гальванических элементов осуществляется переход химической энергии в электрическую. С другой стороны, при действии электрического тока на химические соединения, например, при электролизе, осуществляется химическое превращение.
Электролиз
Процесс окисления — восстановления протекает особенно легко при взаимодействии наиболее энергичных окислителей и восстановителей:
Не случайно в природных соединениях натрий и хлор находятся и состоянии ионов . Алюминий образует устойчивое соединение АI2О3. Между тем, промышленность нуждается в свободном хлоре, в металлических натрии и алюминии, т. е. в простых веществах. Вытеснить их из указанных соединений затруднительно, так как не являются хорошими окислителями. Мы не можем для них подобрать соответствующих партнеров—восстановителей, которые отдали бы свои электроны ионам натрия и алюминия. Единственным надежным путем оказывается путь «принудительного» присоединения электронов, что достигается с помощью электролиза.
Электролизом называются окислительно-восстановительные процессы, протекающие в растворах или расплавах электролитов под действием электрического тока. Принято различать электролиз расплавов и растворов электролитов.
В последнем случае приходится, учитывать, что помимо ионов, на которые диссоциирует электролит, в растворе содержится еще незначительное количество ионов , получающихся при диссоциации воды. Под действием постоянного электрического тока начинается направленное движение ионов к соответствующим электродам. Ионы разряжаются на электродах в последовательности, определяемой теми же двумя факторами: 1) силой окислителя и восстановителя, 2) их концентрацией.
Сила окислителей (катионы металлов) может быть оценена с помощью составленного ранее ряда (2), однако с поправкой на то, что в данном случае (водные растворы) концентрация иона водорода незначительная.
Все же при электролизе раствора хлористого натрия на катоде разряжается не ион натрия, а ион водорода. Хотя концентрация последнего мала, но как окислитель он значительно превосходит ион натрия.
Но если мы возьмем раствор SnCl2, то при электролизе на катоде выделяется не водород, а олово, так как концентрация в растворе соли значительно выше, чем концентрация иона водорода, тогда как различия по способности принимать электроны невелики.
Если, рассматривая ряд активности металлов, мы отмечали, что, щелочные, щелочноземельные металлы и алюминий способны вытеснять водород даже из воды, то теперь мы можем сделать такой вывод: при электролизе растворов солей указанных металлов на катоде выделяется водород. При электролизе водных растворов солей остальных металлов на катоде выделяется металл.
В какой же последовательности происходит отдача электронов, анионами на аноде при электролизе водных растворов? Оказалось, что самыми энергичными восстановителями являются ионы галогеноводородных кислот: Им уступают по силе кислородсодержащие анионы. Схематически этот ряд можно выразить так:
- Для понимания процессов, происходящих на аноде при электролизе водных растворов различных солей, существенно то, что гидроксильная группа занимает в этом ряду положение между ионами бескислородных кислот и ионами кислородных кислот. Следовательно, при электролизе раствора хлорида натрия на аноде разряжаются ионы хлора
- и при электролизе раствора сульфата натрия — ионы гидроксила анод:
- Количество вещества, выделившегося при электролизе, можно Подсчитать, пользуясь законом Фарадея:
где А — атомный вес в у. е.; n — число электронов, соответственно отданных или присоединенных; Q—количество электричества в кулонах, F — 96 493 к — постоянная Фарадея). Вычисление можно провести также, исходя из уравнения реакции, однако нельзя забывать, что коэффициенты в уравнениях катодного и анодного процесса определяются с учетом равного числа отданных и присоединенных электронов.
Пример. Одинаковые ли количества железа и хлора выделяются на уголь-I них электродах при электролизе растворов находящихся в последовательно соединенных ячейках?
Решение. Хлора выделится одинаковое количество, а железа — разное, так как при пропускании одного и того же количества электричества (равное количество электронов!) масса выделившегося вещества будет находиться в зависимости от изменения степени окисления:
Как видно, в первой ячейке железа выделится в 1,5 раза больше, чем во второй.
Коррозия металлов
Коррозией называется процесс разрушения материалов под действием окружающей среды. Такому разрушению в той или иной степени подвержены многие материалы. Мы ограничимся рассмотрением коррозии металлов.
Трудно оценить тот ущерб, который наносит народному хозяйству этот разрушительный процесс. Примерно 10% ежегодно добываемого в мире металла расходуется на возмещение потерь из-за коррозии.
Причина коррозии заключается в том, что металлы, являясь типичными восстановителями, способны самопроизвольно переходить и ионное состояние. Этот переход сопровождается образованием соединений на поверхности металла, что нередко приводит к механическому разрушению изделия, выполненного из этого металла. Этот процесс совершается под действием окислителей, находящихся во внешней среде.
Различают два вида коррозии: химическая и электрохимическая коррозия. Химические и электрохимические реакции, протекающие на границе металл—среда, и приводят к разрушению поверхности металла.
Химическая коррозия — это непосредственное взаимодействие металла с токонепроводящей внешней средой. Например, окисление металла кислородом воздуха при высокой температуре (газовая коррозия) или разрушение, происходящее при низких температурах в органических растворителях, нефти, и т. п.
Наиболее распространенной является газовая коррозия, при которой поверхность металла покрывается различными по составу, толщине и свойствам пленками.
Некоторые окисные пленки защищают в той или иной степени металлы от дальнейшего разрушения другие — напротив, способствуют развитию процесса коррозии (окислы железа, щелочных и щелочноземельных металлов).
Широко распространена электрохимическая коррозия — процесс разрушения металла в растворе электролита.
Взаимодействие металла с растворами, способными проводить электрический ток, происходит не только при непосредственном погружении металлического изделия в раствор электролита, но даже при хранении в атмосферных условиях, так как на его поверхности образуется (адсорбируется) тонкая пленка влаги.
В этом тонком слое воды растворяются газы, содержащиеся в атмосфере, и, таким образом, создаются условия взаимодействия металла с раствором электролита.
В этом случае коррозия принципиально отличается — как по характеру протекания, так и по продуктам реакции — от химической коррозии, Механизм электрохимической коррозии по существу напоминает механизм работы гальванического элемента, ибо практически любой металл содержит те или иные примеси.
Вследствие этого коррозионное разрушение металлов в растворах электролитов чаще всего протекает в результате работы огромного количества короткозамкнутых микроскопических гальванических элементов. Разрушение металла вызывается не только наличием включений и примесей, создающих электрохимическую неоднородность поверхности, но также неодинаковым строением материала, неоднородностью поверхности и т. д.
Механизм химической и электрохимической коррозии металлов показан на рис. 9. Роль образования гальванических пар в процессе взаимодействия с электролитом может быть выяснена на таком примере.
Известно, что ни медь, ни серебро не вытесняют водород из кислот, но если в раствор соляной кислоты опустить соединенные вместе пластины из меди и серебра (короткозамкнутый гальванический элемент), то происходит выделение водорода. Медь растворяется
- а на серебряной пластинке идет восстановление водорода:
- Таким образом, «чистота» металла, его восстановительные свойства, характер и концентрация окислителя во внешней среде — вот основные факторы, определяющие процесс коррозии и образование продуктов коррозии.
В некоторых случаях на коррозию металлов оказывают влияние и другие факторы, являющиеся специфическими для данной географической среды. При рассмотрении коррозии в морской воде приходится учитывать не только ее солевой баланс, но также флору и фауну морей. Так, некоторые морские организмы прикрепляются К днищу корабля, увеличивая его коррозию, и т. д.
- Какие же существуют методы борьбы с коррозией?
- Прежде всего обратим внимание на тот факт, что многие металлы, являющиеся хорошими проводниками электрического тока (серебро,
медь, золото, хром, алюминий, марганец, вольфрам), вместе с тем обладают и достаточной коррозионной устойчивостью. Последняя определяется их кристаллической структурой, либо возникающими на поверхности металла прочными окисными пленками, препятствующими коррозии. При борьбе с коррозией получили применение как металлические, так и окисные пленки.
К числу неметаллических покрытий, помимо окисных (оксидирование), относятся фосфатные и некоторые другие. Поверхность металла может быть также защищена от контакта с внешней средой лаками, красками, смолами, эмалями и т. п.
Все указанные методы борьбы с коррозией предусматривают защиту металлического изделия, но не устраняют окислительного действия внешней среды. Имеются также методы, предусматривающие воздействие на агрессивную внешнюю среду, например, введение ингибиторов (в том числе атмосферных), т. е. веществ, способных замедлять течение реакций, проходящих при коррозии.
Взаимодействие металлов с кислотами
Разрушение металлов осуществляется при действии растворов кислот, в частности таких, как концентрированная азотная и серная. Продукты реакции зависят от активности металла и концентрации кислоты. Если взаимодействие цинка с разбавленной серной кислотой сопровождается выделением водорода
- то при действии концентрированной серной кислоты на цинк реакция протекает по-иному:
т. е. в этом случае окислителем являются уже не ионы водорода, а молекулы серной кислоты. Кроме того, нередко наблюдаются различия и в зарядах катионов (и формулах солей) металлов, имеющих переменные окислительные числа. Так, при действии соляной или разбавленной серной кислоты на железо происходит образование соли двухвалентного железа:
Ясно, что в атмосфере выделяющегося водорода (особенно сильный восстановитель в момент выделения) не может образоваться соединения трехвалентного железа. Если на холоде действовать на железо концентрированной на поверхности железа образуется окисная пленка, не растворимая в кислотах-окислителях.
При взаимодействии металлов с азотной кислотой никогда не выделяется водород: и в концентрированной, и в разбавленной азотной кислоте окислителем выступает азот с окислительным числом +5.
Можно установить связь между составом продуктов взаимодействия металлов с кислотой и положением металлов в ряду активности (напряжений), что отражено в табл. 2. В качестве примера приведены реакции взаимодействия кислот с цинком (один из активных металлов) и медью.
Приведенные в таблице реакции взаимодействия меди с концентрированной и разбавленной и концентрированной Имеются в школьном учебнике.
Их используют для лабораторного получения Обратите внимание на то обстоятельство, что при взаимодействии металла с концентрированной кислотой, помимо продуктов окисления и восстановления, образуется также Вола.
Если ее не удалять (нагревание выше 100°), то кислота становится более разбавленной и тогда при взаимодействии меди, например с концентрированной получается смесь двух газов:
Табл. 2 указывает основные направления процессов; изменившиеся условия меняют их характер.
Услуги по химии:
- Заказать химию
- Заказать контрольную работу по химии
- Помощь по химии
- Лекции по химии:
- Лекции по неорганической химии:
- Лекции по органической химии:
Электрический ток в металлах
Определение 1
Электрическим током в металлах называют упорядоченное движение электронов под действием электрического поля.
Исходя из опытов, видно, что металлический проводник вещество не переносит, то есть ионы металла не участвуют в передвижении электрического заряда.
Носители тока в металлах
При исследованиях были получены доказательства электронной природы тока в металлах. Еще в 1913 году Л.И. Мандельштам и Н.Д. Папалекси выдали первые качественные результаты. А в 1916 году Р. Толмен и Б. Стюарт модернизировали имеющуюся методику и выполнили количественные измерения, которые доказывали, что движение электронов происходит под действием тока в металлических проводниках.
Рисунок 1.12.1 показывает схему Толмена и Стюарта. Катушка, состоящая из большого количества витков тонкой проволоки, приводилась в действие при помощи вращения вокруг своей оси.
Ее концы были прикреплены к баллистическому гальванометру Г. Производилось резкое торможение катушки, что было следствием возникновения кратковременного тока, обусловленного инерцией носителя заряда.
Измерение полного заряда производилось при помощи движения стрелок гальванометра.
Рисунок 1.12.1. Схема опыта Толмена и Стюарта.
Во время торможения вращающейся катушки сила F=-mdυdt, называемая тормозящей, действовала на каждый носитель заряда е. F играла роль сторонней силы, иначе говоря, неэлектрического происхождения. Именно эта сила, характеризующаяся единицей заряда, является напряженностью поля сторонних сил Eст :
- Eст=-medυdt.
- То есть при торможении катушки происходит возникновение электродвижущей силы δ, равной δ=Eстl=medυdtl, где l – длина проволоки катушки. Определенный промежуток времени процесса торможения катушки обусловлен протеканием по цепи заряда q:
- q=∫Idt=1R∫δdt=melυ0R.
- Данная формула объясняет, что l – это мгновенное значение силы тока в катушке, R – полное сопротивление цепи, υ0 – начальная линейная скорость проволоки. Видно, что определение удельного заряда em в металлах производится, исходя из формулы:
- em=lυ0Rq.
Величины, находящиеся с правой стороны, можно измерить. Основываясь на результатах опытов Толмена и Стюарта, установили, что носители свободного заряда имеют отрицательный знак, а отношение носителя в его массе близко по значению удельного заряда электрона, получаемого в других опытах. Было выявлено, что электроны – это носители свободных зарядов.
Современные данные показывают, что модуль заряда электрона, то есть элементарный заряд, равняется e=1,60218·10-19 Кл, а обозначение его удельного заряда – em=1,75882·1011 Кл/кг.
При наличии отличной концентрации свободных электронов есть смысл говорить о хорошей электропроводимости металлов. Это выявили еще перед опытами Толмена и Стюарта. В 1900 году П. Друде, основываясь на гипотезе о существовании свободных электронов в металлах, создал электронную теорию проводимости металлов. Ее развил и расширил Х.
Лоренц, после чего она получила название классическая электронная теория. На ее основании поняли, что электроны ведут себя как электронный газ, похожий на идеальный по своему состоянию. Рисунок 1.12.2 показывает, каким образом он может заполнить пространство между ионами, которые уже образовали кристаллическую решетку металла.
Рисунок 1.12.2. Газ свободных электронов в кристаллической решетке металла. Показана траектория одного из электронов.
Потенциальный барьер. Движение электронов в кристаллической решетке
Определение 2
После взаимодействия электронов с ионами первые покидают металл, преодолевая только потенциальный барьер.
Высота такого барьера получила название работы выхода.
Наличие комнатной температуры не позволяет электронам проходить этот барьер. Потенциальная энергия выхода электрона после взаимодействия с кристаллической решеткой намного меньше, чем при удалении электрона из проводника.
Определение 3
Расположение е в проводнике характеризуется наличием потенциальной ямы, глубина которой получила название потенциального барьера.
Ионы, образующие решетку, и электроны принимают участие в тепловом движении. Благодаря тепловым колебаниям ионов вблизи положений равновесий и хаотичному движению свободных электронов, при столкновении первых со вторыми происходит усиление термодинамического равновесия между электронами и решеткой.
Теорема 1
По теории Друде-Лоренца имеем, что электроны имеют такую же среднюю энергию теплового движения, как и молекулы одноатомного идеального газа. Это делает возможным оценивание средней скорости υт¯ теплового движения электронов, используя молекулярно-кинетическую теорию.
Комнатная температура дает значение, равное 105 м/с.
Если наложить внешнее электрическое поле в металлический проводник, тогда произойдет тепловое упорядоченное движения электронов (электрический ток), то есть дрейф. Определение средней его скорости υд¯ выполняется по интервалу имеющегося времени ∆t через поперечное сечение S проводника электронов, которые находятся в объеме Sυд∆t.
Количество таких е равняется nSυд∆t, где n принимает значение средней концентрации свободных электронов, равняющейся числу атомов в единице объема металлического проводника. За имеющееся количество времени ∆t через сечение проводника проходит заряд ∆q=enSυд∆t.
- Тогда I=∆q∆t=enSυд или υд=IenS.
- Концентрация n атомов в металлах находится в пределах 1028-1029м-3.
- Формула дает возможность оценить среднюю скорость υд¯ упорядоченного движения электронов со значением в промежутке 0,6-6 мм/с для проводника с сечением 1 мм2 и проходящим током в 10 А.
Определение 4
Средняя скорость υд¯ упорядоченного движения электронов в металлических проводниках на много порядков меньше скорости υт их теплового движения υд≪υт.
Рисунок 1.12.3 демонстрирует характер движения свободного е, находящегося в кристаллической решетке.
Рисунок 1.12.3. Движение свободного электрона в кристаллической решетке: а – хаотическое движение электрона в кристаллической решетке металла; b – хаотическое движение с дрейфом, обусловленным электрическим полем. Масштабы дрейфа υд¯∆t сильно преувеличены.
Наличие малой скорости дрейфа не соответствует опыту, когда ток всей цепи постоянного тока устанавливается мгновенно. Замыкание производится при помощи воздействия электрического поля со скоростью c=3·108 м/с. По прошествии времени lc (l — длина цепи) вдоль цепи устанавливается стационарное распределение электрического поля. В ней происходит упорядоченное движение электронов.
Классическая электронная теория металлов предполагает, что их движение подчинено законам механики Ньютона.
Данная теория характеризуется тем, что происходит пренебрежение взаимодействием электронов между собой, а взаимодействие с положительными ионами расценивается как соударения, при каждом из которых e сообщает накопленную энергию решетке. Поэтому принято считать, что после соударения движение электрона характеризуется нулевой дрейфовой скоростью.
Абсолютно все выше предложенные допущения приближенные. Это дает возможность объяснения законов электрического тока в металлических проводниках, основываясь на электронной классической теории.
Закон Ома
Определение 5
В промежутке между соударениями на электрон действует сила, равняющаяся по модулю eE, в результате чего получает ускорение emE.
Конец свободного пробега характеризуется дрейфовой скоростью электрона, которую определяют по формуле
υд=υдmax=eEmτ.
Время свободного пробега обозначается τ. Оно способствует упрощению расчетов для нахождения значения всех электронов. Средняя скорость дрейфа υд равняется половине максимального значения:
- υд=12υдmax=12eEmτ.
- Если имеется проводник с длиной l, сечением S с концентрацией электронов n, тогда запись нахождения тока в проводнике имеет вид:
- I=enSυд=12e2τnSmE=e2τnS2mlU.
U=El – это напряжение на концах проводника. Формула выражает закон Ома для металлического проводника. Тогда электрическое сопротивление необходимо находить:
- R=2me2nτlS.
- Удельное сопротивление ρ и удельная проводимость ν выражаются как:
- ρ=2me2nτ; ν=1ρ=e2nτ2m.
Закон Джоуля-Ленца
Конец пробега электронов под действием поля характеризуется кинетической энергией
12m(υд)max2=12e2τ2mE2.
Определение 6
Исходя из предположений, энергия при соударениях передается решетке, а в последствии переходит в тепло.
Время ∆t каждого электрона испытывается ∆tτ соударений. Проводник с сечение S и длиной l имеет nSl электронов. Тогда выделившееся тепло в проводнике за ∆t равняется
∆Q=nSl∆tτe2τ22mE2=ne2τ2mSlU2∆t=U2R∆t.
Данное соотношение выражает закон Джоуля-Ленца.
Благодаря классической теории, имеет место трактовка существования электрического сопротивления металлов, то есть законы Ома и Джоуля-Ленца. Классическая электронная теория не в состоянии ответить на все вопросы.
Она не способна объяснить разницу в значении молярной теплоемкости металлов и диэлектрических кристаллов, равняющейся 3R, где R записывается как универсальная газовая постоянная. Теплоемкость металла не зависит от количества свободных электронов.
Классическая электронная теория не объясняет температурную зависимость удельного сопротивления металлов. По теории ρ~T, а исходя из экспериментов – ρ~T. Примером расхождения теории с практикой служит сверхпроводимость.
Сопротивление металлического проводника
Исходя из классической теории, удельное сопротивление металлов должно постепенно уменьшаться при понижении температуры, причем остается конечным при любой T. Данная зависимость характерна для проведения опытов при высоких температурах. Если T достаточно низкая, тогда удельное сопротивление металлов теряет зависимость от температуры и достигает предельного значения.
Особый интерес представило явление сверхпроводимости. В 1911 году его открыл Х. Каммерлинг-Оннес.
Теорема 2
Если имеется определенная температура Tкр, различная для разных веществ, тогда удельное сопротивление уменьшается до нуля с помощью скачка, как изображено на рисунке 1.12.4.
Пример 1
Критической температурой для ртути считается значение 4,1 К, для алюминия – 1,2 К, для олова – 3,7 К. Наличие сверхпроводимости может быть не только у элементов, но и у химических соединений и сплавов.
Ниобий с оловом Ni3Snимеют критическую точку температуры в 18 К. Существуют вещества, которые при низкой температуре переходят в сверхпроводящее состояние, тогда как в обычных условиях ими не являются.
Серебро и медь являются проводниками, но при понижении температуры сверхпроводниками не становятся.
Рисунок 1.12.4. Зависимость удельного сопротивления ρ от абсолютной температуры T при низких температурах: a – нормальный металл; b – сверхпроводник.
Сверхпроводящее состояние говорит об исключительных свойствах вещества. Одним из важнейших является способность на протяжении длительного времени поддерживать электрический ток, возбужденный в сверхпроводящей цепи, без затухания.
Классическая электронная теория не может объяснить сверхпроводимость. Это стало возможным спустя 60 лет после его открытия, основываясь на квантово-механических представлениях.
Рост интереса к данному явлению увеличивался по мере появления новых материалов, способных обладать высокими критическими температурами. В 1986 было обнаружено сложное соединение с температурой Tкр=35 К. На следующий год сумели создать керамику с критической Т в 98 К, которая превышала Т жидкого азота (77 К).
Определение 7
Явление перехода веществ в сверхпроводящее состояние при Т, превышающих температуру кипения жидкого азота, называют высокотемпературной сверхпроводимостью.
Позже в 1988 году создали Tl-Ca-Ba-Cu-O соединение с критической Т, достигающей 125 К. На данный момент ученые заинтересованы в поиске новых веществ с наиболее высокими значениями Tкр.
Они рассчитывают на получение сверхпроводящего вещества при комнатной температуре. Если это будет сделано, произойдет революция в науке и технике.
До настоящего времени все свойства и механизмы состава сверхпроводимых керамических материалов до конца не исследованы.
Электрический ток в металлах: подробное объяснение (формулы)
Электрический ток в металлах представляет собой упорядоченное движение свободных электронов. Более подробно об этом читайте далее в нашей статье.
Важно знать
Как известно, электрический ток – это упорядоченный поток носителей электрического заряда. Носители – это заряженные частицы, способные свободно перемещаться во всем объеме тела.
В случае металлов этими частицами являются электроны, которые высвобождаются при образовании связи между атомами металла.
Известно, что металлы в твердом состоянии имеют кристаллическую структуру. Частицы в кристаллах расположены в определенном порядке, образуя пространственную решетку (кристалл).
Наконец, кристаллическая решетка металла образована положительными ионами, погруженными в “облако” хаотически движущихся так называемых свободных электронов, также называемых электронами проводимости.
В зависимости от валентности атомов металла, один атом может освободить от одного до трех электронов при образовании металлических связей. Число таких высвобожденных электронов непосредственно переводится в число носителей заряда.
Это является одним из факторов, влияющих на способность металла проводить электрический ток.
Доказательством того, что ток в металлах вызывается электронами, послужили эксперименты наших отечественных физиков Леонида Исааковича Мандельштама и Николая Дмитриевича Папалекси, а также американских физиков Бальфура Стюарта и Роберта Толмана.
Способность металла проводить электрический ток может быть описана физической величиной, называемой удельным электрическим сопротивлением. Эта физическая величина обозначается греческой буквой ρ (читается как “ро”). Единицей измерения удельного сопротивления является Ом · м, т.е. произведение Ом на метр.
Удельное сопротивление – это константа, которая характеризует материал и имеет различные значения для разных материалов. Например, удельное сопротивление меди составляет 1.72*10-8 Ом · м. Это означает, что электрическое сопротивление медного проводника длиной 1 метр и площадью поперечного сечения 1 м равно 1.72*10-8 Ом .
В целом, чем ниже удельное сопротивление материала, тем лучше он проводит электрический ток.
В таблице ниже приведены некоторые примеры удельного сопротивления часто используемых металлов.
| Металл | Удельное сопротивление (Ом · м) |
| Серебро | 1.59*10-8 |
| Медь | 1.72*10-8 |
| Алюминий | 2.82*10-8 |
| Вольфрам | 5.6*10-8 |
| Железо | 10*10-8 |
Удельное электрическое сопротивление может быть связано с микроскопическими свойствами материала. В частности, он зависит от концентрации носителей заряда и их подвижности.
Движение свободных электронов в металлах не является полностью “свободным”, поскольку во время их движении они взаимодействуют с другими электронами, и прежде всего с ионами кристаллической решетки. Специфика этого движения описывается так называемой классической моделью проводимости.
Основные предположения и выводы этой модели представлены в большом упрощении ниже.
Классическая модель проводимости
Без внешнего электрического поля электроны совершают тепловые хаотические движения, сталкиваясь друг с другом, а также сталкиваясь с ионами кристаллической решетки. В результате такого движения среднее положение электронов практически не меняется (см. рис. 1.).
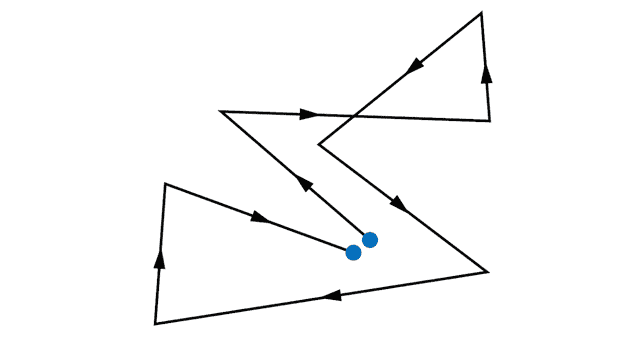 Рис. 1. Пример траектории электрона во время его хаотического теплового движения в металле
Рис. 1. Пример траектории электрона во время его хаотического теплового движения в металле
Из-за квантовых эффектов, и в частности из-за принципа запрета Паули, который не позволяет всем электронам занимать самое низкое энергетическое состояние, средняя скорость электронов в металлах, связанная с их хаотическим тепловым движением, больше, чем скорость частиц в классическом идеальном газе той же температуры. Она составляет порядка 10 м/с.
Если электрическое напряжение U приложено к концам проводника длиной L в нем появится электрическое поле с напряженностью E = U / L
Под действием этого внешнего поля, согласно второму закону динамики, электроны ускоряются: a = F / m,
где F = e*E – сила, с которой электрическое поле действует на электрон с зарядом e. Таким образом, ускорение электрона составляет: a = e*E / m .
Ускоренное движение электрона длится лишь довольно короткое время, пока он не столкнется с иономкристаллической решетки. В результате такого столкновения электрон теряет практически всю свою кинетическую энергию.
Однако замедленный электрон не остается в состоянии покоя – он снова ускоряется под действием электрического поля, снова сталкивается с одним из ионов из ионы кристаллической решетки и т.д.
Этот эффект добавляет к скорости тепловых движений дополнительную направленную среднюю скорость u, которая из-за отрицательного заряда электрона имеет направление, противоположное напряженности внешнего электрического поля. Эта скорость называется средней скоростью дрейфа (рис. 2).
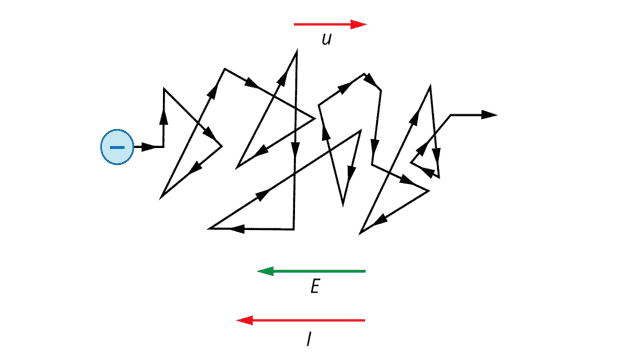 Рис. 2. Дрейф электрона под действием внешнего электрического поля
Рис. 2. Дрейф электрона под действием внешнего электрического поля
В проводнике начинает течь электрический ток с силой тока I (см. рисунок 3).
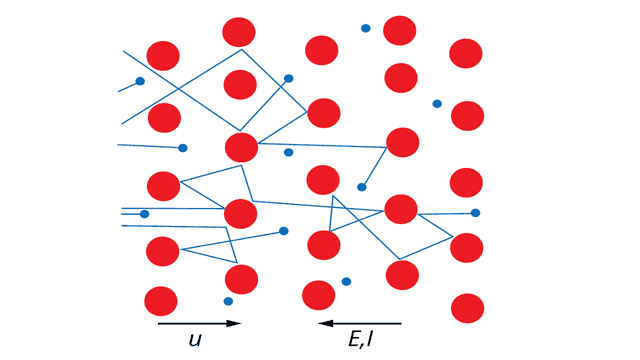 Рис. 3. Дрейфующие электроны сталкиваются с ионами кристаллической решетки
Рис. 3. Дрейфующие электроны сталкиваются с ионами кристаллической решетки
Предполагая, что движение электрона равномерно ускоряется между столкновениями с ионами решетки, с ускорением a = e*E / m , и предполагая, что в результате столкновения электрон передает всю свою кинетическую энергию кристаллической решетке, мы можем вычислить скорость, которую развивает электрон в своем свободном движении: v = a*τ . В этой формуле τ – средний интервал времени между последующими столкновениями дрейфующего электрона с ионами кристаллической решетки.
Поскольку при равномерно ускоренном движении без начальной скорости средняя скорость является средним арифметическим начальной (равной нулю) и конечной скоростью, то получаем: u = v / 2 = e*E*τ / 2*m .
Из полученной формулы следует, что скорость дрейфа, помимо внешнего электрического поля, определяется средним интервалом времени между столкновениями электронов с ионами решетки.
Этот параметр зависит от многих факторов (включая температуру, кристаллическую структуру металла, дефекты кристаллической структуры, примеси) и, как выясняется, существенно влияет на электрическое сопротивление материала.
Средняя дрейфовая скорость электронов составляет порядка 10-4 м/с. Она очень мала по сравнению со скоростью теплового движения, которая составляет порядка 106 м/с.
Классическая теория проводимости достаточно хорошо описывает явление электропроводности в металлах. Однако эта теория не может объяснить экспериментально наблюдаемую зависимость электрического сопротивления от температуры.
Причина упомянутой неудачи классической теории проводимости заключается в том, что она не учитывает влияние ионов решетки на движение электронов между столкновениями.
Более близкие к реальности результаты дает квантовая теория проводимости, которая описывает электроны как частицы, подверженные квантовой статистике, движущиеся в периодическом электрическом поле, создаваемом положительными ионами решетки.
Выводы простым языком
Отрицательный заряд всех свободных электронов по абсолютному значению равен положительному заряду всех ионов решётки. Поэтому в обычных условиях металл электрически нейтрален. Свободные электроны в нём движутся беспорядочно.
Но если в металле создать электрическое поле, то свободные электроны начнут двигаться направленно под действием электрических сил. Возникнет электрический ток.
Беспорядочное движение электронов при этом сохраняется, подобно тому как сохраняется беспорядочное движение в стайке мошкары, когда под действием ветра она перемещается в одном направлении.
« Скорость движения самих электронов в проводнике под действием электрического поля невелика – несколько миллиметров в секунду, а иногда и ещё меньше. Но как только в проводнике возникает электрическое поле, оно с огромной скоростью, близкой к скорости света в вакууме (300 000 км/c), распространяетcя по всей длине проводника. »
Перышкин А. В. Физика 8. – М.: Дрофа, 2010
Как пример, электрический сигнал, посланный, например, по проводам из Москвы во Владивосток (s = 8000 км), приходит туда примерно через 0,03 с.
Одновременно с распространением электрического поля все электроны начинают двигаться в одном направлении по всей длине проводника. Так, например, когда цепь электрической лампы замкнута, электроны в спирали лампы также движутся упорядоченно.
Сравнение электрического тока с потоком воды в водопроводной системе и распространения электрического поля с распространением давления воды поможет нам понять это.
Когда вода поднимается в резервуар для воды, давление (напор) воды очень быстро распространяется по всей системе водоснабжения. Когда мы включаем кран, вода уже находится под давлением и сразу же начинает течь.
Но вода, которая была в кране, течет, а вода из башни достигает крана гораздо позже, потому что вода движется с меньшей скоростью, чем распространяется давление.
Когда говорят о скорости распространения электрического тока в проводнике, то имеют в виду скорость распространения по проводнику электрического поля.






