Что такое коррозийная стойкость
Способность того или иного металла сопротивляться коррозии, называется коррозийной стойкостью. Эта способность определяется скоростью протекания коррозии в определенных условиях. Чтобы оценить скорость коррозии, используют количественные и качественные характеристики.

Качественные характеристики — это:
- изменение внешнего вида поверхности металла;
- изменение микроструктуры металла.
Количественные характеристики — это:
- время до появления первого очага коррозии;
- количество очагов коррозии, образовавшихся за некоторый промежуток времени;
- утончение металла за единицу времени;
- изменение массы металла на единицу площади поверхности за единицу времени;
- объем поглощенного или выделившегося газа в процессе коррозии на единице поверхности за единицу времени;
- плотность электрического тока для данной скорости коррозии;
- изменение того или иного свойства за определенный промежуток времени (механические свойства, отражательная способность, электрическое сопротивление).
Для разных металлов характерна разная стойкость к коррозии. Чтобы устойчивость к коррозии повысить, используют специальные методы: легирование для стали, хромирование, алитирование, никелирование, окраска, цинкование, пассивация и т.д.
Железо и сталь

В присутствии кислорода и чистой воды, железо быстро корродирует, реакция идет по формуле:
В процессе коррозии, рыхлый слой ржавчины покрывает металл, и этот слой отнюдь не защищает его от дальнейшего разрушения, коррозия идет до полного уничтожения металла.
Более активную коррозию железа вызывают растворы солей: если в воздухе присутствует даже немного хлорида аммония (NH4Cl), коррозийный процесс пойдет значительно быстрее.
В слабом растворе соляной кислоты (HСl) реакция тоже активно пойдет.
Азотная кислота (HNO3) в концентрации более 50% вызовет пассивацию металла, — он покроется хоть и хрупким, но все же защитным слоем. Дымящая азотная кислота безопасна для железа.
Серная кислота (H2SO4) в концентрации более 70% пассивирует железо, а если сталь марки Ст3 держать в 90% серной кислоте при температуре 40°С, то в данных условиях скорость ее коррозии не превысит 140 мкм в год. Если же температура составит 90°С, то коррозия пойдет с в 10 раз большей скоростью. Серная кислота концентрацией 50% железо растворит.
Ортофосфорная кислота (H3PO4) не вызовет коррозии железа, как и безводные органические растворители, как растворы щелочей, водный аммиак, сухие Вr2 и Сl2.
Если к воде добавить тысячную долю хромовокислого натрия, то он станет отличным ингибитором коррозии железа, как и натрия гексаметафосфат. А вот ионы хлора (Cl-) снимают с железа защитную пленку и усиливают коррозию. Железо технически чистое, в котором содержится примерно 0,16% примесей, отличается высокой устойчивости к коррозии.
Стали среднелегированные и низколегированные
Легирующие добавки хрома, никеля или меди в низколегированных и среднелегированных сталях повышают их устойчивость к водной и атмосферной коррозии. Чем больше хрома — тем выше устойчивость стали к окислению. Но если хрома меньше 12%, то химически активные среды подействуют на такую сталь разрушительно.
Высоколегированные стали
В высоколегированных сталях легирующих компонентов больше 10%.
Если в стали содержится от 12 до 18% хрома, то такая сталь выдержит контакт почти с любой из органических кислот, с пищевыми продуктами, окажется стойкой к азотной кислоте (HNO3), к щелочам, ко многим растворам солей.
В 25% муравьиной кислоте (CH2O2) коррозия высоколегированной стали пойдет со скоростью порядка 2 мм в год. Однако сильные восстановители, соляная кислота, хлориды и галогены разрушат высоколегированную сталь.
Стали нержавеющие, в которых содержится от 8 до 11% никеля и от 17 до 19% хрома более стойки к коррозии чем просто высокохромистые стали. Такие стали выдерживают кислые окислительные среды, как то хромовокислая или азотокислая, а также сильные щелочные.
Никель в качестве добавки усилит стойкость стали к неокислительным средам, к атмосферным факторам. Но среды кислые восстановительные и кислые с ионами галогенов, — разрушат пассивирующий оксидный слой, в результате сталь потеряет устойчивость к кислотам.
Более высокую коррозийную устойчивость, чем хромоникелевые стали, имеют стали нержавеющие с добавлением молибдена в количестве от 1 до 4%. Молибден даст стойкость к сернистой и серной кислотам, к органическим кислотам, к морской воде и галогенидам.
Ферросилиций (железо с добавлением от 13 до 17% кремния), так называемое железокремнистое литье, обладает коррозийной стойкостью благодаря наличию оксидной пленки SiO2, и которую не способны разрушить ни серная, ни азотная, ни хромовая кислоты, они лишь усиливают эту защитную пленку. А вот соляная кислота (HCl) легко приведет к коррозии ферросилиция.
Сплавы никеля и чистый никель

Никель стоек ко многим факторам, как к атмосферным, так и к лабораторным, к чистой и соленой воде, к щелочным и нейтральным солям, таким как карбонаты, ацетаты, хлориды, нитраты и сульфаты. Не насыщенные кислородом и не горячие органические кислоты не причинят вреда никелю, как и кипящая концентрированная щелочь гидроксид калия (KOH) в концентрации до 60%.
Коррозию вызовут восстановительные и окислительные среды, окислительные щелочные или кислые соли, окислительные кислоты, такие как азотная, влажные газообразные галогены, оксиды азота и диоксид серы.
Монель-металл (до 67 % никеля и до 38 % меди) более стоек к действию кислот, чем чистый никель, но действие сильных окисляющих кислот не выдержит.
Отличается довольно высокой стойкостью к кислотам органическим, к значительному количеству растворов солей. Атмосферная и водная коррозия не грозят монель-металлу, безопасен для него также фтор.
Монель-металл безопасно выдержит действие кипящего фтороводорода (HF) концентрацией 40%, как его выдерживает платина.
Сплавы алюминия и чистый алюминий

Защитная оксидная пленка алюминия делает его устойчивым к обычным окислителям, к уксусной кислоте, к фтору, просто к атмосфере, и к значительному количеству органических жидкостей. Технически чистый алюминий, в котором примесей меньше 0,5%, очень стоек к действию перекиси водорода (H2O2).
Разрушается под действием едких щелочей сильных восстановительных сред. Разбавленная серная кислота и олеум не страшны алюминию, но серная кислота средней концентрации его разрушит, как и горячая азотная кислота.
Защитную оксидную пленку алюминия способна разрушить соляная кислота. Контакт алюминия со ртутью или с солями ртути разрушителен для первого.
Чистый алюминий более устойчив к коррозии, чем например сплав дюралюминий (в котором до 5,5% меди, 0,5% магния и до 1% марганца), который менее стоек к коррозии. Силумин (добавка от 11 до 14% кремния) в этом отношении более устойчив.
Сплавы меди и чистая медь

Чистая медь и ее сплавы не корродируют ни в соленой воде, ни на воздухе. Не страшны меди в плане коррозии: разбавленные щелочи, сухой NH3, нейтральные соли, сухие газы и большинство органических растворителей.
Такие сплавы как бронза, в которых содержится много меди, выдерживают нахождение в кислотах, даже в холодной концентрированной или в горячей разбавленной серной кислоте, либо в концентрированной или разбавленной соляной кислоте при обычной температуре (25°С).
В отсутствие кислорода медь не корродирует при контакте с органическими кислотами. Не оказывают разрушительного действия на медь ни фтор, ни сухой фтороводород.
Но медные сплавы и чистая медь корродируют от различных кислот если есть кислород, а также при контакте с влажным NH3, некоторыми кислыми солями, влажными газами, типа ацетилена, CO2, Cl2, SO2. Медь легко взаимодействует со ртутью. Латунь (цинк и медь) не отличается высокой устойчивостью к коррозии.
Подробнее смотрите здесь — Медь и алюминий в электротехнике
Чистый цинк

Чистая вода, ровно как и чистый воздух, не приводит к коррозии цинка. Но если в воде или в воздухе присутствуют соли, углекислый газ или аммиак, то начнется коррозия цинка. Цинк растворяется в щелочах, особенно быстро — в азотной кислоте (HNO3), медленнее — в соляной и серной кислотах.
Органические растворители и нефтепродукты в принципе не оказывают корродирующего действия на цинк, но если контакт будет длительным, с крекинг-бензином, например, то кислотность бензина повысится при окислении его на воздухе, и начнется коррозия цинка.
Чистый свинец

Высокая устойчивость свинца к водной и атмосферной коррозии — известный факт. Не корродирует свинец и при нахождении в почве. Но если в воде содержится много углекислого газа, то свинец в ней растворится, поскольку образуется гидрокарбонат свинца, который уже будет растворим.
В целом свинец очень стоек к растворам нейтральным, умеренно стоек к щелочным, а также к некоторым кислотам: серной, фосфорной, хромовой и сернистой. Концентрированной серной кислотой (от 98%) при температуре в 25°С, свинец можно медленно растворить.
Фтороводород при концентрации 48% растворит свинец при нагревании. Сильно взаимодействует свинец с соляной и азотной кислотами, с муравьиной и уксусной кислотой.
Серная кислота покроет свинец труднорастворимым слоем хлорида свинца (PbCl2), и дальше растворение уже не пойдет. В концентрированной азотной кислоте свинец также покроется слоем соли, но разбавленная азотная кислота растворит свинец.
Хлориды, карбонаты и сульфаты к свинцу не агрессивны, а растворы нитратов — наоборот.
Чистый титан

Хорошая коррозийная устойчивость — отличительная черта титана. Он не окисляется сильными окислителями, выдерживает растворы солей, FeCl3 и т.д.
Концентрированные минеральные кислоты вызовут коррозию, однако даже кипящая азотная кислота в концентрации менее 65%, серная — до 5%, соляная — до 5% — коррозии титана не вызовут.
Нормальная коррозийная устойчивость к щелочам, к щелочным солям и органическим кислотам выделяет титан в ряду других металлов.
Чистый цирконий

Цирконий более устойчив к серной и соляной кислотам чем титан, однако к царской водке и влажному хлору — устойчив менее. Обладает высокой химической стойкостью к большинству щелочей и кислот, устойчив к перекиси водорода (H2O2).
Действие некоторых хлоридов, кипящая концентрированная соляная кислота, царская водка (смесь концентрированных азотной HNO3 (65—68 % масс.) и соляной HCl (32—35 % масс.
), горячая концентрированная серная кислота и дымящая азотная — вызывают коррозию.
Очень значимым в плане коррозии является такое свойство циркония, как гидрофобность, то есть этот металл не смачивается ни водой, ни водными растворами.
Чистый тантал
Превосходная химическая стойкость тантала подобна стеклу. Его плотная оксидная пленка защищает металл при температурах до 150°С от действия хлора, брома, йода.
Большинство кислот в нормальных условиях не действуют на тантал, даже царская водка и концентрированная азотная кислота не вызывают коррозии.
Растворы щелочей практически не действуют на тантал, но на него действуют фтороводород и концентрированные горячие растворы щелочей, чтобы растворить тантал, применяют расплавы щелочей.
§ 79. Коррозия металлов [1971 Ходаков Ю.В., Эпштейн Д.А., Глориозов П.А. — Неорганическая химия. Учебник для 9 класса]
Новости Библиотека Таблица эл-тов Биографии Карта сайтов Ссылки О сайте
Изделия из металлов и их сплавов, кроме золота и платины, под действием воздуха, дождей, почвенной влаги могут разрушаться, образуя соединения, устойчивые к окружающей среде.
Особенно сильному химическому воздействию подвергаются металлы в аппаратах химической промышленности: здесь на металл действуют кислород, кислоты, щелочи и другие вещества, часто при высоких температурах и повышенных давлениях.
Разрушение металлов и сплавов вследствие химического взаимодействия с окружающей средой называется коррозией (от латинского слова «корродере» — разъедать).
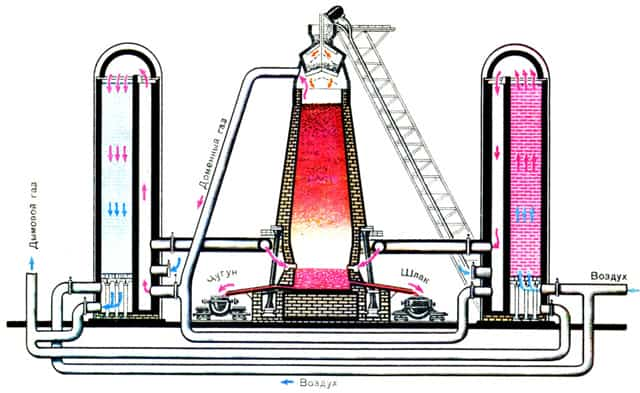 Доменное производство
Доменное производство
В результате коррозии качество изделия и сооружений ухудшается. Они могут стать даже совершенно непригодными к использованию.
При громадном и все возрастающем количестве 1 машин и металлических сооружений, применяемых в промышленности, в сельском хозяйстве и на транспорте, огромное значение имеет предохранение их от коррозии.
Удлинение срока службы машин и сооружений увеличивает мощь нашего социалистического государства, ускоряет его продвижение по пути к коммунизму. Поэтому постоянная борьба с коррозией представляет собой исключительно важную задачу. Но чтобы бороться с коррозией, нужно знать, как она протекает.
- Коррозия металлов — это окислительно-восстановительный процесс, при котором атомы металла окисляются и переходят в ионы, например:
- Fe — 2 = Fe2+
- Сu — 2 = Сu2+
Что способствует и что препятствует коррозии? Выяснцм эти вопросы путем опытов, привлекая те сведения о ржавлении железа, которые вы получили ранее.
Коррозия железа происходит, как нам известно, при участии кислорода и воды. Поместим железный гвоздь в пробирку, наполним ее доверху водой и опрокинем, зажав отверстие пальцем, в сосуд с водой, после чего вытесним воду из пробирки кислородом.
Таким же образом заготовим другие пробирки с такими же гвоздями, но вместо воды в пробирки и сосуды, в которые они будут опрокинуты, нальем раствор поваренной соли. В одном случае к этому раствору добавим немного раствора едкого натра. К одному из гвоздей заранее прикрутим медную проволоку, к другому — полоску цинка.
Спустя примерно сутки мы увидим картину, представленную на рисунке 64. На нем указано, что погружено (железо, находящееся в контакте с цинком, с медью) и в какой раствор погружено (в воду, в раствор поваренной соли, без добавки или с добавкой едкого натра).
О том, как протекала коррозия в каждом случае, вы можете судить по количеству израсходованного кислорода, т. е. по поднятию уровня жидкости в пробирке и по характеру осадившегося в воде продукта коррозии.
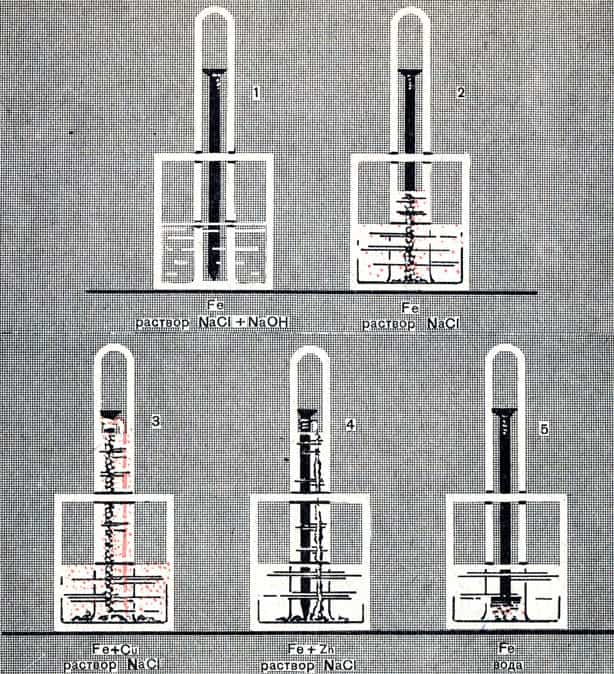 Рис. 64. Коррозия металлов
Рис. 64. Коррозия металлов
Сравним результаты опытов 2 и 3. В обоих случаях железо находилось в одном и том же растворе, но в одном случае оно соприкасалось с медью, а в другом — нет. И там и здесь произошла коррозия и осадился бурый осадок гидроокиси железа (III).
Но в опыте 2 ржавчины получилось мало, а в опыте 3 — много. Соответственно этому и расход кислорода в опыте 2 был мал — уровень раствора в пробирке поднялся невысоко, в опыте 3 — велик.
Таким образом, коррозия, или ржавление железа резко усиливается, когда оно соприкасается с медью.
Сравним теперь результаты опытов 2 и 4. В обоих случаях железо находилось в одном и том же растворе, но в одном случае оно соприкасалось с цинком, а в другом — нет. Наблюдается сильная коррозия: много израсходовалось кислорода и получился обильный осадок.
Но в опыте 2 осадок бурого цвета, это ржавчина. А в опыте 4 осадок получился чисто-белого цвета. Белый осадок — это гидроокись цинка. Следовательно, в опыте 4 корродировало не железо, а цинк.
Таким образом, железо практически не корродирует, если оно соприкасается с цинком.
Усиление коррозии в первом случае и прекращение во втором объясняется возникновением гальванических элементов.
Так, при соприкосновении железа с цинком возникает гальванический элемент, в котором цинк, как более активный металл, будет окисляться, переходя в ионы Zn2+, а отщепляющиеся от его атомов электроны будут перетекать на поверхность железа и восстанавливать ионы водорода, содержащиеся в омывающем металл растворе. Водород на поверхности железа либо выделяется в свободном виде, либо его атомы, не успев сцепиться в молекулы, окисляются растворенным в воде кислородом в воду. Обычно происходит последнее.
При соприкосновении железа с медью тоже возникает гальванический элемент, но в нем будет окисляться в качестве более активного металла железо. На поверхности обоих металлов и в соприкасающемся с ними слое раствора происходят следующие реакции:
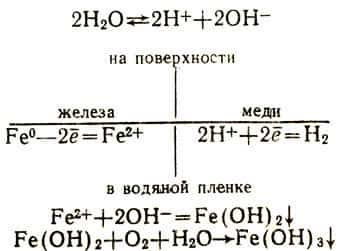
Коррозия металла резко усиливается, если он соприкасается с каким-либо другим менее активным металлом, т. е. расположенным в электрохимическом ряду напряжений правее его. Но коррозия резко ослабляется, если металл соприкасается с другим металлом, расположенным левее в электрохимическом ряду напряжений, т. е. более активным.
Сравним результаты опытов 1 и 2. Добавка к воде поваренной соли усилила коррозию железа — получилось много ржавчины и много израсходовалось кислорода. Добавка к раствору поваренной соли едкого натра, как видно из опыта 5, наоборот, ослабила коррозию — ржавчины получилось мало и кислорода израсходовалось немного.
Таким образом, скорость коррозии данного металла зависит, во-первых, от того, соприкасается или нет этот металл с каким-нибудь другим металлом и каким именно, а во-вторых, от состава омывающей металл среды
Одни составные части омывающей металл среды, в частности ионы хлора, усиливают коррозию металлов, другие составные части могут ослаблять коррозию. Так, коррозия железа ослабляется в присутствии ионов гидроксила.
В приморских местностях коррозия металлических сооружений идет энергичнее, чем вдали от моря. Это объясняется присутствием в морской воде ионов хлора. Брызги морской воды, испаряясь, выделяют в воздух кристаллики растворенных в морской воде солей, а эти кристаллики, растворяясь в водяной пленке на металлах, доставляют в нее ионы хлора.
Теперь мы можем понять широко используемые на практике способы предупреждения коррозии, борьбы с нею.
Чем больше разнятся друг от друга по химической активности два соприкасающихся металла, тем сильнее корродирует o более активный из них и тем надежнее защищен от коррозии второй, менее активный металл.
Поэтому недопустимо, например, наличие в конструкции из алюминиевого сплава деталей из меди и ее сплавов (см. положение алюминия и меди в электрохимическом ряду напряжений).
Если же таких вредных контактов в конструкции нельзя избежать, то стараются обезвредить эти контакты, например, нанесением на них лакокрасочных покрытий.
Защитным действием более активных металлов на менее активные пользуются для предохранения от коррозии подземных трубопроводов и корпусов судов. К трубопроводам присоединяют, а с борта судна при длительных стоянках опускают в воду слитки из сплавов металлов, расположенных близко к началу ряда напряжений — магния или цинка.
Для предохранения металлических изделий от коррозии их изолируют от внешней среды, покрывая лаками, красками, смазками, защитными слоями других металлов. Покрытие должно быть стойким в данной среде, достаточно плотным и иметь хорошее сцепление с металлом.
В некоторых случаях скорость коррозии можно значительно снизить, введя в действующую жидкую среду в небольшом количестве вещества, способствующие образованию на поверхности металла защитной пленки. Такие вещества называют ингибиторами — замедлителями коррозии. Наибольшее применение нашли органические замедлители коррозии.
Введение их, например, в соляную кислоту позволяет хранить и перевозить ее в стальной таре вместо хрупких стеклянных бутылей. Соляная кислота с добавкой ингибитора нашла применение для очистки котлов от накипи и очистки поверхности металлов от ржавчины и окалины. Окислы металлов в ней растворяются, а металл не растворяется.
Воду, поступающую в паровые котлы, обезвреживают, удаляя из нее растворенный кислород.
- Как изменится течение коррозии в опыте 4, если в пробирку будет помещена такая же полоска цинка, но не связанная с железом? Ответ мотивируйте.
- Перечислите известные вам способы борьбы с коррозией металлов.
Составьте опись предметов, обслуживающих вас дома, в которых применены металлы и сплавы. В каждом случае укажите, как связано данное применение металла с его физическими свойствами. Не забудьте включить в перечень такие предметы, как зеркало, медицинский термометр, электрическую лампочку. Отметьте случаи коррозии этих предметов, если они наблюдались.
Большая Рнциклопедия Нефти Рё Газа
Cтраница 1
Усиление РєРѕСЂСЂРѕР·РёРё металла РїСЂРё повышенной температуре связано СЃ увеличением ионизации РІРѕРґС‹, следствием которой является резкое повышение концентрации водородных РёРѕРЅРѕРІ РїРѕ сравнению СЃ РІРѕРґРѕР№ РїСЂРё температуре 25 РЎ. Нейтральность РІРѕРґС‹ означает лишь равенство концентраций водородных Рё гидрофильных РёРѕРЅРѕРІ РІ растворе; абсолютные же РёС… значения увеличиваются СЃ возрастанием степени ионизации РІРѕРґС‹. Следовательно, чтобы иметь СЂРќ — 7 РїСЂРё высокой температуре, РІРѕРґР° должна РїСЂРё 25 РЎ иметь более высокую концентрацию гидроксильных РёРѕРЅРѕРІ, чтобы предотвратить РєРѕСЂСЂРѕР·РёСЋ металла РІ горячей РІРѕРґРµ. Рти соображения часто упускают РёР· РІРёРґСѓ. [1]
Усиление РєРѕСЂСЂРѕР·РёРё металлов Р·Р° счет действия механических нагрузок Рё технологически наследственных деформаций — механохимическая РєРѕСЂСЂРѕР·РёСЏ — связана СЃ проявлением механохимического эффекта / 1 /, вызванного, РІ РѕСЃРЅРѕРІРЅРѕРј, изменением дислокационной структуры металла, формируемой РІ процессе деформации. [2]
Таким образом, усиление РєРѕСЂСЂРѕР·РёРё металлов РІ присутствии хлора следует объяснять, как Рё для сернистого газа, появлением РІ системе РЅРѕРІРѕРіРѕ деполяризатора, значительно превосходящего РїРѕ СЃРІРѕРёРј окислительным свойствам кислород. Что же касается влияния хлора РЅР° РґСЂСѓРіСѓСЋ электрохимическую реакцию, обусловливающую коррозионный процесс — анодную — Рё заключающуюся РІ ионизации металла, то здесь положение следующее. Если скорость РєРѕСЂСЂРѕР·РёРѕРЅРЅРѕРіРѕ процесса лимитируется анодной реакцией, что, например, может иметь место РІ адсорбционных слоях или РЅР° металлах, находящихся РІ пассивном состоянии, то хлор может изменить скорость РєРѕСЂСЂРѕР·РёРѕРЅРЅРѕРіРѕ процесса благодаря ускорению анодной реакции. [3]
- Механические напряжения приводят к усилению коррозии металлов и к появлению локальных разрушений, в частности, к коррозионному растрескиванию. [4]
- Повторный нагрев РїСЂРё температуре сенсибилизации стабилизированных сталей, прошедших предварительную высокотемпературную обработку или нагрев РїСЂРё сварке, РїСЂРёРІРѕРґРёС‚ Рє усилению РєРѕСЂСЂРѕР·РёРё металла РІ кипящей 65 % — РЅРѕР№ азотной кислоте Рё появлению РєРѕСЂСЂРѕР·РёРё РІ серномеднокислом растворе вследствие дополнительного выпадения карбидов С…СЂРѕРјР° Рё обеднения С…СЂРѕРјРѕРј пограничных участков зерен. [5]
- Возможное увеличение концентрации СО2 в воде при наличии в ней бикарбонатов в количестве более 2 мг-экв / л не приводит к заметному усилению коррозии металла, в результате чего можно считать, что коррозионная активность воды, нагретой в контактных газовых экономайзерах, не больше, чем воды, нагретой в бойлерах. [6]
- Щелочная среда в одних случаях способствует образованию защитной пленки из гидратов окиси, в других, наоборот-приводит к растворению окислов металла, образованию хорошо растворимых соединений и тем самым к усилению коррозии металла. [7]
- Затраты за компенсацию негативных последствий, другими словами, издержки компенсации, тесным образом связаны с загрязнением воздушной и водной среды и с такими медико-биологическими и физико-химическими процессами, как рост заболеваемости населения, ухудшение продуктивности сельскохозяйственных земель, усиление коррозии металлов и сплавов. [8]
Практически все процессы, связанные с воздействием рабочих сред, ускоряются под действием механических напряжений. Явление усиления коррозии металла под действием механических напряжений называют ме-ханохимическим эффектом. [9]
Ркстракционная фосфорная кислота содержит также примеси СЃРІРѕР±РѕРґРЅРѕР№ серной, кремнефтористоводородной, Р° РёРЅРѕРіРґР° Рё плавиковой кислот. Примеси эти способствуют усилению РєРѕСЂСЂРѕР·РёРё металлов РІ фосфорной кислоте. [10]
В последнее время широкое применение нашли погружные центробежные насосы, однако их применение поставило ряд ранее не встречающихся проблем, одной из которых является коррозия корпусов центробежных насосов, электродвигателей и обсадной колонны, которые выполняются из разных марок сталей. При их контакте возможно усиление коррозии металла, являющегося в данной системе анодом макрогальванического элемента. В большинстве случаев анодом макрогальванопары являются корпуса центробежных насосов, что вызывает их усиленное коррозионное растворение и требует проведения противокоррозионных мероприятий. [11]
Коррозиен ио-механнческое разрушение металлов. Механические напряжения пршодят к усилению коррозии металлов и к появлению локальных разрушений, в частности, к коррозионному растрескиванию. [12]
Коррозиен ио-механнческое разрушение металлов. Механические напряжения пртодят к усилению коррозии металлов и к появлению локальных разрушений, в частности, к коррозионному растрескиванию. [13]
Для повышения коэффициента полезного действия теплового цикла электростанции увеличивают температуру перегрева и давление острого пара, а также используют вторичный перегрев до возможно более высоких температур. Но при возрастании температуры пара происходит усиление коррозии металла труб поверхностей нагрева вследствие интенсификации диффузионных процессов, так как повышается температура металла стенок труб выходной части пароперегревателей. При увеличении давления острого пара растет температура стенки экранных труб, омываемых с внутренней стороны более горячей водной средой. [14]
Равномерное разрушение металла при простоях, в отличие от коррозии в рабочих условиях, характеризуется образованием большого количества продуктов коррозии, содержащих гидроокись железа [ Fe ( OH) 3 ], которая называется ржавчиной. Образующаяся ржавчина во время работы парового котла ведет к усилению коррозии металла в процессе его эксплуатации. В итоге накопление ржавчины на поверхности металла приводит к подшламовой коррозии. [15]
Страницы: 1 2
Активаторы процесса коррозии и ускорение разрушения металлов
Химическую коррозию ускоряет повышение концентрации агрессивных (способных химически взаимодействовать с металлами) веществ.
Интенсивность электрохимической коррозии в основном зависит от природы контактирующих металлов, от концентрации и вида электролита. Скорость электрохимической коррозии тем выше, чем больше разность потенциалов между находящимися в контакте металлами. Например, железо (Е° Fe/Fe2+ = -0,44 В) при контакте с медью (Е°Cu/Cu2+ = +0,34 В) будет
разрушаться быстрее, чем при контакте с оловом (E°Sn/Sn2+ = -0,14 В).
Процессы окисления на аноде и восстановления на катоде взаимосвязаны. При ускорении или торможении катодного процесса будет также повышаться или снижаться и скорость коррозии. Так, повышение концентрации ионов Н+ или молекул кислорода 02 в электролите увеличивает скорость катодной реакции, а следовательно, ускоряет электрохимическую коррозию металла.
Процессы электрохимической коррозии также сильно ускоряются в присутствии ионов С1 — (растворённые соли — хлориды:NaCl, СаС12 и др.).
Химическое взаимодействие металлов с различными веществами в дополнение к электрохимической коррозии всегда увеличивает общую скорость разрушения металлов.
В большинстве случаев такими активными веществами по отношению к металлам являются кислоты.
Кислоты, в которых окислителем является ион Н+, реагируют с металлами, имеющими отрицательные значения потенциалов, с образованием солей и выделением газа — водорода Н2.
- Например, если цинковое изделие подвергается воздействию раствора соляной кислоты НС1, то наряду с обычной реакцией растворения цинка в кислоте:
- Zn+ 2HC1 →ZnCl2 + H2↑
- Zn° —2ё →Zn2+
- 2H+ +2ё→H2°↑
- происходят также электрохимические процессы в гальванических элементах разного рода, образующихся на поверхности металла:
- Анод:Zn° —2ё →Zn2+
- Катод:2H+ +2ё→ H2°↑(в кислой среде)
- Общая скорость разрушения металла будет складываться из скоростей химического и электрохимического процессов.
- Щёлочи в водных растворах химически не взаимодействуют с большинством металлов, однако некоторые амфотерные металлы (алюминий, цинк, бериллий, олово, свинец) разрушаются водными растворами щелочей, например:
- н2о
- 2А1 + 6КОН → 2К3А1О3 + 3Н2↑
- Рассмотрим, какие процессы происходят при контакте цинкового изделия с водным раствором щёлочи, например, NaOH.
- Так же как и в предыдущем примере, цинк вступает в химическую реакцию, и при этом, окисляясь, разрушается:
- Zn+ 2NaOH→Na2ZnО2 + H2↑
- Zn° —2ё →Zn2+
- 2H+ +2ё→ H2°↑
- Электрохимическая коррозия цинка в среде электролита в данном случае описывается уравнениями:
- Анод: Zn°-2e → Zn2+
- Катод: О2 +2Н2О + 4 ё →4(ОН)—(в отсутствие кислоты)
- Присутствующие в щелочном растворе ионы ОН- замедляют катодную реакцию, а, следовательно, анодный процесс окисления цинка также будет подавляться.
- Таким образом, в щелочной среде коррозия амфотерных металлов происходит практически полностью за счёт химического взаимодействия.
Химическое взаимодействие металла с растворами солей также может ускорять процесс коррозии за счёт образования дополнительных микрогальванических элементов.
Известно, что металл может восстанавливать ионы металлов, имеющих более высокие значения потенциалов, из водных растворов солей.
Например, при добавлении в электролит, находящийся в контакте с цинком, раствора медной соли происходит восстановление меди (ЕZn°
Извлечения из классической книги
И.Л.Розенфельд, В.П.Персианцева «Ингибиторы атмосферной коррозии», М., «ХИМИЯ», 1985г.
Факторы, влияющие на скорость атмосферной коррозии
Наиболее важными факторами, определяющими скорость атмосферной коррозии являются: влажность атмосферы; состав атмосферы; суммарная длительность пребывания пленки влаги, образовавшейся на поверхности металла; ее химический состав; температура воздуха.
Влажность атмосферы. Абсолютная влажность воздуха (количество водяного пара в единице объема воздуха) при неизменных других условиях определяет толщину адсорбционной пленки, образующейся на поверхности металла.
Так, например, толщина слоя влаги, образующейся на поверхности железа при относительной влажности воздуха 55%, составляет 15 молекулярных слоев, а при относительной влажности 100% — 90 – 100 молекулярных слоев…
От относительной влажности зависит и количество воды, которое сконденсируется на поверхности металла при охлаждении изделия, однако и в этом случае при последующем ее испарении коррозия при меньших относительных влажностях, например при 76%, может оказаться выше, чем при 100% влажности.
Сказывается эффект саморазмешивания… Малые скорости коррозии наблюдаются лишь при относительных влажностях до 60%. Превышение этой влажности при любом количестве сконденсированной на поверхности металла влаги приводит к резкому возрастанию скорости коррозии.
Однако при большом количестве сконденсированной влаги коррозия при 80%-ной относительной влажности выше, чем при 100%.
Количество же сконденсированной на поверхности металла влаги зависит от температурного перепада: чем он выше, тем больше конденсируется воды при заданной влажности…
Количество сконденсированной влаги может изменяться также от присутствия на поверхности металла посторонних веществ. Их влияние сказывается на капиллярной конденсации. Кроме того, они способны стать центрами кристаллизации. Особенно опасны вещества, отличающиеся высокой гигроскопичостью.
В их присутствии изменяются значения относительной влажности воздуха, при которой наблюдается резкое возрастание скорости коррозии металлов (Hk — критическая влажность)…
Так, например, при наличии на поверхности железа аммонийных солей скорость коррозии резко возрастает, а влажность воздуха спускается с 80 до 50% …
Природа продуктов коррозии железа оказывает также сильное влияние на критическую влажность; для железа, покрытого продуктами коррозии, образованными в дистиллированной воде, критическая влажность равна 65%, а для морской воды критическая влажность снижается до 50% [194]…
Помимо снижения критической влажности посторонние частицы, осаждающиеся на поверхности металла, могут повышать скорость разрушения металлов вследствие изменения структуры защитных пленок, а также их адгезии с поверхностью металла.
Возникновение поверхностного натяжения между твердыми частицами и продуктами коррозии может приводить к тому, что последние будут прилипать к твердой частичке, а не к поверхности металла, ослабляя этим защитные свойства образующихся продуктов коррозии. Это наблюдается также в том случае, если природа частичек такова, что они могут взаимодействовать с переходящими в раствор ионами металла с образованием растворимых продуктов коррозии вместо нерастворимых гидроокисей металлов.
Отсюда следует весьма важный вывод: возникшие по каким-либо причинам продукты коррозии даже в виде мелких очагов должны быть возможно быстрее удалены, чтобы они не способствовали дальнейшему развитию коррозии. Следует также избегать попадания посторонних частиц на поверхность изделия.
Состав атмосферы. Агрессивные свойства атмосферы по отношению к металлам определяются не только влажностью, но и теми загрязнениями, которые в нее попадают.
Самыми неблагоприятными видами загрязнений являются сернистый газ и хлористый натрий.
Первый попадает в атмосферу вместе с продуктами, образующимися при сжигании сернистого топлива, второй – за счет соли, уносимой ветром с поверхности океанов и морей.
Сернистый газ. С некоторой критической концентрации сернистый газ сильно увеличивает скорость коррозии таких металлов, как железо, алюминий, цинк, медь и другие… При постоянной концентрации сернистого газа в атмосфере скорость коррозии металлов возрастает с повышением относительной влажности атмосферы…
Возрастание скорости коррозии металлов наблюдается и в том случае, когда в атмосфере нет сернистого газа, но поверхность металла предварительно подвергалась его воздействию. Коррозия при этом протекает так, как будто атмосфера содержит сернистый газ …
такой отрицательный эффект связан с тем, что сернистый газ в присутствии адсорбированной влаги на металле образует кристаллогидраты, которые не удаляются с поверхности металла даже при откачке и способствуют возникновению и развитию коррозионного процесса.
Наиболее опасными в промышленной атмосфере являются оседания на поверхности конструкции частичек угольной пыли…
Хлористый натрий. Хлористый натрий, подобно сернистому газу, весьма заметно усиливает коррозию ряда металлов в атмосферных условиях… Основной причиной ускорения коррозии хлористым натрием является образование в его присутствии растворимых продуктов коррозии вместо нерастворимых гидроокисей, возникающих под чистой пленкой влаги.
Кроме того, ионы хлора препятствуют образованию пассивирующих пленок. Агрессивное действие хлористого натрия в условиях атмосферы следует также связывать с его способностью адсорбировать влагу из относительно сухих атмосфер.
Уже при относительной влажности воздуха, равной 70%, хлористый атрий адсорбирует влагу, что сопровождается сильным увеличением скорости коррозии…
Из других загрязнений воздуха наиболее агрессивными являются хлор, аммиак, сероводород и углекислый газ… Не останавливаясь подробно на рассмотрении влияния этих загрязнений атмосферы на механизм и скорость коррозионных процессов, отметим то общее, что есть в действии этих соединений, а также их некоторые отличительные особенности.
Отличительной особенностью хлора является его агрессивность как во влажных, так и в относительно сухих атмосферах (Н = 42%)… При высоких относительных влажностях наступает резкое возрастание скорости коррозии.
Последнее связано с тем, что хлор является сильным катодным деполяризатором при высоких относительных влажностях.
Кроме того, в результате образования хлористых соединений он сдвигает критическую влажность к более низким значениям.
Коррозионная активность сероводорода, подобно сернистому газу, наступает лишь при достижении определенного значения относительной влажности атмосферы… В сухой атмосфере в присутствии сероводорода коррозия цинка, кадмия, олова, алюминия, сурьмы, висмута, хрома, железа, чугуна, легированных сталей, кобальта и никеля ничтожна.
.. Общим для рассматриваемых видов загрязнений является их более низкая (в большинстве случаев) агрессивность по сравнению с сернистым газом и хлористым натрием. Аммиак сам по себе для железа и сплавов на его основе не опасен. Однако для медных сплавов он представляет большую опасность, вызывая коррозионное растрескивание.
Продолжительность пребывания пленки влаги на поверхности металла…
в атмосферах, не загрязненных заметными количествами специфических коррозионно-активных примесей, процесс атмосферной коррозии возникает и развивается лишь в том случае, если на поверхности металла присутствует пленка влаги определенной толщины (10-20 молекулярных слоев), приобретающая свойства электролита. Продолжительность развития коррозионного процесса и количество металла, превратившегося в продукты коррозии, зависит от длительности пребывания пленки электролита на поверхности металла. Чем дольше не высыхает пленка, образовавшаяся на металле, или чем чаще она возобновляется, тем дольше протекает процесс коррозии, а следовательно, при всех прочих равных условиях тем большему коррозионному разрушению подвергается металл…
Существенное значение длительности общего времени пребывания пленки влаги для коррозионного разрушения подтверждается также тем, что, например, в Батуми, где выпадает максимальное по Союзу количество осадков (число дней с росой – 68) и где, казалось бы, коррозия должна быть наибольшей, она оказывается ниже, чем, скажем, в приморских условиях Мурманска, где количество осадков значительно меньше число дней с росой – 25). Это объясняется тем, что в Батуми, где много солнечных дней, условия для удаления пленки с поверхности металла более благоприятны, чем в Мурманске. Поэтому общее время контакта металла с электролитом в Батуми значительно меньше, чем в Мурманске, а следовательно, и коррозия там меньше. Этим же эффектом можно объяснить, почему сильнее корродирует та сторона образца или конструкции, которая обращена к земле, а не та, на которую непосредственно выпадают атмосферные осадки.
Температура воздуха. Скорость коррозии с температурой обычно возрастает, поскольку с ростом температуры увеличивается кинетика электрохимических реакций, обусловливающих коррозионный процесс.
При атмосферной коррозии, протекающей … в видимых слоях электролитов, чаще всего с катодным ограничением, температура изменяет скорость процесса главным образом благодаря изменению кинетики катодной реакции восстановления кислорода, скорость которой определяется скоростью диффузии кислорода к электроду.
Поскольку коэффициент диффузии кислорода с температурой растет (коэффициент диффузии изменяется по закону D = RT / (6p r h),
где R – постоянная Больцмана; r – радиус диффундирующей частицы; h – вязкость среды), а толщина диффузионного слоя уменьшается (вследствие усиления саморазмешивания, обусловленного конвекцией), то повышение температуры должно привести к росту предельного диффузионного тока и, следовательно, скорости коррозии. Необходимо, однако, иметь в виду, что при коррозии металлов в атмосфере с изменением температуры меняется длительность контакта электролита с металлом. Поэтому общий коррозионный эффект зависит от изменения кинетики электродных реакций и от изменения времени пребывания электролита на поверхности металла.
Ввиду наличия двух факторов, действующих в прямо противоположном направлении (длительность контакта металла с электролитом уменьшается с повышением температуры, а скорость реакций, обусловливающих коррозионный процесс, увеличивается), зависимость скорости атмосферной коррозии от температуры является весьма сложной и ее не всегда легко предсказать. Если эффекты, возникающие от длительного пребывания металла в контакте с электролитом, превышают эффекты, возникающие за счет более интенсивного протекания процесса при более высокой температуре, то коррозия в районах, характеризующихся относительно низкой температурой, может быть больше, чем в районах, отличающихся высокими температурами. Однако высокие температуры, сочетающиеся с длительным пребыванием металла в контакте с электролитом, что, например, наблюдается во влажном тропическом климате, способствуют усиленной коррозии






