- Медь азотнокислая — важный для промышленности нитрат
- Структура нитрата меди (Cu (NO3) 2), свойства, применение / химия
- Физико-химические свойства
- Электронная конфигурация
- Химическая структура
- приложений
- риски
- ссылки
- Нитрат меди (II)
- Физические свойства
- Химические свойства
- Разложение
- Гидролиз
- Обменные реакции
- Прочие реакции
- Получение
- Токсичность
- Медь, свойства, соединения, сплавы, производство, применение
- Плотность меди, удельный вес меди и другие характеристики меди
- Модули упругости меди и коэффициент Пуассона
- СОЕДИНЕНИЯ МЕДИ
- ПРОИЗВОДСТВО МЕДИ
- СПЛАВЫ МЕДИ
- ПРИМЕНЕНИЕ МЕДИ
- Copper(II) nitrate — Wikipedia
- Синтез и реакции нитрата меди
- Состав
- Безводный нитрат меди (II)
- Гидратированный нитрат меди (II)
- Приложения
- Органический синтез
- использованная литература
Азотная кислота является одной из самых сильных минеральных кислот, в концентрированном виде выделяет пары желтого цвета с резким запахом. За исключением золота и платины растворяет все металлы.
Применяют азотную кислоту для получения красителей, удобрений, органических нитропродуктов, серной и фосфорной кислот. В результате ожога азотной кислотой образуется сухой струп желто-зеленого цвета.
- В промышленности азотную кислоту получают в результате окисления аммиака на платино-родиевых катализаторах.
- NH3 + O2 → (кат. Pt) NO + H2O
- KNO3 + H2SO4(конц.) → KHSO4 + HNO3↑
- Кислотные свойства
- CaO + HNO3 → Ca(NO3)2 + H2O
- HNO3 + NaOH → NaNO3 + H2O
- Na2CO3 + HNO3 → NaNO3 + H2O + CO2↑
- Термическое разложение
- Реакции с неметаллами
- Азотная кислота способна окислить все неметаллы, при этом, если кислота концентрированная, азот обычно восстанавливается до NO2, если разбавленная — до NO.
- HNO3(конц.) + C → CO2 + H2O + NO2
- HNO3(конц.) + S → H2SO4 + NO2 + H2O
- HNO3(разб.) + S → H2SO4 + NO + H2O
- HNO3(конц.) + P → H3PO4 + NO2 + H2O
- Реакции с металлами
- Для малоактивных металлов (стоящих в ряду напряжений после водорода) реакция с концентрированной азотной кислотой происходит с образованием нитрата и преимущественно NO2.
- Cu + HNO3(конц.) → Cu(NO3)2 + NO2 + H2O
- С разбавленной азотной кислотой газообразным продуктом преимущественно является NO.
- Cu + HNO3(разб.) → Cu(NO3)2 + NO + H2O
- В реакциях с металлами, стоящими левее водорода в ряду напряжений, возможны самые разные газообразные (и не газообразные) продукты: бурый газ NO2, NO, N2O, атмосферный газ N2, NH4NO3.
- Al + HNO3(конц.) ⇸ (реакция не идет)
- При нагревании или амальгамировании (покрытие ртутью) перечисленных металлов реакция с азотной кислотой идет, так как оксидная пленка на поверхности металлов разрушается.
- Al + HNO3 → (t) Al(NO3)3 + NO2 + H2O
Является одноосновной сильной кислотой, вступает в реакции с основными оксидами, основаниями. С солями реагирует при условии выпадения осадка, выделения газа или образования слабого электролита.

При нагревании азотная кислота распадается. На свету (hv) также происходит подобная реакция, поэтому азотную кислоту следует хранить в темном месте. HNO3 → (hv) NO2 + H2O + O2
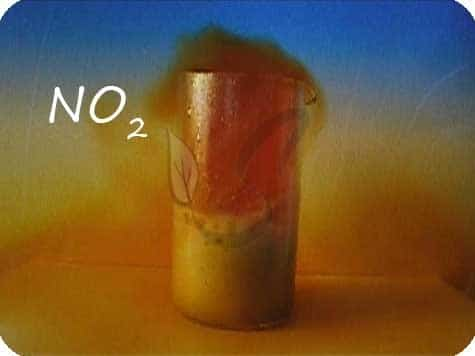
В любой концентрации азотная кислота проявляет свойства окислителя, при этом азот восстанавливается до степени окисления от +5 до -3. На какой именно степени окисления остановится азот, зависит от активности металла и концентрации азотной кислоты.
Помните о закономерности: чем более разбавлена кислота и активен металл, тем сильнее восстанавливается азот. Ниже представлены реакции цинка с азотной кислотой в различных концентрациях.
Zn + HNO3(70% — конц.) → Zn(NO3)2 + NO2 + H2O
Zn + HNO3(35% — ср. конц.) → Zn(NO3)2 + NO + H2O
Zn + HNO3(20% — разб.) → Zn(NO3)2 + N2O + H2O
Zn + HNO3(10% — оч. разб.) → Zn(NO3)2 + N2 + H2O

Посмотрите на таблицу ниже, в которой также отражены изученные нами закономерности.
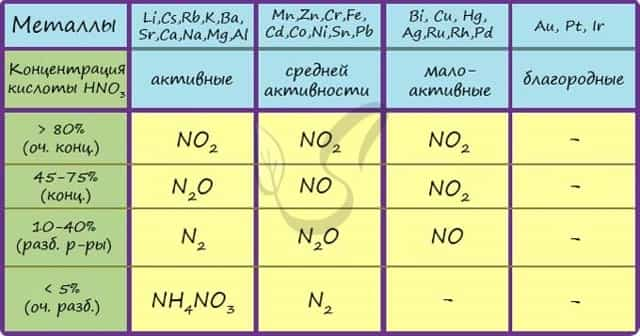
Концентрированная холодная азотная кислота пассивирует хром, железо, алюминий, никель, свинец и бериллий. Это происходит за счет оксидной пленки, которой покрыты данные металлы.
- Получают нитраты в ходе реакции азотной кислоты с металлами, их оксидами и основаниями.
- Fe + HNO3(разб.) → Fe(NO3)2 + N2O + H2O
- В реакциях с оксидами и основаниями газообразный продукт обычно не выделяется.
- MgO + HNO3 → Mg(NO3)2 + H2O
- Cr(OH)3 + HNO3 → Cr(NO3)3 + H2O
- Нитрат аммония получают реакция аммиака с азотной кислотой.
Обратите внимание на следующую закономерность: концентрированная азотная кислота, как правило, окисляет железо и хром до +3. Разбавленная кислота — до +2.
Fe + HNO3(разб.) → Fe(NO3)2 + N2O + H2O
Fe + HNO3(конц.) → Fe(NO3)3 + NO + H2O
- Реакции с металлами, основаниями и кислотами
- Hg(NO3)2 + Mg → Mg(NO3)2 + Hg
- Pb(NO3)2 + LiOH → Pb(OH)2 + LiNO3
- AgNO3 + KCl → AgCl↓ + KNO3
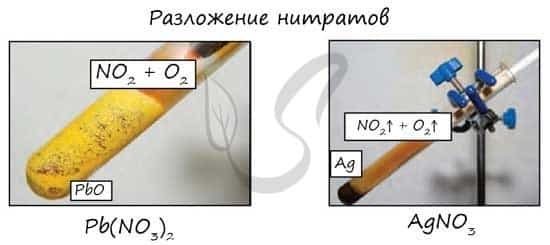
- Разложение нитратов
- Pb(NO3)2 → (t) PbO + NO2 + O2
- NaNO3 → (t) NaNO2 + O2
- Cu(NO3)2 → (t) CuO + NO2 + O2
- PtNO3 → (t) Pt + NO2 + O2
Как и для всех солей, из нитратов можно вытеснить металл другим более активным. Соли реагируют с основаниями и кислотами, если в результате реакции выпадает осадок, выделяется газ или образуется слабый электролит (вода).

Ba(NO3)2 + Na2SO4 → BaSO4 + NaNO3
Нитраты разлагаются в зависимости от активности металла, входящего в их состав.
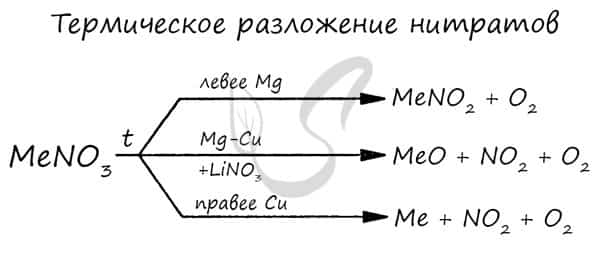
Медь азотнокислая — важный для промышленности нитрат
Свойства
Безводный нитрат меди — белый порошок с бесцветными гигроскопичными кристаллами, водорастворимый. Растворим также в спиртах, этилацетате, жидком аммиаке, диметилсульфоксиде (ДМСО). При нагревании разлагается на оксид меди и диоксид азота. Ядовит.
Водный раствор приобретает ярко-голубой цвет. В зависимости от концентрации растворенного вещества, из него выкристаллизовываются кристаллогидраты с разным количеством молекул воды. Кристаллы имеют голубой цвет, во влажном воздухе поглощают влагу и расплываются. В сухом воздухе они постепенно выветриваются и превращаются в безводную соль
Медь азотнокислая — достаточно активное химическое вещество. Проявляет сильные окислительные свойства. Например, бумага, которую пропитали ее спиртовым раствором, после высыхания способна самовоспламеняться.
Нитрат меди реагирует со щелочами, фосфором, фосфатами, жидким аммиаком, многими солями, гидроксиламином и гидразином.
Меры предосторожности
Реактив считается умеренно токсичным для человека и опасным для окружающей среды (ядовит для обитателей водоемов).
Контакт порошка с кожей приводит к раздражениям, способным спровоцировать различные заболевания кожи.
Если вещество попало в глаза, их следует немедленно и тщательно промыть водой, иначе возможен ожог и помутнение роговицы. При проглатывании вещество действует как яд, вызывая отравления.
На предприятиях, имеющих дело с нитратом меди, нужно строго следить за соблюдением техники безопасности и противопожарной безопасности.
Хранить медь азотнокислую следует на прохладных, сухих, проветриваемых складах, т.к. при нагревании и разложении выделяются газы. Безводную соль необходимо защитить от влияния воздуха, так как она впитывает влагу и превращается в кристаллогидрат, поэтому ее хранят в герметично запаянных пластиковых мешках или другой герметичной таре.
Применение:
- В химпроме — для получения чистой окиси меди; для производства минеральных красителей, катализаторов, на основе меди. В процессах органического синтеза применяется для нитрования органических ароматических соединений.
- В текстильпроме — для окрашивания тканей красителем индиго, для травления тканей.
- В металлургии — для воронения стали и латуни, чернения меди. При изготовлении эмалированных изделий с помощью реактива придают железу коричневый цвет, а меди — черный.
- При изготовлении эмалей и чернил для нанесения надписей и рисунков по жести.
- В сельском хозяйстве — для борьбы с грибковыми болезнями растений.
- В аналитической химии — в эталонных растворах, в колориметрии; для проведения характерных реакций, при проведении анализов на обнаружение серы.
- В фотоделе — для изготовления определенных видов фотобумаги, для проявления негативов.
- В микробиологии — в качестве консервирующего вещества при работе с некоторыми типами растений.
Структура нитрата меди (Cu (NO3) 2), свойства, применение / химия
нитрат меди (II) или нитрат меди, химическая формула которого Cu (NO)3)2, Это яркая неорганическая соль и привлекательные сине-зеленые цвета. Он синтезируется в промышленном масштабе в результате разложения медных руд, в том числе минералов герхардит и руаит..
Другие более выполнимые методы с точки зрения сырья и желаемых количеств соли состоят из прямых реакций с металлической медью и ее производными соединениями. Когда медь находится в контакте с концентрированным раствором азотной кислоты (HNO3) происходит окислительно-восстановительная реакция.
В этой реакции медь окисляется, а азот восстанавливается в соответствии со следующим химическим уравнением:
Cu (s) + 4HNO3(конц) => Cu (НЕТ3)2(ac) + 2H2O (l) + 2NO2(G)
Диоксид азота (НЕТ2) коричневый и ядовитый газ; Полученный водный раствор голубоватый. Медь может образовывать ион меди (Cu+) ион меди (Cu2+) или менее распространенный ион Cu3+; однако ион меди не поддерживается в водных средах многими электронными, энергетическими и геометрическими факторами..
Стандартный восстановительный потенциал для Cu+ (0,52 В) больше, чем для Cu2+ (0,34 В), что означает, что Cu+ он более нестабилен и имеет тенденцию приобретать электрон, чтобы стать Cu (s). Эта электрохимическая мера объясняет, почему CuNO не существует3 как продукт реакции или, по крайней мере, в воде.
индекс
- 1 Физико-химические свойства
- 1.1 Электронная конфигурация
- 2 Химическая структура
- 3 использования
- 4 риска
- 5 ссылок
Физико-химические свойства
Медная селитра встречается безводной (сухой) или гидратированной с различными пропорциями воды. Ангидрид представляет собой голубую жидкость, но после координации с молекулами воды, способными образовывать водородные связи, кристаллизуется в виде Cu (NO)3)2· 3Н2O или Cu (НЕТ3)2· 6H2О. Это три наиболее доступные формы соли на рынке.
Молекулярная масса для сухой соли составляет 187,6 г / моль, добавляя к этому значению 18 г / моль для каждой молекулы воды, включенной в соль. Его плотность равна 3,05 г / мл, и это уменьшается для каждой включенной молекулы воды: 2,32 г / мл для тригидратированной соли и 2,07 г / мл для гексагидратированной соли. Не имеет точки кипения, но сублимирует.
- Три формы нитрата меди хорошо растворимы в воде, аммиаке, диоксане и этаноле. Его точки плавления снижаются по мере добавления другой молекулы во внешнюю сферу координации меди; после плавления происходит термическое разложение нитрата меди с образованием вредных газов NO2:
- 2 Cu (НЕТ3)2(s) => 2 CuO (s) + 4 NO2(г) + О2(G)
- Химическое уравнение выше для безводной соли; для гидратированных солей пар также будет производиться в правой части уравнения.
Электронная конфигурация
Электронная конфигурация для иона Cu2+ это [Ar] 3d9, представляя парамагнетизм (электрон в 3d-орбитали9 непарный).
Поскольку медь является переходным металлом четвертого периода периодической таблицы и потеряла два своих валентных электрона под действием HNO3, у него все еще есть 4s и 4p орбитали, доступные для формирования ковалентных связей. Более того, Cu2+ может использовать две из своих самых внешних 4d орбиталей, чтобы иметь возможность координировать до шести молекул.
Анионы НЕ3- плоские, и поэтому Cu2+ может координировать с ними должно быть sp гибридизации3d2 это позволяет ему принять восьмигранную геометрию; это мешает анионам НЕ3- они «бьют» друг друга.
Это достигается с помощью Cu2+, поместив их в квадратную плоскость вокруг друг друга. Результирующая конфигурация для атома Cu в соли: [Ar] 3d94s24p6.
Химическая структура
Изолированная молекула Cu (NO) представлена на верхнем изображении3)2 в газовой фазе. Атомы кислорода аниона нитрата координируются непосредственно с центром меди (внутренняя координационная сфера), образуя четыре связи Cu-O.
Он имеет квадратную плоскую молекулярную геометрию. Плоскость нарисована красными сферами в вершинах и медной сферой в центре. Газофазные взаимодействия очень слабы из-за электростатического отталкивания между группами NO3-.
- Однако в твердой фазе медные центры образуют металлические связи -Cu-Cu-, создавая полимерные медные цепи.
- Молекулы воды могут образовывать водородные связи с группами NO3-, и они будут предлагать водородные мостики для других молекул воды и так далее, пока не создадут водную сферу вокруг Cu (НЕТ3)2.
- В этой сфере может иметь от 1 до 6 внешних соседей; следовательно, соль легко гидратируется, образуя гидратированные соли три и гекса.
Соль образуется из иона Cu2+ и два иона НЕ3-, придание ему характерной кристалличности ионных соединений (орторомбическая для безводной соли, ромбоэдрическая для гидратированных солей). Тем не менее, ссылки более ковалентные.
приложений
Для захватывающих цветов нитрата меди эта соль находит применение в качестве добавки в керамике, на металлических поверхностях, в некоторых фейерверках, а также в текстильной промышленности в качестве протравы..
Это хороший источник ионной меди для многих реакций, особенно тех, в которых она катализирует органические реакции. Он также находит применение, подобное другим нитратам, в качестве фунгицида, гербицида или консерванта для древесины..
Другое его основное и наиболее инновационное применение — синтез катализаторов CuO или материалов с фоточувствительными свойствами..
Он также используется в качестве классического реагента в учебных лабораториях, чтобы показать реакции внутри гальванических элементов.
риски
— Это сильно окисляющий агент, вредный для морской экосистемы, раздражающий, токсичный и едкий. Важно избегать любого физического контакта непосредственно с реагентом.
- — Не воспламеняется.
- — Разлагается при высоких температурах, выделяя раздражающие газы, среди которых NO2.
- — В организме человека может вызвать хроническое повреждение сердечно-сосудистой и центральной нервной систем.
- — Может вызвать раздражение желудочно-кишечного тракта.
— Будучи нитратом, внутри тела становится нитрит. Нитриты наносят ущерб уровням кислорода в крови и сердечно-сосудистой системе.
ссылки
- Дей Р. и Андервуд А. Количественная аналитическая химия (пятое изд.). Пирсон Прентис Холл, р-810.
- MEL Science. (2015-2017). MEL Science. Получено 23 марта 2018 года от MEL Science: melscience.com
- ResearchGate GmbH. (2008-2018). ResearchGate. Получено 23 марта 2018 года от ResearchGate: researchgate.net
- Научная лаборатория. Научная лаборатория. Получено 23 марта 2018 года из научной лаборатории: sciencelab.com
- Уиттен, Дэвис, Пек и Стэнли. (2008). химия (Восьмое издание). р-321. CENGAGE Learning.
- Википедия. Википедия. Получено 22 марта 2018 г. из Википедии: en.wikipedia.org
- Агирре, Джон Маурисио, Гутьеррес, Адамо и Джиральдо, Оскар. (2011). Простой способ синтеза гидроксильных солей меди. Журнал Бразильского химического общества, 22(3), 546-551
Нитрат меди (II)
Нитрат меди (II) (в форме осно́вной соли) встречается в природе в виде минералов герхардтита и руаита. Свойства минералов представлены в таблице:
| Cu2NO3(OH)3 | Cu2NO3(OH)3 |
| зелёный | темно-зелёный |
| орторомбическая | моноклинная |
| 3,40—3,43 | 3,38 |
| 2 | 2 |
Физические свойства
Безводный нитрат меди (II) при нормальных условиях — твёрдое кристаллическое вещество белого цвета, хорошо растворимое в воде (124,7 г/100 г H2O при 20 °C; 207,7 г/100 г H2O при 80 °C), этаноле, метаноле, этилацетате, ацетонитриле, ДМСО.
При кристаллизации из водных растворов образует ряд кристаллогидратов: нона-, гекса- и тригидраты. Также известны кристаллогидраты, содержащие 1,5 и 2,5 молекулы H2O. Параметры кристаллической решетки кристаллогидратов:
- Cu(NO3)2·6H2O: триклинная сингония, пространственная группа P1, параметры ячейки a = 0,591 нм, b = 0,777 нм, c = 0,543 нм, α = 97,65°, β = 93,88°, γ = 72,53°, Z = 1.
- Cu(NO3)2·3H2O: ромбическая сингония, пространственная группа Pmn21, параметры ячейки a = 1,12 нм, b = 0,505 нм, c = 0,528 нм, Z = 4.
- Cu(NO3)2·2,5H2O: моноклинная сингония, пространственная группа I2/a, параметры ячейки a = 1,64539 нм, b = 0,49384 нм, c = 1,59632 нм, β = 93,764°, Z = 8.
- Cu(NO3)2·1,5H2O: моноклинная сингония, пространственная группа C2/c, параметры ячейки a = 2,22 нм, b = 0,490 нм, c = 1,54 нм, β = 48°, Z = 8.
Гексагидрат разлагается при нагревании до 100 °C в вакууме. Тригидрат разлагается при 120 °C.
Химические свойства
Разложение
Нитрат меди (II) при нагревании разлагается с образованием оксида меди (II) и диоксида азота:
2Cu(NO3)2 →>170∘C 2CuO + 4NO2 + O2
Образовавшийся диоксид азота можно использовать для лабораторного получения азотной кислоты:
3NO2 + H2O ⟶ 2HNO3 + NO↑
Гидролиз
Нитрат меди (II) в водном растворе диссоциирует на ионы с одновременной гидратацией катиона:
Cu(NO3)2 + 4H2O ⟶ [Cu(H2O)4]2+ + 2NO3−
Катион тетрааквамеди (II) подвергается обратимому гидролизу:
[Cu(H2O)4]2+ + H2O ⇄ [Cu(H2O)3(OH)]+ + H3O+ , pKa = 7,34
В упрощённом виде:
Cu2+ + H2O ⇄ CuOH+ + H+
Обменные реакции
В водных растворах нитрат меди (II) вступает в реакции ионного обмена, характерные для растворимых солей двухвалентной меди, например:с щёлочью (выпадает голубой осадок)
Cu(NO3)2 + 2NaOH ⟶ Cu(OH)2 ↓ + 2NaNO3
с фосфатом натрия (выпадает синий осадок)
3Cu(NO3)2 + 2Na3PO4 + 3H2O ⟶ Cu3(PO4)2 ⋅ 3H2O↓ + 6NaNO3
с жёлтой кровяной солью (выпадает красный осадок)
2Cu(NO3)2 + K4[Fe(CN)6] ⟶ Cu2[Fe(CN)6]↓ + 4KNO3
с концентрированным раствором аммиака (раствор приобретает тёмно-синий цвет)
Cu(NO3)2 + 4NH3 ⋅ H2O ⟶ [Cu(NH3)4](NO3)2 + 4H2O
с азидами щелочных металлов (выпадает коричневый осадок азида меди (II))
Cu(NO3)2 + 2MN3 →0−10∘C Cu(N3)2 ↓ + 2MNO3 (M = Li, Na)
Прочие реакции
Нитрат меди (II) реагирует с растворами гидроксиламина (при кипении) и гидразина с выпадением белого осадка азида меди (I):
4Cu(NO3)2 + 18(NH2OH ⋅ H2O) ⟶ 4CuN3↓ + 9N2O↑ + 12NH3↑ + 27H2O 4Cu(NO3)2 + (N2H4 ⋅ H2O) + 4NaOH ⟶ 4CuN3↓ + N2↑ + 4NaN3 + 5H2O
Нитрат меди (II) реагирует с жидким тетраоксидом диазота с выпадением темно-зелёного осадка:
Cu(NO3)2 + N2O4 ⟶ Cu(NO3)2 ⋅ N2O4↓
Получение
Нитрат меди (II) может быть получен растворением в азотной кислоте металлической меди, оксида меди (II) или гидроксида меди (II):
Cu + 4HNO3 ⟶ Cu(NO3)2 + 2NO2↑ + 2H2O CuO + 2HNO3 ⟶ Cu(NO3)2 + H2O Cu(OH)2 + 2HNO3 ⟶ Cu(NO3)2 + 2H2O
Безводный нитрат меди (II) может быть получен при взаимодействии меди с тетраоксидом диазота (реакция ведётся при 80 °C в этилацетате):
Cu + 2N2O4 ⟶ Cu(NO3)2 + 2NO↑
Нитрат меди (II) используют для получения чистого оксида меди (II), медьсодержащих катализаторов, как фунгицид, протраву при крашении тканей.
В сочетании с уксусным ангидридом используется в органическом синтезе в качестве реагента для нитрования ароматических соединений (т. н. «условия Менке»).
Токсичность
- Нитрат меди (II) является умеренно-токсичным веществом — LD50 для крыс перорально 950 мг/кг (тригидрат).
- При контакте с кожей и слизистыми оболочками вызывает раздражение, при попадании в глаза — сильное раздражение с риском помутнения роговицы.
- Представляет опасность для окружающей среды — LC50 для рыб 0,29 мг/л в течение 96 ч.
Медь, свойства, соединения, сплавы, производство, применение
Медь (лат. Cuprum) — химический элемент I группы периодической системы Менделеева (атомный номер 29, атомная масса 63,546).
В соединения медь обычно проявляет степени окисления +1 и +2, известны также немногочисленные соединения трехвалентной меди. Важнейшие соединения меди: оксиды Cu2O, CuO, Cu2O3; гидроксид Cu(OH)2, нитрат Cu(NO3)2.
3H2O, сульфид CuS, сульфат(медный купорос) CuSO4.5H2O, карбонат CuCO3Cu(OH)2, хлорид CuCl2.2H2O.
Медь — один из семи металлов, известных с глубокой древности. Переходный период от каменного к бронзовому веку (4 — 3-е тысячелетие до н.э.
) назывался медным веком или халколитом (от греческого chalkos — медь и lithos — камень) или энеолитом (от латинского aeneus — медный и греческого lithos — камень).
В этот период появляются медные орудия. Известно, что при возведении пирамиды Хеопса использовались медные инструменты.
Чистая медь — ковкий и мягкий металл красноватого, в изломе розового цвета, местами с бурой и пестрой побежалостью, тяжелый (плотность 8,93 г/см3), отличный проводник тепла и электричества, уступая в этом отношении только серебру (температура плавления 1083 °C).
Медь легко вытягивается в проволоку и прокатывается в тонкие листы, но сравнительно мало активна. В сухом вохдухе и кислороде при нормальных условиях медь не окисляется.
Но она достаточно легко вступает в реакции: уже при комнатной температуре с галогенами, например с влажным хлором образует хлорид CuCl2, при нагревании с серой образует сульфид Cu2S, с селеном. Но с водородом, углеродом и азотом медь не взаимодействует даже при высоких температурах.
Кислоты, не обладающие окислительными свойствами, на медь не действуют, например, соляная и разбавленная серная кислоты. Но в присутствии кислорода воздуха медь растворяется в этих кислотах с образованием соотвествующих солей: 2Cu + 4HCl + O2 = 2CuCl2 + 2H2O.
В атмосфере, содержащей CO2, пары H2O и др., покрывается патиной — зеленоватой пленкой основного карбоната (Cu2(OH)2CO3)), ядовитого вещества.
Медь входит более чем в 170 минералов, из которых для промышленности важны лишь 17, в том числе: борнит (пестрая медная руда — Cu5FeS4), халькопирит (медный колчедан — CuFeS2), халькозин (медный блеск — Cu2S), ковеллин (CuS), малахит (Cu2(OH)2CO3). Встречается также самородная медь.
Плотность меди, удельный вес меди и другие характеристики меди
- Плотность — 8,93*103кг/м3;
- Удельный вес — 8,93 г/cм3;
- Удельная теплоемкость при 20 °C — 0,094 кал/град;
- Температура плавления — 1083 °C ;
- Удельная теплота плавления — 42 кал/г;
- Температура кипения — 2600 °C ;
- Коэффициент линейного расширения (при температуре около 20 °C) — 16,7 *106(1/град);
- Коэффициент теплопроводности — 335ккал/м*час*град;
- Удельное сопротивление при 20 °C — 0,0167 Ом*мм2/м;
Модули упругости меди и коэффициент Пуассона
| Наименование материала | Модуль Юнга, кГ/мм2 | Модуль сдвига, кГ/мм2 | Коэффициент Пуассона |
| Медь, литье | 8400 | — | — |
| Медь прокатанная | 11000 | 4000 | 0,31-0,34 |
| Медь холоднотянутая | 13000 | 4900 | — |
СОЕДИНЕНИЯ МЕДИ
- Оксид меди (I) Cu2O3 и закись меди (I) Cu2O, как и другие соединения меди (I) менее устойчивы, чем соединения меди (II). Оксид меди (I), или закись меди Cu2O в природе встречается в виде минерала куприта. Кроме того, она может быть получена в виде осадка красного оксида меди (I) в результате нагревания раствора соли меди (II) и щелочи в присутствии сильного восстановителя.
- Оксид меди (II), или окись меди, CuO — черное вещество, встречающееся в природе (например в виде минерала тенерита). Его получают прокаливанием гидроксокарбоната меди (II) (CuOH)2CO3 или нитрата меди (II) Cu(NO2)2.
- Оксид меди (II) хороший окислитель. Гидроксид меди (II) Cu(OH)2 осаждается из растворов солей меди (II) при действии щелочей в виде голубой студенистой массы. Уже при слабом нагревании даже под водой он разлагается, превращаясь в черный оксид меди (II).
- Гидроксид меди (II) — очень слабое основание. Поэтому растворы солей меди (II) в большинстве случаев имеют кислую реакцию, а со слабыми кислотами медь образует основные соли.
- Сульфат меди (II) CuSO4 в безводном состоянии представляет собой белый порошок, который при поглощении воды синеет. Поэтому он применяется для обнаружения следов влаги в органических жидкостях. Водный раствор сульфата меди имеет характерный сине-голубой цвет. Эта окраска свойственна гидратированным ионам [Cu(H2O)4]2+, поэтому такую же окраску имеют все разбавленные растворы солей меди (II), если только они не содердат каких-либо окрашенных анионов. Из водных растворов сульфат меди кристаллизуется с пятью молекулами воды, образуя прозрачные синие кристаллы медного купороса. Медный купорос применяется для электролитического покрытия металлов медью, для приготовления минеральных красок, а также в качестве исходного вещества при получении других соединений меди. В сельском хозяйстве разбавленный раствор медного купороса применяется для опрыскивания растений и протравливания зерна перед посевом, чтобы уничтожить споры вредных грибков.
- Хлорид меди (II) CuCl2. 2H2O. Образует темно-зеленые кристаллы, легко растворимые в воде. Очень концентрированные растворы хлорида меди (II) имеют зеленый цвет, разбавленные — сине-голубой.
- Нитрат меди (II) Cu(NO3)2.3H2O. Получается при растворении меди в азотной кислоте. При нагревании синие кристаллы нитрата меди сначала теряют воду, а затем легко разлагаются с выделением кислорода и бурого диоксида азота, переходя в оксид меди (II).
- Гидроксокарбонат меди (II) (CuOH)2CO3. Встречается в природе в виде минерала малахита, имеющего красивый изумрудно-зеленый цвет. Искусственно приготовляется действием Na2CO3 на растворы солей меди (II).
- 2CuSO4 + 2Na2CO3 + H2O = (CuOH)2CO3↓ + 2Na2SO4 + CO2↑
- Применяется для получения хлорида меди (II), для приготовления синих и зеленых минеральных красок, а также в пиротехнике.
- Ацетат меди (II) Cu (CH3COO)2.H2O. Получается обработкой металлической меди или оксида меди (II) уксусной кислотой. Обычно представляет собой смесь основных солей различного состава и цвета (зеленого и сине-зеленого). Под названием ярь-медянка применяется для приготовления масляной краски.
Комплексные соединения меди образуются в результате соединения двухзарядных ионов меди с молекулами аммиака. Из солей меди получают разноообразные минеральные краски.
!Все соли меди ядовиты.! Поэтому, чтобы избежать образования медных солей, медную посуду покрывают изнутри слоем олова (лудят).
ПРОИЗВОДСТВО МЕДИ
Медь добывают из оксидных и сульфидных руд. Из сульфидных руд выплавляют 80% всей добываемой меди. Как правило, медные руды содержат много пустой породы. Поэтому для получения меди используется процесс обогащения. Медь получают методом ее выплавки из сульфидных руд.
Процесс состоит из ряда операций: обжига, плавки, конвертирования, огневого и электролитического рафинирования. В процессе обжига большая часть примесных сульфидов превращается в оксиды. Так, главная примесь большинства медных руд пирит FeS2 превращается в Fe2O3.
Газы, образующиеся при обжиге, содержат CO2, который используется для получения серной кислоты. Получающиеся в процессе обжига оксиды железа, цинка и других примесей отделяются в виде шлака при плавке. Жидкий медный штейн (Cu2S с примесью FeS) поступает в конвертор, где через него продувают воздух.
В ходе конвертирования выделяется диоксид серы и получается черновая или сырая медь. Для извлечения ценных (Au, Ag, Te и т.д.) и для удаления вредных примесей черновая медь подвергается сначала огневому, а затем электролитическому рафинированию. В ходе огневого рафинирования жидкая медь насыщается кислородом.
При этом примеси железа, цинка и кобальта окисляются, переходят в шлак и удаляются. А медь разливают в формы. Получающиеся отливки служат анодами при электролитическом рафинировании. Основным компонентом раствора при электролитическом рафинировании служит сульфат меди — наиболее распространенная и дешевая соль меди.
Для увеличения низкой электропроводности сульфата меди в электролит добавляют серную кислоту. А для получения компактного осадка меди в раствор вводят небольшое количество добавок. Металлические примеси, содержащиеся в неочищенной («черновой») меди, можно разделить на две группы.
- Fe, Zn, Ni, Co. Эти металлы имеют значительно более отрицательные электродные потенциалы, чем медь. Поэтому они анодно растворяются вместе с медью, но не осаждаются на катоде, а накапливаются в электролите в виде сульфатов. Поэтому электролит необходимо периодически заменять.
- Au, Ag, Pb, Sn. Благородные металлы (Au, Ag) не претерпевают анодного растворения, а в ходе процесса оседают у анода, образуя вместе с другими примесями анодный шлам, который периодически извлекается. Олово же и свинец растворяются вместе с медью, но в электролите образуют малорастворимые соединения, выпадающие в осадок и также удаляемые.
СПЛАВЫ МЕДИ
- Сплавы, повышающие прочность и другие свойства меди, получают введением в нее добавок, таких, как цинк, олово, кремний, свинец, алюминий, марганец, никель. На сплавы идет более 30% меди.
- Латуни — сплавы меди с цинком ( меди от 60 до 90% и цинка от 40 до 10%) — прочнее меди и менее подвержены окислению. При присадке к латуни кремния и свинца повышаются ее антифрикционные качества, при присадке олова, алюминия, марганца и никеля возрастает антикоррозийная стойкость. Листы, литые изделия используются в машиностроении, особенно в химическом, в оптике и приборостроении, в производстве сеток для целлюлознобумажной промышленности.
- Бронзы. Раньше бронзами называли сплавы меди (80-94%) и олова (20-6%). В настоящее время производят безоловянные бронзы, именуемые по главному вслед за медью компоненту.
- Алюминиевые бронзы содержат 5-11% алюминия, обладают высокими механическими свойствами в сочетании с антикоррозийной стойкостью.
- Свинцовые бронзы, содержащие 25-33% свинца, используют главным образом для изготовления подшипников, работающих при высоких давлениях и больших скоростях скольжения.
- Кремниевые бронзы, содержащие 4-5% кремния, применяют как дешевые заменители оловянных бронз.
- Бериллиевые бронзы, содержащие 1,8-2,3% бериллия, отличаются твердостью после закалки и высокой упругостью. Их применяют для изготовления пружин и пружинящих изделий.
- Кадмиевые бронзы — сплавы меди с небольшим количества кадмия (до1%) — используют для изготовления арматуры водопроводных и газовых линий и в машиностроении.
- Припои — сплавы цветных металлов, применяемые при пайке для получения монолитного паяного шва. Среди твердых припоев известен медносеребряный сплав (44,5-45,5% Ag; 29-31%Cu; остальное — цинк).
ПРИМЕНЕНИЕ МЕДИ
Медь, ее соединения и сплавы находят широкое применение в различных отраслях промышленности.
В электротехнике медь используется в чистом виде: в производстве кабельных изделий, шин голого и контактного проводов, электрогенераторов, телефонного и телеграфного оборудования и радиоаппаратуры. Из меди изготавливают теплообменники, вакуум-аппараты, трубопроводы. Более 30% меди идет на сплавы.
Сплавы меди с другими металлами используют в машиностроении, в автомобильной и тракторной промышленности (радиаторы, подшипники), для изготовления химической аппаратуры.
Высокая вязкость и пластичность металла позволяют применять медь для изготовления разнообразных изделий с очень сложным узором.
Проволока из красной меди в отожженном состоянии становится настолько мягкой и пластичной, что из нее без труда можно вить всевозможные шнуры и выгибать самые сложные элементы орнамента.
Кроме того, проволока из меди легко спаивается сканым серебряным припоем, хорошо серебрится и золотится. Эти свойства меди делают ее незаменимым материалом при производстве филигранных изделий.
Коэффициент линейного и объемного расширения меди при нагревании приблизительно такой же , как у горячих эмалей, в связи с чем при остывании эмаль хорошо держится на медном изделии, не трескается , не отскакивает. Благодаря этому мастера для производства эмалевых изделий предпочитают медь всем другим металлам.
Как и некоторые другие металлы, медь входит в число жизненно важных микроэлементов.
Она участвует в процессе фотосинтеза и усвоении растениями азота, способствует синтезу сахара, белков, крахмала, витаминов. Чаще всего медь вносят в почву в виде пятиводного сульфата — медного купороса CuSO4.5H2O.
В большом количестве он ядовит, как и многие другие соединения меди, особенно для низших организмов. В малых же дозах медь необходима всему живому.
Copper(II) nitrate — Wikipedia
Нитрат меди (II) , Cu ( NO 3 ) 2 , представляет собой неорганическое соединение, которое образует голубое кристаллическое твердое вещество .
Безводный нитрат меди образует темно-сине-зеленые кристаллы и сублимируется в вакууме при 150-200 ° C.
Нитрат меди также представлен в виде пяти различных гидратов , наиболее распространенными из которых являются гемипентагидрат и тригидрат.
Синтез и реакции нитрата меди
Водный раствор нитрата меди (II).
Гидратированный нитрат меди может быть получен путем гидратации безводного материала или путем обработки металлической меди с водным раствором из нитрата серебра или концентрированной азотной кислоты :
Cu + 4 HNO 3 → Cu (NO 3 ) 2 + 2 H 2 O + 2 NO 2
Безводная Cu (NO 3 ) 2 образуется при обработке металлической меди N 2 O 4 :
Cu + 2 N 2 O 4 → Cu (NO 3 ) 2 + 2 NO
При попытке обезвоживания любого из гидратированных нитратов меди (II) путем нагревания вместо этого образуются оксиды, а не Cu (NO 3 ) 2 .
При 80 ° C гидраты превращаются в «основной нитрат меди» (Cu 2 (NO 3 ) (OH) 3 ), который превращается в CuO при 180 ° C.
Используя эту реакционную способность, нитрат меди можно использовать для получения азотной кислоты , нагревая ее до разложения и пропуская пары непосредственно в воду. Этот метод аналогичен последнему этапу процесса Оствальда . Уравнения следующие:
2 Cu (NO 3 ) 2 → 2 CuO + 4 NO 2 + O 2
3НО 2 + Н 2 О → 2 ННО 3 + НЕТ
Природные основные нитраты меди включают редкие минералы герхардтит и руаит , оба из которых являются полиморфами вещества Cu 2 (NO 3 ) (OH) 3 . Гораздо более сложной, основной, гидратированной и содержащей хлориды природной солью является бутгенбахит .
Состав
Безводный нитрат меди (II)
Безводные меди нитрата (II) , была кристаллизует в двух сольватных -свободных полиморфах . α- и β-Cu (NO 3 ) 2 представляют собой полностью трехмерные координационные полимерные сети.
Альфа-форма имеет только одно окружение Cu с координацией [4 + 1], но бета-форма имеет два разных медных центра: один с [4 + 1] и один квадратно-плоский.
Сольват нитрометана также имеет «[4+ 1] координацию» с четырьмя короткими связями Cu-O приблизительно 200 мкм и одной более длинной связью при 240 мкм. Это координационные полимеры с бесконечными цепями центров меди (II) и нитратных групп.
В газовой фазе нитрат меди (II) содержит два бидентатных нитратных лиганда (см. Изображение вверху справа). Таким образом, испарение твердого вещества влечет за собой « растрескивание » с образованием молекулы нитрата меди (II).
Гидратированный нитрат меди (II)
Сообщалось о пяти гидратах : моногидрат (Cu (NO 3 ) 2 · H 2 O), полуторный гидрат (Cu (NO 3 ) 2 · 1,5H 2 O), гемипентагидрат (Cu (NO 3 ) 2 · 2,5H 2 O), тригидрат (Cu (NO 3 ) 2 · 3H 2 O) и гексагидрат ([Cu (H 2 O) 6 ] (NO 3 ) 2 ).
Гексагидрат интересен тем, что все расстояния Cu-O равны, не обнаруживая обычного эффекта ян-теллеровского искажения, который в остальном характерен для октаэдрических комплексов Cu (II).
Это отсутствие эффекта объясняется сильной водородной связью, которая ограничивает эластичность связей Cu-O.
Приложения
Нитрат меди (II) находит множество применений, главным из которых является его превращение в оксид меди (II) , который используется в качестве катализатора для множества процессов в органической химии .
Его растворы используются в текстиле и средствах для полировки других металлов. Нитраты меди содержатся в некоторых пиротехнических средствах . Его часто используют в школьных лабораториях для демонстрации химических реакций гальванических элементов .
Он входит в состав некоторых керамических глазурей и металлических патин.
Органический синтез
Нитрат меди в сочетании с уксусным ангидридом является эффективным реагентом для нитрования ароматических соединений, известного как нитрование Менке в честь голландского химика, который обнаружил, что нитраты металлов являются эффективными реагентами для нитрования.
Гидратированный нитрат меди, адсорбированный на глине, дает реагент под названием «Claycop». Полученная глина синего цвета используется в виде суспензии, например, для окисления тиолов до дисульфидов . Claycop также используется для преобразования дитиоацеталей в карбонилы.
Соответствующий реагент на основе монтмориллонита оказался полезным для нитрования ароматических соединений.
использованная литература
- ^ a b Справочник Perrys 'Chem Eng, 7-е изд.
-
^ a b c
Карманный справочник NIOSH по химической опасности. «# 0150» . Национальный институт охраны труда и здоровья (NIOSH). - ^ Пасс и Сатклифф (1968). Практическая неорганическая химия . Лондон: Чепмен и Холл.
- ^ a b c Х. Уэйн Ричардсон «Соединения меди» Энциклопедия промышленной химии Ульмана 2005, Wiley-VCH, Weinheim. DOI : 10.1002 / 14356007.a07_567 .
- ^ https://www.mindat.org/min-1680.html
- ^ http://www.mindat.org/min-10588.html
- ^ а б https://www.ima-mineralogy.org/Minlist.htm
- ^ https://www.mindat.org/min-811.html
- ^ Wallwork, SC; Аддисон, WE (1965). «Кристаллические структуры безводных нитратов и их комплексов. Часть I. α-форма нитрата меди (II)». J. Chem. Soc . 1965 : 2925–2933. DOI : 10.1039 / JR9650002925 .
- ^ а б Троянов С.И. Морозов И.В.; Знаменков, КО; Ю; Коренев, М. (1995). «Синтез и рентгеновская структура новых нитратов меди (II): Cu (NO 3 ) 2 · H 2 O и β-модификация Cu (NO 3 ) 2 ». Z. Anorg. Allg. Chem . 621 : 1261–1265. DOI : 10.1002 / zaac.19956210727 .
- ^ Даффин, B .; Wallwork, SC (1966). «Кристаллическая структура безводных нитратов и их комплексов. II. Нитрат-нитрометановый комплекс меди (II) 1: 1» . Acta Crystallographica . 20 (2): 210–213. DOI : 10.1107 / S0365110X66000434 .
- ^ ЛаВилла, RE; Бауэр, Ш. (1963). «Структура газообразного нитрата меди (II), определенная методом дифракции электронов». Варенье. Chem. Soc . 85 (22): 3597–3600. DOI : 10.1021 / ja00905a015 .
- ^ Dornberger-Schiff, K .; Leciejewicz, J. (1958). «Zur Struktur не дез Kupfernitrates Cu (NO 3 ) 2 . 1,5Н 2 О» . Acta Crystallogr . 11 (11): 825–826. DOI : 10.1107 / S0365110X58002322 .
- ^ Morosin, В. (1970). «Кристаллическая структура Cu (NO 3 ) 2 .2,5H 2 O». Acta Crystallogr . B26 (9): 1203–1208. DOI : 10.1107 / S0567740870003898 .
- ^ J. Гараж, сборник Prac. Chem.-Technol. Фак. Svst., Cskosl. 1966. С. 35–39.
- ^ Zibaseresht, R .; Хартсхорн, RM (2006). «Динитрат гексааквакоппера (II): отсутствие искажения Яна-Теллера». Acta Crystallogr . E62 : I19-I22. DOI : 10.1107 / S1600536805041851 .
- ^ Menke JB (1925). «Нитрация нитратами». Recueil des Travaux Chimiques des Pays-Bas . 44 : 141. DOI : 10.1002 / recl.19250440209 .
- ^ Балог, М. «Медь (II) Нитрат-K10 бентонитовой глины» в Энциклопедии Реагенты для органического синтеза (Ed: L. Paquette) 2004, J. Wiley & Sons, НьюЙорк. DOI : 10.1002 / 047084289X .
- Перейти ↑ Collet, Christine (1990). «Прямое ароматическое нитрование глин». Angewandte Chemie International Edition на английском языке . 29 (5): 535–536. DOI : 10.1002 / anie.199005351 .






