- Электронная конфигурация атома
- Правила заполнения электронных орбиталей и примеры
- Внешний уровень и валентные электроны
- Тренировка
- Провал электрона
- Основное и возбужденное состояние атома
- Общая характеристика элементов металлов — урок. Химия, 9 класс
- Свойства металлов
- Электрофизическое свойство металлов
- Металлическая связь
- Тест по теме "Металлы"
- Конспект урока для 9 класса "Металлы"
Мы приступаем к изучению химии — мира молекул и атомов. В этой статье мы рассмотрим базисные понятия и разберемся с электронными формулами элементов.
Атом (греч. а — отриц. частица + tomos — отдел, греч. atomos — неделимый) — электронейтральная частица вещества микроскопических размеров и массы, состоящая из положительно заряженного ядра (протонов) и отрицательно заряженных электронов (электронные орбитали).
Описываемая модель атома называется «планетарной» и была предложена в 1913 году великими физиками: Нильсом Бором и Эрнестом Резерфордом
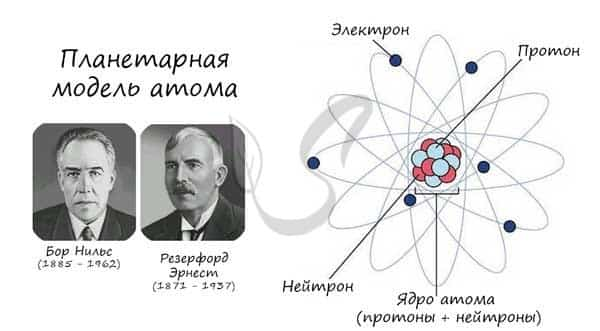
Протон (греч. protos — первый) — положительно заряженная (+1) элементарная частица, вместе с нейтронами образует ядра атомов элементов. Нейтрон (лат. neuter — ни тот, ни другой) — нейтральная (0) элементарная частица, присутствующая в ядрах всех химических элементов, кроме водорода.
Электрон (греч. elektron — янтарь) — стабильная элементарная частица с отрицательным электрическим зарядом (-1), заряд атома — порядковый номер в таблице Менделеева — равен числу электронов (и, соответственно, протонов).
Запомните, что в невозбужденном состоянии атом содержит одинаковое число электронов и протонов. Так у кальция (порядковый номер 20) в ядре находится 20 протонов, а вокруг ядра на электронных орбиталях 20 электронов.

Я еще раз подчеркну эту важную деталь. На данном этапе будет отлично, если вы запомните простое правило: порядковый номер элемента = числу электронов. Это наиболее важно для практического применения и изучения следующей темы.
Электронная конфигурация атома
Электроны атома находятся в непрерывном движении вокруг ядра. Энергия электронов отличается друг от друга, в соответствии с этим электроны занимают различные энергетические уровни.
Энергетические уровни подразделяются на несколько подуровней:
- Первый уровень
- Второй уровень
- Третий уровень
- Четвертый уровень
Состоит из s-подуровня: одной «1s» ячейки, в которой помещаются 2 электрона (заполненный электронами — 1s2)
Состоит из s-подуровня: одной «s» ячейки (2s2) и p-подуровня: трех «p» ячеек (2p6), на которых помещается 6 электронов
Состоит из s-подуровня: одной «s» ячейки (3s2), p-подуровня: трех «p» ячеек (3p6) и d-подуровня: пяти «d» ячеек (3d10), в которых помещается 10 электронов
Состоит из s-подуровня: одной «s» ячейки (4s2), p-подуровня: трех «p» ячеек (4p6), d-подуровня: пяти «d» ячеек (4d10) и f-подуровня: семи «f» ячеек (4f14), на которых помещается 14 электронов
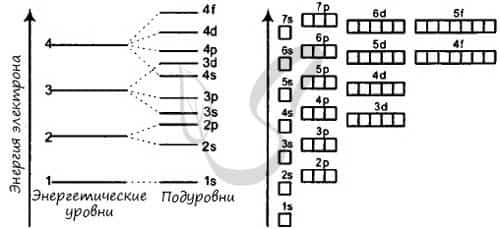
Зная теорию об энергетических уровнях и порядковый номер элемента из таблицы Менделеева, вы должны расположить определенное число электронов, начиная от уровня с наименьшей энергией и заканчивая к уровнем с наибольшей. Чуть ниже вы увидите несколько примеров, а также узнаете об исключении, которое только подтверждает данные правила.
Подуровни: «s», «p» и «d», которые мы только что обсудили, имеют в определенную конфигурацию в пространстве. По этим подуровням, или атомным орбиталям, движутся электроны, создавая определенный «рисунок».
S-орбиталь похожа на сферу, p-орбиталь напоминает песочные часы, d-орбиталь — клеверный лист.
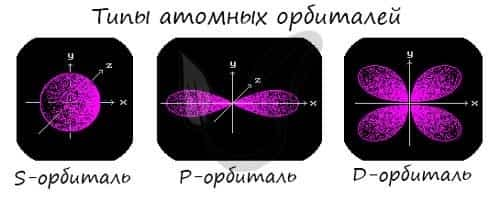
Правила заполнения электронных орбиталей и примеры
Существует ряд правил, которые применяют при составлении электронных конфигураций атомов:
- Сперва следует заполнить орбитали с наименьшей энергией, и только после переходить к энергетически более высоким
- На орбитали (в одной «ячейке») не может располагаться более двух электронов
- Орбитали заполняются электронами так: сначала в каждую ячейку помещают по одному электрону, после чего орбитали дополняются еще одним электроном с противоположным направлением
- Порядок заполнения орбиталей: 1s → 2s → 2p → 3s → 3p → 4s → 3d → 4p → 5s → 4d → 5p → 6s
Должно быть, вы обратили внимание на некоторое несоответствие: после 3p подуровня следует переход к 4s, хотя логично было бы заполнить до конца 4s подуровень. Однако природа распорядилась иначе. Запомните, что, только заполнив 4s подуровень двумя электронами, можно переходить к 3d подуровню.
Без практики теория мертва, так что приступает к тренировке. Нам нужно составить электронную конфигурацию атомов углерода и серы. Для начала определим их порядковый номер, который подскажет нам число их электронов. У углерода — 6, у серы — 16.
Теперь мы располагаем указанное количество электронов на энергетических уровнях, руководствуясь правилами заполнения.
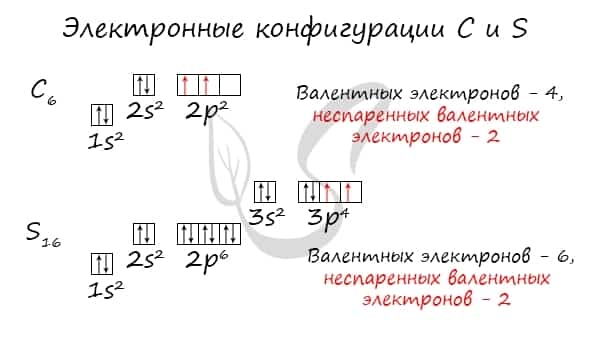
Обращаю ваше особе внимание: на 2p-подуровне углерода мы расположили 2 электрона в разные ячейки, следуя одному из правил. А на 3p-подуровне у серы электронов оказалось много, поэтому сначала мы расположили 3 электрона по отдельным ячейкам, а оставшимся одним электроном дополнили первую ячейку.
Таким образом, электронные конфигурации наших элементов:
- Углерод — 1s22s22p2
- Серы — 1s22s22p63s23p4
Внешний уровень и валентные электроны
Количество электронов на внешнем (валентном) уровне — это число электронов на наивысшем энергетическом уровне, которого достигает элемент. Такие электроны называются валентными: они могут быть спаренными или неспаренными. Иногда для наглядного представления конфигурацию внешнего уровня записывают отдельно:
- Углерод — 2s22p2 (4 валентных электрона)
- Сера -3s23p4 (6 валентных электронов)
Неспаренные валентные электроны способны к образованию химической связи. Их число соответствует количеству связей, которые данный атом может образовать с другими атомами. Таким образом неспаренные валентные электроны тесно связаны с валентностью — способностью атомов образовывать определенное число химических связей.
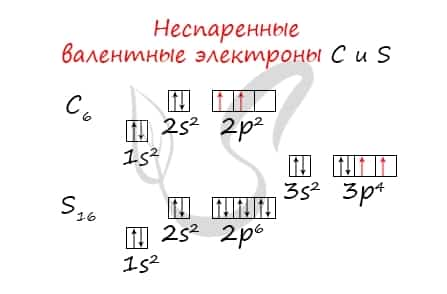
- Углерод — 2s22p2 (2 неспаренных валентных электрона)
- Сера -3s23p4 (2 неспаренных валентных электрона)
Тренировка
Потренируйтесь и сами составьте электронную конфигурацию для магния и скандия. Определите число электронов на внешнем (валентном) уровне и число неспаренных электронов. Ниже будет дано наглядное объяснение этой задаче.
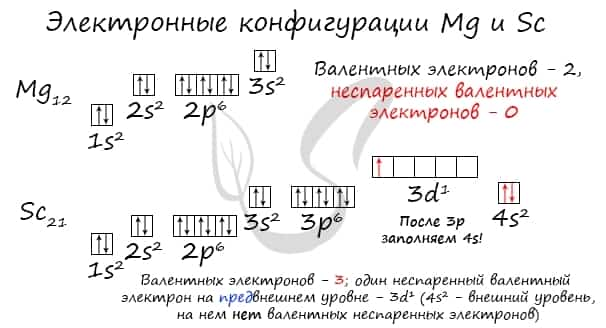
Запишем получившиеся электронные конфигурации магния и фтора:
- Магний — 1s22s22p63s2
- Скандий — 1s22s22p63s23p64s23d1
В целом несложная и интересная тема электронных конфигураций отягощена небольшим исключением — провалом электрона, которое только подтверждает общее правило: любая система стремится занять наименее энергозатратное состояние.
Провал электрона
Провалом электрона называют переход электрона с внешнего, более высокого энергетического уровня, на предвнешний, энергетически более низкий. Это связано с большей энергетической устойчивостью получающихся при этом электронных конфигураций.
Подобное явление характерно лишь для некоторых элементов: медь, хром, серебро, золото, молибден. Для примера выберем хром, и рассмотрим две электронных конфигурации: первую «неправильную» (сделаем вид, будто мы не знаем про провал электрона) и вторую правильную, написанную с учетом провала электрона.
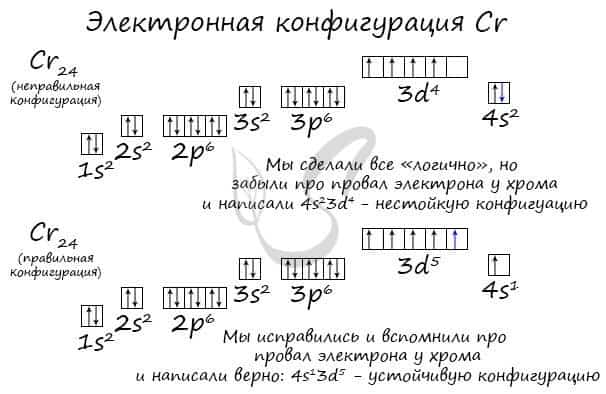
Теперь вы понимаете, что кроется под явлением провала электрона. Запишите электронные конфигурации хрома и меди самостоятельно еще раз и сверьте с представленными ниже.

Основное и возбужденное состояние атома
Основное и возбужденное состояние атома отражаются на электронных конфигурациях. Возбужденное состояние связано с движением электронов относительно атомных ядер. Говоря проще: при возбуждении пары электронов распариваются и занимают новые ячейки.
Возбужденное состояние является для атома нестабильным, поэтому долгое время в нем он пребывать не может. У некоторых атомов: азота, кислорода , фтора — возбужденное состояние невозможно, так как отсутствуют свободные орбитали («ячейки») — электронам некуда перескакивать, к тому же d-орбиталь у них отсутствует (они во втором периоде).
У серы возможно возбужденное состояние, так как она имеет свободную d-орбиталь, куда могут перескочить электроны. Четвертый энергетический уровень отсутствует, поэтому, минуя 4s-подуровень, заполняем распаренными электронами 3d-подуровень.
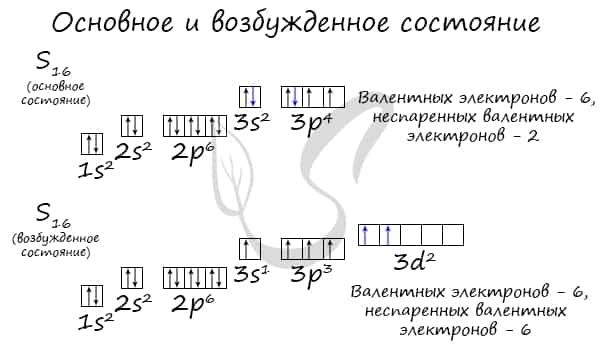
По мере изучения основ общей химии мы еще не раз вернемся к этой теме, однако хорошо, если вы уже сейчас запомните, что возбужденное состояние связано с распаривание электронных пар.
Общая характеристика элементов металлов — урок. Химия, 9 класс
Из (118) известных на данный момент химических элементов (96) образуют простые вещества с металлическими свойствами, поэтому их называют металлическими элементами.
Металлические химические элементы в природе могут встречаться как в виде простых веществ, так и в виде соединений. То, в каком виде встречаются металлические элементы в природе, зависит от химической активности образуемых ими металлов.
Ряд активности металлов
| (Li, K, Ba, Ca, Na, Mg) | (Al, Mn, Zn, Cr, Fe, Ni, Sn, Pb) | H2 | (Cu, Hg, Ag, Pt, Au) |
| активныеметаллы | металлы среднейактивности | неактивныеметаллы |
Металлические элементы, образующие химически активные металлы (Li–Mg), в природе чаще всего встречаются в виде солей (хлоридов, фторидов, сульфатов, фосфатов и других).
Соли, образуемые этими металлами, являются главной составной частью распространённых в земной коре минералов и горных пород.
 |
 |
 |
| Рис. (1). Сильвин — хлоридкалия KCl с примесями | Рис. (2). Галит состоитиз хлорида натрия NaCl | Рис. (3). Кальцитсостоит из карбонатакальция CaCO3 |
В растворённом виде соли натрия, кальция и магния содержатся в природных водах. Кроме того, соли активных металлов — важная составная часть живых организмов. Например, фосфат кальция Ca3(PO4)2 является главной минеральной составной частью костной ткани.
Металлические химические элементы, образующие металлы средней активности (Al–Pb), в природе чаще всего встречаются в виде оксидов и сульфидов.
 |
 |
 |
| Рис. (4). Минерал корунд состоит из оксидаалюминия Al2O3 | Рис. (5). Оксид железа((III)) Fe2O3образует минералгематит | Рис. (6). Минерал галенит cостоит из сульфидасвинца((II)) PbS |
Металлические элементы, образующие химически неактивные металлы (Cu–Au), в природе чаще всего встречаются в виде простых веществ.
 |
 |
|
| Рис. (7). Самородное золото Au | Рис. (8). Самородное серебро Ag | Рис. (9). Самородная платина Pt |
Исключение составляют медь и ртуть, которые в природе встречаются также в виде химических соединений.
 |
||
| Рис. (10). Минерал халькозин содержит сульфидмеди ((I)) Cu2S | Рис. (11). Гидроксокарбонатмеди((II)) (CuOH)2CO3малахит | Рис. (12). Минерал киноварьсодержит сульфидртути((II)) HgS |
Положение элементов металлов в Периодической системе, особенности строения и свойств их атомов
В Периодической системе химических элементов металлы занимают левый нижний угол и находятся в главных (А) и побочных (Б) группах.
Открыть таблицу в большом размере
Рис. (13). Положение металлов в Периодической системе. Знаки металлических химических элементов расположены ниже ломаной линии B — Si — As — Te
В электронной оболочке атомов металлов на внешнем энергетическом уровне, как правило, содержится от (1) до (3) электронов. Исключение составляют только металлы (IV)А, (V)А и (VI)А группы, у которых на наружном энергетическом уровне находятся соответственно четыре, пять или шесть электронов.
В атомах металлов главных подгрупп валентные электроны располагаются на внешнем энергетическом уровне, а у металлов побочных подгрупп — ещё и на предвнешнем энергетическом уровне.
Радиусы атомов металлов больше, чем у атомов неметаллов того же периода. В силу отдалённости положительно заряженного ядра атомы металлов слабо удерживают свои валентные электроны.
Рис. (14). Характер изменения радиусов атомов химических элементов в периодах и в группах. Радиусы атомов металлов существенно больше, чем радиусы атомов неметаллов, находящихся в том же периоде
Главное отличительное свойство металлов — это их сравнительно невысокая электроотрицательность (ЭО) по сравнению с неметаллами.
Рис. (15). Величины относительных электроотрицательностей (ОЭО) некоторых химических элементов (по Л. Полингу). ОЭО металлических химических элементов уступает соответствующей величине неметаллических химических элементов
Атомы металлов, вступая в химические реакции, способны только отдавать электроны, то есть окисляться, следовательно, в ходе превращений могут проявлять себя в качестве восстановителей.
Источники:
Рис. 1. Сильвин https://www.shutterstock.com/ru/image-photo/potassium-salt-on-white-background-lies-1589597632
Рис. 2. Галит https://image.shutterstock.com/image-photo/halite-salt-cubes-isolated-on-600w-499534720.jpg
Рис. 3. Кальцит https://cdn.pixabay.com/photo/2015/04/18/13/22/calcite-728720_960_720.jpg
Рис. 4. Минерал корунд https://image.shutterstock.com/image-photo/macro-photography-natural-mineral-geological-600w-1255553242.jpg
Рис. 5. Оксид железа https://www.shutterstock.com/ru/image-photo/heap-natural-iron-ore-isolated-on-131632697
Рис. 6. Галенит https://cdn.pixabay.com/photo/2014/05/04/18/16/galena-337703_960_720.jpgРис. 7. Самородное золото https://upload.wikimedia.org/wikipedia/commons/4/46/Stringer156_nugget.jpg
Рис. 8. Самородное серебро https://cdn.pixabay.com/photo/2019/08/28/20/06/silver-4437577_960_720.jpg
Рис. 9. Самородная платина https://www.shutterstock.com/ru/image-photo/natural-platinum-nugget-isolated-on-white-1524944957
Рис. 10. Минерал халькозин https://upload.wikimedia.org/wikipedia/commons/5/5f/Chalcocite.jpg
Рис. 11. Малахит https://upload.wikimedia.org/wikipedia/commons/thumb/e/ee/MoreMalachite.jpg/1024px-MoreMalachite.jpg
Рис. 12. Киноварь https://upload.wikimedia.org/wikipedia/commons/c/c7/Cinnabar.jpg
Рис. 13. Положение металлов в Периодической системе © ЯКласс
Рис. 14. Характер изменения радиусов атомов © ЯКласс
Рис. 15. Величины относительных электроотрицательностей © ЯКласс
Свойства металлов
Все чистые (с химической точки зрения) металлы — это простые вещества, состоящие из атомов одного химического элемента. В таблице Менделеева металлические свойства элементов возрастают справа налево. Все чистые металлы (как элементы) — являютя простыми веществами.
Сверхчистые металлы Кристаллический кремний — полупроводник Фотоэффект
Различают физические и химические свойства металлов. В общем случае, свойства металлов достаточно разнообразны.
Различают металлы щелочные, щелочноземельные, чёрные, цветные, лантаноиды (или редкоземельные — близкие по химическим свойствам к щелочноземельным), актиноиды (большинство из них — радиоактивные элементы), благородные и платиновые металлы. Кроме того, отдельные металлы проявляют как металлические, так и неметаллические свойства. Такие металлы — амфотерные (или как говорят — переходные).
Практически все металлы имеют некоторые общие свойства: металлический блеск, строение кристаллической решётки, способность в химических реакциях проявлять свойства восстановителя, при этом окисляясь. В химических реакциях ионы растворённых металлов при взаимодействии с кислотами образуют соли, при взаимодействии с водой (в зависимости от активности металла) образуют щёлочь или основание.
Почему блестят металлы
Свойства металлов
В узлах кристаллической решётки металлов содержатся атомы. Электроны, движущиеся вокруг атомов, образуют «электронный газ» который свободно может перемещаться в разных направлениях. Это свойство объясняет высокую электропроводность и теплопроводность металлов.
Электронный газ отражает почти все световые лучи. Именно поэтому металлы так сильно блестят и чаще всего имеют серый или белый цвет.
Связи между отдельными слоями металла невелики, что позволяет перемещать эти слои под нагрузкой в разных направлениях (по-другому — деформировать металл). Уникальным металлом является чистое золото.
С помощью ковки из чистого золота можно сделать фольгу толщиной 0,002 мм! такой тончайший листочек металла полупрозрачен и имеет зелёный оттенок если смотрень через него на солнечный свет.
Электрофизическое свойство металлов
Электрофизическое свойство металлов выражено в его электропроводности. Принято считать, что все металлы имеют высокую электропроводность, то есть хорошо проводят ток! Но это не так, да и к тому же, всё зависит от температуры, при которой замеряют ток.
Представим себе кристаллическую решётку металла, в которой ток передаётся с помощью движения электронов. Электроны движутся от одного узла кристаллическрой решётки к другому. Один электрон «выталкивает» из узла решётки другой электрон, который продолжает двигаться к другому узлу решётки и т.д.
То есть электропроводность также зависит от того, насколько легко электроны могут перемещаться между узлов решётки. Можно сказать, что электропроводность металла зависит от кристаллического строения решётки и плотности расположения в ней частиц. Частицы в узлах решётки имеют колебания, и эти колебания тем больше, чем выше температура металла.
Такие кролебания значительно препятствуют перемещению электронов в кристаллической решётке. Таким образом, чем ниже температура металла, тем выше его способность проводить ток!
Отсюда вытекает понятие сверхпроводимости, которое наступает в металле при температуре близкой к абсолютному нулю! При абсолютном нуле (-273 0C) колебания частиц в кристаллической решётке металла полностью затухают!
Электрофизическое свойство металлов, связанное с прохождением тока, называют температурным коэффициентом электросопротивления!
Электрофизическое свойство металлов
Электрофизическое свойство металлов
Установлен интересный факт, что, например у свинца (Pb) и ртути (Hg) при температуре, которая выше абсолютного нуля всего на несколько градусов, почти полностью исчезает электросопротивление, то есть наступает условие сверхпроводимости.
Самую высокую электропроводность имеет серебро (Ag), затем медь (Cu), далее идёт золото (Au) и алюминий (Al). С высокой электропроводностью этих металлов связано их использование в электротехнике. Иногда, для обеспечения химической стойкости и антикоррозионных свойств используют именно золото (позолоченные контакты).
Надо отметить, что электропроводность металлов значительно выше, чем электропроводность неметаллов. Вот например, углерод (С — графит) или кремний (Si) имеют электропроводность в 1000 раз меньше, чем, например, у ртути.
Кроме того, неметаллы, в своём большинстве не являются проводниками электричества.
Но среди неметаллов встречаются полупроводники: германий (Ge), кремний кристаллический, а также некоторые оксиды, фосфиты (химические соединения металла с фосфором) и сульфиды (химические соединения металла и серы).
Вам, наверное, знакомо явление фотоэффекта — это свойство металлов под действием температуры или света отдавать электроны.
Что касается теплопроводности металлов, то её можно оценить из таблицы Менделеева, — она распределяется точно также, как электроотрицательность металлов.
(Металлы, находящиеся слева вверху имеют наибольшую электроотрицательность, например, электроотрицательность натрия Na равна -2,76 В).
В вою очередь, теплопроводность металлов объясняется наличием свободных электронов, которые переносят тепловую энергию.
Металлическая связь
В результате электростатического притяжения между катионом и анионом образуется, молекула.
Ионная связь
Теорию ионной связи предложил в 1916г. немецкий ученый В. Коссель. Эта теория объясняет образование связей между атомами типичных металлов и атомамитипичных неметаллов:CsF, CsCl, NaCl, KF, KCl, Na2O и др.
Согласно этой теории, при образовании ионной связи атомы типичных металлов отдают электроны, а атомы типичных неметаллов принимают электроны.
В результате этих процессов атомы металлов превращаются в положительно заряженные частицы, которые называются положительными ионами или катионами; а атомы неметаллов превращаются в отрицательные ионы — анионы. Заряд катиона равен числу отданных электронов.
- Атомы металлов отдают электроны внешнего слоя, а образующиеся ионы имеют завершенные электронные структуры (предвнешнего электронного слоя).
- Величина отрицательного заряда аниона равна числу принятых электронов.
- Атомы неметаллов принимают такое количество электронов, какое им необходимо для завершения электронного октета (внешнего электронного слоя).
- Например: общая схема образования молекулы NaCl из атомов Na и С1: Na°-le = Na+1 Образование ионов
- Сl°+1е-= Сl-
- Na+1 + Сl-= Nа+Сl —
- Na°+ Сl°= Nа+Сl — Соединение ионов
- · Связь между ионами называется ионной связью.
- Соединения, которые состоят из ионов, называются ионными соединениями.
- Алгебраическая сумма зарядов всех ионов в молекуле ионного соединения должна быть равна нулю,потому что любая молекула является электронейтральной частицей.
Резкой границы между ионной и ковалентнои связями не существует. Ионную связь можно рассматривать как крайний случай полярной ковалентнои связи, при образовании которой общая электронная пара полностьюсмещается к атому с большей электроотрицательностью.
Атомы большинства типичных металлов на внешнем электронном слое имеют небольшое число электронов (как правило, от 1 до 3); эти электроны называются валентными.
В атомах металлов прочность связи валентных электронов с ядром невысокая, то есть атомы обладают низкой энергией ионизации.
Это обусловливает легкость потери валентных электронов ч превращения атомов металла в положительно заряженные ионы (катионы):
Ме° -nе ® Меn+
В кристаллической структуре металла валентные электроны обладают способностью легко перемещаться от одного атома к другому, что приводит к обобществлению электронов всеми соседними атомами.
Упрощенно строение кристалла металла представляется следующим образом: в узлах кристаллической решетки находятся ионы Меп+ и атомы Ме°, а между ними относительно свободно перемещаются валентные электроны, осуществляя связь между всеми атомами и ионами металла (рис. 3). Это особый тип химической связи, называемой металлической.
· Металлическая связь — связь между атомами и ионами металлов в кристаллической решетке, осуществляемая обобществленными валентными электронами.
Благодаря этому типу химической связи металлы обладают определенным комплексом физических и химических свойств, отличающим их от неметаллов.
Прочность металлической связи обеспечивает устойчивость кристаллической решетки и пластичность металлов (способность подвергаться разнообразной обработке без разрушения).
Свободное передвижение валентных электронов позволяет металлам хорошо проводить электрический ток и тепло. Способность отражать световые волны (т.е.
металлический блеск) также объясняется строением кристаллической решетки металла.
- Таким образом, наиболее характерными физическими свойствами металлов в зависимости от наличия металлической связи являются:
- ■кристаллическая структура;
- ■металлический блеск и непрозрачность;
- ■пластичность, ковкость, плавкость;
- ■высокие электро- и теплопроводность; и склонность к образованию сплавов.
Тест по теме "Металлы"
тест по теме «Металлы» применяется для определения качества знаний. вопросы репродуктивные.
Тест №4 Тема «Простые вещества – металлы»
Вариант 1.
-
ковалентная полярная; 2) ионная; 3) металлическая; 4) ковалентная неполярная.
-
Во внутреннем строении металлов имеются:
1) только катионы; 2) только анионы; 3) катионы и анионы; 4) катионы и нейтральные атомы.
-
Жидкий металл при комнатной температуре – это:
1) железо; 2) ртуть; 3) золото; 4) литий.
-
Золото алхимики считали символом:
1) Венеры; 2) Марса; 3) Солнца; 4) Сатурна.
-
Неправильное суждение, о том, что все металлы:
1) обладают ковкостью; 2) обладают металлическим блеском; 3) обладают электропроводностью; 4) летучие вещества.
1) натрий; 2) хром; 3) свинец; 4) литий.
-
Металл, обладающий наибольшей плотностью:
1) железо; 2) медь; 3) золото; 4) титан.
1) свинец; 2) серебро; 3) цинк; 4) железо.
-
Среди перечисленных веществ укажите те, которые являются металлами:
-
кремний; 2) бериллий; 3) бор; 4) алюминий; 5) калий; 6) аргон; 7) сера;
 олово.
олово.
- Ответ дайте в виде последовательности цифр в порядке их возрастания.
- Тест №4 Тема «Простые вещества – металлы»
- Вариант 2.
-
Металлы для завершения слоя:
- 1) отдают электроны; 2) принимают электроны; 3) отдают или принимают электроны; 4) у них слой завершённый.
- 2. Связь в металлах между катионами осуществляют:
- 1) свободные электроны; 2) анионы; 3) протоны; 4) нейтроны.
- 3. Самый пластичный из драгоценных металлов:
- 1) серебро; 2) платина; 3) золото; 4) ртуть.
-
Медь алхимики считали символом:
- 1) Венеры; 2) Марса; 3) Солнца; 4) Сатурна.
- 5. Наиболее мягкий металл:
- 1) хром; 2) титан; 3) молибден; 4) свинец.
- 6. Наиболее тугоплавкий металл:
- 1) вольфрам; 2) ртуть; 3) золото; 4) титан.
- 7. Металл, обладающий наименьшей плотностью:
- 1) натрий; 2) олово; 3) свинец; 4) железо.
- 8. Обладает наибольшей электропроводностью:
- 1) железо; 2) золото; 3) алюминий; 4) серебро.
- 9. Расставьте перечисленные металлы в порядке увеличения плотности:
- 1) медь; 2) железо; 3) свинец; 4) алюминий; 5) золото.
- Ответ дайте в виде последовательности цифр.
- Ответы. Тема «Простые вещества – металлы»
- 1 вариант.
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 |
| 1) | 2,4,5,8 | |||||||
| 2) | х | х | х | |||||
| 3) | х | х | х | |||||
| 4) | х | х |
2 вариант.
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 |
| 1) | х | х | х | х | х | 4,2,1,3,5 | ||
| 2) | ||||||||
| 3) | х | |||||||
| 4) | х | х |
- Нормы оценок:
- 1 вариант. 2 вариант
- «5» — 1-2 ошибки «5» — 1-2 ошибки
- «4» — 3-4 ошибки «4» — 3-4 ошибки
- «3» — 5-6 ошибок «3» — 5-7 ошибок
Конспект урока для 9 класса "Металлы"
- 9 класс.
- Тема: Металлы.
- Цель урока:
- – обобщить и систематизировать знания по теме;
- — формировать научное мировоззрение, развивать коммуникативные навыки
- — развивать эмоциональную сферу, мыслительные навыки.
- Тип урока: обобщающий
- Заранее выдаётся следующее домашнее задание по группам:
- Создать рекламу химического элемента, в которой вы должны доказать, что этот элемент:
- — необходимый человеческому организму;
- — необходимый в промышленном производстве;
- — распространён в природе, как и его соединения;
- Информация о химическом элементе должна опираться на строго научные факты. При оценке работы будут учитываться:
- — достоверность; научность; логичность; привлекательность; краткость(не более 2-3 минут).
- Дополнительно будет оцениваться рекламный плакат или рисунок о данном химическом элементе.
- Ход урока.
1. Приветствие. Очень рада вас видеть. Уверена, наше общение сегодня будет интересным, плодотворным!
2. Психологический настрой.
Зачем мы сегодня здесь собрались? Я хочу напомнить вам одну притчу, возможно, вы её знаете. Один мудрец встретил человека, который катил камень. Что ты делаешь? – спросил его мудрец. Я качу камень, — ответил ему человек.
Мудрец пошёл дальше и встретил ещё одного человека, который тоже катил камень. Что ты делаешь? – спросил и его мудрец. Я зарабатываю на хлеб, — ответил ему человек. А третий человек, которого встретил мудрец, сказал, что он строит храм.
А для чего мы собрались здесь сегодня? Провести время? Пообщаться со знакомыми? Узнать что-то новое и чему – то научиться?
Как ваше настроение? Оценим его хлопком – если грустное, то хлопайте тихо, если весёлое и энергичное – то громко.
Оценка эмоц .состояния
3. Актуализация знаний
…было открыто затем и железо и золото с медью, вскоре также ещё серебро и свинцовая сила…Тит Лукреций Кар. Всем знакомы эти строки из знаменитого сочинения «О природе вещей». Давайте поговорим сегодня о…? правильно, металлах. Я уверена, что знания каждого по этой теме разнообразны и глубоки, поэтому давайте поделимся сегодня ими друг с другом!
Какие ассоциации вызывает у вас слово металлы? Обсудите и запишите на листочках, а я на доске. Заслушаем. Какие знания о металлах отразились в наших ассоциациях?
4. Проверка знаний. 1. Тест по теме « Металлы»
Вариант 1.
-
ковалентная полярная; 2) ионная; 3) металлическая; 4) ковалентная неполярная.
-
Во внутреннем строении металлов имеются:
1) только катионы; 2) только анионы; 3) катионы и анионы; 4) катионы и нейтральные атомы.
-
Жидкий металл при комнатной температуре – это:
1) железо; 2) ртуть; 3) золото; 4) литий.
-
Золото алхимики считали символом:
1) Венеры; 2) Марса; 3) Солнца; 4) Сатурна.
-
Неправильное суждение, о том, что все металлы:
1) обладают ковкостью; 2) обладают металлическим блеском; 3) обладают электропроводностью; 4) летучие вещества.
1) натрий; 2) хром; 3) свинец; 4) литий.
-
Металл, обладающий наибольшей плотностью:
1) железо; 2) медь; 3) золото; 4) титан.
1) свинец; 2) серебро; 3) цинк; 4) железо.
-
Среди перечисленных веществ укажите те, которые являются металлами:
-
кремний; 2) бериллий; 3) бор; 4) алюминий; 5) калий; 6) аргон; 7) сера;
 олово.
олово.
Ответ дайте в виде последовательности цифр в порядке их возрастания.
Вариант 2.
-
Металлы для завершения слоя:
- 1) отдают электроны; 2) принимают электроны; 3) отдают или принимают электроны; 4) у них слой завершённый.
- 2. Связь в металлах между катионами осуществляют:
- 1) свободные электроны; 2) анионы; 3) протоны; 4) нейтроны.
- 3. Самый пластичный из драгоценных металлов:
- 1) серебро; 2) платина; 3) золото; 4) ртуть.
-
Медь алхимики считали символом:
- 1) Венеры; 2) Марса; 3) Солнца; 4) Сатурна.
- 5. Наиболее мягкий металл:
- 1) хром; 2) титан; 3) молибден; 4) свинец.
- 6. Наиболее тугоплавкий металл:
- 1) вольфрам; 2) ртуть; 3) золото; 4) титан.
- 7. Металл, обладающий наименьшей плотностью:
- 1) натрий; 2) олово; 3) свинец; 4) железо.
- 8. Обладает наибольшей электропроводностью:
- 1) железо; 2) золото; 3) алюминий; 4) серебро.
- 9. Расставьте перечисленные металлы в порядке увеличения плотности:
- 1) медь; 2) железо; 3) свинец; 4) алюминий; 5) золото.
- Ответ дайте в виде последовательности цифр.
2. Заслушиваем устно домашнее задание по группам.
Физминутка 1 м – игровая разминка «встать по пальцам». Она покажет нам, насколько мы с вами сработались, понимаем друг друга. Я поворачиваюсь спиной, показываю определённое число пальцев, быстро поворачиваюсь и смотрю – должно встать столько человек, сколько пальцев я показала. Её цель – мобилизация всех участников.
3.Синквейн.
- Прочитав или обсудив какой – либо предмет или явление, необходимо дать ему характеристику тремя фразами: первое должно содержать существительные, второе – прилагательные, третье – глаголы, характеризующие предмет обсуждения.
- Примерный синквейн.
- Натрий.
- Едкий, активный.
- Бегает, светит, сверкает.
- Образует соль жизни.
- Золото.
- Солнечный, благородный.
- Блестит, радует, возвышает.
- Это сила и власть.
- Алюминий.
- Лёгкий, прочный.
- Летает, варит, плавает.
- Самый распространённый и необходимый металл.
5.Подведение итогов. Выставление оценок. Оценка работы класса в целом.
6. Рефлексия. Что сегодня вам показалось самым интересным? Что удивило вас? Что понравилось в нашей работе и что не понравилось?
Спасибо за наше сотрудничество!






