Новости Библиотека Энциклопедия Биографии Ссылки Карта сайта О сайте
Когда ионы электролита доходят до электродов, соединенных с полюсами источника постоянного тока, то положительные ионы получают недостающие электроны от отрицательного электрода и в процессе реакции восстановления превращаются в нейтральные атомы (молекулы); отрицательные ионы отдают электроны положительному электроду и в процессе реакции окисления превращаются в нейтральные атомы.
Явление выделения вещества на электродах в процессе окислительно-восстановительной реакции при прохождении тока через электролит называется электролизом. Впервые электролиз наблюдал в 1803 г. в Петербурге — В. П. Петров. В 1833-1834 гг. английский физик М. Фарадей открыл законы электролиза, которые устанавливают, от чего и как зависит масса выделившегося при электролизе вещества.
Пропуская в течение одинаковых промежутков времени ток одной и той же силы через разные электролиты, Фарадей установил, что при этом на электродах выделяются различные количества вещества. Так, ток в 1 а за 1 сек из раствора азотнокислого серебра выделяет 1,118 мг серебра, из раствора медного купороса — 0,328 мг меди.
Значит, масса выделяемого вещества при электролизе зависит от вещества. Скалярная величина, измеряемая массой вещества, выделившегося при электролизе током в1 аза1 сек, называется электрохимическим эквивалентом (обозначается k). Электрохимический эквивалент имеет наименование кг/а*сек, или кг/к.
Если пропустить в течение времени t через раствор медного купороса небольшой ток, то катод слабо покрывается медью, а если ток большей силы — то за то же время на катоде выделится большее количество меди. Оставим силу тока той же, но увеличим теперь время. Замечаем, что меди выделяется еще больше.
Пропуская через разные электролиты различные токи и тщательно измеряя массу вещества, выделяющегося на электродах из каждого электролита, Фарадей открыл первый закон электролиза: масса вещества, выделившегося при электролизе на электродах, прямо пропорциональна произведению силы тока и времени его прохождения через электролит.
- Ток в 1 а за 1 сек при электролизе выделяет на электроде к кг вещества, а ток силой I а за время t сек — в It раз больше:
- m = klt, или m = kq.
- Это формулы первого закона Фарадея для электролиза.
Каждый ион несет с собой и определенную массу вещества и величину заряда, поэтому чем больше ионов подходит к электроду, т. е. чем сильнее ток в электролите, тем больше на электроде выделяется вещества.
Фарадей, пропуская один и тот же ток последовательно через несколько различных электролитов, заметил, что масса выделившегося на электродах вещества неодинакова, хотя сила тока и время его прохождения через различные электролиты были одними и теми же (рис. 109).
Точно взвесив выделившиеся вещества, Фарадей заметил, что вес их не случаен, а зависит от химической природы вещества. На каждый грамм выделенного водорода всегда получалось 107,9 г серебра; 31,8 г меди; 29,35 г никеля.
После введения химического эквивалента — отношения атомной массы (веса) к валентности — оказалось, что эти числа являются химическими эквивалентами данных веществ. Так как атомная масса А и валентность n — числа отвлеченные, то и отношение число отвлеченное.
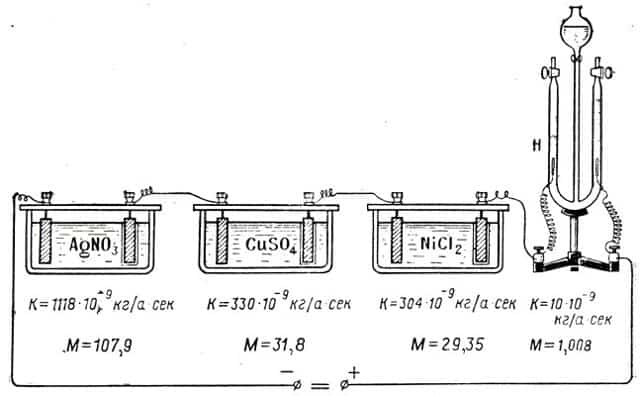 Рис. 109. Ко второму закону Фарадея для электролиза
Рис. 109. Ко второму закону Фарадея для электролиза
Разделив электрохимические эквиваленты веществ на их химические эквиваленты, (k/M), получим:
т. е. одно и то же число 1036*10-11кг/а*сек или 1036*10-11кг/к. Обозначив это постоянное число буквой С, запишем: C = 1036*10-11кг/а*сек. Следовательно, Отсюда электрохимический эквивалент
- k = СМ.
- Это формула второго закона Фарадея для электролиза, который читается так: электрохимические эквиваленты веществ прямо пропорциональны их химическим эквивалентам.
- Заменив электрохимический эквивалент в формуле первого закона Фарадея, получим формулу обобщенного закона Фарадея для электролиза:
или
Массы выделившихся при электролизе веществ прямо пропорциональны их атомным весам и заряду, прошедшему через электролит, и обратно пропорциональны валентности вещества.
Законы Фарадея являются следствием ионной проводимости тока в электролите. Поясним это на таких примерах. Допустим, что производился электролиз одновалентных веществ, например растворов NaCl и AgNO3. Величины зарядов ионов Na и Ag одинаковы.
Когда ионы переносят равные по величине заряды, как в том, так и в другом растворе к соответствующим электродам подойдет одинаковое количество ионов. Но при равном числе подошедших ионов массы отложившихся веществ Na и Ag будут не одинаковы, так как различны массы самих атомов Na и Ag.
У натрия атомная масса 22,997; у серебра — 107,88; поэтому серебра выделится почти в пять раз больше. Значит, количество вещества, выделившегося при электролизе, прямо пропорционально его атомной массе, что и утверждается законом Фарадея.
В случае, когда в электролизе участвуют ионы разной валентности, например Аl, имеющий валентность, равную 3, и Na с валентностью, равной 1, количество ионов Аl и Na, переносящих один и тот же заряд, будет различно. Чем больше валентность иона, т. е.
чем больше его заряд, тем меньшее количество ионов потребуется для переноса данного заряда (например, ионов Аl надо в три раза меньше, чем ионов Na).
Такой зависимостью между валентностью и зарядом иона и объясняется то, что масса выделившегося при электролизе вещества обратно пропорциональна его валентности.
Благодаря простоте, дешевизне и большой чистоте полученных продуктов электролиз получил широкое применение в промышленности для добывания алюминия из бокситовых руд, очистки металлов (например, меди, цинка, золота, серебра) от примесей, покрытия металлических предметов слоем другого металла с целью предохранения их от ржавчины, придания твердости их поверхности (никелирование, хромирование), для изготовления украшений (серебрение, золочение), получения металлических копий с рельефных предметов (например, при изготовлении патефонных пластинок, матриц, клише).
Задача 30. Свинец высокой чистоты, применяемый в атомной энергетике, получают электрорафинированием. Вычислить массу свинца, выделенную за 1 ч током плотностью 0,02 а/см2 и напряжением 0,5 в. Выход по току 95%. Каков расход электроэнергии на выделение 1 кг свинца? Площадь общего сечения катодов, на которых отлагается свинец, 10 м2.
При к п. д. электролитической ванны 100% за счет всей израсходованной электроэнергии A = UIt выделилось бы свинца m = klt, поэтому на выделение 1 кг свинца израсходовано энергии или
Вычислим
Отв.: М≈7,5 кг; А1 ≈ 470 кдж/кг.
Электролиз
Электролиз (греч. elektron — янтарь + lysis — разложение) — химическая реакция, происходящая при прохождении постоянного тока через электролит. Это разложение веществ на их составные части под действием электрического тока.
Процесс электролиза заключается в перемещении катионов (положительно заряженных ионов) к катоду (заряжен отрицательно), и отрицательно заряженных ионов (анионов) к аноду (заряжен положительно).
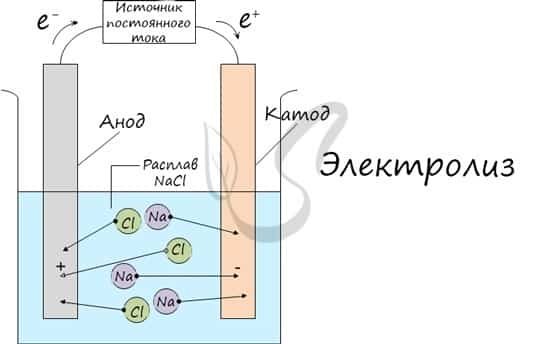
Итак, анионы и катионы устремляются соответственно к аноду и катоду. Здесь и происходит химическая реакция. Чтобы успешно решать задания по этой теме и писать реакции, необходимо разделять процессы на катоде и аноде. Именно так и будет построена эта статья.
Катод
К катоду притягиваются катионы — положительно заряженные ионы: Na+, K+, Cu2+, Fe3+, Ag+ и т.д.
Чтобы установить, какая реакция идет на катоде, прежде всего, нужно определиться с активностью металла: его положением в электрохимическом ряду напряжений металлов.
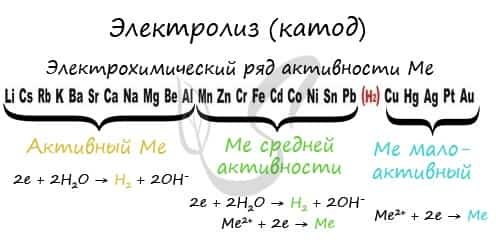
Если на катоде появился активный металл (Li, Na, K) то вместо него восстанавливаются молекулы воды, из которых выделяется водород. Если металл средней активности (Cr, Fe, Cd) — на катоде выделяется и водород, и сам металл. Малоактивные металлы выделяются на катоде в чистом виде (Cu, Ag).
Замечу, что границей между металлами активными и средней активности в ряду напряжений считается алюминий. При электролизе на катоде металлы до алюминия (включительно!) не восстанавливаются, вместо них восстанавливаются молекулы воды — выделяется водород.
В случае, если на катод поступают ионы водорода — H+ (например при электролизе кислот HCl, H2SO4) восстанавливается водород из молекул кислоты: 2H+ — 2e = H2
Анод
К аноду притягиваются анионы — отрицательно заряженные ионы: SO42-, PO43-, Cl-, Br-, I-, F-, S2-, CH3COO-.
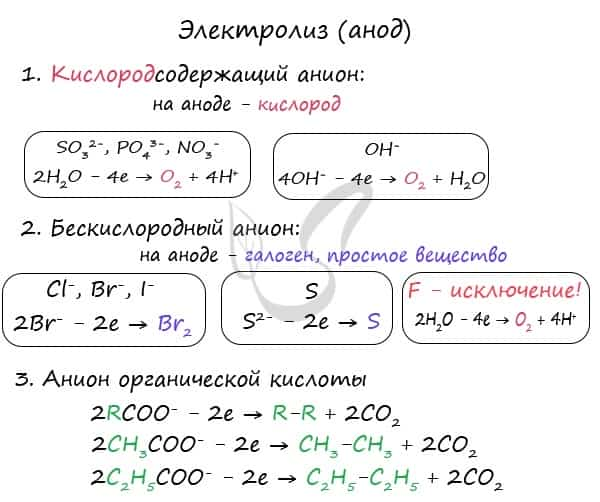
При электролизе кислородсодержащих анионов: SO42-, PO43- — на аноде окисляются не анионы, а молекулы воды, из которых выделяется кислород.
Бескислородные анионы окисляются и выделяют соответствующие галогены. Сульфид-ион при оксилении окислении серу. Исключением является фтор — если он попадает анод, то разряжается молекула воды и выделяется кислород. Фтор — самый электроотрицательный элемент, поэтому и является исключением.
Анионы органических кислот окисляются особым образом: радикал, примыкающий к карбоксильной группе, удваивается, а сама карбоксильная группа (COO) превращается в углекислый газ — CO2.
Примеры решения
В процессе тренировки вам могут попадаться металлы, которые пропущены в ряду активности. На этапе обучения вы можете пользоваться расширенным рядом активности металлов.

Теперь вы точно будете знать, что выделяется на катоде ?
Итак, потренируемся. Выясним, что образуется на катоде и аноде при электролизе растворов AgCl, Cu(NO3)2, AlBr3, NaF, FeI2, CH3COOLi.
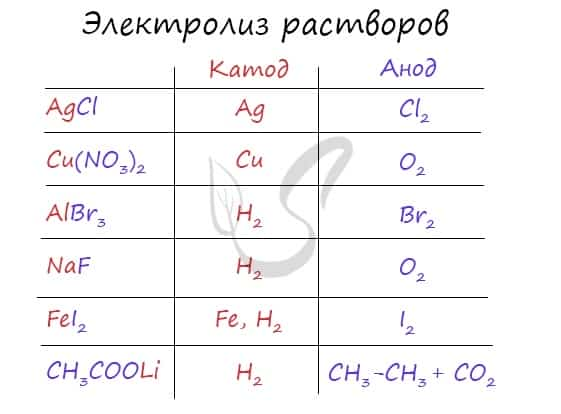
Иногда в заданиях требуется записать реакцию электролиза. Сообщаю: если вы понимаете, что образуется на катоде, а что на аноде, то написать реакцию не составляет никакого труда. Возьмем, например, электролиз NaCl и запишем реакцию:
NaCl + H2O → H2 + Cl2 + NaOH (обычно в продуктах оставляют именно запись «NaOH», не подвергая его дальнейшему электролизу)
Натрий — активный металл, поэтому на катоде выделяется водород. Анион не содержит кислорода, выделяется галоген — хлор. Мы пишем уравнение, так что не можем заставить натрий испариться бесследно ? Натрий вступает в реакцию с водой, образуется NaOH.
Запишем реакцию электролиза для CuSO4:
CuSO4 + H2O → Cu + O2 + H2SO4
Медь относится к малоактивным металлам, поэтому сама в чистом виде выделяется на катоде. Анион кислородсодержащий, поэтому в реакции выделяется кислород. Сульфат-ион никуда не исчезает, он соединяется с водородом воды и превращается в серую кислоту.
Электролиз расплавов
Все, что мы обсуждали до этого момента, касалось электролиза растворов, где растворителем является вода.
Перед промышленной химией стоит важная задача — получить металлы (вещества) в чистом виде. Малоактивные металлы (Ag, Cu) можно легко получать методом электролиза растворов.
Но как быть с активными металлами: Na, K, Li? Ведь при электролизе их растворов они не выделяются на катоде в чистом виде, вместо них восстанавливаются молекулы воды и выделяется водород. Тут нам как раз пригодятся расплавы, которые не содержат воды.
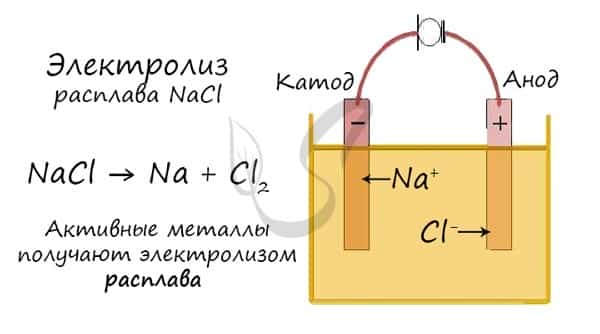
- В безводных расплавах реакции записываются еще проще: вещества распадаются на составные части:
- AlCl3 → Al + Cl2
- LiBr → Li + Br2
Электролиз
Химические реакции, сопровождающиеся переносом электронов (окислительно-восстановительные реакции) делятся на два типа: реакции, протекающие самопроизвольно и реакции, протекающие при прохождении тока через раствор или расплав электролита.
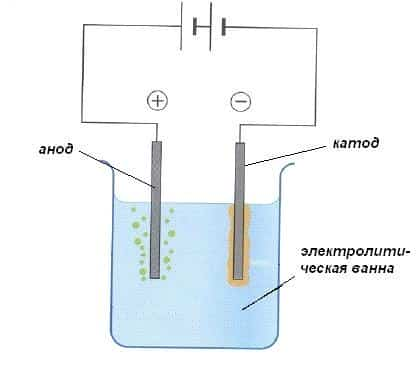
Раствор или расплав электролита помещают в специальную емкость — электролитическую ванну.
Электрический ток — это упорядоченное движение заряженных частиц — ионов, электронов и др. под действием внешнего электрического поля. Электрическое поле в растворе или расплаве электролита создают электроды.
Электроды — это, как правило, стержни из материала, проводящего электрический ток. Их помещают в раствор или расплав электролита, и подключают к электрической цепи с источником питания.
При этом отрицательно заряженный электрод катод — притягивает положительно заряженные ионы — катионы. Положительно заряженный электрод (анод) притягивает отрицательно заряженные частицы (анионы). Катод выступает в качестве восстановителя, а анод — в качестве окислителя.
Различают электролиз с активными и инертными электродами. Активные (растворимые) электроды подвергаются химическим превращениям в процессе электролиза.
Обычно их изготавливают из меди, никеля и других металлов. Инертные (нерастворимые) электроды химическим превращениям не подвергаются.
Их изготавливают из неактивных металлов, например, платины, или графита.
Электролиз растворов
Различают электролиз раствора или расплава химического вещества. В растворе присутствует дополнительное химическое вещество — вода, которая может принимать участие в окислительно-восстановительных реакциях.
Катодные процессы
В растворе солей катод притягивает катионы металлов. Катионы металлов могут выступать в качестве окислителей. Окислительные способности ионов металлов различаются. Для оценки окислительно-восстановительных способностей металлов применяют электро-химический ряд напряжений:

Каждый металл характеризуется значением электрохимического потен-циала.
Чем меньше потенциал, тем больше восстановительные свойства металла и тем меньше окислительные свойства соответствующего иона этого металла.
Разным ионам соответствуют разные значения этого потенциала. Электрохимический потенциал — относительная величина. Электрохимический потенциал водорода принят равным нулю.
Также около катода находятся молекулы воды Н2О. В составе воды есть окислитель — ион H+.
При электролизе растворов солей на катоде наблюдаются следующие закономерности:
1.
Если металл в соли — активный (до Al3+ включительно в ряду напряжений), то вместо металла на катоде восстанавливается (разряжается) водород, т.к. потенциал водорода намного больше. Протекает процесс восстановления молекулярного водорода из воды, при этом образуются ионы OH—, среда возле катода — щелочная:
- 2H2O +2ē → H2 + 2OH—
- Например, при электролизе раствора хлорида натрия на катоде будет вос-станавливаться только водород из воды.
- 2. Если металл в соли – средней активности (между Al3+ и Н+), то на катоде восстанавливается (разряжается) и металл, и водород, так как потенциал таких металлов сравним с потенциалом водорода:
- Men+ + nē → Me0
- 2H+2O +2ē → H20 + 2OH—
- Например, при электролизе раствора сульфата железа (II) на катоде будет восстанавливаться (разряжаться) и железо, и водород:
- Fe2+ + 2ē → Fe0
- 2H+2O +2ē → H20 + 2OH—
- 3. Если металл в соли — неактивный (после водорода в ряду стандартных электрохимических металлов), то ион такого металла является более сильным окислителем, чем ион водорода, и на катоде восстанавливается только металл:
- Men+ + nē → Me0
- Например, при электролизе раствора сульфата меди (II) на катоде будет восстанавливаться медь:
- Cu2+ + 2ē → Cu0
- 4. Если на катод попадают катионы водорода H+, то они и восстанавливаются до молекулярного водорода:
- 2H+ + 2ē → H20
Анодные процессы
Положительно заряженный анод притягивает анионы и молекулы воды. Анод – окислитель. В качестве восстановителей выступаю либо анионы кислотных остаток, либо молекулы воды (за счет кислорода в степени окисления -2: H2O-2).
- При электролизе растворов солей на аноде наблюдаются следующие закономерности:
- 1. Если на анод попадает бескислородный кислотный остаток, то он окисляется до свободного состояния (до степени окисления 0):
- неМеn- – nē = неМе0
- Например: при электролизе раствора хлорида натрия на аноде окисляют-ся хлорид-ионы:
- 2Cl— – 2ē = Cl20
Действительно, если вспомнить Периодический закон: при увеличении электроотрицательности неметалла его восстановительные свойства уменьшаются. А кислород – второй по величине электроотрицательности элемент.
Таким образом, проще окислить практически любой неметалл, а не кислород. Правда, есть одно исключение. Наверное, вы уже догадались. Конечно же, это фтор. Ведь электроотрицательность фтора больше, чем у кислорода.
Таким образом, при электролизе растворов фторидов окисляться будут именно молекулы воды, а не фторид-ионы:
- 2H2O-2 – 4ē → O20+ 4H+
- 2. Если на анод попадает кислородсодержащий кислотный остаток, либо фторид-ион, то окислению подвергается вода с выделением молекулярно-го кислорода:
- 2H2O-2 – 4ē → O20 + 4H+
- 3. Если на анод попадает гидроксид-ион, то он окисляется и происходит выделение молекулярного кислорода:
- 4O-2H– – 4ē → O20 + 2H2O
4. При электролизе растворов солей карбоновых кислот окислению под-вергается атом углерода карбоксильной группы, выделяется углекислый газ и соответствующий алкан.
Например, при электролизе растворов ацетатов выделяется углекислый газ и этан:
2CH3C+3OO– –2ē → 2C+4O2+ CH3-CH3
Суммарные процессы электролиза
- Рассмотрим электролиз растворов различных солей.
- Например, электролиз раствора сульфата меди.
На катоде восстанавливаются ионы меди:
- Катод (–): Cu2+ + 2ē → Cu0
- На аноде окисляются молекулы воды:
- Анод (+): 2H2O-2 – 4ē → O2 + 4H+
- Сульфат-ионы в процессе не участвуют.
Мы их запишем в итоговом уравнении с ионами водорода в виде серной кислоты:
- 2Cu2+SO4 + 2H2O-2 → 2Cu0 + 2H2SO4 + O20
- Электролиз раствора хлорида натрия выглядит так:
- На катоде восстанавливается водород:
- Катод (–): 2H+2O +2ē → H20 + 2OH–
- На аноде окисляются хлорид-ионы:
- Анод (+): 2Cl– – 2ē → Cl20
- Ионы натрия в процессе электролиза не участвуют. Мы записываем их с гидроксид-анионами в суммарном уравнении электролиза раствора хлорида натрия:
- 2H+2O +2NaCl– → H20 + 2NaOH + Cl20
- Следующий пример: электролиз водного раствора карбоната калия.
- На катоде восстанавливается водород из воды:
- Катод (–): 2H+2O +2ē → H20 + 2OH–
- На аноде окисляются молекулы воды до молекулярного кислорода:
- Анод (+): 2H2O-2 – 4ē → O20 + 4H+
- Таким образом, при электролизе раствора карбоната калия ионы калия и карбонат-ионы в процессе не участвуют. Происходит электролиз воды:
- 2H2+O-2 → 2H20 + O20
- Еще один пример: электролиз водного раствора хлорида меди (II).
- На катоде восстанавливается медь:
- Катод (–): Cu2+ + 2ē → Cu0
- На аноде окисляются хлорид-ионы до молекулярного хлора:
- Анод (+): 2Cl– – 2ē → Cl20
- Таким образом, при электролизе раствора карбоната калия происходит электролиз воды:
- Cu2+Cl2– → Cu0 + Cl20
- Еще несколько примеров: электролиз раствора гидроксида натрия.
- На катоде восстанавливается водород из воды:
- Катод (–): 2H+2O +2ē → H20 + 2OH–
- На аноде окисляются гидроксид-ионы до молекулярного кислорода:
- Анод (+): 4O-2H– – 4ē → O20 + 2H2O
- Таким образом, при электролизе раствора гидроксида натрия происходит разложение воды, катионы натрия в процессе не участвуют:
- 2H2+O-2 → 2H20 + O20
Электролиз расплавов
При электролизе расплава на аноде окисляются анионы кислотных остатков, а на катоде восстанавливаются катионы металлов. Молекул воды в системе нет.
- Например: электролиз расплава хлорида натрия. На катоде восстанавливаются катионы натрия:
- Катод (–): Na+ + ē → Na0
- На аноде окисляются анионы хлора:
- Анод (+): 2Cl– – 2ē → Cl20
- Суммарное уравнение электролиза расплава хлорида натрия:
- 2Na+Cl– → 2Na0 + Cl20
- Еще один пример: электролиз расплава гидроксида натрия. На катоде восстанавливаются катионы натрия:
- Катод (–): Na+ + ē → Na0
- На аноде окисляются гидроксид-ионы:
- Анод (+): 4OH– – 4ē → O20 + 2H2O
- Суммарное уравнение электролиза расплава гидроксида натрия:
- 4Na+OH– → 4Na0 + O20 + 2H2O
- Многие металлы получают в промышленности электролизом расплавов.
Например, алюминий получают электролизом раствора оксида алюминия в расплаве криолита. Криолит – Na3[AlF6] плавится при более низкой температуре (1100оС), чем оксид алюминия (2050оС). А оксид алюминия отлично растворяется в расплавленном криолите.
- В растворе криолите оксид алюминия диссоциирует на ионы:
- Al2O3 = Al3+ + AlO33-
- На катоде восстанавливаются катионы алюминия:
- Катод (–): Al3+ + 3ē → Al0
- На аноде окисляются алюминат-ионы:
- Анод (+): 4AlO33– – 12ē → 2Al2O3 + 3O20
- Общее уравнение электролиза раствора оксида алюминия в расплаве криолита:
- 2Al2О3 = 4Al0 + 3О20
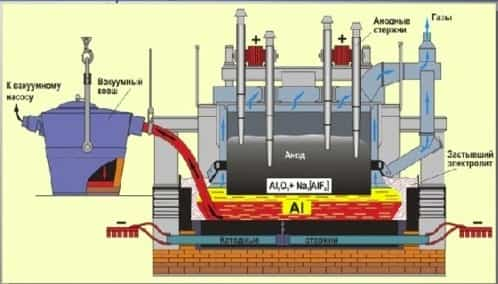
- В промышленности при электролизе оксида алюминия в качестве электродов используют графитовые стержни. При этом электроды частично окисляются (сгорают) в выделяющемся кислороде:
- C0 + О20 = C+4O2-2
Электролиз с растворимыми электродами
- Если материал электродов выполнен из того же металла, который присутствует в растворе в виде соли, или из более активного металла, то на аноде разряжаются не молекулы воды или анионы, а окисляются частицы самого металла в составе электрода.
- Например, рассмотрим электролиз раствора сульфата меди (II) с медными электродами.
- На катоде разряжаются ионы меди из раствора:
- Катод (–): Cu2+ + 2ē → Cu0
- На аноде окисляются частицы меди из электрода:
- Анод (+): Cu – 2ē → Cu2+
- Тренировочные тесты в формате ЕГЭ по теме «Электролиз» (задание 20 ЕГЭ по химии) ( с ответами)
ПОИСК
Здесь q — электрохимический эквивалент, г/(А-ч) А — атомный вес Р — постоянная Фарадея п — валентность. [c.9]
Степень окисления.
Это понятие введено для характеристики состояния атома в молекуле, его синонимы — окислительное число, электрохимическая валентность, состояние окисления, степень окисленности.
Степень окисления отдельных атомов, образующих молекулу, получается, если заряды атомов распределяются так, что их валентные электроны оказываются принадлежащими более электроотрицательному из них.
Иначе, степень окисления атома в молекуле есть электрический заряд, который мог бы возникнуть на атоме, если бы электронные пары, связывающие его с другими атомами, были смещены к более электроотрицательным атомам, а электронные пары, принадлежащие одинаковым атомам, были между ними поделены пополам. [c.80]
Рассмотрим такие электроды, реакции на которых не связаны с выделением из электролита или растворением в нем простых веществ (металлов, элементар[(ых газов). Обязательные для электрохимических реакций получение или отдача электродами электронов, конечно, происходят в элементах и этого типа, но эти процессы связаны с изменением валентности иоиов в растворе. [c.553]
Возможность подразделения процесса растворения металлов в электролитах на два сопряженных процесса — анодный и катодный — облегчает в большинстве случаев его протекание по сравнению с химическим взаимодействием.
При электрохимическом взаимодействии окислитель играет лишь роль деполяризатора, отнимающего валентные электроны металла и обеспечивающего переход металла в ионное состояние, но не вступает с ним при этом в химическое соединение [вторичные процессы и продукты коррозии при электрохимическом механизме коррозии металлов могут иметь место (см. с. 212), но они не обязательны]. [c.181]
Катодные стимуляторы — это вещества, увеличивающие скорость катодного процесса электрохимической коррозии металлов. Катодными стимуляторами являются ионы металлов с переменной валентностью (например, Рез Ре , Си » Си ). [c.351]
Разъясним некоторые общие свойства электрохимических систем, которые будут важны для дальнейшего рассмотрения.
Прежде всего заметим, что в отсутствие разностей электрического потенциала для раствора электролита сохраняется условие электронейтральности. Если обозначить числа молей ионов через л,.
, их (положительные или отрицательные) валентности через 2 , то получим [c.240]
Количество вещества, выделившегося на электроде при прохождении 1 Кл электричества, называется его электрохимическим эквивалентом. По величине электрохимический эквивалент (5) равен атомной (молекулярной) массе элемента (вещества) (Л), деленной на его валентность (п) и постоянную Фарадея [c.151]
Электрохимическое восстановление ионов металлов высших валентностей и окисление низших [c.32]
Устойчивыми валентностями в водных растворах являются Мп2+, Мп +, /последний в виде комплексного аниона. Значения стандартных потенциалов отдельных электрохимических реакций приведены ниже [c.503]
Неравенство химических потенциалов служит причиной перераспределения ионов.
Начинается переход ионов 1 из раствора на поверхность кристаллов Agi, где они будут химически взаимодействовать с ионами Ag+ за счет сил остаточных валентностей и достраивать кристаллическую решетку.
Перенос ионов прекратится по достижении равенства электрохимических потенциалов в жидкой и твердой фазах [c.344]
Далее осадок следует перенести в заранее прокаленный и взвешенный тигель (очень удобен пористый керамический). Тщательно продумайте эту операцию, от нее в значительной мере зависит результат работы.
Можно осадок перенести на беззольный бумажный фильтр (обычная воронка или воронка Бюхнера) и затем вместе с фильтром прокалить при температуре красного каления в никелевом или керамическом тигле.
По известным массам исходной меди и ее оксида (формула ) рассчитайте мольную массу эквивалента меди. Определите валентность меди (например, из приближенного значения атомной массы, полученного по теплоемкости, см. ниже) и вычислите точно атомную массу меди.
Найдите относительную ошибку (погрешность) эксперимента. Определите мольную массу эквивалента меди электрохимическим методом (электролизом) и сравните результаты. [c.114]
Таким образом, химическая активность различных металлов разная. Она определяется способностью атомов металла отдавать валентные электроны. По своей активности все металлы располагаются в определенной последовательности, образуя электрохимический ряд напряжений металлов (см. гл. V, 11). [c.260]
Термин степень окисления имеет синонимы — окислительное число, электрохимическая валентность, состояние окисления, степень окисленности. [c.56]
Олефины с длиннон цепью окисляли смесью бихромата натрия и серной кяслоты в высшие кис — оты при этом происходило восстановление шести-валентного хрома в сз льфат трехвплентього — Сг2(504)з, который затем окисляли электрохимически в бихромат. В данном случае процесс окисления также М0Ж1(0 рассматривать как электрохимический. [c.164]
Щелочные металлы — наиболее типичные представители металлов. Металлические свойства выражены у них наиболее резко. Атомы их слабо удерживают свой единственный валентный электрон.
Поэтому они легко окисляются, будучи в то же время энергичными восстановителями. Они расположены в начале электрохимического ряда встречаются в природе только в виде химических соединений.
Не могут быть восстановлены из этих [c.399]
При электролизе некоторого соединения олова найдено, что электрохимический эквивалент металла равен 0,616 мг/а-ч. Чему равна валентность олова в данном соединении При электролизе другого соединения того же металла электрохимический эквивалент оказался, равен 1,108 г/а-ч. Чему равна валентность олова в этом соединении. Атомный вес Sn 118,69. [c.164]
Уровень электрохимического потенциала электронов у полупроводников и диэлектриков находится в запрещенной зоне, и его возможные перемещения ограничены уровнями валентной зоны и зоны проводимости. [c.83]
Отсюда следует, что коэффициент рекомбинации К существенно зависит от энергетического расположения ловушек в запрещенной зоне (рис. 37).
Максимальные зна-чения К наблюдаются в том случае когда энергетический уровень ловушек —Е находится около середины запрещенной зоны, т. е. вблизи уровня электрохимического потенциала.
Наоборот, приближение уровня ловушек к зоне проводимости или к валентной зоне способствует уменьшению скорости генерации — рекомбинации. [c.143]
Если электрохимический акт ограничивает скорость всего электродного процесса, то наблюдающееся смещение потенциала под током называется часто либо перенапряокением замедленного разряда (замедленной ионизации), либо, особенно в последнее время, перенапряжением переноса заряда.
Однако сущность собственно электрохимической стадии не сводится только к изменению валентного состояния частиц (акты разряда и ионизации) или только к переносу заряда через границу раздела электрод — электролит. Приобретение (или потеря) частицей электрона ириводит одновременно к изменению ее физико-химического и энергетического состояния.
Так, например, в ходе реакции [c.345]
В этом комплексе частицы Н и Н+, располагаясь симметрично относительно оси связи между молекуло воды и металлом (Н2О—М), образуют молекулярный ион Н2+, связанный одновременно с поверхностью металла и с молекулой воды. Связь с металлом обеспечивается за счет валентного электрона, связь с молекулой воды — за счет результативного положительного заряда иона.
Переходный комплекс может появиться и без предварительного акта разряда и образования адсорбированного атома водорода. Для этого необходимо, чтобы один из двух ближайших адсорбированных понов водорода приобрел электрон.
Электрохимическая десорбция, по Гориучи, таким образом, не обязательно должна проходить через разряд гидроксониевого иона на поверхности металла, уже частично покрытой атомами водорода. [c.407]
Для металла, дающего ионы разной валентности, например Си и Сц2+, можно найти потенциалы pi[ i]+,aq Си] и фи[Си2+, aq u], а также потенциал фш[Си2+, Си+, aq u]. Связь между величинами этих потенциалов может быть найдена путем умножения их на —zF, в результате чего получнм изменения изобарного потенциала для соответствующих электрохимических процессов [c.585]
Отсюда следует, что при рассмотрении процесса генерации — рекомбинации в примесном полупроводнике запрещенную зону можно условно разделить на три области среднюю область и две области, одна из которых прилегает к валентной зоне, а другая — к зоне проводимости (рис. 38).
Ширина последних двух областей одинакова и равна расстоянию между уровнем электрохимического потенциала электронов [Хэ и ближайшей к нему зоны (проводимости или валентной).
Если энергетический уровень ловушек находится в средней из выделенных областей, то коэффициент рекомбинации имеет максимальное значание и не зависит от положения этого уровня.
Когда уровень ловушек находится в одной из крайних областей, коэффициент рекомбинации существенно зависит от положения уровня —При этом, так же как и у собственного полупроводника, скорость процесса уменьшается, по мере приближения уровня —к любой из основных зон (см. рис. 38). [c.144]
Определением эффективной валентности анодно растворяющегося индия в растворах H IO4 с добавками Na2 104 электрохимическими и радиохимическими методами и измерениями с помощью индикаторного электрода В. В. Лосевым с сотрудниками было доказано, что анодное растворение индия протекает стадийно с образованием в качестве промежуточного продукта ионов одновалентного индия [c.229]
При возникновении атодной поляризации -2Ре +. [c.126]
Выход по току на катоде в данных условиях и при данной поляризации будет зависеть от скорости электрохимических реакций разряда ионов цинка, разряда ионов водорода и реакций в0сстан01вления ионов высших валентностей до низших (РеЗ+- Ре2+ и др.). [c.437]
Уравнение (VI, 46) свидетельствует, что после установления электрохимического равновесия между металлом и раствором его катионов в растворе всегда должны прео бладать те катионы, потенциал образования которых менее положителен. Равновесная концентрация катионов другой валентности уже при разности цотенциалов (вольта становится, как легко подсчитать, исчезающе малой. [c.167]
Приведенное выше деление металлов на группы с большой и малой поляризацией верно лишь в первом приближении, так как характер поляризации зависит не только от природы металла, но и от свойств и природы электролита (валентность, комплексность ионов и т. п.) и условий, сопровождающих процесс электрокристаллизации. Весьма сильно на течение электрохимических реакций влияет адсорбция поверхностно активных веществ, приводящая к-изменению значения -фрпотенциала. [c.332]
Разберем теперь вопрос об энергетическом положении уровня электрохимического потенциала электронов по отношению к уровням валентной зоны и зоны проводимоеги. Согласно сказанному в 3, значение электрохимического потенциала электронов может быть определено по следующей формуле [c.81]






