- Лабораторная работа № 4
- Номенклатура солей:
- Химические свойства
- Химические свойства солей и способы их получения
- 1.7. Соли
- Соли их классификация, химические свойства и способы получения (Таблица)
- Схема классификации солей по составу
- Таблица классификации солей (пояснения к схеме)
- Таблица способы получения солей
- Химические свойства солей (таблица)
- Химические свойства солей — реакции, определение и примеры
- Классификация и номенклатура солей
- Кислые соли
- Средние соли
- Основные соли
- Двойные соли
- Смешанные соли
- Комплексные соли
- Гидратные соли
- Получение солей
- Получение средних солей
- Получение кислых солей
- Получение основных солей
- Получение двойных солей
- Химические свойства солей
- Химические свойства средних солей
- Соль, свойства и все характеристики
- Получение солей
- Химические свойства солей
- Применение солей
- Примеры решения задач


Средняя оценка: 4.6
Всего получено оценок: 942.
Средняя оценка: 4.6
Всего получено оценок: 942.
Сложные неорганические соединения, образованные металлами и кислотными остатками, называются солями. Химические свойства солей позволяют получать различные соединения.
Общая формула солей –
где М – металл, Ac – кислотный остаток, n и m – количество атомов металла и кислотного остатка соответственно.
По составу и образованию соли делятся на шесть видов:
- средние (нормальные) – образуются путём полного замещения водорода в кислоте атомами металла или гидроксильной группы в основании кислотными остатками (Na3PO4 образован из H3PO4, CuSO4 – из Cu(OH)2, AlCl3 – из HCl);
- кислые – образуются при неполном замещении водорода в кислотах атомами металла (NaHSO4 образован при присоединении Na к H2SO4, Na2HPO4 – из H3PO4);
- основные – образуются при неполном замещении гидроксильных групп кислотными остатками (CaOHCl образован из Ca(OH)2, FeOHCl2 – из Fe(OH)3);
- двойные – состоят из двух металлов и одного кислотного остатка (КNaSO4);
- смешанные – состоят из одного металла и нескольких кислотных остатков (CaClBr);
- комплексные – состоят из комплексного аниона или катиона ([Cu(NH3)4]SO4).
Рис. 1. Разные соли.
Наиболее активными являются кислые соли, включающие водород. Химические свойства кислых солей сходны со свойствами кислот. Они взаимодействуют с металлами, их оксидами и гидроксидами, другими солями, щелочами.
Соли – это кристаллические вещества разных цветов.
Основные физические свойства солей:
- ионная кристаллическая решётка;
- высокие температуры плавления;
- в твёрдом состоянии плохо проводят электричество;
- по растворимости выделяют растворимые, малорастворимые и нерастворимые соли.
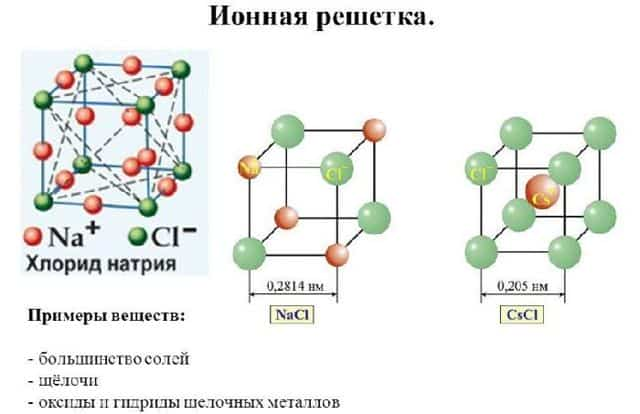 Рис. 2. Ионная кристаллическая решётка.
Рис. 2. Ионная кристаллическая решётка.
Некоторые соли имеют ковалентное или промежуточное, образованное ионными и ковалентными связями, строение.
Соли образуются из кислот и оснований. Реакции кислоты с различными веществами:
- с активными металлами –
- с основными оксидами –
2HCl + CaO → CaCl2 + H2O; - со щелочами –
- с солями (выделяется газ или выпадает осадок) –
Лабораторная работа № 4
- 4. СОЛИ
- Соли– это сложные вещества, образованные
атомами металлов и кислотными остатками. - С точки зрения теории электролитической диссоциации
соли — это электролиты, диссоциирующие в водных
растворах на катионы металлов и анионы кислотных остатков. - Соли
бывают средние (нормальные), кислые и основные.
Средние соли– это
продукты полного замещения водорода в кислоте на атомы металла или гидроксогруппы ОН- в
основании на кислотный остаток. Например: имеем серную кислоту H2SO4.
Средние соли этой кислоты будут иметь состав Na2SO4, CaSO4, Al2(SO4)3.
Средние соли ортофосфорной кислоты H3PO4:
К3PO4, Ca3(PO4)2,
AlPO4.
Средние
соли в водных растворах диссоциируют всегда в одну
ступень:
NaCI ® Na+ + CI —
Al2(SO4)3 ® 2AI3+ + 3SO42-.
Кислые соли можно
рассматривать как продукты неполного замещения атомов водорода кислоты на атомы
металлов. Кислые соли могут быть образованы только от многоосновных кислот.
Хлороводородная кислота HCl кислых солей не имеет.
Серная кислота H2SO4
образует кислые соли в состав которых входит анион HSO4-: NaHSO4, Cu(HSO4)2,
Fe(HSO4)3.
Фосфорная кислота Н3РО4 имеет два типа кислых солей: с
анионами Н2РО4-, НРО42-.
- Кислые
соли диссоциируют ступенчато: - KH2PO4 ® K+ + H2PO4-,
- H2PO4- H+
+ HPO42-, - HPO42- H+
+ PO43-, - Кислые
соли чаще всего образуются в избытке кислоты: - Mg(OH)2 + 2H2SO4 Mg(HSO4)2 + 2H2O.
-
кислая соль - Mg(OH)2 + H2SO4 MgSO4
+ 2H2O -
средняя соль
Основные соли можно
рассматривать как продукты неполного замещения ионов ОН-
основания на ионы кислотных остатков. Они могут быть образованы только многокислотными основаниями. Гидроксиды
щелочных металлов основных солей не имеют.
- Гидроксиду меди Сu(ОН)2
соответствуют основные соли с катионом СuОН+: CuOHNO3, (CuOH)2SO4, (CuOH)3PO4. - Гидроксид хрома (III) Cr(ОН)3 образует два ряда
основных солей с катионами Cr(ОН)2+,
CrОН2+: - Cr(OH)2CI,
- CrOHCI2,
- (Cr(OH)2)2SO4,
- CrOHSO4,
- (Cr(OH)2)3PO4,
- (CrOH)3(PO4)2.
- Основные
соли диссоциируют ступенчато: - CuOHNO3 ® CuOH+ + NO3-
(первая ступень), - CuOH+ Cu2+ + OH-
(вторая ступень). - Основные
соли образуются в избытке основания: - 2Cu(OH)2 + H2SO4 (CuOH)2SO4 + 2H2O
-
основная соль - Cu(OH)2 + H2SO4 CuSO4 + 2H2O
-
средняя соль
Номенклатура солей:
1. Средние соли бескислородных кислот.
Название
данных солей образуется следующим образом.
В начале называется
анион, названия одноатомных анионов образуются из корней латинских названий
соответствующих элементов с суффиксом «ид» (Cl — –
хлорид, F — –
фторид, S2- –
сульфид), затем называется катион. Одноатомные катионы обозначаются русским
названием элемента в родительном падеже. Если элемент имеет переменную
валентность, то она указывается в названии. Например:
- NaCl –
хлорид натрия; - Са3Р2
– фосфид кальция; - FeS –
сульфид железа (II); - Fe2S3 –
сульфид железа (III).
2. Средние соли
кислородсодержащих кислот.
- Названия
анионов кислородосодержащих кислот составляются из корня латинского названия
элемента, образующего кислоту, с добавлением суффиксов: «ат»
(когда кислотообразующий элемент проявляет высшую степень окисления): -
+6
+5 - (SO4)2-
– сульфат, (NO3)-
– нитрат; - «ит» (когда кислотообразующий
элемент проявляет низшую степень окисления): -
+4
+3 - (SO3)2-
– сульфит, (NO2)-
– нитрит. - Название
катионов описано выше. -
+6 - Na2SO4 –
сульфат натрия; -
+5 - К3
РО4 – фосфат калия; - +2
+5 - Cu(NO3)2
— нитрат меди (II); - +1
+5 - CuNO3 —
нитрат меди (I); -
+4 - CaSO3 —
сульфит кальция; -
+3 - AI(NO2)3
—
нитрит алюминия; -
+2 - Fe(NO2)2
—
нитрит железа (II).
Если
данный кислотообразующий элемент образует кислоты более, чем в двух степенях
окисления, то суффикс «ат» применяется
во всех названиях атомов кислот, русские названия которых содержат суффиксы «оватая», «овая» и «ная». При этом к
названию аниона, в котором кислотообразующий элемент имеет высшую степень окисления добавляется приставка «пер». Так, анион хлорноватой
кислоты:
- +5
- ClО3-
– называется хлорат-ион, а анион хлорной кислоты: - +7
- ClО4- – перхлорат-ион.
В
названиях анионов кислот, русские названия которых содержат суффиксы «оватистая» и «истая», используется суффикс «ит». К названию же аниона, в котором кислотообразующий
элемент имеет низшую степень окисления, добавляется приставка «гипо». Так, анион хлористой кислоты ClO2- – называется хлорит-ион, а
хлорноватистый ClO-– гипохлорит-ион.
| Кислородосодержащие кислоты хлора | |
| HСlO – хлорноватистая кислота | KСlO – гипохлорит калия |
| HСlO2 – хлористая кислота | KСlO2 – хлорит калия |
| HClO3 – хлорноватая кислота | KСlO3 – хлорат калия |
| HClO4 – хлорная кислота | KClO4 – перхлорат калия |
- Если
в названии кислоты используются приставки «мета», «орто» и другие, то и в названии соли они сохраняются:
НРО3 – метафосфорная кислота, КРО3 – метафосфат калия, - H3PO4 — ортофосфорная кислота, K3PO4 — ортофосфат
калия. - В
названиях анионов кислых солей с одним атомом водорода содержится
приставка «гидро» (от латинского названия
водорода Hydrogenium –
гидрогениум). Если же в кислотном остатке несколько атомов водорода, то в
названии кислой соли сохраняется приставка «гидро»,
но с греческим числительным, показывающим число атомов водорода в анионе: - NaHSO4 –
гидросульфат натрия; - Са(НСО3)2
– гидрокарбонат кальция; - FeНРО4 – гидрофосфат
железа (II); - КН2РО4
– дигидрофосфат калия; - Fe(Н2РО4)3
– дигидрофосфат железа (Ш).
В
состав катионов основных солей входят катион соответствующего металла и
группа ОН-, которой дано сложное название,
состоящее из корня латинского названия водорода «гидро»
и слова «оксид»: гидроксид – ион, или гидроксо – «группа». Причем в названиях сдвоенные буквы «О»
превращаются в одну. Число ОН- – групп в
сложном катионе указывается греческим числительным:
- ZnOHCl –
хлорид гидроксоцинка; - FeOHSO4 –
сульфат гидроксожелеза (III); - [Al(OH)2]2SO4 –
сульфат дигидроксоалюминия; - SnOHNO3 – нитрат гидроксоолова
(II). - При составлении
формул придерживаются следующих правил: - по
суффиксу в названии средней соли определяют
какой кислоты соль: бескислородной или
кислородсодержащей. - Например:
1.
Хлорид натрия: «ид» показывает, что это соль бескислородной
кислоты с анионом Cl-. Катионом является Na+.
Записываем сначала катион, затем анион Na+Cl-. Катион и анион однозарядны,
индексы не используются.
2.
Сульфид алюминия: Al3+S2-
истинная формула Al2S3,
молекула электронейтральна.
3.
Сульфат железа (III): «ат» показывает, что это соль кислородсодержащей
кислоты, в которой сера в максимальной степени окисления. Это анион SO42-.
Катион железа – Fe3+.
Записываем сначала катион и анион, а затем индексы, выравнивающие число
положительных и отрицательных зарядов: Fe3+(SO4)2-
— истинная формула Fe2(SO4)3.
По названию кислой соли определяют, какой
кислоты соль (бескислородной или кислородсодержащей)
и сколько атомов водорода входит в состав сложного атома. Далее поступают как
при составлении формул средних солей.
Например:
1.
Гидросульфид железа (III).
Соль бескислородной сероводородной кислоты. Анион
содержит один атом водорода НS- ,
катион Fe2+.
Записываем катион, сложный анион и индексы: Fe2+(HS)-, следовательно формула
будет Fe(HS)2.
2. Дигидрофосфат кальция. Соль кислородсодержащей фос-форной кислоты. Сложный анион
содержит два («ди») атома водорода, катион Са2+. Записываем Са2+(Н2РО4)-.
Ставим индексы: Са(Н2РО4)2. Молекула электронейтральна.
По названию основной соли определяют, какой
кислоты данная соль и сколько гидроксогрупп входит в
состав сложного катиона. Записывают сложный катион, затем анион и индексы,
уравнивающие заряды. Если металл имеет переменную валентность, то она
указывается в названии соли. Например:
- 1. Хлорид
гидроксотитана (IV), - (ТiОН)3+Cl — –
правильная формула TiOHCl3. - 2. Нитрат
дигидроксокобальта (III) - (Сo(OH)2)+NO3- –
правильная формула Сo(OH)2NO3. - Классификация солей по следующим признакам:
- 1. По растворимости:
- рстворимые–KCI, Ba(NO3)2,
CuSO4, - нерастворимые–BaSO4, AgCI, Ca3(PO4)2.
- 2.По свойствам:
- cредние или
нормальные– Na2SO4, MgCI2, - кислые
– KHSO4, Ca(H2PO4)2, - основные
– CuOHCI, AI(OH)2NO3. - Получение
- 1.
Взаимодействие металла с неметаллом: - Fe + S FeS.
- 2.
Взаимодействие металлов, расположенных в ряду напряжений левее водорода, с растворами
кислот: - Zn + H2SO4 ZnSO4 + H2
- 3.
Взаимодействие металлов с растворами солей: - Fe + CuSO4 FeSO4 + Cu.
- 4.
Взаимодействие кислот с основаниями (реакция нейтрализации): - HCI + NaOH NaCI + H2O.
- 5.
Взаимодействие кислот с основными оксидами: - H2SO4 + CaO CaSO4 + H2O.
- 6.
Взаимодействие кислот с растворами солей: - H2SO4 + BaCI2 BaSO4 +
2HCI. - 7.
Взаимодействие оснований с растворами солей: - 2NaOH + CuSO4 Cu(OH)2 +
Na2SO4. - 8.
Взаимодействие оснований с кислотными оксидами: - Ca(OH)2 + CO2 CaCO3 +
H2O. - 9.
Взаимодействие основных оксидов с кислотами: - CaO + CO2 CaCO3
- 10.
Взаимодействие растворов солей с неметаллами: - 2KBr + CI2 2KCI + Br2.
- 11.
Взаимодействие растворов солей между собой: - NaCI + AgNO3 AgCI +
NaNO3. - 12.
Получение солей аммония: - NH3 + HCI NH4CI.
Химические свойства
- 1.
Растворы солей взаимодействуют с металлами, расположенными в ряду напряжений левее,
чем металл, входящий в состав соли: - Zn + FeSO4 ZnSO4 + Fe.
- 2.Растворимые
в воде соли взаимодействуют с основаниями: - CuSO4 + 2NaOH Cu(OH)2 +
Na2SO4, - KHSO4 + KOH K2SO4 + H2O.
- 3.
Соли взаимодействуют с растворами кислот:
- CaCI2 + H2SO4 CaSO4 +
2HCI, - Ca(HCO3)2 + 2HCI CaCI2
+ H2O + CO2 - MgOHCI + HCI MgCI2 + H2O.
- 4.Водные
растворы солей взаимодействуют между собой с образованием новых солей: - BaCI2 + Na2SO4 BaSO4 +
2NaCI, - Ca(HCO3)2 + Na2CO3
CaCO3 +
2NaHCO3. - 5.
Растворы солей взаимодействуют с неметаллами:
- 2NaI + Br2 2NaBr + I2
- 6.
Многие соли при нагревании разлагаются, особенно - легко – карбонаты:
- CaCO3 CaO + CO2
- (CuOH)2CO3
CuO + CO2 +
H2O, - 2NaHCO3 Na2CO3 +
CO2 +
H2O. - 7.
Некоторые соли взаимодействуют с водой с образованием кристаллогидратов:
CuSO4 + 5H2O ® CuSO4 . 5 Н2О.
белый
цвет
голубой
цвет
Основные
классы неорганических соединений связаны между собой. Генетической связью между
ними считают тот факт, что из неорганических соединений одного класса можно
получить соединение другого класса. Иногда это можно сделать в одну стадию,
иногда – в несколько:
Химические свойства солей и способы
их получения
Цель работы:ознакомиться
с химическими свойствами солей и способами их получения. Освоить работу с
аппаратом Киппа.
Посуда и реактивы:аппарат
Киппа, пробирки, микрошпатель,
спиртовка, фильтровальная бумага, фарфоровая чашка. Растворы
сульфата меди, серной кислоты, иодида калия, нитрата серебра, хлорида никеля,
кобальта, бария, щелочи, гидроксида кальция, порошок
серы, железные опилки, кусочки цинка.
Ход
работы:
Опыт
№ 1. Взаимодействие металла с неметаллом
В пробирку поместить один микрошпатель железных опилок и один микрошпатель
порошка серы. Тщательно перемешать и подогреть на спиртовке, зажав пробирку в
держателе.
Убедитесь, что реакция сопровождается выделением большого количества
тепла, соблюдая правила техники безопасности. Пробирку охладить и содержимое ее
перенести на лист фильтровальной бумаги.
Полученное вещество однородно и имеет
черный цвет. Написать уравнение реакции и назвать полученную соль.
Опыт
№ 2. Взаимодействие металла с кислотой
В
пробирку налить 2–3 см3 разбавленной серной кислоты и бросить
кусочек цинка. Наблюдается бурная реакция с выделением пузырьков газа
(водорода) и образованием соли, в чем можно убедиться, выпарив несколько капель
содержимого пробирки в фарфоровой чашке. Написать уравнение реакции. Уравнять
методом электронного баланса.
Опыт
№ 3. Взаимодействие металла с раствором соли
В
голубой раствор сульфата меди (II)
опустить 2–3 кусочка гранулированного цинка, нагреть жидкость до кипения и
перемешивать ее до обесцвечивания. Наблюдать выделение красного металла.
Написать уравнение реакции, сделать выводы.
Опыт
№ 4. Взаимодействие неметалла с раствором соли
Внести
в пробирку 3–4 см3 раствора иодида калия и прилить несколько капель
хлорной воды. Выпадает черный осадок мелкодисперсного иода. Написать уравнение реакции и указать, какая соль
образовалась.
Опыт
№ 5. Взаимодействие соли с кислотой
Смешать
в пробирке немного раствора нитрата серебра с разбавленной соляной кислотой.
Наблюдается выделение белого творожистого осадка. Эта реакция является
качественной на катион серебра Ag+ и
анион СI — .Написать уравнения реакций.
Опыт
№ 6. Взаимодействие соли с основанием
В две
пробирки налить небольшое количество хлоридов никеля (II) и кобальта (II). Добавить в обе пробирки 5–6 капель
раствора гидроксида натрия. Отметить цвет выпавших
осадков и указать, какие соли при этом образовались. Написать уравнения
реакций.
- Опыт
№ 7. Взаимодействие солей между собой - К
раствору хлорида бария в пробирке прилить раствор сульфата калия. -
К раствору нитрата бария прилить раствор сульфата магния. -
В обоих случаях наблюдается выпадение белого осадка. Эта реакция является
качественной на катион Ba2+ и
анион SO42 - Какая соль выпадает в осадок и какие соли образуются в
растворе в первом и во втором случае? - Опыт
№ 8. Образование кислой соли
Налить
в пробирку 3–4 см3 известкового молока Ca(OH)2 и пропустить в раствор
оксид углерода (IV) из
аппарата Киппа. Наблюдать выпадение осадка средней
соли, затем продолжить пропускать углекислый газ до растворения осадка. Растворение
осадка объясняется образованием кислой соли (растворимость ее больше, чем
средней) Ca(HCO3)2.
Написать уравнения реакций.
Опыт
№ 9. Образование основной соли
В две
пробирки внести по 6–8 капель разбавленного раствора сульфата меди (II). В одну пробирку быстро добавить
избыток раствора щелочи. Наблюдать образование ярко-голубого осадка гидроксида меди (II).
В
другую пробирку разбавленный раствор щелочи прибавлять по каплям. В этом случае
образуется светло-голубой осадок основной соли (CuOH)2SO4. Написать
уравнение реакций и назвать образовавшиеся соли в обеих пробирках.
1.7. Соли
Соли принято делить на три группы: средние, кислые и основные.
Кислые и основные соли
Кислые соли представляют собой продукт неполного замещения кислот и оснований. По международной номенклатуре атом водорода, входящий в состав кислой соли, обозначается приставкой гидро-, а группа `»OH»^-` – приставкой гидрокси, например: `»NaHS»` – гидросульфид натрия, `»NaHSO»_4` – гидросульфат натрия, `»Mg(OH)Cl»` – гидроксихлорид магния, `»Al(OH)»_2″Cl»` – дигидроксихлорид алюминия.
Существуют также некоторые другие типы солей, например, двойные соли, в которых содержатся два разных катиона и один анион:
`»CaCO»_3*»MgCO»_3` (доломит), `»KCl»*»NaCl»` (сильвинит), `»KAl(SO»_4)_2` — алюмокалиевые квасцы, или смешанные соли, в которых содержится один катион и два разных аниона: `»CaOCl»_2` или `»Ca(OCl)Cl»`.
Соли представляют собой ионные соединения, и их названия строятся по названиям катионов и анионов. Для солей бескислородных кислот к названию неметалла добавляется суффикс -ид, например, хлорид натрия `»NaCl»`.
При наименовании солей кислородсодержащих кислот к латинскому корню названия элемента добавляется окончание -ат для высшей степеней окисления, -ит для более низких (для некоторых кислот используется приставка гипо- для низких степеней окисления неметалла; для солей хлорной и марганцовой кислот используется приставка пер-):
| `»CaCO»_3` — карбонат натрия | `»КClO»` — гипохлорит калия |
| `»FeSO»_3` — сульфит железа (II) | `»KClO»_2` — хлорит калия |
| `»KMnO»_4` — перманганат калия | `»KClO»_3` — хлорат калия |
| `»KNO»_2` — нитрит калия | `»KClO»_4` — перхлорат калия |
Способы получения средних солей
Соли тесно связаны со всеми остальными классами неорганических соединений и могут быть получены практически из любого класса. Большинство способов получения солей было разобрано выше.
- Способы получения кислых и основных солей
- Кислые соли могут быть получены либо неполной нейтрализацией кислот, либо действием избытка кислот на средние соли, щелочи, оксиды или соли:
- `»NaOH» + «H»_2″SO»_4 -> «NaHSO»_4 + «H»_2″O»`;
- `»Na»_2″SO»_4 + «H»_2″SO»_4 -> 2″NaHSO»_4`;
- `»NaCl» + «H»_2″SO»_4 -> «NaHSO»_4 + «HCl»`;
- `»CaCO»_3 + «CO»_2 + «H»_2″O» -> «Ca(HCO»_3)_2`.
- Основные соли часто получаются при осторожном добавлении небольших количеств щелочей к растворам средних солей металлов, имеющих малорастворимые основания, или при действии солей слабых кислот на средние соли:
- `»AlCl»_3 + 2″NaOH» -> «Al(OH)»_2″Cl» + 2″NaCl»`;
- В общем виде способы получения кислых или основных солей из средних солей представим в виде следующей схемы:

- Химические свойства солей
Многие соли устойчивы при нагревании. Однако соли аммония, а также некоторые соли малоактивных металлов, слабых кислот и кислот, в которых элементы проявляют высшие или низшие степени окисления, при нагревании разлагаются (также см. получение оксидов).
- $$ {mathrm{NH}}_{4}mathrm{Cl} stackrel{mathrm{t}°mathrm{C}}{ o } {mathrm{NH}}_{3}uparrow + mathrm{HCl}$$;
- $$ 2{mathrm{FeSO}}_{4} stackrel{mathrm{t}°mathrm{C}}{ o } {mathrm{Fe}}_{2}{mathrm{O}}_{3} + {mathrm{SO}}_{2}uparrow + {mathrm{SO}}_{3}uparrow $$;
- $$ 4{mathrm{FeSO}}_{4} stackrel{mathrm{t}°mathrm{C}}{ o } 2{mathrm{Fe}}_{2}{mathrm{O}}_{3} + 4{mathrm{SO}}_{2}uparrow + {mathrm{O}}_{2}uparrow $$;
- $$ ({mathrm{NH}}_{4}{)}_{2}{mathrm{Cr}}_{2}{mathrm{O}}_{7} stackrel{mathrm{t}°mathrm{C}}{ o } {mathrm{Cr}}_{2}{mathrm{O}}_{3} + {mathrm{N}}_{2}uparrow + 4{mathrm{H}}_{2}mathrm{O}$$;
- $$ 2{mathrm{KClO}}_{3} stackrel{150-300°mathrm{C}, {mathrm{MnO}}_{2}}{ o } 2mathrm{KCl} + 3{mathrm{O}}_{2}uparrow $$;
- $$ 4{mathrm{KClO}}_{3} stackrel{400°mathrm{C}}{ o } 3{mathrm{KClO}}_{4} + mathrm{KCl}$$.
- Взаимодействие растворов или расплавов солей менее активных металлов с более активными металлами:
- `»Cu» + 2″AgNO»_3 -> 2″Ag»darr + «Cu(NO»_3)_2`.
- Взаимодействие соли с кислотой, в результате которого образуется нерастворимое или летучее вещество:
- `»AgNO»_3 + «HBr» → «AgBr»↓ + «HNO»_3`;
- `»FeS» + 2″HCl» → «H»_2″S»↑ + «FeCl»_2`.
- Взаимодействие раствора соли со щелочью, в результате которого образуется нерастворимое вещество:
- `»CuCl»_2 + «KOH» → «Cu(OH)»_2 ↓+ 2″KCl»`;
- `»Na»_2″CO»_3 + «Ca(OH)»_2 → «CaCO»_3↓ + 2″NaOH»`.
- Взаимодействие растворов солей друг с другом, в результате которого образуется нерастворимое вещество:
- `»Na»_2″CO»_3 + «Ba(NO»_3)_2 → «BaCO»_3 ↓+ 2″NaNO»_3`.
- Участие в ОВР:
- `2″FeCl»_2 + «Cl»_2 → 2″FeCl»_3`;
- `2″NaNO»_2 + «O»_2 → 2″NaNO»_3`;
- `»Na»_2″SO»_3 + «H»_2″O» + «Cl»_2 → «Na»_2″SO»_4 + 2″HCl»`.
- Гидролиз некоторых солей:
- $$ {mathrm{MgCl}}_{2} + {mathrm{H}}_{2}mathrm{O}
ightleftarrows mathrm{MgOHCl} + mathrm{HCl}$$; - $$ {mathrm{Na}}_{2}{mathrm{CO}}_{3} + {mathrm{H}}_{2}mathrm{O}
ightleftarrows {mathrm{NaHCO}}_{3} + mathrm{NaOH}$$. - При нагревании многие кислые соли разлагаются:
- $$ 2{mathrm{NaHCO}}_{3} stackrel{mathrm{t}°mathrm{C}}{ o } {mathrm{Na}}_{2}{mathrm{CO}}_{3} + {mathrm{CO}}_{2}uparrow + {mathrm{H}}_{2}mathrm{O}$$;
- $$ mathrm{Ca}({mathrm{HCO}}_{3}{)}_{2} stackrel{mathrm{t}°mathrm{C}}{ o } {mathrm{CaCO}}_{3}downarrow + {mathrm{CO}}_{2}uparrow + {mathrm{H}}_{2}mathrm{O}$$.
- Генетический ряд состоит из веществ, которые образованы одним химическим элементом, принадлежат к разным классам соединений и связаны взаимными превращениями.
- В приведённой ниже таблице обобщены рассмотренные выше химические свойства важнейших классов неорганических соединений.
| Реагент | Основной оксид | Амфотерный оксид | Кислотный оксид | Щелочь | Амфотерный гидроксид | Кислота | Соль | `»H»_2″O»` |
| Основной оксид | `-` | соль | соль | `-` | соль `+` `»H»_2″O»` | соль `+` `»H»_2″O»` | `-` | щелочь |
| Амфотерный оксид | соль | `-` | соль | соль `+` `»H»_2″O»` | `-` | соль `+` `»H»_2″O»` | `-` | `-` |
| Кислотный оксид | соль | соль | `-` | соль `+` `»H»_2″O»` | соль `+` `»H»_2″O»` | `-` | `-` | кислота |
| Щелочь | `-` | соль `+` `»H»_2″O»` | соль `+` `»H»_2″O»` | `-` | соль `+` `»H»_2″O»` | соль `+` `»H»_2″O»` | соль `+` основание | дис- социация |
| Амфотерный гидроксид | соль `+` `»H»_2″O»` | `-` | соль `+` `»H»_2″O»` | соль `+` `»H»_2″O»` | `-` | соль `+` `»H»_2″O»` | `-` | |
| Кислота | соль `+` `»H»_2″O»` | соль `+` `»H»_2″O»` | `-` | соль `+` `»H»_2″O»` | соль `+` `»H»_2″O»` | `-` | соль `+` кислота | дис- социация |
| Соль | `-` | `-` | `-` | соль `+` основание | `-` | соль `+` кислота | соль `+` соль | гидролиз |
Соли их классификация, химические свойства и способы получения (Таблица)
Соли — это химические соединения, которые в водных растворах диссоциируют с образованием катиона металла (или NH4+) и анионов кислотного остатка.
Схема классификации солей по составу
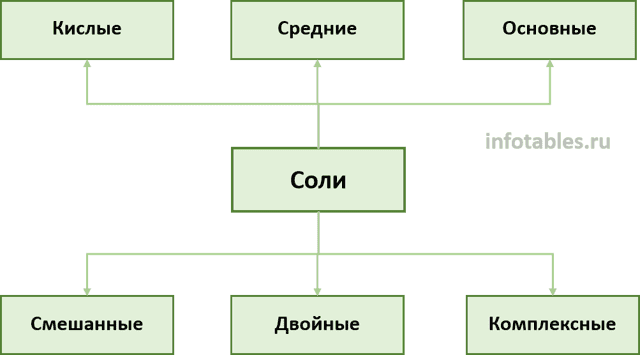
Таблица классификации солей (пояснения к схеме)
| Понятие | Определение | Примеры |
| Средние соли | Продукты полного замещения атомов водорода на металл | BaSO4, СаСО3 |
| Кислые соли | Продукты неполного замещения атомов водорода на металл. Кислые соли могут образовывать только 2-х или многоосновные кислоты | NaHCO3, MgHSO4 |
| Основные соли | Соли, которые кроме ионов металла и кислотного остатка содержат гид-роксо группы | Аl(ОН)2Сl, [Са(ОН)]2СО3 |
| Двойные соли | Соли, в которых атомы водорода многоосновной кислоты замещены разными металлами | KNaSO4 |
| Смешанные соли | Соли двух кислот | СаClBr |
| Комплексные соли | Соли, содержащие комплексный ион | [Ag(NH3)2]Cl; K4[Fe(CN)6] |
Таблица способы получения солей
| Реакция | Пример |
| Взаимодействия кислот и оснований | KOH + HCl → KCl + H2O |
| Взаимодействия кислот с основными оксидами | H2SO4 + CuO → CuSO4 + Н2O |
| Взаимодействия щелочей с кислотными оксидами | 2NaOH + SiO2 → Na2SiO3 + H2O |
| Взаимодействия кислотных и щелочных оксидов | Na2O + CO2 → Na2CO3 |
| Взаимодействия щелочей с солями | 3KOH + FeCl3 → 3KCl + Fe(OH)↓ |
| Взаимодействия кислот с солями | NaCO3 + 2HCl → 2NaCl + CO2↑ + H2O |
| Взаимодействия двух солей | Na2SO4 + BaCl2 → BaSO4↓ + 2NaCl |
| Взаимодействия простых веществ | 2K + Cl2 → 2KCl |
| Взаимодействия металлов с кислотами | 2Al + 6HCl → 2AlCl3 + 3H2↑ |
| Взаимодействия металлов с солями | Fe + CuSO4 → FeSO4 + Cu |
| Термического разложения некоторых кислородсодержащих солей | 2NaNO3 →t→ 2NaNO2 + 02↑ |
Химические свойства солей (таблица)
| Свойства солей | Примеры реакций |
| Отношение к нагреванию |
|
| Взаимодействие с кислотами | AgNO3 + НС1 → AgCl↓ + HNO3 (должно произойти связывание ионов) |
| Взаимодействие с щелочами | CuSO4 + 2NaOH → Cu(OH)2↓ + 2Na2SO4 (должно произойти связывание ионов) |
| Взаимодействие с металлами |
|
| Взаимодействие солей между собой | Если исходные соли растворимы CuSO4 + BaCl2 → CuCl2 + BaSO4↓; SO42- + Ва2+ → BaSO4 (происходит связывание ионов) |
Вывод: свойства солей определяются ионами металлов и кислотных остатков, которые находятся в их растворах.
Химические свойства солей — реакции, определение и примеры
Соли — это сложные вещества, в состав которых входят катионы металла и анионы кислотного остатка. Иногда в состав солей входят водород или гидроксид-ион.
Классификация и номенклатура солей
Так как соли — это продукт полного или частичного замещения металлом атома водорода в кислоте, по составу их можно классифицировать следующим образом.
Кислые соли
Образованы неполным замещением атомов водорода на металл в кислоте.
В наименованиях кислых солей указывают количество водорода приставками «гидро-» или «дигидро-», название кислотного остатка и название металла. Если металл имеет переменную валентность, то в скобках указывают валентность.
Примеры кислых солей и их наименования:
- LiHCO3 — гидрокарбонат лития,
- NaHSO4 — гидросульфат натрия,
- NaH2PO4 — дигидрофосфат натрия.
Средние соли
Образованы полным замещением атомов водорода в кислоте на металл.
Наименования средних солей складываются из названий кислотного остатка и металла. При необходимости указывают валентность.
Примеры средних солей с названиями:
- CuSO4 — сульфат меди (II),
- CaCl2 — хлорид кальция.
Основные соли
- Продукт неполного замещения гидроксогрупп на кислотный остаток.
- В наименованиях основных солей указывают количество гидроксид-ионов приставкой «гидроксо-» или «дигидроксо-», название кислотного остатка и название металла с указанием валентности.
- Пример: Mg(OH)Cl — гидроксохлорид магния.
Двойные соли
- В состав входят два разных металла и один кислотный остаток.
- Наименование складывается из названия аниона кислотного остатка и названий металлов с указанием валентности (если металл имеет переменную валентность).
- Примеры двойных солей и их наименования:
- KNaSO4 — сульфат калия-натрия,
- KAl(SO4)2 — сульфат калия-алюминия.
Смешанные соли
- Содержат один металл и два разных кислотных остатка.
- Наименования смешанных солей складываются из названия кислотных остатков (по усложнению) и названия металла с указанием валентности (при необходимости).
- Примеры смешанных солей с наименованиями:
- CaClOCl — хлорид-гиполхорит кальция,
- PbFCl — фторид-хлорид свинца (II).
Комплексные соли
- Образованы комплексным катионом или анионом, связанным с несколькими лигандами.
- Называют комплексные соли по схеме: координационное число + лиганд с окончанием «-о» + комплексообразователь с окончанием «-ат» и указанием валентности + внешняя сфера, простой ион в родительном падеже.
- Пример: K[Al(OH)4] — тетрагидроксоалюминат калия.
Гидратные соли
- В состав входит молекула кристаллизационной воды.
- Число молекул воды указывают численной приставкой к слову «гидрат» и добавляют название соли.
- Пример: СuSO4∙5H2O — пентагидрат сульфата меди (II).
Получение солей
Получение средних солей
Средние соли можно образовать в ходе следующих реакций:
-
- Металл + неметалл:
- 2Na + Cl2 = 2NaCl
- Fe + S =FeS
- Так получают только соли бескислородных кислот.
-
Металл, стоящий левее H2 в ряду активности, с раствором кислоты:
Mg + 2HCl = MgCl2 + H2
-
Металл с раствором соли менее активного металла:
Fe + CuCl2 = FeCl2 + Cu
-
Основный оксид + кислотный оксид:
Na2O + CO2 = Na2CO3
-
Основный оксид и кислота:
CuO + H2SO4= CuSO4 + H2O
-
Основание с кислотным оксидом:
2NaOH + SO3 = Na2SO4 + H2O
-
Основание с кислотой (реакция нейтрализации):
Ca(OH)2 + 2HCl = CaCl2 + 2H2O
-
- Взаимодействие соли с кислотой:
- MgCO3 + 2HCl = MgCl2 + H2O + CO2
- BaCl2 + H2SO4 = BaSO4 + 2HCl
- Взаимодействие возможно, если одним из продуктов реакции будет нерастворимая соль, вода или газ.
-
Реакция раствора основания с раствором соли:
2NaOH + CuSO4 = Na2SO4 + Ba(OH)2
-
Взаимодействие растворов двух солей с образованием новых солей:
NaCl + AgNO3 = AgCl + NaNO3
Получение кислых солей
Кислые соли образуются при взаимодействии:
-
Кислот с металлами:
Zn + 2H2SO4 = H2 + Zn(HSO4)2
-
Кислот с оксидами металлов:
CaO + H3PO4 = CaHPO4 + H2O
-
Гидроксидов металлов с кислотами:
Ba(OH)2 + H3PO4 = BaHPO4 + 2H2O
-
Кислот с солями:
Ca3PO4 + 4H3PO4 = 3Ca(H2PO4)2
-
Аммиака с кислотами:
NH3 + H3PO4 = NH4H2PO4
- Получение кислых солей возможно, если кислота в избытке.
- Также кислые соли образуются в ходе реакции основания с избытком кислотного оксида:
- KOH + CO2 = KHCO3
- 2SO2 + Ca(OH)2 = Ca(HSO3)2
Получение основных солей
-
Взаимодействие кислоты с избытком основания:
Fe(OH)3 + HCl = Fe(OH)2Cl + H2O
-
Добавление (по каплям) небольших количеств щелочей к растворам средних солей металлов:
Cu(NO3)2 + NaOH = CuOHNO3 + NaNO3
-
Взаимодействие солей слабых кислот со средними солями:
2MgCl2 + 2Na2CO3 + H2O = [Mg(OH)]2CO3 + CO2 + 4NaCl
- Реакции солей с лигандами:
- AgCl + 2NH3 = [Ag(NH3)2]Cl
- FeCl3 + 6KCN = K3[Fe(CN)6] + 3KCl
- Zn(OH)2 + 2NaOH = Na2[Zn(OH)4]
- Al2O3 + 2NaOH +3H2O = 2Na[Al(OH)4]
-
Растворимые соли являются электролитами, следовательно, могут распадаться на ионы. Средние соли диссоциируют сразу:
NaCl → Na+ + Cl-
-
- Термическое разложение:
- CaCO3 = CaO + CO2
- Нитраты разлагаются в зависимости от активности металла соли:
Получение двойных солей
Двойные соли получают совместной кристаллизацией двух солей:
Cr2(SO4)3 + K2SO4 + 24H2O = 2[KCr(SO4) 2 • 12H2O]
Химические свойства солей
Химические свойства средних солей
Соль, свойства и все характеристики
Соли – твердые вещества разного цвета. Растворимость их различна. Некоторые соли хорошо растворимы в воде, например все нитраты; другие же, например карбонат кальция, сульфат бария и т.п., практически нерастворимы.
Получение солей
- Соли можно получить, действуя кислотами на металлы, основные оксиды и основания:
- 2H3PO4 + 6Na = 2Na3PO4 + 3H2↑;
- 3H2SO4 + Fe2O3 = Fe2(SO4)3 + 3H2O;
- 3HNO3 + Cr(OH)3 = Cr(NO3)3 + 3H2O.
- Соли образуются при реакции кислотных оксидов со щелочами, а также кислотных оксидов с основными:
- N2O5 + Ca(OH)2 = Ca(NO3)2 + H2O;
- P2O5 + 3CaO = Ca3(PO4)2.
- Соли можно получить при взаимодействии солей с кислотами, со щелочами, с металлами, с нелетучими кислотными оксидами и другими солями:
- Ca3(PO4)2 + 3H2SO4 = 3CaSO4 + 2H3PO4;
- Fe2(SO4)3 + 6NaOH = 2Fe(OH)3↓ + 3Na2SO4;
- CuSO4 + SiO2 = CaSiO3 + CO2↑ (t0);
- Al2(SO4)3 + 3BaCl2 = 3BaSO4↓ + 2AlCl3.
- Соли образуются при взаимодействии металлов с неметаллами:
- 2Fe + 3Cl2 = 2FeCl3.
Химические свойства солей
Соли реагируют с металлами. Составляя уравнения этих реакций, следует руководствоваться рядом Н.Н. Бекетова. Так как эти реакции протекают в водных растворах, то для практических опытов нельзя применять литий, натрий, калий, кальций, барий и другие активные металлы, которые при обычных условиях реагируют с водой.
HgSO4 + Sn = SnSO4 + Hg↓.
Соли реагируют с кислотами. При проведении этих реакций обычно берут сухую соль и действуют концентрированной кислотой.
- AgNO3 + HClconc = AgCl↓ + HNO3.
- Соли реагируют с щелочами в водных растворах в результате чего образуются нерастворимые основания.
- FeCl3 + 3NaOHaq = Fe(OH)3↓ + 3NaCl.
Соли реагируют с солями. Реакции протекают в растворах и используются для получения практически нерастворимых солей.
- CuSO4 + H2S = CuS↓ + H2O.
- Некоторые соли при нагревании разлагаются. Характерным примером такой реакции является обжиг известняка, основной составной частью которого является карбонат кальция:
- CaCO3 = CaO + CO2↑ (t0).
Применение солей
Большинство солей широко используется в промышленности и в быту. Например, всем известно применение поваренной соли, т.е. хлорида натрия, в быту. В промышленности он используется для получения гидроксида натрия, соды, хлора, натрия и т.д. Соли азотной и ортофосфорной кислот в основном являются минеральными удобрениями.
Многие средства защиты растений от болезней, вредителей, некоторые лекарственные средства тоже относятся к классу солей.
Примеры решения задач
| Понравился сайт? Расскажи друзьям! |






