Взаимодействие валентных (наименее прочно связанных с ядром) электронов атомов приводит к образованию химических связей, т. е. к объединению атомов в молекулу. Образование молекулы из атомов возможно лишь тогда, когда оно приводит к выигрышу энергии; молекулярное состояние должно обладать меньшей энергией, чем атомное состояние, и, следовательно, быть устойчивее.
Таким наиболее устойчивым является состояние атома, когда число электронов на внешнем электронном уровне максимальное, которое он может вместить; такой уровень называется завершенным и характеризуется наибольшей прочностью. Таковы электронные конфигурации атомов благородных газов.
Значит, образование химической связи должно приводить к завершению внешнего электронного уровня атомов.
Это взаимодействие валентных электронов, приводящее к образованию химической связи, может осуществляться по-разному. Различают три основных вида химической связи: ковалентную, ионную и металлическую.
Рассмотрим механизм возникновения ковалентной связи на примере образования молекулы водорода (рис. 3):
`»H» + «H» = «H»_2`;`Delta»H»=-436` кДж/моль
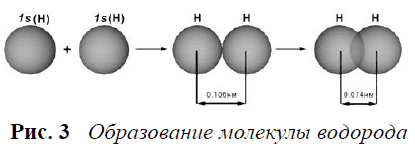
Реакция сопровождается высвобождением большого количества тепла, значит, она энергетически выгодна.
Ядро свободного атома водорода окружено сферически симметричным электронным облаком, образованным `1s`-электроном. При сближении атомов до определенного расстояния происходит частичное перекрывание их электронных облаков (орбиталей).
Обычно наибольшее перекрывание электронных облаков осуществляется вдоль линии, соединяющей ядра двух атомов.
В каждом атоме хлора `7` валентных электронов, из них `6` в виде неподеленных пар, а `1` — неспаренный электрон. Образование химической связи происходит именно за счёт неспаренных электронов каждого атома хлора.
Они связываются в общую пару (или неподелённую пару) электронов. Если считать, что общая пара принадлежит обоим атомам, то каждый из них становится обладателем `8` электронов, т. е. приобретает устойчивую конфигурацию благородного газа.
Поэтому ясно, что молекула хлора энергетически выгоднее, чем отдельные атомы.
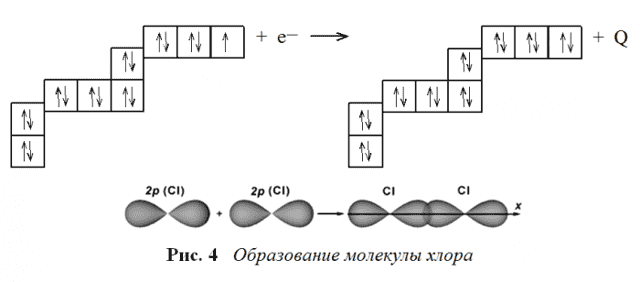
Это также `sigma`-связь, но она образована перекрыванием `p`-электронных орбиталей по оси `x` (рис. 4).
Если в реагирующих атомах имеется $$ 2$$ или $$ 3$$ неспаренных электрона, то могут образоваться не $$ 1$$, а $$ 2$$ или $$ 3$$ связи, т. е. общие электронные пары. Если между атомами возникла одна ковалентная связь, то она называется одинарной, если две -двойной, если три — тройной. Они обозначаются соответственно «`=`» или «`-=`» штрихами.
Но хотя обозначение их одинаково, они отличаются по своим свойствам от одинарной `sigma`-связи. Чтобы пояснить разницу, рассмотрим образование тройной связи в молекуле азота `»N»_2`. В ней атомы имеют три общие пары электронов:
$$ :underset{·}{overset{·}{mathrm{N}}}·+·underset{·}{overset{·}{mathrm{N}}}: o stackrel{··}{mathrm{N}}⋮⋮stackrel{··}{mathrm{N}}$$
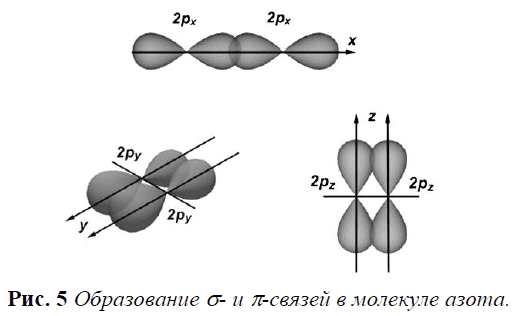
Они образованы неспаренными `p`-электронами двух атомов азота:
Орбитали `2p`-электронов расположены взаимно перпендикулярно, т. е. по осям `x`, `y` и `z`.
Если перекрывание по оси `x` ведёт к образованию `σ`-связи (перекрывание вдоль линии, связывающей центры атомов), то перекрывание по осям `y` и `z` происходит по обе стороны от линии, связывающей центры соединяющихся атомов.
Такая ковалентная связь, возникающая при перекрывании орбиталей по обе стороны от линии, связывающей центры соединяющихся атомов, называется `pi`-связью.
Очевидно, что взаимное перекрывание орбиталей в случае `pi`-связи меньше, чем в случае `sigma`-связи, поэтому `pi`-связь всегда менее прочная, чем `sigma`-связь. Но в сумме три связи `(sigma_x+pi_y+pi_z)` придают молекуле $$ {mathrm{N}}_{2}$$ большую прочность (рис. 5), поэтому молекула азота при нормальных условиях нереакционноспособна.
Таким образом, если имеется ординарная связь, то это обязательно `sigma`-связь; если имеется двойная или тройная связь, то одна из составляющих её связей обязательно `sigma`-связь (как более прочная она формируется первая и разрушается последняя), а остальные -`pi`-связи. И `sigma`-, и `pi`-связи – это разновидности ковалентной связи.
В общем случае ковалентной называется химическая связь, осуществляемая электронными парами.
Различают неполярную и полярную ковалентную связь.
Все рассмотренные выше молекулы образованы атомами одного и того же элемента, при этом двухэлектронное облако связи распределяется в пространстве симметрично относительно ядер обоих атомов, и электронная пара в одинаковой мере принадлежит обоим атомам. Такая связь называется неполярной ковалентной связью.
Иной случай реализуется, если связь образуют два атома различных элементов с отличающимися величинами относительной электроотрицательно-сти, например $$ mathrm{HCl}$$, $$ {mathrm{H}}_{2}mathrm{O}$$, $$ {mathrm{H}}_{2}mathrm{S}$$, $$ {mathrm{NH}}_{3}$$ и др. В этом случае электронное облако связи смещено к атому с большей относительной электроотрицательностью. Такой вид связи называется полярной ковалентной связью.
Например, полярная ковалентная связь образуется при взаимодействии атомов водорода и хлора (рис. 6).
$$ mathrm{H}·+·underset{··}{overset{··}{mathrm{Cl}}}: o mathrm{H}:underset{··}{overset{··}{mathrm{Cl}}}:$$
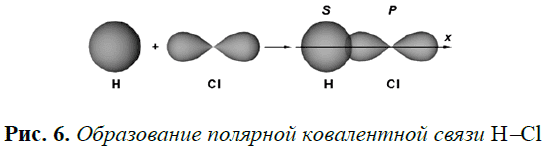
Электронная пара смещена к атому хлора, так как относительная электроотрицательность хлора `(x=3)` больше, чем у водорода `(x=2,1)`.
У молекул, содержащих неполярную связь, связующее облако распределяется симметрично между ядрами обоих атомов, и ядра в равной степени тянут его к себе.
Электрический момент диполя таких молекул $$( {mathrm{H}}_{2},{mathrm{F}}_{2},{mathrm{Cl}}_{2}$$ и др.`)` равен нулю.
Молекулы, содержащие полярную связь, образованы связующим электронным облаком, смещенным в сторону атома с большей относительной электроотрицательностью.
Описанные выше примеры образования ковалентной связи относятся к обменному механизму, когда каждый из соединяющихся в молекулу атомов предоставляет по электрону. Однако образование ковалентной связи может происходить и по донорно-акцепторному механизму.
В этом случае химическая связь возникает за счёт двухэлектронного облака одного атома (спаренных электронов) и свободной орбитали другого атома. Атом, предоставляющий неподеленную пару, называется донором, а атом, принимающий её (т. е.
предоставляющий свободную орбиталь) – акцептором.
Рассмотрим в качестве примера механизм образования иона $$ {mathrm{NH}}^{4+}$$. В молекуле аммиака атом азота имеет неподеленную пару электронов; у иона водорода свободна `1s`-орбиталь.
При образовании катиона аммония двухэлектронное облако азота становится общим для атомов $$ mathrm{N}$$ и $$ mathrm{H}$$, т. е. оно превращается в молекулярное электронное облако.
Таким образом, возникает четвертая ковалентная связь:
Положительный заряд иона водорода становится общим (он рассредоточен между всеми атомами), а двухэлектронное облако (неподеленная электронная пара), принадлежавшее азоту, становится общим с водородом.
По своим свойствам четвертая $$ mathrm{N}-mathrm{H}$$ связь в ионе $$ {mathrm{NH}}_{4}^{+}$$ ничем не отличается от остальных трех.
Поэтому донорно-акцепторная связь — это не особый вид связи, а лишь особый механизм (способ) образования ковалентной связи.
Еще один тип связи — ионная связь — возникает, когда взаимодействуют электронные облака атомов, чьи относительные электроотрицательности резко отличаются. В этом случае общая электронная пара настолько смещена к одному из атомов, что практически переходит в его владение.
При этом он образует отрицательно заряженный анион, а атом, отдавший электрон — катион.
Например, атомы натрия и хлора резко отличаются по электроотрицательности (`x=0,9` и `x=3` соответственно), поэтому атом хлора очень сильно притягивает электрон, стремясь завершить свой внешний электронный уровень, а атом натрия охотно его отдаёт, поскольку ему для получения устойчивой конфигурации внешнего слоя удобнее отдать единственный валентный электрон:
$$ mathrm{Na}left(1{s}^{2}2{s}^{2}2{p}^{6}3{s}^{1}
ight)–е={mathrm{Na}}^{+}left(1{s}^{2}2{s}^{2}2{p}^{6}
ight)$$
$$ mathrm{Cl}left(1{s}^{2}2{s}^{2}2{p}^{6}3{s}^{2}3{p}^{5}
ight)+е={mathrm{Cl}}^{-}left(1{s}^{2}2{s}^{2}2{p}^{6}3{s}^{2}3{p}^{6}
ight)$$.
Электронная оболочка атома натрия превратилась в устойчивую оболочку атома неона, а оболочка хлора — в устойчивую оболочку другого инертного газа — аргона. Между ионами $$ {mathrm{Na}}^{+}$$ и $$ {mathrm{Cl}}^{-}$$, несущими разноименные заряды, возникают силы электростатического притяжения, в результате чего образуется соединение $$ mathrm{NaCl}$$.
Ионные соединения образуют атомы элементов, резко отличающихся по электроотрицательности, например атомы элементов главных подгрупп $$ mathrm{I}$$ и $$ mathrm{II}$$ и групп с элементами главных подгрупп $$ mathrm{VI}$$ и $$ mathrm{VII}$$ групп.
Таким образом, между механизмами возникновения ковалентной и ионной связей нет принципиального различия. Они различаются лишь степенью поляризации (смещения) общих электронных пар. Поэтому можно рассматривать ионную связь как предельный случай полярной ковалентной связи.
Вместе с тем надо помнить о важных отличиях ионной связи от ковалентной.
Ионная связь характеризуется ненаправленностью в пространстве (каждый ион может притягивать ион противоположного знака по любому направлению) и ненасыщаемостью (взаимодействие ионов не устраняет способность притягивать или отталкивать другие ионы).
Вследствие ненаправленности и ненасыщаемости ионные соединения в твёрдом состоянии представляют собой ионную кристаллическую решётку, в которой каждый ион взаимодействует не с одним, а со многими ионами противоположного знака; например, в решётке хлорида натрия катион натрия окружён шестью хлорид-анионами и наоборот.
Связи между ионами многочисленны и прочны, поэтому вещества с ионной решёткой тугоплавки, малолетучи и обладают сравнительно высокой твёрдостью. При плавлении ионных кристаллов прочность связи между ионами уменьшается, и расплавы их проводят электрический ток. Ионные соединения, как правило, хорошо растворяются в воде и других полярных растворителях.
В то же время ковалентная связь отличается насыщаемостью (т. е. способностью атомов образовывать ограниченное количество ковалентных связей, определяемое числом неспаренных электронов) и направленностью (определённой пространственной структурой молекул, которой мы коснёмся ниже).
Твёрдые вещества, состоящие из молекул (полярных и неполярных), образуют молекулярные кристаллические решётки.
Молекулы в таких решётках соединены сравнительно слабыми межмолекулярными силами, поэтому вещества с молекулярной решёткой имеют малую твёрдость, низкие температуры плавления, они плохо растворимы в воде, а их растворы почти не проводят электрический ток.
Число неорганических веществ с молекулярной кристаллической решёткой невелико: лёд, твёрдый оксид углерода `(«IV»)` («сухой лёд»), твёрдые галогеноводороды и простые вещества, но зато большинство кристаллических органических соединений имеют молекулярную решётку.
Если же в узлах решётки располагаются атомы, соединённые прочными ковалентными связями, то такие вещества имеют высокие температуры плавления, прочность и твёрдость, они практически нерастворимы в жидкостях.
Характерный пример вещества с атомной кристаллической решёткой — алмаз; она характерна также для твёрдого бора, кремния, германия и соединений некоторых элементов с углеродом и кремнием.
Особый тип решётки в твёрдом состоянии образуют металлы. В узлах такой металлической кристаллической решётки находятся катионы металлов, а между ними — отрицательно заряженный «электронный газ».
Атомы металлов в решётке упакованы так тесно, что валентные орбитали соседних атомов перекрываются, и электроны получают возможность свободно перемещаться из орбиталей одного атома в орбитали других атомов, осуществляя связь между всеми атомами данного кристалла металла.
Лишённые валентных электронов, атомы превращаются в катионы, а электроны, осуществляющие связь, перемещаются по всему кристаллу металла и становятся общими.
Металлическая связь имеет некоторое сходство с ковалентной, поскольку и в ее основе лежит обобществление валентных электронов.
Однако при ковалентной связи эти электроны находятся вблизи соединенных атомов и прочно с ними связаны, тогда как при металлической связи электроны свободно перемещаются по всему кристаллу и принадлежат всем его атомам. Именно поэтому кристаллы с ковалентной связью хрупки, а с металлической – пластичны, т. е.
без разрушения изменяют форму, прокатываются в листы, вытягиваются в проволоку. Наличие свободных электронов придает кристаллам металлов непрозрачность, высокую электрическую проводимость, теплопроводность.
Иногда в соединениях мы встречаемся с особой формой химической связи – так называемой водородной связью. Она менее прочна, чем уже рассмотренные виды, и может считаться дополнительной связью к уже существующим ковалентным.
- Водородную связь обозначают точками, подчёркивая тем самым её сравнительную слабость (примерно в $$ 15–20$$ раз слабее ковалентной).
- Водородная связь весьма распространена и играет важную роль при ассоциации молекул, в процессах кристаллизации, растворения, образования кристаллогидратов, электролитической диссоциации и других важных физико-химических процессах.
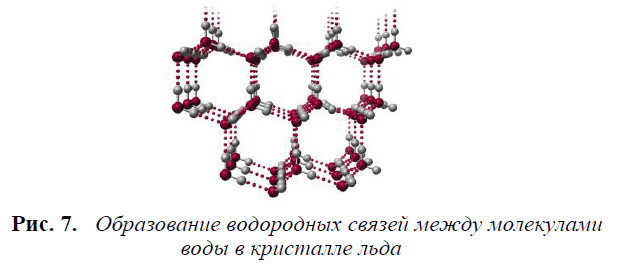
- Молекула воды может образовывать четыре водородные связи, так как имеет два атома водорода и две несвязывающие электронные пары:
- Эта способность обусловливает строение и свойства воды и льда.
Вода является жидкостью, хотя более тяжелый сероводород — полный электронный аналог воды — газ. Молекулы воды образуют между собой водородные связи, что увеличивает плотность вещества в жидком состоянии и его температуру кипения. Между молекулами сероводорода подобных связей не возникает из-за большого радиуса и сравнительно малой электро-отрицательности атома серы.
При замерзании количество водородных связей между молекулами воды становится максимальным. Строго ориентируясь относительно друг друга, они образуют правильные шестиугольники. Образованные ими канальцы заполнены воздухом, поэтому плотность льда меньше плотности воды (рис. 7).
Водородная связь приводит к образованию димеров муравьиной и уксусной кислот, устойчивых в газообразном и жидком состоянии:
Благодаря водородной связи фтороводород `»HF»` в обычных условиях суще-ствует в жидком состоянии (`»t»_»кип»=19,5^@»C»`), а плавиковая кислота диссоциирует с образованием как фторид-аниона `»F»^−`, так и гидродифторид-аниона $$ {mathrm{HF}}_{2}^{-}$$.
Важную роль играют водородные связи в химии процессов жизнедеятельности, поскольку они распространены в молекулах белков, нуклеиновых кислот и других биологически важных соединений.
§ 13. Металлическая химическая связь
>>> Перейти на мобильный размер сайта >>>
Учебник для 8 класса
ХИМИЯ
Вы узнали, как взаимодействуют между собой атомы элементов-металлов и элементов-неметаллов (электроны переходят от первых ко вторым), а также атомы элементов-неметаллов между собой (неспаренные электроны внешних электронных слоёв их атомов объединяются в общие электронные пары). Теперь мы познакомимся с тем, как взаимодействуют между собой атомы элементов-металлов. Металлы обычно существуют не в виде изолированных атомов, а в виде слитка или металлического изделия. Что удерживает атомы металла в едином объёме?
Атомы большинства элементов-металлов на внешнем уровне содержат небольшое число электронов — 1, 2, 3. Эти электроны легко отрываются, а атомы превращаются в положительные ионы. Оторвавшиеся электроны перемещаются от одного иона к другому, связывая их в единое целое.
Разобраться, какой электрон принадлежал какому атому, просто невозможно. Все оторвавшиеся электроны стали общими. Соединяясь с ионами, эти электроны временно образуют атомы, потом снова отрываются и соединяются уже с другим ионом и т. д. Бесконечно происходит процесс, который можно изобразить схемой:
Следовательно, в объёме металла атомы непрерывно превращаются в ионы и наоборот. Их так и называют атом-ионами.
| Связь в металлах и сплавах между атом-ионами посредством обобществлённых электронов называют металлической. |
На рисунке 41 схематически изображено строение фрагмента металла натрия. Каждый атом натрия окружён восемью соседними атомами.
Рис. 41. Схема строения фрагмента кристаллического натрия
Оторвавшиеся внешние электроны свободно движутся от одного образовавшегося иона к другому, соединяя, будто склеивая, ионный остов натрия в один гигантский металлический кристалл (рис. 42).
Рис. 42. Схема металлической связи
Металлическая связь имеет некоторое сходство с ковалентной, так как основана на обобществлении внешних электронов.
Однако при образовании ковалентной связи обобществляются внешние неспаренные электроны только двух соседних атомов, в то время , как при образовании металлической связи в обобществлении этих электронов участвуют все атомы.
Именно поэтому кристаллы с ковалентной связью хрупки, а с металлической, как правило, пластичны, электропроводны и имеют металлический блеск.
На рисунке 43 изображена древняя золотая фигурка оленя, которой уже более 3,5 тыс. лет, но она не потеряла характерного для золота — этого самого пластичного из металлов — благородного металлического блеска.
рис. 43. Золотой олень. VI в. до н. э.
Металлическая связь характерна как для чистых металлов, так и для смесей различных металлов — сплавов, находящихся в твёрдом и жидком состояниях.
Однако в парообразном состоянии атомы металлов связаны между собой ковалентной связью (например, парами натрия заполняют лампы жёлтого света для освещения улиц больших городов).
Пары металлов состоят из отдельных молекул (одноатомных и двухатомных).
Вопрос о химических связях — центральный вопрос науки химии. Вы познакомились с начальными представлениями о типах химической связи. В дальнейшем вы узнаете много интересного о природе химической связи. Например, что в большинстве металлов, кроме металлической связи, есть ещё и ковалентная связь, что существуют и другие типы химических связей.
Ключевые слова и словосочетания
- Металлическая связь.
- Атом-ионы.
- Обобществлённые электроны.
Работа с компьютером
- Обратитесь к электронному приложению. Изучите материал урока и выполните предложенные задания.
- Найдите в Интернете электронные адреса, которые могут служить дополнительными источниками, раскрывающими содержание ключевых слов и словосочетаний параграфа. Предложите учителю свою помощь в подготовке нового урока — сделайте сообщение по ключевым словам и словосочетаниям следующего параграфа.
Вопросы и задания
- Металлическая связь имеет черты сходства с ковалентной связью. Сравните эти химические связи между собой.
- Металлическая связь имеет черты сходства с ионной связью. Сравните эти химические связи между собой.
- Как можно повысить твёрдость металлов и сплавов?
- По формулам веществ определите тип химической связи в них: Ва, ВаВr2, НВr, Вr2.
Гдз химия 11 класc габриелян о.с. остроумов и.г. сладков с.а. §6 металлическая химическая связь ответы
Гдз химия 11 класc габриелян о.с. остроумов и.г. сладков с.а. §6 металлическая химическая связь ответы
Другие задания смотри здесь…
| Красным цветом даются ответы, а фиолетовым ― объяснения. |
Задание 1Как расположены металлы в периодической системе? Металлы располагаются преимущественно в левой и нижней части периодической таблицы от условной диагонали, проведённой от бора к астату, т. е. в основном в I, II и III группах, а также к металлам относятся все элементы Б-групп.Какими особенностями строения атомов и кристаллов различаются металлы и неметаллы? Атомы металлов на внешнем энергетическом уровне, как правило, содержат от 1 до 3 электронов, а неметаллы от 4 до 7, поэтому атомы металлов, в отличие от неметаллов, легко отдают валентные электроны. Металлы имеют металлические кристаллические решетки, а неметаллы ― молекулярные кристаллические решетки, но некоторые аллотропные модификации неметаллов имеют атомные кристаллические решетки.
Задание 2
Что такое сплавы? Сплавы ― это металлические материалы, полученные из расплавов двух или более веществ, одно из которых металл.Какие сплавы относятся к чёрным, а какие к цветным? Сплавы железа относятся к чёрным, а сплавы других металлов ― к цветным.
Задание 3
Какая связь называется металлической? Металлической связью называется связь в металлах и сплавах между атом-ионами металлов, осуществляемая совокупностью валентных электронов.Сравните эту связь с другими связями.
Общее с ковалентной связью: заключается в обобществлении валентных электронов.
Различия с ковалентной связью: при образовании ковалентной связи обобществляются внешние неспаренные электроны между двумя соседними атомами, в пределах одной молекулы, в то время как, при образовании металлической связи обобществляются валентные электроны всех атомов.
Общее с ионной связью: происходит путем отдачи и принятия электронов.Различия с ионной связью: при ионной связи электроны переходят от одного атома только к соседнему, тогда как при металлической связи электроны способны переходить на любой атом, то есть все электроны обобществлены.
Задание 4
Какое агрегатное состояние характерно для простых веществ – металлов при обычных условиях? Твердое агрегатное состояние.Чем особенна ртуть? Ртуть ― металл, который при обычных условиях имеет жидкое агрегатное состояние, т.е.
является исключением среди металлов.Почему аэрокомпании запрещают ртуть и содержащие её изделия к свободной перевозке? Пары ртути и ртутные соединения оказывают действие токсического характера на организм человека.
Задание 5
Какие свойства алюминия лежат в основе его применения? Низкая плотность (лёгкий металл), цвет и металлический блеск, высокая пластичность, высокая тепло- и электропроводность, химическая стойкость (благодаря плотной оксидной плёнке).
Задание 6
Какие свойства золота лежат в основе его применения? Цвет (красивый жёлтый) и металлический блеск, пластичность, высокая электропроводность, химическая инертность (не корродирует).
Почему, решая вопрос о строении атома, Резерфорд для своего опыта выбрал золотую фольгу? Благодаря пластичности золота для опыта была изготовлена фольга толщиной всего 0,003 мм.
Задание 7
Какое количество вещества никеля и меди содержится в 2,5 т мельхиора? Дано: m(мельхиора)=2,5 т=2500 кг, ω(Cu)=80%Найти: n(Cu)-?, n(Ni)-?Решениеm(Cu)=ω(Cu)•m(мельхиора):100%=80%•2500 кг :100%=2000 кгm(Ni)=m(мельхиора)-m(Cu)=2500 кг- 2000 кг=500 кгM(Cu)=64 кг/кмоль, M(Ni)=59 кг/кмольn(Cu)=m(Cu):M(Cu)=2000 кг : 64 кг/кмоль=31,25 кмольn(Ni)=m(Ni):M(Ni)=500 кг : 59 кг/кмоль=8,475 кмоль
Ответ: n(Cu)=31,25 кмоль, n(Ni)=8,475 кмоль
Другие задания смотри здесь…
Большая Рнциклопедия Нефти Рё Газа
Cтраница 2
Окисная пленка препятствует образованию металлической связи между расплавленным припоем и паяемым металлом, и поэтому ее необходимо удалить.
Наиболее эффективным средством удаления окис-ных пленок при пайке рельефных изделий оказались специальные газовые флюсы, активно взаимодействующие не только с окислами, но и с металлом. [16]
Следовательно, при образовании металлической связи происходит обобществление электронов не между двумя атомами, а в объеме всего кристалла. Таким образом, кристалл металла состоит из положительно заряженных ионов, которые удерживаются вместе общим электронным облаком. [17]
- Необходимо отметить, что образование металлических связей происходит как при динамических, так и при статических нагрузках. [18]
- Сварное соединение возникает вследствие образования металлических связей при совместном пластическом деформировании свариваемых поверхностей металла. [19]
- Как видно, природа образования металлических связей под действием ультразвуковых упругих колебаний опровергает выдвинутые различными авторами гипотезы о том, что металлическая связь может образовываться только под действием пластических деформаций и наклепа-дабо в результате взаимной диффузии атомов, находящихся в контакте, при наличии жидкой фазы на соединяемых поверхностях или и стых их поверхностей. [20]
- В заключение нашего обсуждения образования металлических связей мы должны объяснить, почему свойства, присущие металлам, полностью исчезают при переходе вдоль периода к элементам, расположенным в правой части периодической таблицы. [21]
РЈ переходных металлов РІ образовании металлической СЃРІСЏР·Рё, участвуют d — электроны. Поэтому количество d — электронов РЅР° РѕРґРёРЅ атом РІ кристалле резко меняется РїРѕ сравнению СЃ изолированным атомо-Рј.
�менно в этом заключается основная трудность установления зависимости каталитической активности переходных металлов от электронного строения.
Р’ зависимости РѕС‚ распределения d — электронов РІ кристалле меняются его электронные характеристики.
Получаемые методом Полинга электронные характеристики кристалла — число СЃ ( — дырок РЅР° атом, вес — состояний металла — наиболее широко используются РІ катализе. [22]
При сварке металлов взрывом происходит образование металлических связей по дислокационному механизму.
Активация процесса образования металлических связей связана с интенсивностью совместной пластической деформации поверхностных слоев свариваемого металла, которая определяется скоростью распространения пластической деформации и ее величиной, а также величиной давления, развивающегося в зона соударения. [23]
РџСЂРё отсутствии литого СЏРґСЂР° возможно образование металлической СЃРІСЏР·Рё между атомами РІ отдельных зонах контакта деталь — деталь.
Такими зонами являются места пластической деформации микровыступов на поверхностях деталей при условии, что величина деформации обеспечивает разрушение поверхностных оксидов и сближение активированных теплотой атомов до параметра кристаллической решетки, после чего между атомами образуется металлическая связь. Такое соединение называют склейкой, оно имеет низкую и очень нестабильную прочность и непригодно для работы, особенно при переменных нагрузках. [24]
Указать условия, необходимые для образования металлической связи. [25]
�спользование большего числа электронов для образования металлической связи в легких актинидах вызвано их большей тенденцией к многократной ионизации по сравнению с ланта-нидами. [26]
В процессе конденсации, затвердения и образования металлических связей неспаренные электроны каждого атома никеля стремятся спариться с неспаренными электронами соседних атомов.
Рто РїСЂРёРІРѕРґРёС‚ Рє уменьшению числа электронных вакансий РІ твердом никеле РїРѕ сравнению СЃ газообразным, чем Рё объясняется определенное значение: 0 6 вакансий или 0 6 неспаренных электронов РЅР° атом никеля. Если принять, что спаривание d — электронов возрастает СЃРѕ сближением атомов РІ сплаве Рё является линейной функцией РѕС‚ концентрации никеля, то число вакансий РЅР° атом никеля можно считать равным 2 — ( 2 — — 0 6) ат. [27]
При достижении таких расстояний возможен процесс образования металлических связей, т.е.
появление коллективных электронов двух соединяемых поверхностей и их взаимодействие с положительно заряженными ионами кристаллических решеток. [28]
РџРѕРґ схватыванием металлов обычно понимают явление образования адгезионных металлических связей между микроучастками поверхностей контактирующих тел РїСЂРё сближении РёС… РЅР° расстояния РїРѕСЂСЏРґРєР° межатомных. Схватывание металлических поверхностей РїСЂРѕРёСЃС…РѕРґРёС‚ РїСЂРё различных условиях трения: между одинаковыми Рё различными материалами, РЅР° РІРѕР·РґСѓС…Рµ, РІ газовых Рё жидких средах РїСЂРё высоких Рё отрицательных температурах. Наиболее интенсивно схватывание развивается РІ вакууме, Р° также РІ нейтральных Рё восстановительных газовых средах. Установлено, что пластическая деформация металла РІ Р·РѕРЅРµ контакта — необходимое условие возникновения Рё развития узлов ( мостиков) схватывания. Такая активизация поверхности контактирующих тел способствует развитию процесса схватывания. [29]
Соединение металлов происходит в твердом состоянии вследствие образования металлических связей на свариваемых поверхностях при их совместном деформировании. [30]
Страницы: 1 2 3 4
Металлическая связь
В
атомах металлов внешние валентные
электроны удерживаются значительно
слабее, чем в атомах неметаллов. Это
обуславливает потерю связи электронов
с отдельными атомами на достаточно
большой промежуток времени и их
обобществление.
Образуется обобществленный
ансамбль из внешних электронов.
Существование подобной электронной
системы приводит к возникновению сил,
которые удерживают положительные ионы
металла в сближенном состоянии, несмотря
на их одноименную заряженность.
Такая
связь называется металлической. Подобная
связь характерна только для металла и
существует в твердом и жидком состоянии
вещества. Металлическая связь является
одним из видов химической связи.
Она
основана на обобществлении внешних
электронов, которые теряют связь с
атомом и поэтому называются свободными
электронами (рис. 7).
Подтверждением
существования металлической связи
являются следующие факты. Все металлы
имеют высокую теплопроводность и высокую
электропроводность, которая обеспечивается
за счет наличия свободных электронов.
Кроме того, это же обстоятельство
определяет хорошую отражательную
способность металлов к световому
облучению, их блеск и непрозрачность,
высокую пластичность, положительный
температурный коэффициент
электросопротивления.
Стабильность
кристаллической решетки металлов
невозможно объяснить такими видами
связи как ионная и ковалентная.
Ионная
связь между атомами металла, находящихся
в узлах кристаллической решетки,
невозможна, так как они имеют один и тот
же заряд.
Ковалентная связь между атомами
металла также маловероятна, поскольку
каждый атом имеет от 8 до 12 ближайших
соседей, а образование ковалентных
связей с таким количеством обобществленных
пар электронов неизвестно.
Рис.
7. Металлическая связь.
Между
металлической и ковалентной связью
имеется сходство. Оно заключается в
том, что оба типа связи основаны на
обобществлении валентных электронов.
Однако ковалентная связь соединяет
только два соседних атома, и общие
электроны находятся в непосредственной
близости от соединенных атомов. В
металлической связи несколько атомов
участвуют в обобществлении валентных
электронов.
Таким
образом, понятие металлической связи
неразрывно связано с представлением о
металлах как совокупности положительно
заряженных ионных остовов с большими
промежутками между ионами, заполненными
электронным газом, при этом на
макроскопическом уровне система остается
электрически нейтральной.
Водородная связь
Связь,
которая образуется между атомов водорода
одной молекулы и атомом сильно
электроотрицательного элемента (O,
N,
F)
другой молекулы, называется водородной
связью.
Атомный
радиус водорода очень мал. Кроме того,
при смещении или полной отдаче своего
единственного электрона водород
приобретает сравнительно высокий
положительный заряд, за счет которого
водород одной молекулы взаимодействует
с атомами электроотрицательных элементов,
имеющих частичный отрицательный заряд,
выходящий в состав других молекул (HF,
H2O,
NH3).
Водородную
связь принято обозначать точками. Она
гораздо более слабая, чем ионная или
ковалентная связь, но более сильная,
чем обычное межмолекулярное взаимодействие.
Наличие
водородных связей объясняет увеличения
объема воды при понижении температуры.
Это связано с тем, что при понижении
температуры происходит укрепление
молекул и поэтому уменьшается плотность
их «упаковки».
открытый урок на тему "Металлическая связь"
- Урок химии в 8 классе по теме «Металлическая химическая связь» (с использованием технологии критического мышления).
- Цели урока:
- Образовательные:
- познакомить учащихся с металлической связью, знать определение металлической связи;
- уметь объяснять свойства металлов, исходя из типа химической связи, находить черты сходства и различия ее с ковалентной и ионной связью;
- Развивающие:
- создание условий для развития умения самостоятельно приобретать знания, используя различные источники информации;
- развитие критического мышления, памяти, внимания, наблюдательности.
- Воспитательная: воспитание положительной мотивации учения, правильной самооценки и чувства ответственности.
Тип урока: — изучение нового материала. Оборудование: ПК, медиапроектор, на доске — формулы веществ на магнитах, на каждом столе у учащихся – мини-лекция, образцы металлов и сплавов, листки чистой бумаги, бланк с заданиями.
Ход урока
1.
Стадия вызова — Добрый день, ребята! Садитесь. Мне приятно видеть вас снова на уроке химии.
— Я уверена, что наша работа будет плодотворной. Вы все сможете достигнуть положительного результата в учебном труде. Вы все успешны. Но для этого надо трудиться. Как сказал Плавт, римский драматург: «Кто хочет съесть ядро ореха, должен расколоть его скорлупу» (слайд 1)
- СОСТАВЛЕНИЕ КЛАСТЕРА ( ПУЧОК)
- Задачи этой стадии:
- самостоятельное определение учащимися направлений в изучении темы, тех ее аспектов, которые хотелось бы обсудить и осмыслить;
- самостоятельная актуализация по теме и пробуждение познавательной активности;
на этой фазе работы заслушивается коллективное мнение, знание об этом понятии и выявляются остаточные знания.На этом этапе не дается оценка знаний. Но кластер пока с доски не стирается.
Учитель ставит перед ребятами вопрос: « А соответствуют ли ваши представления научным понятиям?» и ставит учебную задачу.
Учитель: Что мы изучаем с вами в течение нескольких уроков? Ученики: Химическую связь.
Учитель: Что мы знаем о химической связи? Ученики: Типы химических связей, их механизмы образования .
Учитель: Какие типы химических связей мы изучили? Ученики: Ионную и ковалентную: неполярную и полярную.
Учитель: Какую химическую связь называют ионной? Ковалентной? Какая связь называется ковалентной неполярной и полярной? Ученики дают определение типам связи.
Учитель: Ребята, на доске даны формулы веществ распределите их по типам связи. Формулы веществ: NaCl , O2 , HCl , Na , K2S , H2S, Mg , H2 ,Al .
У каких веществ вы затруднились определить тип химической связи? Что это за вещества, определите по периодической системе? А если образуется простое вещество металл? Какой вид связи может быть в этих веществах?
- (предположение: металлическая)
- Верно. И тема урока сегодня: «Металлическая химическая связь» (Слайд 2)(запись в тетрадях)
- Химическая связь
- ↓
- Типы химической связи
- ↙ ↓ ↘
- ? Ионная Ковалентная
- Металлическая ↙ ↘
Неполярная Полярная Учитель: Ребята, у вас на столах лежат образцы металлов и сплавов. Внимательно рассмотрите их.
– Вы уже знаете, как взаимодействуют между собой атомы металлов и неметаллов, а также атомы неметаллов между собой.– Сегодня мы рассмотрим, как будут взаимодействовать атомы металлов между собой. Почему металлы существуют в виде слитка, куска или металлического изделия?– Что удерживает атомы металла в единое целое?
– Какими свойствами обладают металлы и от чего они зависят – мы с вами должны ответить на этом уроке (
Слайд 3)– Целью нашего урока является: (Слайд 4)
- Сформировать понятие о металлической связи.
- Изучить механизм образования связи.
- Познакомиться со свойствами металлов.
- 2.
СТАДИЯ ОСМЫСЛЕНИЯ
Учащимся предлагается новая информация, которую они должны отработать.
Задачи этой стадии:
- организация активной работы с информацией, увязать их уже с имеющимися знаниями
- активно отслеживать свое понимание (каждому)
Эта технология связана с текстом и письмом. Требования к тексту: 7-10 минут прочтения.
Текст-это последовательность осмысленных высказываний, передающих информацию, объединенных общей темой, обладающих свойствами связности и целостности. Текст должен быть адаптирован, Читая текст, обсуждают в парах, взаимоопрос.
Мини-лекция.
Металлы – это элементы 1-3 групп главных подгрупп, а также всех побочных подгрупп периодической системы. Они хорошо проводят электрический ток. С чем это связано? Чтобы ответить на этот вопрос, необходимо установить особенности их строения. Что мы сегодня и сделаем.
Атомы металлов на внешнем энергетическом уровне имеют небольшое число электронов, поэтому они стремятся их отдать. Хорошо, если есть неметалл, который их примет. А если его нет, что тогда?
В куске металла, слитке или металлическом изделии атомы металла отдают внешние электроны и посылают их в этот кусок, слиток или изделие, превращаясь при этом в положительные ионы.
«Оторвавшиеся» электроны перемещаются от одного иона к другому, временно снова соединяются с ними в атомы, снова отрываются. И этот процесс происходит непрерывно. В куске металла существуют то атомы, то ионы. Их так и называют атом-ионы.
Здесь же присутствуют и свободные электроны, которые могут выступать в роли переносчиков электрических зарядов.
А схему образования металлической связи можно записать так: Ме0 – ne- ←→ Mеn+ атомы ионы металла металла
, где n – число внешних электронов, участвующих в образовании связи.
Наблюдается этот вид связи в металлах – простых веществах и сплавах. Таким образом, металлической называется связь в металлах и сплавах между атом-ионами посредством обобществленных внешних электронов.
Металлическая связь имеет некоторое сходство с ковалентной связью, так как основана на обобществлении внешних электронов.
Однако при образовании ковалентной связи обобществляются внешние неспаренные электроны только двух соседних атомов, в то время как при образовании металлической связи в обобществлении этих электронов участвуют все атомы.
Именно поэтому кристаллы с ковалентной связью хрупки, а с металлической, как правило, тверды, пластичны, электропроводны, теплопроводны и имеют металлический блеск.
Вопросы для обсуждения: 1.Для каких веществ характерна металлическая связь? 2.
Какие частицы участвуют в ее образовании? 3.Как образуется металлическая связь? 4. Запишите в тетрадях схему образования металлической связи. 5.Какие свойства характерны для металлов? 6.В следующих предложениях вставьте пропущенные слова и выражения: «Связь в …………. и ……… между …………. посредством ……………………. электронов называют …………………… .(запишите в тетрадях)
3. СТАДИЯ РЕФЛЕКСИИ – ОСМЫСЛЕНИЕ
Учитель: Итак , ребята возвращаемся к нашей схеме. Какой тип химической связи характерен для данных веществ? Какие частицы участвуют в образовании этой связи? Этот процесс можно представить следующим образом:
(демонстрация слайдов 5-8 презентации)
Дайте определение металлической химической связи. (слайд 9) А сейчас я предлагаю закрепить изученный материал, работая по карточкам. Для организации работы воспользуйтесь алгоритмом. Время на работу 4-5 минут.
Карточка по видам химической связи
| Вариант I | Вариант II | Вариант III | Вариант IV | |
| 1 | CO2 | O2 | NaCl | Са |
| 2 | К2О | NO | К | Br2 |
| 3 | H2 | Na | SiН3 | Са2Р3 |
| 4 | Mg | КI | N2 | NH3 |
- Алгоритм работы с карточкой
- Из предложенных в карточке формул веществ выбери формулу простого вещества металла.
- Запиши схему образования металлической химической связи для выбранного вещества.
- Обсуди полученные результаты с соседом по парте.
— Давайте проверим полученные результаты. Желающие работают у доски. (работа у доски)
— Проверим правильность выполнения задания. (демонстрация слайда 10)
— А как будет у алюминия? Попробуйте каждый самостоятельно в тетради, а …выполнит работу у доски.
— Проверим результат (демонстрация слайда 11)
— Особенности металлической связи мы рассмотрели. Ребята еще раз рассмотрите выданные вам образцы металлов и сплавов. Какими общими свойствами они обладают? (слайд12) Как вы думаете , чем обусловлены эти свойства? Правильно, металлической связью, а именно строением атома. То есть зная строение атома мы можем определить свойства вещества.
Молодцы. Я с вами согласна (или несогласна).
— Для подведения итога работы по теме, я предлагаю вам выполнить задание в тестовой форме, чтобы проверить как вы усвоили материал урока.
(индивидуальная работа по карточкам с тестовым заданием) Тест
1.
Химическая связь – а) взаимодействие между атомами б) взаимодействие между молекулами в) взаимодействие между электронами 2. Связь в металлах и сплавах между атом-ионами посредством обобществленных внешних электронов, называется а) ковалентной б) ионной в) металлической 3.Положительно заряженный ион – это а) катион б) анион в) электрон 4. Вещество, молекула которого образована посредством металлической связи: а) H2 – водород б) Na – натрий в) H2S – сероводород. 5) Схема образования металлической химической связи: а) Э0 – nе- → Эn+ б) Э0 + nе- → Эn- в) Э0 – nе- ←→ Эn+
(проверка по слайду)
— Обменяйтесь своими работами и проверьте правильность выполнения заданий, используя ключ на экране.
— Кто смог ответить на все вопросы? Вы молодцы!
- — На этом знакомство с металлической связью мы заканчиваем.
- Запишите задание на дом. (слайд)
- — И в завершении урока попробуйте проанализировать свою работу по желанию, начиная словами: Я научился- Я освоил- Я затрудняюсь- Я не смог- (слайд)
— Вы сегодня молодцы. Все смогли подняться еще на ступеньку выше в своих знаниях химии. Раскололи скорлупу ореха. Я благодарю вас за работу. До свидания.






