- Виды оксидов
- Номенклатура оксидов
- Названия некоторых оксидов: таблица
- 2. Взаимодействие с кислотными оксидами и кислотами
- Химические свойства кислотных оксидов
- 1. Взаимодействие с водой
- 3. Взаимодействие с амфотерными оксидами и гидроксидами
- 2. Окисление простых веществ — неметаллов
- 3. Разложение гидроксидов
- 4. Окисление сложных веществ
- Классы неорганических соединений
- 1. Идем по синим стрелочкам
- 2. Идем по зеленым стрелочкам
- 3. Идем по желтым стрелочкам
- Обсуждение: «Классы неорганических соединений»
- Оксиды их классификация, способы получения и химические свойства (таблица, схема)
- Схема классификация оксидов
- Таблица классификация оксидов с примерами
- Способы получения оксидов таблица
- Химические свойства оксидов таблица
- Таблица оксидов
- Таблица оксидов (1 часть):
- Таблица оксидов (2 часть):
- Таблица оксидов (3 часть):
Оксиды — это сложные вещества, состоящие из двух химических элементов (т. е. бинарные соединения), один из которых — кислород в степени окисления −2.
Общая формула оксидов: ЭxOy, где Э – химический элемент, а x и y — индексы, определяемые степенью окисления химических элементов.
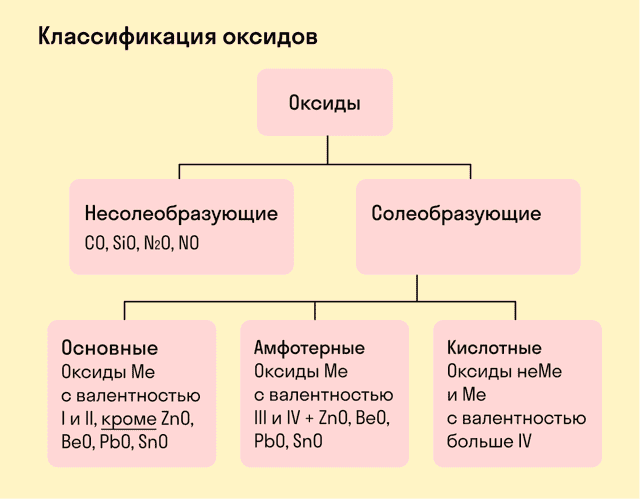
Виды оксидов
- Все оксиды делятся на солеобразующие и несолеобразующие.
- Несолеобразующие оксиды — это оксиды, которые не взаимодействуют с кислотами и щелочами, то есть не способны образовать соли.
- К несолеобразующим оксидам относят: CO, SiO, N2O, NO.
- Солеобразующие оксиды — это оксиды, которые взаимодействуют с кислотами и щелочами с образованием солей.
- Солеобразующие оксиды делятся на три группы:
-
Основные оксиды — это оксиды, образованные металлами со степенью окисления +1 или +2.
Примеры основных оксидов: Na+12O, Ca+2O, Ba+2O.
-
- Амфотерные оксиды — оксиды, образованные металлами со степенью окисления +3 или +4.
- К амфотерным оксидам относят также: ZnO, BeO, PbO, SnO.
- Несмотря на то, что эти металлы проявляют степень окисления +2 в данных соединениях, их оксиды проявляют амфотерные свойства.
- Примеры амфотерных оксидов: Al+32O3, Fe2+3O3.
-
Кислотные оксиды — оксиды, образованные металлами с валентностью V и более или неметаллами с любой валентностью (за исключением несолеобразующих оксидов, то есть CO, SiO, N2O, NO).
Примеры кислотных оксидов: S+6O3, N2+5O5, Mn2+7O7.
Если один и тот же химический элемент образовывает несколько оксидов, то с увеличением степени окисления основные свойства оксидов ослабевают и усиливаются кислотные.
Например:
- CrO (оксид хрома (II)) — проявляет основные свойства;
- Cr2O3 (оксид хрома (III)) — проявляет амфотерные свойства;
- CrO3 (оксид хрома (VI)) — проявляет кислотные свойства.
Закрепим знания о типах оксидов, изучив схему:
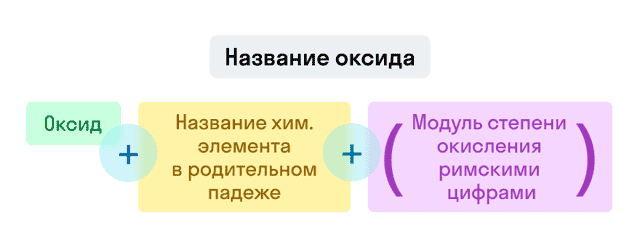
Номенклатура оксидов
Названия оксидов строятся по систематической номенклатуре следующим образом:
-
Пишем слово «оксид».
-
Указываем название второго химического элемента в родительном падеже.
-
Если этот элемент имеет переменную валентность, то указываем валентность элемента в этом соединении в скобках римской цифрой.
Примеры названий оксидов:
- Fe2O3 — оксид железа (III). Читается: феррум два о три.
- Na2O — оксид натрия. Читается: натрия два о.
- SO3 — оксид серы (VI). Читается: эс о три.
До появления систематической номенклатуры вещества называли по присущим им специфическим свойства (цвету, запаху и т. д.). Такой способ названия веществ — тривиальная номенклатура. Некоторые названия используются и сейчас.
Названия некоторых оксидов: таблица
| H2O | Вода | Оксид водорода |
| CO2 | Углекислый газ | Оксид углерода (IV), диоксид углерода |
| CO | Угарный газ | Оксид углерода (II), монооксид углерода |
| SO3 | Серный газ | Оксид серы (VI), триоксид серы |
| SO2 | Сернистый газ | Оксиды серы (IV), диоксид серы |
| SiO2 | Кварц, горный хрусталь, песок кварцевый, речной и морской | Оксид кремния |
| Al2O3 | Глинозем | Оксид алюминия |
| Fe2O3 | Гематит (крокус) | Оксид железа (III) |
| CaO | Негашеная известь | Оксид кальция |
С водой способны реагировать оксиды тех металлов, которым соответствуют растворимые гидроксиды. То есть с водой реагируют только оксиды щелочных и щелочноземельных металлов.
Оксид магния взаимодействует с водой только при нагревании.
2. Взаимодействие с кислотными оксидами и кислотами
Основные оксиды, соответствующие щелочам, взаимодействуют со всеми кислотными оксидами и кислотами. Оксиды неактивных металлов взаимодействуют только с кислотными оксидами, соответствующими сильным кислотам, или с сильными кислотами.
В эту реакцию могут вступать только основные оксиды щелочных или щелочноземельных металлов. При сплавлении двух оксидов образуется соль.
Как составлять такие соли: металл в этой соли берем из основного оксида, а кислотный остаток из амфотерного оксида (они проявляют более кислотные свойства).
Химические свойства кислотных оксидов
1. Взаимодействие с водой
Кислотные оксиды взаимодействуют с водой с образованием соответствующих кислот. За исключением SiO2, которому соответствует нерастворимая кремниевая кислота.
Кислотные оксиды сильных кислот способны взаимодействовать с любыми основными оксидами или основаниями.
Кислотные оксиды, соответствующие слабым кислотам (такие как CO2, SO2), способны взаимодействовать с основными оксидами, соответствующим щелочам, а также с щелочами.
3. Взаимодействие с амфотерными оксидами и гидроксидами
С амфотерными оксидами в реакцию вступают кислотные оксиды — как правило, сильных кислот.
Амфотерные оксиды не взаимодействуют с водой — даже при нагревании!
Амфотерные оксиды взаимодействуют только с сильными и средними кислотами и их оксидами.
Амфотерные оксиды взаимодействуют только с теми оксидами, которые соответствуют щелочам. Реакция протекает только в расплаве, так как в растворе такие оксиды взаимодействуют преимущественно с водой с образованием щелочей.
Продукты взаимодействия амфотерных оксидов со щелочами зависят от условий проведения реакции. В растворе образуются комплексные соли, а при сплавлении – средние соли.
Почти все металлы окисляются кислородом до устойчивых степеней окисления.
Например: 4Al + 3O2 = 2Al2O3
Не взаимодействуют с кислородом: платина, золото и палладий.
- Металлы с переменной степенью окисления, как правило, образуют соединения в степени окисления +3:
- 4Cr + 3O2 = 2Cr2O3
- При взаимодействии щелочных металлов (элемента IA группы) образуются пероксиды Me2O2 или надпероксиды MeO2, где Ме — щелочной металл.
2. Окисление простых веществ — неметаллов
- При окислении неметаллов в избытке кислорода, как правило, образуются высшие оксиды (это оксиды, в которых неметалл проявляют высшую степень окисления):
- 4P + 5O2 (избыток) = 2P2O5
- При недостаточном количестве кислорода образуются оксиды неметаллов в промежуточной степени окисления:
- 4P + 3O2 (недостаток) = 2P2O3
- Существуют и исключения. Например, сера окисляется лишь до оксида серы (IV) даже в избытке кислорода:
- S + O2 = SO2
- Или азот, который взаимодействует с кислородом только при температуре 2 000̊С или под действием электрического разряда с образованием оксида азота (II):
- N2 + O2 = 2NO
Галогены (элементы VIIA группы) вовсе не взаимодействуют с кислородом, так же как и инертные газы (элементы VIIIA группы).
3. Разложение гидроксидов
- Некоторые кислоты и гидроксиды неустойчивы и самопроизвольно разлагаются по схеме:
- Гидроксид (кислота) = оксид + вода
- Например:
- H2SO3 = SO2↑ + H2O
- H2CO3 = CO2↑ + H2O
- Ag(OH) = Ag2O + H2O
- NH4OH = NH3↑ + H2O
- Оксиды тяжелых металлов (нерастворимые гидроксиды) и кремниевая кислота разлагаются при нагревании по той же самой схеме.
- Например:
4. Окисление сложных веществ
- Сложные бинарные (состоящие из двух химических элементов) соединения окисляются с образованием двух оксидов этих элементов в устойчивых степенях окисления.
- Например:
- 2H2S + 3O2 = 2SO2 + 2H2O
- 4NH3 + 5O2 = 4NO + 6H2O
Также оксиды получают разложением солей, например, карбонатов, нитратов сульфатов и т. д.
Например, Li2CO3 = Li2O + CO2↑
Мы узнали, какие вещества в химии называют оксидами, какие бывают оксиды, а также разобрали свойства каждого вида. Осталось подкрепить теорию практикой — а сделать это можно на курсах по химии в онлайн-школе Skysmart!
Учёба без слёз
Пошаговый гайд от Екатерины Мурашовой о том, как перестать делать уроки за ребёнка и выстроить здоровые отношения с учёбой

Классы неорганических соединений
Это очень важная тема в неорганической химии и в учебниках, и в интернете, но здесь я хочу показать именно практическое применение классификации. Так что, давайте разбираться!
- Основные классы неорганических соединений:
- простые вещества;
- сложные вещества:
- оксиды;
- основания;
- кислоты;
- соли
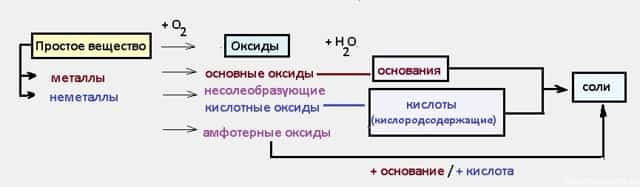
- Давайте сразу разберем эту схему на примерах:
- У нас есть простые вещества:
- металлы: Na, например
- неметаллы: S
При взаимодействии с кислородом (O2) образуются оксиды:
- из металлов образуются основные оксиды: 4Na + O2 = 2Na2O
- из переходных элементов (диагональ о Be к At) — амфотерные оксиды — Al2O3
- из неметаллов образуются кислотные оксиды — SO2
- также из неметаллов образуются несолеобразующие оксиды: 2С + O2 = 2CO
Названия оксидов очень логичны — из основных оксидов образуются основания — соединения с- OH — группой:
Na2O + H2O = NaOH
( Me(OH)x — общая формула. Х= степени окисления металла. Заряд группы -OH= -1)
- Систематическое названия — гидроксиды;
- Растворимые основания называются щелочи.
- Кислотные оксиды при взаимодействии с водой дают кислоты — соединения, у которых в начале молекулы стоит Н — водород: SO2 + H2O = H2SO3
- (Когда пишите уравнения взаимодействия, то просто складываете атомы: сначала H, потом неметалл, потом кислород)
- Кислоты и основания при взаимодействии друг с другом дают соли: 2NaOH + H2SO3 = Na2SO3 + 2H2O
Эта реакция называется реакцией нейтрализации, т.к. кислота и щелочь дают соль и воду — «нейтрализуется» действие каждого из реагентов.
- Амфотерные оксиды и несолеобразующие лучше разобрать отдельно… у них своя запутанная история ????
- Есть еще одна довольно удобная табличка по взаимодействиям основных классов неорганических соединений:
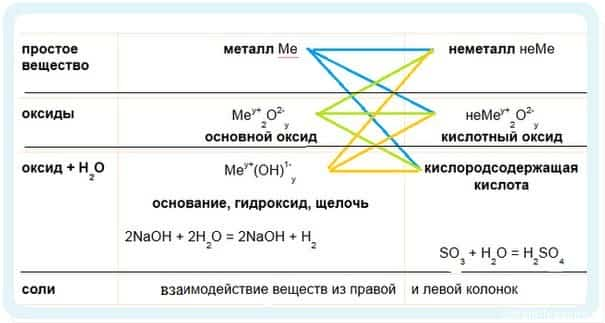
- Правый столбец — все, что относится к металлам и их соединениям.
- Левый столбец — неметаллы и их соединения.
- ВНУТРИ СТОЛБЦА РЕАКЦИИ НЕ ИДУТ!
- (есть некоторые исключения — например, реакции оксидов и металлов d-элементов)
Т.е. основной оксид с основанием взаимодействовать не будет: Na2O + NaOH —> реакция не идет
- кислота с кислотным оксидом взаимодействовать не будут: SO2 + H2SO3 —> реакция не идет
- ВЕЩЕСТВА ИЗ РАЗНЫХ СТОЛБЦОВ РЕАГИРУЮТ МЕЖДУ СОБОЙ
- Давайте эти реакции разберем подробнее…
1. Идем по синим стрелочкам
- 1. Металл + неметалл = соль:
- 2Na+ Cl2 = 2NaCl — хлорид натрия
- 2Na + S = Na2S — сульфид натрия
- 2.
металл + кислотный оксид = оксид металла + неметалл/несолеобразующий оксид:
- 2Na + CO2 = Na2O + CO
- Na + SO2 = Na2O + S
- здесь суть в том, что металл окисляется кислородом кислотного оксида, а оксид, соответственно, восстанавливается металлом.
- 3.
металл + кислота = соль + …
-
Здесь нам понадобится ряд активности металлов.
- Если металл стоит ДО ВОДОРОДА Н, то он вытесняет водород из кислот: 2Na + 2HCl =2 NaCl + H2
- Если металл стоит ПОСЛЕ ВОДОРОДА, то реакция идет без выделения H2: Сu + 4HNO3 = Cu(NO3)2 + NO2 +2 H2O
- 4. металл + соль = другая соль + другой металл
- И опят нам нужен ряд активности металлов. Только предыдущий металл может вытеснить последующий из его соли:
- 2Na + MgCl2 = 2NaCl + Mg
- Na + CaCl2 —> реакция не идет!
2. Идем по зеленым стрелочкам
- 1.
Основной оксид + неметалл = металл/ оксид с меньшей степенью окисления + кислотный оксид/ несолеобразующий оксид
- Na2O + S = 2Na + SO2
- Fe2O3 + C = 2FeO + CO
- здесь идет окислительно-восстановительный процесс — неметалл восстанавливает основной оксид, сам при этом окисляется
- 2. Основной оксид + кислотный оксид = соль
- Na2O + SO2 = Na2SO3 — сульфит натрия (просто «складываем» количество атомов ???? )
- 3. Основной оксид + соль —> реакция не идет
3. Идем по желтым стрелочкам
- 1. основание + неметалл =…
- Обычно такие реакции не идут. Исключение составляет NaOH и Cl2:
- 2. основание + кислотный оксид = соль
- 2NaOH + SO2 = Na2SO3 + H2O
- 3. основание + кислота = соль — РЕАКЦИЯ НЕЙТРАЛИЗАЦИИ
- NaOH + HCl = NaCl + H2O
- 4. основание + соль —> реакция идет, если образуется газ, осадок или малодиссоциирующее вещество
Как видите, в большинстве случаев реакции между веществами из двух столбцов приводят к образованию соли. Ну а исключения надо отдельно все разобрать, а некоторые выучить.
в ЕГЭ это задания:
- А7 — классификация органических и неорганических веществ.
- А8 — свойства простых веществ.
- А9 — химические свойства оксидов.
- А10 — свойства оснований и кислот.
- А11 — химические свойства солей.
- А12 — взаимосвязь неорганических соединений.
в ГИА (ОГЭ) по химии:
- А9 — Химические свойства простых веществ: металлов и неметаллов
- А10 — Химические свойства оксидов: основных, амфотерных, кислотных
- А11 — Свойства оснований и кислот
- А12 — Химические свойства солей (средних)
[TESTME 13]
Обсуждение: «Классы неорганических соединений»
(Правила комментирования)
Оксиды их классификация, способы получения и химические свойства (таблица, схема)
- Оксиды — это бинарные соединения кислорода, то есть сложные вещества, состоящие из двух элементов, один из которых является кислород.
- Э2+nOn-2 — общая формула оксидов, где
- n — степень окисления элемента
- -2 — степень окисления кислорода
- Названия оксидов составляется из слова «оксид» и названия элемента образующего оксид в родительном падеже (CaO — оксид кальция).
Схема классификация оксидов
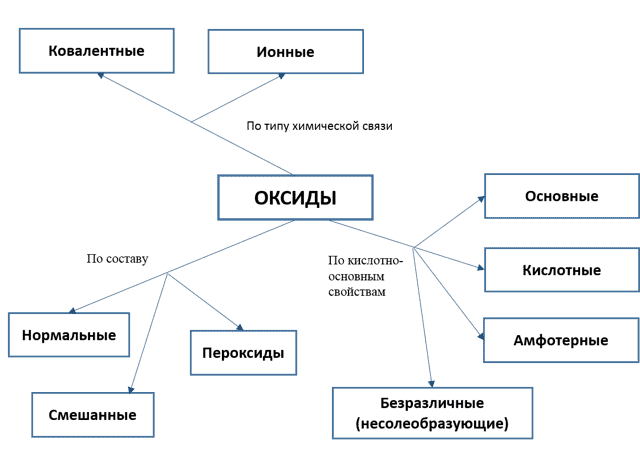
Таблица классификация оксидов с примерами
| Классификация оксидов | Определение | Примеры реакций | Типичные взаимодействия |
| Нормальные | Оксиды, в которых есть только связи между кислородом и каким-нибудь элементом | MgO, SO3, SiO2 | Смотрите свойства кислотных и основных оксидов |
| Пероксиды | Те, в которых есть связи между двумя атомами кислорода | Na2O2, H2O2 | Смотрите таблицу свойства пероксида водорода |
| Смешанные оксиды | Те, которые представляют собой смесь двух оксидов одного элемента в разных степенях окисления | Pb3O4 = 2РbО · PbO2 Fe3O4 = FeO · Fe2O3 | Обладают теми же свойствами, что и входящие в их составы оксиды |
| Кислотные или ангидриды | Оксиды, которые реагируют с водой, образуя кислоты; с основаниями и основными оксидами — образуют соли | SO3, SO2, Mn2O7 |
|
| Основные оксиды | Те, которые реагируют с водой, образуя основания; с кислотами и кислотными оксидами образуют соли | CaO, Na2O |
|
| Амфотерные оксиды | Те, которые в зависимости от условий проявляют свойства и кислотных, и основных оксидов | ZnO, Al2O3 |
|
| Безразличные (несолеобразующие) | Оксиды, которые не реагируют ни с кислотами, ни с основаниями. Солей не образуют | NO, N2O | NO + Н2O -/-> N2O + NaOH |
Способы получения оксидов таблица
Почти все хим. элементы образуют оксиды. На данный момент не получены оксиды гелия, неона и аргона.
| Способы получения оксидов | Примеры | Примечание |
| Взаимодействие простых веществ с кислородом | S + O2 → SO2 4Аl + 3O2 → 2Аl203 | Так получают преимущественно оксиды неметаллов |
| Термическое разложение оснований, солей, кислот |
|
Так получают преимущественно оксиды металлов |
| Взаимодействие простых веществ и солей с кислотами-окислителями |
|
Способ получения преимущественно оксидов неметаллов |
Химические свойства оксидов таблица
| Классификация оксидов | Химические свойства оксидов | Примеры реакции |
| Основные оксиды | 1. Основной оксид* + вода —> щелочь | К2О + Н2О → 2КОН, ВаО + Н2O → Ва(ОН)2 |
| 2. Основной оксид + кислота —> соль + вода | CuO + H2SO4 → CuSO4 + Н2О | |
| 3. Основной оксид + кислотный оксид —> соль | MgO + СО2 → MgCO3, ЗСаО + P2O5 → Ca3(PO4)2 | |
| Кислотные оксиды | 1. Кислотный оксид + вода —> кислота |
|
| 2. Кислотный оксид + щелочь —> соль + вода | SO3 + 2NaOH → Na2SO4+ Н2O | |
| 3. Кислотный оксид + основной оксид —> соль | SiO2 + CaO t→ CaSiO3, Р2O4 + ЗК2O → 2К3РО4 | |
| Амфотерные оксиды | 1. С кислотами реагируют как основные оксиды | ZnO + H2SO4 → ZnSO4 + Н2O |
| 2. С основаниями (щелочами) реагируют как кислотные оксиды | ZnO + 2NaOH → Na2ZnO2 + Н2O |

_______________
Источник информации: Насонова А.Е. Химия, школьная программа в таблицах и формулах, 1998
Таблица оксидов
Оксиды: основные оксиды, кислотные оксиды, амфотерные оксиды:
Оксид (именуемые также окисел, окись) – это бинарное соединение химического элемента с кислородом в степени окисления −2, в котором сам кислород связан только с менее электроотрицательным элементом.
Химический элемент кислород по электроотрицательности находится на втором месте после фтора, поэтому к оксидам относятся почти все соединения химических элементов с кислородом. Исключение составляет, например, дифторид кислорода OF2.
В зависимости от химических свойств различают:
— солеобразующие оксиды:
- основные оксиды. К ним относятся оксиды металлов, степень окисления которых +1, + 2;
- кислотные оксиды. К ним относятся оксиды металлов со степенью окисления +5, + 6, + 7, и оксиды неметаллов;
- амфотерные оксиды. К ним относятся оксиды металлов со степенью окисления +3, +4, и оксиды-исключения: ZnO, BeO, SnO, PbO;
— несолеобразующие оксиды: оксид углерода (II) СО, оксид азота (I) N2O, оксид азота (II) NO, оксид кремния (II) SiO и оксид серы (II) SO.
В зависимости от количества атомов элементов в оксиде, кроме кислорода различают:
— простые, включающие в молекулу атомы одного элемента, кроме кислорода, и находящихся в в одной степени окисления. Например, оксид лития Li2O.
— сложные оксиды, включающие в молекулу атомы двух и более элементов, кроме кислорода. Например, оксид лития-кобальта (III) Li2O·Co2O3;
— двойные оксиды, в которые атомы одного и того же элемента входят в двух или более степенях окисления. Например, оксид марганца (II, IV) Mn5O8. Во многих случаях такие оксиды могут рассматриваться как соли кислородсодержащих кислот.
Таблица оксидов (1 часть):
| Атомный номер | Химический элемент | Символ | Оксиды |
| 1 | Водород | H | H2O (вода) |
| 2 | Гелий | He | нет |
| 3 | Литий | Li | Li2O (оксид лития) |
| 4 | Бериллий | Be | BeO (оксид бериллия) |
| 5 | Бор | B | B2O3 (оксид бора (III)) |
| 6 | Углерод | C | CO (оксид углерода (II), монооксид углерода, угарный газ),
|
| 7 | Азот | N | N2O (оксид азота (I), закись азота, оксонитрид азота, веселящий газ),
|
| 8 | Кислород | O | — |
| 9 | Фтор | F | нет |
| 10 | Неон | Ne | нет |
| 11 | Натрий | Na | Na2O (оксид натрия) |
| 12 | Магний | Mg | MgO (оксид магния) |
| 13 | Алюминий | Al | Al2O3 (оксид алюминия) |
| 14 | Кремний | Si | SiO (оксид кремния (II), монооксид кремния), SiO2 (оксид кремния (IV), диоксид кремния, кремнезём) |
| 15 | Фосфор | P | P4O (монооксид тетрафосфора),
|
| 16 | Сера | S | SO (оксид серы (II), монооксид серы, моноокись серы), SO2 (оксид серы (IV), диоксид серы, двуокись серы, сернистый газ, сернистый ангидрид), SO3 (оксид серы (VI), трёхокись серы, серный газ, ангидрид серной кислоты) |
| 17 | Хлор | Cl | Cl2O (оксид хлора (I), гемиоксид хлора, ангидрид хлорноватистой кислоты),
|
| 18 | Аргон | Ar | нет |
| 19 | Калий | K | K2O (оксид калия) |
| 20 | Кальций | Ca | CaO (оксид кальция, окись кальция, негашёная известь, в просторечии — кирабит, кипелка) |
| 21 | Скандий | Sc | Sc2O3 (оксид скандия, сесквиоксид скандия) |
| 22 | Титан | Ti | TiO (оксид титана (II)), Ti2O3 (оксид титана(III), трёхокись титана), TiO2 (оксид титана (IV), диоксид титана, двуокись титана, титановые белила) |
| 23 | Ванадий | V | VO (оксид ванадия (II), окись ванадия),
|
| 24 | Хром | Cr | CrO (оксид хрома (II), закись хрома),
|
| 25 | Марганец | Mn | MnO (оксид марганца (II), окись марганца, монооксид марганца),
|
| 26 | Железо | Fe | FeO (оксид железа (II), закись железа),
|
| 27 | Кобальт | Co | CoO (оксид кобальта (II), окись кобальта),
|
| 28 | Никель | Ni | NiO (оксид никеля (II), окись никеля, бунзенит), Ni2O3 (оксид никеля (III), окисел никеля; сесквиоксид никеля) |
| 29 | Медь | Cu | Cu2O (оксид меди (I), гемиоксид меди, оксид димеди, закись меди, куприт), CuO (оксид меди (II), окись меди), Cu2O3 (оксид меди (III), триоксид димеди) |
| 30 | Цинк | Zn | ZnO (оксид цинка, окись цинка) |
| 31 | Галлий | Ga | Ga2O (оксид галлия (I), закись галлия, гемиоксид галлия), Ga2O3 (оксид галлия (III)) |
| 32 | Германий | Ge | GeO (оксид германия (II), окись германия), GeO2 (оксид германия (IV), диоксид германия, двуокись германия) |
| 33 | Мышьяк | As | As2O3 (оксид мышьяка (III), триоксид мышьяка), As2O5 (оксид мышьяка (V), пентоксид мышьяка) |
| 34 | Селен | Se | SeO2 (оксид селена (IV), диоксид селена, двуокись селена, доунеит, селенолит), SeO3 (оксид селена (VI), триоксид селена, селеновый ангидрид) |
| 35 | Бром | Br | Br2O (оксид брома, оксид брома (I), окись брома, ангидрид бромноватистой кислоты) |
Таблица оксидов (2 часть):
| 36 | Криптон | Kr | нет |
| 37 | Рубидий | Rb | Rb2O (оксид рубидия, окись рубидия) |
| 38 | Стронций | Sr | SrO (оксид стронция, окись стронция) |
| 39 | Иттрий | Y | Y2O3 (оксид иттрия, сесквиоксид иттрия) |
| 40 | Цирконий | Zr | ZrO2 (оксид циркония (IV), оксид циркония, диоксид циркония) |
| 41 | Ниобий | Nb | NbO (оксид ниобия (II), окись ниобия),
|
| 42 | Молибден | Mo | Mo2O3 (оксид молибдена (III), окись молибдена),
|
| 43 | Технеций | Tc | TcO2 (оксид технеция (IV), окись технеция (IV)), Tc2O7 (оксид технеция (VII), окись технеция (VII)) |
| 44 | Рутений | Ru | Ru2O3 (оксид рутения (III), окись рутения (III), сесквиоксид рутения), RuO2 (оксид рутения(IV), окись рутения (IV)), RuO4 (оксид рутения(VIII), тетраоксид рутения) |
| 45 | Родий | Rh | RhO (оксид родия (II), окисел родия), Rh2O3 (оксид родия (III), сесквиоксид родия), RhO2 (оксид родия (IV), окисел родия) |
| 46 | Палладий | Pd | PdO (оксид палладия (II), окись палладия), Pd2O3•n H2O (оксид палладия (III), окисел палладия), PdO2 (оксид палладия (IV), окисел палладия) |
| 47 | Серебро | Ag | Ag2O (оксид серебра (I)), Ag+1Ag+3O2 или Ag2O2 (оксид серебра (I,III), оксид серебра (III)-серебра (I), монооксид серебра, диоксид дисеребра) |
| 48 | Кадмий | Cd | Cd2O (оксид кадмия (I)), CdO (оксид кадмия (II)) |
| 49 | Индий | In | In2O (оксид индия (I), окись индия (I), гемиоксид индия, закись индия), InO (оксид индия (II), окись индия (II)), In2O3 (оксид индия (III)) |
| 50 | Олово | Sn | SnO (оксид олова (I), монооксид олова, олово окись (II), олово закись, олово одноокись), SnO2 (оксид олова (IV), окись олова, двуокись олова, диоксид олова, касситерит), Sn3O4 |
| 51 | Сурьма | Sb | Sb2O3 (оксид сурьмы (III), сесквиоксид сурьмы, сурьмянистый ангидрид), Sb2O5 (оксид сурьмы (V), пятиокись сурьмы, сурмяный ангидрид), Sb2O4 или SbIIISbVO4 (тетраоксид сурьмы, диоксид сурьмы) |
| 52 | Теллур | Te | TeO2 (оксид теллура (IV), диоксид теллура, теллурит, двуокись теллура, ангидрид теллуристой кислоты),
|
| 53 | Йод | I | I+12O (монооксид дийода),
|
| 54 | Ксенон | Xe | |
| 55 | Цезий | Cs | |
| 56 | Барий | Ba | |
| 57 | Лантан | La | |
| 58 | Церий | Ce | |
| 59 | Празеодим | Pr | |
| 60 | Неодим | Nd | |
| 61 | Прометий | Pm | |
| 62 | Самарий | Sm | |
| 63 | Европий | Eu | |
| 64 | Гадолиний | Gd | |
| 65 | Тербий | Tb | |
| 66 | Диспрозий | Dy | |
| 67 | Гольмий | Ho | |
| 68 | Эрбий | Er | |
| 69 | Тулий | Tm | |
| 70 | Иттербий | Yb |






