- Общая характеристика
- Природные соединения
- Получение
- Химические свойства
- Оксиды щелочноземельных металлов
- Получение
- Химические свойства
- Гидроксиды щелочноземельных металлов
- Получение
- Химические свойства
- Жесткость воды
- Щёлочноземельные металлы | это… Что такое Щёлочноземельные металлы?
- Физические свойства
- Химические свойства
- Нахождение в природе
- См. также
- Ссылки
- Литература
- II группа главная подгруппа Периодической таблицы Менделеева (щелочноземельные металлы)
- Взаимодействие со сложными веществами
- Итоговая контрольная работа по химии 9 класс
- Элементы 2-й группы: бериллий, магний, кальций, стронций, барий, радий
- Общие свойства магния, кальция и других элементов
К щелочноземельным металлам относятся металлы IIa группы: бериллий, магний, кальций, стронций, барий и радий. Отличаются легкостью, мягкостью и сильной реакционной способностью.
Общая характеристика
От Be к Ra (сверху вниз в периодической таблице) происходит увеличение: атомного радиуса, металлических, основных, восстановительных свойств, реакционная способность. Уменьшается электроотрицательность, энергия ионизация, сродство к электрону.
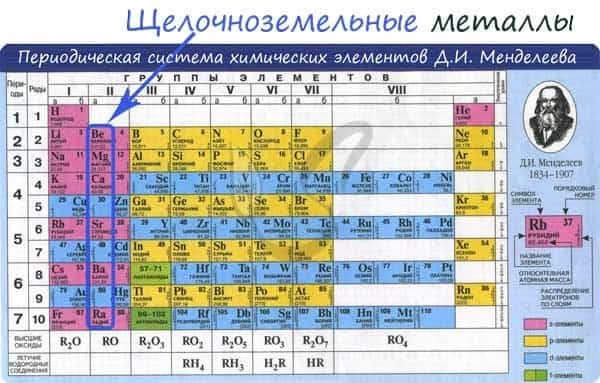
Электронные конфигурации у данных элементов схожи, так как они находятся в одной группе (главной подгруппе!), общая формула ns2:
- Be — 2s2
- Mg — 3s2
- Ca — 4s2
- Sr — 5s2
- Ba — 6s2
- Ra — 7s2
Природные соединения
В природе щелочноземельные металлы встречаются в виде следующих соединений:
- Be — BeO*Al2O3*6SiO2 — берилл
- Mg — MgCO3 — магнезит, MgO*Al2O3 — шпинель, 2MgO*SiO2 — оливин
- Ca — CaCO3 — мел, мрамор, известняк, кальцит, CaSO4*2H2O — гипс, CaF2 — флюорит

Получение
Это активные металлы, которые нельзя получить электролизом раствора. С целью их получения применяют электролиз расплавов, алюминотермию и вытеснением их из солей другими более активными металлами.
- MgCl2 → (t) Mg + Cl2 (электролиз расплава)
- CaO + Al → Al2O3 + Ca (алюминотермия — способ получения металлов путем восстановления их оксидов алюминием)
- MgBr2 + Ca → CaBr2 + Mg

Химические свойства
- Реакции с водой
- Реакции с кислотами
- Реакции с неметаллами
- Mg + O2 → MgO (оксид магния)
- Ca + I2 → CaI2 (йодид кальция)
- При нагревании реагируют с серой, азотом, водородом и углеродом.
- Mg + S → (t) MgS (сульфид магния)
- Ca + N2 → (t) Ca3N2 (нитрид кальция)
- Ca + H2 → (t) CaH2 (гидрид кальция)
- Ba + C → (t) BaC2 (карбид бария)
- С оксидами других металлов
Все щелочноземельные металлы (кроме бериллия и магния) реагируют с холодной водой с образованием соответствующих гидроксидов. Магний реагирует с водой только при нагревании. Ca + H2O → Ca(OH)2 + H2↑ 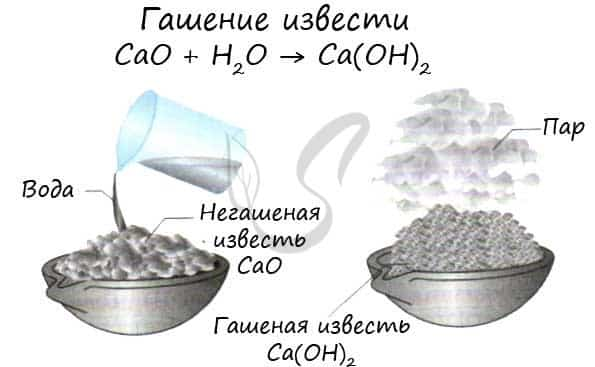
Щелочноземельные металлы — активные металлы, стоящие в ряду активности левее водорода, и, следовательно, способные вытеснить водород из кислот: Ba + HCl → BaCl2 + H2
Хорошо реагируют с неметаллами: кислородом, образуя оксиды состава RO, с галогенами (F, Cl, Br, I). Степень окисления у щелочноземельных металлов постоянная +2.

Ba + TiO2 → BaO + Ti (барий, как более активный металл, вытесняет титан)
Оксиды щелочноземельных металлов
Имеют общую формулу RO, например: MgO, CaO, BaO.
Получение
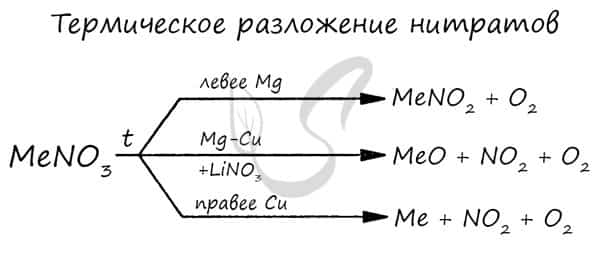
- Оксиды щелочноземельных металлов можно получить путем разложения карбонатов и нитратов:
- MgCO3 → (t) MgO + CO2
- Ca(NO3)2 → (t < 560°C) Ca(NO2)2 + O2
- Ca(NO3)2 → (t > 560°C) CaO + O2 + NO2
- Рекомендую взять на вооружение общую схему разложения нитратов:
Химические свойства
Проявляют преимущественно основные свойства, все кроме BeO — амфотерного оксида.
- Реакции с кислотами и кислотными оксидами
- BaO + HCl → BaCl2 + H2O
- CaO + H2SO4 → CaSO4 + H2O
- MgO + SO3 → MgSO4
- CaO + CO2 → CaCO3
- CaO + SiO2 → CaSiO3
- Реакция с водой
- В нее вступают все, кроме оксида бериллия.
- CaO + H2O → Ca(OH)2
- MgO + H2O → Mg(OH)2
- Амфотерный оксид бериллия
- BeO + HCl → BeCl2 + H2O
- BeO + NaOH + H2O → Na2[Be(OH)4] (тетрагидроксобериллат натрия)
- Если реакция проходит при высоких температурах (в расплаве) комплексная соль не образуется, так как происходит испарение воды:
- BeO + NaOH → Na2BeO2 + H2O (бериллат натрия)
- BeO + Na2O → Na2BeO2
Амфотерные свойства оксида бериллия требуют особого внимания. Этот оксид проявляет двойственные свойства: реагирует с кислотами с образованием солей, и с основаниями с образованием комплексных солей.
Гидроксиды щелочноземельных металлов
Проявляют основные свойства, за исключением гидроксида бериллия — амфотерного гидроксида.
Получение
Получают гидроксиды в реакции соответствующего оксида металла и воды (все кроме Be(OH)2)
CaO + H2O → Ca(OH)2
Химические свойства
- Основные свойства большинства гидроксидов располагают к реакциям с кислотами и кислотными оксидами.
- Ba(OH)2 + H2SO4 → BaSO4↓ + H2O
- Ca(OH)2 + 2CO2 → Ca(HCO3)2
- Ca(HCO3)2 + Ca(OH)2 → CaCO3 + H2O + CO2
- Ca(OH)2 + CO2 → CaCO3↓ + H2O

- Реакции с солями (и не только) идут в том случае, если соль растворимы и по итогам реакции выделяется газ, выпадает осадок или образуется слабый электролит (вода).
- Ba(OH)2 + Na2SO4 → BaSO4↓ + NaOH
- Гидроксид бериллия относится к амфотерным: проявляет двойственные свойства, реагируя и с кислотами, и с основаниями.
- Be(OH)2 + HCl → BeCl2 + H2O
- Be(OH)2 + NaOH → Na2[Be(OH)4]
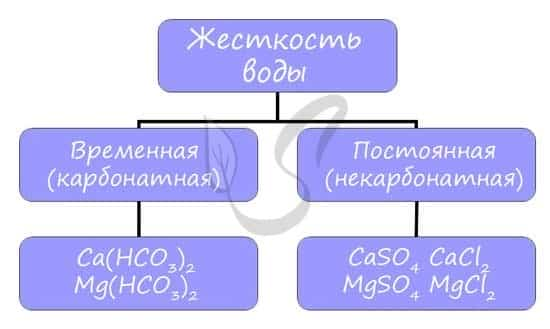
Жесткость воды
Жесткостью воды называют совокупность свойств воды, зависящую от присутствия в ней преимущественно солей кальция и магния: гидрокарбонатов, сульфатов и хлоридов.
Различают временную (карбонатную) и постоянную (некарбонатную) жесткость.
- Вероятно, вы часто устраняете жесткость воды у себя дома, осмелюсь предположить — каждый день. Временная жесткость воды устраняется обычным кипячением воды в чайнике, и известь на его стенках — CaCO3 — бесспорное доказательство устранения жесткости:
- Ca(HCO3)2 → CaCO3↓ + CO2 + H2O
- Также временную жесткость можно устранить, добавив Na2CO3 в воду:
- Ca(HCO3)2 + Na2CO3 → CaCO3↓ + NaHCO3
- С постоянной жесткостью бороться кипячением бесполезно: сульфаты и хлориды не выпадут в осадок при кипячении. Постоянную жесткость воды устраняют добавлением в воду Na2CO3:
- CaCl2 + Na2CO3 → CaCO3↓ + NaCl
- MgSO4 + Na2CO3 + H2O → [Mg(OH)]2CO3↓ + CO2↑ + Na2SO4
Жесткость воды можно определить с помощью различных тестов. Чрезмерно высокая жесткость воды приводит к быстрому образованию накипи на стенках котлов, труб, чайника.

Щёлочноземельные металлы | это… Что такое Щёлочноземельные металлы?
Щё́лочноземе́льные мета́ллы — химические элементы 2-й группы[1] периодической таблицы элементов: бериллий, магний, кальций, стронций, барий и радий[2][3]. Названы так потому, что их оксиды — «земли» (по терминологии алхимиков) — сообщают в воде щелочную реакцию. Соли щёлочноземельных металлов, кроме радия, широко распространены в природе в виде минералов. Происхождение этого названия связано с тем, что их гидроксиды являются щелочами, а оксиды по тугоплавкости сходны с оксидами алюминия и железа, носившими ранее общее название «земли
Физические свойства
Все щёлочноземельные металлы — серые, твёрдые при комнатной температуре вещества. В отличие от щелочных металлов, они существенно более твёрдые, и ножом преимущественно не режутся (исключение — стронций).
Плотность щёлочноземельных металлов с порядковым номером растёт, хотя явно рост наблюдается только начиная с кальция, который имеет минимальную среди них плотность (ρ = 1,55 г/см³), самый тяжёлый — радий, плотность которого примерно равна плотности железа.
Химические свойства
Щёлочноземельные металлы имеют электронную конфигурацию внешнего энергетического уровня ns², и являются s-элементами, наряду с щелочными металлами. Имея два валентных электрона, щёлочноземельные металлы легко их отдают, и во всех соединениях имеют степень окисления +2 (очень редко +1).
Химическая активность щёлочноземельных металлов растёт с ростом порядкового номера.
Бериллий в компактном виде не реагирует ни с кислородом, ни с галогенами даже при температуре красного каления (до 600 °C, для реакции с кислородом и другими халькогенами нужна ещё более высокая температура, фтор — исключение).
Магний защищён оксидной плёнкой при комнатной температуре и более высоких (до 650 °C) температурах и не окисляется дальше.
Кальций медленно окисляется и при комнатной температуре вглубь (в присутствии водяных паров), и сгорает при небольшом нагревании в кислороде, но устойчив в сухом воздухе при комнатной температуре. Стронций, барий и радий быстро окисляются на воздухе, давая смесь оксидов и нитридов, поэтому их, так же и как щелочные металлы (и кальций), хранят под слоем керосина.
Оксиды и гидроксиды щёлочноземельных металлов имеют тенденцию к усилению основных свойств с ростом порядкового номера: Be(OH)2 — амфотерный, нерастворимый в воде гидроксид, но растворим в кислотах (а также проявляет кислотные свойства в присутствии сильных щелочей), Mg(OH)2 — слабое основание, нерастворимое в воде, Ca(OH)2 — сильное, но малорастворимое в воде основание, Sr(OH)2 — лучше растворимо в воде, чем гидроксид кальция, сильное основание (щёлочь) при высоких температурах, близких к точке кипения воды (100 °C), Ba(OH)2 — сильное основание (щёлочь), по силе не уступающее KOH или NaOH, и Ra(OH)2 — одна из сильнейших щелочей, очень коррозионное вещество.
Нахождение в природе
Все щёлочноземельные металлы имеются (в разных количествах) в природе. Ввиду своей высокой химической активности все они в свободном состоянии не встречаются.
Самым распространённым щёлочноземельным металлом является кальций, количество которого равно 3,38 % (от массы земной коры). Немногим ему уступает магний, количество которого равно 2,35 % (от массы земной коры).
Распространены в природе также барий и стронций, которых соответственно 0,05 и 0,034 % от массы земной коры. Бериллий является редким элементом, количество которого составляет 6·10−4% от массы земной коры.
Что касается радия, который радиоактивен, то это самый редкий из всех щёлочноземельных металлов, но он в небольшом количестве всегда содержится в урановых рудах. В частности, он может быть выделен оттуда химическим путём. Его содержание равно 1·10−10% (от массы земной коры)[4].
См. также
Ссылки
- http://enc.mail.ru/article/74002900
Литература
II группа главная подгруппа Периодической таблицы Менделеева (щелочноземельные металлы)
- К щелочноземельным металлам относят химические элементы: двувалентные металлы, составляющие IIА группу:
- Бериллий Be
- магний Mg
- кальций Ca,
- стронций Sr,
- барий Ba и
- радий Ra.
- Хотя бериллий Be по свойствам больше похож на алюминий, а магний Mg проявляет некоторые свойства щелочноземельных металлов, но в целом отличается от них.
- Все щелочноземельные металлы — вещества серого цвета и гораздо более твердые, чем щелочные металлы.
Бериллий Be устойчив на воздухе. Магний и кальций (Mg и Ca) устойчивы в сухом воздухе. Стронций Sr и барий Ba хранят под слоем керосина.
От Be к Ra (сверху вниз в периодической таблице) происходит увеличение:
- атомного радиуса,
- металлических, основных, восстановительных свойств,
- реакционной способности.
Уменьшается
- электроотрицательность,
- энергия ионизация,
- сродство к электрону.
- Электронные конфигурации у данных элементов схожи, все они содержат 2 электрона на внешнем уровне ns2:
- Be — 2s2
- Mg —3s2
- Ca — 4s2
- Sr — 5s2
- Ba — 6s2
- Ra — 7s2
Как правило, щелочноземельные металлы в природе присутствуют в виде минеральных солей: хлоридов, бромидов, йодидов, карбонатов, нитратов и др.
Основные минералы, в которых присутствуют щелочноземельные металлы:
Магний
- Магний получают электролизом солей, чаще всего хлоридов: расплавленного карналлита (KCl·MgCl26H2O) или хлорида магния с добавками хлорида натрия при 720–750°С:
MgCl2 → Mg + Cl2
- восстановлением прокаленного доломита в электропечах при 1200–1300°С:
- 2(CaO · MgO) + Si → 2Mg + Ca2SiO4
- Кальций
- Кальций получают электролизом расплавленного хлорида кальция с добавками фторида кальция:
- CaCl2 → Ca + Cl2
- Барий
- Барий получают алюмотермическим способом — восстановление оксида бария алюминием в вакууме при 1200 °C:
- 4BaO+ 2Al → 3Ba + Ba(AlO2)2
Качественные реакции
- Окрашивание пламени солями щелочных металлов
Цвет пламени:
- Ca — кирпично-красный
- Sr — карминово-красный (алый)
- Ba — яблочно-зеленый
- Взаимодействие с веществами:
- С кислородом
- С кислородом взаимодействуют при нагревании с образованием оксидов
- 2Сa + O2 → 2CaO
- Видео Горение кальция
- С галогенами
- (F, Cl, Br, I)
- Щелочноземельные металлы реагируют с галогенамипри нагревании с образованием галогенидов .
- Сa + Cl2→ 2СaCl2
- С водородом
- Щелочноземельные металлы реагируют с водородом при нагревании с образованием гидридов:
- Сa + H2 СaH2
- Бериллий с водородом не взаимодействует.
- Магний реагирует только при повышенном давлении:
- Mg + H2 → MgH2
- С серой
- Щелочноземельные металлы при нагревании взаимодействуют с серой с образованием сульфидов сульфидов:
- Сa + S СaS
- Ca + 2C → CaC2 (карбиды)
- С азотом
- При комнатной температуре с азотом взаимодействует только магний с образованием нитрида:
- 6Mg + 2N2 → 2Mg3N2
- Остальные щелочноземельные металлы реагируют с азотом при нагревании.
- С углеродом
- Щелочноземельные металлы реагируют с углеродом с образованием карбидов, преимущественно ацетиленидов:
- Ca + 2C → CaC2
- Бериллий при нагревании с углеродом с образует карбид — метанид:
- 2Be + C → Be2C
- С фосфором
- Щелочноземельные металлы при нагревании взаимодействуют с фосфором с образованием фосфидов:
- 3Сa + 2P Сa3 P2
Взаимодействие со сложными веществами
- С водой
- Кальций, стронций и барий взаимодействуют с водой при комнатной температуре с образованием щелочи и водорода:
- Sr + 2H2O → Sr(OH)2 + H2↑,
- Магний реагирует с водой при кипячении, а бериллий с водой не реагирует.
- С кислотами
- С растворами HCl, H2SO4, H3PO4 щелочноземельные металлы взаимодействуют с образованием соли и выделением водорода:Са + H2SO4(разб)= СаSO4 + H2
- С кислотами-окислителями (HNO3 и конц. H2SO4):
- с концентрированной серной:
- 4Ca + 10H2SO4(конц) → 4CaSO4 + H2S↑ + 5H2O;
- с разбавленной и концентрированной азотной:
- 4Sr + 10HNO3(конц) → 4Sr(NO3)2 + N2O +5H2O
- С водными растворами щелочей
- В водных растворах щелочей растворяется только бериллий:
- Be + 2NaOH + 2H2O → Na2[Be(OH)4] + H2
- С солями
- В расплаве щелочноземельные металлы могут взаимодействовать с некоторыми солями:
- Ca + CuCl2 → CaCl2 + Cu
Запомните! В растворе щелочноземельные металлы взаимодействуют с водой, а не с солями других металлов.
- С оксидами
- Щелочноземельные металлы могут восстанавливать из оксидов такие неметаллы как кремний, бор, углерод:
- 2Ca + SiO2 → 2CaO + Si
- Магний сгорает в атмосфере углекислого газа с образованием оксида магния и сажи (С):
- 2Mg + CO2 → 2MgO + C
Итоговая контрольная работа по химии 9 класс
- Итоговая (стандартизированная) контрольная работа по химии
- за курс «Химия. 9 класс»
- Вариант № 1
- А1. Распределение электронов по энергетическим уровням 2е, 8е, 2е соответствует частице 1) Мg0 2) О2- 3) Мg2+ 4) S2-
- А2. В ряду элементов Na – Mg – Al — Si
-
уменьшаются радиусы атомов
-
уменьшается число протонов в ядрах атомов
-
увеличивается число электронных слоёв в атомах
-
уменьшается высшая степень окисления атомов в соединениях
А3. Фактор, не влияющий на скорость химических реакций,
-
природа реагирующих веществ
-
температура
-
концентрация реагирующих веществ
4)тип химической реакции
А4. Наиболее электропроводным металлом из перечисленных является
-
цинк 3) свинец
-
медь 4) хром
- А5. Металл, не относящийся к щёлочноземельным,
- 1)магний 3) стронций
- 2)кальций 4) барий
- А6. Наиболее активно реагирует с водой
-
скандий 3) калий
-
магний 4) кальций
А7. Агрегатное состояние иода при нормальных условиях
-
жидкое 2) твёрдое 3) газообразное
А8.Металл, с которым не взаимодействует концентрированная серная кислота,
1)железо 2)магний 3)цинк 4)натрий
Часть В. Тестовые задания на соответствие.
В1. Установите соответствие между реагирующими веществами и продуктами их взаимодействия.
- Реагирующие Продукты их
- вещества взаимодействия
- А) Cu +Cl2 1) Cu(OH)2 и Cl2
- Б) CuО + HCl 2) CuCl
- В) Cu 2О + HCl 3) CuCl2 и H2O
- 4) CuCl2
- 5) CuCl и H2O
В2. Установите соответствие между типами и уравнениями химических реакций.
- ТИПЫ ХИМИЧЕСКИХ РЕАКЦИЙ
- А) соединения, ОВР, необратимая
- Б) разложения, ОВР, эндотермическая
- В) соединения, ОВР, гомогенная
- УРАВНЕНИЯ РЕАКЦИЙ
-
N2(г) + 3H2(г) ↔ 2NH3(г) + Q
-
2КNO3 = 2KNO2 + O2 +Q
-
FeO + C → Fe + CO -Q
-
4Fe + 3O2 + 6H2O = 4Fe(OH)3
-
2Al + Fe2O3 = 2Fe + Al2O3 +Q
Часть С. Задания с развёрнутым ответом.
С1. Запишите уравнения реакций, с помощью которых можно осуществить превращения Zn → ZnCl2 → Zn(OH)2 → ZnO
Для перехода 2 запишите ионное уравнение.
С2. . К 34,8г сульфата калия прилили раствор, содержащий 83,2 г хлорида бария. Определите массу образовавшегося осадка. (5б).
С3.Расставьте коэффициенты в уравнении реакции с помощью электронного баланса. Cu +HNO3→Cu(NO3)2+NO +H2O.
Итоговая (стандартизированная) контрольная работа по химии за курс «Химия. 9 класс».
Вариант № 2
А1. Распределение электронов по энергетическим уровням 2е, 8е, 6е соответствует атому
-
углерода 3) фосфора
-
серы 4) хлора
А2. В ряду элементов С –N — О — F
-
уменьшается высшая степень окисления элементов в соединениях
-
увеличиваются радиусы атомов
-
уменьшается восстановительная способность простых веществ
-
увеличивается высшая степень окисления элементов в соединениях
А3. Фактор, не влияющий на скорость химических реакций,
-
катализатор
-
способ получения реагентов
-
природа реагирующих веществ
-
концентрация реагирующих веществ
А4. Металл, не относящийся к щелочным металлам,
-
калий 3) литий
-
кальций 4) натрий
А5. Свойство ртути, которое ограничивает её применение в бытовых термометрах
-
агрегатное состояние
-
температура плавления
-
токсичность
-
высокая плотность
А6. Водород нельзя получить путём взаимодействия металлов с кислотой
-
азотной 3) соляной
-
серной 4) фосфорной
А7. Свойство, характерное для озона,
-
хорошо растворяется в воде
-
не имеет запаха
-
бактерициден
-
легче воздуха
А8. Вода взаимодействует с каждым из веществ, формулы которых
1)Ca и Na2O 2) Na2O и Cu 3)CuO и N2O5 4)ZnO и SO2
Часть В. Тестовые задания на соответствие.
В2. Установите соответствие между исходными веществами и продуктами реакций.
- Исходные вещества Продукты реакции
- А) Na и H2O 1) Na2SO3 и H2O
- Б) Na2O и H2O 2) NaOH и H2O
- В ) NaOH и SO2 3) NaOH и H2
- 4) NaOH
В2. Установите соответствие между типами и уравнениями реакций.
- ТИПЫ ХИМИЧЕСКИХ РЕАКЦИЙ
- А) замещения, ОВР, эндотермическая
- Б) разложения, ОВР, экзотермическая
- В) соединения, ОВР, необратимая
- УРАВНЕНИЯ РЕАКЦИЙ
-
N2(г) + 3H2(г) ↔ 2NH3(г) + Q
-
2КNO3 = 2KNO2 + O2 +Q
-
FeO + C → Fe + CO -Q
-
4Fe + 3O2 + 6H2O = 4Fe(OH)3
-
2Al + Fe2O3 = 2Fe + Al2O3 +Q
Часть С. Задания с развёрнутым ответом.
С1. Запишите уравнения реакций, с помощью которых можно осуществить превращения MgO→ MgCI2→Mg(OH)2→ Mg(NO3)2
Для перехода 3 запишите ионное уравнение.
С2. К раствору, содержащему 63,9г нитрата алюминия, прилили раствор, содержащий 39,2г фосфорной кислоты. Определите массу фосфата алюминия.
С3. Расставьте коэффициенты в уравнении реакции с помощью электронного баланса. Cu + HNO3→ Cu(NO3)2 + NO2 + H2O
- Рекомендации по оцениванию работы
- Максимальное количество баллов – 21 балл
- Задания базового уровня (А1-А8), только один правильный ответ. (1 балл)
- Задания повышенного уровня (В1-В2), найти соответствие. (2 балла)
- Задание С1, С2, С3 — требуют полного ответа. (3 балла)
- Соответствие баллов, полученных за выполнение заданий, отметке/оценке по пятибалльной шкале оценивания
| Отметка | 2 | 3 | 4 | 5 |
| Число баллов за работу | 0-9 | 10-13 | 14-17 | 18-21 |
Ответы: Итоговая (стандартизированная) контрольная работа по химии за курс «Химия. 9 класс
Часть С. 1.
|
|
Элементы 2-й группы: бериллий, магний, кальций, стронций, барий, радий
В результате успешного освоения материала этой главы студент должен:
знать
- • химические свойства бериллия, магния, кальция и их важнейших соединений (оксидов, гидроксидов, солей магния и кальция);
- • определение понятия «жесткость воды»;
уметь
- • производить вычисления с использованием понятия «жесткость воды»;
- • вычислять массовую долю оксидов щелочноземельных металлов в соединениях;
владеть
• представлениями о катионах магния и кальция как важнейшей химической форме их существования в природе, об отличиях в строении их первичных и вторичных гидратных оболочек, о различиях в растворимости солей магния, кальция и щелочных металлов; о комплексных соединения магния и кальция и роли магния в хлорофилле; о роли катионов магния и кальция в живой клетке, о роли магния и кальция в почве, об известковании и гипсовании почв.
Общие свойства магния, кальция и других элементов
2-й группы
Все элементы 2-й группы: бериллий Be, магний Mg, кальций Са, стронций Sr, барий Ва и радий Ra — металлы. Наибольшие отличия в химических свойствах от остальных элементов подгруппы проявляет элемент второго периода — бериллий.
Для бериллия характерно образование соединений с ковалентными связями, тогда как другие элементы 2-й группы образуют соединения с преобладанием ионного характера связи.
Магний также отличается по химическим свойствам от остальных элементов подгруппы, но эти отличия значительно меньше, чем отличия бериллия. Кальций, стронций, барий и радий часто объединяют под общим названием щелочноземельные металлы.
Их назвали так потому, что оксиды этих металлов но химическим свойствам занимают промежуточное положение между оксидами щелочных металлов и оксидами, которые раньше называли землями, например А1203.
Распространение в природе. Как и щелочные металлы, все элементы 2-й группы встречаются в природе только в виде соединений.
Бериллий — редкий, но не рассеянный элемент. Он образует более 50 собственных минералов. Наибольшее значение из них имеет берилл (табл. 16.1). Разновидности берилла — драгоценные камни: изумруд, аквамарин, гелиодор.
- Кальций и магний относятся к числу элементов с большими кларками.
- Самые распространенные минералы литосферы, содержащие кальций и магний, — различные силикаты, например
- Таблица 16.1
- Распространенность и типы природных соединений элементов 2-й группы
| Элемент |
|
Минералы | Биологически активные соединения и их важнейшие функции |
| Be |
|
СаСЬ(к) -749 |
Гидриды. Кальций при нагревании реагирует с водородом с образованием ионного гидрида кальция СаН2. Магний тоже взаимодействует с водородом, но очень медленно даже при высокой температуре и повышенном давлении. При этом образуется гидрид магния MgH2, который по свойствам и природе химической связи занимает промежуточное положение между ионными и ковалентными гидридами. Гидрид кальция устойчив при нагревании. Гидрид магния разлагается при нагревании до 280°С: С водой и другими соединениями, способными отщеплять протон, MgH2 реагирует менее энергично, чем СаН2: Галогениды. Магний и кальций взаимодействуют с галогенами с образованием галогенидов: где Г = F, Cl, Br, I. Все галогениды магния и кальция — бесцветные кристаллические вещества. Фториды магния и кальция — малорастворимые соединения. Их кристаллы нс содержат кристаллизационной воды. Они относятся к числу наиболее тугоплавких и труднолетучих фторидов (табл. 16.5). В парах присутствуют линейные молекулы MgF2 и уголковые молекулы CaF2. В природе фторид кальция образует минерал флюорит (плавиковый шпат), который используют в качестве сырья для получения фторо- водорода и элементного фтора. Таблица 16.5 Свойства фторидов магния и кальция
| Показатель | MgF2 | CaF2 |
| Температура плавления, °С | 1263 | 1418 |
| Температура кипения, °С | 2272 | 2530 |
| Растворимость, моль/1000 г Н20 | 2,1-10 3 | 2,1-ИГ4 |
Хлориды, бромиды и иодиды магния и кальция очень хорошо растворимы в воде. Кристаллизуясь из водных растворов при комнатной температуре, они образуют гексагидраты МГ2-6Н20, например СаС12-6Н20. Кристаллогидраты при нагревании теряют воду. Процесс этот происходит в несколько этапов, например обезвоживание гексагидрата хлорида кальция можно изобразить следующей схемой: При обезвоживании галогениды частично гидролизуются. Не содержащие кристаллизационной воды галогениды магния и кальция (кроме фторидов) гигроскопичны: поглощают пары воды из воздуха. Безводные галогениды термически устойчивы. Обезвоженный СаС12 используют для осушки газов и жидкостей. Растворы СаС12 и MgCl2 замерзают при значительно более низких температурах, чем чистая вода; на этом основано использование их в качестве средства против обледенения. Растворы СаС12 используют как лекарство при аллергических заболеваниях, кровотечениях и т.п. Оксиды. Кальций интенсивно взаимодействует с кислородом при комнатной температуре. При нагревании он сгорает. Магний при обычных условиях защищен от окисления оксидной пленкой. Он сгорает только после ее разрушения при 600°С. При горении на воздухе наряду с оксидами МО образуются нитриды M3N2. В промышленности MgO и СаО получают прокаливанием карбонатов: Особо чистые оксиды обоих металлов можно получить при прокаливании нитратов. Оксид магния (жженая магнезия) и оксид кальция (негашеная известь) — тугоплавкие бесцветные кристаллы. Оксиды магния и кальция — основные оксиды. При взаимодействии их с водой образуются гидроксиды: Реагируя с кислотами, MgO и СаО дают соли: Оксиды магния и кальция находят широкое применение в химической промышленности и строительстве. Оксид магния применяют в медицине для понижения кислотности желудочного сока. Сульфиды, нитриды, фосфиды, карбиды и силициды. Эти бинарные соединения магния и кальция при взаимодействии с водой гидролизуются: Гидроксиды. Гидроксиды обоих металлов — бесцветные кристаллические вещества, малорастворимые в воде. Гидроксид магния Mg(OH)2 — слабое основание. Гидроксид кальция Ca(OH)2 — сильное основание лишь по первой ступени диссоциации'. Диссоциация по второй ступени, т.е. диссоциация катиона СаОН+, происходит по механизму слабого электролита: При нагревании гидроксиды магния и кальция разлагаются: Оба гидроксида взаимодействуют с кислотами и кислотными оксидами. Соли. Соли щелочноземельных металлов и магния, подобно солям щелочных металлов, бесцветны, если окраска не обусловлена анионами. В отличие от солей щелочных металлов многие соли магния и кальция малорастворимы (табл. 16.6): это фториды и соли с двух- и трехзарядными анионами. Растворимые соли щелочноземельных металлов выделяются из водных растворов почти всегда в виде кристаллогидратов. Многие из них содержат по 6 молекул воды. У других кристаллогидратов число молекул воды иное — 2,4, 8 и даже 12 и может изменяться с температурой. Таблица 16.6 Растворимость некоторых солей магния и кальция (моль/1000 г Н20) при 25°С
| Соли | Растворимость солей | Соли | Растворимость солей | ||
| Mg2+ | Са2+ | Mg2+ | Са2+ | ||
| Фториды mf2 | О со | 2,2 Ю-4 | Г идрокарбонаты М(11С03)2 | 0,9 | 2,7-10 2 |
| Хлориды МС12 | 5,81 | 7,93 | Карбонаты МСОз | 4,5-10 3 | 7,1-10 5 |
| Бромиды МВг2 | 5,61 | 7,65 | Сульфаты mso4 | 3,10 | 1,2-10 2 |
| Йодиды М12 | 5,25 | 7,35 | Дигидрофосфаты М(П2Р04)2 | 0,6 | 0,6 |
| Нитраты М(Ш3)2 | 2,93 | 8,42 | Гидрофосфаты мнро4 | 9,2 -10 4 | 7,9 -10 4 |
| Перхлораты М(СЮ4)2 | 4,48 | 7,89 | Фосфаты М3(Р04)2 | 5,9-10 4 | 4,0 -10 6 |
Карбонаты. В природе карбонат кальция образует два минерала, различающихся структурами кристаллических решеток: широко распространенный кальцит и реже встречающийся арагонит. Оба минерала не содержат кристаллизационной воды. Карбонат магния в отличие от СаСОз, кроме безводного минерала магнезита MgC03, образует минералы, в состав которых входит кристаллизационная вода.лансфор- дит MgC03 -5H20 и несквегонит MgC03-3H20. Безводные карбонаты магния и кальция — малорастворимые вещества, причем растворимость СаСОз существенно меньше растворимости MgCC>3. Если вода содержит углекислый газ, обе соли растворяются с образованием гидрокарбонатов, существующих только в водных растворах: При прокаливании MgC03 и СаСОз разлагаются с образованием оксида соответствующего металла и оксида углеро- да(1У). Нитраты. Эти соли магния и кальция хорошо растворимы. При обычных условиях они выделяются из растворов в виде кристаллогидратов Mg(N03)2 • 6Н20 и Са(Ы0з)2-4Н20. Безводные соли при нагревании разлагаются с выделением кислорода, оксида азота(1У) и оксида соответствующего металла: Сульфаты. В природе сульфат магния MgS04 существует в виде нескольких минералов. Все они содержат кристаллизационную воду, как, например, эпсомит (горькая соль) MgSO/, ? 7Н2(). Безводный сульфат магния можно получить из кристаллогидратов при нагревании до 320°С. С некоторыми солями щелочных металлов MgSO/, образует двойные соли, многие из которых встречаются в природе н представляют собой минералы, например карналлит и каинит. Сульфат- ион SO 1~ и катион Mg2+ образуют комплексное соединение, поэтому сульфат магния хорошо растворяется в воде. Сульфат кальция в отличие от сульфата магния образует в природе не только кристаллогидрат CaS04-2H20 (гипс), но и не содержащий кристаллизационной воды минерал ангидрит. При нагревании до 120°С гипс частично теряет воду и превращается в 2CaS04-H20. Кашица, приготовленная из 2CaS04H20 и воды, быстро затвердевает в результате протекания реакции Сульфат кальция — малорастворимая соль. При температурах порядка 1000°С безводные сульфаты обоих металлов разлагаются: Фосфаты. В сельском хозяйстве в качестве фосфорных удобрений используют фосфаты кальция: ортофосфат Са3(Р04)2, гидроортофосфат СаНР04, дигидроортофосфат Са(Н2Р04)2. В этом ряду увеличивается растворимость солей. Кислые соли могут образовывать кристаллогидраты: СаНР04 • 2Н20 и Са(Н2Р04)2 • Н20. Фосфаты магния не находят такого широкого применения, как фосфаты кальция, вследствие дороговизны их производства. В небольших количествах в качестве удобрения используют малорастворимый ортофосфат магния-аммония MgNH4P04 • 6Н20, который содержит сразу три питательных элемента: азот, фосфор и магний. Жесткость воды. Это свойство природной воды, обусловленное присутствием в ней катионов Са2+ и Mg2″. При использовании жесткой воды в системах горячего водоснабжения образуются осадки нерастворимых солей кальция и магния (накипь). При мойке и стирке в жесткой воде резко возрастает расход моющих средств и мыла, так как они расходуются на образование нерастворимых солей катьция и магния. Жесткость воды измеряется в миллимолях эквивалента палитр (ммоль/л). Суммарная молярная концентрация эквивалентов катионов Са2+ и Mg2+ (ммоль/л) называется общей жесткостью. Различают воду мягкую (жесткость < 2 ммоль/л), средней жесткости (жесткость 2—10 ммоль/л) и жесткую (жесткость >10 ммоль/л). Общая жесткость складывается из карбонатной (временной) и некарбонатной (постоянной). Карбонатная жесткость обусловлена присутствием в воде растворимых гидрокарбопатов Са(НС03)2 и Mg(HCO






