- Кремний
- Физические свойства
- Химические свойства кремния
- Оксид кремния (IV) — кремнезём SiO2
- Единственная и неповторимая — кремниевая кислота и силикаты
- Фактчек
- Проверь себя
- Кремний
- Кремниевая (силиконовая) долина
- Основное и возбужденное состояние кремния
- Природные соединения
- Получение
- Химические свойства
- Оксид кремния IV — SiO2
- Кремниевая кислота
- Кремний — общая характеристика элемента и химические свойства
- Аллотропия кремния
- Получение кремния
- Нахождение кремния в природе
- Химические свойства Si
- Кремний и его соединения
- Способы получения кремния
- Физические свойства кремния. Аллотропные модификации кремния
- Химические свойства кремния
- Силан (моносилан) SiH4
- Оксид кремния (IV) (кремнезем) SiO2
- Физические свойства
- Химические свойства
- Кремниевые кислоты
- Способы по-лучения
- Химические свойства
- Силикаты — соли кремниевых кислот
- Стекло
- Цемент
- 2.3.4. Химические свойства углерода и кремния
- Восстановительные свойства углерода
- Взаимодействие углерода с оксидами неметаллов
- Окислительные свойства углерода
- Химические свойства кремния
- Взаимодействие кремния с простыми веществами
- неметаллами
- металлами
- Взаимодействие кремния со сложными веществами
- Химические свойства кремния
- Физические и химические свойства кремния;
- Песок тоже с кремнием: разберем соединения кремния — силаны, оксиды, силикаты;
- Единственная и неповторимая — поговорим о свойствах кремниевой кислоты.
В чайном сервизе твоей бабушки обязательно найдется кремний, так как диоксид кремния входит в состав стекла. Ну а загорать на пляже без песочка (SiO2) ну просто невозможно (песок встречается на каждом шагу).
Кремний
Кремний встречается во многих веществах и предметах, которые нас окружают. Достаточно вспомнить только солнечные батареи, которые служат альтернативным источником энергии!
Так что же из себя представляет кремний? Он, как и углерод, находится в IVA-группе и имеет конфигурацию внешнего электронного слоя 3s23p2.
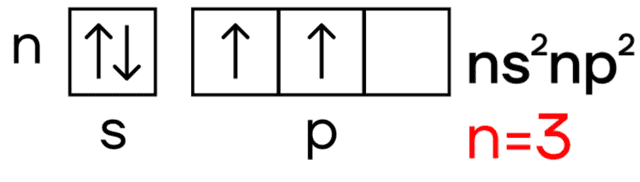
В возбужденном состоянии электроны на s-орбитали распариваются, и один из них переселяется на p-орбиталь. В результате, атом приобретает конфигурацию ns1np3.
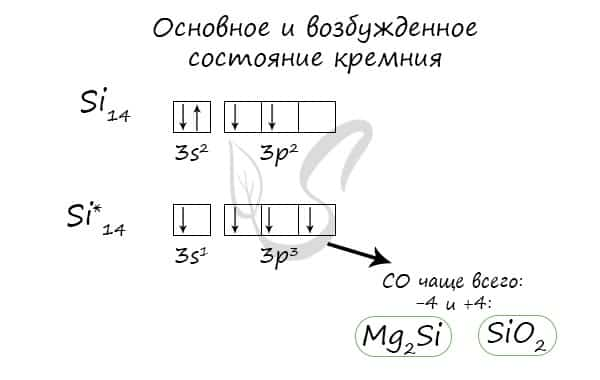
В возбужденном состоянии число неспаренных атомов кремния возрастает до четырех, и кремний приобретает валентность IV:

У кремния возможны следующие степени окисления: -4, +2, +4.
Физические свойства
| Кремний — второй по распространенности элемент на Земле (после кислорода). Кремний встречается только в виде сложных веществ, таких как горный хрусталь, кварц, кремнезем. |

Кристаллическая решётка простого вещества кремния — атомная, сам кремний представляет собой вещество темно-серого цвета с металлическим блеском. Является полупроводником.
Химические свойства кремния
У кремния относительно низкая электроотрицательность. А что это значит? Это значит, что он будет яро проявлять восстановительные свойства, даже ещё более выраженные чем у углерода! Поэтому из неметаллов будет вступать в реакции с типичными окислителями, повышая свою степень окисления до +4:
| Кремний не реагирует с водородом и фосфором в силу близких значений электроотрицательностей! |
В отличие от других неметаллов, реагирующих со щелочами, кремний является в этих реакциях только восстановителем, повышая степень окисления до +4:
- А с окислителями реакция идет?
Конечно! Но не со всеми. Отобрать электроны «слабенький» кремний способен только у самых слабых — у металлов. Как и углерод, кремний реагирует в основном с металлами активными и средней активности, образуя силициды:
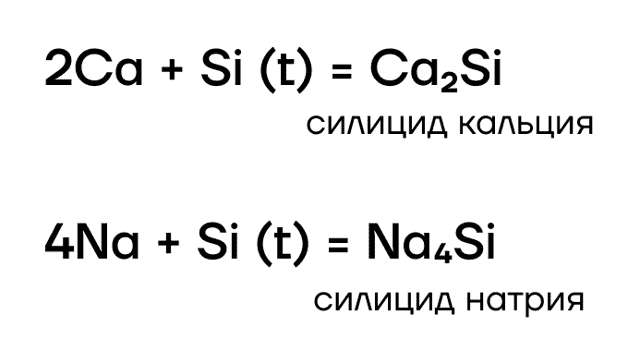
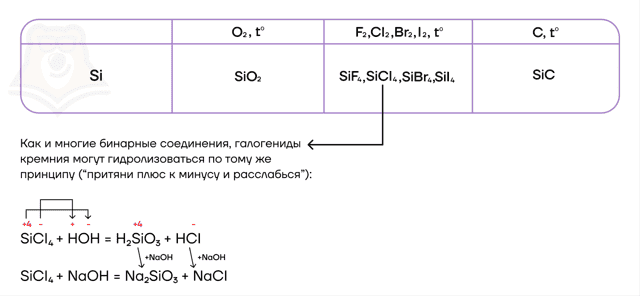
Как и многие другие бинарные соединения, силициды металлов могут гидролизоваться:
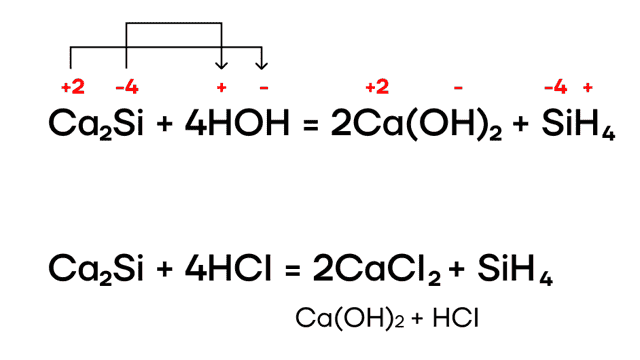
Образующийся бесцветный газ с неприятным запахом — силан — за счёт степени окисления кремния -4 проявляет восстановительные свойства и способен реагировать с окислителями (например, с кислородом):
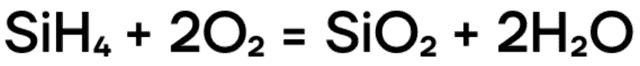
- (оксид кремния(IV) входит в состав песка, который мы видим на улице)
- Получение кремния
- Кремний в основном получают восстановлением из диоксида кремния SiO2 сильными восстановителями: углеродом, металлами:
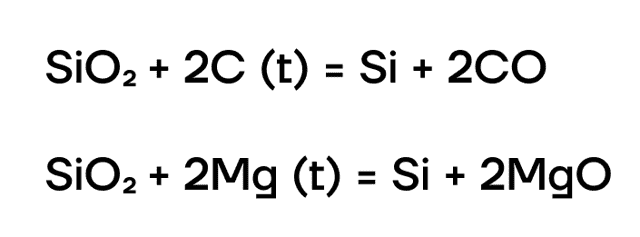
Оксид кремния (IV) — кремнезём SiO2
Диоксид кремния — кислотный оксид, главный компонент почти всех земных горных пород. Из кремнезема и силикатов состоит почти 90 % массы литосферы.
Почему же диоксид кремния такой исключительный? Да все потому, что это — единственный кислотный оксид, который не реагирует с водой! Как следствие, ему соответствует нерастворимая кремниевая кислота H2SiO3.
- Основно-кислотное взаимодействие
Как кислотный оксид, SiO2 проявляет кислотные свойства, а значит, способен взаимодействовать с веществами, проявляющими основные свойства, с образованием солей — силикатов:
- А в реакции вытеснения вступает?
Да! SiO2 в реакциях вытеснения — условно «сильный» оксид, способный вытеснять условно «слабые» (CO2, SO2) из их солей при сплавлении (t):
За счёт высокой степени окисления кремния +4 SiO2 проявляет слабо выраженные окислительные свойства и может вступать в ОВР, как правило, только с очень сильными восстановителями (например, углеродом или металлами):
Единственная и неповторимая — кремниевая кислота и силикаты
Кремниевая кислота, хоть и нерастворима, но всё-таки проявляет кислотные свойства, взаимодействуя с сильными основаниями (щелочами):
| А ещё силикаты различных металлов образуют красивые нитевидные кристаллы, которые используются в эксперименте « силикатный сад»! |
Её соли — силикаты, как и другие соли, являются электролитами, а значит, способны вступать в РИО с другими электролитами: солями, основаниями, кислотами:
Как нерастворимый гидроксид, кремниевая кислота способна разлагаться при нагревании на воду и соответствующий оксид:
Фактчек
- Кремний — химический элемент IVA группы, третьего периода периодической системы химических элементов Д. И. Менделеева, с атомным номером 14.
- Возможные степени окисления кремния: -4, +2, +4.
- Электронная конфигурация атома кремния: 1s22s22p63s13p3.
- Кремний за счёт низкой электроотрицательности ярко проявляет восстановительные свойства.
- Кремний образует множество соединений, в том числе оксид кремния SiO2 — кислотный оксид, который соответствует кремниевой кислоте H2SiO3. Соли кремниевой кислоты называются силикатами.
Проверь себя
Задание 1.Сколько неспаренных электронов содержит атом кремния в возбужденном электронном состоянии?
- 1 электрон;
- 2 электрона;
- 3 электрона;
- 4 электрона.
Задание 2.С каким из следующих простых веществ не реагирует кремний?
- Углерод;
- Бром;
- Фосфор;
- Кислород.
Задание 3.С каким из перечисленных веществ будет реагировать диоксид кремния?
- Карбонат натрия;
- Сульфат калия;
- Хлорид рубидия;
- Ортофосфат кальция.
Задание 4.Какое свойство отличает кремниевую кислоту от других кислот?
- Она содержит атомы кислорода;
- При комнатной температуре кремниевая кислота — жидкость;
- Она нерастворима в воде;
- Она проявляет амфотерные свойства.
Задание 5.Как называются бинарные соединения кремния и металлов?
- Силаны;
- Силициды;
- Силикаты;
- Силоксаны.
Ответы: 1. — 4; 2. — 3; 3. — 1; 4. — 3; 5. — 2.
Кремний
Кремний — неметаллический элемент IVa группы периодической таблицы Д.И. Менделеева. Второй после кислорода элемент по распространенности в земной коре.
В чистом виде в природе практически отсутствует. Чаще всего встречается в виде кремнезема — SiO2 — песок, песчаник, кварц, глина.

Кремниевая (силиконовая) долина
Регион в штате Калифорния (США), отличающийся большой плотностью высоко технологичных компаний, связанных с производством компьютеров и микропроцессоров.
Кремний является природным полупроводником, используется как основной материал для производства микросхем. Кремний ближе, чем вы думаете: внутри гаджета, которым вы пользуетесь ?

Основное и возбужденное состояние кремния
При возбуждении атома кремния электроны на s-подуровне распариваются и один из них переходит на p-подуровень.
Природные соединения
В природе кремний встречается в виде следующих соединений:
- SiO2 — кварц, кремнезем, гранит, песчаник, песок, глина
- SiO2 с примесью Fe3+ — цитрин
- SiO2 с примесью Fe2+ и Fe3+ — аметист

Получение
- В промышленности кремний получают путем восстановления кремнезема в электрических печах, алюминотермией.
- SiO2 + C → (t) Si + CO2↑
- SiO2 + Al → (t) Si+ Al2O3
- В лабораторных условиях мелкий белый песок прокаливают с магнием:
- SiO2 + Mg → (t) MgO + Si
Химические свойства
- Реакции с неметаллами
- Si + Cl2 → (t) SiCl4
- Si + C → (t) SiC
- Si + O2 → (t) SiO2
- Si + O2 → (t = 1200 °C) SiO
- Реакции с металлами
- Реакция с щелочами
При обычных условиях без нагревания кремний реагирует только со фтором. Si + F2 → SiF4 При нагревании кремний вступает в реакции с остальными галогенами (Cl, Br, I), углеродом, кислородом. При очень высоких температурах (1200 °C) кремний с кислородом образует оксид кремния II — несолеобразующий оксид.

В подобных реакциях кремния проявляет свои окислительные способности. Ca + Si → Ca2Si (силицид кальция)
С целью травления (удаления поверхностного слоя материала) кремниевые изделия можно погружать в раствор щелочи. KOH + Si → K2SiO3 + H2↑
Оксид кремния IV — SiO2
Оксид кремния IV имеет атомное строение, обладает высокой прочностью и твердостью. Плавится при температуре +1730 °C градусов.
- Получение
- В промышленности оксид кремния IV получают нагреванием кремния в атмосфере кислорода.
- Si + O2 → SiO2
В лабораторных условиях проводят реакция силиката натрия с уксусной кислотой. Кремниевая кислота сразу же распадается на SiO2, который выпадает в осадок, и воду.
Na2SiO3 + CH3COOH → CH3COONa + H2SiO3↓
H2SiO3 → SiO2 + H2O

Химические свойства
- Реакции с кислотами
- Реакции с основными оксидами и щелочами
- С карбонатами
Химически SiO2 устойчив к действию кислот, однако вступает в реакцию с газообразным фтороводородом (газом) и плавиковой кислотой (жидкостью). SiO2 + HF → SiF4 + H2O
SiO2 является кислотным оксидом, соответствует кремниевой кислоте. Вступая в реакции с основными оксидами и щелочами, образует соли данной кислоты — силикаты. MgO + SiO2 → MgSiO3 NaOH + SiO2 → Na2SiO3 + H2O 
Так как чаще всего кислотные оксиды с солями не реагируют, тем более необычной кажется реакция оксида кремния IV с карбонатами. K2CO3 + SiO2 → K2SiO3 + CO2↑
Кремниевая кислота
Слабая, малорастворимая в воде кислота. Ее соли носят название — силикаты.
Получение
Поскольку кремниевая кислота малорастворима, то банальной реакцией SiO2 с водой ее не получить. Эту задачу решают в две стадии через ее соли — силикаты.
- LiOH + SiO2 → Li2SiO3 + H2O
- Li2SiO3 + HCl → LiCl + H2SiO3↓
- Химические свойства
- Кремниевая кислота слабая, нестойкая, легко распадается на воду и оксид кремния IV.
- H2SiO3 → H2O + SiO2

Кремний — общая характеристика элемента и химические свойства
На внешнем энергетическом уровне атома углерода содержится 4 электрона, которые имеют электронную конфигурацию 3s 2 3p 2 . Кремний проявляет степени окисления -4, +2, +4. Кремний – типичный неметалл, в зависимости от типа превращения элемент может быть окислителем и восстановителем.
Аллотропия кремния
Кристаллический кремний – тёмно-серое вещество с металлическим блеском, большая твёрдость, хрупок, полупроводник; t°пл. 1415°C; t°кип. 2680°C.
Имеет алмазоподобную структуру (sp 3 — гибридизация атомов кремния) и образует прочные ковалентные σ- связи. Инертен.
Аморфный кремний — бурый порошок, гигроскопичен, более реакционноспособен.
Получение кремния
1) 2С + Si +4 O 2 – t° → Si 0 + 2CO
2) 2Mg + Si +4 O 2 – t° → 2MgO + Si 0
Нахождение кремния в природе
 Кремний – второй по распространенности элемент на Земле после кислорода.Его содержание в земной коре составляет 27,6 % (мас.). Встречается только в виде соединений.
Кремний – второй по распространенности элемент на Земле после кислорода.Его содержание в земной коре составляет 27,6 % (мас.). Встречается только в виде соединений.
Оксид кремния образует большое количество природных веществ – горный хрусталь, кварц, кремнезем. Составляет основу многих полудрагоценных камней – агат, аметист, яшма и др. Также кремний входит в состав породообразующих минералов – силикатов и алюмосиликатов – полевых шпатов, глин, слюд и др.
Химические свойства Si
- Типичный неметалл средней активности.
- Как восстановитель: 1) С кислородом
- Si 0 + O 2 – t° → Si +4 O 2
- 2) С галогенами, со фтором без нагревания. Si 0 + 2F 2 → SiF 4
- 3) С углеродом Si 0 + C – t° → Si +4 C
- (SiC — карборунд –твёрдый, используется для шлифовки)
- 4) С азотом
- 3Si + 2N 2 – t° → Si 3 N 4 .
- 5) С кислотами не реагирует. Растворяется только в смеси азотной и плавиковой кислот: 3Si + 4HNO 3 + 18HF → 3H 2 [SiF 6 ] + 4NO + 8H 2 O
- 6) Со щелочами (при нагревании): Si 0 + 2NaOH + H 2 O → Na 2 Si +4 O 3 + 2H 2
- Как окислитель:
- 6) С металлами (образуются силициды): Si 0 + 2Mg – t° → Mg 2 Si -4
- Разложением силицидов металлов кислотой получают силан (SiH 4 ) Mg 2 Si + 2H 2 SO 4 → SiH 4 + 2MgSO 4
- 7) С водородом не взаимодействует.
Кремний и его соединения
Кремний 14Si является аналогом углерода, находится в главной подгруппе IV группы, в 3-м периоде. Как и углерод, кремний является неметаллом и проявляет в своих соединениях и положительные и отрицательные степени окисления, наиболее характерными из которых являются +4 и -4.
14Si 1s22s22p63s23p2
Аr = 28,0855
Изотопы: 28Si (92.27 %); 29Si (4.68 %); 30Si (3,05 %)
ЭО = 1,8
Кремний — второй после кислорода по распространенности в земной коре элемент (27,6 % по массе). В свободном состоянии в природе не встречается, находится преимущественно в виде SiO2 или силикатов.
Соединения Si токсичны; вдыхание мельчайших частиц SiO2 и др. соединений кремния (например, асбеста) вызывает опасную болезнь — силикоз
В основном состоянии атом кремния имеет валентность = II, а в возбужденом состоянии = IV.
Наиболее устойчивой степенью окисления Si является +4. В соединениях с металлами (силицидах) С.О. -4.
Способы получения кремния
Самым распространенным природным соединением кремния является кремнезем (диоксид кремния) SiО2. Он является основным сырьем для получения кремния.
- 1) Восстановление SiO2 углеродом в дуговых печах при 1800'С: SiO2 + 2С = Si + 2СО
- 2) Высокочистый Si из технического продукта получают согласно схеме:
- a) Si → SiCl2 → Si
- б) Si → Mg2Si → SiH4 → Si
Физические свойства кремния. Аллотропные модификации кремния
1) Кристаллический кремний — вещество серебристо — серого цвета с металлическим блеском, кристаллическая решетка типа алмаза; т. пл. 1415'С, т. кип. 3249'С, плотность 2,33 г/см3; является полупроводником.
2) Аморфный кремний — порошок бурого цвета.
Химические свойства кремния
- При низких температурах кремний химически инертен, при нагревании его реакционная способность резко возрастает.
- 1. С кислородом взаимодействует при Т выше 400°С:
- Si + О2 = SiO2 оксид кремния
- 2.
С фтором реагирует уже при комнатной температуре:
- Si + 2F2 = SiF4 тетрафторид кремня
- 3. С остальными галогенами реакции идут при температуре = 300 — 500°С
- Si + 2Hal2 = SiHal4
- 4.
С парами серы при 600°С образует дисульфид:
- Si + 2S = SiS2
- 5. Реакция с азотом происходит выше 1000°С:
- 3Si + 2N2 = Si3N4 нитрид кремния
- 6.
При температуре = 1150°С реагирует с углеродом:
- SiO2 + 3С = SiС + 2СО
- По твердости карборунд близок к алмазу.
7. С водородом кремний непосредственно не реагирует.
8. Кремний стоек к действию кислот. Взаимодействует только со смесью азотной и фтороводородной (плавиковой) кислот:
- 3Si + 12HF + 4HNO3 = 3SiF4 + 4NO + 8H2O
- 9. реагирует с растворами щелочей с образованием силикатов и выделением водорода:
- Si + 2NaOH + H2O = Na2SiO3 + 2H2↑
- 10. Восстановительные свойства кремния используют для выделения металлов из их оксидов:
- 2MgO = Si = 2Mg + SiO2
- Кремний образует силициды с s-металлами и большинством d-металлов.
Состав силицидов данного металла может быть различен. (Например, FeSi и FeSi2; Ni2Si и NiSi2.) Один из наиболее известных силицидов — силицид магния, который можно получать прямым взаимодействием простых веществ:
2Mg + Si = Mg2Si
Силан (моносилан) SiH4
Силаны (кремневодороды) SinH2n + 2, (ср. с алканами), где п = 1-8. Силаны — аналоги алканов, отличаются от них неустойчивостью цепей -Si-Si-.
- Моносилан SiH4 — бесцветный газ с неприятным запахом; растворяется в этаноле, бензине.
- Способы получения:
- 1. Разложение силицида магния соляной кислотой: Mg2Si + 4HCI = 2MgCI2 + SiH4
- 2. Восстановление галогенидов Si алюмогидридом лития:
SiCl4 + LiAlH4 = SiH4↑ + LiCl + AlCl3 - Химические свойства.
- Силан — сильный восстановитель.
- 1.SiH4 окисляется кислородом даже при очень низких температурах:
- SiH4 + 2O2 = SiO2 + 2Н2О
- 2. SiH4 легко гидролизуется, особенно в щелочной среде:
- SiH4 + 2Н2О = SiO2 + 4Н2
- SiH4 + 2NaOH + Н2О = Na2SiO3 + 4Н2
Оксид кремния (IV) (кремнезем) SiO2
Кремнезем существует в виде различных форм: кристаллической, аморфной и стеклообразной. Наиболее распространенной кристаллической формой является кварц. При разрушении кварцевых горных пород образуются кварцевые пески. Монокристаллы кварца — прозрачны, бесцветны (горный хрусталь) или окрашены примесями в различные цвета (аметист, агат, яшма и др.).
Аморфный SiO2 встречается в виде минерала опала: искусственно получают силикагель, состоящий из коллоидных частиц SiO2 и являющийся очень хорошим адсорбентом. Стеклообразный SiO2 известен как кварцевое стекло.
Физические свойства
В воде SiO2 растворяется очень незначительно, в органических растворителях также практически не растворяется. Кремнезем является диэлектриком.
Химические свойства
- 1. SiO2 — кислотный оксид, поэтому аморфный кремнезем медленно растворяется в водных растворах щелочей:
- SiO2 + 2NaOH = Na2SiO3 + Н2О
- 2. SiO2 взаимодействует также при нагревании с основными оксидами:
- SiO2 + К2О = K2SiO3;
- SiO2 + СаО = CaSiO3
- 3. Будучи нелетучим оксидом, SiO2 вытесняет углекислый газ из Na2CO3 (при сплавлении):
- SiO2 + Na2CO3 = Na2SiO3 + CO2↑
- 4. Кремнезем реагирует с фтороводородной кислотой, образуя кремнефтористоводородную кислоту H2SiF6:
- SiO2 + 6HF = H2SiF6 + 2Н2О
- 5. При 250 — 400°С SiO2 взаимодействует с газообразным HF и F2, образуя тетрафторсилан (тетрафторид кремния):
- SiO2 + 4HF (газ.) = SiF4 + 2Н2О
- SiO2 + 2F2 = SiF4 + O2
Кремниевые кислоты
- Известны:
- — ортокремниевая кислота H4SiО4;
- — метакремниевая (кремниевая) кислота H2SiO3;
- — ди- и поликремниевые кислоты.
- Все кремниевые кислоты малорастворимы в воде, легко образуют коллоидные растворы.
Способы по-лучения
- 1. Осаждение кислотами из растворов силикатов щелочных металлов:
- Na2SiO3 + 2HCl = H2SiO3↓ + 2NaCl
- 2. Гидролиз хлорсиланов: SiCl4 + 4Н2О = H4SiO4 + 4HCl
Химические свойства
- Кремниевые кислоты — очень слабые кислоты (слабее угольной кислоты).
- При нагревании они дегидратируются с образованием в качестве конечного продукта кремнезема
- H4SiО4 → H2SiO3 → SiO2
Силикаты — соли кремниевых кислот
- Поскольку кремниевые кислоты чрезвычайно слабые, их соли в водных растворах сильно гидро лизованы:
- Na2SiO3 + Н2О = NaHSiO3 + NaOH
- SiO32- + Н2О = HSiO3- + ОН- (щелочная среда)
- По этой же причине при пропускании углекислого газа через растворы силикатов происходит вытеснение из них кремниевой кислоты:
- K2SiO3 + СO2 + Н2О = H2SiO3↓ + K2СO3
- SiO3 + СO2 + Н2О = H2SiO3↓ + СO3
- Данную реакцию можно рассматривать как качественную реакцию на силикат-ионы.
- Среди силикатов хорошо растворимыми являются только Na2SiO3 и K2SiO3, которые называются растворимым стеклом, а их водные растворы — жидким стеклом.
Стекло
Обычное оконное стекло имеет состав Na2O • СаО • 6SiO2, т. е. является смесью силикатов натрия и кальция. Его получают сплавлением соды Na2CO3, известняка СаСO3 и песка SiO2;
Na2CO3 + CaCO3 + 6SiO2 = Na2O • СаО • 6SiO2 + 2СO2↑
Цемент
Порошкообразный вяжущий материал, образующий при взаимодействии с водой пластичную массу, превращающуюся со временем в твердое камневидное тело; основной строительный материал.
Химический состав наиболее распространенного портланд-цемента (в % по массе) — 20 — 23% SiO2; 62 — 76 % СаО; 4 — 7 % Al2O3; 2-5% Fe2O3; 1- 5% МgО.
2.3.4. Химические свойства углерода и кремния
Углерод способен образовывать несколько аллотропных модификаций. Это алмаз (наиболее инертная аллотропная модификация), графит, фуллерен и карбин.
Древесный уголь и сажа представляют собой аморфный углерод. Углерод в таком состоянии не имеет упорядоченной структуры и фактически состоит из мельчайших фрагментов слоев графита. Аморфный углерод, обработанный горячим водяным паром, называют активированным углем.
1 грамм активированного угля из-за наличия в нем множества пор имеет общую поверхность более трехсот квадратных метров! Благодаря своей способности поглощать различные вещества активированный уголь находит широкое применение как наполнитель фильтров, а также как энтеросорбент при различных видах отравлений.
С химической точки зрения аморфный углерод является наиболее активной его формой, графит проявляет среднюю активность, а алмаз является крайне инертным веществом. По этой причине, рассматриваемые ниже химические свойства углерода следует прежде всего относить к аморфному углероду.
Восстановительные свойства углерода
Как восстановитель углерод реагирует с такими неметаллами как, например, кислород, галогены, сера.
В зависимости от избытка или недостатка кислорода при горении угля возможно образование угарного газа CO или углекислого газа CO2:
При взаимодействии углерода со фтором образуется тетрафторид углерода:
При нагревании углерода с серой образуется сероуглерод CS2:
Углерод способен восстанавливать металлы после алюминия в ряду активности из их оксидов. Например:
Также углерод реагирует и с оксидами активных металлов, однако в этом случае наблюдается, как правило, не восстановление металла, а образование его карбида:
Взаимодействие углерода с оксидами неметаллов
Углерод вступает в реакцию сопропорционирования с углекислым газом CO2:
Одним из наиболее важных с промышленной точки зрения процессов является так называемая паровая конверсия угля. Процесс проводят, пропуская водяной пар через раскаленный уголь. При этом протекает следующая реакция:
При высокой температуре углерод способен восстанавливать даже такое инертное соединение как диоксид кремния. При этом в зависимости от условия возможно образование кремния или карбида кремния (карборунда):
- Также углерод как восстановитель реагирует с кислотами окислителями, в частности, концентрированными серной и азотной кислотами:
Окислительные свойства углерода
- Химический элемент углерод не отличается высокой электроотрицательностью, поэтому образуемые им простые вещества редко проявляют окислительные свойства по отношению к другим неметаллам.
- Примером таких реакций является взаимодействие аморфного углерода с водородом при нагревании в присутствии катализатора:
- а также с кремнием при температуре 1200-1300 оС:
Окислительные свойства углерод проявляет по отношению к металлам.
Углерод способен реагировать с активными металлами и некоторыми металлами средней активности. Реакции протекают при нагревании:
- Карбиды активных металлов гидролизуются водой:
- а также растворами кислот-неокислителей:
- При этом образуются углеводороды, содержащие углерод в той же степени окисления, что и в исходном карбиде.
Химические свойства кремния
Кремний может существовать, как и углерод в кристаллическом и аморфном состоянии и, также, как и в случае углерода, аморфный кремний существенно более химически активен, чем кристаллический.
Иногда аморфный и кристаллический кремний, называют его аллотропными модификациями, что, строго говоря, не совсем верно. Аморфный кремний представляет собой по сути конгломерат беспорядочно расположенных друг относительно друга мельчайших частиц кристаллического кремния.
Взаимодействие кремния с простыми веществами
неметаллами
- При обычных условиях кремний ввиду своей инертности реагирует только со фтором:
- С хлором, бромом и йодом кремний реагирует только при нагревании.
При этом характерно, что в зависимости от активности галогена, требуется и соответственно различная температура:
- Так с хлором реакция протекает при 340-420 оС:
- С бромом – 620-700 оС:
- С йодом – 750-810 оС:
- Все галогениды кремния легко гидролизуются водой:
- а также растворами щелочей:
- Реакция кремния с кислородом протекает, однако требует очень сильного нагревания (1200-1300оС) ввиду того, что прочная оксидная пленка затрудняет взаимодействие:
- При температуре 1200-1500 оС кремний медленно взаимодействует с углеродом в виде графита с образованием карборунда SiC – вещества с атомной кристаллической решеткой подобной алмазу и почти не уступающего ему в прочности:
- С водородом кремний не реагирует.
металлами
Ввиду своей низкой электроотрицательности кремний может проявлять окислительные свойства лишь по отношению к металлам. Из металлов кремний реагирует с активными (щелочными и щелочноземельными), а также многими металлами средней активности. В результате такого взаимодействия образуются силициды:
- Силициды активных металлов легко гидролизуются водой или разбавленными растворами кислот-неокислителей:
- При этом образуется газ силан SiH4 – аналог метана CH4.
Взаимодействие кремния со сложными веществами
- С водой кремний не реагирует даже при кипячении, однако аморфный кремний взаимодействует с перегретым водяным паром при температуре около 400-500оС. При этом образуется водород и диоксид кремния:
- Из всех кислот кремний (в аморфном состоянии) реагирует только с концентрированной плавиковой кислотой:
- Кремний растворяется в концентрированных растворах щелочей. Реакция сопровождается выделением водорода:
Химические свойства кремния
Химические свойства кремния добавить в закладки
Так же как и углерод, кремний расположен во втором периоде, главной подгруппе IV группы периодической системы химических элементов.
На внешнем энергетическом уровне у кремния четыре электрона. В отличии от атомов углерода, у кремния наружные электроны удалены дальше от ядра и значит слабее связаны.
Поэтому у кремния надо ожидать ослабления неметаллических свойств по сравнению с углеродом и некоторое проявление металлических свойств.
Действительно, кремний в виде простого вещества по внешнему виду больше похож на металл, чем углерод. Характерны степени окисления -4 и +4.
При обычных условиях кремний химически малоактивен и взаимодействует только с фтором. Остальные реакции протекают только при повышенных температурах.
I. Окислительные свойства
Свойства окислителя кремний проявляет в реакциях с металлами при высоких температурах с образованием силицидов. В данные реакции вступают щелочные и щелочноземельные металлы, а также металлы средней активности.
- Si + 2Mg → Mg2Si
- Силициды разлагаются кислотами с образованием газа – силана SiH4.
- II. Восстановительные свойства
- Как восстановитель кремний взаимодействует со многими неметаллами.
- При сильном нагревании измельченный кремний загорается на воздухе, образуя двуокись кремния. Si + O2 → SiO2
- С галогенами реакция протекает так же при повышенных температурах: с хлором – 340 – 4200 С; с бромом – 620-7000 С; с йодом – 750-8100 С. Si + 2Cl2 =SiCl4 Si + 2Br2 =SiBr4 Si + 2I2 =SiI4
- Соединение кремния с углеродом, карбид кремния SiC, называется карборунд. Это твердое вещество, по твердости схоже с алмазом, применяется в качестве абразивного материала для изготовления точильных камней и шлифовальных кругов. Si + C = SiC
- С азотом реагирует при нагревании смеси до 10000 С, образуя при этом нитрид кремния. 3Si + 2N2 → Si3N4
- Кремний с кислотами не взаимодействует, исключение смесь плавиковой и азотной кислот. Другие кислоты его пассивируют и он покрывается оксидной пленкой.
3Si + 4HNO3 + 18HF → 3H2[SiF6] + 4NO + 8H2O
- В отличие от реакции с кислотами, со щелочами кремний взаимодействует активно. При этом он проявляет слабые кислотные свойства.
Si + 2KOH + H2O → K2SiO3 + H2↑
Смотри также:
- Номенклатура неорганических веществ
- Характерные химические свойства простых веществ – металлов: щелочных, щелочноземельных, магния, алюминия; переходных металлов (меди, цинка, хрома, железа)
- Характерные химические свойства простых веществ – неметаллов: водорода, галогенов, кислорода, серы, азота, фосфора, углерода, кремния
- Характерные химические свойства оксидов: оснóвных, амфотерных, кислотных
- Характерные химические свойства оснований и амфотерных гидроксидов
- Характерные химические свойства кислот
- Характерные химические свойства солей: средних, кислых, оснóвных; комплексных ( на примере соединений алюминия и цинка)
- Взаимосвязь различных классов неорганических веществ