- Общие сведения
- Физические свойства
- Получение
- Карбонилирования метанола
- Метод BASF
- Метод Monsanto
- Метод Cativa
- Окисления этаналя
- Окисления углеводородов
- Ферментация
- Химические свойства
- Токсичность
- Применение
- Формула уксусной кислоты в химии
- Физические свойства уксусной кислоты
- Химические свойства уксусной кислоты
- Примеры решения задач
- § 20. УКСУСНАЯ КИСЛОТА
- Химические свойства уксусной кислоты
- ПОИСК
Уксусная кислота — органическое соединение, одноосновная карбоновая кислота состава CH 3 COOH. При обычных условиях представляет собой бесцветную жидкость с резким запахом. Температура плавления чистой кислоты несколько ниже комнатной температуры, при замерзании она превращается в бесцветные кристаллы — это дало ей техническое наименование ледяная уксусная кислота.
Название кислоты образована словом уксус, что происходит от лат. Acetum — кислое вино. По номенклатуре IUPAC она систематическую название етанова кислота, которая характеризует соединение как производную этана.
Поскольку молекула кислоты имеет в своем составе функциональную группу ацетил CH 3 CO (условное обозначение Ac), ее формула также может записываться как AcOH.
В контексте кислотно-основных взаимодействий символом Ac иногда сказывается ацетат-анион CH 3 COO — — в таком случае формула будет иметь запись HAc.
Взаимодействуя с металлами, щелочами и спиртами, уксусная кислота образует ряд солей и эфиров — ацетатов (етаноатив).
Уксусная кислота — один из базовых продуктов промышленного органического синтеза. Более 65% мирового производства уксусной кислоты идет на изготовление полимеров, производных целлюлозы и винилацетата.
Поливинилацетат является основой многих ґрунтивних покрытий и красок. С ацетатной целлюлозы изготавливают ацетатного волокна. Уксусная кислота и ее эфиры важные промышленные растворители и экстрагенты.
Общие сведения
Уксусная кислота известна человечеству с древнейших времен.
Уксус, 4-12% раствор уксусной кислоты в воде, как продукт ферментации вина получил широкое використування более чем 5000 лет назад, прежде всего как пищевой консервант.
Древнегреческий врач Гиппократ использовал растворы кислоты в качестве антисептика, а также в составе настоек от многочисленных заболеваний, включая лихорадку, запоры, желудочные язвы, плеврит.
Уксусная кислота находится в низких концентрациях во многих растительных и животных системах. Она, в частности, синтезируется бактериями рода Acetobacter и Clostridium. Среди рода Acetobacter наиболее эффективно вид Acetobacter aceti.
В 1996 году американскими учеными было сообщено о наблюдении молекул уксусной кислоты в газо-пылевом облаке Стрелец B2. Подобное открытие впервые было осуществлено с применением интерферометрической оборудования.
Физические свойства
Уксусная кислота при стандартном состояния является бесцветной жидкостью с резким запахом. При замерзании при температуре 16,635 ° С, она превращается в прозрачные кристаллы (ледяная уксусная кислота).
| 1,056 | 0,786 | 0,599 | 0,464 | 0,424 |
Уксусная кислота неограниченно смешивается с водой, образует значительное количество азеотропных смесей с органическими растворителями:
| Гексан | 68,3 | 6,0 | 94,0 |
| Октан | 105,7 | 53,7 | 46,3 |
| Циклогексан | 78,8 | 9,6 | 90,4 |
| Бензол | 80,05 | 2,0 | 98,0 |
| Толуол | 100,6 | 28,1 | 71,9 |
| Етилбензен | 114,65 | 66 | 34 |
| Стирен | 116,8 | 85,7 | 14,3 |
| Пиридин | 138,1 | 51,1 | 48,9 |
| Тетрахлорметан | 76 | 98,46 | 1,54 |
| Хлоробензен | 114,7 | 58,5 | 41,5 |
| Нитроэтан | 112,4 | 30 | 70 |
Другие физические свойства:
- критическое давление 5,79 МПа;
- критическая температура 321,6 ° С;
- удельная теплоемкость 2 010 Дж / (кг · K) (при 17 ° С);
- поверхностное натяжение 27,8 · 10 -3 Дж / м² (при 20 ° С);
- коррозионная активность 10% -го водного раствора по отношению к ст. 3 2,97 г / (ч · м²) (20 ° С).
Получение
Синтез растворов уксусной кислоты (уксуса) проводится в основном методом ферментации, а для получения чистой кислоты, в значительных масштабах применяются методы карбонилирования метанола, окисления бутана и этаналя. Основным методом является получение из метанола.
Карбонилирования метанола
Возможность получения уксусной кислоты из метанола была открыта в немецком концерне BASF в 1913 году:
В 1938 году сотрудник BASF Вальтер Реппе продемонстрировал эффективность использования в качестве катализаторов карбонилов металлов VIIIB группы (группа 9), в частности, карбонила кобальта [Co 2 (CO) 8]. Первое полномасштабное производство с применением кобальтового катализатора было развернуто в 1960 году в Людвигсгафени, Германия.
В конце 1960-х в компании «Monsanto» разработали новый тип катализаторов на основе родия, которые имели значительно более высокую активность и селективность по сравнению с кобальтовым: даже при атмосферном давлении выход конечного продукта составлял 90-99%. В 1986 году этот метод приобрел «BP Chemicals» и передал его на совершенствование компании «Celanese».
В начале 1990-х «Monsanto» запатентовала использование нового, иридиевого, катализатора. Его преимущество заключалось в большей стабильности и меньшем количестве жидких побочных продуктов. «BP» приобрел права на этот патент и внедрил в производство под названием метод Cativa (англ. Cativa process).
Метод BASF
В производстве по методу BASF катализатором выступает карбонил кобальта [Co 2 (OH) 8], который in situ получают из йодида кобальта (II):
В реакционной системе образован карбонил активируют и в дальнейшем он находится в виде комплекса [Co (CO) 4] -:
На первой стадии исходный метанол взаимодействует с йодоводнем, который является сопутствующим продуктом синтеза карбонила, с образованием йодометану:
Йодометан реагирует с карбонил:
Впоследствии проводится карбонилирования что ведет к сложному ацилкарбонильного интермедиата:
Под действием йодид-ионов комплекс разлагается, высвобождая катализатор и ацетилйодид, который гидролизуется до уксусной кислоты:
Побочными продуктами в этом цикле является метан, этаналь, этанол, пропионовая кислота, алкильные ацетаты, 2-етилбутан-1-ол. На метан превращается около 2,5% метанола, а на жидкие побочные продукты — 4,5%. 10% монооксида углерода окисляется до диоксида:
Для реакции карбонилирования метанола чрезвычайно важны парциальные давления исходных веществ. Так, выход конечного продукта достигает 70% в зависимости от подачи монооксида углерода и 90% в зависимости от метанола.
Метод Monsanto
По методу Monsanto катализатором является дийододикарбонилродат [Rh (CO) 2 I 2] -, который синтезируют in situ из йодида родия (III) в водном или спиртовом среде.
Компания «Celanese» усовершенствовала этот метод, дополнив его циклом оптимизации кислот, когда незначительная дополнительное количество уксусной кислоты в форме ацетат-ионов подавалась на катализатор и повышала его эффективность при низких концентрациях исходных соединений.
Синтез проводится при температуре 150-200 ° C и давлении 3,3-3,6 МПа.
Метод Cativa
Аналогичным метода Monsanto является метод Cativa. Здесь катализатором выступает заряженный комплекс [Ir (CO) 2 I 2] -.
По сравнению с родиевым катализатором, иридиевый имеет и преимущества, и недостатки: так, окисления иридия йодометаном происходит в 150-200 раз быстрее, но процесс миграции метильной группы проходит в 10 5 -10 6 раз медленнее, к тому же образования побочного продукта метана для иридиевого катализатора выше.
Окисления этаналя
Прекурсором для получения уксусной кислоты служит этаналь, который синтезируют окислением этанола в присутствии солей серебра:
Окисление альдегида происходит по радикальному механизму с использованием инициатору:
Реакция проходит через стадию образования пероксоацетатного радикала:
Полученная пероксоацетатна кислота реагирует с ацетальдегидом с образованием ацетальдегидперацетату, который по механизму перегруппировки Байера — Виллигера разлагается на уксусную кислоту:
Побочным продуктом является метилформиат, который образуется в результате миграции метильной группы.
Катализаторами взаимодействий являются соли кобальта или марганца. Они также играют важную роль в уменьшении количества перацетат-радикалов в реакционной системе, тем самым предотвращая образование взрывоопасных концентраций:
Взаимодействия по этому методу проводятся при температуре 60-80 ° C и давлении 0,3-1,0 МПа. Преобразование альдегида в ацетатную кислоту обычно происходит с выходом более 90% и селективностью по кислотой более 95%.
Окисления углеводородов
Уксусная кислота может быть получена из бутана и легких фракций нефти. Этот метод является одним из самых распространенных благодаря низкой стоимости углеводородного сырья. В присутствии металлических катализаторов типа кобальта, хрома, марганца, бутан окисляется воздухом:
Основными побочными продуктами являются ацетальдегид и бутанон.
Ферментация
Некоторые бактерии, в частности, рода Acetobacter и Clostridium, производят кислоту в процессе своей жизнедеятельности. Использование человеком подобных ферментационных процессов известно еще с давних времен. Таким образом образуется низкоонцентрированных уксусная кислота, которая полностью удовлетворяет бытовые нужды.
К ферментативного производства привлекаются виды бактерий Acetobacter aceti и искусственно выведенные Clostridium thermoaceticum. Для подкормки бактерий используют сахаросодержащую сырье — глюкозу, ксилозу и т.п.:
Значительным преимуществом этого метода является полная экологичность производства.
Химические свойства
В газовой фазе между молекулами кислоты возникают водородные связи, поэтому они находятся преимущественно в димерних форме (также известные тетрамеры):
Кроме этого возможно образование гидратированного димера: молекулы сочетаются между собой только одним связью, а к свободным карбоксильной и гидроксильной групп присоединяются водородными связями по одной молекуле воды. Степень превращения в димерные структур увеличивается с повышением концентрации раствора и снижается с повышением температуры.
Уксусная кислота является типичной карбоновой кислотой, она участвует во всех реакциях, характерных для этого ряда соединений. В водном растворе кислота распадается и отдает ион H + молекулам воды, образуя структуру с двумя равными связями C-O:
Проявляя кислотные свойства, уксусная кислота взаимодействует с активными металлами, оксидами и гидридами металлов, металлоорганических соединений, аммиаком, образуя ряд солей — ацетатов.
Органические ацетаты является эфирами — продуктами взаимодействия кислоты со спиртами:
Конденсацией кислоты с этен синтезируют винилацетата — промышленно важную соединение, мономер поливинилацетата:
При воздействии сильных обезвоживающих агентов (типа P 2 O 5) образуется уксусный ангидрид. Аналогичным результат при участии некоторых агентов хлорирования (тионилхлорида, фосгена) — тогда синтез ангидрида проходит через стадию получения ацетилхлорида.
Пропуская разогретую пару кислоты над катализатором (оксидами марганца, тория, циркония), можно синтезировать ацетон (с выходом около 80%):
При нагревании до 600 ° C уксусная кислота дегидратируется к Кётене — етенону:
Токсичность
Находясь в состоянии пара в воздухе, кислота повреждает глаза, нос и горло уже при концентрации более 10 мг / м³. Серьезные последствия наблюдаются при десятидневной повторяющейся действия загрязненной кислотой воздуха с содержанием до 26 мг / м³.
Низкоонцентрированных растворы уксусной кислоты (около 5%) могут раздражать слизистые оболочки.
Концентрированная кислота в значительной степени повреждает кожу при контакте: в случае ее попадания, необходимо промыть пораженное место большим количеством воды или раствора пищевой соды.
При проглатывании уксусной кислоты наблюдается боль в пищеводе и рту, это может привести к появлению тошноты и проблем с дыханием. В этом случае необходимо ополоснуть ротовую полость и обратиться к врачу.
Токсические дозы при потреблении кислоты человеком точно не известны. Полулетальные дозой для крыс является 3310 мг / кг, для кроликов — 1200 мг / кг. Потребление человеком 89-90 г чистой кислоты крайне опасно, а предельной численностью для ежедневного потребления является 2,1 г.
Применение
Применение уксусной кислоты достаточно разнообразное.
В химической промышленности из нее производят пластические массы, различные красители, лекарственные вещества, искусственное волокно (ацетатный шелк), невоспламеняющуюся кинопленку и многие другие вещества.
Соли уксусной кислоты — ацетаты алюминия, хрома, железа — применяют как протраву при окраске тканей. Уксусная кислота имеет широкое применение и в качестве растворителя.
В пищевой промышленности применяется как консервант, регулятор кислотности и вкусовая приправа; в Европейской системе пищевых добавок уксусная кислота имеет код E260.
Кислота применяется при солянокислотного обработке призабойной зоны пласта в качестве стабилизатора (с целью стабилизации продуктов реакции) от выпадения складновилучуваних гелеобразных соединений железа (осадка).
В зависимости от содержания железа в кислотном растворе (от 0,01 до 0,5%) берут 1-3% уксусную кислоту. Для приготовления рабочих растворов используют как синтетическую кислоту, так и лесохимическую техническую очищенную.
Формула уксусной кислоты в химии
Онлайн калькуляторы
На нашем сайте собрано более 100 бесплатных онлайн калькуляторов по математике, геометрии и физике.
Справочник
Основные формулы, таблицы и теоремы для учащихся. Все что нужно, чтобы сделать домашнее задание!
Заказать решение
Не можете решить контрольную?! Мы поможем! Более 20 000 авторов выполнят вашу работу от 100 руб!
- Химическая формула: CH3COOH
- Брутто-формула: C2H4O2
- Структурная формула:
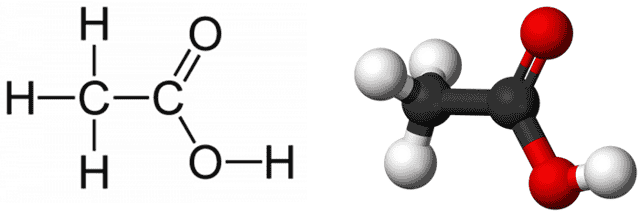
Молярная масса: 60,05 г/моль.
Уксусная кислота – предельная одноосновная карбоновая кислота. Образует соли – ацетаты.
Слабая кислота, константа диссоциации Ka=1,75 •10–5, рКа = 4,76.
Физические свойства уксусной кислоты
Уксусная кислота — бесцветная жидкость с резким характерным запахом, кислым вкусом. Гигроскопична, неограниченно растворяется в воде. Существует в виде димеров. Безводная уксусная кислота называется ледяной, поскольку при замерзании образует льдовидную массу.
Химические свойства уксусной кислоты
Уксусная кислота проявляет все основные свойствами карбоновых кислот.
- Взаимодействует с активными металлами с образованием водорода и соответствующих солей (ацетатов):
- Взаимодействует с оксидами металлов:
- Взаимодействует с гидроксидами металлов:
- В присутствии серной кислоты вступает в реакцию этерификации с образованием сложных эфиров:
- Вступает в реакции галогенирования с образованием галогенуксусных кислот:
- Реакция горения:
- Качественной реакцией на соли уксусной кислоты является взаимодействие с сильными кислотами. Уксусная кислота слабая и вытесняется сильными кислотами из растворов солей, при этом появляется ее характерный запах:
- Получение. Наиболее экономически выгодный промышленный способ получения уксусной кислоты – карбонилирование метанола моноксидом углерода, катализатор – соли родия, промотор – иодид-ионы:
- Биохимический способ – окисление этанола:
Водные растворы уксусной кислоты используются в пищевой промышленности (пищевая добавка E260), бытовой кулинарии, и консервировании. Уксусную кислоту применяют для получения лекарственных и душистых веществ, в качестве растворителя.
| Концентрированная уксусная кислота (с концентрацией более 30%) способна вызывать химические ожоги. Пары уксусной кислоты раздражают слизистые оболочки верхних дыхательных путей |
Примеры решения задач
| Понравился сайт? Расскажи друзьям! |
§ 20. УКСУСНАЯ КИСЛОТА



Безводная (ледяная) уксусная кислота СН 3 СООН представляет собой бесцветную гигроскопическую жидкость или бесцветные кристаллы с резким запахом. Она смешивается с водой, этиловым спиртом и диэтиловым эфиром во всех соотношениях. Эта кислота перегоняется с водяным паром. Уксусную кислоту получают при брожении некоторых органических веществ и путем синтеза. Эта кислота содержится в продуктах сухой перегонки дерева. В небольших количествах уксусная кислота может содержаться в человеческом организме.
Применение. Действие на организм. Уксусная кислота применяется для синтеза красителей, получения ацетата целлюлозы, ацетона и многих других веществ. В виде уксуса и уксусной эссенции она применяется в пищевой промышленности и в быту для приготовления пищи.
Отмечены случаи отравления уксусной кислотой (главным образом уксусной эссенцией), принятой внутрь. 10—20 г уксусной эссенции или 200—300 мл уксуса является смертельной дозой. Уксусная кислота оказывает действие на кровь и почки. При контакте с кожей ледяная уксусная кислота вызывает ожоги и образование пузырьков.
После приема концентрированной уксусной кислоты или уксусной эссенции внутрь поражается верхняя часть пищевого канала, появляется кровавая рвота, понос, развивается гемолитическая анемия, гемогло-бинурия, анурия и уремия.
При вдыхании паров уксусной кислоты происходит раздражение слизистых оболочек дыхательных путей, могут развиваться бронхопневмония, катаральный бронхит, воспаление глотки и г. д.
Метаболизм. Метаболитом уксусной кислоты является ацетальдегид, превращающийся частично в этиловый спирт и частично разлагающийся с образованием оксида углерода (IV) и воды.
Уксусная кислота относится к веществам, изолируемым из объектов перегонкой с водяным паром. В отличие от других веществ этой группы уксусную кислоту отгоняют из объектов биологического происхождения, подкисленных 10 %-м раствором серной или фосфорной кислоты.
Перегонку уксусной кислоты производят до отрицательной реакции дистиллята на наличие этой кислоты. Ввиду ее летучести дистиллят собирают в сосуд, содержащий 0,1 н. раствор гидроксида натрия. В дистилляте ацетат-ионы определяют при помощи перечисленных ниже реакций.
Обнаружение уксусной кислоты
Реакция с хлоридом железа (III). От прибавления хлорида железа (III) к ацетат-ионам появляется красная окраска, обусловленная образованием основного ацетата железа:
Выполнение реакции. 2—3 мл дистиллята вносят в пробирку и прибавляют 1 каплю 5 %-го свежеприготовленного раствора хлорида железа (III). Появление красной окраски указывает на наличие ацетат-ионов в дистилляте. При нагревании окрашенного раствора происходит гидролиз, в результате которого выпадает бурый осадок.
Предел обнаружения: 1,25 мг ацетат-ионов в 1 мл дистиллята.
Реакция с нитратом лантана и иодом. При взаимодействии ацетат-ионов с нитратом лантана La(NO 3 ) 3 в присутствии иода и аммиака раствор приобретает темно-синюю окраску или выпадает такого же цвета осадок. Появление этой окраски или осадка обусловлено адсорбцией иода основным ацетатом лантана. Подобную окраску дают и пропионаты.
Выполнение реакции. К 1 мл дистиллята прибавляют 0,5 мл 5 %-го водного раствора нитрата лантана, 0,5 мл 0,25 %-го спиртового раствора иода и 5 капель 2 н. раствора аммиака. Появление интенсивной синей или коричнево-фиолетовой окраски указывает на наличие ацетат-ионов в дистилляте.
Предел обнаружения: 500 мкг ацетат-ионов в 1 мл. Этой реакции мешают сульфаты, фосфаты и катионы, дающие с аммиаком осадки.
Реакция образования индиго. При нагревании уксусной кислоты или ацетатов с солями кальция образуется ацетон:
Образовавшийся ацетон в присутствии щелочей взаимодействует с о -нитробензальдегидом. При этом образуется ряд промежуточных продуктов. Конечным продуктом реакции является, индиго. Уравнение этой реакции приведено выше (см. гл. IV, §11).
Выполнение реакции. Около половины дистиллята вносят в пробирку и выпаривают досуха. К сухому остатку прибавляют смесь равных количеств оксида кальция и карбоната кальция.
Отверстие пробирки накрывают фильтровальной бумагой, смоченной свежеприготовленным раствором о -нитробензальдегида в 5 %-м растворе гидроксида натрия. Затем пробирку нагревают на пламени газовой горелки до прокаливания ее содержимого.
При наличии ацетат-ионов в исследуемом растворе на бумаге, пропитанной раствором о -нитробензальдегида, появляется синее пятно (окраска индиго).
Эту реакцию дают соединения, при гидролизе которых образуется группа СН 3 СО—. К таким соединениям относятся диацетил и др.
Реакция образования уксусно-этилового эфира. При нагревании ацетатов с этиловым спиртом в присутствии серной кислоты образуется уксусно-этиловый эфир (этилацетат):
Выполнение реакции. В пробирку вносят 3—5 мл дистиллята и выпаривают досуха. К сухому остатку прибавляют 1 мл этилового спирта и 2 мл концентрированной серной кислоты, а затем смесь осторожно нагревают на пламени горелки. При наличии ацетатов в дистилляте появляется специфический запах этилацетата.
- СОДЕРЖАНИЕ
- ПРЕДЫДУЩАЯ | СЛЕДУЮЩАЯ
- Еще по теме:
Химические свойства уксусной кислоты


Средняя оценка: 4.2
Всего получено оценок: 618.
Обновлено 3 Декабря, 2020
Средняя оценка: 4.2
Всего получено оценок: 618.
Обновлено 3 Декабря, 2020
Этановая или уксусная кислота – это слабая карбоновая кислота, которая широко применяется в промышленности. Химические свойства уксусной кислоты определяет карбоксильная группа COOH.
Уксусная кислота (CH3COOH) – это концентрированный уксус, знакомый человечеству с давних времён. Его изготовляли путём брожения вина, т.е. углеводов и спиртов.
По физическим свойствам уксусная кислота – бесцветная жидкость с кислым вкусом и резким запахом. Попадание жидкости на слизистые оболочки вызывает химический ожог. Уксусная кислота обладает гигроскопичностью, т.е. способна поглощать водяные пары. Хорошо растворима в воде.
Рис. 1. Уксусная кислота.
Основные физические свойства уксуса:
- температура плавления – 16,75°C;
- плотность – 1,0492 г/см3;
- температура кипения – 118,1°C;
- молярная масса – 60,05 г/моль;
- теплота сгорания – 876,1 кДж/моль.
В уксусе растворяются неорганические вещества и газы, например, бескислородные кислоты – HF, HCl, HBr.
Способы получения уксусной кислоты:
- из ацетальдегида путём окисления атмосферным кислородом в присутствии катализатора Mn(CH3COO)2 и высокой температуре (50-60°С) – 2CH3CHO + O2 → 2CH3COOH;
- из метанола и угарного газа в присутствии катализаторов (Rh или Ir) – CH3OH + CO → CH3COOH;
- из н-бутана путём окисления в присутствии катализатора при давлении 50 атм и температуре 200°C – 2CH3CH2CH2CH3 + 5O2 → 4CH3COOH + 2H2O.
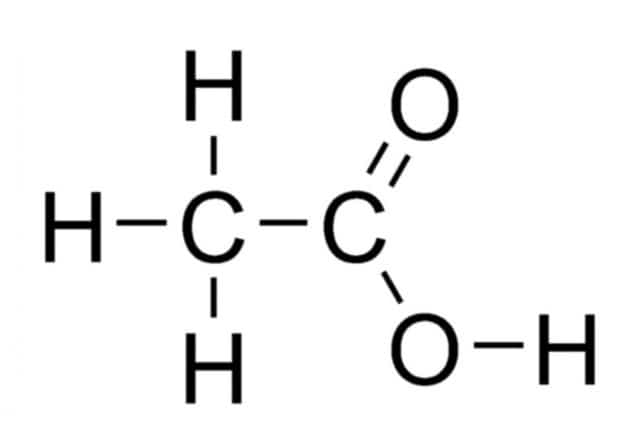 Рис. 2. Графическая формула уксусной кислоты.
Рис. 2. Графическая формула уксусной кислоты.
Уравнение брожения выглядит следующим образом – СН3СН2ОН + О2 → СН3СООН + Н2О. В качестве сырья используется сок или вино, кислород и ферменты бактерий или дрожжей.
Уксусная кислота проявляет слабые кислотные свойства. Основные реакции уксусной кислоты с различными веществами описаны в таблице.
| Взаимодействие | Что образуется | Пример |
| С металлами | Соль, водород | Mg + 2CH3COOH → (CH3COO)2Mg + H2 |
| С оксидами | Соль, вода | CaO + 2CH3COOH → (CH3COO)2Ca + H2O |
| С основаниями | Соль, вода | CH3COOH + NaOH → CH3COONa + H2O |
| С солью | Соль, углекислый газ, вода | 2CH3COOH + K2CO3 → 2CH3COOK + CO2 + H2O |
| С неметаллами (реакция замещения) | Органическая и неорганическая кислоты |
|
| С кислородом (реакция окисления) | Углекислый газ и вода | CH3COOH + 2O2 → 2CO2 + 2H2O |
Эфиры и соли, которые образует уксусная кислота, называются ацетатами.
Уксусная кислота широко применяется в различных отраслях:
- в фармацевтике – входит в состав лекарственных препаратов;
- в химической промышленности – используется для производства ацетона, красителей, ацетилцеллюлозы;
- в пищевой промышленности – применяется для консервации и вкуса;
- в лёгкой промышленности – используется для закрепления краски на ткани.
Уксусная кислота является пищевой добавкой под маркировкой Е260.
 Рис. 3. Использование уксусной кислоты.
Рис. 3. Использование уксусной кислоты.
CH3COOH – уксусная кислота, получаемая из ацетальдегида, метанола, н-бутана. Это бесцветная жидкость с кислым вкусом и резким запахом. Из разбавленной уксусной кислоты производят уксус.
Кислота обладает слабыми кислотными свойствами и реагирует с металлами, неметаллами, оксидами, основаниями, солями, кислородом.
Уксусная кислота широко применяется в фармацевтике, пищевой, химической и лёгкой промышленности.
Чтобы попасть сюда — пройдите тест.
Средняя оценка: 4.2
Всего получено оценок: 618.
А какая ваша оценка?
Гость завершил
Тест «Ася»с результатом 10/14
Гость завершил
Тест «Биография Шопена»с результатом 9/12
Гость завершил
Тест «Биография Благининой»с результатом 8/10
Гость завершил
Тест «Евгений Онегин»с результатом 4/16
Не подошло? Напиши в х, чего не хватает!
ПОИСК
Коррозионная активность уксусной кислоты и ее водных растворов изучена достаточно подробно (табл. 1.14).
[c.37]
О коррозионной активности уксусной кислоты дает представление табл. 1.14 подробные данные по стойкости материалов в хлористом натрии см. ВТ. 1, а в серной кислоте в т. 4 настоящего справочного руководства.
[c.316]
О коррозионной активности уксусной и муравьиной кислот можно судить по данным табл. 2 и 9.
[c.59]
Иногда в продукции скважин встречаются простейшие органические кислоты жирного ряда (уксусная, муравьиная и др.). Тем не менее ввиду малой концентрации они играют второстепенную роль по сравнению с коррозионной активностью других агрессивных компонентов.
[c.143]
Серную и соляную кислоты используют для травления, очистки от продуктов коррозии, накипи, лакокрасочных покрытий и асфальтосмолистых отложений. Применяют также уксусную, щавелевую, олеиновую, лимонную и нафтеновую кислоты. Коррозионная активность кислот уменьшается при введении в очистной раствор ингибирующих добавок.
[c.105]
Наличие в кислоте примесей значительно снижает коррозионную стойкость этих сплавов (см. табл. 14 и 16). Смеси органических кислот обладают, как правило, большей коррозионной активностью, чем отдельные кислоты.
Наиболее частым спутником уксусной кислоты является муравьиная кислота, присутствие которой сильно повышает агрессивные свойства уксусной кислоты по отношению к легированным сталям, монель-метал-лу, хастеллою С, однако смесь этих кислот заметно не увеличивает коррозию меди.
Поэтому на отечественных заводах аппаратуру, соприкасающуюся с нагретыми смесями уксусной кислоты с муравьиной, пропионовой, серной и др., обычно изготовляют из меди, а также из алюминиевой или оловянистой бронзы и, реже, из ферросилида.
[c.20]
Каждая стадия производства связана с применением уксусной кислоты, коррозионная активность которой в ряде случаев повыщается из-за присутствия в ней различных технологических примесей.
[c.44]
Ацетальдегид-ректификат, применяемый для получения уксусной кислоты, содержит до 99% ацетальдегида, до 0,3% кротонового альдегида и до 0,05% уксусной кислоты (остальное вода). Ацетальдегид обладает малой коррозионной активностью.
[c.46]
Для производства эфиров обычно используется полученная лесохимическим способом уксусная кислота-сырец, обладающая более активными коррозионными свойствами, в частности к меди и ее сплавам, чем чистая кислота.
Концентрация серной кислоты составляет 76—78% и 92—94%.
Серная кислота 76— 78%-НОЙ концентрации обладает высокой коррозионной активностью по отношению к черным металлам, поэтому при ее применении необходимы защитные футеровки (большей частью силикатные).
[c.125]
На возможность пассивирования металлов кислородом воды указывает и Хор. Основанием для такого утверждения явились эксперименты, в которых с помощью меченых атомов было установлено, что при анодном окислении никеля в серной кислоте из воды переходило на металл гораздо больше кислорода, чем из сульфат-ионов. В литературе встречается и ряд других указаний, свидетельствующих о пассивирующих свойствах воды. В частности, Эванс сообщает любопытный факт 99%-ная уксусная кислота не оказывала никакого коррозионного воздействия на алюминий, однако стоило из нее удалить 0,05% воды, как скорость коррозии увеличилась в 100 раз. В диметилформамиде, содержавшем серную кислоту, никель переходил в пассивное состояние, когда концентрация воды превышала 0,2%. В отсутствие воды никель активно растворялся. Описаны также случаи пассивирования титана незначительными количествами воды в неводных средах, а также алюминиевых сплавов и нержавеющих сталей в окислителях.
[c.70]
Безводный чистый этиловый спирт при обычной температуре практически не вызывает -коррозии углеродистой стали. Коррозионная активность применяемых в производстве технических спиртов обусловливается,наличием примесей и, следовательно, зависит от происхождения спирта и степени его очистки.
Установлено, что, например, недостаточно очищенные сульфитные спирты могут содержать следы сернистой кислоты и других сернистых соединений, агрессивное действие которых становится особенно заметным при повышенных, температурах.
Известно также, что даже самый чистый спирт при длительном соприкосновении с воздухом окисляется в ацетальдегид и далее в уксусную кислоту и приобретает кислую реакцию.
[c.164]
Коррозионные проблемы в отделении гидратации эфира в общем схожи С теми, которые возникают в печном цехе, где происходит каталитическое расщепление спирта.
Это и понятно, так как в обоих процессах, наряду с другими побочными продуктами образуется в небольшом количестве уксусная кислота, которая и придает производственным средам коррозионную активность.
Высокие температуры, характерные для процесса гидратации эфира, не позволяют применять на этом участке какие-либо покрытия. Таким, образом, вопросы борьбы с коррозией сводятся к выбору коррозионностойкого металла.
[c.188]
Муравьиная кислота наиболее коррозионно активная, часто присутствует в виде примесей в других кислотах, причем особенно часто в уксусной. Поэтому представляло интерес определить влияние добавок муравьиной кислоты на скорость коррозии металлов в уксусной кислоте.
[c.180]
Хромоникельмолибденовые стали. К этой группе относятся хромоникелевые стали, дополнительно легированные 2—4 % Мо. Молибден повышает коррозионную стойкость сталей в условиях воздействия фосфорной, муравьиной, уксусной кислот и других средах повышенной агрессивности.
Повышение содержания N1 по сравнению со сталями типа 18-10 сопряжено с уменьшением растворимости С и соответственно повышением его активности при образовании карбидных фаз. По этой причине стали этой группы часто стабилизируют Ti или Nb.
[c.
273]
В органических кислотах достаточно устойчивы. Обычно применяемый уксус (4—5%-ная уксусная кислота) на правильно закаленную полированную хромистую сталь типа Х13 не действует, но зато заметно разъедает сталь при неполированной поверхности, а также неправильно термически обработанную, или сталь с заниженным процентом хрома, или с завышенным содержанием углерода.
Это является пробой качества ножевого товара из этих сталей. Фруктовые соки по своему коррозионному действию аналогичны уксусу. Характерно, однако, что лимонный сок не вызывает коррозии этих сталей, в то время как чистая лимонная кислота той же концентрации оказывается коррозионно-активной. Это объясняется наличием природных ингибиторов в естественном лимонном соке.
[c.
483]
Высокохромистые сплавы обладают высокой коррозионной стойкостью в окислительных и других активных средах (азотная кислота, концентрированная серная кислота, уксусная, фосфорная, большинство органических кислот, формалин, фурфурол, белильная известь, растворы солей, щелочи, морская вода и др.).
[c.227]
Пропионовая кислота и ее растворы обладают не меньшей коррозионной активностью по отношению к черным и цветным металлам, чем уксусная кислота. Горячие высококонцентрированные растворы пропионовой кислоты действуют на алюминий слабее, чем 80%-ная и менее концентрированные кислоты. Коррозия меди в нагретой до 100° концентрированной пропионовой кислоте достигает 9 мм1год.
[c.59]
Водные растворы уксуснокислых солей обладают значительно меньщей коррозионной активностью, чем растворы уксусной кислоты (ср. табл. 2 и 27).
Однако применение стальной аппаратуры и коммуникаций не может быть рекомендовано ни для солей щелочных металлов, вызывающих ржавление, ни для солей тяжелых металлов, обладающих вследствие гидролиза кислой реакцией, обусловливающей кислотную коррозию.
Кроме того, при контакте растворов уксуснокислой меди и некоторых других солей тяжелых металлов с железом на последнем высаживается медь или другой металл, обладающий более высоким потенциалом, чем железо, что приводит к интенсивной контакторной коррозии.
[c.130]
Детали машин и области применения детали и узлы основного оборудования трубопроводов АЭУ с водяным теплоносителем трубы для перегревателей и коллекторов тепловых эле1сгростанций, работающие при температуре 610. .. 640 °С. Сварные аппараты и сосуды, работающие в коррозионно-активных средах (разбавленные растворы азотной, уксусной, фосфорной кислот, растворы щелочей и солей).
[c.176]
Основные технологические стадии, хлорирование фенола до трихлорфенола при 60—65° С и последующее окислительное хлорирование при 80—85° С в среде ледяной и 96%-ной серной кислоты сопровождаются выделением большого количества, до 80% в абгазах, активного коррозионного агента хлористого водорода. Кроме того, уксусная кислота 30—100%-ной концентрации в соответствии с ГОСТом 13819-68 относится к среде и сильно агрессивным средам.
[c.121]
При испытании алюминиевых сплавов с анодной пленкой по методу погружения в электролит необходимо предусмотреть частую смену раствора, если анодная пленка наполнена хромпиком. В первый период испытания раствор меняют каждые сутки, затем один раз в пять суток.
Смена раствора необходима потому, что из наполненной пленки вымывается хромпик, который снижает коррозионную активность раствора. Алюминиевые сплавы с анодной пленкой, предназначенные для применения в промышленной атмосфере, по данным работы [11], можно испытывать, применяя ускоренный метод корродкот.
Хорошие результаты получаются при испытании во влажных камерах с распылением растворов хлористого натрия, содержащих уксусную кислоту и СиС1г (СА 55-испытание).
[c.181]
Фурфурол как растворитель имеет ряд положительных качеств высокая селективная способность, сравнительно низкая температура кипения, высокая температура обработки при экстракции, дающая возможность легкого смешения раствора с маслом, быстрого достижения равновесия и быстрого отстаивания.
Но у фурфурола есть и такой серьезный недостаток, как нестабильность при перегонке н хранении под действием кислорода воздуха, света, влаги, кислот и в результате повышения температуры фурфурол разлагается (окисляется) [10—13]. Продуктами окисления фурфурола являются муравьиная, уксусная, фуранкарбоновая, р-формил-акриловая кислоты.
Образование этих кислых продуктов и накопление их в фурфуроле оказывает значительное влияние на коррозионную активность фурфурола.
[c.241]
На каждой стадии производства в рабочих средах присутствует уксусная кислота, коррозионная активность которой во многих случаях возрастает вследствие стимулирующего влияния примесей. На опасных участках используется обычно хромоникелемолибдено-вая сталь, а там, где среды менее агрессивны, — алюминий.
[c.53]
Таким образом, в процессе этерификации коррозионная активность среды возрастает из-за введения полярных растворителей — метанола, воды, которые способствуют повышению константы ионизации Н2504, и образования промежуточных продуктов синтеза — муравьиной и уксусной кислот.
К факторам, снижающим скорость коррозии, относятся понижение температуры на стадии этерификации до 87—95 °С и образование эфира (ММА).
Коррозионная активность ацетона, диметило-вого эфира, метилакрилата, метилизобутирата по отношению к металлам не выше, чем у ММА, поэтому указанные примеси в составе сред идут под общим названием органические примеси .
[c.107]
На стадиях полимеризации, отделения непрореагировавшего ПВА, омыления, промывки и отжима ПВС, подсушки и растворения ПВС рабочие среды обладают слабой и средней агрессивностью по отношению к конструкционным материалам.
Наиболее агрессивные компоненты — уксусная кислота (0,1—0,2%), масляная кислота (0,1—0,2%), ацетат натрия (до 0,05%), метиловый спирт.
На этих стадиях процесса используют оборудование из высоколегированной стали 12Х18Н10Т, углеродистой стали со стеклоэмалевым покрытием, технического алюминия. На стадиях ацеталирования и промывки ПВС применяют оборудование из углеродистой стали со стеклоэмалевым покрытием.
Это связано с тем, что на стадии ацеталирования вводят катализатор — соляную кислоту, наличие которой (0,4—0,001 %), а также хлорида натрия определяет коррозионную активность сред на всех последующих стадиях процесса.
[c.297]
В аэрированной 90%-ной СНдСООН, содержащей 2 и 3% НСООН, при 90° С при анодной поляризации сталь ОХ21Н5Т активна при высоких плотностях тока, потенциал незначительно смещается в положительную сторону при токе, большем 1000 мка см-.
Затруднение поляризации хромоникелевых сталей в растворах уксусной кислоты с НСООН указывает на облегчение коррозионного процесса этих сталей.
На анодную поляризуемость и скорость коррозии хромоникельмолибденовых сталей в таких же условиях муравьиная кислота оказывает меньшее влияние.
[c.171]
НЫХ Аткинса 1. Следы органических кислот, как например, лимонной, яблочной или уксусной, происходят, возможно, из болотной растительности Очень сильной является коррозия, вызываемая водами пустынь, содержащими хлористый магний — соль, которая может в результате гидролиза сообщать воде кислую реакцию. Было уже давно установлено, что вода, текущая по трубопроводу, построенному для снабжения золотых россыпей Кульгарди (Зашадная Австралия), сохраняет свой коррозионный характер даже после удаления кислорода, вследствие присутствия хлористого магния. Обработка известью уменьшает коррозионную активность, но не совсем, так как последняя зависит также и от присутствия кислорода. Комбинированный метод, состоящий из деаэрации и известковой обработки, согласно данным О Брайэна и Парра дает гораздо лучшие результаты.
[c.357]
Влияние солей на коррозию в кислотах.
Добавка солей к кислоте может иметь двоякое влияние на ее коррозионную активность, так как (1) соль увеличивает ее проводимость и, может способствовать образованию комплексных ионов (оба эти фактора благоприятствуют коррозии), однако (2) во многих случаях соль может адсорбироваться металлом и оказать частичную защиту. Вальперт — установил, что добавка соли, стимулирующей коррозию хрома в серной кислоте, может задержать коррозию железа. Коррозия железа в 8 N серной кислоте задерживается соляной, муравьиной, уксусной, пропионовой и масляной кислотами, повидимому, вследствие адсорбции. Задержку коррозии производят также иодистый, бромистый и хлористый натрий, причем наиболее эффективным является иодистый, а наименее — хлористый натрий. Питч приписывает это явление блокировке адсорбционных центров. Такие факты, как более быстрая коррозия железа в серной кислоте, чем в соляной (тогда как в случае цинка имеет место обратное явление), ускорение коррозии тиоциа-натом калия, коррозии кадмия в соляной кислоте и задержка этой добавкой коррозии алюминия при тех же концентрациях показывают, как трудно делать предсказания, когда одновременно действуют два противоположных фактора.
[c.386]
В керосиновых баках, встроенных в конструкцию крыла самолета, создаются особые условия, в которых жизнедеятельность микроорганизмов может вызвать интенсивную коррозию металла.
Развитию микроорганизмов в керосине способствуют влага, содержащая минеральные соли, водорастворимые компоненты, мер-коптаны, поверхностно-активные вещества, снижающие поверхностное натяжение между водой и поверхностью баков и усиливающие эффгкт смачивания, что способствует удержанию влаги на поверхности защитного покрытия бака. В керосине встречаются несколько десятков различных видов бактерий и н колько типов грибков. Продукты жизнедеятельности этих микроорганизмов содержат кислые вещества (муравьиную, уксусную, азотную и другие кислоты), усиливающие коррозионную активность электролита.
[c.46]
В процессе старения в масле образуются кислоты (муравьиная, уксусная, пропионовая, серная и др.), способные непосредственно вступать в химическую реакцию, особенно с металлом подшипниковых сплавов, вызывая их коррозию.
Наиболее чувствительными к коррозии являются свинцовистая бронза и свинцовистые баббиты. Эффективность действий антикоррозионных присадок связана прежде всего с защитными пленками, создаваемыми присадками на смазываемых деталях.
Они защищают металл от воздействия коррозионно-активных продуктов в масле, уменьшают каталитическое воздействие металла на окисление масла, препятствуют непосредственному контакту и схватыванию металлических поверхностей трущихся пар.
Применяемые присадки имеют также нейтрализующие свойства за счет повышенной щелочности. Поэтому важнейшее значение имеют юющие присадки, которые имеются в маслах М14ВЦ, М14ВИ и др. [14, 351.
[c.210]
При помощи потенциостатических анодных поляризационных кривых выяснены причины двойственного поведения нержавеющих сталей в смеси уксусной и муравьиной кислот.
Показано, что нержавеющие стали IX17H2 и Х18Н9Т могут находиться в смеси кислот в двух стационарных состояниях — активном и пассивном, причем возможен переход из одного состояния в другое как самопроизвольный, так и под влиянием внешних условий.
В пассивном состоянии стали в смеси кислот обладают высокой коррозионной стойкостью, в активном состоянии — малостойки. Пассивное состояние нержавеющих сталей в смеси кислот неустойчиво и легко может быть нарушено.
[c.23]






