- Металлы главной подгруппы II группы
- Характеристические соединения
- Физические свойства
- Способы получения
- Химические свойства
- Взаимодействие с кислородом и азотом при горении на воздухе
- Взаимодействие с водой
- Взаимодействие с углекислым газом и др. оксидами
- Взаимодействие с оксидами и солями металлов
- Взаимодействие с галогенопроизводными УВ (в среде безводного эфира)
- Кальций
- Химические свойства
- 1 . Взаимодействие с простыми веществами — неметаллами
- 2. Взаимодействие с водой и кислотами с выделением Н2
- 3. Взаимодействие с азотной и концентрированной серной кислотами
- Атомы элементов 2(IIa) группы
- Химические свойства Mg, Ca
- Получение магния и кальция
- Применение
- II группа главная подгруппа Периодической таблицы Менделеева (щелочноземельные металлы)
- Взаимодействие со сложными веществами
- Щелочноземельные металлы: общая характеристика, строение; свойства и получение — урок. Химия, 9 класс
- Общая характеристика элементов главной подгруппы II группы

Металлы II группы главной подгруппы
Учитель МБОУ «ОСОШ № 2»
Москвитина И.В .

Металлы II группы главной подгруппы Цель : Дать общую характеристику металлам II группы (А) главной подгруппы П.С.Х.Э. Д.И.Менделеева.
ЗАДАЧИ УРОКА:
- Рассмотреть электронное строение атомов
- Изучить физические и химические свойства металлов II А группы
- Формировать умение записывать химические свойства в виде уравнений

- Положение металлов в Периодической системе
- Изменение свойств в группе
- История названия
- Нахождение в природе
- Физические свойства
- Химические свойства
- Закрепление

- Металлы II группы главной подгруппы
- B е бериллий
- Mg магний
- Ca кальций
- Sr стронций
- Ba барий
- R а радий

Щелочноземельные металлы: Mg Ca Sr Ba R а
- Происхождение этого названия связано с тем, что их гидроксиды являются щелочами, а оксиды по тугоплавкости сходны с оксидами алюминия и железа, носившими ранее общее название «земли»
R а — редкий радиоактивный элемент, 40т минерала карналлита содержит 1г радия.

- Строение атома
- Mg +12 2 ē , 8 ē , 2 ē
- Ca +20 2 ē , 8 ē , 8 ē , 2 ē
- Sr +38 2 ē , 8 ē , 18 ē , 8 ē , 2 ē
- Ba +56 2 ē , 8 ē , 18 ē , 18 ē , 8 ē , 2 ē
- Что общего в атомном строении ?

- Бериллий, магний и щелочноземельные металлы находятся в IIA-группе
- Строение внешнего энергетического уровня ns 2
- Максимальная степень окисления +2
- Валентность — II
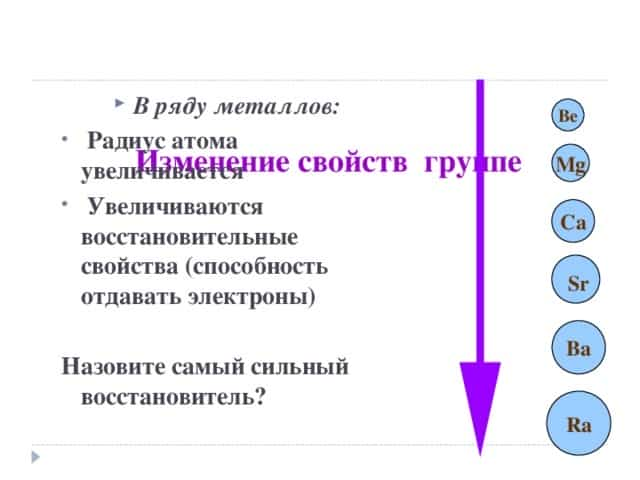
Изменение свойств группе
- Радиус атома увеличивается
- Увеличиваются восстановительные свойства (способность отдавать электроны)
- Назовите самый сильный восстановитель?
- Ве
- Мg
- Ca
- Sr
- Ba
- Ra

- Физические свойства
- Щелочные металлы легкие, мягкие и легкоплавкие, серебристы, стронций имеет золотистый оттенок.
- Кальций — твердый и пластичный
- Бериллий — светло-серый, твердый, хрупкий
- Стронций — ковкий
- Магний — относительно мягкий, пластичный, ковкий
- 8
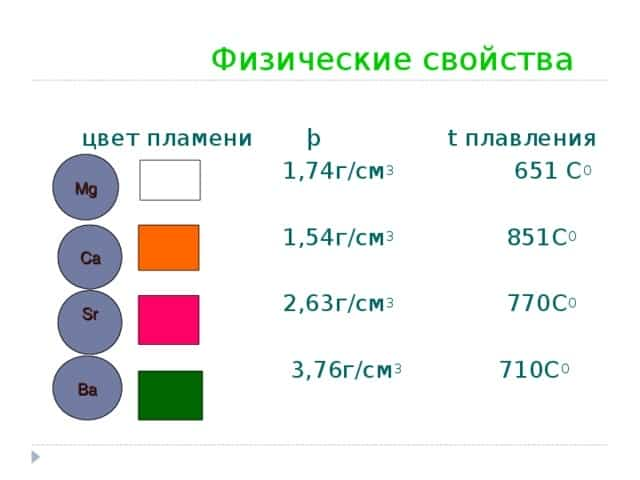
- Физические свойства
- цвет пламени þ t плавления
- 1,74г/ см 3 651 С 0
- 1,54г/ см 3 851 С 0
- 2,63г/ см 3 770 С 0
- 3,76г/ см 3 710 С 0
- Mg
- Ca
- Sr
- Ba
ОТКРЫТИЕ МЕТАЛЛОВ
- Магний и кальций были впервые получены английским химиком и физиком Г. Дэви в 1808 г.
- Магний из белой магнезии. По названию минерала дали название элементу.
- Название элемента кальций происходит от лат. Слова кальс, что означает «известь, мягкий камень».
Гемфри Дэви
(1778 – 1829)
- Нахождение в природе
- Как активные металлы, они встречаются в природе только в виде соединений
- Кальциевые горные породы – известняк, мрамор, мел.
- Магниевая горная порода – магнезит.
MgCO 3
Карбонат магния — широко применяется в производстве стекла, цемента, кирпича, а также в металлургии для перевода пустой породы в шлак.
В природе: CaCO 3
Карбонат кальция – одно из самых распространённых на Земле соединений. Его содержат горные породы – мел, мрамор, известняк. Природный мел — представляет собой остатки раковин древних животных используется при производстве зубной пасты, школьного мела.
Известняк – используется в строительстве как прекрасный строительный камень и как сырьё для получения: цемента, гашеной и негашеной извести, стекла. Мрамор — минерал скульпторов, архитекторов и облицовщиков.
Из него создавал свои творения Микеланджело, стены всемирно известного индийского мавзолея Тадж-Махал выложены из мрамора, им же облицованы многие станции московского метро.
CaSO 4 ∙ 2H 2 O
Встречается в природе в виде минерала гипса, представляющего собой кристаллогидрат – сульфата кальция. Используется в строительстве, в медицине для наложения гипсовых повязок, для получения слепков.
Встречается в природе в виде минерала гипса, представляющего собой кристаллогидрат. Используется в строительстве, в медицине для наложения гипсовых повязок, для получения слепков.
Mg S O 4
Сульфат магния — известный под названием горькая, или английская, соль, используют в медицине в качестве слабительного. Содержится в морской воде и придаёт ей горький вкус
Ca 3 (PO 4 ) 2
Фосфат кальция — входит в состав фосфоритов ( горная порода) и апатитов (минерал) , а также в состав костей и зубов. В организме взрослого человека содержится более 1 кг Са в виде фосфата кальция .
BaSO 4
Сульфат бария – баритовая каша, благодаря нерастворимости и способности задерживать рентгеновские лучи применяется в рентгенодиагностике.
Са(ОН) 2
Гидроксид кальция или гашеная известь называется известковым раствором, образуется при взаимодействии оксида кальция с водой, реакция сопровождается большим количеством тепла.
Прозрачный раствор Са(ОН) 2 называют известковой водой, а белую взвесь в воде известковым молоком. Гашеную известь широко используют в строительстве.
Известковое молоко применяют в сахарной промышленности для очистки свекловичного сока. При нагревании Са(ОН) 2 разлагается на оксид и воду.
- Химические свойства
- 2Me 0 + O 0 2 → 2Me +2 O -2 оксид
- Me 0 + H 0 2 → Me +2 H 2 гидрид
- Me 0 +Cl 0 2 → Me +2 Cl 2 хлорид
- Me 0 + N 0 2 → Me 3 +2 N -3 2 НИТРИД
- Me 0 + S 0 → Me +2 S -2 сульфид
- Me 0 + 2HCl → Me +2 Cl 2 + H 2
- Me 0 + 2H 2 O → Me +2 (OH) 2 + Н 2
- гидроксид
- вывод
Особенность бериллия:
- Бериллий – переходный элемент
- Бериллий и его соединения проявляют амфотерные свойства, реагируют с кислотами и щелочами
- Ве + 2НС l = ВеС l 2 + Н 2
- Ве + 2 N аОН = N а 2 ВеО 2 + Н 2
- Практически не взаимодействует с водой
- Ве + Н 2 О =(реакция не идёт)
т.к. препятствует защитная плёнка на его поверхности
- Проверка знаний (Самостоятельная работа)
- Запишите конкретные уравнения реакции, на примере кальция, расставьте коэффициенты методом электронного баланса
- а) Са + S = _______ г) Са + С1 2 = ______
- б) Са + N 2 = _______ д) Са + Н 2 О = ______
- в) Са + Н 2 = _______
- ____
Домашнее задание:
Итог урока
- Познакомились с металлами II группы главной подгруппы П.С.Х.Э. Д.И.Менделеева
- Узнали общую характеристику металлов II группы главной подгруппы
- Рассмотрели электронное строение атомов
- Изучили физические и химические свойства
- Узнали о важнейших соединениях этих металлов и области их применения
Используемая литература
- Габриелян О.С. Химия 9.-Москва.:Дрофа, 2013
- Габриелян О.С., Остроумов И.Г. Настольная книга учителя. Химия 9. -Москва: Дрофа 2010
Габриелян О.С. Контрольные и проверочные работы. Химия 9. -Москва.:Дрофа, 2011.
Спасибо за внимание
- Проверь себя (самостоятельная работа )
- Решить задачу №1 стр.67
- Дано: Решение:
- ω (костей) = 0,2 пусть m (организма) =50 кг
- ω (Са 3 (РО 4 ) 2 = 0,2 m (костей) = m (организма) . ω (костей) =
Найти: 50 кг . 0.2=10 кг.
m (Са 3 (РО 4 ) 2 — ?
m (Са) — ? m (Са 3 (РО 4 ) 2 = m (костей) . ω (Са 3 (РО 4 ) 2=
10 . 0,2 = 2кг
М(Са 3 (РО 4 ) 2 =40 . 3 +(31+18+ 16 . 4)2=310г/ моль
в 310 г содержится 120 г
2000г —————— x Г
Металлы главной подгруппы II группы
- 4Be 1s22s2
- 12Mg [Ne]3s2
- 20Са [Ar]4s2
- 28Sr [Kr]5s2
- 56Ba [Xe]6s2
- 88Ra [Rn]7s2
- Групповое сходство элементов обусловлено наличием 2-х спаренных электронов на внешнем электронном слое и заключается в следующем:
- — постоянная валентность II
- — постоянная степень окисления +2
- — легкость образования 2-зарядных ионов Me+2
- С ростом заряда ядра и радиуса атомов свойства элементов закономерно изменяются:
- — энергия ионизации Еион уменьшается
- — сродство атомов к электрону уменьшается
- — электроотрицательность уменьшается
- — металлические свойства усиливаются
По важнейшим атомным характеристикам и по физико-химическим свойствам металлов и их соединений наибольшим сходством между собой обладают Са, Sr , Ba , имеющие общее название — щелочноземельные металлы. Эти элементы имеют практически одинаковые значения ЭО, находятся рядом в электрохимическом ряду напряжений; химическая активность в целом от Са к Ва возрастает незначительно; они во многих отношениях сходны со щелочными металлами.
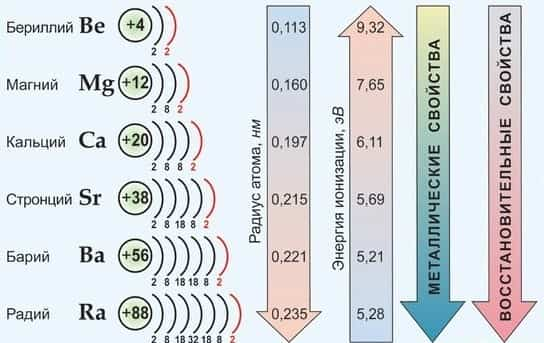
Среди s2-элементов резко выделяется бериллий, который обнаруживает более значительное сходство с алюминием (диагональное сходство).
По распространенности в природе и по практической значимости важнейшими элементами являются Са и Mg.
В свободном состоянии в виде простых веществ все s2-элементы — белые твердые вещества с металлическим блеском на срезе, обладающие всеми общими свойствами металлов. Лишь бериллий хрупкий и плохо поддается обработке.
Характеристические соединения
| Оксиды | Гидроксиды | ||||
| формула | характер | отношение к воде | формула | характер | отношение к воде |
| ВеО | амфотерный | не растворимый, не взаимодействует | Ве(ОН)2 Н2ВеO2 |
амфотерный | не растворимый |
| МgО | основный | не растворимый, не взаимодействует | Mg(ОН)2 | слабое основание | не растворимый |
| СаО | основные | хорошо растворимые, взаимодействуют | Са(ОН)2 | сильные основания | мало растворимый |
| SrO | Sr(ОН)2 | растворимый | |||
| BaO | Bа(ОН)2 | растворимый |
- 12Mg [Ne]3s2
- Ar 24.305
- Изотопы 24Mg (78.60 %)
- 25Mg (10.11 %)
- 26Mg (11.29 %)
- ЭО 1.2
- E° -2,37 В
Кларк в земной коре 2,35 % по массе. В свободном виде не встречается. Является одним из самых распространенных породообразующих элементов (более 200 минералов).
Основные из них:
— магнезит MgCO3
— доломит СаСО3 • МgСО3
— карналлит КСl • МgСl2 • 6Н2O
— горькая (английская) соль MgS04• 7H2O В виде катионов Mg2+ находится в природных водах (в 1 м3 морской воды содержится около 1 кг Mg2+). Наряду с ионами Са2+обусловливает жесткость воды.
Магний и его соединения играют важную роль в биологических процессах. В качестве комплексообразователя Mg входит в молекулы хлорофилла, а также в другие важные биокомплексы.
Магний — единственный элемент гл. подгр. II группы, применяемый в сравнительно больших количествах в металлическом состоянии (как свободный металл).
Физические свойства
В чистом виде магний — блестящий серебристобелый металл, быстро тускнеющий на воздухе вследствие окисления. Это легкий, относительно мягкий и пластичный металл, легкоплавкий и обладающий хорошей электропроводностью. В сплавах с Al является основным конструкционным материалом в авиа-, судо- и ракетостроении.
Способы получения
1. Электролитический (основной). Электролизу подвергают тщательно обезвоженный расплав хлорида магния (t ≈ 800°C):
- MgCl2 = Mg + Cl2↑
- 2. Карботермический (t ˃ 2000°C)
- MgO + С = Mg↑(пары) + СО ↑
Химические свойства
Mg — химически активный металл, особенно в порошкообразном состоянии или в виде ленты. Во всех реакциях магний ведет себя как очень сильный восстановитель:
Mg — 2e- → Mg2+.
Как и другие активные металлы, Mg взаимодействует с кислотами, растворами солей менее активных металлов, со многими неметаллами. Ниже приведены реакции, в которых проявляются некоторые особенности химического поведения магния.
Взаимодействие с кислородом и азотом при горении на воздухе
Реакция сопровождается выделением болышого количества энергии. в т. ч в виде света. При этом ослепительно белое пламя обогащено фотохимически активными лучами (магниевая вспышка).
- Происходит одновременное образование оксида и нитрида:
- 2Мg + О2 = 2МgО
- ЗМg + N2 = Mg3N2
Взаимодействие с водой
- При обычной температуре Мg с водой не реагирует, так как сразу покрывается плотной пленкой — нерастворимым в воде Мg(ОН)2
- 1) Мg активно реагирует с кипящей водой:
- Мg+ 2Н2O = Мg(ОН)2 + H2↑
- 2) особенно активно реагирует с водяным паром (Т > 380°С), поэтому совершенно недопустимо тушить горящий Мg водой — это может привести к взрыву.
- 3) Мд легко растворяется в воде в присутствии NH4CI:
- Mg + 2Н2O+ 2NH4Cl = MgCl2 + H2↑ + 2NH3•Н2O
- Протеканию реакции способствует кислая среда, образующаяся в результате гидролиза NH4Cl
Взаимодействие с углекислым газом и др. оксидами
Благодаря сильному сродству к кислороду Мg отнимает его у многих оксидов, например, зажженный Мg продолжает гореть в атмосфере CO2 восстанавливая его до свободного углерода:
2Мg + CO2 = 2МgО + С
Взаимодействие с оксидами и солями металлов
См. «Основные способы получения металлов. Магнийтермия».
Взаимодействие с галогенопроизводными УВ (в среде безводного эфира)
- Мg + С2Н5Сl → С2Н5-Мg-Сl этилмагнийхлорид
- Мg + С6Н5Br → С6Н5-Мg-Br фенилмагнийбромид
- Образующиеся Мg-органические соединения носят общее название реактивов Гриньяра и широко используются в органическом синтезе.
Кальций
- 20Ca [Ar]4s2
- Аr 40.08
- Основные изотопы:
- 40Са (96.94 %)
- 44Са (2.09 %)
- 422Са (0.667 %)
- ЭО 1.0
- Е° -2.
86 В
- Один из основных породообразующих элементов; входит в состав многочисленных минералов в виде соединений:
- — СаСО3 (мел, мрамор, известняк)
- — СаСО3 • МgСО3 (доломит)
- — CaSO4 (ангидрит)
- — CaSO4• 2Н2O (гипс)
Химические свойства
Кальций — один из самых активных металлов; во всех реакциях участвует как сильный восстановитель:
Са° — 2e- → Са2+
1 . Взаимодействие с простыми веществами — неметаллами
- а) при горении на воздухе образуется преимущественно оксид;
- 2Са + O2 = 2СаО оксид
- б) при Т — 500° частично происходит реакция с азотом:
- ЗСа + N2 = Ca3N2 нитрид
- Са + Cl2 = CaCI2 хлорид
- в) взаимодействие с серой, фосфором, углеродом, кремнием:
- Са + S = CaS сульфид
- ЗСа + 2Р = Са3Р2 фосфид
- Са + 2С = СаС2 карбид
- Са + 2Si = CaSi 2 силицид
- г) нагревание в струе Н2 сопровождается воспламенением:
- Са + Н2 = СаН2 гидрид
2. Взаимодействие с водой и кислотами с выделением Н2
- (кроме HF и Н3РO4, из-за нерастворимости фторида CaF2 и фосфата Са3(РO4)2)
- Са +2Н2O = Са(ОН)2 + Н2;
- Са + 2HCl = СаСl2 + Н2
- Са + 2СН3СООН → (СН3СОО)2Са+ H2;
3. Взаимодействие с азотной и концентрированной серной кислотами
- 4Са +10HNO3(разб) = 4Ca(NO3)2 + NH4NO3 + 3H2O
- 5Са + 12HNO3(конц) = 5Ca(NO3)2 + N2 + 6Н2O
- ЗСа + 4H2SO4(конц) = 3CaSO4 + S + 4Н2O
Атомы элементов 2(IIa) группы
| Порядковый номер | 4 | 12 | 20 | 38 | 56 | 88 |
| Атомная масса (относительная) | 9,01 | 24,30 | 40,08 | 87,62 | 137,33 | 226 |
| Плотность (н.у.), г/см3 | 1,85 | 1,74 | 1,55 | 2,54 | 3,5 | 5,5 |
| tпл, К | 1551 | 923 | 1112 | 1042 | 1022 | 1233 |
| tкип, К | 3243 | 1363 | 1757 | 1657 | 1910 | 2010 |
| Энергия ионизации, кДж/моль | 899,0 | 737,7 | 589,7 | 549,5 | 502,8 | 509,3 (1-й электрон)979,0 (2-й) |
| Электронная формула | [He]2s2 | [Ne]3s2 | [Ar]4s2 | [Kr]5s2 | [Xe]6s2 | [Rn]7s2 |
| Электроотрицательность (по Поллингу) | 1,57 | 1,31 | 1,00 | 0,95 | 0,89 | 0,9 |
Электронные формулы инертных газов:
- He — 1s2;
- Ne — 1s22s22p6;
- Ar — 1s22s22p63s23p6;
- Kr — [Ar]3d104s24p6;
- Xe — [Kr]4d105s25p6;
- Rn — [Xe]4f145d106s26p6.
Рис. Строение атома магния.
Во 2 группу (IIa группу по старой классификации) периодической таблицы химических элементов Д. И. Менделеева входят 6 металлов: бериллий, магний, кальций, стронций, барий, радий (см. таблицу выше).
Последние четыре — Ca, Sr, Ba, Ra называют щелочноземельными металлами, поскольку гидроксиды этих металлов обладают щелочными свойствами, а их оксиды по своей тугоплавкости похожи на оксиды тяжелых металлов, называемых ранее «землями».
Самым распространенным в земной коре элементом 2(IIa) группы является кальций (4,1% по массе), далее идут: магний (2,3%), барий (0,05%), стронций (0,037%), бериллий (0,00026%), радий (6·10-11).
Наиболее важным элементом подгруппы берилия является кальций, который входит в состав костей всех животных и человека, определяя их прочность. Концентрация ионов кальция и магния в воде определяет ее жесткость.
Элементы 2(IIa) группы в свободном виде в природе не встречаются, но входят в состав многих соединений:
- Be:
- 3BeO·Al2O3·SiO2 — минерал берилл;
- берилл с примесью Cr2O3 — изумруд;
- берилл с примесью Fe — аквамарин;
- (BeAl2)O4 — хризоберилл;
- (BeAl2)O4 с примесью Cr — александрит.
- Mg:
- MgCO3·CaCO3 — доломит;
- MgCO3 — магнезит;
- MgO·Al2O3 — шпинель;
- 2MgO·SiO3 — оливин;
- магний содержится в морской воде, а также входит в состав хлорофилла — важнейшей части фотосинтезирующего аппарата растений.
- Ca:
- CaCO3 — кальцит;
- CaSO4·2H2O — гипс;
- CaF2 — флюорит;
- Ca5(PO4)3F — фторапатит;
- Ca3(PO4)2 — фосфат кальция.
- Sr и Ba встречаются в виде карбонатов и сульфатов.
Физические свойства:
- металлы II группы имеют серебристо-белый цвет;
- низкую плотность (плотность увеличивается в подгруппе сверху-вниз);
- низкую температуру плавления (температуры плавления уменьшаются в подгруппе сверху-вниз);
- обладают высокой пластичностью;
- высокой электро- и теплопроводностью.
Все атомы элементов 2(IIa) группы на внешнем энергетическом уровне имеют по два валентных s-электрона (см. Электронная конфигурация атомов), с которыми в химических соединениях достаточно легко «расстаются», завершая, таким образом, свой внешний энергетический уровень, который становится устойчивым, по аналогии с завершенным энергетическим уровнем инертных газов.
Таким образом, отдавая «ненужные» валентные электроны (см. Валентность), элементы 2(IIa) группы в химических соединениях проявляют степень окисления +2, являясь сильными восстановителями, проявляя при этом высокую реакционную способность.
С ростом порядкового номера химического элемента увеличивается не только общее кол-во электронов (энергетических уровней), но также и радиус атома, что в свою очередь, обуславливает уменьшение энергии ионизации (соответственно усиление металлических свойств элемента) в направлении от бериллия к радию. В этом ряду активность металлов и их восстановительные свойства возрастают.
Наибольшее значение из всех шести элементов 2(IIa) группы имеют магний и кальций — металлы серебристо-белого цвета, мягкие и очень легкие, о них и пойдет речь дальше.
Химические свойства Mg, Ca
- при нагревании выше 600°C магний сгорает на воздухе ослепительно ярким белым пламенем (при н. у. магний защищен оксидной пленкой), с образованием оксида и нитрида магния: O2 + 2Mg = 2MgO; N2 + 3Mg = Mg3N2;
- кальций на влажном воздухе быстро реагирует с кислородом покрываясь рыхлой пленкой (смесь оксида и гидроксида кальция), при нагревании в кислороде воспламеняется: O2 + 2Ca = 2CaO;
- при н. у. легко реагируют с галогенами, образуя галогениды: Ca + Cl2 = CaCl2; Mg + Cl2 = MgCl2;
- при нагревании реагируют с неметаллами, образуя гидриды, нитриды, сульфиды, карбиды:
- H2 + Mg = MgH2;
- N2 + 3Ca = Ca3N2;
- S + Mg = MgS;
- 2C + Ca = CaC2.
- при кипячении магний вытесняет из воды водород, образуя гидроксид магния (кальций реагирует с водой при н. у.
): 2H2O + Mg = Mg(OH)2 + H2; 2H2O + Ca = Ca(OH)2 + H2;
- реагируют с соляной и разбавленной серной кислотой: Ca + 2HCl = CaCl2 + H; Mg + H2SO4(рзб) = MgSO4 + H2;
- реагируют с разбавленной азотной кислотой, образуя нитрат аммония: 4Mg + 10HNO3(рзб) = 4Mg(NO3)2 + NH4NO3 + 3H2O;
- с концентрированной азотной кислотой (магний реагирует при нагревании): 4Mg + 10HNO3(кнц) = 4Mg(NO3)2 + N2O + 5H2O;
- с концентрированной серной кислотой: 4Mg + 5H2SO4(кнц) = 4CaSO4 + H2S + 4H2O;
- поскольку атомы элементов 2(IIa) группы являются сильными восстановителями, магний и кальций используются в реакциях восстановления металлов из их оксидов и галогенов, что находит широкое практическое применение в реакциях метллотермии, когда для получения редкоземельных металлов используют гораздо более распространенные щелочноземельные металлы:
- магнийтермия (в вакууме): 2RbCl + Ca = 2Rb + CaCl2;
- кальцийтермия (в вакууме): 2CsCl + Mg = 2Cs + MgCl2.
Оксиды и гидроксиды магния и кальция…
Получение магния и кальция
- электролизом расплавов солей: MgCl2 → Mg + Cl2;
- металлотермией (промышленный способ) при t>1200°C в электропечи в условиях вакуума, восстанавливая металлы из их соединений: 3CaO + 2Al = 3Ca + Al2O3;
- углетермией (восстановлением оксидов углем) в электропечи при t>2000°C: MgO + C = Mg + CO.
Применение
- Be:
- в качестве легирующей добавки к сплавам, придавая им твердость и прочность;
- как замедлитель и отражатель нейтронов в атомной промышленности.
- Mg:
- широко используется в конструкционных сверхлегких сплавах в автомобиле- и авиастроении;
- для получения редкоземельных металлов методом металлотермии;
- в органическом синтезе;
- в фото- и пиротехнике.
- Ca:
- в металлургии для удаления различных примесей при выплавке сталей и других сплавов;
- для получения редкоземельных металлов методом металлотермии;
- для выделения из воздуха инертных газов.
II группа главная подгруппа Периодической таблицы Менделеева (щелочноземельные металлы)
- К щелочноземельным металлам относят химические элементы: двувалентные металлы, составляющие IIА группу:
- Бериллий Be
- магний Mg
- кальций Ca,
- стронций Sr,
- барий Ba и
- радий Ra.
- Хотя бериллий Be по свойствам больше похож на алюминий, а магний Mg проявляет некоторые свойства щелочноземельных металлов, но в целом отличается от них.
- Все щелочноземельные металлы — вещества серого цвета и гораздо более твердые, чем щелочные металлы.
Бериллий Be устойчив на воздухе. Магний и кальций (Mg и Ca) устойчивы в сухом воздухе. Стронций Sr и барий Ba хранят под слоем керосина.
От Be к Ra (сверху вниз в периодической таблице) происходит увеличение:
- атомного радиуса,
- металлических, основных, восстановительных свойств,
- реакционной способности.
Уменьшается
- электроотрицательность,
- энергия ионизация,
- сродство к электрону.
- Электронные конфигурации у данных элементов схожи, все они содержат 2 электрона на внешнем уровне ns2:
- Be — 2s2
- Mg —3s2
- Ca — 4s2
- Sr — 5s2
- Ba — 6s2
- Ra — 7s2
Как правило, щелочноземельные металлы в природе присутствуют в виде минеральных солей: хлоридов, бромидов, йодидов, карбонатов, нитратов и др.
Основные минералы, в которых присутствуют щелочноземельные металлы:
Магний
- Магний получают электролизом солей, чаще всего хлоридов: расплавленного карналлита (KCl·MgCl26H2O) или хлорида магния с добавками хлорида натрия при 720–750°С:
MgCl2 → Mg + Cl2
- восстановлением прокаленного доломита в электропечах при 1200–1300°С:
- 2(CaO · MgO) + Si → 2Mg + Ca2SiO4
- Кальций
- Кальций получают электролизом расплавленного хлорида кальция с добавками фторида кальция:
- CaCl2 → Ca + Cl2
- Барий
- Барий получают алюмотермическим способом — восстановление оксида бария алюминием в вакууме при 1200 °C:
- 4BaO+ 2Al → 3Ba + Ba(AlO2)2
Качественные реакции
- Окрашивание пламени солями щелочных металлов
Цвет пламени:
- Ca — кирпично-красный
- Sr — карминово-красный (алый)
- Ba — яблочно-зеленый
- Взаимодействие с веществами:
- С кислородом
- С кислородом взаимодействуют при нагревании с образованием оксидов
- 2Сa + O2 → 2CaO
- Видео Горение кальция
- С галогенами
- (F, Cl, Br, I)
- Щелочноземельные металлы реагируют с галогенамипри нагревании с образованием галогенидов .
- Сa + Cl2→ 2СaCl2
- С водородом
- Щелочноземельные металлы реагируют с водородом при нагревании с образованием гидридов:
- Сa + H2 СaH2
- Бериллий с водородом не взаимодействует.
- Магний реагирует только при повышенном давлении:
- Mg + H2 → MgH2
- С серой
- Щелочноземельные металлы при нагревании взаимодействуют с серой с образованием сульфидов сульфидов:
- Сa + S СaS
- Ca + 2C → CaC2 (карбиды)
- С азотом
- При комнатной температуре с азотом взаимодействует только магний с образованием нитрида:
- 6Mg + 2N2 → 2Mg3N2
- Остальные щелочноземельные металлы реагируют с азотом при нагревании.
- С углеродом
- Щелочноземельные металлы реагируют с углеродом с образованием карбидов, преимущественно ацетиленидов:
- Ca + 2C → CaC2
- Бериллий при нагревании с углеродом с образует карбид — метанид:
- 2Be + C → Be2C
- С фосфором
- Щелочноземельные металлы при нагревании взаимодействуют с фосфором с образованием фосфидов:
- 3Сa + 2P Сa3 P2
Взаимодействие со сложными веществами
- С водой
- Кальций, стронций и барий взаимодействуют с водой при комнатной температуре с образованием щелочи и водорода:
- Sr + 2H2O → Sr(OH)2 + H2↑,
- Магний реагирует с водой при кипячении, а бериллий с водой не реагирует.
- С кислотами
- С растворами HCl, H2SO4, H3PO4 щелочноземельные металлы взаимодействуют с образованием соли и выделением водорода:Са + H2SO4(разб)= СаSO4 + H2
- С кислотами-окислителями (HNO3 и конц. H2SO4):
- с концентрированной серной:
- 4Ca + 10H2SO4(конц) → 4CaSO4 + H2S↑ + 5H2O;
- с разбавленной и концентрированной азотной:
- 4Sr + 10HNO3(конц) → 4Sr(NO3)2 + N2O +5H2O
- С водными растворами щелочей
- В водных растворах щелочей растворяется только бериллий:
- Be + 2NaOH + 2H2O → Na2[Be(OH)4] + H2
- С солями
- В расплаве щелочноземельные металлы могут взаимодействовать с некоторыми солями:
- Ca + CuCl2 → CaCl2 + Cu
Запомните! В растворе щелочноземельные металлы взаимодействуют с водой, а не с солями других металлов.
- С оксидами
- Щелочноземельные металлы могут восстанавливать из оксидов такие неметаллы как кремний, бор, углерод:
- 2Ca + SiO2 → 2CaO + Si
- Магний сгорает в атмосфере углекислого газа с образованием оксида магния и сажи (С):
- 2Mg + CO2 → 2MgO + C
Щелочноземельные металлы: общая характеристика, строение; свойства и получение — урок. Химия, 9 класс
Щелочноземельными металлами называют (4) химических элемента (I)(I)(A) группы Периодической системы Д. И. Менделеева, начиная с кальция:
кальций (Ca), стронций (Sr), барий (Ba), радий (Ra).
Электронное строение атомовНа внешнем энергетическом уровне атомы металлов (IIA) группы имеют два электрона.
Поэтому для всех щелочноземельных металлов характерна степень окисления (+2).
Этим объясняется сходство их свойств.
Для металлов (I)(I)(A) группы (сверху вниз) характерно:
- увеличение радиуса атомов;
- усиление восстановительных, металлических свойств.
Из щелочноземельных металлов кальций наиболее широко распространён в природе, а радиоактивный радий — менее всего.
- Все щелочноземельные металлы обладают высокой химической активностью, поэтому встречаются в природе только в виде соединений.
- Основными источниками кальция являются его карбонаты CaCO3 (мел, мрамор, известняк).
- В свободном виде простые вещества представляют собой типичные металлы от серого до серебристого цвета.
Физические свойства простых веществВ твёрдом агрегатном состоянии атомы связаны металлической связью. Это обусловливает общие физические свойства простых веществ металлов: металлический блеск, ковкость, пластичность, высокую тепло- и электропроводность.
- Тем не менее, металлы (I)(I)(A) группы имеют разные значения температуры плавления, плотности и других физических свойств.
- Щелочноземельные металлы обладают высокой химической активностью, реагируют с кислородом, водородом, другими неметаллами, оксидами, кислотами, солями.
- Они являются сильными восстановителями.
- Щелочноземельные металлы активно реагируют с:
- водой, образуя соответствующие гидроксиды и выделяя водород:
- кислотами, легко растворяясь в их растворах с образованием соответствующих солей:
- Ba+2HCl=BaCl2+H2↑;
- с неметаллами, образуя оксиды или соответствующие соли (гидриды, галогениды, сульфиды и др.):
- Bа+Cl2=BаCl2,
- Bа+S=BаS.
Щелочноземельные металлы получают в основном электролизом расплавов галогенидов. Чаще используются хлориды металлов.
При этом на катоде восстанавливаются катионы, а на аноде окисляются анионы.
Суммарное уравнение реакции электролиза расплава хлорида кальция:
CaCl2=эл. токCa+Cl2↑.
Общая характеристика элементов главной подгруппы II группы
Слайд 1
Общая характеристика элементов главной подгруппы II группы. 9 класс
Слайд 2
Щелочноземельные металлы В главную подгруппу II группы входят бериллий Be, магний Mg, кальций Са, стронций Sr, барий Ва, радий Ra. Из них кальций, стронций, барий относятся к семейству щелочноземельных металлов.
Слайд 3
1) строение атома Это s-элементы. В виде простых веществ типичные металлы. На внешнем уровне имеют по два электрона. Отдавая их, они проявляют в соединениях степень окисления +2.
В окислительно-восстановительных реакциях все металлы подгруппы ведут себя как сильные восстановители, однако несколько более слабые, чем щелочные металлы. Это объясняется тем, что атомы металлов II группы имеют меньшие атомные радиусы, чем атомы соответствующих щелочных металлов, расположенных в тех же периодах.
Это связано с некоторым сжатием электронных оболочек, так как s-подуровень внешнего электронного слоя у них завершен, поэтому электроны ими удерживаются сильнее.
Слайд 4
2) физические свойства Все щёлочноземельные металлы — серые, твёрдые при комнатной температуре вещества. В отличие от щелочных металлов, они существенно более твёрдые, и ножом преимущественно не режутся (исключение — стронций).
Плотность щёлочноземельных металлов с порядковым номером растёт, хотя явно рост наблюдается только начиная с кальция, который самый лёгкий из них (ρ = 1,55 г/см³), самый тяжёлый — радий, плотность которого примерно равна плотности железа.
Слайд 5
3) химические свойства Са + 2Н 2 0 = Са(ОН) 2 + Н 2 Mg + 2Н 2 0 = Mg(ОН) 2 + Н 2 Mg + 2НС l = МуС l 2 + Н 2 Химическая активность щёлочноземельных металлов растёт с ростом порядкового номера.
Бериллий в компактном виде не реагирует ни с кислородом, ни с галогенами даже при температуре красного каления (до 600 °C, для реакции с кислородом и другими халькогенами нужна ещё более высокая температура, фтор — исключение).
Магний защищён оксидной плёнкой при комнатной температуре и более высоких (до 650 °C) температурах и не окисляется дальше.
Кальций медленно окисляется и при комнатной температуре вглубь (в присутствии водяных паров), и сгорает при небольшом нагревании в кислороде, но устойчив в сухом воздухе при комнатной температуре. Стронций, барий и радий быстро окисляются на воздухе, давая смесь оксидов и нитридов, поэтому их, так же и как щелочные металлы (и кальций) хранят под слоем керосина.
Слайд 6
Нахождение в природе Все щёлочноземельные металлы имеются (в разных количествах) в природе. Ввиду своей высокой химической активности все они в свободном состоянии не встречаются.
Самым распространённым щелочноземельным металлом является кальций, количество которого равно 3,38 % (от массы земной коры). Немногим ему уступает магний, количество которого равно 2,35 % (от массы земной коры).
Распространены в природе также барий и стронций, которых соответственно 0,05 и 0,034 % от массы земной коры. Бериллий является редким элементом, количество которого составляет 6·10−4% от массы земной коры.
Что касается радия, который радиоактивен, то это самый редкий из всех щёлочноземельных металлов, но он в небольшом количестве всегда содержится в урановых рудах. В частности, он может быть выделен оттуда химическим путём. Его содержание равно 1·10−10% (от массы земной коры).
- Слайд 7
- Состав морской воды
- Слайд 8
Минеральные воды Минеральные воды имеют важное бальнеологическое значение и их широко используют в санаторно-курортном лечении.
Минеральные воды используют для питьевого лечения и для ванн, купаний, душей, проводимых в бальнеолечебницах и в лечебных бассейнах, а также для ингаляций и полосканий при заболеваниях носоглотки и верхних дыхательных путей, для орошений при гинекологических болезнях, для промываний, главным образом при заболеваниях органов пищеварения, нарушениях обмена веществ и т. д.
- Слайд 9
- Месторождения минеральных вод на территории Красноярского края В настоящее время на территории края для обеспечения деятельности санаторно-курортных учреждений эксплуатируются 4 месторождения минеральных вод: Кожановское в Балахтинском районе, Нанжульское в 10 км север-северо-западнее Красноярска, Тагарское в Минусинском районе и Учумское в Ужурском районе (для сравнения: на территории России в эксплуатации находятся 700 месторождений и участков, из которых 75 % – в европейской части страны).
- Слайд 10
Кальций в природе Большая часть кальция содержится в составе силикатов и алюмосиликатов различных горных пород (граниты, гнейсы и т. п.), особенно в полевом шпате — анортите Ca[Al2Si2O8].
В виде осадочных пород соединения кальция представлены мелом и известняками, состоящими в основном из минерала кальцита (CaCO3). Кристаллическая форма кальцита — мрамор — встречается в природе гораздо реже.
Довольно широко распространены такие минералы кальция, как кальцит CaCO3, ангидрит CaSO4, алебастр CaSO4·0.5H2O и гипс CaSO4·2H2O, флюорит CaF2, апатиты Ca5(PO4)3(F,Cl,OH), доломит MgCO3·CaCO3. Присутствием солей кальция и магния в природной воде определяется её жёсткость.
Кальций, энергично мигрирующий в земной коре и накапливающийся в различных геохимических системах, образует 385 минералов (четвёртое место по числу минералов). кальцит Изделия из гранита
Слайд 11
Радий в природе Радий довольно редок. За прошедшее с момента его открытия время — более столетия — во всём мире удалось добыть всего только 1,5 кг чистого радия. Одна тонна урановой смолки, из которой супруги Кюри получили радий, содержит лишь около 0,0001 г радия-226.
Весь природный радий является радиогенным — возникает при распаде урана-238, урана-235 или тория-232; из четырёх найденных в природе наиболее распространённым и долгоживущим изотопом (период полураспада 1602 года) является радий-226, входящий в радиоактивный ряд урана-238.
В равновесии отношение содержания урана-238 и радия-226 в руде равно отношению их периодов полураспада: (4,468·109 лет)/(1602 года)=2,789·106. Таким образом, на каждые три миллиона атомов урана в природе приходится лишь один атом радия или 1,02 мкг/т (кларк в земной коре).
Слайд 12
Биологическая роль Радий чрезвычайно радиотоксичен. В организме он ведёт себя подобно кальцию — около 80 % поступившего в организм радия накапливается в костной ткани.
Большие концентрации радия вызывают остеопороз, самопроизвольные переломы костей и злокачественные опухоли костей и кроветворной ткани. Опасность представляет также радон — газообразный радиоактивный продукт распада радия.
Преждевременная смерть Марии Кюри произошла вследствие хронического отравления радием, так как в то время опасность облучения ещё не была осознана.
Слайд 13
Интересные факты В начале века, после своего открытия, радий считался полезным и включался в состав многих продуктов и бытовых предметов: хлеб, шоколад, питьевая вода, зубная паста, пудры и кремы для лица, краска циферблатов наручных часов, средство для повышения тонуса и потенции.






