Реальные металлы, которые используют в качестве конструкционных материалов, состоят из большого числа кристаллов неправильной формы. Эти кристаллы называют зернами, или кристаллитами, а строение — поликристаллическим, или зернистым.
Существующие технологии производства металлов не позволяют получить их идеальной чистоты, поэтому реальные металлы содержат примесные атомы. Любой металл, содержащий 99,9% — химически чистый, 99,99% — высокочистый, 99,999% — сверхчистый.
Атомы любых примесей по своим размерам и по своему строению резко отличаются от атомов основного компонента, поэтому силовое поле внутри реального металла и его строение сильно отличаются от теоретического. Дефекты кристаллического строения подразделяются по геометрическим признакам на поверхностные, точечные и линейные.
Поверхностные дефекты представляют собой поверхности раздела между отдельными зернами или субзернами в поликристаллическом металле; к ним относятся также дефекты упаковки.
Границы между отдельными зернами представляют переходную область шириной до нескольких десятков межатомных расстояний, в которой решетка одного зерна, имеющего определенную кристаллографическую ориентацию, переходит в решетку другого зерна, имеющего иную кристаллографическую ориентацию (рисунок 5, а).
Поэтому на границе зерна наблюдается искаженное кристаллическое строение и более высокое энергетическое состояние. Кроме того, на границах зерен в технических металлах скапливаются примеси, что еще больше нарушает правильный порядок расположения атомов.
Это определяет особенности поведения границ зерен при механическом, температурном и химическом воздействии.
В результате нарушенного строения границы ослабляют или упрочняют металл, что приводит соответственно к межкристаллитному (межзеренному) или транскристаллитному (по телу зерна) разрушению.
Под действием высоких температур металл стремится уменьшить поверхностную энергию границ зерен за счет роста зерен и сокращения протяженности их границ.
При химическом воздействии границы зерен оказываются более активными и вследствие этого коррозионное разрушение начинается по границам зерен (это лежит в основе микроанализа металлов при изготовлении шлифов).
а – графит
б – алмаз
в — фуллерен С60
Рисунок 4 — Полиморфные модификации углерода
Есть еще один источник поверхностного искажения кристаллического строения металла. Если рассмотреть зерно при большом увеличении, то окажется, что внутри его имеются участки, разориентированные друг относительно друга на угол 15’…30′. Такая структура называется блочной, или мозаичной, а области — блоками мозаики (рисунок 5, б).
Свойства металлов будут зависеть как от размеров блоков и зерен, так и от их взаимной ориентации.
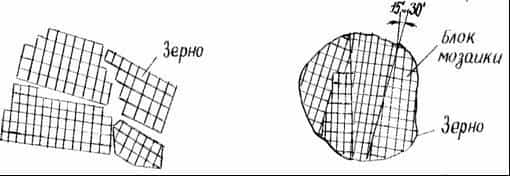
а — границы зерен поликристаллического строения металлов;
б — участки разориентированной структуры зерна — блоки мозаики
Рисунок 5 — Источники поверхностных дефектов
Изучение строения металлов рентгеноструктурным анализом и электронной микроскопией позволило установить, что внутреннее кристаллическое строение зерна или блока не является правильным. В кристаллических решетках реальных металлов существуют дефекты, которые нарушают связи между атомами и оказывают влияние на свойства металлов. К ним относятся точечные и линейные дефекты.
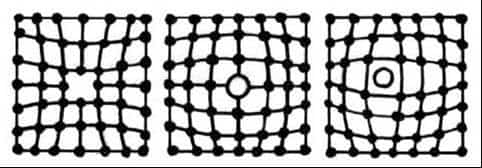
Точечные дефекты малы в трех измерениях и размерами приближаются к точке. Виды этих дефектов приведены на рисунке 6.
Одним из распространенных дефектов является вакансия, т. е. место, не занятое атомом (дефект Шоттки). На место вакантного узла может перемещаться новый атом, а вакантное место — ”дырка” — образуется по соседству.
С повышением температуры концентрация вакансий возрастает, так как атомы, расположенные вблизи поверхности, могут выйти на поверхность кристалла, а их место займут атомы, находящиеся дальше от поверхности.
С повышением температуры концентрация вакансий возрастает, так как атомы, расположенные вблизи поверхности, могут выйти на поверхность кристалла, а их место займут атомы, находящиеся дальше от поверхности.
Наличие вакансий в решетке сообщает атомам подвижность, т.е. позволяет им перемещаться в процессе самодиффузии и диффузии и тем самым оказывает влияние на такие процессы, как старение, выделение вторичных фаз и т.п.
Другими точечными дефектами являются дислоцированные атомы (дефект Френкеля), т.е. атомы собственного металла, вышедшие из узла решетки и занявшие место где-то в междоузлии. При этом на месте переместившегося атома образуется вакансия. Концентрация таких дефектов невелика, т.к. для их образования требуется существенная затрата энергии.
- а б в
- а — вакансия; б — замещенный атом; в — внедренный атом
- Рисунок 6 — Виды точечных дефектов
- а б
- а — краевая дислокация; б — винтовая дислокация
- Рисунок 7 — Виды дислокаций
- В любом металле присутствуют чужеродные атомы примесей, которые занимают в кристаллической решетке либо места основных атомов (замещение), либо внедряются внутрь ячейки (внедрение).
- Вокруг точечных дефектов нарушаются правильность кристаллического строения, силовое поле атомов во всех направлениях.
Линейные дефекты малы в двух измерениях, в третьем они могут достигать длины кристалла (зерна). К линейным дефектам относятся цепочки вакансий, межузельных атомов и дислокации. Дислокации являются особым видом несовершенств в кристаллической решетке. С позиции теории дислокаций рассматриваются прочность, фазовые и структурные превращения.
Дислокацией называется линейное несовершенство, образующее внутри кристалла зону сдвига.
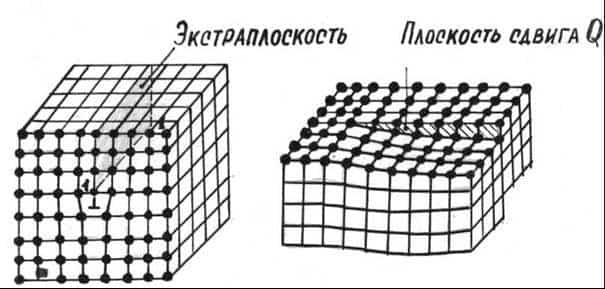
Дислокации бывают краевые и винтовые (рисунок 7).
Краевая дислокация образуется, если внутри кристалла появляется лишняя полуплоскость атомов, которая называется экстраплоскостью. Ее край 1-1 создает линейный дефект решетки, который называется краевой дислокацией.
Условно принято, что дислокация положительная, если она находится в верхней части кристалла и обозначается знаком ”^”, если дислокация находится в нижней части — отрицательная (“┬“). Дислокации одного и того же знака отталкиваются, а противоположного — притягиваются.
Под воздействием напряжения краевая дислокация может перемещаться по кристаллу (по плоскости сдвига), пока не достигнет границы зерна (блока). При этом образуется ступенька величиной в одно межатомное расстояние.
Винтовая дислокация (рисунок 7, б). Образуется неполным сдвигом кристалла по плотности Q. В отличие от краевой дислокации винтовая дислокация параллельна вектору сдвига. Она называется правой, если образована движением по часовой стрелке, и левой – против часовой стрелки.
Дислокации образуются в процессе кристаллизации металлов при ”захлопывании” группы вакансий, а также в процессе пластической деформации и фазовых превращений. Важной характеристикой дислокационной структуры является плотность дислокаций.
Под плотностью r дислокаций понимают суммарную длину дислокаций Sl (см), приходящуюся на единицу объема V кристалла (см3). Таким образом. размерность плотности дислокаций, см-2, у отожженных металлов — 106…108 см-2. При холодном пластическом деформировании плотность дислокаций возрастает до 1011…1012 см-2.
Более высокая плотность дислокаций приводит к появлению микротрещин и разрушению металла.
Дислокации наряду с другими дефектами участвуют в фазовых превращениях, рекристаллизации, служат готовыми центрами при выпадении второй фазы из твердого раствора.
Вдоль дислокаций скорость диффузии на несколько порядков выше, чем через кристаллическую решетку без дефектов. Дислокации служат местом концентрации примесных атомов, в особенности примесей внедрения, так как это уменьшает искажения решетки.
Примесные атомы образуют вокруг дислокации зону повышенной концентрации, которая мешает движению дислокаций и упрочняет металл.
Все перечисленные дефекты кристаллического строения приводят к появлению внутренних напряжений. По величине объема, где они уравновешиваются, различают напряжения I, II и III рода.
- Внутренние напряжения I рода — это зональные напряжения, возникающие между отдельными зонами сечения или между отдельными частями детали. К ним относятся термические напряжения, которые появляются при ускоренном нагреве и охлаждении при сварке, термической обработке.
- Внутренние напряжения II рода — возникают внутри зерна или между соседними зернами, обусловлены дислокационной структурой металла.
- Внутренние напряжения III рода — возникают внутри объема порядка нескольких элементарных ячеек; главным источником являются точечные дефекты.
Внутренние остаточные напряжения являются опасными, так как складываются с действующими рабочими напряжениями и могут привести к преждевременному разрушению конструкции. Для снятия внутренних остаточных напряжений проводится отжиг I рода.
Энергетические условия и механизм процесса кристаллизации >
Дальше >
Строение и структура металлов
- ГЛАВА 7
- МЕТАЛЛЫ В СТРОИТЕЛЬСТВЕ
- Общие сведения о металлах. Классификация металлов
Металлы (от лат.
metallum — шахта, рудник) — группа элементов, в виде простых веществ обладающих характерными металлическими свойствами, такими как высокие тепло- и электропроводность, положительный температурный коэффициент сопротивления, высокая пластичность и металлический блеск.
Большая часть металлов присутствует в природе в виде руд и соединений. Они образуют оксиды, сульфиды, карбонаты и другие химические соединения.
Для получения чистых металлов и дальнейшего их применения необходимо выделить их из руд и провести очистку. При необходимости проводят легирование и другую обработку металлов. Изучением этого занимается наука металлургия.
Металлургия различает руды чёрных металлов (на основе железа) и цветных (в их состав не входит железо, всего около 70 элементов).
Все металлы и сплавы подразделяются на две группы: черные металлы и цветные.
Черные металлы представляют собой сплав железа с небольшим количеством углерода.
Наряду с углеродом черные металлы могут содержать кремний, марганец, фосфор, серу и другие химические элементы, попадающие в металлы из руд или добавляемые в них в процессе плавки.
Для улучшения качества или придания специфических свойств в состав черных металлов вводят легирующие добавки — медь, никель, хром, кремний.
- В зависимости от содержания углерода черные металлы подразделяются на чугуны и стали.
- В сталях содержится до 2% углерода, а в чугунах содержится от 2 до 6,7% углерода.
- Цветные металлы представляют собой сплавы на основе алюминия, магния, меди, никеля, хрома, цинка, олова, свинца.
Металлы состоят из зерен, тесно прилегающих друг к другу. Эти зерна можно заметить на свежем изломе металлического стержня невооруженным глазом. Более четко структура металла видна под микроскопом при сильном увеличении.
- В зависимости от химического состава структурные составляющие железоуглеродистых сплавов носят следующие наименования:
- — аустенит — твердый раствор углерода в гамма-железе (гамма-железо — одна из форм кристаллов чистого железа); предельная концентрация углерода в аустените 1,7%; аустенит немагнитен, характеризуется большой вязкостью, хорошей сопротивляемостью истиранию и химической стойкостью;
- — феррит — технически чистое железо, которое характеризуется малой твердостью, небольшой прочностью и высокой пластичностью; феррит магнитен; свойства феррита в значительной степени зависят от размера его зерна; в структуре стали феррит располагается в виде отдельных светлых зерен, перемежающихся с темными участками перлита, или в виде светлых окаймлений вокруг зёрен перлита;
- — цементит — химическое соединение железа с углеродом; обладает высокой твердостью, но в, то, же время хрупок; форма цементита в стали оказывает влияние на ее механические свойства, особенно на ударную вязкость;
- — перлит — смесь цементита и феррита; содержание углерода в перлите 0,83 %', чем мельче зерна перлита в металле, тем выше его механические свойства.
Химический состав и структура металла предопределяет его физические и механические свойства: прочность, твердость, плотность. Механические свойства в значительной степени позволяют определить, насколько хорошо будет работать деталь в эксплуатационных условиях.
Строение и структура металлов
Металлы относятся к твердым телам кристаллического строения.
Твердое тело —это агрегатное состояние вещества, характеризующееся стабильностью формы и объема.По своему внутреннему строению твердые тела разделяются на кристаллические и аморфные.
Кристаллы — это твёрдые тела, частицы которых располагаются в строгом порядке, образуя пространственные периодически повторяющиеся структуры.
Точнее, частицы колеблются около определенных положений равновесия. Если их мысленно соединить прямыми линиями, то получается своего рода «скелет» кристалла. Такое изображение кристалла называется кристаллической решеткой.
Теоретически доказано, что всего может существовать 230 различных пространственных кристаллических структур.
Большинство из них (но не все) обнаружены в природе или созданы искусственно.
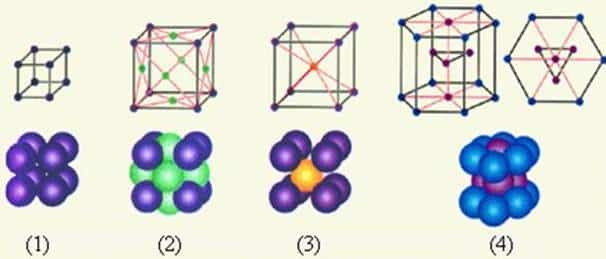
Рис. 7.1. Виды кристаллического строения металлов
На рис. 7.1. приведены примеры простых кристаллических решеток: 1 – простая кубическая решетка; 2 – гранецентрированная кубическая решетка; 3 – объемно-центрированная кубическая решетка; 4 – гексагональная решетка.
Металлы имеют относительно сложные типы кубических решеток — объемно центрированная (ОЦК) и гранецентрированная (ГЦК) кубические решетки.
Рис. 7.2. Объемно-центрированная кристаллическая решетка
Основу ОЦК-решетки составляет элементарная кубическая ячейка (рис.7.2.), в которой положительно заряженные ионы металла находятся в вершинах куба, и еще один атом в центре его объема, т. е. на пересечении его диагоналей. Такой тип решетки в определенных диапазонах температур имеют железо, хром, ванадий, вольфрам, молибден и др. металлы.
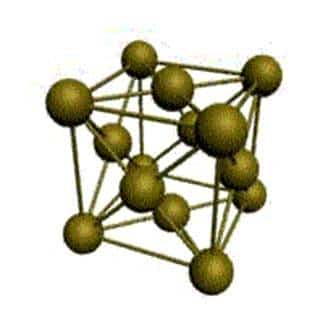
Рис.7.3. Гранецентрированная кристаллическая решетка
В гранецентрированной кристаллической решетке (ГЦК-решетки) (рис.7.3) элементарной ячейкой служит куб с центрированными гранями. Подобную решетку имеют железо, алюминий, медь, никель, свинец и др. металлы.
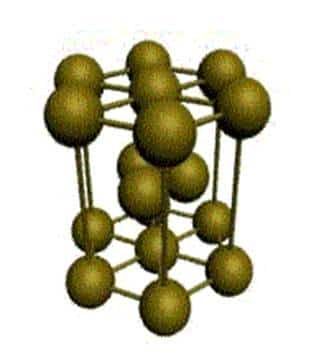
Рис.7.4. Гексагональная плотноупакованная кристаллическая решетка
Третьей распространенной разновидностью плотноупакованных решеток является гексагональная плотноупакованная (ГПУ, рис.7.4). ГПУ-ячейка состоит из отстоящих друг от друга на параметр с параллельных центрированных гексагональных оснований. Три иона (атома) находятся на средней плоскости между основаниями.
В гексагональных решетках отношение параметра с/а всегда больше единицы. Такую решетку имеют магний, цинк, кадмий, бериллий, титан и др.
Компактность кристаллической решетки или степень заполненности ее объема атомами является важной характеристикой. Она определяется такими показателями, как параметр решетки, число атомов в каждой элементарной ячейке, координационное число и плотность упаковки.
Параметр решетки – это расстояние между атомами по ребру элементарной ячейки. Параметры решетки измеряются в нанометрах (1 нм = 10-9 м = 10 Å). Параметры кубических решеток характеризуются длиной ребра куба и обозначаются буквой а.
Для характеристики гексагональной решетки принимают два параметра – сторону шестигранника а и высоту призмы с.
Когда отношение с/а = 1,633, то атомы упакованы наиболее плотно, и решетка называется гексагональной плотноупакованной (рис. 7.4).
Некоторые металлы имеют гексагональную решетку с менее плотной упаковкой атомов (с/а > 1,633). Например, для цинка с/а = 1,86, для кадмия с/а = 1,88.
Параметры, а кубических решеток металлов находятся в пределах от 0,286 до 0,607 нм. Для металлов с гексагональной решеткой, а лежит в пределах 0,228-0,398 нм, а с в пределах 0,357- 0,652 нм.
Параметры кристаллических решеток металлов могут быть измерены с помощью рентгеноструктурного анализа.
При подсчете числа атомов в каждой элементарной ячейке следует иметь в виду, что каждый атом входит одновременно в несколько ячеек. Например, для ГЦК-решетки, каждый атом, находящийся в вершине куба, принадлежит 8 ячейкам, а атом, центрирующий грань, двум. И лишь атом, находящийся в центре куба, полностью принадлежит данной ячейке.
Таким образом, ОЦК — и ГЦК-ячейки содержат соответственно 2 и 4 атома.
Под координационным числом понимается количество ближайших соседей данного атома.
Особенности структуры сплавов
14.01.2016
Легирование металла высокопрочных сплавов приводит к образованию твердых растворов замещения или внедрения, а в случае превышения предела растворимости — к образованию избыточных фаз.В общем случае строение металлов и сплавов характеризуется наличием структур различного масштаба, которые можно классифицировать следующим образом.
Атомно-кристаллическая структура. На атомарном уровне (размер 10в-10 м — 1 А) имеет место атомно-кристаллическая структура в виде упорядоченного расположения атомов (ионов) в узлах кристаллической решетки. На рис. 1.
1 приведены наиболее распространенные типы атомно-кристаллических структур: кубическая гранецентрированная (ГЦК), кубическая объем но центрированная (ОЦК), гексагональная плотноупакованная (ГПУ).
Упорядоченное расположение атомов в кристаллах характеризуется наличием ближнего и дальнего порядка. Координационное число, которое определяется числом ближайших соседних атомов, равно 12 для структур ГЦК и ГПУ и 8 для ОЦК-структуры.
Согласно модели жестких шаров коэффициент заполнения пространства кристаллической решетки составляет 0,74 для ГЦК- и ГПУ-структур и 0,68 для менее плотной ОЦК-структуры.
В рассматриваемых кристаллических решетках существует два типа междоузлий или пустот: октаэдрические и тетраэдрические (рис. 1.1).Более крупные — октаэдрические — пустоты окружены шестью атомами, расположенными в вершинах правильного октаэдра. Более мелкие пустоты — тетраэдрические — распложены в вершинах тетраэдра,Атомно-кристаллическая структура металлов и сплавов может быть представлена в общем случае ограниченным набором элементарных ячеек, характеризующих строго определенное расположение положительных ионов в пространстве, параллельными переносами которых (трансляциями) в трех измерениях можно построить всю кристаллическую решетку.Плотное заполнение пространства «без просветов» возможно при определенном наборе элементов симметрии. В связи с этим в кристаллах отсутствуют оси симметрии пятого порядка и более высокого, чем шестой порядок.
Образование твердых растворов замещения происходит путем замещения атомов (ионов) в узлах кристаллической решетки основы сплава (матрицы) и определяется, в частности, размерным фактором. При различии размеров атомов, не превышающем 15%, существует непрерывный ряд твердых растворов, а при большем различии размеров атомов образуется твердый раствор с ограниченной растворимостью.
Твердые растворы внедрения по модели плотной упаковки жестких шаров образуются в результате заполнения междоузлий в кристаллической решетке матрицы. Растворимость элемента внедрения зависит от количества и размеров пор. Как правило, растворимость элементов внедрения мала, в частности предельная растворимость наиболее распространенного легирующего элемента внедрения в высокопрочных сплавах — углерода — составляет 0,01%, и в связи с этим в высокопрочных сплавах происходит выделение фаз внедрения.Фазы внедрения, к которым относятся карбидные, боридные, нитридные, гидридные фазы, которым придается существенное значение в металловедении высокопрочных сплавов, обладают металлическими свойствами и образуются в результате заполнения межузлий кристаллической решетки металлических атомов (ионов) атомами внедрения. Оптимальное соотношение размеров атома внедрения и атомов матрицы согласно правилу Хегга ≥ 0,59. Следует отметить, что кристаллическая решетка металлических атомов в структуре фаз внедрения отличается от кристаллической решетки соответствующего металла.Интерметаллические соединения представляют собой промежуточные фазы, т. е. фазы, имеющие кристаллическую решетку, отличную от решеток, образующих фазу компонентов, и обладающие металлическими свойствами. На диаграммах состояния интерметаллические соединения характеризуются областью гомогенности, поскольку их состав может отличаться от определенного стехиометрического состава. Интерметаллидные фазы, характеризующиеся отсутствием заметной растворимости, плавление которых происходит без изменения состава (разложения), т. е. конгруентно, относят к дальтонидам. Интерметаллидные фазы с широкой областью гомогенности, на линии ликвидуса которых отсутствует сингулярная точка и плавление которых происходит инконгруентно, представляют собой бертоллиды.По своей природе интерметаллидные фазы делят на ряд классов; электронные соединения, структура которых определяется электронной концентрацией; интерметаллидные фазы, имеющие сложные решетки.В высоколегированных сплавах образуются интерметаллидные фазы σ, Р, μ, R, χ, фазы Лавеса, которые имеют сложную элементарную ячейку, содержащую ≥ 20 атомов (рис. 1.2). При анализе этих фаз используется представление атомно-кристаллической структуры путем заполнения решетки координационными полиэдрами (многогранниками). Идея выделения координационных полиэдров в кристаллической структуре связана с образованием устойчивых группировок атомов, которые сохраняются в кристалле как целое и поэтому рассматриваются как структурные единицы.Координационные полиэдры не заполняют целиком объем кристаллической решетки в отличие от элементарных ячеек и таким образом условно отделяют заполненную часть от незаполненной. Координационные полиэдры образуют кристаллическую структуру в результате сочленения между собой по вершинам либо по ребрам или граням.Таким образом, структура интерметаллических соединений, которые трудно или невозможно представить в виде плотных упаковок жестких шаров, характеризуется сохранением тенденции к наибольшему заполнению пространства. Рассмотренная модель представления кристаллической структуры применяется, например, в случае интерметаллидных фаз σ, Р, μ, R, χ, образованных металлами с несколько различающимися размерами атомов и имеющих сложную элементарную ячейку. Для всех этих фаз характерны большие координационные числа и высокая степень компактности.Упорядоченное расположение атомов в этих фазах связано с тем, что более крупные атомы занимают позиции с большим координационным числом. На ширину области гомогенности влияет соотношение атомных радиусов, однако определяющим фактором в образовании рассмотренных фаз является электронная концентрация.Исследование атомно-кристаллической структуры осуществляется дифракционными методами структурного анализа: рентгеновским структурным анализом, электронографией и нейтронографией. Методы туннельной микроскопии, микроскопии атомных сил, атомного ионного проектора позволяют изучать положение отдельных атомов на поверхности твердых тел.Кристаллическая структура металлов и сплавов существенным образом влияет на их физико-механические свойства. Анизотропия, т. е, различие свойств по разным направлениям, повышенная склонность к хрупкому разрушению, хладноломкость, ограничение систем скольжения при деформации определяются кристаллической структурой сплавов, структурно-фазовыми составляющими.
Аморфные структуры по уровню пространственного разрешения являются типом атомной структуры, который характеризуется наличием ближнего атомного порядка по аналогии со структурой жидкости и отсутствием дальнего порядка, характерного для кристаллического состояния. Таким образом, твердые тела с аморфной структурой представляют собой переохлажденные жидкости — металлические стекла.
Дислокационная структура. Кристаллическая структура, построенная трансляциями элементарной ячейки, является идеальной. Реальные кристаллические решетки металлов и сплавов имеют дефекты: нульмерные (точечные) — вакансии и межузельные атомы; одномерные (линейные) — дислокации; двухмерные (поверхностные) — границы блоков, зерен, дефекты упаковки и др.; трехмерные (объемные) — пустоты, поры, включения.Дефекты кристаллической структуры оказывают существенное влияние на свойства металлов и сплавов. В металловедении дислокационная структура характеризует плотность, распределение и природу отдельных дислокаций, а также их скопления с образованием субзерен, зарождение рекристаллизованных зерен.Основные типы дислокационных структур металлов и сплавов — ячеистая, полигональная (субзеренная) и рекристализованная структуры.По сравнению с атомно-кристаллической структурой дислокационная структура соответствует более низкому уровню разрешения в пределах от 10 нм до сотен микрометров.Методами исследования дислокационных структур являются: прямой метод дифракционной электронной микроскопии, метод рентгенографии, в определенной мере метод металлографии.Влияние дислокационной структуры на свойства металлов и сплавов проявляется, например, в эффекте упрочнения при интенсивной пластической деформации (наклепе) и разупрочнения при возврате и рекристаллизации.От дислокационной структуры существенно зависят прочностные свойства металла. Целенаправленно изменяя дислокационную структуру за счет выбора химического состава сплава, режимов его термической, термомеханической обработки, можно обеспечить высокий уровень свойств.
Тонкая, электронно-микроскопическая структура. Метод дифракционной электронной микроскопии в общем случае позволяет исследовать тонкую, или электронно-микроскопическую, структуру, т. е. структуру металла с дислокациями, дефектами упаковки, двойниками, а также структуру сплавов на стадии зонного распада и фазового старения при увеличениях 10в4—10в5.
Наноструктура, ультрадисперсная структура. Характеризуется размером областей с кристаллической структурой на уровне 10в-9 м (1 нанометр). В связи с этим значительная доля атомов (порядка 50 %) находится на поверхностях — границах кристаллитов, образуя кристаллически не упорядоченные пограничные слои. Такого типа «композиционная» структура обладает уникальными свойствами.Ультрамелкозернистая структура (микрокристаллическая структура). Представляет собой структуру с размером зерна менее 10 мкм. Наличие ультрамелкозернистой структуры в металлических сплавах является необходимым условием проявления эффекта сверхпластичности.Микроструктура. Металлографически выявляемая структура металлов и сплавов, для которой характерен уровень разрешения светового оптического микроскопа с увеличениями порядка 100—1000 раз. Методы рентгенографии, сканирующей электронной микроскопии также применяются для анализа микроструктуры металлов и сплавов,Основными элементами микроструктуры являются зерна, субзерна, ячейки, дендриты, границы зерен, междендритные области, выделения частиц различных фаз, структурные составляющие (например, эвтектика, эвтектоид и др.), дефекты структуры в виде пор, включений, микротрещин и др. Роль микроструктуры в обеспечении требуемых физико-механических свойств сплавов невозможно преувеличить. Размер зерна, внутрикристаллическая (дендритная) ликвация (химическая и структурная неоднородность), преимущественная пространственная ориентация зерен (текстура), гомогенные и гетерогенные выделения частиц второй фазы, образование зерен первичной и вторичной рекристаллизации — факторы, определяющие влияние микроструктуры на свойства высокопрочных сплавов.Этот тип структуры характеризуется довольно широким интервалом размеров (масштаба) структурных элементов от — 1 мкм до — 1 мм. Минимальные размеры элементов микроструктуры (~ 1 мкм) характерны для дисперсных структурных составляющих (перлит, сорбит в сталях), отдельных дислокаций и их скоплений в монокристаллах, зародышей рекристаллизации в деформированных металлах. Максимальные размеры (~ 1 мм) соответствуют крупнозернистым структурам.
Макроструктура. Выявляется при визуальном наблюдении или при наблюдении с небольшим увеличением отдельных образцов, а также изделий, полуфабрикатов, слитков массой до нескольких тонн.
Масштаб макроструктуры соответствует размерам образцов и изделий от нескольких миллиметров до нескольких метров.Макроструктура выявляет различные виды зональной ликвации и пористости в слитках высоколегированных сталей и сплавов, неоднородность структуры, например в виде зон равноосных и столбчатых кристаллов в слитках, и др.
Влияние макроструктуры сплавов на свойства изделий проявляется, например, в виде формирования волокнистой структуры деформированных изделий, способствующей повышению конструкционной прочности (например, волокнистая структура коленчатого вала двигателя внутреннего сгорания).
Элементами макроструктуры являются зерна первичной кристаллизации, а также дефекты структуры слитков в виде различных видов пористости, зональной ликвации, приводящие к снижению технологической пластичности высоколегированных сплавов.
Следует отметить, что в ряде случаев, в частности при анализе механизмов сверхпластичности, помимо рассмотренных структурных уровней структуры выделяют промежуточный тип структуры — мезоструктуру, определяемую как структуру промежуточного масштаба (уровня), соответствующего среднему размеру зерна.
Для современного металловедения характерен многоуровневый анализ структуры металлов и сплавов с учетом взаимосвязи между изменениями структуры различных уровней и степени их влияния но свойства. Синергетический подход и мультифрактальный формализм при анализе процессов формирования структуры материалов в сильно неравновесных состояниях рассматриваются как перспективное направление в материаловедении.Разработка новых сплавов определяется выбором основы сплава (матрицы), легирующего элемента или комплекса элементов, заданием оптимальной их концентрации.Диаграммы состояний высокопрочных сплавов обычно характеризуются наличием областей непрерывных и ограниченных твердых растворов легирующих элементов, образованием интерметаллидных соединений и фаз внедрения.Особую роль играет характер распределения интерметаллидных фаз и фаз внедрения, обусловленный спецификой фазовых превращений (в виде отдельных частиц или, например, в виде эвтектики).Кинетика распада пересыщенного твердого раствора оказывает существенное влияние на формирование структуры высокопрочных сплавов, в частности сплавов на основе никеля и алюминия.
Анализ соответствующей диаграммы состояния сплавов позволяет в предельном случае термодинамического равновесия определить физико-химические особенности взаимодействия элементов, типы образующихся фаз, таких, как граничные твердые растворы, промежуточные соединения (интерметаллидные фазы или фазы внедрения), структурно-фазовое состояние и эффективность упрочнения сплава.
Большая Рнциклопедия Нефти Рё Газа
Cтраница 1
Металлические структуры обладают некоторыми очень характерными свойствами.
Каждый атом РІ кристаллической структуре металла имеет высокое координационное число ( часто двенадцать Рё РёРЅРѕРіРґР° восемь), Рё структура характеризуется высокой электро — Рё теплопроводностями.
Атомы РІ металле располагаются близко РѕРґРёРЅ Рє РґСЂСѓРіРѕРјСѓ; это означает, что наблюдается значительное перекрывание орбиталей внешних электронов Рё что валентные электроны фактически связаны РЅРµ СЃ отдельным СЏРґСЂРѕРј, Р° делокализованьг РїРѕ всем атомам металла. Таким образом, металл можно рассматривать как ансамбль положительных РёРѕРЅРѕРІ, которые, вообще РіРѕРІРѕСЂСЏ, представляют СЃРѕР±РѕР№ сферы одинакового радиуса ( марганец Рё уран являются исключениями), как можно более плотно упакованные РІ пространстве. Существует РґРІР° СЃРїРѕСЃРѕР±Р° плотной упаковки одинаковых сфер: РѕРґРёРЅ РёР· РЅРёС… РїСЂРёРІРѕРґРёС‚ Рє гексагональной, Р° РґСЂСѓРіРѕР№ — Рє кубической симметрии, РЅРѕ РІ каждом случае координационное число равно двенадцати. Объемноцентрированная кубическая структура щелочных металлов менее плотно упакована: для нее координационное число равно РІРѕСЃСЊРјРё Рё каждый РёРѕРЅ имеет восемь ближайших соседей РІ услах окружающего его РєСѓР±Р°. [1]
Металлическая структура, характерная для металлов в их твердом ( и жидком) агрегатном состоянии, является наиболее сложной.
Рта структура содержит одновременно атомы нейтральные Рё ионизированные.
В металлической структуре непрерывно осуществляется обмен электронами между нейтральными и ионизированными атомами без затраты энергии. [3]
Металлическая структура характеризуется относительно малой связью внешних валентных электронов в атомах металлов с ядром.
Связь в решетке металла возникает в результате взаимодействия положительных ионов с электронным газом.
Рлектроны, находясь между ионами, стараются стянуть РёС…, стремясь уравновесить силы отталкивания, действующими между положительно заряженными ионами. [4]
Вследствие стабильной металлической структуры аустенит-ные стали сохраняют в течение длительного времени приемлемо низкую ползучесть даже при температурах выше 500 С. [5]
В металлических структурах атомные радиусы играют не менее важную роль, чем ионные в неорганических соединениях. [6]
| Микротвердрсть переходных металлов. [7] |
Процесс образования металлических структур РёР· свободных атомов обычно рассматривают как результат взаимодействия газа РёР· почти свободных валентных электронов СЃ атомными остовами. Рлектронный газ стягивает положительно заряженные атомные остовы РІ ту или РёРЅСѓСЋ структуру. Образование предельно вырожденного электронного газа путем отрыва валентных электронов РѕС‚ свободных атомов требует больших энергий, равных СЃСѓРјРјРµ потенциалов ионизации. Рнергии ионизации электронов возрастают РѕС‚ 4 — 5 СЌР’ для щелочных металлов РґРѕ 200 — 270 СЌР’ для С…СЂРѕРјР°, молибдена, вольфрама. Р’ СЃРІСЏР·Рё СЃ этим необходим энергетический анализ Рё сопоставление теплот испарения, плавления Рё превращения металлов СЃ энергией образования электронного газа. [8]
Последняя РёР· типичных металлических структур — ОЦК ( калий, натрий, литий, ванадий… [9]
Силициды с металлическими структурами образованы замещением металлических атомов атомами кремния без перестройки решетки металла ( иногда с уплотнением), при котором наряду с металлическими связями между атомами имеются ковалентные. [10]
Кристаллы с металлической структурой обозначены темными кружками, неметаллические структуры-светлыми кружками.
Для углерода указаны графит и алмаз. Для олова приведены металлическая белая форма и серая форма со структурой алмаза.
[12]
Вакансии РІ металлических структурах вызывают сжатие, Р° РІ ионных — расширение структур. [14]
Даже в изотропных металлических структурах узлов самолетов редко возникают однородные поля механических напряжений.
В композиционных материалах за счет анизотропности структуры материала поля напряжений всегда анизотропны. Адгезионные соединения, таким образом, находятся в области несимметричных напряжений.
Напряжения в адгезионных соединениях возникают уже во время процесса отверждения связующего при повышенной температуре.
При определении геометрии соединения композитов адгезионным методом необходимо учитывать максимальные колебания напряжений, скорость изменения напряжения, необходимую размеростабильность соединения. [15]
Страницы: 1 2 3 4
Структура металлов. Методы изучения
Анализы структуры металлов: микро-, макро- и тонкая структура.
Строение металла условно делится на микро-, макро- и тонкую структуру.
1. Макроструктура.
Макроструктуру материала изучают визуально без применения специального оборудования или при незначительном увеличении (под лупой).
Осмотр помогает оценить структуру сплава после подготовки материала (шлифовка, травление) для дальнейшего исследования.
С помощью макроструктурного анализа можно выявить:
• явные, сплошные дефекты заготовок, которые могут стать причиной разрушения вещества (усадочная пористость, пузыри газа, трещины, раковины);
• причины разрушения готовых деталей;
• вид излома;
• локализацию кристаллов и дендритов литья, их форму, размер;
• химическую неоднородность кристаллизованного или созданного с помощью термической или химической обработки металла;
• волокна деформированного сплава.
2. Микроструктурный анализ.
Метод предполагает изучение металла при увеличении в 50 — 2000 раз световым микроскопом, что позволяет увидеть частицы до 0,2 мкм. Метод возможен благодаря рассмотрению структуры в отраженном свете, поэтому образцами для исследования служат микрошлифы с полированной поверхностью, в которых можно увидеть микротрещины и неметаллические составные.
Для эффективности анализа, поверхность предварительно травят специальными реактивами, состав которых зависит от испытуемого вещества.
Изучение микроструктуры помогает выявить форму и размер зерен, фазы и структуру вещества.
Использование электронных микроскопов с большим разрешением также возможно при исследовании металла. Их изображение появляется с помощью быстрого потока летящих электронных лучей (длина волн 0,04 – 0,12)*10-8см.
Просвечивающие микроскопы — проходя потоком электронов через изучаемый образец, дает картину неоднородного рассеивания электронов в структуре объекта.
Косвенные и прямые методы.
Косвенный анализ изучает не объект, а только его отпечаток, рельеф микрошлифа. Метод применяется с целью предупреждения повторного излучения, которое искажает картину.
Прямой — просветное изучение фольги (до 300 нм). Фольгу получают из испытуемого объекта.
Растровые микроскопы помогают изучить поверхность объекта и имеют немного меньшую разрешающую способность. Изображение при испытании получают при излучении электронов вторичной эмиссии с поверхности, подвергаемой потоку первичных электронов.
3. Тонкая структура.
Метод основан на изучении атомно-кристаллической структуры твердой решетки с помощью рентген волн. Анализ позволяет определить химическую связь сплава, локализацию дефектов и их концентрацию, структуру, свойства, тип твердых растворов, напряжение, плотность дислокаций.
Pereosnastka.ru
- Понятие о структуре металлов и сплавов
- Категория:
- Изготовление форм
Понятие о структуре металлов и сплавов
Все металлы и сплавы имеют кристаллическое, или зернистое, строение.
Их кристаллы состоят из мельчайших частиц — атомов, которые располагаются в строго определенном порядке, образуя мельчайшие кристаллические решетки, которые можно рассмотреть с помощью рентгеновских лучей. Атомы находятся в непрерывном движении.
При нагреве металла движение атомов усиливается, а по достижении температуры плавления кристаллические решетки разрушаются, благодаря чему расплавленный металл приобретает жидкотекучесть. При охлаждении металла кристаллические решетки образуются вновь.
Форма, размеры и расположение зерен характеризуют внутреннее строение —структуру металла, которая наряду с химическим составом оказывает большое влияние на свойства металлов и сплавов: чем меньше зерно, тем плотнее материал, тем выше его механические свойства.
Структуру сплавов определяют в металлографической лаборатории путем рассмотрения шлифа (отшлифованного до зеркального блеска среза кусочка сплава) при увеличении в 100—500 и более раз с помощью металлографического микроскопа. Для выявления отдельных структурных составляющих сплава шлиф обрабатывают растворами кислот.
Железоуглеродистые сплавы в зависимости от содержания углерода подразделяются на две группы — чугуны и стали. Если в железоуглеродистом сплаве содержится до 2% углерода, то его называют сталью, а если больше 2% углерода — то чугуном.
Железоуглеродистые сплавы могут содержать в качестве структурных составляющих графит, феррит, цементит, перлит и др.
Графит —свободный углерод, находящийся в основной массе сплава в виде пластйнок или зерен. Присутствуя в сером чугуне в виде пластин, графит как бы разделяет основную металлическую массу и тем самым снижает прочность и пластичность. Шаровидный графит в меньшей степени нарушает сплошность основной структуры сплава, благодаря чему повышается его прочность и пластичность.
Феррит — почти чистое железо, в котором углерод растворен в небольшом количестве (до 0,04%). Обладает большой вязкостью и пластичностью, низкой прочностью и сопротивляемостью износу.
Цементит — химическое соединение 6,67% углерода и 93,33% железа. Обладает очень большой твердостью и хрупкостью. Значительное количество цементита в белом чугуне делает его хрупким, не -поддающимся механической обработке.
Перлит — смесь тонких, чередующихся между -собой пластин цементита и феррита. Перлит содержит 0,83% углерода и 99,17% железа. Обладает высокой прочностью, твердостью, вязкостью и является основой высококачественных чугунов и сталей.