- Физические свойства
- Химические свойства
- Реакции горения
- Горение веществ на воздухе и в кислороде
- Кислород
- Общая характеристика элементов VIa группы
- Основное состояние атома кислорода
- Природные соединения
- Получение
- Химические свойства
- Физические и химические свойства кислорода
- Химические свойства кислорода
- Физические свойства кислорода
- Получение кислорода
- Примеры решения задач
- Химические свойства кислорода
- Химические свойства кислорода — Основы химии на Ида Тен
- Взаимодействие кислорода со сложными веществами
- Окисление – горение и медленное окисление
- Химические свойства кислорода — характеристика, строение и основные реакции — Помощник для школьников Спринт-Олимпик.ру
- Нахождение в природе и физические свойства
- Химические характеристики и соединения
- Оксиды и пероксиды
- Озон (O3) — аллотропная модификация
- Получение кислорода
- Применение и промышленное значение
- Химические свойства кислорода
- Почему же в кислороде горение идет энергичнее, чем в воздухе?
- А горит ли сам кислород?
Архив уроков › Химия 8 класс
В уроке 18 «Физические и химические свойства кислорода» из курса «Химия для чайников» выясним, какие физические и химические свойства имеет кислород и узнаем о реакциях горения.

Как у любого химического вещества, у кислорода есть свой набор физических и химических свойств, по которым его можно отличить от других веществ.
Физические свойства
По своим физическим свойствам простое вещество кислород относится к неметаллам. При нормальных условиях он находится в газообразном агрегатном состоянии. Кислород не имеет цвета, запаха и вкуса. Масса кислорода объемом 1 дм3 при н. у. равна примерно 1,43 г.
При температуре ниже −183 °С кислород превращается в голубую жидкость, а при −219 °С эта жидкость переходит в твердое вещество. Это означает, что температура кипения кислорода равна: t кип.= −183 °С, а температура плавления составляет: t пл.= −219 °С. Кислород плохо растворяется в воде.
Химические свойства
Кислород является химически активным веществом. Он способен вступать в реакции с множеством других веществ, однако для протекания большинства этих реакций необходима более высокая, чем комнатная, температура. При нагревании кислород реагирует с неметаллами и металлами.
Если стеклянную колбу наполнить кислородом и внести в нее ложечку с горящей серой, то сера вспыхивает с образованием яркого пламени и быстро сгорает (рис. 80).

Химическую реакцию, протекающую в этом случае, можно описать следующим уравнением:
В результате реакции образуется вещество SO2, которое называется сернистым газом. Сернистый газ имеет резкий запах, который вы ощущаете при зажигании обычной спички. Это говорит о том, что в состав головки спички входит сера, при горении которой и образуется сернистый газ.
Подожженный красный фосфор в колбе с кислородом вспыхивает еще ярче и быстро сгорает, образуя густой белый дым (рис. 81).

При этом протекает химическая реакция:
Белый дым состоит из маленьких твердых частиц продукта реакции — P2O5.
Если в колбу с кислородом внести тлеющий уголек, состоящий в основном из углерода, то он также вспыхивает и сгорает ярким пламенем (рис. 82).

Протекающую химическую реакцию можно представить следующим уравнением:
Продуктом реакции является CO2, или углекислый газ, с которым вы уже знакомы. Доказать образование углекислого газа можно, добавив в колбу немного известковой воды. Помутнение свидетельствует о присутствии CO2 в колбе.
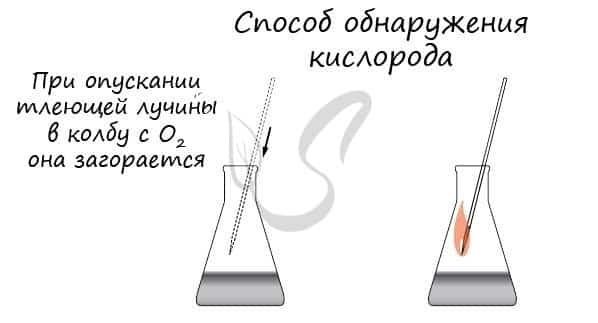
Возгорание уголька можно использовать для отличия кислорода от других газов. Если в сосуд (колбу, пробирку) с газом внести тлеющий уголек и он вспыхнет, то это указывает на наличие в сосуде кислорода.
Кроме неметаллов, с кислородом реагируют и многие металлы. Внесем в колбу с кислородом раскаленную стальную проволоку, состоящую в основном из железа. Проволока начинает ярко светиться и разбрасывать в разные стороны раскаленные искры, как при горении бенгальского огня (рис. 83).

При этом протекает следующая химическая реакция:
В результате реакции образуется вещество Fe3O4 (железная окалина). В состав формульной единицы этого вещества входят три атома железа, причем один из них имеет валентность II, а два других атома имеют валентность III. Поэтому формулу этого вещества можно представить в виде FeO * Fe2O3.
На заметку: Реакцию железа с кислородом используют для резки стальных изделий. Для этого определенный участок детали сначала нагревают с помощью кислородногазовой горелки.
Затем направляют на нагретое место струю чистого кислорода, для чего перекрывают кран поступления горючего газа в горелку. Нагретое до высокой температуры железо вступает в химическую реакцию с кислородом и превращается в окалину.
Так можно разрезать очень толстые железные детали.
Реакции горения
Общим для рассмотренных нами реакций является то, что при их протекании выделяется много света и теплоты. Очень многие вещества именно так взаимодействуют между собой.
- Рассмотренные выше реакции простых веществ серы, фосфора, углерода и железа с кислородом являются реакциями горения.
- Реакциями горения называются химические реакции, протекающие с выделением большого количества теплоты и света.
- Кроме простых веществ, в кислороде горят и многие сложные вещества, например метан CH4. При горении метана образуются углекислый газ и вода:
В результате этой реакции выделяется очень много теплоты. Вот почему ко многим домам подведен природный газ, основным компонентом которого является метан. Теплота, выделяющаяся при горении метана, используется для приготовления пищи и других целей.
На заметку: Некоторые химические реакции протекают очень быстро. Такие реакции называют взрывными или просто взрывами. Например, взаимодействие кислорода с водородом может протекать в форме взрыва.
Горение может протекать не только в кислороде, но и в других газах. Об этих процессах вы узнаете при дальнейшем изучении химии.
Горение веществ на воздухе и в кислороде
Вы уже знаете, что в состав окружающего нас воздуха входит кислород. Поэтому многие вещества горят не только в чистом кислороде, но и на воздухе.
Горение на воздухе протекает чаще всего гораздо медленнее, чем в чистом кислороде. Происходит это потому, что в воздухе лишь одна пятая часть по объему приходится на кислород.
Если уменьшить доступ воздуха к горящему предмету (а следовательно, уменьшить доступ кислорода), горение замедляется или прекращается.
Отсюда понятно, почему для тушения загоревшегося предмета на него следует набросить, например, одеяло или плотную тряпку.
На заметку: При пожарах для тушения горящих предметов часто используют пену (рис. 84). Она обволакивает горящий предмет и прекращает доступ к нему кислорода. Горение сначала замедляется, а затем прекращается совсем.
Некоторые вещества, быстро сгорающие в кислороде, на воздухе не горят вообще. Так, если нагреть железную проволоку на воздухе даже до белого каления, она все равно не станет гореть, тогда как в чистом кислороде быстро сгорает с образованием раскаленных искр.
Краткие выводы урока:
- При обычных условиях кислород — газ, не имеющий цвета, запаха и вкуса, плохо растворимый в воде.
- Кислород обладает высокой химической активностью. Он вступает в химические реакции со многими простыми и сложными веществами.
- Химические реакции, протекающие с выделением большого количества теплоты и света, называют реакциями горения.
- В чистом кислороде вещества горят намного быстрее, чем на воздухе.
Надеюсь урок 18 «Физические и химические свойства кислорода» был понятным и познавательным. Если у вас возникли вопросы, пишите их в комментарии.
Кислород
Кислород (лат. Oxygenium) — элемент VIa группы 2 периода периодической таблицы Д.И. Менделеева. Первым открывает группу халькогенов — элементов VIa группы.
Газ без цвета, без запаха, составляет 21% воздуха.

Общая характеристика элементов VIa группы
Общее название элементов VIa группы O, S, Se, Te, Po — халькогены. Халькогены (греч. χαλκος — руда + γενος — рождающий) — входят в состав многих минералов. Например, кислород составляет 50% массы земной коры.
От O к Po (сверху вниз в периодической таблице) происходит увеличение: атомного радиуса, металлических, основных, восстановительных свойств. Уменьшается электроотрицательность, энергия ионизации, сродство к электрону.
Среди элементов VIa группы O, S, Se — неметаллы. Te, Po — металлы.
Электронные конфигурации у данных элементов схожи, так как они находятся в одной группе (главной подгруппе!), общая формула ns2np4:
- O — 2s22p4
- S — 3s23p4
- Se — 4s24p4
- Te — 5s25p4
- Po — 6s26p4
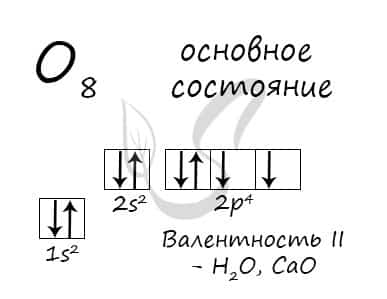
Основное состояние атома кислорода
У атома кислорода (как и атомы азота, фтора, неона) нет возбужденного состояния, так как отсутствует свободная орбиталь с более высоким энергетическим уровнем, куда могли бы перемещаться валентные электроны.
Атом кислорода имеется два неспаренных электрона, максимальная валентность II.
Природные соединения
- Воздух — в составе воздуха кислород занимает 21% (это число пригодится в задачах!)
- В форме различных минералов в земной коре кислорода содержится около 50%
- В живых организмов кислород входит в состав органических веществ: белков, жиров, углеводов и нуклеиновых кислот
Получение
В промышленности кислород получают из сжиженного воздуха. Также активно применяются кислородные установки, мембрана которых устроена как фильтр, отсеивающие кислород (мембранная технология).
В лаборатории кислород получают разложением перманганата калия (марганцовки) или бертолетовой соли при нагревании. Применяется реакция каталитического разложения пероксида водорода.
- KMnO4 → K2MnO4 + MnO2 + O2↑
- KClO3 → KCl + O2↑
- H2O2 → (кат. — MnO2) H2O + O2
- На подводных лодках для получения кислорода применяют следующую реакцию:
- Na2O2 + CO2 → Na2CO3 + O2↑

Химические свойства
Является самым активным неметаллом после фтора, образует бинарные соединения со всеми элементами кроме гелия, неона, аргона. Чаще всего реакции с кислородом экзотермичны (горение), ускоряются при повышении температуры.
- Реакции с неметаллами
- Во всех реакциях, кроме взаимодействия со фтором, кислород проявляет себя в качестве окислителя.
- NO + O2 → (t) NO2
- S + O2 → (t) SO2
- 2C + O2 = (t) 2CO (неполное окисление — угарный газ, соотношение 2:1)
- C + O2 = (t) CO2 (полное окисление — углекислый газ, соотношение 1:1)
- F + O2 → OF2 (фторид кислорода, O+2)
- Реакции с металлами
- Li + O2 → Li2O (оксид)
- Na + O2 → Na2O2 (пероксид)
- K + O2 → KO2 (супероксид)
- Горение воды
- Окисление органических веществ
- Контролируемое окисление
В реакциях кислорода с металлами образуются оксиды, пероксиды и супероксиды. Реакции с активными металлами идут без нагревания.
Известна реакция горения воды во фторе.
F2 + H2O → HF + O2
Все органические вещества сгорают с образованием углекислого газа и воды.
C3H7 + O2 = CO2 + H2O

При применении катализаторов и особых реагентов в органической химии достигают контролируемого окисления: алканы окисляются до спиртов, спирты — до альдегидов, альдегиды — до кислот.
Процесс можно остановить на любой стадии в зависимости от желаемого результата.
Физические и химические свойства кислорода
Атомная масса – 16 а.е.м. Молекула кислорода двухатомна и имеет формулу – О2
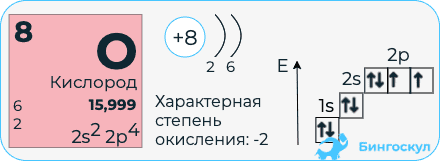
Кислород относится к семейству p-элементов. Электронная конфигурация атома кислорода 1s22s22p4.
В своих соединениях кислород способен проявлять несколько степеней окисления: «-2», «-1» (в пероксидах), «+2» (F2O).
Для кислорода характерно проявление явления аллотропии – существования в виде нескольких простых веществ – аллотропных модификаций. Аллотропные модификации кислорода – кислород O2 и озон O3.
Химические свойства кислорода
Кислород является сильным окислителем, т.к. для завершения внешнего электронного уровня ему не хватает всего 2-х электронов, и он легко их присоединяет. По химической активности кислород уступает только фтору. Кислород образует соединения со всеми элементами кроме гелия, неона и аргона.
Непосредственно кислород нее вступает в реакции взаимодействия с галогенами, серебром, золотом и платиной (их соединения получают косвенным путем). Почти все реакции с участием кислорода – экзотермические. Характерная особенность многих реакций соединения с кислородом — выделение большого количества теплоты и света.
Такие процессы называют горением.
Взаимодействие кислорода с металлами. Со щелочными металлами (кроме лития) кислород образует пероксиды или надпероксиды, с остальными – оксиды. Например:
- 4Li + O2 = 2Li2O;
- 2Na + O2 = Na2O2;
- K + O2 = KO2;
- 2Ca + O2 = 2CaO;
- 4Al + 3O2 = 2Al2O3;
- 2Cu + O2 = 2CuO;
- 3Fe + 2O2 = Fe3O4.
Взаимодействие кислорода с неметаллами. Взаимодействие кислорода с неметаллами протекает при нагревании; все реакции экзотермичны, за исключением взаимодействия с азотом (реакция эндотермическая, происходит при 3000С в электрической дуге, в природе – при грозовом разряде). Например:
- 4P + 5O2 = 2P2O5;
- S+ O2 = SO2;
- С + O2 = СО2;
- 2Н2 + O2 = 2Н2О;
- N2 + O2 ↔ 2NO – Q.
- Взаимодействие со сложными неорганическими веществами. При горении сложных веществ в избытке кислорода образуются оксиды соответствующих элементов:
- 2H2S + 3O2 = 2SO2↑ + 2H2O (t);
- 4NH3 + 3O2 = 2N2↑ + 6H2O (t);
- 4NH3 + 5O2 = 4NO↑ + 6H2O (t, kat);
- 2PH3 + 4O2 = 2H3PO4 (t);
- SiH4 + 2O2 = SiO2 + 2H2O;
- 4FeS2+11O2 = 2Fe2O3 +8 SO2↑ (t).
- Кислород способен окислять оксиды и гидроксиды до соединений с более высокой степенью окисления:
- 2CO + O2 = 2CO2 (t);
- 2SO2 + O2 = 2SO3 (t, V2O5);
- 2NO + O2 = 2NO2;
- 4FeO + O2 = 2Fe2O3 (t).
- Взаимодействие со сложными органическими веществами. Практически все органические вещества горят, окисляясь кислородом воздуха до углекислого газа и воды:
- CH4 + 2O2 = CO2↑ +H2O.
- Кроме реакций горения (полное окисление) возможны также реакции неполного или каталитического окисления, в этом случае продуктами реакции могут быть спирты, альдегиды, кетоны, карбоновые кислоты и другие вещества:
Окисление углеводов, белков и жиров служит источником энергии в живом организме.
Физические свойства кислорода
Кислород – самый распространенный элемент на земле (47% по массе). В воздухе содержание кислорода составляет 21% по объему. Кислород – составная часть воды, минералов, органических веществ. В растительных и животных тканях содержится 50 -85 % кислорода в виде различных соединений.
В свободном состоянии кислород представляет собой газ без цвета, вкуса и запаха, плохо растворимый в воде (в 100 л воды при 20С растворяется 3 л кислорода. Жидкий кислород голубого цвета, обладает парамагнитными свойствами (втягивается в магнитное поле).
Получение кислорода
- Различают промышленные и лабораторные способы получения кислорода. Так, в промышленности кислород получают перегонкой жидкого воздуха, а к основным лабораторным способам получения кислорода относят реакции термического разложения сложных веществ:
- 2KMnO4 = K2MnO4 + MnO2 + O2↑
- 4K2Cr2O7 = 4K2CrO4 + 2Cr2O3 +3 O2↑
- 2KNO3 = 2KNO2 + O2↑
- 2KClO3 = 2KCl +3 O2↑
Примеры решения задач
| Понравился сайт? Расскажи друзьям! |
Химические свойства кислорода
Химические свойства кислорода добавить в закладки
Кислород входит в VI группу главной подгруппы периодической системы химических элементов. На внешнем энергетическом уровне 6 электронов, то есть незавершенный. Поэтому он способен достраивать свой уровень, присоединяя электроны и проявляя окислительные свойства. Степень окисления характерна -2, исключение составляют пероксиды, в которых он проявляет степень окисления -1 и фторид кислорода (степень окисления у кислорода +2). Кислород никогда не проявляет положительных степеней окисления, что говорит о его высокой окислительной способности. Кислород является универсальным окислителем. Реакции горения так же относятся к реакциям окисления.
Кислород способен образовывать две аллотропные модификации O2 и O3 (озон). Причем озон является более сильным окислителем, чем кислород.
Кислород характеризуется проявлением преимущественно окислительных свойств, в виде исключения и восстановительных.
Восстановительные свойства проявляет в реакции с фтором, которая протекает при высоких температурах. Продуктом реакции является фторид кислорода (II) – бесцветный ядовитый газ.
F2 + O2 → OF2
Окислительные свойства
- Взаимодействует с металлами с образованием оксидов и пероксидов (натрий, калий).
- 2Li + O2 → 2Li2O 2Na + O2 → Na2O2
- При горении железа в кислороде образуется окалина.
- 3Fe + 2O2 → Fe3O4
- Реакции с неметаллами протекают с выделением энергии, их относят к экзотермическим.
- C + O2 → CO2 S + O2 → SO2 4P + 5O2 → 2P2O5
- Исключением является взаимодействие азота с кислородом – реакция протекает с поглощением энергии и относится к эндотермическим.
- N2 + O2 → 2NO — Q
- Для кислорода характерны реакции со сложными веществами, которые также протекают с выделением большого количества теплоты и образованием воды.
CH4 + 2O2 → 2H2O + CO2↑
Смотри также:
- Номенклатура неорганических веществ
- Характерные химические свойства простых веществ – металлов: щелочных, щелочноземельных, магния, алюминия; переходных металлов (меди, цинка, хрома, железа)
- Характерные химические свойства простых веществ – неметаллов: водорода, галогенов, кислорода, серы, азота, фосфора, углерода, кремния
- Характерные химические свойства оксидов: оснóвных, амфотерных, кислотных
- Характерные химические свойства оснований и амфотерных гидроксидов
- Характерные химические свойства кислот
- Характерные химические свойства солей: средних, кислых, оснóвных; комплексных ( на примере соединений алюминия и цинка)
- Взаимосвязь различных классов неорганических веществ
Химические свойства кислорода — Основы химии на Ида Тен
Кислороду присуща высокая химическая активность. Многие вещества реагируют с кислородом при комнатной температуре. Так, например, свежий срез яблока довольно быстро приобретает бурую окраску, это происходит вследствие химических реакций между органическими веществами, содержащимися в яблоке, и кислородом, содержащимся в воздухе.
С простыми веществами кислород, как правило, реагирует при нагревании. В металлическую ложечку для сжигания веществ поместим уголек, нагреем его в пламени спиртовки докрасна и опустим в сосуд с кислородом. Наблюдаем яркое горение уголька в кислороде. Уголь – простое вещество, образованное элементом углеродом.
В реакции кислорода с углеродом образуется углекислый газ:
C + O2 = CO2
Стоит отметить, что многие химические вещества имеют тривиальные названия. Углекислый газ – это тривиальное название вещества.
Тривиальные названия веществ используются в повседневной жизни, многие из них имеют давнее происхождение. Например, пищевая сода, бертолетова соль.
Однако у каждого химического вещества есть и систематическое химическое название, составление которого регламентируется международными правилами – систематической химической номенклатурой.
Так, углекислый газ имеет систематическое название оксид углерода (IV).
Углекислый газ является сложным веществом, бинарным соединением, в состав которого входит кислород. Поместим в ложечку для сжигания веществ серу и нагреем. Сера плавится, затем загорается. На воздухе сера горит бледным, почти незаметным, синим пламенем. Внесем серу в сосуд с кислородом – сера горит ярким синим пламенем. В реакции серы с кислородом образуется сернистый газ:
S + O2 = SO2
Сернистый газ, как и углекислый газ, относится к группе оксидов. Это оксид серы (IV) – бесцветный газ с резким едким запахом. Теперь внесем в сосуд с кислородом подожженный красный фосфор. Фосфор горит ярким, ослепительным пламенем. Сосуд заполняется белым дымом. Белый дым – это продукт реакции, мелкие твердые частицы оксида фосфора (V):
4P + 5O2 = 2P2O5
В кислороде способны гореть не только неметаллы. Металлы также энергично взаимодействуют с кислородом. Например, магний горит в кислороде и на воздухе ослепительным белым пламенем. Продукт реакции – оксид магния:
2Mg + O2 = 2MgO
Попробуем сжечь в кислороде железо. Раскалим в пламени спиртовки стальную проволоку и быстро опустим в сосуд с кислородом. Железо горит в кислороде с образованием множества искр. Вещество, полученное в результате реакции, называют железной окалиной:
3Fe + 2O2 = Fe3O4.
Снопы искр, образующихся при горении бенгальского огня, объясняются сгоранием порошка железа, входящего в состав этих пиротехнических изделий.
После рассмотренных реакций можно сделать важные выводы: кислород реагирует как с металлами, так и неметаллами; часто эти реакции сопровождаются горением веществ. Продуктами реакций кислорода с простыми веществами являются оксиды.
Обратите внимание, что при взаимодействии кислорода с простыми веществами – металлами и неметаллами образуются сложные вещества – оксиды. Такой тип химических реакций называют реакциями соединения.
Реакция соединения – реакция, в результате которой из двух или нескольких менее сложных по строению веществ, образуются более сложные по строению вещества
Взаимодействие кислорода со сложными веществами
Кислород способен вступать в реакции и со сложными веществами. В качестве примера рассмотрим реакцию, которая протекает при горении бытового газа, который состоит из метана CH4. По горению метана в конфорке печи можно сделать выводы, что реакция протекает с выделением энергии в виде тепла и света. Каковы продукты этой реакции?
СН4 + 2О2 = СО2 + 2Н2О.
Продукты реакции оксиды: углекислый газ (оксид углерода (IV)) и вода (оксид водорода). В реакции кислорода с минералом пиритом FeS2 (важный минерал железа и серы) получают оксиды серы и железа. Реакция происходит при нагревании:
4FeS2 + 11O2 = 8SO2 + 2Fe2O3
Окисление – горение и медленное окисление
Горение – это первая химическая реакция, с которой познакомился человек. Огонь… Можно ли представить наше существование без огня? Он вошел в нашу жизнь, стал неотделим от нее. Без огня человек не сварит пищу, сталь, без него невозможно движение транспорта. Огонь стал нашим другом и союзником, символом славных дел, добрых свершений, памятью о минувшем.
С химической точки зрения горение – это химическая реакция, сопровождающаяся выделением потока раскаленных газов и энергии в виде тепла и света. Можно сказать, что кислород, вступая в реакцию с простыми веществами, окисляет их:
Простое вещество + Кислород окисление → Продукты окисления (оксиды) + Энергия.
Окисление веществ может и не сопровождаться горением, то есть выделением пламени. Такие процессы называют медленным окислением.
Медленное окисление – процесс постепенного взаимодействия веществ с кислородом, с медленным выделением теплоты, не сопровождающийся горением.
Так, например, углекислый газ образуется не только при горении углерода в кислороде, но и при медленном окислении органических веществ кислородом воздуха (гниении, разложении).
Итог статьи:
- В реакции простых веществ с кислородом, образуются оксиды
- Реакции простых веществ с кислородом протекают, как правило, при нагревании
- Реакции простых веществ с кислородом – это реакции соединения
- Тривиальные названия химических веществ не отражают химического состава веществ, используются в повседневной практике, многие из них сложились исторически
- Систематические названия химических веществ отражают химический состав вещества, соответствуют международной систематической номенклатуре
- Реакция соединения – реакция, в результате которой, из двух или нескольких менее сложных по строению веществ, образуются более сложные по строению вещества
- Кислород способен реагировать со сложными веществами
- Горение – химическая реакция, сопровождающаяся выделением энергии в виде тепла и света
- Медленное окисление – процесс постепенного взаимодействия веществ с кислородом, с медленным выделением теплоты, не сопровождающийся горением
Химические свойства кислорода — характеристика, строение и основные реакции — Помощник для школьников Спринт-Олимпик.ру
В 1772 году шведский химик Шееле открыл элемент кислород. Химические свойства этого вещества оказались воистину уникальными: он реагирует практически со всеми металлами (кроме золота и платины), взаимодействует с неметаллами, органическими и неорганическими веществами. Позднее, в 1774 году, это же доказал и английский ученый Пристли.
Нахождение в природе и физические свойства
Кислород (формула O2) — элемент, который наиболее распространен в земной коре (его весовое содержание составляет 49,13%). Также он содержится в воздухе, где его 23%, входит в состав воды (88,9%), во всех оксидах и кислородосодержащих солях. Общая характеристика кислорода при обычных условиях:
- бесцветный газ;
- не имеет запаха;
- плохо растворим в воде (как и в других растворителях);
- сжижается при -183°C, а затвердевает при -219°C.
Примечательно, что в жидком и твердом состоянии O2 приобретает цвет: он становится голубым. А еще он притягивается магнитом.
В таблице периодической системы находится в главной подгруппе (классе) VI группы. Элементы, расположенные здесь, на внешнем электронном слое имеют по 6 электронов, поэтому могут либо присоединять 2 электрона, либо (кроме кислорода) отдавать 4 или 6 электронов. Именно этим и объясняются их физ. и хим. свойства.
При нормальных условиях чистый кислород малоактивен, но в присутствии воды его реакционная способность усиливается. Реакции, которые протекают с участием этого вещества, называются горением. К этому процессу относится и ржавление, а также дыхание (медленное горение).
Примечание: химическая сущность дыхания состоит в соединении углерода и водорода органических веществ с кислородом.
Химические характеристики и соединения
С точки зрения химии, этот элемент — типичный активный неметалл. Во всех соединениях он проявляет степень окисления -2 (исключение — реакции с фтором). Как может протекать взаимодействие веществ с кислородом:
- Уравнения взаимодействия с металлами. 2Ca + O2 → 2CaO (оксид кальция или негашеная известь); 4Al + 3O2 → 2Al2O3.
- Реакции с неметаллами — в результате образуются несолеобразующие оксиды. S+O2 → SO2 (сернистый газ); N2 + O2 → 2NO (окись азота).
Кроме этих веществ, кислород хорошо вступает в реакции с органическими и неорганическими соединениями (с серой, углеродом, сульфидами металлов — то есть с соединениями, которые горючи в атмосфере O2). Со сложными веществами взаимодействие будет протекать по плану (реакции горения):
- CH4 + 2O2 → CO2 + 2H2O.
- 4Fe (OH)2 + O2 + 2H2O → 4Fe (OH)3.
Справка: в атомарном состоянии элемент более активен, чем в молекулярном. Именно на этом свойстве основано применение кислорода в качестве отбеливающего агента — так легче разрушаются окрашивающие органические вещества.
В молекулярном состоянии кислород может существовать в виде O2 и озона O3, то есть для него характерно явление аллотропии (существование нескольких простых веществ одного и того же химического элемента).
Оксиды и пероксиды
Если говорить кратко, можно сказать, что кислород образует два типа соединений: оксиды и пероксиды. При этом первые из названых можно рассматривать как производные воды (схема): H-O-H, Na-O-Na. Вторые же можно охарактеризовать как пероксидов водорода (тоже схематично): H-O-O-H, Na-O-O-Na.
Получить оксиды можно несколькими способами. Первый — это непосредственным взаимодействием с элементами, а второй — разложение при нагревании гидроксидов или солей. Примеры:
- Непосредственное взаимодействие. 2Mg + O2 → 2MgO.
- Разложение. Cu (OH)2 → CuO + H2O; CaCO3 → CaO + CO2.
С кислородом не будут прямо соединяться галогены, некоторые газы и благородные металлы. Щелочные металлы, за исключением лития, при взаимодействии будут образовывать пероксиды или супероксиды: 2Na +O2 → Na2O2; K + O2 → KO2 (супероксид).
Ряд окислов может соединяться с водой, образуя гидроксиды кислот — такие будут называться кислотными оксидами или ангидридами. К таким относятся SO2 (сернистый ангидрид), CO2 (угольный ангидрид). Те кислородные соединения, которые с водой образуют основания, именуют основными.
Часть оксидов обладает амфотерными свойствами. Гидроксиды таких соединений могут выступать кислотами или основаниями.
Высшие оксиды металлов (то есть те, где он находится в высшей степени окисления) всегда обладают кислотными свойствами: V2O5, Cr2O3. Известна также группа индифферентных (несолеобразующих) окислов: CO, SiO, NO.
Большинство бинарных кислородных соединений устойчивы к нагреванию. А вот оксиды благородных металлов при повышении температуры легко разлагаются.
Озон (O3) — аллотропная модификация
Это соединение образуется при медленном окислении влажного белого фосфора, а также при разложении концентрированной серной кислоты, перманганата калия, бихромата калия и некоторых других соединений (в этом случае O3 — примесь).
В природе озон образуется при окислении смолы хвойных деревьев, ультрафиолетовом облучении кислорода в верхних слоях атмосферы. Качественная реакция на присутствие O3 в воздухе:
O3 + 2KI + H2SO4 → I2 + K2SO4 + H2O + O2.
В промышленности его получают при действии тихого электрического заряда на O2: 3O2 → 2O3. Реакция протекает в специальном приборе — озонаторе, чистое вещество отделяется сжижением.
По внешнему виду — синяя жидкость, взрывоопасная. От соприкосновения с ним эфиры, спирты, скипидар воспламеняются. Озон разрушает многие органические вещества, а микроорганизмы вообще убивает. Какие химические свойства характерны для него:
- при воздействии на ненасыщенные органические вещества O3 присоединяется к ним по месту двойной связи, в результате чего образуются озониды;
- это сильный окислитель.
Благодаря своим бактерицидным свойствам озон широко применяется в промышленности: в пивоваренном производстве, для обеззараживания воды.
Получение кислорода
Один из методов получения — рефракционная перегонка воздуха, но такой кислород содержит около 3% инертных газов (в основной это аргон). Другой вариант — ректификация жидкого воздуха. Этот процесс можно кратко описать так:
- воздух сжимают при давлении 100−200 атм;
- нагревают, после чего охлаждают в специальных аммиачных холодильниках;
- охлажденную смесь пропускают через дроссель, при выходе из которого давление резко падает.
При расширении газов температура понижается, и воздух сжижается. Эта операция повторяется многократно для увеличения выхода конечного продукта.
Сжиженный воздух — смесь газов (в основном это азот и кислород, остальных там меньше 1%). Из-за разницы температур кипения (у N2 она -195,8°C, кислород закипает при -183°C) из жидкого воздуха отгоняется азот, а затем O2.
Полученный этим методом кислород содержит примеси азота, поэтому его подвергают дополнительной очистке.
В лаборатории его можно получить несколькими способами. Основные из них:
- Разложение бертолетовой соли. Реакция протекает при повышенной температуре и в присутствии катализатора, в роли которого используют диоксид марганца: 2KClO3 → 2KCl + 3O2.
- Процесс разложения перманганата калия при нагревании: 2KMnO4 → K2MnO4 + MnO2 + O2.
- Выделяют из нитратов щелочных металлов: 2NaNO3 → 2NaNO2 + O2.
- В процессе распада оксида ртути: 2HgO → 2Hg + O2.
Еще один способ синтеза — электролизация воды в присутствии гидроксидов щелочных металлов, например, KOH. Эти вещества добавляются для увеличения электропроводности.
Применение и промышленное значение
Благодаря своим свойствам кислород широко применяется в технике. В присутствии этого элемента окислительные процессы протекают гораздо интенсивнее, чем в простом воздухе.
При этом повышается температура пламени.
Поэтому O2 активно применяется для интенсификации окисления в химической и металлургической промышленности (выплавка чугуна и стали, обжиг сульфидных руд, резка металлов и прочее).
Смеси жидкого кислорода с горючими веществами (углерод, сера, древесные опилки) под названием оксиликвиты используются как взрывчатое вещество в горной и горнодобывающей промышленности (при проведении горно-взрывных работ).
Чистый O2 применяется в медицине (при лечении бронхиальной астмы, органов ЖКТ — приготовление специальных коктейлей, и прочее), в кислородных приборах при работе под землей и под водой, на больших высотах.
Незаменим он и в процессе производства ракетного топлива (окислитель).
ПредыдущаяСледующая
Химические свойства кислорода
Кислород вступает в соединения почти со всеми элементами периодической системы Менделеева.
Реакция соединения любого вещества с кислородом называется окислением.
Большинство таких реакций идет с выделением тепла. Если при реакции окисления одновременно с теплом выделяется свет, ее называют горением. Однако не всегда удается заметить выделяющиеся тепло и свет, так как в некоторых случаях окисление идет чрезвычайно медленно. Заметить тепловыделение удается тогда, когда реакция окисления происходит быстро.
В результате любого окисления — быстрого или медленного — в большинстве случаев образуются окислы: соединения металлов, углерода, серы, фосфора и других элементов с кислородом.
Вам, вероятно, не раз приходилось видеть, как перекрывают железные крыши. Перед тем как покрыть их новым железом, старое сбрасывают вниз. На землю вместе с железом падает бурая чешуя — ржавчина. Это гидрат окиси железа, который медленно, в течение нескольких лет, образовывался на железе под действием кислорода, влаги и углекислого газа.
Ржавчину можно рассматривать как соединение окиси железа с молекулой воды. Она имеет рыхлую структуру и не предохраняет железо от разрушения.
Для предохранения железа от разрушения — коррозии — его обычно покрывают краской или другими коррозионно устойчивыми материалами: цинком, хромом, никелем и другими металлами. Предохранительные свойства этих металлов, как и алюминия, основаны на том, что они покрываются тонкой устойчивой пленкой своих окислов, предохраняющих покрытие от дальнейшего разрушения.
Предохранительные покрытия значительно замедляют процесс окисления металла.
В природе постоянно происходят процессы медленного окисления, сходные с горением.
При гниении дерева, соломы, листьев и других органических веществ происходят процессы окисления углерода, входящего в состав этих веществ. Тепло при этом выделяется чрезвычайно медленно, и поэтому обычно оно остается незамеченным.
- Но иногда такого рода окислительные процессы сами по себе ускоряются и переходят в горение.
- Самовозгорание можно наблюдать в стоге мокрого сена.
- Быстрое окисление с выделением большого количества тепла и света можно наблюдать не только при горении дерева, керосина, свечи, масла и других горючих материалов, содержащих углерод, но и при горении железа.
Налейте в банку немного воды и наполните ее кислородом. Затем внесите в банку железную спираль, на конце которой укреплена тлеющая лучинка. Лучинка, а за ней и спираль загорятся ярким пламенем, разбрасывая во все стороны звездообразные искры.
Это идет процесс быстрого окисления железа кислородом. Он начался при высокой температуре, которую дала горящая лучинка, и продолжается до полного сгорания спирали за счет тепла, выделяющегося при горении железа.
- Тепла этого так много, что образующиеся при горении частицы окисленного железа накаляются добела, ярко освещая банку.
- Состав окалины, образовавшейся при горении железа, несколько иной, чем состав окисла, образовавшегося в виде ржавчины при медленном окислении железа на воздухе в присутствии влаги.
- В первом случае окисление идет до закиси-окиси железа (Fe3O4), входящей в состав магнитного железняка; во втором — образуется окисел, близко напоминающий бурый железняк, который имеет формулу 2Fe2O3 ∙ Н2O.
- Таким образом, в зависимости от условий, в которых протекает окисление, образуются различные окислы, отличающиеся друг от друга содержанием кислорода.
Так, например, углерод в соединении с кислородом дает два окисла — окись и двуокись углерода. При недостатке кислорода происходит неполное сгорание углерода с образованием окиси углерода (СО), которую в общежитии называют угарным газом. При полном сгорании образуется двуокись углерода, или углекислый газ (СO2).
Фосфор, сгорая в условиях недостатка кислорода, образует фосфористый ангидрид (Р2O3), а при избытке — фосфорный ангидрид (Р2O5). Сера в различных условиях горения также может дать сернистый (SO2) или серный (SO3) ангидрид.
В чистом кислороде горение и другие реакции окисления идут быстрее и доходят до конца.
Почему же в кислороде горение идет энергичнее, чем в воздухе?
Обладает ли чистый кислород какими-то особыми свойствами, которых нет у кислорода воздуха? Конечно, нет. И в том и в другом случае мы имеем один и тот же кислород, с одинаковыми свойствами.
Только в воздухе кислорода содержится в 5 раз меньше, чем в таком же объеме чистого кислорода, и, кроме того, в воздухе кислород перемешан с большими количествами азота, который не только сам не горит, но и не поддерживает горение.
Поэтому, если непосредственно около пламени кислород воздуха уже израсходован, то другой его порции необходимо пробиваться через азот и продукты горения. Следовательно, более энергичное горение в атмосфере кислорода можно объяснить более быстрой подачей его к месту горения.
При этом процесс соединения кислорода с горящим веществом идет энергичнее и тепла выделяется больше. Чем больше в единицу времени подается к горящему веществу кислорода, тем пламя ярче, тем температура выше и тем сильнее идет горение.
А горит ли сам кислород?
Возьмите цилиндр и опрокиньте его вверх дном. Подведите под цилиндр трубку с водородом. Так как водород легче воздуха, он полностью заполнит цилиндр.
Зажгите водород около открытой части цилиндра и введите в него сквозь пламя стеклянную трубку, через которую вытекает газообразный кислород. Около конца трубки вспыхнет огонь, который будет спокойно гореть внутри цилиндра, наполненного водородом. Это горит не кислород, а водород в присутствии небольшого количества кислорода, выходящего из трубки.
Что же образуется в результате горения водорода? Какой при этом получается окисел?
Водород окисляется до воды. Действительно, на стенках цилиндра постепенно начинают осаждаться капельки конденсированных паров воды. На окисление 2 молекул водорода идет 1 молекула кислорода, и образуются 2 молекулы воды (2Н2 + O2 → 2Н2O).
Если кислород вытекает из трубки медленно, он весь сгорает в атмосфере водорода, и опыт проходит спокойно.
Стоит только увеличить подачу кислорода настолько, что он не успеет сгореть полностью, часть его уйдет за пределы пламени, где образуются очаги смеси водорода с кислородом, появятся отдельные мелкие вспышки, похожие на взрывы.
Смесь кислорода с водородом — это гремучий газ. Если поджечь гремучий газ, произойдет сильный взрыв: при соединении кислорода с водородом получается вода и развивается высокая температура.
Пары воды и окружающие газы сильно расширяются, создается большое давление, при котором может легко разорваться не только стеклянный цилиндр, но и более прочный сосуд.
Поэтому работа с гремучей смесью требует особой осторожности.
Кислород обладает еще одним интересным свойством. Он вступает в соединение с некоторыми элементами, образуя перекисные соединения.
Приведем характерный пример. Водород, как известно, одновалентен, кислород двухвалентен: 2 атома водорода могут соединиться с 1 атомом кислорода. При этом получается вода. Строение молекулы воды обычно изображают Н — О — Н. Если к молекуле воды присоединить еще 1 атом кислорода, то образуется перекись водорода, формула которой Н2O2.
Куда же входит второй атом кислорода в этом соединении и какими связями он удерживается? Второй атом кислорода как бы разрывает связь первого с одним из атомов водорода и становится между ними, образуя при этом соединение Н—О—О—Н. Такое же строение имеет перекись натрия (Na—О—О—Na), перекись бария.
Характерным для перекисных соединений является наличие 2 атомов кислорода, связанных между собой одной валентностью. Поэтому 2 атома водорода, 2 атома натрия или 1 атом бария могут присоединить к себе не 1 атом кислорода с двумя валентностями (—О—), а 2 атома, у которых в результате связи между собой также остается только две свободные валентности (—О—О—).
Перекись водорода можно получить действием разбавленной серной кислоты на перекись натрия (Na2O2) или перекись бария (ВаO2). Удобнее пользоваться перекисью бария, так как при действии на нее серной кислотой образуется нерастворимый осадок сернокислого бария, от которого перекись водорода легко отделить путем фильтрования (ВаO2 + H2SO4 → BaSO4 + Н2O2).
Перекись водорода, как и озон, — соединение неустойчивое и разлагается на воду и атом кислорода который в момент выделения обладает большой окислительной способностью. При низких температурах и в темноте разложение перекиси водорода идет медленно.
А при нагревании и на свету оно происходит значительно быстрее. Песок, порошок двуокиси марганца, серебра или платины также ускоряют разложение перекиси водорода, а сами при этом остаются без изменения.
Вещества, которые только влияют на скорость химической реакции, а сами остаются неизмененными, называются катализаторами.
Если налить немного перекиси водорода в склянку, на дне которой находится катализатор — порошок двуокиси марганца, разложение перекиси водорода пойдет с такой быстротой, что можно будет заметить выделение пузырьков кислорода.
Способностью окислять различные соединения обладает не только газообразный кислород, но и некоторые соединения, в состав которых он входит.
Хорошим окислителем является перекись водорода. Она обесцвечивает различные красители и поэтому применяется в технике для отбеливания шелка, меха и других изделий.
Способность перекиси водорода убивать различные микробы позволяет применять ее как дезинфицирующее средство. Перекись водорода употребляется для промывания ран, полоскания горла и в зубоврачебной практике.
Сильными окислительными свойствами обладает азотная кислота (HNO3). Если в азотную кислоту добавить каплю скипидара, образуется яркая вспышка: углерод и водород, входящие в состав скипидара, бурно окислятся с выделением большого количества тепла.
Бумага и ткани, смоченные азотной кислотой, быстро разрушаются. Органические вещества, из которых сделаны эти материалы, окисляются азотной кислотой и теряют свои свойства. Если смоченную азотной кислотой бумагу или ткань нагреть, процесс окисления ускорится настолько, что может произойти вспышка.
Азотная кислота окисляет не только органические соединения, но и некоторые металлы. Медь при действии на нее концентрированной азотной кислотой окисляется сначала до окиси меди, выделяя из азотной кислоты двуокись азота, а затем окись меди переходит в азотнокислую соль меди.
Не только азотная кислота, но и некоторые ее соли обладают сильными окислительными свойствами.
Азотнокислые соли калия, натрия, кальция и аммония, которые в технике получили название селитры, при нагревании разлагаются, выделяя кислород. При высокой температуре в расплавленной селитре тлеющий уголек сгорает так энергично, что появляется яркобелый свет.
Если же в пробирку с расплавленной селитрой вместе с тлеющим угольком бросить кусочек серы, горение пойдет с такой интенсивностью и температура повысится настолько, что стекло начнет плавиться.
Эти свойства селитры давно были известны человеку; он воспользовался этими свойствами для приготовления пороха.
Черный, или дымный, порох приготовляется из селитры, угля и серы. В этой смеси уголь и сера являются горючими материалами. Сгорая, они переходят в газообразный углекислый газ (СO2) и твердый сернистый калий (K2S). Селитра, разлагаясь, выделяет большое количество кислорода и газообразный азот. Выделившийся кислород усиливает горение угля и серы.
В результате горения развивается такая высокая температура, что образовавшиеся газы могли бы расшириться до объема, который в 2000 раз больше объема взятого пороха.
Но стенки замкнутого сосуда, где обычно производят сжигание пороха, не позволяют газам легко и свободно расширяться. Создается огромное давление, которое разрывает сосуд в его наиболее слабом месте.
Раздается оглушительный взрыв, газы с шумом вырываются наружу, унося с собой в виде дыма размельченные частицы твердого вещества.
Так из калийной селитры, угля и серы образуется смесь, обладающая огромной разрушительной силой.
К соединениям с сильными окислительными свойствами относятся и соли кислородосодержащих кислот хлора. Бертолетова соль при нагревании распадается на хлористый калий и атомарный кислород.
Еще легче, чем бертолетова соль, отдает свой кислород хлорная, или белильная, известь. Белильной известью отбеливают хлопок, лен, бумагу и другие материалы. Хлорная известь употребляется и как средство против отравляющих веществ: отравляющие вещества, как и многие другие сложные соединения, разрушаются под действием сильных окислителей.
Окислительные свойства кислорода, его способность легко вступать в соединение с различными элементами и энергично поддерживать горение, развивая при этом высокую температуру, уже давно обратили на себя внимание ученых различных областей науки. Особенно этим заинтересовались химики и металлурги. Но использование кислорода было ограничено, так как не было простого и дешевого способа получения его из воздуха и воды.
На помощь химикам и металлургам пришли физики. Они нашли очень удобный способ выделения кислорода из воздуха, а физико-химики научились получать его в огромных количествах из воды.
Источник: В. Медведовский. Кислород. Государственное Издательство Детской литературы Министерства Просвещения РСФСР. Ленинград. Москва. 1953






