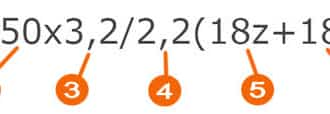- Как рассчитать степень окисления
- Алгоритм действий
- Как узнать степень окисления нескольких элементов
- Как определить высшую и низшую степень окисления
- Как найти степень окисления в органическом соединении
- Графический метод
- Валентность и степень окисления: в чем разница?
- Вопросы для самопроверки
- Степень окисления | CHEMEGE.RU
- Полезные советы:
- Таблица степени окисления химических элементов
- Примеры решения задач
- Электроотрицательность. Степень окисления и валентность химических элементов
- Степень окисления химических элементов и ее вычисление
- Валентность. Валентные возможности атомов
- Валентные возможности водорода
- Валентные возможности углерода
- Валентные возможности азота
- Валентные возможности фосфора
- Валентные возможности кислорода
- Валентные возможности серы
Для начала давайте вспомним, как проходят химические связи в молекуле вещества. Взаимодействуя между собой, атомы могут притягивать или отдавать электроны для образования общей электронной пары. Атом с более высокой электроотрицательностью (ЭО) притягивает электроны и приобретает отрицательный заряд, а атом с меньшей ЭО, напротив, отдает электроны и обретает положительный заряд.
Степень окисления — это условный заряд, который предположительно обретет атом после перемещения электронов. Он вычисляется из предположения, что все свободные электроны полностью перемещаются от одного атома к другому и все образованные связи — ионные.
Почему в определении степени окисления мы говорим об условном заряде? Потому что в реальности он может быть другим, а химические связи атома в соединении не обязательно будут ионными. Но мы предполагаем, что все именно так, чтобы немного упростить расчеты. Это помогает в составлении формул и классификаций.
Запомните:
-
Численно степень окисления равна количеству электронов, которые перешли от одного атома к другому.
-
У атома с меньшей ЭО, который отдает электроны, — положительная степень окисления.
-
У атома с большей ЭО, который притягивает электроны, — отрицательная степень окисления.
-
Простые вещества, такие как Cl2, O2 и т. д., имеют степень окисления, равную 0, поскольку смещения электронов в данном случае не происходит.
Как рассчитать степень окисления
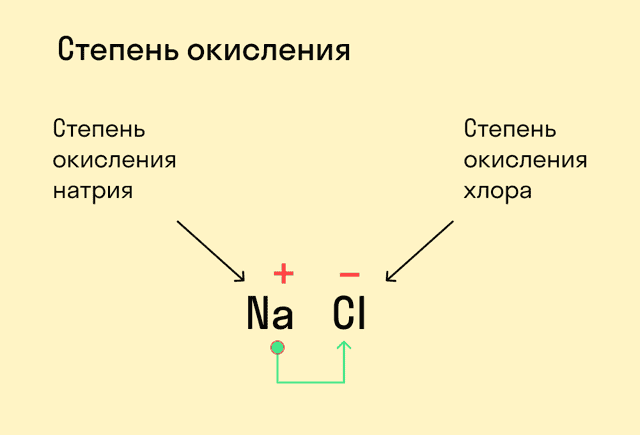
Как мы уже выяснили выше, определить степень окисления элемента (иначе говоря, окислительное число) помогает электроотрицательность. Значения ЭО легко узнать, пользуясь таблицей Менделеева или шкалой относительной электроотрицательности. Сравните, у какого химического элемента в соединении ЭО выше — этот элемент будет притягивать электроны и приобретет отрицательный заряд.
Шкала относительной электроотрицательности
В нейтральной молекуле все окислительные числа в сумме образуют ноль. В ионе их сумма равна заряду иона.
Это правило поможет составить уравнение и посчитать степень окисления любого химического элемента в соединении, если известны данные по остальным элементам. Еще больше облегчат расчеты следующие закономерности:
- у водорода в гидридах окислительное число −1, а во всех остальных веществах оно равно +1;
- у кислорода степень окисления в оксидах равна −2, в пероксидах −1, в соединениях с фтором +2;
- у неметаллов в соединениях с водородом и металлами окислительное число всегда отрицательное;
- у металлов степень окисления всегда положительная.
Также есть элементы, которые во всех соединениях отдают или принимают одинаковое количество электронов, поэтому их окислительное число — постоянная величина.

Алгоритм действий
Итак, мы знаем основные закономерности. Давайте разберемся, как находить степени окисления на примерах. Предлагаем следующий алгоритм действий.
-
Посмотрите, является ли вещество элементарным. Если да — значит, оно находится в химически несвязанном состоянии и окислительное число равно 0. Это правило подходит как для веществ, образованных из отдельных атомов, так и для тех, что включают многоатомные молекулы одного и того же элемента.
-
Пример
Степень окисления Cl2, S8 равна 0.
-
Если это соединение, определите, состоит ли оно из ионов. В многоатомном ионе сумма всех степеней окисления равна его заряду. Узнайте эту сумму из таблицы растворимости и составьте уравнение с известными окислительными числами.
-
Если соединение — нейтральная молекула, составьте уравнение, учитывая, что все окислительные числа в сумме равны 0.
Пример
Допустим, нужно определить заряд азота в ионе аммония.
Согласно таблице растворимости заряд иона аммония NH4+ равен +1. Это значит, что сумма степеней окисления в этом соединении тоже будет равна +1.
Также известно, что водород всюду, кроме гидридов, имеет заряд +1. В данном случае есть 4 атома водорода, т. е. +1 × 4.
Составим формулу: х + (+1) × 4 = +1. Значит х = −3.
Окислительное число азота в ионе аммония равно −3, т. е. N-3H4+1.
Пример
Допустим, нужно определить степень окисления серы в соединении Na2SO4.
Мы знаем, что у щелочного металла Na постоянное окислительное число +1. Кислород, согласно вышеизложенным правилам, в оксидах имеет заряд −2.
Составим уравнение: (+1) × 2 + х + (−2) × 4 = 0. Значит х = −6.
Степень окисления серы равна −6, т. е. Na2+1S-6O4-2.
Как узнать степень окисления нескольких элементов
А как быть, если неизвестны окислительные числа двух и более элементов в соединении? В математике уравнения с двумя неизвестными не всегда имеют решение. Но в химии есть выход: можно разделить химическую формулу на несколько частей, которые имеют постоянные заряды.
Пример
Как вычислить степень окисления в сложном веществе (NH4)2SO4? Посмотрим на него как на соединение двух ионов с известными зарядами: NH4+ и SO42-.
Поскольку мы знаем окислительные числа водорода и кислорода, найти заряды азота и серы в каждом ионе не составит труда.
В ионе NH4+ формула для определения заряда азота будет следующей: х + (+1) × 4 = 1. Понятно, что х = −3, т. е. степень окисления азота −3.
В ионе SO42- формула для серы х + (−2) × 4 = −2. Следовательно, х = 6, т. е. заряд серы равен +6.
Получаем следующие окислительные числа: (N-3H4+1)2S+6O4-2.
Как определить высшую и низшую степень окисления
Выделяют высшую (или максимально положительную) и низшую (максимально отрицательную) степени окисления. В диапазоне между ними располагаются окислительные числа, которые могут принадлежать данному химическому элементу в различных соединениях. Для четных групп характерны четные числа в диапазоне, а для нечетных групп — нечетные.
- Высшая степень окисления совпадает с номером группы элемента (для элементов в главной подгруппе) в короткой форме периодической системы.
- Низшая степень окисления равна числу, которое получится, если от номера группы элемента отнять 8.
- Исключения: фтор, железо, кобальт, родий, подгруппа никеля, кислород, благородные газы (помимо ксенона).
- Проиллюстрируем на примере, как найти высшую и низшую степень окисления.
Хлор (Cl), согласно короткой периодической таблице, принадлежит к группе VII. Значит, его максимальное окислительное число будет +7. Такой условный заряд элемент приобретает в оксиде хлора Cl2O7 и хлорной кислоте HClO4. Минимальное число получаем следующим образом: 7 − 8 = −1 (характерно для хлороводорода HCl).
Картинка
По степени окисления можно понять, как поведет себя вещество в окислительно-восстановительных реакциях. Если в соединении главный действующий элемент имеет высшую степень окисления, оно является окислителем, а если он имеет низшую степень окисления — восстановителем.
Например, серная кислота является окислителем, поскольку у серы в данном случае заряд +6. А вот в сернистой кислоте у серы заряд всего +4, поэтому она может проявлять и окислительную способность, и восстановительную. В сероводороде заряд серы равен −2, и это минимальная степень окисления, а значит, данное вещество — восстановитель.
Как найти степень окисления в органическом соединении
В органической химии определять окислительные числа элементов немного сложнее, поскольку все органические вещества включают углерод, известный большим количеством неполярных связей. Если у нас всего один атом углерода, можно использовать стандартный способ.
- Пример
- Рассчитайте степень окисления углерода в метаноле H3C−OH.
- Мы знаем, что водород Н имеет окислительное число +1, а у кислорода в данном случае оно равно −2. Составим уравнение:
- х + (+1) × 4 + (+2) × 1 = 0
- х + 4 − 2 = 0
- х = −2
Заряд углерода равен −2, т. е. C-2H4+1O-2.
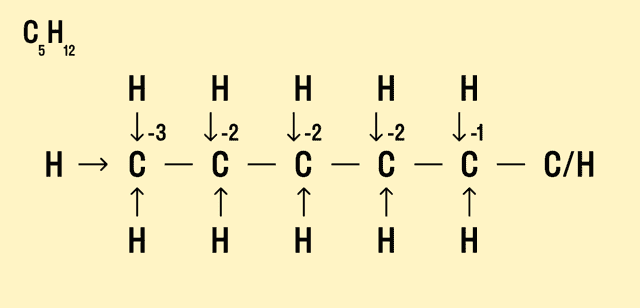
Но что делать, если атомов углерода больше? Придется анализировать структурную формулу, чтобы понять, какие химические связи есть между элементами и сколько электронов они теряют/приобретают в результате. Такой вариант нахождения окислительного числа называют графическим.
Графический метод
-
Нарисуйте структурную формулу соединения.
-
Изобразите стрелками химические связи и смещение атомов (все связи между атомами углерода С−С считайте неполярными).
-
Посчитайте, сколько стрелок ведет к атому (это «−») и сколько от него (это «+»), а затем суммируйте «+» и «−», чтобы узнать степень окисления.
- валентность не имеет знака, в то время как у окислительного числа он есть («+» или «−»);
- валентность равна нулю только в том случае, если атом не имеет связей с другими частицами, а степень окисления может быть равна нулю и при наличии таких связей;
- вычисляя степень окисления, мы предполагаем, что в соединении ионные связи, хотя на самым деле это может быть не так, а валентность всегда имеет реальный смысл.
-
Почему степень окисления называют формальным зарядом, условным?
-
Что отражает численная величина степени окисления?
-
Чему равна сумма всех окислительных чисел в ионе?
-
Как определить низшую степень окисления?
-
Как найти две неизвестных степени окисления в одном веществе?
-
Как определять степени окисления в органических веществах?
Валентность и степень окисления: в чем разница?
Школьники, которые только начали изучать данные разделы химии, нередко путают степень окисления и валентность. Численно эти показатели могут совпадать (но далеко не всегда), а вот по смыслу они в корне различаются.
Валентность показывает, какое количество связей способен образовать один атом, а степень окисления — сколько электронов перемещается в результате этих связей.
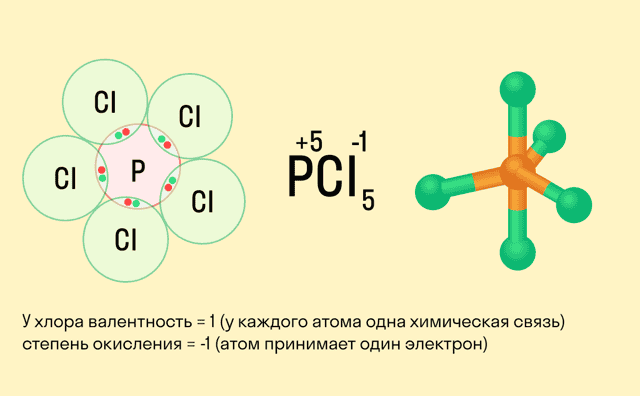
Между этими двумя понятиями есть следующие отличия:
Поэтому отождествлять эти два понятия ни в коем случае не стоит. Более того, не нужно ориентироваться на валентность, пытаясь определить окислительное число.
Вопросы для самопроверки
Степень окисления | CHEMEGE.RU
Темы кодификатора ЕГЭ: Электроотрицательность. Степень окисления и валентность химических элементов.
Когда атомы взаимодействуют и образуют химическую связь, электроны между ними в большинстве случаев распределяются неравномерно, поскольку свойства атомов различаются. Более электроотрицательный атом сильнее притягивает к себе электронную плотность.
Атом, который притянул к себе электронную плотность, приобретает частичный отрицательный заряд δ—, его «партнер» — частичный положительный заряд δ+. Если разность электроотрицательностей атомов, образующих связь, не превышает 1,7, мы называем связь ковалентной полярной.
Если разность электроотрицательностей, образующих химическую связь, превышает 1,7, то такую связь мы называем ионной.
Степень окисления – это вспомогательный условный заряд атома элемента в соединении, вычисленный из предположения, что все соединения состоят из ионов (все полярные связи – ионные).
Что значит «условный заряд»? Мы просто-напросто договариваемся, что немного упростим ситуацию: будем считать любые полярные связи полностью ионными, и будем считать, что электрон полностью уходит или приходит от одного атома к другому, даже если на самом деле это не так. А уходит условно электрон от менее электроотрицательного атома к более электроотрицательному.
Например, в связи H-Cl мы считаем, что водород условно «отдал» электрон, и его заряд стал +1, а хлор «принял» электрон, и его заряд стал -1. На самом деле таких полных зарядов на этих атомах нет.
Наверняка, у вас возник вопрос — зачем же придумывать то, чего нет? Это не коварный замысел химиков, все просто: такая модель очень удобна.
Представления о степени окисления элементов полезны при составлении классификации химических веществ, описании их свойств, составлении формул соединений и номенклатуры.
Особенно часто степени окисления используются при работе с окислительно-восстановительными реакциями.
- Степени окисления бывают высшие, низшие и промежуточные.
- Высшая степень окисления равна номеру группы со знаком «плюс».
- Низшая определяется, как номер группы минус 8.
- И промежуточная степень окисления — это почти любое целое число в интервале от низшей степени окисления до высшей.
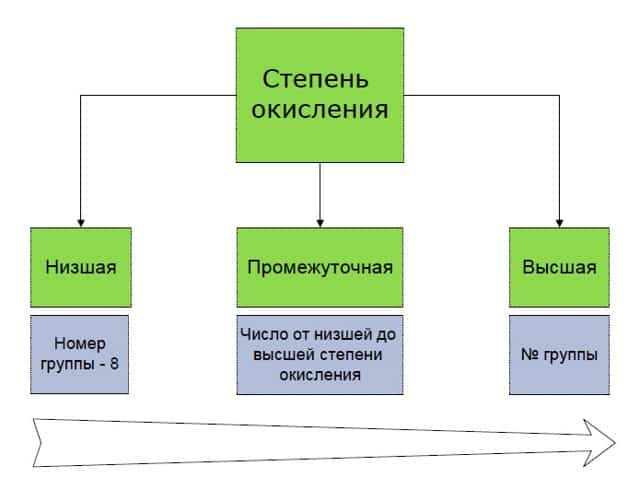
Например, для азота характерны: высшая степень окисления +5, низшая 5 — 8 = -3, а промежуточные степени окисления от -3 до +5. Например, в гидразине N2H4 степень окисления азота промежуточная, -2.
Чаще всего степень окисления атомов в сложных веществах обозначается сначала знаком, потом цифрой, например +1, +2, -2 и т.д. Когда речь идет о заряде иона (предположим, что ион реально существует в соединении), то сначала указывают цифру, потом знак. Например: Ca2+, CO3 2-.
Для нахождения степеней окисления используют следующие правила:
- Степень окисления атомов в простых веществах равна нулю;
- В нейтральных молекулах алгебраическая сумма степеней окисления равна нулю, для ионов эта сумма равна заряду иона;
- Степень окисления щелочных металлов (элементы I группы главной подгруппы) в соединениях равна +1, степень окисления щелочноземельных металлов (элементы II группы главной подгруппы) в соединениях равна +2; степень окисления алюминия в соединениях равна +3;
- Степень окисления водорода в соединениях с металлами (солеобразные гидриды — NaH, CaH2 и др.) равна -1; в соединениях с неметаллами (летучие водородные соединения) +1;
- Степень окисления кислорода равна -2. Исключение составляют пероксиды – соединения, содержащие группу –О-О-, где степень окисления кислорода равна -1, и некоторые другие соединения (супероксиды, озониды, фториды кислорода OF2 и др.);
- Степень окисления фтора во всех сложных веществах равна -1.
Выше перечислены ситуации, когда степень окисления мы считаем постоянной. У всех остальных химических элементов степень окисления — переменная, и зависит от порядка и типа атомов в соединении.
Примеры:
Задание: определите степени окисления элементов в молекуле дихромата калия: K2Cr2O7.
Решение: степень окисления калия равна +1, степень окисления хрома обозначим, как х, степень окисления кислорода -2. Сумма всех степеней окисления всех атомов в молекуле равна 0. Получаем уравнение: +1*2+2*х-2*7=0. Решаем его, получаем степень окисления хрома +6.
В бинарных соединениях более электроотрицательный элемент характеризуется отрицательной степенью окисления, менее электроотрицательный – положительной.
Обратите внимание, что понятие степени окисления – очень условно! Степень окисления не показывает реальный заряд атома и не имеет реального физического смысла. Это упрощенная модель, которая эффективно работает, когда нам необходимо, например, уравнять коэффициенты в уравнении химической реакции, или для алгоритмизации классификации веществ.
Степень окисления – это не валентность! Степень окисления и валентность во многих случаях не совпадают. Например, валентность водорода в простом веществе Н2 равна I, а степень окисления, согласно правилу 1, равна 0.
Это базовые правила, которые помогут Вам определить степень окисления атомов в соединениях в большинстве случаев.
В некоторых ситуациях вы можете столкнуться с трудностями при определении степени окисления атома. Рассмотрим некоторые из этих ситуаций, и разберем способы их разрешения:
- В двойных (солеобразных) оксидах степень у атома, как правило, две степени окисления. Например, в железной окалине Fe3O4 у железа две степени окисления: +2 и +3. Какую из них указывать? Обе. Для упрощения можно представить это соединение, как соль: Fe(FeO2)2. При этом кислотный остаток образует атом со степенью окисления +3. Либо двойной оксид можно представить так: FeO*Fe2O3.
- В пероксосоединениях степень окисления атомов кислорода, соединенных ковалентными неполярными связями, как правило, изменяется. Например, в пероксиде водорода Н2О2, и пероксидах щелочных металлов степень окисления кислорода -1, т.к. одна из связей – ковалентная неполярная (Н-О-О-Н). Другой пример – пероксомоносерная кислота (кислота Каро) H2SO5 (см. рис.) содержит в составе два атома кислорода со степенью окисления -1, остальные атомы со степенью окисления -2, поэтому более понятной будет такая запись: H2SO3(O2). Известны также пероксосоединения хрома – например, пероксид хрома (VI) CrO(O2)2 или CrO5, и многие другие.
- Еще один пример соединений с неоднозначной степенью окисления – супероксиды (NaO2) и солеобразные озониды KO3. В этом случае уместнее говорить о молекулярном ионе O2 с зарядом -1 и и O3 с зарядом -1. Строение таких частиц описывается некоторыми моделями, которые в российской учебной программе проходят на первых курсах химических ВУЗов: МО ЛКАО, метод наложения валентных схем и др.
- В органических соединениях понятие степени окисления не очень удобно использовать, т.к. между атомами углерода существует большое число ковалентных неполярных связей. Тем не менее, если нарисовать структурную формулу молекулы, то степень окисления каждого атома также можно определить по типу и количеству атомов, с которыми данный атом непосредственно связан. Например, у первичных атомов углерода в углеводородах степень окисления равна -3, у вторичных -2, у третичных атомов -1, у четвертичных — 0.
Потренируемся определять степень окисления атомов в органических соединениях. Для этого необходимо нарисовать полную структурную формулу атома, и выделить атом углерода с его ближайшим окружением — атомами, с которыми он непосредственно соединен.
Полезные советы:
- Для упрощения расчетов можно использовать таблицу растворимости – там указаны заряды наиболее распространенных ионов. На большинстве российских экзаменов по химии (ЕГЭ, ГИА, ДВИ) использование таблицы растворимости разрешено. Это готовая шпаргалка, которая во многих случаях позволяет значительно сэкономить время.
- При расчете степени окисления элементов в сложных веществах сначала указываем степени окисления элементов, которые мы точно знаем (элементы с постоянной степенью окисления), а степень окисления элементов с переменной степенью окисления обозначаем, как х. Сумма всех зарядов всех частиц равна нулю в молекуле или равна заряду иона в ионе. Из этих данных легко составить и решить уравнение.
Тренировочный тест по теме «Степени окисления и валентность» 10 вопросов, при каждом прохождении новые.
Таблица степени окисления химических элементов
Она принимает как положительные, так и отрицательные значения. Чтобы указать степень окисления элемента в соединении нужно поставить сверху над его символом арабскую цифру с соответствующим знаком («+» или «-»).
Следует помнить, что степень окисления — величина, не имеющая физического смысла, так как не отражает реальный заряд атома. Однако это понятие весьма широко используется в химии.
Максимальную положительную и минимальную отрицательную степень окисления можно определить с помощью Периодической таблицы Д.И. Менделеева. Они равны номеру группы, в которой расположен элемент, и разнице между значением «высшей» степени окисления и числом 8, соответственно.
- Если рассматривать химические соединения более конкретно, то в веществах с неполярными связями степень окисления элементов равна нулю (N2, H2, Cl2).
- Степень окисления металлов в элементарном состоянии равна нулю, так как распределение электронной плотности в них равномерно.
- В простых ионных соединениях степень окисления входящих в них элементов равна электрическому заряду, поскольку при образовании этих соединений происходит практически полный переход электронов от одного атома к другому: Na+1I-1, Mg+2Cl-12, Al+3F-13, Zr+4Br-14.
При определении степени окисления элементов в соединениях с полярными ковалентными связями сравнивают значениях их электроотрицательностей. Поскольку при образовании химической связи электроны смещаются к атомам более электроотрицательных элементов, то последние имеют в соединениях отрицательную степень окисления.
Существуют элементы, для которых характерно только одно значение степени окисления (фтор, металлы IA и IIA групп и т.д.). Фтор, характеризующийся наибольшим значением электроотрицательности, в соединениях всегда имеет постоянную отрицательную степень окисления (-1).
Щелочные и щелочноземельные элементы, для которых свойственно относительно невысокое значение электроотрицательности, всегда имеют положительную степень окисления, равную соответственно (+1) и (+2).
Однако, имеются и такие химические элементы, для которых характерны несколько значений степени окисления (сера – (-2), 0, (+2), (+4), (+6) и др.).
Для того, чтобы легче было запомнить сколько и какие степени окисления характерны для конкретного химического элемента используют таблицы степеней окисления химических элементов, которые выглядят следующим образом:
| Порядковый номер | Русское / англ. название | Химический символ | Степень окисления |
| 1 | Водород / Hydrogen | H | (+1), (-1) |
| 2 | Гелий / Helium | He | 0 |
| 3 | Литий / Lithium | Li | (+1) |
| 4 | Бериллий / Beryllium | Be | (+2) |
| 5 | Бор / Boron | B | (-1), 0, (+1), (+2), (+3) |
| 6 | Углерод / Carbon | C | (-4), (-3), (-2), (-1), 0, (+2), (+4) |
| 7 | Азот / Nitrogen | N | (-3), (-2), (-1), 0, (+1), (+2), (+3), (+4), (+5) |
| 8 | Кислород / Oxygen | O | (-2), (-1), 0, (+1), (+2) |
| 9 | Фтор / Fluorine | F | (-1) |
| 10 | Неон / Neon | Ne | 0 |
| 11 | Натрий / Sodium | Na | (+1) |
| 12 | Магний / Magnesium | Mg | (+2) |
| 13 | Алюминий / Aluminum | Al | (+3) |
| 14 | Кремний / Silicon | Si | (-4), 0, (+2), (+4) |
| 15 | Фосфор / Phosphorus | P | (-3), 0, (+3), (+5) |
| 16 | Сера / Sulfur | S | (-2), 0, (+4), (+6) |
| 17 | Хлор / Chlorine | Cl | (-1), 0, (+1), (+3), (+5), (+7), редко (+2) и (+4) |
| 18 | Аргон / Argon | Ar | 0 |
| 19 | Калий / Potassium | K | (+1) |
| 20 | Кальций / Calcium | Ca | (+2) |
| 21 | Скандий / Scandium | Sc | (+3) |
| 22 | Титан / Titanium | Ti | (+2), (+3), (+4) |
| 23 | Ванадий / Vanadium | V | (+2), (+3), (+4), (+5) |
| 24 | Хром / Chromium | Cr | (+2), (+3), (+6) |
| 25 | Марганец / Manganese | Mn | (+2), (+3), (+4), (+6), (+7) |
| 26 | Железо / Iron | Fe | (+2), (+3), редко (+4) и (+6) |
| 27 | Кобальт / Cobalt | Co | (+2), (+3), редко (+4) |
| 28 | Никель / Nickel | Ni | (+2), редко (+1), (+3) и (+4) |
| 29 | Медь / Copper | Cu | +1, +2, редко (+3) |
| 30 | Цинк / Zinc | Zn | (+2) |
| 31 | Галлий / Gallium | Ga | (+3), редко (+2) |
| 32 | Германий / Germanium | Ge | (-4), (+2), (+4) |
| 33 | Мышьяк / Arsenic | As | (-3), (+3), (+5), редко (+2) |
| 34 | Селен / Selenium | Se | (-2), (+4), (+6), редко (+2) |
| 35 | Бром / Bromine | Br | (-1), (+1), (+5), редко (+3), (+4) |
| 36 | Криптон / Krypton | Kr | |
| 37 | Рубидий / Rubidium | Rb | (+1) |
| 38 | Стронций / Strontium | Sr | (+2) |
| 39 | Иттрий / Yttrium | Y | (+3) |
| 40 | Цирконий / Zirconium | Zr | (+4), редко (+2) и (+3) |
| 41 | Ниобий / Niobium | Nb | (+3), (+5), редко (+2) и (+4) |
| 42 | Молибден / Molybdenum | Mo | (+3), (+6), редко (+2), (+3) и (+5) |
| 43 | Технеций / Technetium | Tc | (+6) |
| 44 | Рутений / Ruthenium | Ru | (+3), (+4), (+8), редко (+2), (+6) и (+7) |
| 45 | Родий / Rhodium | Rh | (+4), редко (+2), (+3) и (+6) |
| 46 | Палладий / Palladium | Pd | (+2), (+4), редко (+6) |
| 47 | Серебро / Silver | Ag | (+1), редко (+2) и (+3) |
| 48 | Кадмий / Cadmium | Cd | (+2), редко (+1) |
| 49 | Индий / Indium | In | (+3), редко (+1) и (+2) |
| 50 | Олово / Tin | Sn | (+2), (+4) |
| 51 | Сурьма / Antimony | Sb | (-3), (+3), (+5), редко (+4) |
| 52 | Теллур / Tellurium | Te | (-2), (+4), (+6), редко (+2) |
| 53 | Иод / Iodine | I | (-1), (+1), (+5), (+7), редко (+3), (+4) |
| 54 | Ксенон / Xenon | Xe | |
| 55 | Цезий / Cesium | Cs | (+1) |
| 56 | Барий / Barium | BA | (+2) |
| 57 | Лантан / Lanthanum | La | (+3) |
| 58 | Церий / Cerium | Ce | (+3), (+4) |
| 59 | Празеодим / Praseodymium | Pr | (+3) |
| 60 | Неодим / Neodymium | Nd | (+3), (+4) |
| 61 | Прометий / Promethium | Pm | (+3) |
| 62 | Самарий / Samarium | Sm | (+3), редко (+2) |
| 63 | Европий / Europium | Eu | (+3), редко (+2) |
| 64 | Гадолиний / Gadolinium | Gd | (+3) |
| 65 | Тербий / Terbium | Tb | (+3), (+4) |
| 66 | Диспрозий / Dysprosium | Dy | (+3) |
| 67 | Гольмий / Holmium | Ho | (+3) |
| 68 | Эрбий / Erbium | Er | (+3) |
| 69 | Тулий / Thulium | Tm | (+3), редко (+2) |
| 70 | Иттербий / Ytterbium | Ib | (+3), редко (+2) |
| 71 | Лютеций / Lutetium | Lu | (+3) |
| 72 | Гафний / Hafnium | Hf | (+4) |
| 73 | Тантал / Tantalum | Ta | (+5), редко (+3), (+4) |
| 74 | Вольфрам / Tungsten | W | (+6), редко (+2), (+3), (+4) и (+5) |
| 75 | Рений / Rhenium | Re | (+2), (+4), (+6), (+7), редко (-1), (+1), (+3), (+5) |
| 76 | Осмий / Osmium | Os | (+3), (+4), (+6), (+8), редко (+2) |
| 77 | Иридий / Iridium | Ir | (+3), (+4), (+6), редко (+1) и (+2) |
| 78 | Платина / Platinum | Pt | (+2), (+4), (+6), редко (+1) и (+3) |
| 79 | Золото / Gold | Au | (+1), (+3), редко (+2) |
| 80 | Ртуть / Mercury | Hg | (+1), (+2) |
| 81 | Талий / Thallium | Tl | (+1), (+3), редко (+2) |
| 82 | Свинец / Lead | Pb | (+2), (+4) |
| 83 | Висмут / Bismuth | Bi | (+3), редко (+3), (+2), (+4) и (+5) |
| 84 | Полоний / Polonium | Po | (+2), (+4), редко (-2) и (+6) |
| 85 | Астат / Astatine | At | — |
| 86 | Радон / Radon | Ra | |
| 87 | Франций / Francium | Fr | — |
| 88 | Радий / Radium | Ra | (+2) |
| 89 | Актиний / Actinium | Ac | (+3) |
| 90 | Торий / Thorium | Th | (+4) |
| 91 | Проактиний / Protactinium | Pa | (+5) |
| 92 | Уран / Uranium | U | (+3), (+4), (+6), редко (+2) и (+5) |
Примеры решения задач
| Понравился сайт? Расскажи друзьям! |
Электроотрицательность. Степень окисления и валентность химических элементов
Электроотрицательность (ЭО) – свойство атомов элементов оттягивать на себя электроны от другого атома в соединении.
На ЭО влияет несколько факторов: радиус атома и расстояние между ядром и валентными электронами. Численные значения ЭО приблизительные. Часто используют шкалу определения ЭО по Полингу.
Относительная электроотрицательность атомов элементов по Полингу
Анализируя данную шкалу можно выявить ряд закономерностей, перекликающихся с периодическим законом (ПЗ).
- В периодической системе химических элементов (ПСХЭ) ЭО в периоде увеличивается слева направо и уменьшается в главной подгруппе.
- ЭО связана с окислительно-восстановительными свойствами элементов, поэтому типичные неметаллы характеризуются высокой ЭО, а металлы – низкой. Самая высокая ЭО у фтора, потому что он самый сильный окислитель.
В зависимости от значения электроотрицательности образуются вещества с различным видом химической связей: если между атомами нет разности в электроотрицательности, образуются простые вещества (состоящие из одного вида атомов), чем больше разность, тем полярность молеклы возрастает: образуются молекулы веществ с полярной связью и ионной связью.
Степень окисления химических элементов и ее вычисление
- Степень окисления(СО) – условный заряд атомов химических элементов в соединении на основании того, что все связи ионные.
- Степень окисления может иметь отрицательное, положительное или нулевое значение, которое обычно помещается над символом элемента в верхней части.
- При определении СО следует руководствоваться следующими правилами:
- Сумма СО в химическом соединении всегда равна нулю, так как молекулы электронейтральны; в сложном ионе соответствует заряду иона.
- СО всех простых веществ соответствует нулю;
- Высшая положительная СО определяется по номеру группы; низшая отрицательная равна восемь минус номер группы;
- Элементы с наибольшей ЭО имеют отрицательную СО, с наименьшей – положительную;
- Постоянную СО имеют фтор (-1), щелочные металлы (+1), щелочноземельные, а также бериллий, магний, цинк (+2), алюминий (+3). У кислорода СО равна -2, исключение пероксиды (+2). У водорода +1, исключение соединения с металлами (гидриды) -1.
Применяя эти правила можно рассчитать степени окисления элементов в сложном веществе.
К примеру, определим степени окисления элементов в фосфорной кислоте H3PO4.
- Найдем и проставим известные степени окисления у водорода и кислорода, а СО фосфора примем за «х». — H+13 PX O-24
- Используя эти значения составим и решим уравнение с одной неизвестной. (+1) * 3 + (x) * 1 + (-2) * 4 = 0 Следовательно, x=5 или +5. Таким образом, СО у фосфора +5.
Рассчитаем степени окисления у элементов в нитрате алюминия Al(NO3)3.
- Проставим известные СО элементов – алюминий и кислород, у азота примем СО за «x». Al+3 (NxO-23)3
- Составим и решим уравнение — (+3) * 1 + 3x + 9 * (-2) = 0. В итоге получаем x=+5, то есть СО у азота в соединении +5.
Валентность. Валентные возможности атомов
Валентность — это способность атома присоединять ряд других атомов для образования химической связи.
Валентность может быть определена числом химических связей, образующих атом, или числом неспаренных электронов.
Валентность обозначается римскими цифрами и указывается над химическим элементом справа вверху и не имеет знака (+ или -). Может быть постоянной или переменной.
Для определения валентности применяются определенные правила:
- У металлов главных подгрупп валентность всегда постоянная и определяется по номеру группы.
- У металлов побочных подгрупп и неметаллов валентность переменная. Высшая валентность = номеру группы, а низшая = 8 — номер группы.
Валентность может совпадать со степенью окисления, но не имеет знака «+» или «-», не может быть равна нулю.
Валентные возможности атомов могут определяться:
- Количеством неспаренных электронов;
- Наличием свободных орбиталей;
- Наличием неподеленных пар электронов.
Валентные возможности водорода
Валентные возможности водорода определяются одним неспаренным электроном на единственной орбитали. Водород обладает слабой способностью отдавать или принимать электроны, поэтому для него характерны в основном ковалентные химические связи. Ионные связи он может создавать с металлами, образуя гидриды. Ковалентные химические связи образуются за счет общих электронных пар. Поскольку у водорода всего один электрон, он способен образовывать только одну связь. По этой причине для него характерна валентность равная I.
Валентные возможности углерода
На внешнем энергетическом уровне у углерода 4 электрона: 2 спаренных и 2 неспаренных. Это состояние атома называется основным. По числу неспаренных электронов можно сказать, что углерод проявляет валентность равную II. Однако такая валентность проявляется только в некоторых соединениях.
В органических соединениях и некоторых органических веществах углерод проявляет валентность равную IV. Эта валентность характерна для возбужденного состояния С. Из основного в возбужденное состояние он может переходить при получении дополнительной энергии. Один электрон с s-подуровня переходит на p-подуровень, где есть свободная орбиталь.
Атом С способен присоединять и отдавать электроны с образованием ковалентных связей. Валентные возможности углерода очень широкие, он может принимать значение степени окисления от +4 до -4.
Валентные возможности азота
У азота на валентном энергетическом уровне находится 5электронов: 3 неспаренных и 2 спаренных. Исходя из этого, валентность азота может быть равна III. В возбужденное состоянии атом азота не может переходить. Однако азот может выступать в качестве донора при образовании ковалентных химических связей, обеспечивая своей электронной паре атом, имеющий свободную орбиталь. В этом случае валентность у азота будет равна IV, причем для азота, как элемента пятой группы, это максимальная валентность. Валентность V он проявлять не способен.
Валентные возможности фосфора
В отличие от азота, фосфор имеет свободные 3d-орбитали, на которые могут переходить электроны. На внешнем энергетическом уровне находятся 3 неспаренных электрона.
Атом фосфора способен переходить из основного состояния в возбужденное. Электроны с p-подуровня переходят на d-подуровень. В этом случае атом Р приобретает валентность, равную V.
Таким образом, строение электронной оболочки атома увеличивает валентные возможности Р, по сравнению с азотом, от I до V.
Валентные возможности кислорода
На последнем энергетическом уровне у кислорода 2 неспаренных электрона. В соединениях чаще всего проявляет валентность II. У кислорода нет d-подуровня, поэтому переход электронов невозможен. Валентные возможности очень ограничены – проявляет II и III валентности.
Валентные возможности серы
Сера, так же, как и кислород, р в VI группе главной подгруппе ПСХЭ. Поэтому на валентном энергетическом уровне у серы 2 неспаренных электрона. Напрашивается вывод, что валентность серы равна II.
Однако у серы есть и d-подуровень, который расширяет ее валентные возможности. Сера способна переходить из основного состояния в возбужденное, при этом может быть либо 4 неспаренных электрона, либо 6.
- Таким образом, сера способна проявлять валентности II, IV, VI.
- Опираясь на этот материал, можно определить все возможные валентности для любого химического элемента.
- Смотри также: