

 А Б В Г Д Е Ж З И К Л М Н О П Р С Т У Ф Х Ц Ч Ш Щ Э Ю Я
А Б В Г Д Е Ж З И К Л М Н О П Р С Т У Ф Х Ц Ч Ш Щ Э Ю Я
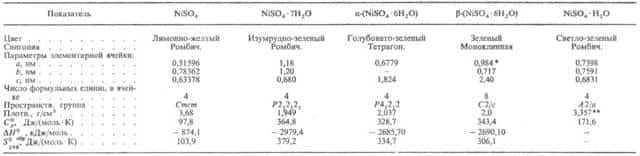
Никеля сульфат NiSO4, кристаллы (см. табл.); выше 700 °С разлагается с образованием NiO и SO3, давление диссоциации 7,5 кПа (760 °С); гигроскопичен; р-римость (г в 100 г): в воде-21,4 (0°С), 29,94 (30°С), 33,39 (50°С), 43,42 (99°С); в метаноле-0,001 (15°С); в этаноле-0,017 (15°С). Образует гидраты, важнейший из них-н и к е л е в ы й к уп о р о с NiSO4- 7Н2О, кристаллизующийся из водных р-ров в интервале от -3,4 до 31,5°С; т. пл. 31,5°С (инконгруэнтно); показатели преломления: больший Ng= 1,4925, средний Nm = 1,4893, меньший Np = 1,4693; р-римость в воде 101 г в 100 г (20 °С); раств. в этаноле. Из водных р-ров при 31,5-53,6 °С кристаллизуется a-форма гексагидрата NiSO4.6H2O, а при 53,6-84,8 °С-его b-форма. Выше 84,8 °С устойчив моногидрат NiSO4.H2O, к-рый обезвоживается при 280 °С. Гидраты с 2, 3, 4 и 5 молекулами воды метастабильны, кристаллизуются из водных р-ров при 90-98°С.
- СВОЙСТВА NiSO4 И ЕГО ГИДРАТОВ
-
- * Значения параметров даны для минерала; b = 97,5°.
- ** Рентгеновская плотность.
Никеля сульфат образует двойные соли M2Ni(SO4)2•6Н2О, где М-К, Rb, Cs, NH4, аммиакаты NiSO4.6NH3, NiSO4.4NH3.2H2O и др.
Никелевый купорос получают взаимод. Ni, NiO, Ni(OH)2 или гидроксокарбоната Ni с H2SO4, растворением Ni в разб. H2SO4, содержащей немного HNO3, с послед. нейтрализацией гидроксокарбонатом Ni и упариванием. Гептагидрат получают также из сульфатных р-ров кобальтового про-из-ва и из р-ров при рафинировании Сu.
Никеля сульфат встречается в природе: минералы моренозит NiSO4•7Н2О, ретгерсит a-(NiSO4•6Н2О), никельгексагидрит b-(NiSO4.6H2O).
Никелевый купорос, а также смесь гепта- и гексагидратов (пром. продукт) используют для получения чистого электро-литич. Ni, др. соед.
Ni и никелесодержащих катализаторов; никелевый купорос, а также MINi(SO4)2 (где М-К, NH4)-компоненты электролитов в гальванотехнике для нанесения покрытий на металлы; никелевый купорос применяют также как фунгицид.
ПДК в атм. воздухе 0,002 мг/м3 (максимальная разовая), 0,001 мг/м3 (среднесуточная). 1 мг/м3.
Лит.: Позин М. Е., Технология минеральных солей, 4 изд., ч. 1, Л., 1974, с. 731-37. И. Н. Один.
А Б В Г Д Е Ж З И К Л М Н О П Р С Т У Ф Х Ц Ч Ш Щ Э Ю Я
Никель (II) сернокислый — нужный для промышленности реактив
- Получают безводный реактив несколькими методами: • воздействием серной кислоты H2SO4 на металлический никель;• в качестве побочного продукта производства кобальта;• из электролитов, применяющихся при очистке меди.
Встречается в естественном виде как минерал моренозит.
 |
|
| Никель сернокислый «хч», «ч» | Никель сернокислый 7-водный ч |
Свойства
Чистый сернокислый никель — это мелкокристаллическое, очень гигроскопичное вещество бледно-желтого цвета. Водорастворим, растворим в спиртах, легко поглощает влагу из воздуха и переходит в состояние кристаллогидрата с разным количеством молекул кристаллизационной воды. Практическое применение нашли гептагидрат NiSO4•7H2O и гексагидрат NiSO4•6H2O никеля.
При нагревании безводный реактив разлагается на оксид никеля NiO и трехокись серы SО3. Вступает в реакции с концентрированными и неконцентрированными гидроксидами. Легко взаимодействует с соляной кислотой, с другими кислотами и сильными окислителями почти не реагирует. Образует двойные соли вида M(NiSО4)2•6H2O. Связываеся с белками крови. Высокотоксичен.
Не горит, не взрывается.
Никелиевый купорос — это кристаллогидрат с формулой NiSO4•7H2O, ярко-зеленые водорастворимые кристаллы. В процессе нагревания кристаллизационная вода теряется и сульфат становится безводным.
Кристаллогидрат сернокислого никеля с 6-ю молекулами кристаллизационной воды — растворимый в воде и спиртах кристаллический порошок бирюзового цвета. При хранении на воздухе постепенно обезвоживается.
Меры предосторожности
Реактив относится ко 2-му классу опасности (опасные вещества). Способствует развитию онкологических заболеваний, негативно влияет на наследственные изменения. При контакте оказывает раздражающее воздействие на кожу, слизистые органов дыхания и глаз, вызывает аллергические реакции и гиперчувствительность к никелю.
Процесс растворения никелиевого купороса в воде может сопровождаться образованием аэрозоля, относящегося к 1-му классу опасности.
На предприятиях, имеющих дело с сульфатом никеля и его кристаллогидратами, следует проводить постоянный мониторинг их содержания в воздухе. Работников необходимо обеспечить защитной одеждой, средствами защиты лица, органов дыхания, рук. Помещение должно быть оснащено принудительной вентиляцией, оборудование следует загерметизировать.
Хранят и перевозят реактивы в герметично закрытых бумажных или полиэтиленовых мешках. Хранят на сухих складах, защищенных от сырости.
Применение
• В сельском хозяйстве — входит в состав фунгицидов.
Химические свойства элементов:никель
Ключевые слова: никель, получение никеля, применение никеля, соединения никеля, оксиды никеля, гидроксиды никеля, сульфиды никеля, сульфаты никеля, нитраты никеля, фосфаты никеля, токсическое действие никеля и его неорганических соединений.
По распространенности в природе никель превосходит медь и несколько уступает цинку. В земной коре содержится 2∙10-2% (вес.) никеля, в литосфере 8∙10-3%, метеоритах каменных 0,14% и железных 8,6% . Ряд ученых предполагает, что ядро Земли на 6—8% состоит из никеля. Никель содержится в метеоритах. Среднее содержание никеля в растениях составляет 10-6 %.
Никель — металл серебристо-белого цвета с едва заметным коричневатым оттенком, очень тягучий, ковкий, легко поддается прокатке, ферромагнитен, но в меньшей степени, чем железо. Плотность никеля 8,85—8,9 г/см3. Никель высокой чистоты (99,94%) имеет т. пл. 1455°С.
Промышленное значение имеют сульфидные, силикатные или окисленные руды никеля.Встречается в природе в виде соединений с S, As, Sb. При шахтной плавке с дымовыми газами выбрасывается в атмосферу 2% шихты в виде пыли.
Применяется как легирующий компонент многих сортов стали и специальных сплавов; как катализатор при гидрогенизации, конверсии метана водяным паром и др.; в производстве щелочных аккумуляторов; в гальванотехнике; в химическом машиностроении.
Получается обжигом обогащенного никелевого концентрата и последующим восстановлением до Ni; особо чистый Ni получается разложением карбонилов никеля..
Металлический никель при комнатной температуре в отсутствие влаги устойчив к действию кислорода и галоидов; при нагревании до 500° С слегка окисляется на воздухе и разлагает воду, выделяя водород. Порошкообразный никель, полученный дистилляцией из амальгам или электролизом, слабо пирофорен.
Никель—малоактивный металл; при комнатной температуре вода на него не действует. В разбавленных минеральных кислотах (НС1,H2SО4)растворяется медленно, легче растворим в азотной кислоте. Кон-центрированная азотная кислота пассивирует металл, как и железо. Щелочи, сода, поташ в водных растворах и в расплавах не действуют на никель.
Никель входит в состав разнообразных сплавов с железом, а также медью, алюминием и многими другими элементами.Металлический никель в мелкораздробленном состоянии при повышении температуры поглощает водород, применяется как катализатор при гидрировании органических соединений.
Для никеля установлено существование гидрида NiH , известны также гидриды состава NiH2, NiH4.Никель способен взаимодействовать с монооксидом углерода, образуя карбонилы.
Химические соединения никеля
Оксид никеля (II), NiO — порошок светлого зеленовато-желтого цвета, растворимый в азотной кислоте при нагревании и в растворе аммиака. После прокаливания при высокой температуре оксид никеля NiO не растворяется в щелочах (аммиаке) и минеральных кислотах. Оксид никеля NiO удовлетворяет требованиям к весовым формам.
Применяется в аналитической химии .Получается, например, при прокаливании диметилглиоксимата никеля. Применяется в качестве пигмента в керамической и стекольной промышленности; для приготовления катализаторов.
Лабораторным способом получения является прокаливание гидроксида никеля Ni(OH)2, карбоната никеля NiCО3 или нитрата никеля Ni(NО3)2.
Оксид никеля (III) и закись-окись никеля (II и III), Ni3О4 — порошкообразные вещества темно-серого и черно-коричневого цвета (соответственно); растворяются в серной и азотной кислотах с выделением кислорода и в соляной кислоте с выделением хлора. Получается прокаливанием карбоната никеля; обжигом никелевых руд. Представляет собой серо-черный порошок. При 600° разлагается, не плавясь
Диоксид никеля NiО2 — аморфное вещество черного цвета. Это наименее прочное кислородное соединение никеля. С трудом растворяется в минеральных кислотах, выделяя кислород или хлор.
Ион никеля образует с гидроксил-ионом в зависимости от условий ряд соединений различного состава, проявляя склонность к образованию основных солей .
Гидроксид никеля (II), Ni(OH)2—порошок светло-зеленого цвета или аморфные кристаллы, при температуре 230° С разлагается на NiO и Н2О. Растворим в кислотах и NH4OH.
Получается при действии растворов щелочей на соли Ni(II). Применяется в производстве щелочных аккумуляторов.
Гидроксид никеля (II) в присутствии сильных окислителей (С12, Вг2) в щелочной среде переходит в гидроксид никеля (III), Ni(OH)3.
Гидроксид никеля (III) существует в двух модификациях: α-модификация — черный аморфный порошок, плотн. 4,15; Разлагается при нагревании; реагирует с кислотами. β-модификация не имеет явно кристаллической структуры, на воздухе переходит в соединение Ni3O2(OH)4.
Гидроксиды никеля получаются косвенным путем: Ni(OH)3 — действием разбавленных растворов щелочей на соли никеля (обладает основными свойствами); гидроксиды никеля (III) и (II, III) образуются при действии окислителей в щелочной среде. Ni(OH)3 может быть получен действием перекиси водорода в слабо уксуснокислой среде на соли никеля.
Последний способ часто применяется в качественном анализе для обнаружения и отделения никеля.
Сульфиды никеля Метод отделения никеля в виде сульфида широко используется в химическом анализе. Известны три модификации сульфида никеля NiS, имеющие различную растворимость в водных растворах и кислотах .Встречаются в природе в виде минералов миллерита NiS, полидимита Ni3S и ваэсита NiS2; в файнштейне — промежуточном, продукте — присутствуют Ni3S2 и Ni6Se.
Получаются: NiS — нагреванием NiO с S либо действием H2S и (NH4)2S на растворы солей Ni(II); Ni2S— нагреванием смеси NiSО4 с S в токе Hg либо восстановлением NiSО4 углеродом в электропечи; Ni3S4— нагреванием NiCl2 с полисульфидом калия в запаянной трубке;
Сульфид никеля по внешнему виду, будучи выделенным и высушенным, независимо от модификации представляет черный порошок. NiS во влажном состоянии на воздухе переходит в NiOHS. Сульфид NiS легко образует коллоидные растворы (золи), в форме которых проходит через фильтр; это соединение трудно коагулирует.
Никель в виде сульфида часто отделяют (обычно совместно с кобальтом) от других элементов, поэтому важно соблюдать условия для образования легкоотфильтровываемого осадка сульфида никеля NiS.
Осаждением свежеприготовленным раствором сульфида аммония (не содержащим карбоната аммония) также получают сульфид никеля хорошего качества. Сульфиды никеля и кобальта в кристаллическом состоянии получаются при действии сероводорода в присутствии пиридина.
Применяются как катализаторы при гидрогенизации и дегидрогенизации.
Сульфат никеля Применяется в производстве аккумуляторов; в фунгицидных смесях; для изготовления катализаторов, в жировой и парфюмерной промышленности.
Получается растворением Ni в H2SО4; из растворов электролитов рафинирования меди; из сульфатных растворов — отходов производства Кобальта. NiSО4 — желтые кристаллы; плотн. 3,68; при 840° разлагается, теряя SО3; раств. в воде 38,3 г/100 г (20°).
Легко образует двойные соли типа Me(NiSО4)2-6H2О; NiSО4-7H2О — зеленые кристаллы;
Нитрат никеля в зависимости от температуры образует несколько гигроскопичных кристаллогидратов: Ni(NО3)2∙9H2О, Ni(NО3)2∙6H2O, Ni(NО3)2∙3H2О. Нитраты никеля применяются для получения других соединенйй Ni, никелевых катализаторов. Получаются при растворении Ni в HNO3.
Фосфаты никеля. Фосфат-ионы образуют с солями никеля аморфный осадок яблочно-зеленого цвета переменного состава; осадок растворим в минеральных кислотах, а также в уксусной кислоте и NH4OH. Известны ортофосфат никеля Ni(PО4)2∙8H2О, аммоний-никельфосфат NH4NiPО4∙2H2О, натрий- триникельфосфат Na3NiP3O10∙12Н2О и другие.
Токсическое действие никеля и его неорганических соединений. Общий характер действия. Ni активирует или угнетает ряд ферментов, влияет на дефосфорилирование аминотрифосфата. В крови человека Ni связывается преимущественно с γ-глобулином сыворотки.
Оказывает влияние на кроветворение, углеводный обмен. Металлический Ni и его соединения вызывают образование опухолей у животных, а также профессиональный рак. Канцерогенное действие Ni связывают с нарушением метаболизма клеток.
Соли Ni вызывают поражение кожи человека с развитием повышенной чувствительности к металлу.
- Гидроксиды никеля
- Никель: сплавы никеля, жаропрочные, магнитные, сплавы с особыми свойствами.
- Никель-кадмиевые аккумуляторы.
- Нитрат никеля Ni(NO3)2∙6H2O, никель азотнокислый.
- Оксиды никеля: оксид никеля (II) и оксид никеля(III).
- Сульфат никеля NiSO4∙ 7H2O никель сернокислый.
- Карбонат никеля NiCO3, никель углекислый основной.
- Хлорид никеля NiCl2 , никель хлористый.
Сульфат никеля
Технология минеральных солей (удоБрений, пестицидов, промышленных солей, окислов и кислот)
ФИЗИКО-ХИМИЧЕСКИЕ СВОЙСТВА
Никель образует два основных окисла: закись никеля NiO и окись никеля №гб3 и соответствующие им гидроокиси. Гидрат закиси никеля Ni(OH)2 образуется в виде светло-зеленого осадка при действии щелочей на растворы солей двухвалентного никеля. При нагревании теряет воду и переходит в закись никеля серо-зеленого цвета.
Степень гидратации является важным свойством гидрата закиси никеля, особенно в связи с применением его для изготовления анодной массы щелочных аккумуляторов — степенью гидратации определяется структура и электрохимические свойства анодной массы. Вода в гидрате имеет две формы связи — молекулярную и гидроксильную.
По мере обезвоживания возрастает удельная поверхность и пористость гидрата1. Гидрат окиси никеля Ni(OH)3, имеющий черно-бурый цвет, образуется при окислении Ni(OH)2.
В водных аммиачных растворах растворимость Ni(OH)2 при 20° равна 2,35 г/л Ni при концентрации 36,4 г/л NH3 и 14,5 г/л Ni при 193 г/л NH3 2.
При взаимодействии 0,2 н. раствора №С12 с 2 н. щелочными смесями, содержащими NaOH и менее 50% Na2C03, образуются суспензии гидрата закиси никеля, характеризующиеся интенсивным уменьшением рН раствора (на 1 —1,8 за 24 ч).
Старение осадка сопровождается уменьшением количества щелочи в растворе и превращением карбоната в бикарбонат за счет обмена ионов ОН» Раствора на ионы С03~> адсорбированные осадком3. О старении основных карбонатов никеля см.
4~7.
Основной карбонат никеля является промежуточным продуктом при аммиачном выщелачивании никелевых руд. Предварительно РУДЫ подвергают восстановительному обжигу.
Выщелачивание производят водным раствором аммиака, содержащим карбонат аммония, в присутствии кислорода.
После выщелачивания из раствора отгоняют аммиак, в результате чего осаждается основной карбонат никеля, который подвергают обжигу8.
С окисью углерода никель образует жидкое летучее соединение— тетракарбонил никеля Ni(CO)4, которое при нагревании разлагается с выделением металлического никеля. На этом основан один из способов извлечения никеля из некоторых продуктов первичной переработки руд, в которых основная масса никеля находится уже в виде металла.
Сульфат никеля NiS04 кристаллизуется из водных растворов при температурах от —3,15 до 31,5° в виде NiS04-7H20— никелевого купороса, кристаллы которого имеют форму ромбических призм изумрудно-зеленого цвета.
При выветривании купороса на воздухе, а также при кристаллизации из водных растворов при температуре от 31,5 до 53,6° образуется a-NiS04-6H20 синеватого цвета; в интервале 53,6—99° кристаллизуется |3-NiS04-6H20 зеленого цвета.
При более высоких температурах образуются метаста — бильные кристаллогидраты с меньшим числом молекул воды (от 5 до 2) и стабильный NiS04-H20 с точно не установленными температурами превращения вследствие затруднений, обусловленных образованием сильно пересыщенных растворов.
Выше 280° сульфат никеля обезвоживается. NiS04 устойчив до 800°, а выше этой температуры разлагается с выделением SO39. Насыщенный водный раствор содержит при 0° — 21,4%, при 99° —43,4 NiS04.
Обычно при кристаллизации охлаждением насыщенного раствора вначале выделяется шестиводный сульфат никеля, а затем образуется некоторое количество семиводного.
Соотношение между ними зависит от температуры начала и конца кристаллизации, а также от скорости перехода одной формы сульфата в другую.
При Быстрой кристаллизации из концентрированных растворов получается продукт приблизительного состава NiSO^ • 6,2Н20, при мед» ленной кристаллизации — NiS04 • 6,5НгО 10.
При взаимодействии растворов сульфата никеля и едкой щелочи выделяются осадки осноеных сульфатов никеля, состав которых зависит от концентрации растворов. При добавлении 0,1 н.
раствора NaOH к растворам NiS04 с концентрацией, меньшей 0,1 М, образуется осадок гидрата закиси никеля; в интервале концентраций А, 1—М NiS04 осаждается 3NiS04-4Ni(0H)2, а при еше больших концентрациях NiS04 вначале выделяется 3NiS04 • »2Ni(OH)2, постепенно переходящий в 3NiS04 • 4Ni (ОН) 2 п — По другим данным12, при приливании раствора NaOH к раствору NiS04 образуется осадок NiS04-4Ni(0H)2, а при обратном порядке сливания растворов — NiS04 • 5Ni (ОН)2. Четырехосновной сульфат никеля неустойчив в воде и растворах NaOH и переходит В Nl(OH)2.
В системе NiS04—H2S04—Н20 существуют13 комплексные ионы [Ni(S04)2]2~. Никельаммонийсульфат Ni(NH4)2(S04)2, образуется при подкислеиии серной кислотой аммиачного раствора сульфата никеля от рН = 7,1 8 до рН ж 4 при 55—60°.
В присутствии в растворе также кобальта при снижении рН до 6,2 выделяется почти весь никель (практически свободный от кобальта) в виде Ni(NH4)2(S04)2.
При снижении рН оставшегося раствора до 4 выделяется остальной никель и почти весь кобальт в виде Ni(NH4)2(S04H и CO(NH4)2(SC>4)214..
В системе NiS04—C0SO4—Н20 образуются смешанные кристаллы; при 20° в ряду смешанных кристаллов имеется разрыв 15.
В системе NiS04—Na2S04 образуются твердые растворы в ши —
OKoft области со стороны сульфата натрия и три двойные соли: Na2S04 • NiS04, Na2S04 • NiS04 и Na2S04 • 3NiS04. Имеются две эвтектики: при 41% NiS04 — 671° и при 55% NiS04 — 700°|6.
ПРИМЕНЕНИЕ
Никелевый купорос применяют главным образом в гальванотехнике при никелировании металлов, для изготовления аккумуляторов, для производства твердых сплавов, в жировой и парфюмерной промышленности, для изготовления катализаторов и пр. В смеси с другими препаратами его используют в качестве фунгицида 17.
Технический никель сернокислый выпускают трех марок: НС-0 для производства реактивов, НС-1 с Государственным знаком качества и НС-1 для никелирования, аккумуляторной, жировой и парфюмерной промышленности. Согласно ГОСТ 2665—73, сульфат никеля должен содержать не менее 20,6% никеля вместе с кобальтом, а при отсутствии последнего не менее 20,3% никеля. Допустимые количества примесей указаны в табл. 48.
ТАБЛИЦА 48
Максимально допустимые количества примесей в техническом сульфате никеля, %
|
| В сульфате никеля марки НС-0 содержание Са, Mg, Na и К в сумме не должно превышать 0,3%; в продукте для аккумуляторной промышленности должно быть меньше 0,02% магния, а для никелирования— меньше 0,004% цинка. |
ПОЛУЧЕНИЕ НИКЕЛЕВОГО КУПОРОСА РАСТВОРЕНИЕМ НИКЕЛЯ В СЕРНОЙ КИСЛОТЕ
Небольшие количества технического сульфата никеля изготовляют растворением металлического никеля в серной кислоте, к которой добавлено немного азотной кислоты.
На 1 кг металлического никеля берут 5 кг 33—35%-ной серной кислоты и 120—150 г азотной кислоты (100%). Реакция идет при нагревании паром до 60°.
Полученный раствор сульфата никеля, отделенный от нерастворив — шегося остатка, в случае необходимости подвергают очистке от примесей железа и меди.
Медь может быть вытеснена из раствора порошком металлического никеля, а железо после этого выделяется в виде гидрата окиси действием черного гидрата никеля (смесь гидратов 2, 3 и 4-валентного никеля) или зеленого гидрата никеля (основной карбонат никеля) в присутствии кислорода воздуха. Полученный раствор сульфата никеля подвергают кристаллизации обычными способами.
Примеси железа и меди могут быть отделены от раствора NiS04 ступенчатым осаждением гидроокисей аммиаком с отделением осадка гидроокиси железа при рН = 3 и гидроокиси меди при рН = 4,5.
Осаждение гидроокисей облегчается при введении перед каждой ступенью нейтрализации затравки соответствующей гидроокиси 18.
Разработан метод очистки раствора NiS04 от примесей железа и меди противоточной экстракцией; экстрагентом является Ni-мыло 19.
Очистка раствора NiS04 от ионов цинка может быть осуществлена анионообменным методом с применением смолы — вофатита MD. Предварительно ее обрабатывают сероводородом для насыщения ионами S2″; при обработке под давлением 19 ат концентрация серы достигает 0,58 г на 100 мл смолы. В результате ионного обмена при рН = 3,2 протекает реакция:
S-вофатит + Zn2++ SO^~ = ZnS+ SC^~ + вофатит
При этом 80—90% выделяющегося сульфида цинка задерживается в свободном объеме ионообменной колонны, равном 60— 70% от объема смолы. Остальное количество ZnS улавливается неполярным фильтром — вофатитом F20.
Ионообменные смолы могут быть также использованы для очистки раствора NiS04, полученного из отработанных катализаторов. Предварительно смолу обрабатывают щелочью.
При пропускании через такую смолу кислого водного раствора, содержащего ионы Fe3+ и Ni2+, в результате ионного обмена рН раствора повышается до 3—5 и из раствора выделяется только железо. Наиболее эффективно Fe3+ отделяется при рН = 4,5.
Такая величина рН достигается при обработке щелочных смол растворомNH4CI21,
Очистка растворов NiS04 при помощи ионообменных смол является, по-видимому, наиболее эффективной.
При производстве удобрений, красителей, взрывчатых веществ требуется такой компонент, как кислота азотная. Вещество также используется в современной металлургии, при синтезе серной кислоты. Если вы ищете, где продается азотная кислота в …
Родентициды это средства защиты от грызунов. Их применяют для уничтожения крыс, мышей и некоторых видов диких хомяков. Применять их в качестве уничтожителя начинают в том случае, если грызуны становятся стихийным …
При взаимодействии хлорита натрия с хлором происходит образование хлористого натрия и выделяется двуокись хлора: 2NaC102 + С12 = 2NaCl + 2 СЮ2 Этот способ ранее был основным для получения двуокиси …
ПОИСК
Опыт 8. Получение аммиаката никеля (II). К раствору сульфата никеля прилейте избыток аммиачной воды. Объясните наблюдаемое. [c.63]
Изучена кинетика гетерогенного разложения гидроперекиси кумола на сульфате никеля [348] и ионообменной смоле КУ-2 [c.302]
В качестве анода используют фольговые оксидно-никелевые электроды щелочных аккумуляторов либо аноды из устойчивых в щелочной среде материалов, например графита.
Нели при электрохимическом синтезе карбоновых кислот в щелочной электролит ввести сульфат никеля, то в процессе электролиза на поверхности таких анодов осаждается слой гидроксидов никеля, которые окисляют спирт наряду с гидроксидами, находящимися в объеме раствора. [c.208]
При электролизе водного раствора сульфата никеля(П) иа алоде протекает процесс 2Н20 = 20а-Ь -j-411++ 4 . Из какого материала сделан апод [c.195]
При получении гидрата закиси используют растворы, содержащие 15—20% N 504 и 26—29% МаОН. Осаждение проводят в цилиндрическом реакторе из нержавеющей стали, снабженном механической мешалкой.
Раствор сульфата никеля прибавляют при перемешивании к щелочи через трубу с большим числом отверстий. При этом поддерживают температуру 40—50 °С. После окончания осаждения в растворе должен оставаться избыток щелочи (6— 9%).
[c.94]
Катализатор получают смещением измельченных порошков сульфата никеля и окиси алюминия (в соотношении 1 1) с последующим формированием, прокаливанием и восстановлением в течение 10 ч в токе На при температуре 600° С.
Катализатор достаточно активен, хотя и не содержит таких промотирующих добавок как Си, Сг, Со, Мп. Он не приводит к образованию кокса в условиях реакции. На обычном никелевом катализаторе наблюдается закоксовывание [c.
169]
Окись кремния и сульфаты металлов, содержащиеся в катализаторе, снижают его активность.
Катализаторы конверсии отравляются под действием сернистых соединений, в частности сероводорода [223, 224], в связи с превращением никеля в соответствующие неактивные соединения — сульфаты и сульфиды никеля.
На свойства катализаторов существенно влияют качество применяемого сырья и условия их приготовления. Сырьем для производства катализаторов являются глинозем, соли алюминия (сульфат), никеля (сульфат, нитрат), магния, кальция и др. [c.88]
В атмосфере. В промышленной атмосфере образуется пленка, не обладающая защитными свойствами, которая состоит из основного сульфата никеля (потускнение металла). Потускнение сводится к минимуму, если электролитически нанести на поверхность тонкий слой хрома. Никель обладает высокой стойкостью к окислению на воздухе при повышенных температурах. [c.360]
Стандартный электродный потенциал никелевого электрода при 298 К равен —0,25 В. Как будет заряжена (положительно или отрицательно) поверхность металлического никеля, если его опустить в раствор сульфата никеля [c.63]
Процессы, протекающие на катоде называются катодным восстановлением, а на аноде — анодным окислением. Например, при электролизе водного раствора сульфата никеля катодное восстановление проходит по реакции [c.150]
Применение некоторых катализаторов значительно ускоряет процесс сернокислотной гидратации. Для этой цели используются соли железа, кобальта, никеля, меди, платины, серебра [41, 42], а также соединения висмута [43, 44]. Сульфат серебра [45, 46] и соли меди [47—49] сильно ускоряют гидролиз сложных эфиров серной кпслоты.
Рекомендуется применять в качестве катализаторов галогениды бора пли бораты в соединении с сульфатами никеля и других тяжелых металлов [50]. Необходимые для этого реакционные условия определены Поповым [51]. При высоком давлении и высокой температуре каталитическое действие проявляют сульфаты органических оснований, например изопроииламина, анилина, наф-ти.
талшна, хинолнна [52], а также сульфаты и галогениды цинка, магния, бериллия [53] и алюминия [54]. Соли алюминия обладают каталитическим действием при высоком давлении и низких температурах в водном растворе.
Наконец, следует упомянуть еще кремневую или борвольфрамовую кислоту и их соли [55], однако процессы с их участием протекают прн 200—300 °С под давлением уже, в газообразной фа.зе. [c.60]
Электропроводность раствора электролитического рафинирования меди зависит от содержания сульфата меди, свободной серной кислоты, присутствия сульфатов никеля, цинка, железа и температуры. [c.181]
Раствор, направляемый на очистку, перерабатывается двумя способами. Первый способ заключается в утилизации меди и кислоты, содержащихся в растворе, и извлечении сульфата никеля, второй —8 выделении электролизом меди и электроположительных примесей и затем кристаллизации сульфата никеля. [c.187]
Кроме того, при большом количестве анодного шлама и высокой плотности тока на катодах возникает массовое образование шишек, что понижает качество катодов.
Высокая плотность тока ограничивается также содержанием сульфата никеля, мышьяка и сурьмы в растворе.
При рафинировании анодов, содержащих выше 0,2% Ag и 0,01 % Аи, рекомендуется снижать плотность тока во избежание больших, потерь вследствие перехода в катод драгоценных металлов. [c.199]
Материальный баланс электролитического аффинажа сплавов своеобразен. Например, при переработке сплава с 80% Си и 20% N1 на 1 т катодной меди получается в качестве побочного продукта 1 т семиводного сульфата никеля. Процесс электролиза основан на непрерывной регенерации раствора с периодическим отбором части его на выделение сульфата (см. [c.214]
Приготовление гидратов окиси никеля сводится к действию щелочного раствора гипохлорита на сульфат никеля [c.377]
Опыт 8. Получить анодную поляризационную кривую на никелевом электроде в электролите № 1, а также в растворе сульфата никеля и борной кислоты (концентрации такие же, как в электролите № 1). [c.44]
В какой последовательностн будут выделяться металлы при электролизе раствора, содержащего в одинаковой концентрации сульфаты никеля, серебра, меди [c.194]
Сульфат никеля(П), х. ч., стандартный раствор, содержащий 0,01 мг1мл никеля. Навеску сульфата никеля(И), соответствующую 0,1 г никеля, помещают в мерную колбу емкостью 1 л, растворяют в воде, подкисляют 2 мл концентрированной серной кислоты, доводят объем водой до I л и тщательно перемешивают перед употреблением разбавляют его в 10 раз и получают раствор с содержанием 0,01 мг/мл никеля(II). [c.493]
Весьма удовлетворительный катализатор никель на кизельгуре готовят осаждением (при перемешивании) основного карбоната никеля из моля сульфата никеля (в 0,1 молярном растворе) в присутствии кизельгура (например. Filter el) действием 1,7 моля карбоната натрия (горячий концентрированный раствор).
Осадок отмывают от сульфата, сушат, разлагают карбонат и окончательно восстанавливают в токе водорода. Оптимальная температура восстановления 425°. Восстановленный катализатор содержит около 65% никеля и 35% кизельгура.
Для парофазной гидрогенизации высушенный осадок (перед декарбонизацией — восста- новлением) смешивается с 4% смазывающего вещества (например, порошкообразный графит) и приготовляется в виде таблеток.
После восстано-влёния эти таблетки готовы для использования в нарофазной гидрогенизации или Hie они могут быть измельчены в ступке вместе с несколькими кусочками сухого льда (для создания инертной среды) для использования в жидкофазной гидрогенизации. [c.266]
С то же целью производят осернение катализатора. Не исключено, по нашему мнению, что одна из функций вводимых в катализатор добавок (окислов щелочных, щелочноземельных металлов и др ) состоит в ограничении активности катализатора.
Смысл такого ограничения становится понятным, если принять во внимание, что на чрезмерно активном катализаторе должны интенсивно протекать побочные реакции углеобразования.
В пользу высказанного предположения о роли добавок указывает возможность создания незауглероживающегося (в условиях процесса конверсии бензина) никель-алюминиевого катализатора, в составе которого полностью отсутствуют те добавки, которые обычно используются для подавления углеобразования (см. табл. 30, № 21).
Подавление избыточной активности в данном случае, возможно, достигается за сче серы, которую вводят в катализатор с применяемым в качестве сырья сульфатом никеля и полностью не удаляют в процессе изготовления катализатора. [c.49]
Опыт 4. Получение аквоаммино- и амминокомплексов никеля (П). Влияние природы лигандов на окраску комплексов никеля (II). К раствору сульфата никеля (II) по каплям прибавляйте концентрированный раствор аммиака.
Объясните постепенное изменение ок раски раствора при прибавлении аммиака. Часть раствора сохраните для последующего опыта. Другую часть раствора испытайте по отношеншэ к раствору сульфида аммония и кислоте. Объясните наблюдаемое.
[c.161]
С -ма элскТ )о. ииа раствора сульфата никеля [c.298]
Соли никеля большей частью имеют зелень н цвет. Из них наибольшее npHM HeiHje имеет сульфат никеля NiS04-7H20, образующий красивые изумрудно-зеленые кристаллы. [c.695]
При прохождении тока через раствор сульфата никеля на катоде выделяются никель и водород. Определите выход по току никеля, если послз пропускания 0,5 А ч выделилось 17,4 см На (при н. у.). [c.433]
Рассчитайте выход rio току никеля при электролизе раствора сульфата никеля с ам = 0,1 при pH 3 и pH 6, если потенциал катода oi носительно стандартного водородного электрода ф = —0,80 В.
Эффекты деполяризации и сверхполяризации в системе никель — во ород отсутствуют константа а в уравнении Тафеля перенапряже-ни J выделения водорода на никеле при pH О равна 0,62 В стандартный ток обмена никелевого электрода /о ni = 3 10″ А/см коэффициенты гереноса для процессов разряда ионов Н» и равны н+г= == 0,5 ам,г+ = 0,29j [c.434]
Лабораторнь(е исследования проводили с модельным раствором стока, содержащим от 20 до 80 мг/л сульфата никеля в расчете на металл. Объем сточных вод, подвергаемых обессоливанию, во всех опытах оставался постоянным и составлял 60 л. [c.198]
Дульцит (галактит) — в отличие от других сахарных спиртов слабо растворим в воде и имеет лишь слегка сладкий вкус. Встречается во многих растениях и некоторых дрожжах. Получен каталитическим гидрированием галактозы. При гидрировании инвертированной лактозы образуется дульцит и сорбит, причем дульцит легко выделяется кристаллизацией.
Промышленное производство дульцита может быть организовано из арабогалактана камеди лиственницы, состоящего из 83% галактана и 12% араба-на при гидролитическом гидрировании арабогалактана в присутствии никеля Ренея и сульфата никеля (гидролизующий агент) был получен дульцит (с примесью арабита) с выходом более 90% [11]. [c.
12]
Если целлюлозу (например, хлопковый делинт) подвергнуть предварительно механохи.
мической деструкции, то ее гидролитическое гидрирование протекает в более мягких условиях подобно крахмалу, деструктированная целлюлоза гидрируется на никелевом катализаторе в присутствии сульфата никеля или железоаммиачных квасцов с выходом сорбита 94—967о- В аналогичных условиях из арабогалактана лиственницы при гидролитическом гидрировании получен дульцит (с примесью арабита) с выходом выше 90% [23]. [c.77]
В наиболее значительных процессах этой группы в качестве окислителя используют кислород воздуха в присутствии таких катализаторов, как оксид железа (II) (процессы Феррокс , Глууд и Манчестер ), сульфат никеля (процесс Никель ), тиоарсенат натрия (процесс Тиолокс ), цианид железа (процессы Фишера и Стаатстинен — Отто ) или органический катализатор окисле-ения (процесс Перокс ). [c.147]
Показано, что сульфат никеля предварительно обезвоженный, ускоряет разложение гидроперекиси кумола на ацетон и фенол. В з1ход фенола в отдельных опытах достигал 94—97% от теоретического. В небольших количествах в реакции образуются диметилфенилкарбинол и ацетофенон (следы). Гетерогенное разложение гидроперекиси на сульфате никеля в гептане протекает с заметной скоростью при 50° С.
С повышением температуры скорость реакции увеличивается. Пачальняя скорость такого разложения гидроперекиси изопропилбензола прямо пропорциональна концентрации катализатора. В отличие от кислотно-каталитиче-ского разложения [343] процесс протекает без самоускорения. Добавки фенола и ацетона не влияют, а добавка диметилфенилкар-бпнола сильно замедляет скорость реакции. [c.
303]
Никель довольно устойчив к коррозии в морской атмосфере, но чувствителен к серной кислоте, присутствующей в атмосфере промышленной (см. табл. 8.2). В последнем случае на поверхности металла образуется пленка из основного сульфата никеля. Коррозия в промышленной атмосфере Нью Йорка примерно в 30 раз выше, чем в морской атмосфере Ла-Джолла (штат Калифорния) [c.177]
Никель чувствителен к агрессивным воздействиям, особенно в промышленной атмосфере. Из-за потускнения металла ве дедст-вие образования пленки основного сульфата никеля, уменьшающего зеркальный блеск поверхности, покрытия постепенно теряют отражательную способность [4].
Для того чтобы уменьшить потускнение, на никель электроосаждением наносят очень тонкий (0,0003—0,0008 мм) слой хрома. Отсюда возник термин хромовое покрытие , хотя в действительности оно в основном состоит из никеля. Оптимальные условия защиты достигаются, если в покровном хромовом слое образуются микротрещины.
Чтобы получить этот эффект, в гальванически,е ванны для электроосаждения хрома вводят соответствующие добавки. Тонкий никелевый слой, осажденный из электролита, содержащего блескообразователи (обычно соединения серы), в свою очередь наносится на вдвое или втрое более толстый матовый слой, электроосажденный из обычной ванны никелирования.
Многочисленные трещины в хроме способствуют инициации коррозии во многих местах поверхности, что уменьшает в конечном итоге глубину коррозионных разрушений, которые в противном случае протекали бы в нескольких отдельных точках.
Блестянщй никель, содержащий небольшие количества серы, является анодом по отношению к нижнему слою никеля, в котором серы меньше, и поэтому выступает в качестве протекторного покрытия. Развитие любого питтинга, образующегося под хромовым покрытием, происходит в основном вширь, а не за счет роста в глубь никелевых слоев.
Таким образом, предотвращается коррозия основного металла. Система многослойных покрытий обладает более высокой защитной способностью, чем однослойные хромовые или никелевые покрытия той же толщины [51. [c.234]
Порошок никеля. Для получения никелевого порошка высокой дисперсности рекомендуются электролиты, содержащие сульфат никеля или двойную никельаммониевую соль ( 0,3 н.), сернокислый (или хлористый) аммоний (0,5—1,0 и.
) для буферирования раствора и хлористый натрий (0,2—0,4 н.) для активирования анодов при pH = 6—7. При комнатной температуре плотность тока 10—20 А/дм , выход по току 60—30%, продолжительность непрерывного электролиза 30—60 мин.
[c.327]
Образец исследуемой соли никеля сульфат никеля N 504-/ НгО, нитрат никеля К1(Ы0з)2-6Н20, хлорид никеля N1012-бНгО. [c.39]
Никель в растворе сульфата никеля в зависимости от pH раствора в среде воздуха имегг потенциал от +0,04 до -1-0,26 в. Потенциал пассивного хрома в водных растворак достигает +0,4—j-0,5 в. Потенциал алюминия в большинстве вэдны х растворов при pH = 6—7 равен —0,4 до —0,6 в (сравнить со стандартными потенциалами этих металлов, приведенными в табл. 4). [c.115]
Для электролиза растворов сульфата никеля с нерастворимым анодом применяются сплавы никеля с кремнием состава N 381 (12,1% 51) или N13512 (22,5 /о 51). [c.133]
Избыток сульфата никеля (последний как примесь чаще всего встречается в аноде) затрудняет процесс рафинирования. Участвуя в переносе тока, ионы никеля скапливаются в прика-тодном слое, затрудняя диффузию ионов меди.
При более или менее высоких плотностях тока нарушается питание двойного слоя ионами меди, возникает заметная концентрациовная поляризация и связанный с ней предельный ток разряда ионов меди . Катодные осадки становятся рыхлыми, кристаллы не связанными (см. рис.
61—62), появляются включения раствора, на катоде начинается разряд ионов примесей, потенциалы которых близки к потенциалу меди, [c.150]
Как видно из схемы, яеред выпаркой растворов сульфата никеля из них удаляют остаток меди, мышья и сурьму посредством электролиза в специальных ваннах со свинцовыми анода-М И, после чего раствор, освобожденный от меди и примесей, на- [c.189]
Ри с. 160. Изменение pH растворов сульфата никеля с разлитыми буфер ными добавками в присутствии сульфатов и. хлоридов натрия В зав исимости от количества вводимого 0,2-н. NaOH [c.336]
Убыль Н1И келя В01СП0ЛНЯЮТ посредством электролитического приготовления раствора сульфата никеля в специально предназначенных ваннах. [c.361]
Свойства сульфата никеля
Сульфат никеля (сернокислый никель, никелевый купорос) – это одна из разновидностей никелевых солей, а именно соль H2SO4 и двухвалентного Ni с хим. формулой NiSO4.
Пребывание на воздухе с высокой влажностью и кристаллизация из водных растворов приводят к образованию кристаллогидратов. При этом количество координированных водных молекул может быть разным.
Наиболее распространенная форма, используемая в химии, является кристаллогидратом NiSO4· 7H2О.
Внешний вид – кристаллические структуры, имеющие бело-желтый/изумрудно-зеленый/бирюзовый окрас. В воде это вещество растворяется хорошо: 38,3 г/100 мл. Без затруднений формирует двойные соли. Гигроскопичность – значительная.
Молярная масса – 154,75 г/моль, плотность – 1,948, 2,07 или 4,01 г/см3. Плотность зависит от формы материала. Первые два показатели характерны кристаллогидратам (гепта- и гексагидрату, соответственно). Последний – безводной форме.
Термосвойства: t плавления – 450 °C, t разложения – 840 °C (с потерей SО3).
Сульфат никеля и сульфат железа
Так как свойства Fe и Ni похожи, то и у их сульфатов наблюдаются определенные сходства. Однако есть и существенные различия. Ni, в целом, проявляет пассивность к кислотам. Реакции с кислотами, а тем более с сильными окисляющими продуктами, слабые. При этом реакция с хлористоводородной кислотой происходит легко.
Получение сернокислого никеля возможно путем растворения Ni в сульфатной кислоте. Также источниками могут служить электролитные растворы рафинирования меди и сульфатные растворы, являющиеся отходами кобальтового изготовления.
Если говорить о кристаллогидратах, то для их создания загрязненное безводное вещество растворяют в водной среде, после чего получившийся раствор обрабатывают перекисью водорода. Но это не все. Еще нужно выполнить нейтрализацию.
Для этого задействуют углекислый никель, а также ортофосфорную кислоту, фосфат натрия или монокалийфосфат. Природным аналогом данного продукта выступает минерал моренозит.
Применение
Различные свойства NiSO4 определяют его использование в тех или иных сферах, причем потребность в нем в наши дни немалая.
Наибольшее количество данного соединения идет на гальванику (обработка металлов путем никелирования).
С его участием производят аккумуляторы, ускорители реакций, оксиферы в электронной и электротехнической отраслях. В металлургическом направлении применяется для создания сплавов.
Кроме того, входит в состав фунгицидов-комплексов. Как реагент задействуется в химии, парфюмерии и масло-жировой промышленности.
Сульфат никеля и безопасность
Имея дело с этим веществом, важно помнить о его токсичности. Попадание в организм чревато канцерогенным и общим токсическим влиянием. Контакт с кожными покровами и слизистыми может вызывать раздражения и высокую чувствительность к Ni. При этом опасности возгорания, пожара и взрыва нет.
Соблюдайте правила обращения с никелевым купоросом как с веществом, наделенным индексом «опасное». Спецодежда, спецобувь и другие СИЗ обязательны. Также нужно оборудовать рабочее помещение приточно-вытяжной вентиляцией и следить за тем, чтобы техника была герметизирована. И не забывайте о требованиях к упаковке, транспортировке, хранению.






