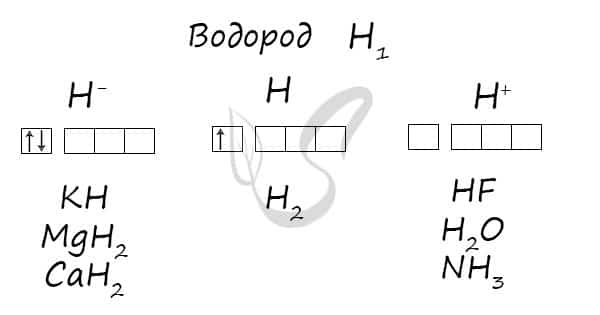
- Водород
- Степени окисления
- Получение
- Химические свойства
- Вода
- Кристаллогидраты
- Пероксид водорода
- Урок 22. Химические свойства водорода – HIMI4KA
- Реакции водорода с простыми веществами
- Реакции водорода со сложными веществами
- §7.3 Химические свойства и применение водорода
- 2.3.1. Химические свойства водорода и галогенов
- Взаимодействие водорода с простыми веществами
- с металлами
- с неметаллами
- Взаимодействие водорода со сложными веществами
- с оксидами металлов
- c оксидами неметаллов
- c кислотами
- c солями
- Химические свойства галогенов
- Взаимодействие галогенов с простыми веществами
- Взаимодействие галогенов с неметаллами
- водородом
- фосфором
- серой
- Взаимодействие галогенов с металлами
- Реакции галогенов со сложными веществами
- Реакции замещения с галогенами
- Взаимодействие галогенов с водой
- Взаимодействие галогенов с растворами щелочей
- Химические свойства водорода
Новости Библиотека Таблица эл-тов Биографии Карта сайтов Ссылки О сайте
Химики хорошо знают особенности молекулы водорода Н2, атома Н и иона Н+. Менее изучены свойства отрицательного иона Н- (гидридный ион), который содержится в молекулах соединений водорода с активными металлами (натрий, калий, кальций и др.).
Молекула водорода довольно прочна и в реакцию вступает лишь при условии, что реагирующие вещества получают небольшой избыток энергии.
Так, водород соединяется с кислородом лишь при поджигании, и тогда реакция развивается быстро и бурно, а при определенном соотношении между объемами смешанных газов сопровождается сильнейшим взрывом (гремучий газ: два объема водорода на один объем кислорода).
Можно и иным способом заставить водород вступить в реакцию с кислородом, именно: применить катализатор. Мельчайшие частицы металла платины действуют как ускорители реакции горения водорода. На поверхности этого металла кислород образует неустойчивое и активное поверхностное соединение, энергично реагирующее с водородом.
Следовательно, на пути прямой реакции водород + + кислород существует «барьер», который можно обойти, либо добавив энергию, либо применив катализатор. Такие барьеры просто означают, что для реакции нужно, чтобы сталкивающиеся молекулы (Н2 + О2) имели в момент столкновения избыток энергии (энергию активации).
Катализатор ведет реакцию по иному пути (через оксиды платины), и на этом пути барьеров практически нет (они очень маленькие), и реакция проходит быстро (рис. 5). Атом водорода гораздо активнее молекулы*, потому что этот атом — радикал (его обозначают Н0), у него имеется один электрон, который не связан с другим.
С элементами, атомы которых присоединяют электрон (например, с углеродом, галогенами, кислородом), водород реагирует с выделением значительных количеств теплоты и образует соединения, где он связан ковалентной связью.
Так, например, реакция водорода с фтором, хлором, углеродом ведет к образованию молекул HF, НС1, СН4, электронное строение которых можно представить схемами:
* (
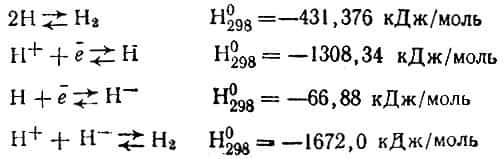
)
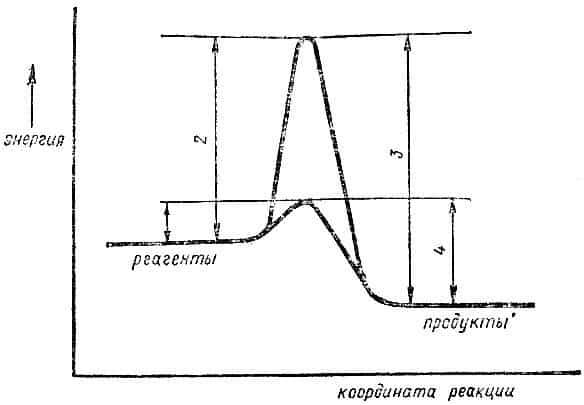 Рис. 5. Влияние катализатора на ход реакции: 1 — активационный барьер прямой реакции с катализатором, 2 — активационный барьер прямой реакции без катализатора, 3 — активационный барьер обратной реакции без катализатора, 4 — активационный барьер обратной реакции с катализатором
Рис. 5. Влияние катализатора на ход реакции: 1 — активационный барьер прямой реакции с катализатором, 2 — активационный барьер прямой реакции без катализатора, 3 — активационный барьер обратной реакции без катализатора, 4 — активационный барьер обратной реакции с катализатором
Эти вещества газообразны при обычных условиях. Между такими соединениями иногда происходит борьба за ион водорода. Так, при растворении НСl в воде молекула воды отрывает ион водорода Н+ от галогена и присоединяет его к паре электронов кислорода:
Получается хлористоводородная кислота. Поэтому ион водорода практически никогда не встречается в свободном состоянии — он всегда «прикреплен» к какой-либо паре электронов. Сочетание Н3O+ называется гидроксонием (по всем данным ион гидроксония в воде еще дополнительно соединен с тремя молекулами воды).
В виде гидроксония ион водорода и действует в растворах. Поэтому, когда мы пишем в уравнениях реакции формулу иона водорода Н+, мы в сущности допускаем неточность надо было бы писать и молекулы того растворителя, в котором находится этот ион.
В водном растворе спирта (этилового) ион водорода связан с молекулой С2Н5ОН так, что получается ион С2Н5ОН⋅Н+ — ион этоксония, с аммиаком и аминами образуются ионы типа NH4+ — аммоний или R — NH2 — Н+ у аминов.
Присоединение иона водорода к молекулам различных соединений очень распространено в химии и биохимии и называется протонизацией. Соединения, содержащие ион Н- (гидридный ион) получаются при взаимодействии щелочных и щелочно-земельных металлов (металлы главной подгруппы второй группы) с водородом при нагревании.
Реакция протекает довольно энергично и в результате получается белое кристаллическое вещество, проявляющее свойство соли. Водород, следовательно, в этом случае играет роль аниона:
- Гидриды щелочных и щелочно-земельных металлов — сильные восстановители, и с водой они выделяют водород:
- NaH + H2О = NaOH + H2↑
- В расплавленном состоянии гидриды проводят электрический ток и на аноде выделяется водородный гидридный ион.
- Водород дает соединения с другими металлами, в том числе и с переходными, но строение их более сложно и там трудно выделить гидридный ион.
Водородная связь. Особенность электронного строения атома водорода приводит к тому, что в некоторых случаях водород способен образовывать своеобразную химическую связь, называемую водородной. Ее образование можно себе представить следующим образом.
Если атом водорода связан в молекуле с сильно электроотрицательным элементом, таким, как фтор, кислород, азот (реже хлор и сера), то общая электронная пара в молекулах (HF, Н2О и т. п.) сильно смещена от водорода к атому электроотрицательного элемента.
Положительный заряд протона водорода сконцентрирован в малом объеме. Протон действует своим положительным зарядом на соседнюю молекулу и может одновременно вступить во вторичную более слабую связь, взаимодействуя с неподеленной электронной парой другого атома или иона и частично обобществляя ее.
Связь может быть как межмолекулярной, так и внутримолекулярной. В последнем случае она объединяет соседние группы атомов одной и той же молекулы.
Примером возникновения водородной связи может служить образование димеров воды и муравьиной кислоты, а также стабилизация структуры молекулы хлорфенола:
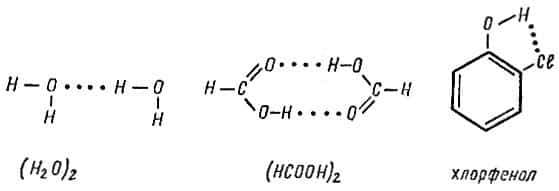
Водородную связь обычно обозначают точками, тем самым указывая, что она гораздо слабее (примерно в 15-20 раз) ковалёнтной связи. Энергия водородной связи, т. е. работа, которую необходимо затратить на ее разрыв, составляет всего 20-30 кДж/моль.
Когда явление водородной связи впервые было установлено в 1877 г. русскими химиками Н. Н. Бекетовым и М. А. Ильинским, оно не укладывалось в классические представления о строгой ограниченности валентности элементов.
Это отразилось на названиях, которые давали открытому явлению: «неполное сродство», «дробная» или «делимая валентность», «побочная валентность», «вторичные силы» и т. д. Водородную связь сводили к простому электростатическому притяжению между протоном и другой полярной группой.
Но сейчас ясно, что существенную роль здесь играет и донорно-акцепторное взаимодействие.
Водородная связь оказывает влияние на свойства многих химических соединений. Так, благодаря водородным связям фтороводород в обычных условиях (ниже 19,5° С) существует не в газообразном, а в жидком виде. Молекулы имеют состав от H2F2 до H6F6.
Наличием водородных связей объясняются и необычные физические свойства воды. Вода — единственный оксид неметалла, находящийся при обычных условиях в жидком состоянии.
Температура кипения воды (100° С) очень высока по сравнению с водородными соединениями других элементов подгруппы кислорода (H2S, H2Se, H2Te). Она превышает теоретически рассчитанное значение 80° С. У воды также большая плотность и большая теплоемкость.
Все это указывает на значительную прочность связей между молекулами воды, для разрушения которых приходится затрачивать дополнительную энергию.
При температурах близких к 0°С в воде существуют молекулы состава (Н2О)8, с повышением температуры они распадаются на более простые: (Н2О)4 и (Н2О)2. Молекулы (H2О)2 встречаются в воде при 100 °С и даже в водяных парах.
Свойством воды образовывать различные по структуре полимерные молекулы, более компактные или более объемистые, объясняется ее аномальное поведение при изменении температуры. Так, плавление льда сопровождается не расширением, как у подавляющего большинства веществ, а сжатием.
При этом плотность воды несколько возрастает и только после 4°С начинает падать. Необычно меняется с температурой теплоемкость и другие свойства.
Все эти явления связаны с тем, что при плавлении льда и дальнейшем нагревании происходит разрушение «рыхлой» структуры, образованной крупными ассоциатами воды, и переход к более компактным мелким ассоциатам.
Особенно большую роль водородные связи играют в молекулах белков, нуклеиновых кислот и других биологически важных соединений. Благодаря водородным связям, возникающим между карбонильными и аминогруппами ( -NH…
O = C-), входящими в состав отдельных участков цепи биополимеров, осуществляется особая укладка молекулы в пространстве.
Так, полипептидные цепи белков обычно находятся в виде винтовых спиралей (α-спиралей) или укладываются в β-структуры — «складчатые слои», которые образуются из нескольких участков растянутых цепей, лежащих антипараллельно друг к другу. Обе такие структуры удерживаются водородными связями (рис. 6).
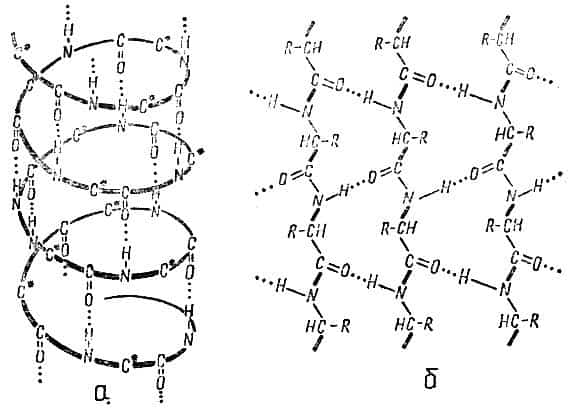 Рис. 6. Вторичная структура белка: а — α-спираль, б — β-структура
Рис. 6. Вторичная структура белка: а — α-спираль, б — β-структура
Молекулы так называемых фибриллярных белков, входящих в состав соединительных тканей, мышц, волос, обычно представляют собой вытянутую α-спираль и напоминают длинную пружину. Отдельные молекулы под действием возникающих между ними водородных связей скручиваются друг с другом подобно проводам в кабеле (рис. 7).
Образующиеся при этом структуры действительно отличаются свойством пружины: они могут растягиваться до длины, вдвое превышающей их нормальную длину, и вновь сжиматься, когда нагрузка исчезает. Это происходит, например, при сжатии и растяжении мышц. Подобное поведение является следствием перестройки водородных связей.
Добиться удлинения спиралеобразных молекул белка можно и другим путем — при увлажнении. Молекулы воды, внедряясь в структуру полипептидной цепи, нарушают водородные связи, и конформация белка меняется. На этом основано действие волосяного гигрометра. Он представляет собой обычный волос, натянутый грузиком, и перекинутый через подвижное колесо.
Когда влажность воздуха в помещении увеличивается, волос удлиняется, колесо поворачивается и прикрепленный к нему указатель перемещается по шкале.
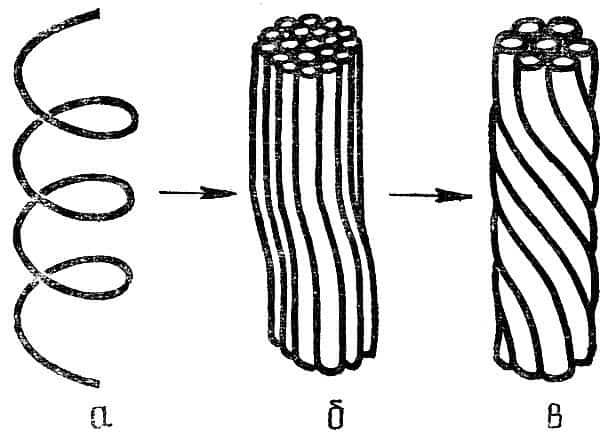 Рис. 7. Структура нити фибриллярного белка: а — спираль полипептидной цепи, б — третичная структура белка, в — четвертичная структура
Рис. 7. Структура нити фибриллярного белка: а — спираль полипептидной цепи, б — третичная структура белка, в — четвертичная структура
Водород
Водород (лат. hydrogenium = греч. ὕδωρ — вода + γεννάω — рождаю) — самый легкий химический элемент, при обычных условиях — газ без цвета, запаха и вкуса. В соединении с кислородом образует воду.
Водород — самый распространенный элемент Вселенной, входит в состав всего живого и небесных тел (73% массы Солнца).

Степени окисления
Проявляет степени окисления: -1, 0, +1.
Получение
В промышленности водород получают различными методами:
- Конверсия с водяным паром при t = 1000 °C
- Методом газификации угля, торфа, сланца
- Электролизом водных растворов щелочей
- Каталитическим окислением кислородом (неполное окисление)
CH4 + H2O → CO + H2
C + H2O → CO + H2
H2O → H2↑ + O2↑
CH4 + O2 → CO + H2

Лабораторные методы традиционно отличаются от промышленных своей простотой. В лаборатории водород получают:
- Вытеснением водорода из кислот
- Гидролизом гидридов
- Взаимодействием активных металлов с водой
- Реакцией цинка или алюминия с раствором щелочи
Fe + HCl → FeCl2 + H2↑
CaH2 + H2O → Ca(OH)2 + H2↑
Ca + H2O → Ca(OH)2 + H2↑
Al + NaOH + H2O → Na[Al(OH)4] + H2↑
Химические свойства
- В реакциях водород проявляет себя как восстановитель и окислитель. Как восстановитель реагирует с элементами, электроотрицательность которых выше, чем у водорода:
- Как восстановитель реагирует с кислородом, галогенами, азотом, серой, оксидами металлов. При комнатной температуре из перечисленных реакция идет только со фтором.
- H2 + O2 → (t) H2O
- H2 + F2 → HF (со взрывом в темноте)
- H2 + Cl2 → (t) HCl (со взрывом только на свету)
- H2 + N2 → NH3
- H2 + S → H2S
- H2 + ZnO → Zn + H2O
- Как окислитель реагирует с металлами

Na + H2 → NaH (гидрид натрия)
Mg + H2 → MgH2
Вода
Химические свойства:
- Реакция с металлами
- Реакции с основными и кислотными оксидами
- Гидролиз солей
- Реакция с гидридами активных металлов
- Реакции с C, CO, CH4
- C + H2O → CO + H2
- H2O + CO → (кат.) CO2 + H2
- H2O + CH4 → (кат.) CO + H2
- С галогенами
Металлы, стоящие в ряду активности до водорода, вытесняют водород из воды. K + H2O → KOH + H2
Реагирует с основными оксидами — с образованием оснований (реакция идет, если основание растворимо), и с кислотными оксидами — с образованием соответствующих кислот. Не забывайте сохранять степени окисления! CaO + H2O → Ca(OH)2 P2O5 + H2O → H3PO4
Отмечу здесь реакцию двойного гидролиза, которая заключается в гидролизе одной соли по катиону (CrBr3), а другой — по аниону (Na2CO3). Na2CO3 + CrBr3 + H2O → Cr(OH)3↓ + CO2 + NaBr
LiH + H2O → LiOH + H2↑
Cl2 + H2O → HCl + HClO (соляная и хлорноватистая кислоты — без нагревания) Cl2 + H2O → HCl + HClO3 (соляная и хлорноватая кислоты — при нагревании) 
Кристаллогидраты
Кристаллогидраты — кристаллические соединения, содержащие молекулы воды как самостоятельные структурные единицы. Вода, входящая в состав кристаллогидратов, называется кристаллической. Примеры: CaSO4*2H2O, Na2SO4*10H2O.
При нагревании кристаллогидраты теряют воду. Одним из наиболее известных кристаллогидратов является медный купорос: CuSO4*5H2O. Медный купорос имеет характерный голубой цвет, а безводный сульфат меди — белый.

В задачах бывает дана масса медного купороса. Надо помнить о том, что часто в реакции не участвует кристаллическая вода. В таком случае следует вычесть кристаллизационную воду и найти массу безводного сульфата меди.

Пероксид водорода
Представляет собой бесцветную жидкость с металлическим вкусом. Концентрированные растворы пероксида водорода взрывоопасны.
- Получают пероксид водорода в реакции с пероксидами и супероксидами металлов.
- K2O2 + H2O → KOH + H2O2
- BaO2 + H2SO4 → BaSO4 + H2O2
- В разбавленных растворах пероксид водорода легко разлагается:
- H2O2 → H2O + O2↑
- Также перекись проявляет окислительные свойства:
- KCl + H2O2 + H2SO4 → Cl2 + K2SO4 + H2O

Перекисью водорода обрабатывают раневую поверхность. Выделяющийся при разложении атомарный кислород разрушает бактериальные клетки, предотвращая осложнение в виде бактериальной инфекции.
Урок 22. Химические свойства водорода – HIMI4KA
Архив уроков › Химия 8 класс
В уроке 22 «Химические свойства водорода» из курса «Химия для чайников» узнаем с какими веществами реагирует водород; выясним, какими химическими свойствами обладает водород.

Водород вступает в химические реакции с простыми и сложными веществами. Однако при обычных условиях водород малоактивен. Для его взаимодействия с другими веществами необходимо создать условия: повысить температуру, применить катализатор и др.
Реакции водорода с простыми веществами
При нагревании водород вступает в реакции соединения с простыми веществами — кислородом, хлором, азотом, серой.
Если поджечь на воздухе чистый водород, выходящий из газоотводной трубки, он горит ровным, еле заметным пламенем. Теперь поместим трубку с горящим водородом в банку с кислородом (рис. 95).
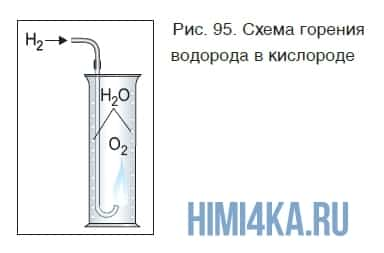
Горение водорода продолжается, при этом на стенках банки видны капли воды, образующейся в результате реакции:
При горении водорода выделяется много теплоты. Температура кислородно-водородного пламени достигает больше 2000 °С.
Химическая реакция водорода с кислородом относится к реакциям соединения. В результате реакции образуется оксид водорода (вода). Это значит, что произошло окисление водорода кислородом, т. е. эту реакцию мы можем назвать и реакцией окисления.
Если же в пробирку, опрокинутую вверх дном, собрать немного водорода методом вытеснения воздуха, а затем поднести к ее отверстию горящую спичку, то раздастся громкий «лающий» звук небольшого взрыва смеси водорода с воздухом. Такую смесь называют «гремучей».
На заметку: Способность водорода в смеси с воздухом образовывать «гремучий газ» часто являлась причиной катастроф на воздушных шарах, заполненных водородом. Нарушение герметичности оболочки шара приводило к пожару и даже взрыву. В наше время воздушные шары заполняют гелием или постоянно нагнетаемым горячим воздухом.
В атмосфере хлора водород сгорает с образованием сложного вещества — хлороводорода. При этом протекает реакция:
Реакция водорода с азотом происходит при повышенной температуре и давлении в присутствии катализатора. В результате реакции образуется аммиак NH3:
Если струю водорода направить на расплавленную в пробирке серу, то у ее отверстия ощутится запах тухлых яиц. Так пахнет газ сероводород H2S — продукт реакции водорода с серой:
На заметку: Водород способен не только растворяться в некоторых металлах, но и реагировать с ними. При этом образуются химические соединения, называемые гидридами (NaH — гидрид натрия). Гидриды некоторых металлов используют как горючее в ракетных двигателях на твердом топливе, а также при получении термоядерной энергии.
Реакции водорода со сложными веществами
Водород реагирует при повышенной температуре не только с простыми, но и со сложными веществами. Рассмотрим в качестве примера его реакцию с оксидом меди(II) CuO (рис. 96).
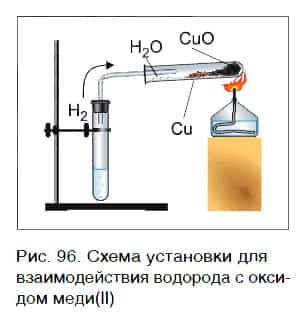
Пропустим водород над нагретым порошком оксида меди(II) CuO. По мере протекания реакции цвет порошка изменяется с черного на коричнево красный. Это цвет простого вещества меди Cu. В ходе реакции на холодных частях пробирки появляются капельки жидкости. Это еще один продукт реакции — вода H2O. Отметим, что в отличие от простого вещества меди вода — сложное вещество.
Уравнение реакции оксида меди(II) с водородом:
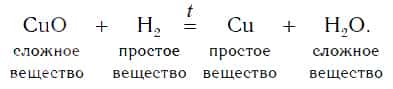
Водород в реакции с оксидом меди(II) проявляет способность отнимать у оксида металла кислород, тем самым восстанавливать металл из этого оксида. В результате происходит восстановление меди из сложного вещества CuO до металлической меди (Cu).
Реакции восстановления — это реакции, в ходе которых сложные вещества отдают атомы кислорода другим веществам.
Вещество, отнимающее атомы кислорода, называют восстановителем. В реакции с оксидом меди(II) восстановитель — водород. Так же реагирует водород и с оксидами некоторых других металлов, например PbO, HgO, MoO3, WO3 и др. Окисление и восстановление всегда взаимосвязаны между собой. Если одно вещество (Н2) окисляется, то другое (CuO) — восстанавливается, и наоборот.
Краткие выводы урока:
- При нагревании водород реагирует с кислородом, хлором, азотом, серой.
- Восстановление — это отдача атомов кислорода сложными веществами другим веществам.
- Процессы окисления и восстановления взаимосвязаны между собой.
Надеюсь урок 22 «Химические свойства водорода» был понятным и познавательным. Если у вас возникли вопросы, пишите их в комментарии.
§7.3 Химические свойства и применение водорода
Водород – один из рекордсменов по числу многообразия соединений. Наибольшее их количество приходится на соединения с углеродом, которые изучает органическая химия.
Но и неорганические соединения водорода весьма разнообразны. В таблице 6-1 приведены только простейшие соединения водорода с типичными s- и р-элементами.
Таблица 7-1. Примеры соединений водорода с типичными s- и р-элементами. Указана степень окисления водорода во всех соединениях.
** Соединения металлов с водородом (они называются гидридами металлов) представляют собой твердые вещества. Гидриды металлов можно получать непосредственно из металла и водорода:
Гидриды бурно реагируют с водой с образованием газообразного водорода:
Это еще один удобный способ получения газообразного водорода. Источником водородных атомов являются как гидрид металла, так и вода. Поэтому для получения 1 м3 водорода необходимо всего 0,94 кг гидрида кальция, в то время как для получения того же количества газа действием металлов на кислоты требуется 2,5 кг железа или 2,9 кг цинка.
Соединения водорода с неметаллами в большинстве являются газами. Исключение составляет вода. Такое резкое отличие воды от соседей по таблице 7-1 объясняется существованием между молекулами воды особого вида химической связи
Из всех соединений водорода одним из важнейших является аммиак, который получают реакцией водорода с азотом при высокой температуре, давлении и в присутствии катализатора:
Это один из немногих химических процессов, позволяющих связывать довольно инертный атмосферный азот. В дальнейшем из более активного в химическом отношении аммиака получают множество азотистых соединений
азотную кислоту, красители, взрывчатые вещества, азотные удобрения.
Восстановительные свойства водорода используют для получения чистых металлов из их оксидов. Например, при нагревании оксида меди CuO в токе водорода образуется вода и порошок металлической меди:
Для некоторых очень тугоплавких металлов восстановление их оксидов водородом оказывается удобным и экономичным способом получения. Например, металл вольфрам, из которого делают нити лампочек накаливания, получают с помощью реакции:
WO3 + 3 H2 = W + 3 H2O
Металл получается в виде порошка, который затем можно прессовать в готовые изделия. После спекания такие изделия не требуют дальнейшей обработки. Этот способ получения металлов и деталей из них называется порошковой металлургией.
Важной является также реакция горения водорода. Можно ожидать, что реакция водорода с таким хорошим окислителем, как кислород, протекает с большим выделением энергии. Это действительно так. Приведем количество энергии, образующейся при сжигании 1 кг различных топлив, включая водород:
Водород 110 000
43 000 кДж
Уголь 33 000 кДж
Дрова 10 000 кДж
Таким образом, водород является чрезвычайно теплотворным химическим топливом. Кроме того, при сжигании водорода образуется только вода, в то время как другие топлива загрязняют атмосферу оксидами углерода, азота и несгоревшими остатками топлива.
Водород используется в качестве горючего в современной ракетной технике. Российская ракета-носитель «Энергия» выводила на орбиту более 100 тонн различных грузов благодаря водородно-кислородным двигателям. В ее двигателях использовались жидкий кислород и жидкий водород.
Вы уже знаете, что смеси водорода с кислородом называются гремучим газом и взрываются от малейшей искры. Поэтому работа с водородом в качестве топлива требует таких мер предосторожности, которые бы исключали возможность взрыва. Современная техника позволяет достичь высокого уровня безопасности, но история знает трагедии, связанные со взрывами водорода.
В первой половине века в разных странах было построено большое количество летательных аппаратов легче воздуха – дирижаблей.
Однако большое количество энергии, выделяющееся в реакции водорода с кислородом, таит в себе огромную опасность.
6 мая 1937 года крупнейший в мире пассажирский дирижабль «Гинденбург», прилетевший из Германии в Нью-Джерси (США), взорвался и рухнул на землю от искры, проскочившей между причальной мачтой и корпусом дирижабля.
На фотографии ниже запечатлен этот трагический момент. Во многом именно из-за этой катастрофы строительство пассажирских дирижаблей вскоре прекратилось.

В настоящее время водород не применяют для наполнения аэростатов и других летательных аппаратов легче воздуха. Для этих целей используют более дорогой, но зато безопасный газ гелий.
Задачи.
7.6. Требуется получить 159 г меди из оксида меди CuO. Сколько граммов воды необходимо разложить электролизом, чтобы получить водород для проведения этого превращения?
7.7. Вольфрам
** 7.8 (НГУ). Напишите формулы всех известных вам соединений водорода с элементами 2-го периода. Найдите среди них те, которые реагируют между собой и напишите уравнения реакций.
** 7.9. С помощью каких химических реакций можно получить аммиак NH
2.3.1. Химические свойства водорода и галогенов
Атом водорода имеет электронную формулу внешнего (и единственного) электронного уровня 1s1. С одной стороны, по наличию одного электрона на внешнем электронном уровне атом водорода похож на атомы щелочных металлов.
Однако, ему, так же как и галогенам не хватает до заполнения внешнего электронного уровня всего одного электрона, поскольку на первом электронном уровне может располагаться не более 2-х электронов.
Выходит, что водород можно поместить одновременно как в первую, так и в предпоследнюю (седьмую) группу таблицы Менделеева, что иногда и делается в различных вариантах периодической системы:
С точки зрения свойств водорода как простого вещества, он, все-таки, имеет больше общего с галогенами. Водород, также как и галогены, является неметаллом и образует аналогично им двухатомные молекулы (H2).
В обычных условиях водород представляет собой газообразное, малоактивное вещество. Невысокая активность водорода объясняется высокой прочностью связи между атомами водорода в молекуле, для разрыва которой требуется либо сильное нагревание, либо применение катализаторов, либо и то и другое одновременно.
Взаимодействие водорода с простыми веществами
с металлами
Из металлов водород реагирует только с щелочными и щелочноземельными! К щелочным металлам относятся металлы главной подгруппы I-й группы (Li, Na, K, Rb, Cs, Fr), а к щелочно-земельным — металлы главной подгруппы II-й группы, кроме бериллия и магния (Ca, Sr, Ba, Ra)
При взаимодействии с активными металлами водород проявляет окислительные свойства, т.е. понижает свою степень окисления. При этом образуются гидриды щелочных и щелочноземельных металлов, которые имеют ионное строение. Реакция протекает при нагревании:
Следует отметить, что взаимодействие с активными металлами является единственным случаем, когда молекулярный водород Н2 является окислителем.
с неметаллами
- Из неметаллов водород реагирует только c углеродом, азотом, кислородом, серой, селеном и галогенами!
- Под углеродом следует понимать графит или аморфный углерод, поскольку алмаз — крайне инертная аллотропная модификация углерода.
- При взаимодействии с неметаллами водород может выполнять только функцию восстановителя, то есть только повышать свою степень окисления:
Взаимодействие водорода со сложными веществами
с оксидами металлов
Водород не реагирует с оксидами металлов, находящихся в ряду активности металлов до алюминия (включительно), однако, способен восстанавливать многие оксиды металлов правее алюминия при нагревании:
c оксидами неметаллов
Из оксидов неметаллов водород реагирует при нагревании с оксидами азота, галогенов и углерода. Из всех взаимодействий водорода с оксидами неметаллов особенно следует отметить его реакцию с угарным газом CO.
Смесь CO и H2 даже имеет свое собственное название – «синтез-газ», поскольку из нее в зависимости от условий могут быть получены такие востребованные продукты промышленности как метанол, формальдегид и даже синтетические углеводороды:
c кислотами
С неорганическими кислотами водород не реагирует!
Из органических кислот водород реагирует только с непредельными, а также с кислотами, содержащими функциональные группы способные к восстановлению водородом, в частности альдегидные, кето- или нитрогруппы.
c солями
- В случае водных растворов солей их взаимодействие с водородом не протекает. Однако при пропускании водорода над твердыми солями некоторых металлов средней и низкой активности возможно их частичное или полное восстановление, например:
Химические свойства галогенов
Галогенами называют химические элементы VIIA группы (F, Cl, Br, I, At), а также образуемые ими простые вещества. Здесь и далее по тексту, если не сказано иное, под галогенами будут пониматься именно простые вещества.
Все галогены имеют молекулярное строение, что обусловливает низкие температуры плавления и кипения данных веществ. Молекулы галогенов двухатомны, т.е. их формулу можно записать в общем виде как Hal2.
| F2 | Светло-желтый газ с резким раздражающим запахом |
| Cl2 | Желто-зеленый газ с резким удушливым запахом |
| Br2 | Красно-бурая жидкость с резким зловонным запахом |
| I2 | Твердое вещество с резким запахом, образующее черно-фиолетовые кристаллы |
Следует отметить такое специфическое физическое свойство йода, как его способность к сублимации или, иначе говоря, возгонке. Возгонкой, называют явление, при котором вещество, находящееся в твердом состоянии, при нагревании не плавится, а, минуя жидкую фазу, сразу же переходит в газообразное состояние.
Электронное строение внешнего энергетического уровня атома любого галогена имеет вид ns2np5, где n – номер периода таблицы Менделеева, в котором расположен галоген.
Как можно заметить, до восьмиэлектронной внешней оболочки атомам галогенов не хватает всего одного электрона. Из этого логично предположить преимущественно окисляющие свойства свободных галогенов, что подтверждается и на практике.
Как известно, электроотрицательность неметаллов при движении вниз по подгруппе снижается, в связи с чем активность галогенов уменьшается в ряду:
F2 > Cl2 > Br2 > I2
Взаимодействие галогенов с простыми веществами
Все галогены являются высокоактивными веществами и реагируют с большинством простых веществ.
Однако, следует отметить, что фтор из-за своей чрезвычайно высокой реакционной способности может реагировать даже с теми простыми веществами, с которыми не могут реагировать остальные галогены.
К таким простым веществам относятся кислород, углерод (алмаз), азот, платина, золото и некоторые благородные газы (ксенон и криптон). Т.е. фактически, фтор не реагирует лишь с некоторыми благородными газами.
Остальные галогены, т.е. хлор, бром и йод, также являются активными веществами, однако менее активными, чем фтор. Они реагируют практически со всеми простыми веществами, кроме кислорода, азота, углерода в виде алмаза, платины, золота и благородных газов.
Взаимодействие галогенов с неметаллами
водородом
- При взаимодействии всех галогенов с водородом образуются галогеноводороды с общей формулой HHal. При этом, реакция фтора с водородом начинается самопроизвольно даже в темноте и протекает со взрывом в соответствии с уравнением:
- Реакция хлора с водородом может быть инициирована интенсивным ультрафиолетовым облучением или нагреванием. Также протекает со взрывом:
- Бром и йод реагируют с водородом только при нагревании и при этом, реакция с йодом является обратимой:
фосфором
- Взаимодействие фтора с фосфором приводит к окислению фосфора до высшей степени окисления (+5).
При этом происходит образование пентафторида фосфора:
- При взаимодействии хлора и брома с фосфором возможно получение галогенидов фосфора как в степени окисления + 3, так и в степени окисления +5, что зависит от пропорций реагирующих веществ:
- При этом в случае белого фосфора в атмосфере фтора, хлора или жидком броме реакция начинается самопроизвольно.
- Взаимодействие же фосфора с йодом может привести к образованию только триодида фосфора из-за существенно меньшей, чем у остальных галогенов окисляющей способности:
серой
Фтор окисляет серу до высшей степени окисления +6, образуя гексафторид серы:
Хлор и бром реагируют с серой, образуя соединения, содержащие серу в крайне не свойственных ей степенях окисления +1 и +2. Данные взаимодействия являются весьма специфичными, и для сдачи ЕГЭ по химии умение записывать уравнения этих взаимодействий не обязательно. Поэтому три нижеследующих уравнения даны скорее для ознакомления:
Взаимодействие галогенов с металлами
- Как уже было сказано выше, фтор способен реагировать со всеми металлами, даже такими малоактивными как платина и золото:
- Остальные галогены реагируют со всеми металлами кроме платины и золота:
Реакции галогенов со сложными веществами
Реакции замещения с галогенами
Более активные галогены, т.е. химические элементы которых расположены выше в таблице Менделеева, способны вытеснять менее активные галогены из образуемых ими галогеноводородных кислот и галогенидов металлов:
- Аналогичным образом, бром вытесняет серу из растворов сульфидов и сероводорода:
- Хлор является более сильным окислителем и окисляет сероводород в его водном растворе не до серы, а до серной кислоты:
Взаимодействие галогенов с водой
Вода горит во фторе синим пламенем в соответствии с уравнением реакции:
Бром и хлор реагируют с водой иначе, чем фтор. Если фтор выступал в роли окислителя, то хлор и бром диспропорционируют в воде, образуя смесь кислот. При этом реакции обратимы:
- Взаимодействие йода с водой протекает в настолько ничтожно малой степени, что им можно пренебречь и считать, что реакция не протекает вовсе.
Взаимодействие галогенов с растворами щелочей
Фтор при взаимодействии с водным раствором щелочи опять же выступает в роли окислителя:
Умение записывать данное уравнение не требуется для сдачи ЕГЭ. Достаточно знать факт о возможности такого взаимодействия и окислительной роли фтора в этой реакции.
В отличие от фтора, остальные галогены в растворах щелочей диспропорционируют, то есть одновременно и повышают и понижают свою степень окисления. При этом, в случае хлора и брома в зависимости от температуры возможно протекание по двум разным направлениям. В частности, на холоду реакции протекают следующим образом:
- а при нагревании:
Йод реагирует с щелочами исключительно по второму варианту, т.е. с образованием йодата, т.к. гипоиодит не устойчив не только при нагревании, но также при обычной температуре и даже на холоду:
Химические свойства водорода
Химические свойства водорода добавить в закладки
Водород – неметалл, имеет молекулярное строение. Характерно двойственное положение в периодической системе химических элементов – расположен в I и VII группах. Проявляет свойства как окислителя, так и восстановителя. При определенных условиях и с определенными элементами он может проявлять себя как металл и как неметалл.
Сходство с металлами:
- Одинаковая конфигурация внешнего электронного уровня;
- В большинстве соединений способен проявлять степень окисления +1;
- Обладает хорошо выраженными восстановительными свойствами, то есть способен отдавать электроны и восстанавливать другие элементы;
- Типичны реакции замещения.
Сходство с неметаллами:
- Атом водорода может присоединять электроны, то есть обладает окислительными свойствами;
- Образуя химические соединения с металлами, приобретает степень окисления -1;
- Молекула водорода представляет собой газообразное вещество из двух атомов;
Рассмотрим на примерах химические свойства водорода как восстановители и как окислителя.
I. Восстановительные свойства
- Для водорода типична реакция горения с кислородом. Причем при нормальных условиях данная реакция не протекает. Необходимым условием является нагрев и чем больше нагревание, тем реакция протекает энергичнее. При смеси двух объемов водорода и одного объема кислорода образуется «гремучий газ» и происходит взрыв.
- Типичны реакции с неметаллами:
- Взаимодействует с серой, продуктом реакции является сероводород. Реакция происходит, когда водород проходит через расплавленную серу. H2 + S → H2S↑
- При нагревании водород может вступать в реакцию с азотом с образованием аммиака. Главным условием этой реакции является высокая температура и давление, а также наличие катализатора. 3H2 + N2 → 2NH3↑
- Из галогенов при обычной температуре водород реагирует лишь с фтором.
- H2 + F2 → 2HF
- С хлором реагирует только на свету, образуя хлороводород, с бромом реакция протекает менее энергично, с йодом не идет до конца даже при высоких температурах.
- H2 + Cl2 → 2HCl
- Взаимодействие с оксидами неметаллов. Данные реакции протекают при нагревании с оксидами азота, углерода и галогенов. К примеру, реакция с оксидом углерода (II) протекает при высоких температурах и продуктом реакции является метанол, а смесь СО и Н2 называется «синтез-газ»
2H2 + CO → CH3OH
- Водород способен восстанавливать металлы из их оксидов. Предпосылкой такой реакции является расположение металла в электрохимическом ряду напряжений справа от алюминия.
CuO + H2 → Cu + H2O
Водород является универсальным восстановителем, который используется в большинстве процессов химического синтеза для получения чистых веществ.
II. Окислительные свойства
В качестве окислителя водород взаимодействует с металлами с образованием гидридов. Например, продуктом реакции натрия и водорода будет гидрид натрия. В данных химических процессах водород проявляет отрицательную степень оксиления.
H2 +2Na → 2NaH
Смотри также:
- Номенклатура неорганических веществ
- Характерные химические свойства простых веществ – металлов: щелочных, щелочноземельных, магния, алюминия; переходных металлов (меди, цинка, хрома, железа)
- Характерные химические свойства простых веществ – неметаллов: водорода, галогенов, кислорода, серы, азота, фосфора, углерода, кремния
- Характерные химические свойства оксидов: оснóвных, амфотерных, кислотных
- Характерные химические свойства оснований и амфотерных гидроксидов
- Характерные химические свойства кислот
- Характерные химические свойства солей: средних, кислых, оснóвных; комплексных ( на примере соединений алюминия и цинка)
- Взаимосвязь различных классов неорганических веществ






