Высокие температуры, используемые при сварке плавлением, с одной стороны, понижают термодинамическую устойчивость оксидов, как это было показано в п. 9.2, но, с другой стороны, скорость их образования резко увеличивается и за очень небольшое время сварочного цикла металлы поглощают значительное количество кислорода.
Поглощенный кислород может находиться в металле или в растворенном состоянии в виде оксидов (обычно низшей степени окисления), или субоксидов (ТІбО, ТізО, Ті20), а также может создавать неметаллические включения эндогенного типа, образовавшиеся при раскислении металла более активными элементами. И то, и другое резко снижает качество сварных соединений, особенно пластичность металла шва.
Исследования этого вопроса показали, что основная масса кислорода в металле обычно находится в неметаллических включениях [20].
Источниками кислорода в металле при сварке служат окислительно-восстановительные реакции между металлом и атмосферой сварочной дуги, металлом и шлаками, образующимися в результате плавления флюсов или при разложении и плавлении компонентов электродного покрытия, а также при взаимодействии с наполнителями порошковой проволоки.
Особенно велики скорости взаимодействия металла с окружающей средой в высокотемпературной зоне сварки (см. п. 8.6), к которой следует отнести каплю плавящегося металла на торце электрода илн электродной проволоки, дуговой или плазменный разряд и переднюю часть ванны.
Более медленно эти процессы развиваются в хвостовой части ванны, так как там температура приближается к температуре кристаллизующегося металла. Температурный перепад между этими зонами настолько велик,что реакции окисления — восстановления меняют свое направление (см. п. 8.4).
Так, в капле плавящегося на электроде металла происходит интенсивное поглощение кремния и марганца в результате окисления железа, в то время как в хвостовой части сварочной ванны кремний и марганец восстанавливают железо, окисляясь сами.
- Кроме того, взаимодействие металла с кислородом при сварке осложняется образованием растворов оксидов в металлах, а это сильно изменяет их термодинамическую устойчивость из-за возрастания энтропии в процессе растворения.
- ОКИСЛЕНИЕ МЕТАЛЛОВ В РАСТВОРАХ
- Все промышленно важные металлы растворяют свои оксиды, образуя жидкие растворы, а некоторые образуют с ними твердые растворы, но обычно в очень малых концентрациях.
- Процесс диссоциации оксида металла в растворе может быть выражен уравнением (квадратные скобки обозначают раствор в металле) 2[МеО] *=±2 [Me] + 02|, где [МеО] —оксид металла, растворенный в металле.
Этот процесс в ненасыщенных и насыщенных растворах реализуется различно, как показано на рис. 9.5, а, б.
Для ненасыщенного раствора (рис, 9.
5, а) число степеней свободы будет С = 2 + 2 — 2 — 2 или р^ = f(T, х), где х — состав ненасыщенного раствора (обозначение р’02 введено для давления диссоциации, зависящего не только от температуры, но и концентрации раствора).
Таким образом, р^ не может уже рассматриваться как константа равновесия, зависящая только от температуры, но эта величина будет определять энергию Гиббса, соответствующую данной системе:
AG = —RTnpQ2- (9.5)
Принимаем, что Кц — К; = Кр при ро = 1.
Для насыщенного раствора (рис. 9.5, б), в котором появляется еще одна фаза — избыток растворяемого вещества, число степеней свободы будет
- С = 2 + 2 — 3= 1
- или
- POl=f(T) Xmc = fl(T), а энергия Гиббса будет равна
- AG° = —ДЛпро*- (9-6)
|
Р, т, к р, т, хнас~?(Т) Рнс 9 5. Схема взаимодействия металла с кислородом в ненасыщенном (а) и насыщенном (б) растворах |
- Следовательно, один и тот же процесс окисления металла может развиваться в насыщенном и ненасыщенном растворе по-разному.
- Поведение растворенного вещества в растворе определяется его активностью, а не массовой концентрацией, так как растворенное вещество взаимодействует с растворителем, образуя комплексы переменного состава, а его молекулы могут также взаимодействовать друг с другом. Активность растворенного вещества может быть представлена уравнением
- а, = у, N„ (9.7)
- где a, — активность компонента в растворе; у, — коэффициент активности — величина, как правило, меньшая единицы; А, — молярная доля или безразмерная концентрация.
В разбавленных растворах (малой концентрации) коэффициент активности стремится к единице. Металлы обычно очень ограниченно растворяют свои оксиды, а оксиды других металлов практически не растворяют.
Для насыщенного раствора (рис. 9.5, б) напишем уравнение, аналогичное выражению (9.7) :
- CLнас^^ У насА Нао (9-8)
- В насыщенном растворе, концентрация которого определяется только температурой, активность растворенного вещества условно можно принять за единицу, так как оно находится в равновесии со свободной фазой растворенного вещества, и, принимая также уі = у»ао можно записать отношение
- а, = А/Анао (9.9)
- Тогда при условии ненасыщенности раствора оксида металла в металле можно написать константу равновесия так:
- Кр = Ро2 = Ро2(аме/амео)> (9.10)
где аще~ Аме/Аме вас; амео = Амео/Амео нас в соответствии с формулой (9.9).
- Отсюда видно, что давление диссоциации ро2 представляет собой функцию концентрации раствора при условии постоянной температуры.
- Выразим эту зависимость через расчетные термодинамические функции (AG0):
- Ро2 = Ро2(аМео/ аМе) (9.11)
- и соответственно
AG = AG0+2і? ПпаМе-—2i? TlnaMeo (9-12)
Если аМео-*»1 и аме-*»1> то Ро2^Ро2> 3 AG->-AG0, но если амео—>-0, что соответствует чистому металлу, не содержащему в себе оксида, то
Ро2 = 0, а AG —оо. (9.13)
Таким образом, можно сделать вывод, что нельзя получить металл чистым по кислороду в условиях равновесных металлургических процессов.
ПОНЯТИЕ О СИСТЕМАХ МЕТАЛЛ — КИСЛОРОД
Рассмотрим взаимодействие наиболее важных промышленных металлов с кислородом. В сварочной технике наиболее часто встречаются сплавы на основе железа — стали самых разнообразных марок и назначений. Общий объем сварных конструкций из стали исчисляется десятками миллионов тонн.
Медь и ее сплавы сваривают в очень небольших объемах, так как медь — дефицитный цветной металл.
Сварные изделия из меди необходимы в электротехнической промышленности, в химическом, энергетическом и общем машиностроении.
В последнее время непрерывно увеличивается производство сварных конструкций из титана и его сплавов, из алюминия и его сплавов, а также из тугоплавких металлов, таких как вольфрам и молибден.
Система железо — кислород. Железо может проявлять в своих соединениях степень окисления от +6 до +2.
Оксид Fe03, образованный ковалентными полярными связями, обладает кислотными свойствами, неустойчив и при сварке образоваться не может. Оксид Fe203 — соединение со смешанными связями, ам — фотерное — образует соли (ферриты).
В природе Fe203 встречается в виде железной руды — гематита, или если он гидратирован, то в виде (РегОз-ШО), бурого железняка или гетита.
При высоких температурах Fe203 разлагается
ЗРезОз 2Fe304 -)- 1 /202,
при температуре 1725 К давление кислорода будет 105 Па. Феррит железа Fe304 = Fe(Fe02)2— очень устойчивое соединение. Встречается в природе в виде магнетита — железной руды. При температурах выше 845 К Fe304 разлагается
2Fe304 ^6Fe0 + 02f; lg po2 = — 32 056/Г + lg T + 14,55;
при температурах ниже 845 К реакция идет сразу до железа:
|
Рис. 9.6. Нонвариат* ная система железа, его оксидов и кислорода |
1/2Fe304 ^3/2Fe + 02t; lgp02= — 28 264/7″ + lg T + 10,076. (9.15)
Основной оксид железа FeO легко окисляется и переходит, поглощая кислород, в Fe304 и потом в Fe203. При температурах выше 845 К оксид может разлагаться до железа:
2Fe0^2Fe + 02f; lgPo!=- 26 868/7’ + lg7’ + 8,4. (9.16)
Оксиды железа при Т = 845 К образуют нонвариантную систему (рис. 9.6) Fe304; FeO; Fe; Ог, существующую при строго определенных параметрах состояния (Г = 845 К; lgрог = = — 20,48).
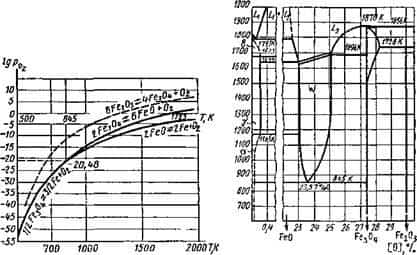 Рис. 9.7. Зависимость логарифма давления Рис. 9.8. Диаграмма плавкости сис- диссоциации оксидов железа от темпера — темы Fe—О (массовые доли) туры |
Уравнения (9.14)…(9.16) приведены по В. А. Кистяковскому, и совместным решением этих уравнений можно определить параметры нонвариантной системы.
Кривые давлений диссоциации по этим уравнениям приведены на рис. 9.7, но эти кривые характерны для насыщенных растворов. Области между кривыми характеризуют ненасыщенные растворы, которые могут существовать в системе железо — кислород в зависимости от температуры и концентрации кислорода. Такими фазами в системе железо — кислород будут:
L — жидкий раствор FeO в железе, предельную концентрацию можно определить по уравнению Н. Н. Доброхотова:
- lg[% FeO]Hac= — 6000/Г + 3,36; (9.17)
- Z.2 — жидкий раствор FeO в Fe3C4( ликвирующий с раствором L,
- 6 — твердый раствор FeO в 6-железе;
- у — твердый раствор FeO в у-железе (оксиаустенит);
- а — твердый раствор FeO в а-железе;
- W—твердый раствор FeO в Fe304, образующийся при кристаллизации L2 и существующий при температуре выше 845 К — вюстит.
Все эти фазы представлены на диаграмме плавкости системы Fe—О, которая приведена на рис. 9.8.
Наибольшее значение для металлургических процессов при сварке имеет область L, соответствующая сварочной ванне, поглощающей кислород. Она отделена от остальной сисемы линией, уравнение которой (9.17) приведено выше.
- Процессы в этой области: 2[FeO] 2[Fe] + 02f.
- раствор раствор газ
- Константа равновесия может быть записана так:
- Кр = Рсъ = p’oftlc/a FeO = f (7), (9.18)
где рЬг—давление диссоциации, зависящее не только от температуры, но и концентрации кислорода; po,— давление диссоциации для насыщенного раствора, зависящее только от температуры (AG0 = — RT In р02); aFe и aFe0 — активности компонентов раствора (см. рис. 9.7).
- Ввиду малой растворимости оксида железа в жидком железе [уравнение (9.17)] можно записать:
- aFe = Nfz jNve«ас « [% Fe] / [% Fe]Hac « 1; aFeo = /Vrco/AVeo нас « [% FeO] / [% FeO]пае.
- Подставляя эти значения в уравнение константы равновесия, получим
Ке = Ро2 = р’о, [ % FeO] V [ % FeO]2. (9..19)
- По формуле (9.19) можно найти энергию Гиббса для этого случая:
- р’ог = Рог [% FeO]2/[% FeO] „ас;
- AG = — RT In p’o, = AG° + 2RT In [% FeO] sac — 2RT ln[%FeO].
- (9.20)
Из полученных уравнений видно, что при [% FeO] -»- —>- О p’os —>- 0, а AG-voo, т. е. при любых малых концентрациях кислорода в газовой атмосфере жидкое железо будет его поглощать, окисляясь при этом, из-за чего в процессе сварки стали
любым способом не можем избежать окисления металла шва^и
|
Рис. 9.9. Нонвари — антная система меди, ее оксидов и |
должны принимать дополнительные меры для снижения содержания кислорода до допустимых пределов — раскисление.
Система медь — кислород. Медь с кислородом образует в основном два соединения: куприт Си20 и тенорит СиО, которые вместе с кислородом и металлической медью образуют при Т « 650 К нонвариантную систему (рис. 9.9). Медь — малоактивный металл и его оксиды относительно легко распадаются. Наиболее устойчивый оксид — Си20, образующий растворы в жидкой меди:
- 4Си + 02 ї=ї 2[Си20].
- КИСЛОрОДа жидк. раствор
- В растворе он повышает свою устойчивость, но в момент кристаллизации образуется эвтектика Си—Си20 и свободная фаза Си20 теряет свою устойчивость. «Водородная болезнь» меди, приводящая к разрушению металла, вызывается следующим процессом:
- 2 [Н] + Си20 2Си + Н20.
- Водород, растворенный в металле, взаимодействует с Си20, находящимся в эвтектике, и восстанавливает его до Си, но образующаяся при этом вода не может диффундировать в металл и разрушает его по границам зерен.
Диаграмма плавкости Си—О приведена на рис. 9.10. На диаграмме область L указывает на образование раствора Си20 — Си, но растворимость Си20 в твердой фазе ничтожно мала. Таким образом, при сварке меди и ее сплава необходимо принимать все меры для снижения степени ее окисления или вводить раскислители (см. п. 9.4).
Система никель — кислород. Никель с кислородом дает два соединения: №20з и NiO; Г4і20з малоустойчив, сильный окислитель и используется для получения электрической энергии в щелочных аккумуляторах. В условиях сварки он не может существовать.
|
Рис. 9.10. Диаграмма плавкости системы Си — О (массовые доли) |
| Рис. 9.11. Диаграмма плавкости системы Ni — О (массовые доли) |
Оксид NiO устойчивый, обладает основными свойствами, сильно растворим в жидком никеле, а в твердом никеле почти не растворяется. Диаграмма плавкости Ni—О приведена на рис. 9.11.
Процессы окисления при сварке для никеля рассчитывают так же, как для железа и меди, с учетом активности оксида в растворе.
Система титан — кислород. Титан с кислородом образует ряд осидов с различной степенью окислення: ТіО; Ті203; Ті305; Ті02, а также ряд субоксидов: Ті20; ТізО; ТібО. Кроме того, кислород может растворяться в твердом металле. Оксиды, особенно низшей степени окисления, обладают большой шириной области гомогенности. На рис. 9.
12 приведена фазовая диаграмма оксидов титана, в которой заштрихованные участки представляют собой двухфазные области. Диаграмма плавкости Ті—О для малых концентраций кислорода приведена на рис. 9.13 (по И. И. Корнилову).
Титан — весьма активный металл и его оксиды все термодинамически устойчивы, наиболее устойчив низший оксид ТЮ, повышающий свою устойчивость при растворении в жидком титане. Процессы диссоциации оксидов титана идут ступенчато:
- т,’°*
- ТЮ2————— V ТІ2О3 -► ТЮ -► Ті.
- рутил
Графики изменения значений AG0 в зависимости от температуры приведены на рис. 9.14, уравнения стандартного изменения энергии Гиббса по стандартным значениям энтальпий и энтропий приведены ниже:
- 6ТЮ2 ^ 2Ti305 — f 02f; AG° = 745 960-162,28 Т (кривая 1);
- 4Ti305 ^ 6Ti203 + 02f; AG° = 724 200-160,12 T (кривая 2);
- 2Ti2(W4TiO + 02f; AG° = 963 200-186,88 T (кривая 3);
- 2ТіО^* 2Ti + 02f; AG° = 1 036 780-196,54 T (кривая 4);
- 4Ti02 ^ 2Ti203 + Out; AG° = 718 400-159,96 T (кривая 5);
- Атомов кислорода на атом титана
|
0 0,2 0А 0,6 0,8 1,0 1,2 1,ц 1,6 1,8 2,0 1- Г~1— 1- 1— 1— 1- 1— 1- 1— 1—- 1—— 1—- 1 і — 1——— 1 1 1 rn 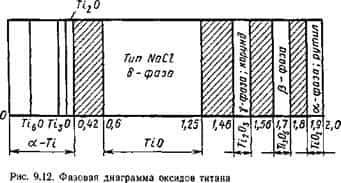
|
Г, К
|
/О 20 30 00 тл Рис. 9.13. Диаграмма плавкости системы Ті—О (атомные доли) для малых содержаний кислорода |
|
А0° кДж
Рис. 9.14. Изменение AG0 для ступенчатой диссоциации окси-і дов титана |
- 2500 2300 2/00 то то
- 1500
- то то
- ООО
- 700
Система алюминий — кислород. Алюминий образует один оксид А1203 (корунд) и два субоксида АЮ и А120, но субоксиды крайне неустойчивы. Корунд А1203 образует ряд гидратов и проявляет изоморфизм:
А1203 • ЗН20 -^ткА1203 • Н20 -§Z§5. v. А120з — ІШ*. а-А120з
- гидраргилит бемит у корунд а корунд
- Наиболее устойчивая форма оксида алюминия — а-корунд; А120з — амфотерный оксид, образующий соли как в кислой, так и в щелочной среде, чем пользуются при подготовке к сварке, протравливая поверхности соединяемых деталей и электродной проволоки._ Субоксиды алюминия получаются при сплавлении А120з с алюминием:
- А1203 + А1 ^ ЗАЮ (71 = 1773 К);
- А1203 + 4А1 ^ ЗА120 (Т = 1873 К) —
Оксиды алюминия не растворяются в металле и при поглощении кислорода при сварке образуют или пленки оксидов, или просто включения А1203. И то и другое сильно понижает качество сварных соединений.
Защита сварных швов от коррозии
Несмотря на то, что сварочное соединение одно из самых прочных, сам процесс сварки закладывает основу для ускоренного разрушения шва от коррозии. Чтобы этому противодействовать, применяют разные способы для предотвращения ржавления металла.
Давайте разберемся, что это за способы и какие из них наиболее доступны в бытовых и производственных условиях.
Сварочные швы начинают ржаветь быстрее основного металла. Это можно заметить на следующий день, осмотрев конструкцию, над которой трудились вчера.
Коррозия возникает на соединениях, созданных любым методом сварки (MMA, TIG, MIG) и не зависит от аппарата и его цены.
Образование ржавчины на швах обусловлено следующими причинами:
- После сварки процесс коррозии бывает наружный, внутренний или объединенный, что по-своему влияет на внешний вид соединения и ухудшение его характеристик. По типу коррозии существует:
Защита сварочного шва от коррозии выполняется при помощи химических, термических и механических процессов. Рассмотрев технологию, необходимые средства для каждого метода, получится выбрать подходящий для своих условий работы.
Отжиг
Чтобы убрать температурные напряжения в конструкции после сварки, изделие отжигают. Это происходит путем нагрева детали до 800 градусов. Затем его помещают в водный раствор натрий-хрома (3%), содержащий ингибиторы коррозии. Благодаря такой обработке напряжения сглаживаются, шов «впитывает» молекулы хрома. Это продлевает срок службы сварочного соединения и защищает от ржавчины.
Но для такого метода нужно оборудование и условия для нагрева изделия до 800 градусов. Это можно сделать при помощи газовой горелки или в крупной печи.
Затем требуется большая емкость, куда окунается деталь со сварочными швами. Следовательно, крупные конструкции в бытовых условиях обработать сложно.
Процесс по отжигу (нагреву и последующему охлаждению) занимает время, что сказывается на производительности при большой партии одинаковой продукции.
Анодирование
Электрохимический процесс, при котором защита сварных швов от возникновения коррозии достигается путем создания на поверхности особо прочной пленки. Процесс происходит в такой последовательности:
- Швы предварительно травят, обрабатывая азотной кислотой. Остальную поверхность просто обезжиривают растворителями (уайт-спирит, ацетон, бензин).
- В ванну на дно укладывают свинцовые листы. К ним присоединяют контакты с напряжением, чтобы проводник стал катодом.
- Емкость наполняют серной или хромовой кислотой. Чаще используют серную среду, поскольку процесс требует меньшего расхода электроэнергии. Хромовый ангидрид более дорогостоящий.
- К изделию подключают второй полюс, чтобы оно играло роль анода.
- Деталь погружается в ванну и подается напряжение. Происходит анодирование, создается устойчивый особо прочный верхний слой.
- Изделие извлекается и промывается горячей водой для удаления кислоты. Горячая вода содействует уменьшению пор в металле и уплотнению защитной пленки.
- Затем деталь сушат.
Для анодирования необходимо электричество, химические растворы и емкость, способная вместить конструкцию со сварочными швами. Следовательно, создать условия для такого метода защиты можно только на производстве. В быту получится организовать анодирование только для небольших изделий.
Лужение
Лужение сварочного шва — это наплавление на его поверхность другого материала, служащего защитой. Чаще всего используют олово или его сплавы, поскольку у них относительно невысокая температура плавления. Сварочный шов обрабатывают механически до нужного вида, толщины, формы.
Затем газовой горелкой или паяльной лампой разогревают поверхность соединения. Второй рукой подают в нагреваемую зону припой — оловянный стержень. Он постепенно плавится и олово растекается по поверхности основного металла.
Когда припой остывает, образуется прочная защитная пленка, устойчивая не только к образованию коррозии, но и механическому воздействию.
Метод можно реализовать в домашних условиях, в гараже или мастерской. Понадобится олово и паяльная лампа. Но сам процесс лужения долгий по времени, требует аккуратности и терпения.
Работа на вертикальных поверхностях осложняется законами гравитации — расплавленное олово скапывает вниз.
Поэтому способ защиты сварочного шва подойдет только как разовый, а для серийного применения нужно искать другой метод.
Шпаклевание, грунтование
Техника защиты часто используется в автомастерских для защиты швов при замене арок, порогов, других частей кузова автомобилей. После сварки швы зачищаются и шпаклюются, чтобы вывести ровную плоскость, скрыть следы сварочных работ.
Затем поверхность грунтуют, красят и покрывают лаком. Процесс очень кропотливый, требует большого опыта, навыка, иначе сварочный шов будет виден.
Если не качественно удалить ржавчину в околошовной зоне, коррозия продолжится под ЛКП и вскоре краску вспучит, потребуется все переделывать.
Подбор присадки и проволоки
При сварке нержавеющей стали часть легирующих элементов выгорает под действием высоких температур.
Чтобы компенсировать потери, выбирают проволоку с увеличенным содержанием хрома, благодаря чему шов остается максимально приближенным по составу к основному металлу.
Но такая технология защиты шва от коррозии применима только с легированными металлами. Для малоуглеродистой и углеродистой конструкционной стали аналогов нет.
Возможности сварочной химии
Наиболее простой способ защиты всех видов сварных соединений — применение сварочной химии. Это специальные средства, наносимые на швы после сварки, которые надежно защищают металл от ржавчины. Их можно использовать на любой поверхности (горизонтальной, вертикальной, потолочной). По консистенции сварочная химия бывает в виде пасты или спрея.

Пасты для защиты сварочных швов имеют разный принцип действия, что зависит от состава. Есть травильные пасты, применяющиеся для легированных сталей. Они восстанавливают коррозионностойкие свойства за счет серной, плавиковой и азотной кислот, находящихся в составе.
Другие пасты состоят из смеси синтетических масел. Они образуют на поверхности сварочного шва защитную пленку, устойчивую к:
Еще одни виды паст состоят из алкидной смолы. Они выполнены с металлическим блеском, напоминающим цинковое покрытие. Смола устойчива к солям, температурам от -50 до +240 градусов. Надежно изолирует шов от контакта с воздухом и водой.
Все виды защитных антикоррозионных паст не содержат вредных компонентов, поэтому безопасны для сварщика. Имеют желеобразную консистенцию, легко наносятся на вертикальные и потолочные поверхности, не стекают вниз.
Пасты с маслами обеспечивают дополнительную смазку, чтобы контактирующие со швом детали не стачивали верхний слой соединения. Нанесение пасты занимает минимум времени, поэтому не сказывается на производительности.

Спреи для защиты шва от коррозии изготавливаются на основе акриловой смолы, синтетического воска и пигментов нержавеющей стали. Бывают прозрачные, с серебристым или латунным оттенком, придающим изделию красивый вид. По применению они еще проще, чем пасты. После сварки требуется распылить средство по шву и окружающей поверхности.
Спреи и пасты для защиты швов могут наносить даже новички — особых знаний не нужно. Удобство работы во всех пространственных положениях с большими и малыми конструкциями делает их лучшим способом защиты от ржавчины.
Ответы на вопросы: защита сварных швов от коррозии Как долго спрей защищает сварочный шов от ржавчины?
Это зависит от состава. Срок защиты производитель указывает в характеристиках. Например, спреи на восковой основе, образующие прозрачную пленку, защищают в течение 3 месяцев. Этого достаточно, чтобы полностью собрать крупную конструкцию, транспортировать ее в другое место и там уже окрасить.
Можно ли удалить защитную пленку от спрея?
Да, перед окрашиванием или необходимостью в дальнейшей сварке пленка стирается очистителями, продающимися в специализированных магазинах.
Какую температуру выдерживает защитный спрей?
Большинство спреев выдерживают температуру до 200 градусов. Некоторые товары способны кратковременно переносить до 300 градусов. Пасты на основе синтетических масел сохраняют свои свойства при 1200 градусах.
Как наносить спрей на сварочный шов?
Необходимо дождаться остывания соединения. Нанесение проводят при комнатной температуре с расстояния 25 см до поверхности. Предварительно шов обрабатывают очистителем.
Как быстро высыхает антикоррозионная защита?
Большинство спреев на отлип высыхает спустя 10 минут. За деталь уже можно браться, переставлять ее. Полное отвердение наступает спустя 4-6 часов.
Остались вопросы
Оставьте Ваши контактные данные и мы свяжемся с Вами в ближайшее время
Процессы, протекающие при плавлении и остывании металла в сварном шве
Подробности Подробности Опубликовано 27.05.2012 13:32 Просмотров: 17287
В процессе сварки расплавленный металл сварочной ванны вступает во взаимодействие с газами, находящимися в пламени горелки или в воздухе.
В результате такого взаимодействия могут произойти испарение, окисление (соединение с кислородом) и выгорание компонентов (составляющих) металлического сплава, раскисление расплавленного металла, насыщение металла углеродом или водородом и другие явления.
Испарение металлов. При сварке металлы нагреваются до температуры, которая может быть равной или близкой к температуре кипения, в результате чего происходит1 их интенсивное испарение. Особенно легко испаряются цинк, магний, свинец.
Испарение металлов при сварке сплавов (особенно медно-цинковых, алюминиево-магниевых, железомарганцевых и других) может привести к значительному уменьшению концентрации отдельных составляющих, что в свою очередь повлечет за собой значительное изменение свойств металла.
Окисление металла при сварке. Металл окисляется преимущественно газами пламени горелки или при проникновении кислорода воздуха из окружающей среды. Некоторое значение может иметь и окисление расплавляемого металла окислами (окалина, ржавчина), находящимися на поверхности свариваемого металла или присадочной проволоки.
Растворяясь в стали, кислород вступает в соединение не только с железом, но и с примесями, что увеличивает общее содержание кислорода в стали. Наличие кислорода в стали (в виде окислов или в чистом виде) приводит к понижению механических свойств металла.
В процессе окисления содержание в металле некоторых элементов уменьшается, так как они выгорают. Так, при сварке стали выгорают углерод, кремний и марганец. В результате выгорания указанных элементов свойства стали изменяются.
Например, при выгорании углерода образуется окись углерода, которая, выходя из ванны, вызывает кипение ее и усиливает разбрызгивание металла сварочной ванны, — шов получается пористым с пониженными механическими свойствами.
Раскисление металла. При совместном существовании в жидком металле нескольких разнородных окислов между ними могут происходить химические реакции, в результате чего получаются соединения, имеющие температуру плавления ниже температуры плавления исходных окислов.
- Эта особенность облегчает удаление окислов из металла, так как полученные соединения, имея низкую температуру плавления, находятся все время в жидком состоянии и легко удаляются из расплавленной ванны.
- При сварке ряда металлов применяются флюсы, в состав которых входят компоненты, способствующие образованию таких легкоплавких соединений.
- Таким образом, под раскислением следует понимать удаление из металла кислорода, находящегося в нем в виде различных окислов.
Процессы раскисления и окисления происходят одновременно и взаимосвязано.
Так, например, восстановление окислов железа и стали в условиях сварки осуществляется преимущественно углеродом, кремнием и в небольшой степени марганцем, т. е.
при этом окисляются три элемента за счет кислорода окислов железа. Возможность протекания этих реакций зависит от температуры и процентного содержания элементов.
Наличие в стали легирующих примесей (кремния, марганца, хрома, титана и др.), которые легче окисляются, уменьшает окисление углерода, так как восстановление окислов железа происходит в основном за счет окисления этих примесей.
Раскисление сварочной ванны может в некоторой степени осуществляться углеродом, окисью углерода или водородом, имеющимися в пламени горелки. При этом пламя не только восстанавливает окислы, но и предохраняет расплавленный металл от окисления его кислородом и насыщения азотом воздуха, при растворении которых шов получается хрупким.
Нужно иметь в виду, что ацетиленокислородное пламя является слабым восстановителем, так как газы пламени действуют главным образом лишь на поверхности сварочной ванны.
Поэтому газовую смесь сварочного пламени по отношению к расплавленному железу правильнее рассматривать не как раскислитель, восстанавливающий окислы железа, а как защитную среду, затрудняющую доступ кислорода к сварочной ванне и замедляющую окисление металла.
Это особенно ярко выявляется при сварке высокоуглеродистых и высоколегированных сталей, а также при сварке меди, латуни, бронзы и алюминиевых сплавов, раскисление которых одним пламенем оказывается недостаточным. В таких случаях требуется применять флюсы, которые способствуют удалению окислов из металла.
Таким образом, для полного раскисления металла путем восстановления окислов, которые растворены в ванне, необходимо применять более сильные раскислители. Такими раскислителями, в частности, могут быть кремний и марганец. Вводить эти элементы можно путем применения специальных легированных присадочных проволок или путем нанесения специальных обмазок на малоуглеродистую сварочную проволоку.
Имеющиеся в проволоке отдельные примеси влияют на процесс сварки различно: одни примеси улучшают механические свойства металла шва, другие вызывают интенсивное образование газов или вязких и тугоплавких шлаков в сварочной ванне, что приводит к пористости металла шва и загрязнению его неметаллическими включениями.
Рассмотрим, как влияют отдельные элементы присадочной проволоки на процесс сварки.
Углерод при большом содержании усложняет сварку, вызывая значительное газообразование в ванне и кипение ее в процессе сварки, способствует нежелательному росту зерна металла шва и уменьшает его пластические свойства.
Нормальным содержанием углерода в присадочной проволоке для сварки малоуглеродистой стали следует считать 0,06—0,18%.
В присадочных стержнях для сварки серого чугуна количество углерода доводится до 3,5—4%, что необходимо для получения в шве структуры серого чугуна.
Марганец при содержании его в малоуглеродистой проволоке приблизительно до 1% является хорошим раскислителем. Более высокое содержание марганца приводит к нежелательному образованию в металле шва шлаков.
Если же в присадочной проволоке наряду с высоким содержанием марганца имеет место повышенное содержание углерода, то сварной шов может приобрести склонность к закалке.
В стержнях для сварки чугуна содержание марганца как элемента, способствующего отбеливанию чугуна, ограничивается 0,5-0,6%.
Кремний является раскислителем при сварке стали. При большом содержании его на поверхности ванны образуется тугоплавкий и вязкий шлак, препятствующий выходу газов из сварочной ванны при ее застывании. Металл шва при этом получается пористым и загрязненным шлаками. Поэтому в малоуглеродистой проволоке содержание кремния ограничивается 0,03%.
При раскислении и легировании наплавленного металла более благоприятные результаты дает проволока, содержащая в необходимых количествах одновременно как марганец, так и кремний.
Сера вызывает красноломкость сварного шва, способствует появлению в нем пористости и трещин. Поэтому содержание серы в проволоке допускается в количестве не более 0,03—0,04%. В чугуне сера также является вредной примесью, так как сообщает ему тугоплавкость, способствует образованию пор в металле шва. Содержание серы в чугунных прутках ограничивается 0,08%.
Фосфор вызывает хладноломкость стали, сильно понижает ее пластические свойства. Содержание фосфора в присадочной проволоке не должно быть выше 0,03—0,04%. В чугунных прутках содержание фосфора доходит до 0,5—0,8%, так как он способствует жидко текучести чугуна и хорошему заполнению расплавленным металлом резделки кромок чугунного изделия.
Помимо указанных элементов, в состав проволоки могут входить хром, никель, молибден. Содержание их в проволоке благоприятно влияет на качество сварки. Они способствуют раскислению металла шва, восполняют выгорающие элементы, улучшают химический состав металла шва.
При сварке меди для раскисления сварочной ванны применяют медную проволоку с небольшим содержанием фосфора, который является раскислителем по отношению к окиси меди.
Водород, имеющийся в пламени с избытком ацетилена, растворяясь в металле, ухудшает его свойства. Например, при сварке меди растворение водорода приводит к появлению пор и микротрещин. Аналогичные явления могут наблюдаться при растворении водорода в стали.
Растворение в металле шва серы и фосфора может происходить при большом содержании их соединений в пламени горелки. При увеличении содержания серы могут образоваться горячие трещины; Поэтому при сварке металлов, чувствительных к таким примесям (например, никеля), необходимо применять только хорошо очищенный ацетилен.
№83 Окисление и раскисление металла при сварке
Окисление и раскисление металла при сварке.
При сварке на воздухе расплавленный металл окисляется атомарным и ионным свободным или связанным кислородом. Свободным называют кислород, который получается в зоне дуги из атмосферы воздуха; связанным — кислород, находящийся в оксиде, например SiО2.
При сварке стали в значительном количестве окисляется железо, например
[Fe] + (1⁄2 О2) → [FeO], где квадратными скобками (как принято в теории металлургических процессов) обозначены вещества в металлическом, а круглыми — в шлаковом расплаве. В результате реакции получается низший оксид железа — закись железа FeO.
В сварочном расплаве закись железа растворяется в железе меньше, чем в сталеплавильной печи, что объясняется, прежде всего, малым промежутком времени, в течение которого происходит окисление и растворение компонентов при сварке.
При охлаждении сварочной ванны происходит обратное явление: закись железа (или отрицательные ионы кислорода) выпадают из раствора, так как их растворимость уменьшается со снижением температуры. Скорость охлаждения металла в сварочной ванне влияет на количество выпавшей закиси железа из раствора.
При относительно низких скоростях охлаждения закись железа полностью выпадает из раствора и располагается по границам зерен как более легкоплавкий компонент, затем при дальнейшем охлаждении ниже 570°С свободная закись железа преобразуется в более высший оксид железа Fe2О4(4FeО → Fe3О4 + Fe) в виде глобулей (шлаковых шариков), которые нарушают прочную связь между зернами и вызывают красноломкость металла, а при комнатной температуре — хрупкость.
- Кроме оксида железа металл шва засорен и другими оксидами, образующимися от окисления других элементов, например Mn, Si, С.
- Окисление марганца, кремния и углерода свободным кислородом протекает по формулам:
- [Мn] + (1⁄2 О2) →[МnО]
- [Si] + (21⁄2 О2) →[SiО2]
- [С] + (1⁄2 О2) → [СО]
- [СО] + (1⁄2 О2) →[СО2]
- Улучшение прочностных свойств стали достигается восстановительным процессом, называемым раскислением.
- Различают осаждающее и диффузионное раскисление.
- Сущность осаждающего раскисления сводится к тому, что железо восстанавливается из растворенной закиси железа металлом, обладающим более высоким химическим сродством к кислороду и дающим оксид с очень малой растворимостью в железе. Химическая реакция осаждающего раскисления
- [FeO] + (Ме) → [Fe] + (МеО).
- Оксид МеО выпадает при охлаждении из раствора в виде отдельной фазы (шлаковой частицы), всплывает на поверхность сварного шва и образует совместно с другими оксидами сварочный шлак.
В качестве осаждающих раскислителей при сварке применяют чистые материалы (С, Аl), ферросплавы (ферромарганец, ферросилиций, ферротитан и др.), комплексные раскислители (сплавы, содержащие два раскисляющих элемента и более одновременно).
- При подборе раскислителя учитывают его раскислительную способность. Например, при раскислении большим количеством углерода в процессе затвердевания расплава в шве могут от раскисления оставаться газы СО и СО2, образуя в швах поры:
- [FeO] + (С) → [СО] + [Fe]
- [FeO] + [СО] → [СО2] + [Fe]
- Чтобы этого не было, нужно иметь остаточного кислорода такое количество, которое обеспечивало бы кристаллизацию без излишнего количества газовыделений.
- Стремятся также к тому, чтобы продукты раскисления равномерно распределялись в металле шва.
Содержание азота или его вредное влияние в металле шва можно снизить при раскислении и введением в металл химических элементов, образующих с азотом нерастворимые в жидком металле нитриды, которые в лучшем случае поднимаются из металла шва в сварочный шлак, а в худшем случае — остаются в металле шва с незначительным ухудшением механических свойств. Например, алюминий, применяемый для раскисления железа, соединяется со свободным азотом, образуется нитрид алюминия Аl + N → A1N, который из сварочной ванны удаляется в шлаковую фазу.
При пользовании несколькими раскислителями подбирают их так, чтобы продуктами раскисления являлись бы основные, кислотные и амфотерные оксиды. Эти оксиды, соединяясь между собой, быстрее поднимаются вверх (в сварочный шлак) и не оказывают вредного влияния.
Сущность диффузионного раскисления состоит в том, что для удаления закиси железа из металлического расплава пользуются такими сварочными материалами (покрытием, флюсом, порошком), при плавлении которых образуются сложной структуры шлаки, восстановительные шлаки. Принципиальная химическая реакция диффузионного раскисления [FeO] + (SiО2) → (SiО2 · FeO).
В качестве минералов для диффузионного раскисления пользуются такими, в которых содержится малое количество оксидов основного металла.
При сварке сталей раскисление железа и других химических элементов стали обязательно, так как при существующей технологии в металле шва кислорода может оказаться больше, чем в свариваемом металле.