- Периодическая таблица химических элементов Менделеева: группы, периоды, металлы и неметаллы в ПСХЭ — свойства периодической системы
- Свойства химических элементов, а также формы и свойства образуемых ими веществ и соединений находятся в периодической зависимости от величины зарядов ядер их атомов
- Структура Периодической системы элементов
- Свойства Периодической системы элементов
- Элементы Периодической таблицы Менделеева
- Щелочные металлы
- Учите химию вместе с домашней онлайн-школой «Фоксфорда»! По промокоду CHEMISTRY892021 вы получите бесплатный недельный доступ к курсам химии за 8 класс и 9 класс
- Щелочноземельные металлы
- Лантаноиды и актиноиды
- Переходные металлы
- Неметаллы
- Подгруппа углерода
- Подгруппа азота
- Подгруппа кислорода
- Галогены
- Инертные газы
- Вопросы к параграфу 39 — ГДЗ по Химии 9 класс Учебник Рудзитис, Фельдман (решебник)
- 2. Чем по строению и свойствам кристаллические решётки металлов отличаются от ионных и атомных кристаллических решёток?
- 3. Каковы общие физические свойства металлов? Объясните эти свойства, основываясь на представлениях о металлической связи
- 4. Почему некоторые металлы пластичные (например, медь), а другие — хрупкие (например, сурьма)?
- 5. При «растворении» в соляной кислоте 12,9 г сплава, состоящего из меди и цинка, получили 2,24 л водорода (н. у.). Вычислите массовые доли (в процентах) цинка и меди в этом сплаве
- 6. Медно-алюминиевый сплав обработали 60 г соляной кислоты (массовая доля НСl — 10%). Вычислите массу и объём выделившегося газа (н. у.)
- Тестовые задания
- 1. Наиболее ярко металлические свойства проявляет простое вещество, атомы которого имеют строение электронной оболочки
- 1) 2е, 1е
- 2) 2е, 2е
- 3) 2е, Зе
- 4) 2е, 4е
- 2. Наиболее ярко металлические свойства проявляет простое вещество, атомы которого имеют строение электронной оболочки
- 1) 2е, 2е
- 2) 2е, 8е, 2е
- 3) 2е, 8е, 8е, 2е
- 4) 2е, 8е, 18е, 8е, 2е
- 3. Хорошо проводит электрический ток твёрдое вещество, имеющее кристаллическую решётку
- 1) молекулярную
- 2) атомную
- 3) металлическую
- 4) ионную
- Главные переходные металлы (d-элементы) и их соединения
- Характеристика переходных элементов – меди, хрома, железа по их положению в периодической системе химических элементов Д.И. Менделеева и особенностям строения их атомов
- Характерные степени окисления d элементов:
- В зависимости от плотности, металлы делят на лёгкие (плотность 0,53 ÷ 5 г/см³) и тяжёлые (5 ÷ 22,5 г/см³)
- 4.5 Категории химических элементов
Положение металлов в Периодической системе, особенности строения их атомов, физические свойства.
Большинство химических элементов в Периодической системе относится к металлам, они располагаются по диагонали от бора к астату. К металлам относятся девяноста два химических элемента.
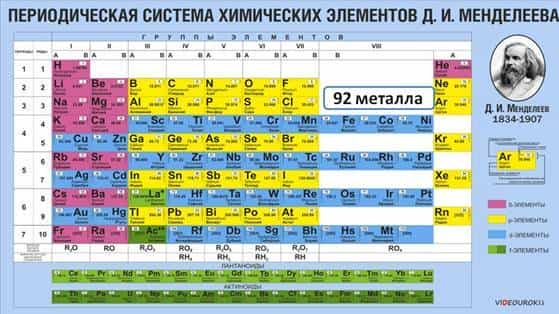
Каждый период (кроме первого) начинается металлом. Так, металлы IA группы называются щелочными металлами. К ним относятся: Li, Na, K, Rb, Cs, Fr.
Своё название они получили благодаря соответствующим гидроксидам, которые называются щелочами, т.е. растворимыми в воде основаниями.
Щелочные металлы имеют на внешнем энергетическом уровне только один электрон, который они легко отдают, при этом проявляют восстановительные свойства.
Ме0 – ē → Ме+
Причём восстановительные свойства в этой группе увеличиваются от лития к францию, как и радиусы атомов, поэтому растёт и способность к отдаче внешнего электрона. Химическая активность щелочных металлов по группе сверху вниз тоже увеличивается.
- Металлы IIA группы также являются типичными металлами и сильными восстановителями, так как в реакциях они отдают два своих электрона.
- Ме0 – 2ē → Ме2+
- Кальций, стронций и барий называют щелочноземельными элементами, потому что их оксиды, которые раньше называли «землями» при растворении в воде образуют щёлочи.
К металлам относятся и элементы IIIA группы кроме бора. У этих металлов на внешнем энергетическом уровне находится три электрона, которые они отдают и превращаются в ионы.
Ме0 – 3ē → Ме3+
В IVA группе к металлам относятся германий, олово, свинец, в VA группе металлами являются сурьма и висмут, в VIA группе – полоний, а в VIIA и VIIIA группе все элементы являются неметаллами.
Элементы побочных подгрупп все являются металлами. Их отличительной особенностью является то, что на внешнем уровне у них обычно содержится один или два электрона, остальные валентные электроны располагаются на предвнешнем слое. К металлам относятся и лантаниды, и актиниды, которые обычно располагаются ниже основной таблицы.
- Запомните:
- · у металлов сравнительно большие радиусы атомов
- · их внешние электроны значительно удалены от ядра и слабо с ним связаны
- · Атомы металлов содержат на внешнем уровне от одного до трех электронов
- · легко отдают электроны, превращаясь при этом в положительные ионы
- · являются восстановителями
- · Металлы не могут присоединять электроны.
- Однако деление элементов на металлы и неметаллы условно.
- Например, аллотропные модификации олова: так серое, или α-олово – неметалл, а белое, или β-олово – металл.
Такая модификация углерода, как алмаз – это неметалл, а графит имеет некоторые характерные свойства металлов.
Такие металлы, как цинк, хром, алюминий и другие – типичные металлы, но образуют оксиды и гидроксиды амфотерного характера. А теллур и йод – типичные неметаллы, но обладают некоторыми свойствами, характерными для металлов.
Физические свойства металлов.
Для металлов характерна металлическая химическая связь. В узлах кристаллической решётки располагаются атомы и положительные ионы металлов, которые связаны благодаря обобществлению внешних электронов, которые принадлежат всему кристаллу.
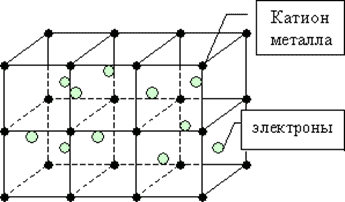
Для всех металлов характерно твёрдое агрегатное состояние, исключение составляет ртуть – она жидкая.
- Для большинства металлов характерен белый или серый цвет, только золото окрашено в желтый цвет, а медь в желто-красный.
- AuCu
Во-первых, для металлов характерна пластичность, которая проявляется в их ковкости, то есть они способны изменять форму под внешним воздействием и сохранять принятую форму после прекращения этого воздействия.
Из-за этого, металлы способны расплющиваться от удара или вытягиваться в проволоку. Эти свойства используют кузнецы. При этом слои смещаются относительно друг друга, но связь сохраняется благодаря «свободным» электронам.
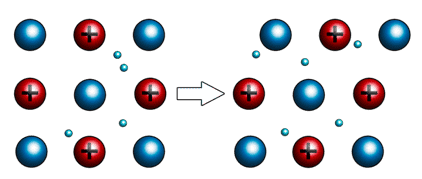
Наиболее пластичными являются золото, серебро, медь. Например, из золота можно изготовить «золотую фольгу» толщиной 0,003 мм, которую используют для золочения изделий.
Второе свойство металлов – это электропроводность. Оно обусловлено присутствием в их кристаллических решётках подвижных электронов, которые направленно перемещаются по действием электрического поля.
При нагревании колебательные движения ионов в кристалле усиливаются, что затрудняет направленное движение электронов и ведёт к снижению электрической проводимости.
А вот при охлаждении, электропроводность металлов усиливается, и близи абсолютного нуля переходят в сверхпроводимость.
Наибольшую электропроводность имеют серебро и медь, а наименьшую – марганец, свинец, ртуть и вольфрам.
Наличие свободных электронов в металлах объясняет и такое их свойство, как электро- и теплопроводность. Лучшими проводниками электрического тока являются: серебро, медь, золото, алюминий.
Третье физическое свойство металлов – это теплопроводность, это свойство тоже связано с высокой подвижностью свободных электронов.
Четвёртое свойство – металлический блеск связано с отражение световых лучей. Металлы обладают металлическим блеском. Свет поглощается поверхностью металла, и электроны начинают испускать свое излучение, которое мы воспринимаем как металлический блеск. Палладий, ртуть, серебро и медь лучше других отражают свет.
В порошкообразном состоянии большинство металлов теряет блеск, приобретая серую или чёрную окраску, но только алюминий и магний сохраняют блеск в порошке. Из алюминия, серебра и палладия изготавливают зеркала, в том числе и те, которые используются в прожекторах.
Самые твёрдые металлы – это металлы побочной подгруппы VIA группы. Например, хром по твёрдости напоминает алмаз. Наиболее твёрдыми ещё являются титан и молибден. Самые мягкие – щелочные металлы, например, натрий и калий легко режутся ножом.
По плотности различают легкие металлы, у которых плотность меньше 5 г/см3. К таким относятся щелочные и щелочноземельные металлы и алюминий. Из переходных металлов к ним относятся скандий, иттрий и титан. Они имеют большое значение в технике благодаря своей лёгкости и тугоплавкости.
Тяжелыми считаются металлы, у которых плотность больше 5 г/см3. Самым тяжелым является осмий, а самым лёгким – литий.
По температуре плавления металлы делятся на легкоплавкие, у которых эта температура меньше 1000 0С, и тугоплавкие, у которых она больше 1000 0С. Самым легкоплавким металлом является ртуть, а самым тугоплавким – вольфрам, из которого изготавливают нити накаливания для ламп. Кроме того, в конструкцию лампы входит ещё восемь металлов.
Лёгкие металлы, как правило, являются легкоплавкими, например, галлий может плавиться уже на ладони руки, а тяжёлые металлы, напротив, являются тугоплавкими.
Ряд государств, приняло решение о замене привычных ламп накаливания на более экономичные и долговечные современные лампы, например, галогенные, люминесцентные и светодиодные. Галогенная лампа – это тоже лампа накаливания с вольфрамовой нитью, заполненная инертными газами с добавкой паров галогенов (брома или йода).
- Люминесцентные лампы – это лампы дневного света, но они содержат ртуть, поэтому нуждаются в особом способе утилизации.
Светодиодные лампы – самые экономичные и долговечные (срок работы до 100 тыс. ч), но и самые дорогие из ламп.
- В технике металлы делятся на чёрные – это железо и его сплавы и цветные – это все остальные.
- Золото, серебро и платину, и некоторые другие металлы относят к драгоценным металлам.
Таким образом, следует запомнить, что большинство элементов в Периодической системе относятся к металлам, для металлов характерна металлическая кристаллическая решётка и металлическая химическая связь, которая обуславливает такие физические свойства металлов, как твёрдость, металлический блеск, ковкость и пластичность, тепло и – электропроводность. У металлов на внешнем энергетическом уровне от 1 до 3 электронов, поэтому они отдают свои электроны и проявляют восстановительные свойства.
Периодическая таблица химических элементов Менделеева: группы, периоды, металлы и неметаллы в ПСХЭ — свойства периодической системы
К середине XIX века учёные располагали множеством сведений о физических и химических свойствах разных элементов и их соединений. Появилась необходимость упорядочить эти знания и представить их в наглядном виде.
Исследователи из разных стран пытались создать классификацию, объединяя элементы по сходству состава и свойств веществ, которые они образуют. Однако ни одна из предложенных систем не охватывала все известные элементы.
Пытался решить эту задачу и молодой русский профессор Д.И. Менделеев. Он собирал и классифицировал информацию о свойствах элементов и их соединений, а затем уточнял её в ходе многочисленных экспериментов.
Собрав данные, Дмитрий Иванович записал сведения о каждом элементе на карточки, раскладывал их на столе и многократно перемещал, пытаясь выстроить логическую систему.
Долгие научные изыскания привели его к выводу, что свойства элементов и их соединений изменяются с возрастанием атомной массы, однако не монотонно, а периодически.
Так был открыт периодический закон, который учёный сформулировал следующим образом: «Свойства элементов, а потому и свойства образуемых ими простых и сложных тел, стоят в периодической зависимости от их атомного веса».

Своё открытие Менделеев совершил почти за 30 лет до того, как учёным удалось понять структуру атома. Открытия в области атомной физики позволили установить, что свойства элементов определяются не атомной массой, а зависят от количества электронов, содержащихся в нём. Поэтому современная формулировка закона звучит так:
Свойства химических элементов, а также формы и свойства образуемых ими веществ и соединений находятся в периодической зависимости от величины зарядов ядер их атомов
Этот принцип Менделеев проиллюстрировал в таблице, в которой были представлены все 63 известных на тот момент химических элемента. При её создании учёный предпринял ряд весьма смелых шагов.
- Во-первых, многочисленные эксперименты позволили Менделееву сделать вывод, что атомные массы некоторых элементов ранее были вычислены неправильно, и он изменил их в соответствии со своей системой.
- Во-вторых, в таблице были оставлены места для новых элементов, открытие которых учёный предсказал, подробно описав их свойства.
 Первый вариант Периодической таблицы элементов, составленной Д.И. Менделеевым.
Первый вариант Периодической таблицы элементов, составленной Д.И. Менделеевым.
Мировое научное сообщество поначалу скептически отнеслось к открытию русского химика. Однако вскоре были открыты предсказанные им химические элементы: галлий, скандий и германий.
Это разрушило сомнения в правильности системы Менделеева, которая навсегда изменила науку.
Там, где раньше учёному требовалось провести ряд сложнейших (и даже не всегда возможных в реальности) опытов — теперь стало достаточно одного взгляда в таблицу.
Существует легенда, якобы знаменитая таблица явилась Менделееву во сне. Но сам Дмитрий Иванович эту информацию не подтвердил.
Он действительно нередко засиживался над работой до поздней ночи и засыпал, продолжая размышлять над решением задачи, однако факт мистического озарения во сне учёный отрицал: «Я над ней, может быть, двадцать лет думал, а вы думаете, сел и вдруг — готово!».
Теперь расскажем, как устроена Периодическая таблица элементов Менделеева и как ею пользоваться.
Структура Периодической системы элементов
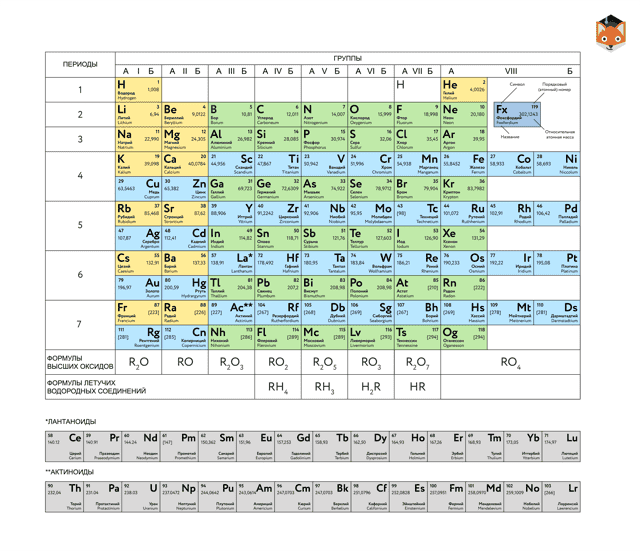 Периодическая таблица химических элементов
Периодическая таблица химических элементов
На настоящий момент Периодическая таблица Менделеева содержит 118 химических элементов. Каждый из них занимает своё место в зависимости от атомного числа. Оно показывает, сколько протонов содержит ядро атома элемента и сколько электронов в атоме находятся вокруг него. Атом каждого последующего элемента содержит на один протон больше, чем предыдущий.
Периоды — это строки таблицы. На данный момент их семь. У всех элементов одного периода одинаковое количество заполненных электронами энергетических уровней.
Группы — это столбцы. В группы в Периодической таблице объединяются элементы с одинаковым числом электронов на внешнем энергетическом уровне их атомов.
В кратком варианте таблицы, используемой в школьных учебниках, элементы разделены на восемь групп.
Каждая из них делится на главную (A) и побочную (B) подгруппы, которые объединяют элементы со сходными химическими свойствами.

Каждый элемент обозначается одной или двумя латинскими буквами. Порядковый номер элемента (число протонов в его ядре) обычно пишется в левом верхнем углу.
Также в ячейке элемента указана его относительная атомная масса (сумма масс протонов и нейтронов).
Это усреднённая величина, для расчёта которой используются атомные массы всех изотопов элемента с учётом их содержания в природе. Поэтому обычно она является дробным числом.
Чтобы узнать количество нейтронов в ядре элемента, необходимо вычесть его порядковый номер из относительной атомной массы (массового числа).
Свойства Периодической системы элементов
Расположение химических элементов в таблице Менделеева позволяет сопоставлять не только их атомные массы, но и химические свойства.
Вот как они изменяются в пределах группы (сверху вниз):
- Металлические свойства усиливаются, неметаллические ослабевают.
- Увеличивается атомный радиус.
- Усиливаются основные свойства гидроксидов и кислотные свойства водородных соединений неметаллов.
В пределах периодов (слева направо) свойства элементов меняются следующим образом:
- Металлические свойства ослабевают, неметаллические усиливаются.
- Уменьшается атомный радиус.
- Возрастает электроотрицательность.
Элементы Периодической таблицы Менделеева
По положению элемента в периоде можно определить его принадлежность к металлам или неметаллам. Металлы расположены в левом нижнем углу таблицы, неметаллы — в правом верхнем углу. Между ними находятся полуметаллы. Все периоды, кроме первого, начинается щелочным металлом. Каждый период заканчивается инертным газом.
Щелочные металлы

Первая группа главная подгруппа элементов (IA) — щелочные металлы. Это серебристые вещества (кроме цезия, он золотистый), настолько мягкие, что их можно резать ножом. Поскольку на их внешнем электронном слое находится только один электрон, они очень легко вступают в реакции. Плотность щелочных металлов меньше плотности воды, поэтому они в ней не тонут, а бурно реагируют с образованием щёлочи и водорода. Реакция идёт настолько энергично, что водород может даже загореться или взорваться. Эти металлы настолько активно реагируют с кислородом в воздухе, что их приходится хранить под слоем керосина (а литий — под слоем вазелина).
Учите химию вместе с домашней онлайн-школой «Фоксфорда»! По промокоду CHEMISTRY892021 вы получите бесплатный недельный доступ к курсам химии за 8 класс и 9 класс
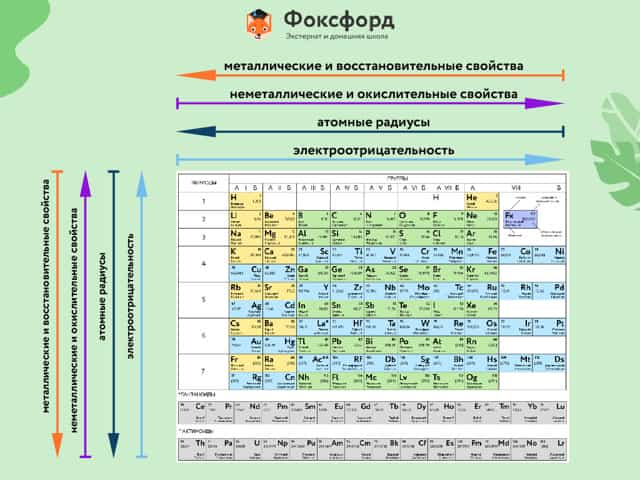
Щелочноземельные металлы
Вторая группа главная подгруппа (IIА) представлена щелочноземельными металлами с двумя электронами на внешнем энергетическом уровне атома. Бериллий и магний часто не относят к щелочноземельным металлам. Они тоже имеют серебристый оттенок и легко взаимодействуют с другими элементами, хотя и не так охотно, как металлы из первой группы главной подгруппы. Температура плавления щелочноземельных металлов выше, чем у щелочных. Ионы магния и кальция обусловливают жёсткость воды.
Лантаноиды и актиноиды
В третьей группе побочной подгруппе (IIIB) шестого и седьмого периодов находятся сразу несколько металлов, сходных по строению внешнего энергетического уровня и близких по химическим свойствам. У этих элементов электроны начинают заполнять третий по счёту от внешнего электронного слоя уровень. Это лантаноиды и актиноиды. Для удобства их помещают под основной таблицей.

Лантаноиды иногда называют «редкоземельными элементами», поскольку они были обнаружены в небольшом количестве в составе редких минералов и не образуют собственных руд.
Актиноиды имеют одно важное общее свойство — радиоактивность. Все они, кроме урана, практически не встречаются в природе и синтезируются искусственно.
Переходные металлы

Элементы побочных подгрупп, кроме лантаноидов и актиноидов, называют переходными металлами. Они вполне укладываются в привычные представления о металлах — твёрдые (за исключением жидкой ртути), плотные, обладают характерным блеском, хорошо проводят тепло и электричество. Валентные электроны их атомов находятся на внешнем и предвнешнем энергетических уровнях.
Неметаллы
Правый верхний угол таблицы до инертных газов занимают неметаллы.
Неметаллы плохо проводят тепло и электричество и могут существовать в трёх агрегатных состояниях: твёрдом (как углерод или кремний), жидком (как бром) и газообразном (как кислород и азот).
Водород может проявлять как металлические, так и неметаллические свойства, поэтому его относят как к первой, так и к седьмой группе Периодической системы.
Подгруппа углерода
Четвёртую группу главную подгруппу (IVА) называют подгруппой углерода. Углерод и кремний обладают всеми свойствами неметаллов, германий и олово занимают промежуточную позицию, а свинец имеет выраженные металлические свойства. Углерод образует несколько аллотропных модификаций — вариантов простых веществ, отличающихся по своему строению, а именно: графит, алмаз, фуллерит и другие.
Большинство элементов подгруппы углерода — полупроводники (проводят электричество за счёт примесей, но хуже, чем металлы). Графит, германий и кремний используют при изготовлении полупроводниковых элементов (транзисторы, диоды, процессоры и так далее).
Подгруппа азота
Пятую группу главную подгруппу (VA) называют пниктогенами или подгруппой азота. В ходе реакций эти элементы могут как отдавать электроны, так и принимать их, завершая внешний энергетический уровень.
Физические свойства элементов подгруппы азота различны. Азот является бесцветным газом. Фосфор, мягкое вещество, образует несколько вариантов аллотропных модификаций — белый, красный и чёрный фосфор. Мышьяк — твёрдый полуметалл, способный проводить электрический ток. Висмут — блестящий серебристо-белый металл с радужным отливом.
Азот — основное вещество в составе атмосферы нашей планеты. Некоторые элементы подгруппы азота токсичны для человека (фосфор, мышьяк, висмут). При этом азот и фосфор являются важными элементами почвенного питания растений, поэтому они входят в состав большинства удобрений. Азот и фосфор также участвуют в формировании важнейших молекул живых организмов — белков и нуклеиновых кислот.
Подгруппа кислорода
Халькогены или подгруппа кислорода — элементы шестой группы главной подгруппы (VIA). Для завершения внешнего электронного уровня атомам этих элементов не хватает лишь двух электронов, поэтому они проявляют сильные окислительные (неметаллические) свойства. Однако, по мере продвижения от кислорода к полонию они ослабевают.
Кислород образует две аллотропные модификации — кислород и озон — тот самый газ, который образует экран в атмосфере планеты, защищающий живые организмы от жёсткого космического излучения.
Кислород и сера легко образуют прочные соединения с металлами — оксиды и сульфиды. В виде этих соединений металлы часто входят в состав руд.
Галогены
Седьмая группа главная подгруппа (VIIA) представлена галогенами — неметаллами с семью электронами на внешнем электронном слое атома. Это сильнейшие окислители, легко вступающие в реакции. Галогены («рождающие соли») назвали так потому, что они реагируют со многими металлами с образованием солей. Например, хлор входит в состав обычной поваренной соли.
Самый активный из галогенов — фтор. Он способен разрушать даже молекулы воды, за что и получил своё грозное имя (слово «фтор» переводится на русский язык как «разрушительный»). А его «близкий родственник» — иод — используется в медицине в виде спиртового раствора для обработки ран.
Инертные газы
Инертные газы, расположенные в последней, восьмой группе главной подгруппе (VIIIA) — элементы с полностью заполненным внешним электронным уровнем. Они практически не способны участвовать в реакциях. Поэтому их иногда называют «благородными», проводя параллель с представителями высшего общества, которые брезгуют контактировать с посторонними.
У инертных газов есть удивительная способность: они светятся под действием электромагнитного излучения, поэтому используются для создания ламп. Так, неон используется для создания светящихся вывесок и реклам, а ксенон — в автомобильных фарах и фотовспышках.
Гелий обладает массой всего в два раза больше массы молекулы водорода, но, в отличие от последнего, не взрывоопасен и используется для заполнения воздушных шаров.
Вопросы к параграфу 39 — ГДЗ по Химии 9 класс Учебник Рудзитис, Фельдман (решебник)

Авторы: Рудзитис Г.Е., Фельдман Ф.Г.
Издательство: Просвещение
Тип: Учебник
Металлы в периодической таблице химических элементов Д.И. Менделеева располагаются преимущественно в I, II, III группах.
Строение атомов металлов от строения атомов неметаллов отличается тем, что у атомов металлов на внешнем энергетическом уровне чаще всего располагается от одного до трёх элементов, атомы металлов обладают большим радиусом.
2. Чем по строению и свойствам кристаллические решётки металлов отличаются от ионных и атомных кристаллических решёток?
| Металлическая кристаллическая решётка | Ионная кристаллическая решётка | Атомная кристаллическая решётка |
| Сходства | В узлах решётки — катионы металлов. | в узлах решётки — нейтральные атомы. |
| Различия | Нет анионов, есть нейтральные атомы. | Есть катионы металлов и относительно свободные электроны. |
3. Каковы общие физические свойства металлов? Объясните эти свойства, основываясь на представлениях о металлической связи
Особое строение кристаллической решётки — наличие свободных электронов — объясняет физические свойства металлов, такие как пластичность (изменение формы при ударе), хорошая ковкость, металлический блеск, непрозрачность (свободные электроны взаимодействуют с падающими на металл квантами света), электропроводность (направленное движение свободных электронов от отрицательного к положительному полюсу под влиянием разности потенциалов), теплопроводность (высокая подвижность свободных электронов и колебание атомов, из-за чего температура по массе металла быстро выравнивается).
4. Почему некоторые металлы пластичные (например, медь), а другие — хрупкие (например, сурьма)?
При увеличении числа электронов на внешнем энергетическом уровне обеспечивается прочность отдельных слоёв ионов, препятствует их свободному скольжению, уменьшая пластичность. У меди на внешнем энергетическом уровне 1 электрон, у сурьмы — 5.
5. При «растворении» в соляной кислоте 12,9 г сплава, состоящего из меди и цинка, получили 2,24 л водорода (н. у.). Вычислите массовые доли (в процентах) цинка и меди в этом сплаве

6. Медно-алюминиевый сплав обработали 60 г соляной кислоты (массовая доля НСl — 10%). Вычислите массу и объём выделившегося газа (н. у.)

Тестовые задания
1. Наиболее ярко металлические свойства проявляет простое вещество, атомы которого имеют строение электронной оболочки
1) 2е, 1е
2) 2е, 2е
3) 2е, Зе
4) 2е, 4е
1) 2е, 1е
2. Наиболее ярко металлические свойства проявляет простое вещество, атомы которого имеют строение электронной оболочки
1) 2е, 2е
2) 2е, 8е, 2е
3) 2е, 8е, 8е, 2е
4) 2е, 8е, 18е, 8е, 2е
4) 2е, 8е, 18е, 8е, 2е
3. Хорошо проводит электрический ток твёрдое вещество, имеющее кристаллическую решётку
1) молекулярную
2) атомную
3) металлическую
4) ионную
3) металлическую
Вам также может понравиться
Главные переходные металлы (d-элементы) и их соединения
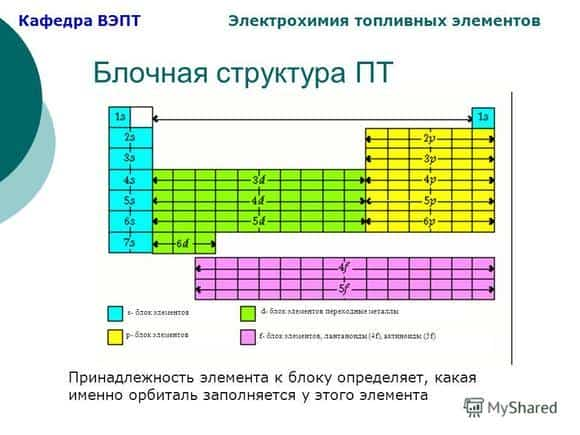
Все d-элементы являются металлами. Элементы образуют три переходных ряда — в 4-м, 5-м и 6-м периодах соответственно. Многие переходные металлы и их соединения используются в качестве катализаторов.
Согласно более строгому определению, переходными называются элементы с валентными d— или f-электронами. Первый переходный ряд включает 10 элементов, от скандия до цинка. Он характеризуется внутренней застройкой 3d-орбиталей. Дело в том, что полузаполненные или заполненные d—подоболочки обладают большей устойчивостью, чем частично заполненные.
Характеристика переходных элементов – меди, хрома, железа по их положению в периодической системе химических элементов Д.И. Менделеева и особенностям строения их атомов
Большинство d-элементов кристаллизуется не в одной, а в нескольких формах. Цинк не входит в число переходных элементов. Его физические и химическиесвойства не позволяют относить его к переходным металлам. В частности, в своих соединениях он обнаруживает только одно состояниеокисления и не проявляет каталитической активности.
Химические свойства этих элементов определяются участием в реакциях электронов обеих указанных оболочек. Хром и медь имеют на своих 4s-орбиталях всего по одному электрону. Такая подоболочка является полузаполненной.
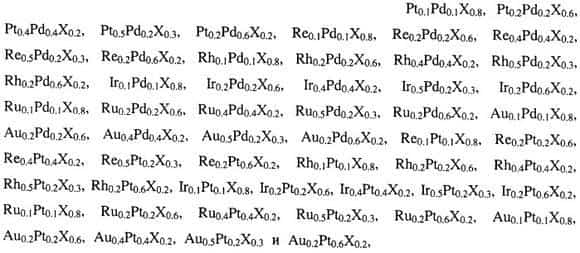
Характерные степени окисления d элементов:
Это металл средней активности. Ее наиболее устойчивые степени окисления +2 и +1. В ряду напряжений металлов медь находится после водорода, ее химическая активность не очень велика. Оксиды меди: Cu2O CuO.
Последний и гидроксид меди Cu(OH)2 проявляют амфотерные свойства с преобладанием основных. Цинк относится к металлам средней активности, в своих соединениях проявляет единственную степень окисления +2.
Оксид и гидроксид цинка являются амфотерными.

Электроны заполняют 4/-, а не 5(/-подуровень потому, что в этом случае атом обладает меньшей энергией. Поэтому в большинстве своих соединений лантаноиды имеют степень окисления -1-3, а не +2. Это обстоятельство объясняет близость свойст лантаноидов к свойствам элементов подгруппы скандия.
В зависимости от плотности, металлы делят на лёгкие (плотность 0,53 ÷ 5 г/см³) и тяжёлые (5 ÷ 22,5 г/см³)
Поскольку число валентных электронов заметно меньше числа орбиталей, то простые вещества, образованные переходными элементами, являются металлами. Для всех переходных элементов характерно образование комплексных соединений.
Таблицапереходных металлов. При образовании соединений атомы металлов могут использовать не только валентные s- и p-электроны, но и d-электроны.
Поэтому для d-элементов гораздо более характерна переменная валентность, чем для элементов главных подгрупп.
Поэтому в своих соединениях они проявляют положительные степени окисления. Есть три примечательных элемента из семейства переходных металлов. Без переходных металлов наш организм существовать не может.
Железо – это действующее начало гемоглобина. Кобальт – центр витамина В-12. Медь, марганец и молибден, а также некоторые другие металлы входят в состав ферментов.
Большое использование сплавов переходных металлов: сталь, чугун, бронза, латунь, победит.
Сплавы даже разделяют на черные и цветные по содержанию в них железа. Слово «металл» заимствовано из немецкого языка. Отмечается в «Травнике» Николая Любчанина, написанном в 1534 году: «…злато и серебро всех металей одолеваетъ». Бо́льшая часть металлов присутствует в природе в виде руд и соединений. Они образуют оксиды, сульфиды, карбонаты и другие химические соединения.
При необходимости проводят легирование и другую обработку металлов. Металлургия различает руды чёрных металлов (на основе железа) и цветных (в их состав не входит железо, всего около 70 элементов). Золото, серебро и платина относятся также к драгоценным (благородным) металлам.
Металлы извлекают из земли в процессе добычи полезных ископаемых. Добытые руды служат относительно богатым источником необходимых элементов. Для выяснения нахождения руд в земной коре используются специальные поисковые методы, включающие разведку и исследование рудных месторождений.
Железо находится в 4-м периоде, в VIII группе, в побочной подгруппе. Эти элементы занимают в периодической таблице переходное положение между электроположительными s-элементами и электроотрицательными p-элементами.
4.5 Категории химических элементов
Левая нижняя часть блока таблицы содержит типичные металлы, правая верхняя — типичные неметаллы. Элементы, занимающие места на границе между металлами и неметаллами, иногда называют полуметаллами.
Мета́ллы
Металлы – это химические элементы, атомы которых отдают электроны с внешнего или предвнешнего энергетического уровней, образуя при этом положительно заряженные ионы.Из 114 элементов, известных в настоящее время, 96 являются металлами. Металлы и их соединения играют важную роль в минеральной и органической жизни Земли.
Атомы и ионы металлов входят в состав важнейших соединений, участвующих в жизнедеятельности растений, животных и человека.
Практически все металлы имеют сравнительно большие радиусы и малое, от 1 до 3, число электронов на внешнем энергетическом уровне, исключения составляют только германий, олово, свинец (4 электрона), сурьма, висмут (5 электронов) и полоний (6 электронов).
Для атомов металлов характерны низкие значения электороотрицательности и восстановительные свойства.
В Периодической системе химических элементов Д.И. Менделеева металлы располагаются ниже диагонали бериллий – астат.
Элементы, расположенные вблизи диагонали, например, бериллий, алюминий, титан, германий, сурьма обладают двойственным характером и относятся к металлоидам. Металлы располагаются в начале периодов, к ним относятся s-элементы 1 и 2 групп, р-элементы 13 группы, все, кроме бора, 14 группы: германий, олово, свинец, 15 группы: сурьма, висмут, а также все d- и f- элементы.
Физические свойства металлов
Все металлы в большей или меньшей степени обладают металлическим блеском, довольно высокой плотностью, тепло- и электропроводностью, положительным температурным коэффициент сопротивления, высокой пластичностью и металлическим блеском.
Твердость металлов различна, так же значительно различаются их температуры плавления и кипения
Неметаллы
Неметаллы – это химические элементы, атомы которых принимают электроны для завершения внешнего энергетического уровня, образуя при этом отрицательно заряженные ионы.
Практически все неметаллы имеют сравнительно малые радиусы и большое число электронов на внешнем энергетическом уровне от 4 до 7, для них характерны высокие значения электроотрицательности и окислительные свойства.
Химических элементов-неметаллов всего 16, но два из них, кислород и кремний составляют 76 % от массы земной коры. Неметаллы составляют 98,5 % от массы растений и 97,6 % от массы человека. Из углерода, водорода, кислорода, серы, фосфора и азота состоят все важнейшие органические вещества, они являются элементами жизни.
Водород и гелий – основные элементы Вселенной из них состоят все космические объекты, включая наше Солнце. Без соединений неметаллов невозможно представить нашу жизнь, особенно если вспомнить, что жизненно важное химическое соединение – вода – состоит из водорода и кислорода.
Если большинство элементов-металлов не окрашены, исключение составляют только медь и золото, то практически все неметаллы имеют свой цвет: фтор – оранжево-желтый, хлор – зеленовато-желтый, бром – кирпично-красный, йод – фиолетовый, сера – желтая, фосфор может быть белым, красным и черным, а жидкий кислород – голубой.
Физические свойства неметалловВсе неметаллы не проводят тепло и электрический ток, поскольку у них нет свободных носителей заряда – электронов, все они использованы для образования химических связей. Кристаллы неметаллов непластичные и хрупкие, так как любая деформация приводит к разрушению химических связей. Большинство из неметаллов не имеют металлического блеска.
Полуметаллы
Химические элементы которые могут проявлять лишь слабые металлические свойства.Полуметаллы расположены примерно вдоль диагонали, проходящей от левого верхнего к правому нижнему углу блока р-элементов в Периодической таблице.Полуметаллы имеют ковалентную кристаллическую решетку при наличии металлической проводимости (электропроводности).Валентных электронов у них либо недостаточно для образования полноценной «октетной» ковалентной связи (как в боре), либо они не удерживаются достаточно прочно (как в тeллуре или полонии) из-за больших размеров атома. Поэтому связь в ковалентных кристаллах этих элементов имеет частично металлический характер.
Некоторые полуметаллы (кремний, германий) являются полупроводниками. Полупроводниковые свойства этих элементов объясняются многими сложными причинами, но одна из них — существенно меньшая (хотя и не нулевая) электропроводность, объясняемая слабой металлической связью. Роль полупроводников в электронной технике чрезвычайно важна.






