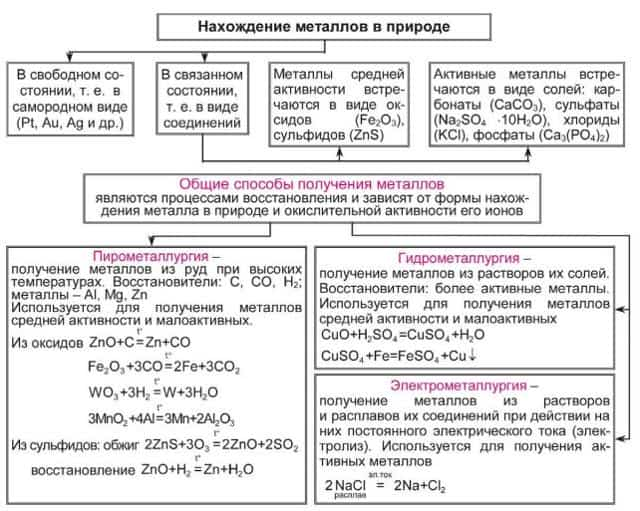
- Общие способы получения металлов
- Пирометаллургия
- Гидрометаллургия
- Электрометаллургия
- Общие способы получения металлов
- Получение металлов — урок. Химия, 9 класс
- § 81. Способы промышленного получения металлов [1971 Ходаков Ю.В., Эпштейн Д.А., Глориозов П.А. — Неорганическая химия. Учебник для 9 класса]
- Химия. 11 класс

Основные способы получения металлов
Урок в 11 классе

- Способы получения металлов
- обычно разделяют на три типа:
- пирометаллургические — восстановление при высоких температурах;
- гидрометаллургические — восстановление из солей в растворах;
- электрометаллургические — электролиз раствора или расплава.

- Пирометал-лургически
- получают : чугун, сталь, медь, свинец, никель, хром и другие металлы.
- Доменный процесс –
- получение стали и чугуна

Гидрометаллургически получают : золото, цинк, никель и некоторые другие металлы.
Получаемые металлы: Cd, Ag, Au, Cu, Zn, Mo и др.
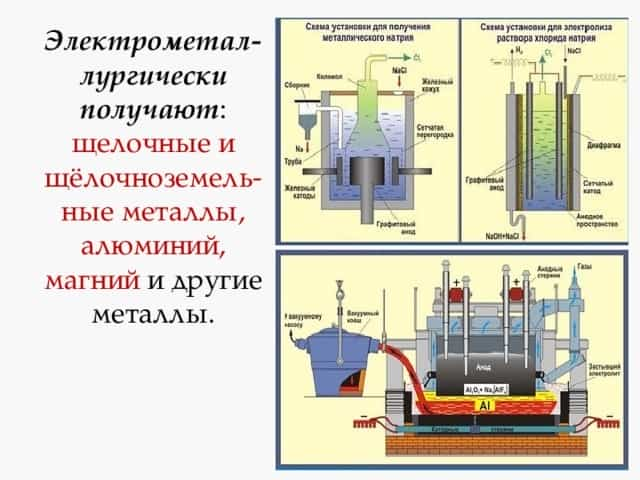
Электрометал-лургически получают : щелочные и щёлочноземель-ные металлы, алюминий, магний и другие металлы.

- Общие способы получения металлов
- 1. Восстановление металлов из оксидов углем или угарным газом
- Например,
- Mе x O y + C = CO 2 + Me,
- 1. ZnO y + C t = CO + Zn
- Mе x O y + C = CO + Me,
- 2. Fe 3 O 4 + 4CO t = 4CO 2 + 3Fe
- 3. MgO + C t = Mg + CO
- Mе x O y + CO = CO 2 + Me
- Не подходит для металлов, образующих карбиды с углём.
- получают : Fe, Cu, Pb, Sn, Cd, Zn

- Общие способы получения металлов
- 2. Обжиг сульфидов с последующим восстановлением (если металл находится в руде в виде соли или основания, то последние предварительно переводят в оксид)
- Например,
- 1 стадия –
- Mе x S y +O 2 = Mе x O y +SO 2
- 1. 2ZnS + 3O 2 t = 2ZnO + 2SO 2 ↑
- 2 стадия –
- Mе x O y + C = CO 2 + Me или
- 2. MgCO 3 t = MgO + CO 2 ↑
- Mе x O y + CO = CO 2 + Me

- Общие способы получения металлов
- 3 Алюмотермия ( в тех случаях, когда нельзя восстановить углём или угарным газом из-за образования карбида или гидрида )
- Например,
- 1. 4SrO + 2Al t = Sr(AlO 2 ) 2 + 3Sr
- Mе x O y + Al = Al 2 O 3 + Me
- получают: Mn, Cr, Ti, Mo, W, V и др
- 2. 3MnO 2 + 4Al t = 3Mn + 2Al 2 O 3
- 3. 2Al + 3BaO t = 3Ba + Al 2 O 3 (получают барий высокой чистоты)

- Общие способы получения металлов
- 4. Водородотермия — для получения металлов особой чистоты
- Например,
- 1. WO 3 + 3H 2 t = W + 3H 2 O↑
- Mе x O y + H 2 = H 2 O + Me
- 2. MoO 3 + 3H 2 t = Mo + 3H 2 O↑
- Получают металлы большей чистоты : Cu, Ni, W, Fe, Mo, Cd, Pb

Восстановление металлов электрическим током (электролиз)
А) Щелочные и щелочноземельные металлы получают в промышленности электролизом расплавов солей ( хлоридов ):
2NaCl расплав, электр. ток. 2 Na + Cl 2 ↑
CaCl 2 расплав, электр. ток. Ca + Cl 2 ↑
расплавов гидроксидов :
4NaOH расплав, электр. ток. 4Na + O 2 ↑ + 2H 2 O
(!!! используют изредка для Na)
Восстановление металлов электрическим током (электролиз)
Б) Алюминий в промышленности получают в результате электролиза расплава оксида алюминия в криолите Na 3 AlF 6 (из бокситов):
2Al 2 O 3 расплав в криолите, электр. ток. 4Al + 3 O 2 ↑
В) Электролиз водных растворов солей используют для получения металлов средней активности и неактивных:
2CuSO 4 +2H 2 O раствор, электр. ток. 2Cu + O 2 + 2H 2 SO 4
- Металл, который получают
- Способ получения
- Щелочные металлы, Ca, Sr
- 5А
- Ba
- 3
- Al
- 5Б
- Fe в виде сплавов
- 1
- Для получения металлов средней активности и неактивных:
- 5В
- Примеры заданий по теме : «Общие способы получение металлов»
- Задания с выбором ответа ( А10, А24, А29).
- А1. Реакция возможна между
- 1) Ag и K 2 SO 4 (р-р)
- 2) Zn и KCl (р-р)
- 3) Mg и SnCl 2 (р-р)
- 4) Ag и CuSO 4 (р-р)
А2. Какой из металлов вытесняет железо из сульфата железа (II)?
1) Cu 2) Zn 3) Sn 4) Hg
A3. Какой из металлов вытесняет медь из сульфата меди (II)?
- 1) Zn 2) Ag 3) Hg 4) Au
- A4. Формула вещества, восстанавливающего оксид меди (II) — это
- 1) CO 2 2) H 2 3) HNO 3 4) Cl 2
- A5. Формула вещества, не восстанавливающего оксид железа (III) —
- 1) HCl 2) Al 3) H 2 4) C
- А6. Для осуществления превращений в соответствии со схемой:
- Al(OH) 3 → AlCl 3 → Al необходимо последовательно использовать
- 1) хлор и водород
- 2) хлорид натрия и водород
- 3) хлороводород и цинк
- 4) соляную кислоту и калий
- А7. Пирометаллургический метод получения металлов отражает реакция:
- 1) HgS + O 2 → Hg + SO 2
- 2) CuSO 4 + Fe → FeSO 4 + Cu
- 3) 2NaCl (ток)→ 2Na + Cl 2
- 4) CuSO 4 + Zn → ZnSO 4 + Cu
- А8. Гидрометаллургический метод получения металлов отражает реакция:
- 1) HgS + O 2 → Hg + SO 2
- 2) CuSO 4 + Fe → FeSO 4 + Cu
- 3) 2NaCl (ток)→ 2Na + Cl 2
- 4) AlCl 3 + 3K → Al + 3KCl
- А9. В качестве восстановителя при выплавке железа в промышленности
- наиболее часто используют
- 1) водород
- 2) алюминий
- 3) натрий
- 4) кокс
- А10. Оксид углерода (II) проявляет восстановительные свойства при нагревании с
- 1) N 2 2) H 2 S 3) Fe 4) Fe 2 O 3
- Задания с кратким ответом (В3)
- В1. При электролизе раствора AgNO 3 на катоде выделяется
- 1) серебро
- 2) водород
- 3) серебро и водород
- 4) кислород и водород
- В2. Установите соответствие между формулой вещества и продуктом электролиза его водного раствора
- ФОРМУЛА ВЕЩЕСТВА ПРОДУКТЫ ЭЛЕКТРОЛИЗА
- ВОДНОГО РАСТВОРА
- А) AgF 1) Ag, F 2
- Б) NaNO 3 2) Ag, O 2 , HF
- B) Pb(NO 3 ) 2 3) H 2 , O 2
- Г) NaF 4) Pb, O 2 , HNO 3
- 5) H 2 , NO 2 , O 2
- 6) NaOH, H 2 , F 2
- В3. Установите соответствие между формулой вещества и продуктом электролиза его водного раствора
- ФОРМУЛА ВЕЩЕСТВА ПРОДУКТЫ ЭЛЕКТРОЛИЗА ВОДНОГО РАСТВОРА ВОДНОГО РАСТВОРА
- А) HgCl 2 1) металл, хлор
- Б) AlCl 3 2) водород, хлор, гидроксид
- В) Hg(ClO 4 ) 2 металла
- Г) Na 2 SO 3 3) водород, кислород
- 4) металл, кислород, кислота
- 5) металл, сернистый газ
- 6) водород, сернистый газ
- В4. Установите соответствие между формулой вещества и продуктом электролиза его водного раствора
- ФОРМУЛА ВЕЩЕСТВА ПРОДУКТЫ ЭЛЕКТРОЛИЗА
- ВОДНОГО РАСТВОРА
- А) нитрат цинка 1) цинк, кислород, азотная кислота
- Б) бромид цинка 2) водород, кислород
- В) бромид калия 3) водород, оксид азота (IV)
- Г) нитрат калия 4) цинк, бром
- 5) водород, бром, гидроксид калия
- 6) калий, бром
- 7) калий, оксид азота (IV)
- В5. Установите соответствие между формулой вещества и продуктом электролиза его водного раствора, образующимся на като-де
- ФОРМУЛА ВЕЩЕСТВА ПРОДУКТЫ ЭЛЕКТРОЛИЗА
- ВОДНОГО РАСТВОРА
- А) Li 2 SO 4 1) H 2
- Б) Ba(OH) 2 2) O 2
- В) MgCl 2 3) Cl 2
- Г) SnCl 2 4) Li
- 5) Ba
- 6) Mg
- 7) Sn
В6. Верны ли следующие суждения о промышленных способах получения металлов?
А. В основе пирометаллургии лежит процесс восстановления металлов из руд при высоких температурах.
Б. В промышленности в качестве восстановителей используют оксид углерода (II) и кокс.
- 1) верно только А
- 2) верно только Б
- 3) верны оба суждения
- 4) оба суждения неверны
- В7. Установите соответствие между металлом и способом его
- электролитического получения.
- МЕТАЛЛ ЭЛЕКТРОЛИЗ
- А) натрий 1) водного раствора солей
- Б) алюминий 2) водного раствора гидроксида
- В) серебро 3) расплава поваренной соли
- Г) медь 4) расплавленного оксида
- 5) раствора оксида в расплав-
- ленном криолите
- 6) расплавленного нитрата
В8. Установите соответствие между металлом и способом его электролитического получения.
- МЕТАЛЛ ЭЛЕКТРОЛИЗ
- А) калий 1) расплавленного нитрата
- Б) магний 2) водного раствора гидроксида
- В) медь 3) расплава хлорида
- Г) свинец 4) расплавленного оксида
- 5) раствора оксида в расплавленном криолите
- 6) водного раствора солей
В9. Установите соответствие между металлом и способом его электролитического получения.
- МЕТАЛЛ ЭЛЕКТРОЛИЗ
- А) хром 1) водного раствора солей
- Б) алюминий 2) водного раствора гидроксида
- В) литий 3) расплава соли
- Г) барий 4) расплавленного оксида
- 5) раствора оксида в расплав-
- ленном криолите
- 6) расплавленного нитрата
- Задания с развёрнутым ответом (С2)
- С1. Напишите уравнения реакций, с помощью которых можно осуществить превращения:
- Cu → Cu(NO 3 ) 2 → Cu(OH) 2 → Х → Сu → CuSO 4
- Укажите условия протекания реакций.
C2. Даны вещества: алюминий, оксид марганца (IV), водный раствор сульфата меди и концентрированная соляная кислота.
Напишите уравнения четырёх возможных реакции между этими веществами.
Общие способы получения металлов
Значительная химическая активность металлов (взаимодействие с кислородом воздуха, другими неметаллами, водой, растворами солей, кислотами) приводит к тому, что в земной коре они встречаются главным образом в виде соединений: оксидов, сульфидов, сульфатов, хлоридов, карбонатов и т. д. В свободном виде встречаются металлы, расположенные в ряду напряжений правее водорода (Аg, Нg, Рt,Аu, Сu), хотя гораздо чаще медь и ртуть в природе можно встретить в виде соединений.
- Минералы и черные породы, содержащие металлы и их соединения, из которых выделение чистых металлов технически возможно и экономически целесообразно, называют рудами .
- Получение металлов из руд — задача металлургии.
- Металлургия — это и наука о промышленных способах получения металлов из руд, и отрасль промышленности.
- Любой металлургический процесс — это процесс восстановления ионов металла с помощью различных восстановителей. Суть его можно выразить так:
- М n+ + ne−→M
- Чтобы реализовать этот процесс, надо учесть активность металла, подобрать восстановитель, рассмотреть технологическую целесообразность, экономические и экологические факторы.
-

- В соответствии с этим существуют следующие способы получения металлов:
- • пирометаллургический;
- • гидрометаллургический;
- • электрометаллургический.
Пирометаллургия
- Пирометаллургия — восстановление металлов из руд при высоких температурах с помощью углерода, оксида углерода (II), водорода, металлов — алюминия, магния.
- Например, олово восстанавливают из касситерита СнО 2 , а медь — из куприта Cu 2 O
- прокаливанием с углем (коксом):
- SnО 2 + 2С = Sn + 2СО ↑; Cu 2 O + С = 2Cu+ СО ↑
- Сульфидные руды предварительно подвергают обжигу при доступе воздуха, а затем полученный оксид восстанавливают углем:
- 2ZnS + 30 2 = 2ZnО + 2SO 2 ↑; ЗнО + С = Zn + СО ↑ сфалерит (цинковая обманка)
Из карбонатных руд металлы выделяют также путем прокаливания с углем, т. к. карбонаты при нагревании разлагаются, превращаясь в оксиды, а последние восстанавливаются углем:
- FeСO3 = FеО + СO 2 ↑ ; FеО + С = Fе + СО ↑ сидерит (шпатовый железняк)
- Восстановлением углем можно получить Фе, Су, Zn, Сд, Ge, Sn, Рб и другие металлы, не образующие прочных карбидов (соединений с углеродом).
- В качестве восстановителя можно применять водород или активные металлы:
- 1) МоO 3 + ЗН 2 = Мо + ЗН 2 O (водородотермия)
- К достоинствам этого метода относится получение очень чистого металла.
- 2) TiO 2 + 2Мg = Тi + 2МgO (магнийтермия)
- ЗМnO 2 + 4Аl = ЗМn + 2Аl 2 O 3 (алюминотермия)
- Чаще всего в металлотермии используют алюминий, теплота образования оксида
которого очень велика (2А1 + 1,5 O 2 = Аl 2 O 3 + 1676 кДж/моль). Электрохимический ряд напряжений металлов нельзя использовать для определения возможности протекания реакций восстановления металлов из их оксидов. Приближенно установить возможность этого процесса можно на основании расчета теплового эффекта реакции (Q), зная значения теплот образования оксидов:
- Q= Σ Q 1 — Σ Q 2 ,
- где Q 1 — теплота образования продукта, Q 2 -теплота образования исходного вещества.
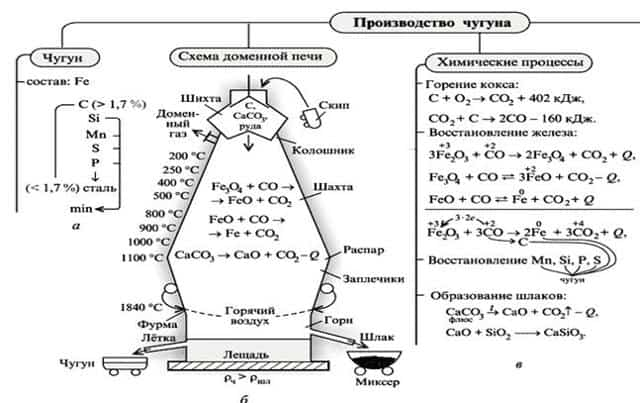
- Доменный процесс (производство чугуна): C + O 2 = CO 2 , CO 2 + C ↔ 2CO 3Fe 2 O 3 + CO = 2(Fe 2 Fe 3 2 )O 4 + CO 2 (Fe 2 Fe 3 2 )O 4 + CO= 3FeO + CO 2 FeO + CO= Fe + CO 2 (чугун содержит до 6,67% углерода в виде зерен графита и цементита Fe 3 C);
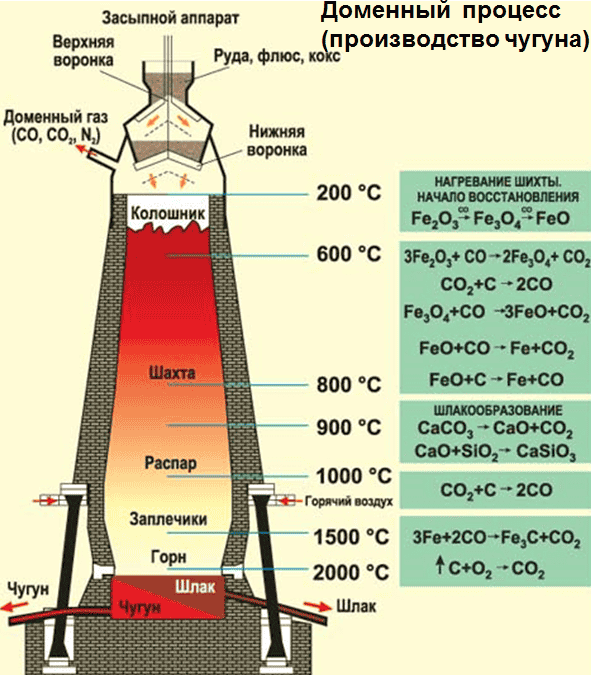 Выплавка стали (0,2-2,06% углерода) проводится в специальных печах (конвертерных, мартеновских, электрических), отличающихся способом обогрева. Продувание воздуха, обогащенного кислородом, приводит к выгоранию из чугуна избыточного углерода, а также серы, фосфора и кремния в виде оксидов. При этом оксиды либо улавливаются в виде отходящих газов (CO 2 , SO 2 ), либо связываются в легко отделяемый шлак – смесь Ca 3 (PO 4 ) 2 и CaSiO 3 . Для получения специальных сталей в печь вводят легирующие добавки других металлов.
Выплавка стали (0,2-2,06% углерода) проводится в специальных печах (конвертерных, мартеновских, электрических), отличающихся способом обогрева. Продувание воздуха, обогащенного кислородом, приводит к выгоранию из чугуна избыточного углерода, а также серы, фосфора и кремния в виде оксидов. При этом оксиды либо улавливаются в виде отходящих газов (CO 2 , SO 2 ), либо связываются в легко отделяемый шлак – смесь Ca 3 (PO 4 ) 2 и CaSiO 3 . Для получения специальных сталей в печь вводят легирующие добавки других металлов.
Гидрометаллургия
- Гидрометаллургия — это восстановление металлов из их солей в растворе.
- Процесс проходит в два этапа: 1) природное соединение растворяют в подходящем реагенте для получения раствора соли этого металла; 2) из полученного раствора данный металл вытесняют более активным или восстанавливают электролизом. Например, чтобы получить медь из руды, содержащей оксид меди СуО, ее обрабатывают разбавленной серной кислотой:
- СуО + Н 2 SО 4 = СuSO 4 + Н 2
- Затем медь либо извлекают из раствора соли электролизом, либо вытесняют из сульфата железом:
- СuSO 4 . + Fе = Сu + FеSO 4
- Таким образом, получают серебро, цинк, молибден, золото, уран.
Электрометаллургия
Электрометаллургия — восстановление металлов в процессе электролиза растворов или расплавов их соединений.
Этим методом получают алюминий, щелочные металлы, щелочноземельные металлы. При этом подвергают электролизу расплавы оксидов, гидроксидов или хлоридов.
- Примеры:
 а) NaCl (электролиз расплава) → 2Na + Cl 2
а) NaCl (электролиз расплава) → 2Na + Cl 2 - б) CaCl 2 (электролиз расплава) → Ca + Cl↑ в) 2Al 2 O 3 (электролиз расплава) → 2Al + 3O 2 ↑ г) 2Cr 2 (SO 4 ) + 6H 2 O(электролиз) → 4Cr↓ + 3O 2 ↑ +6H 2 SO 4 д) 2MnSO 4 + 2H 2 O (электролиз) → 2Mn↓ + O 2 ↑+2H 2 SO 4 е) FeCl 2 (электролиз раствора) → Fe↓ + Cl 2 ↑
-
Общие способы получения металлов
Природные соединения металлов:
| хлориды | сильвинит КСl ∙ NaCl, каменная соль NaCl; |
| сульфиды | серный колчедан FeS2, киноварь HgS, цинковая обманка ZnS; |
| карбонаты | мел, мрамор, известняк СаСО3, магнезит MgCO3, доломит CaCO3 ∙ MgCO3; |
| сульфаты | глауберова соль Na2SO4 ∙ 10 H2O, гипс CaSO4 ∙ 2Н2О; |
| оксиды | магнитный железняк Fe3O4, красный железняк Fe2O3, бурый железняк Fe2O3 ∙ Н2О. |
| нитраты | чилийская селитра NaNO3; |
- Минералы и горные породы, содержащие металлы и их соединения и пригодные для промышленного получения металлов, называются рудами.
- Отрасль промышленности, которая занимается получением металлов из руд, называется металлургией.
- Способы получения металлов из руд.
1. Электрометаллургический способ — это способы получения металлов с помощью электрического тока (электролиза). Этим методом получают алюминий, щелочные металлы, щелочноземельные металлы.
- При этом подвергают электролизу расплавы оксидов, гидроксидов или хлоридов:
- NaCl (расплав) D Na+ + Cl-
- катод Na+ + e à Na0 ¦ 2
- анод 2Cl — — 2e à Cl20 ¦ 1
суммарное уравнение: 2NaCl (распл.) – (э. ток)à 2Na + Cl2
Современный способ получения алюминия был изобретен в 1886 году. Он заключается в электролизе раствора оксида алюминия в расплавленном криолите. Расплавленный криолит растворяет Al2O3, как вода растворяет сахар.
- Al2O3 (расплав) D Al3+ + AlO33–
- катод Al3+ +3e à Al 0 ¦ 4
- анод 4AlO33– –12 e à 2Al2O3 +3O2 ¦ 1
суммарное уравнение: 2Al2O3(распл.) – (э. ток)à 4Al + 3O2 .
2. Пирометаллургический способ — это восстановление металлов из их руд при высоких температурах с помощью восстановителей: неметаллических: кокс, оксид углерода (II), водород; металлических: алюминий, магний, кальций.
| Алюмотермия: Fe+32O3 +2Al = 2Fe0 + Al2O3 | Получают железо, хром. |
| Восстановление оксидов металлов водородом (водородотермия): Cu +2O + H2 –(t)à Cu0 + H2O | Получают малоактивные металлы – медь, вольфрам. |
| Получение чугуна: В вертикальной печи кокс окисляется до СО, затем происходит постепенное восстановление железа из руды: |
|
| Восстановление углём (коксом): ZnO + C –(t)à Zn + CO | Получают цинк, никель. |
3. Гидрометаллургический способ основан на растворении природного соединения с целью получения раствора соли этого металла и вытеснением данного металла более активным. Например, руда содержит оксид меди и ее растворяют в серной кислоте: CuO + H2SO4 = CuSO4 + H2O, затем проводят реакцию замещения:
- CuSO4 + Fe = FeSO4 + Cu.
- Таким способом получают серебро, цинк, молибден, золото, ванадий.
- Если для восстановления требуется оксид металла, то в процессе переработки сначала получают оксид:
- а) из сульфида – обжигом в кислороде: 2ZnS + 3O2 = 2ZnO + 2SO2
- б) из карбоната – разложением: СаСО3 –(t)à СаО + СО2
- Чугун и сталь.
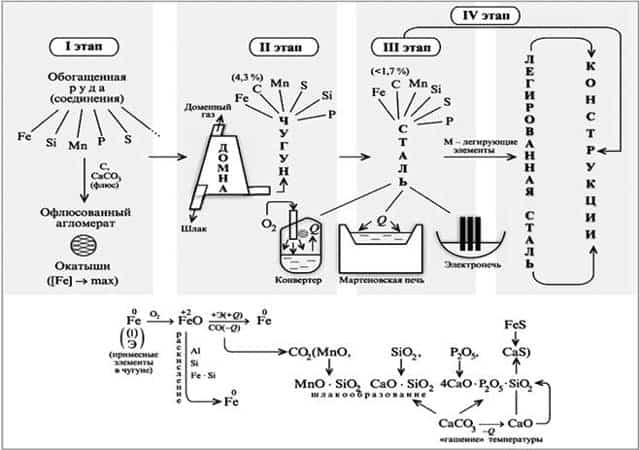
- Производство железа основано на карботермическом восстановлении оксидных металлсодержащих руд.
- 1) Сульфидные и другие руды вначале подвергают окислительному обжигу: 4FeS2 + 11O2 = 2Fe2O3 + 8SO2.
- 2)Восстановление оксидных руд осуществляется в доменных печах, при этом протекают следующие реакции:
- 3Fe2O3 + CO –(t)àCO2 + 2Fe3O4, Fe3O4 + CO–(t)àCO2 + 3FeO, FeO + CO–(t)àCO2 + Feили FeO + C –(t)àCO + Fe.
Полученное железо насыщено углеродом. 3)Затем происходит «выжигание» углерода в сталеплавильных или конверторных печах с образованием стали.
Получение металлов — урок. Химия, 9 класс
Рудами называют минералы и горные породы, содержащие металлы и их соединения, из которых технически возможно и экономически целесообразно получать чистые металлы.
Способами промышленного получения металлов из металлических руд занимается металлургия.
Металлургия — это и наука о промышленной добыче металлов из руд, а также соответствующая отрасль промышленности.
Чтобы получить металл из руды, нужно осуществить восстановление катионов металла.
Все способы получения металлов можно разделить на пирометаллургические и электрометаллургические.
Пирометаллургия — восстановление металлов из руд при высоких температурах с помощью углерода (C), оксида углерода((II)) (CO), водорода H2, металлов — алюминия (Al), магния (Mg).

Цех пирометаллургического производства
1. Восстановление металлов из их оксидов с помощью углерода (в виде кокса, раньше — в виде древесного угля) или оксида углерода((II)) называется карботермией.
Например, олово восстанавливают из оловянного камня углеродом:
Sn+4O2−2+C0⟶t°Sn0+C+4O−22.
Медь восстанавливают из куприта оксидом углерода((II)):
Cu+12O−2+C+2O−2⟶t°2Cu0+C+4O−22.
2. Восстановление металлов из их оксидов с помощью металлов называется металлотермией.
Например, хром восстанавливают из оксида хрома((III)) при помощи алюминия (алюминотермия):
Cr+32O−23+2Al0⟶t°2Cr0+Al+32O−23.
Титан восстанавливают из оксида титана((IV)) магнием:
Ti+4O2−2+2Mg0⟶t°Ti0+2Mg+2O−2.
3. Восстановление металлов из их оксидов с помощью водорода. Таким образом получают металлы с высокой степенью чистоты.
Например, так восстанавливают вольфрам из оксида вольфрама((VI)):
W+6O3−2+3H02⟶t°W0+3H2+1O−2.
4. Руды, образованные сульфидами металлов, предварительно подвергают обжигу (окисляют кислородом воздуха), а затем металл восстанавливают из образовавшегося оксида.
Например, цинковую обманку (сульфид цинка) подвергают обжигу (при этом образуется оксид цинка и диоксид серы), а затем полученный оксид цинка восстанавливают углеродом:
1) 2Zn+2S−2+3O02⟶t°2Zn+2O−2+2S+4O−22; 2) Zn+2O−2+C0⟶t°Zn0+C+2O−2.
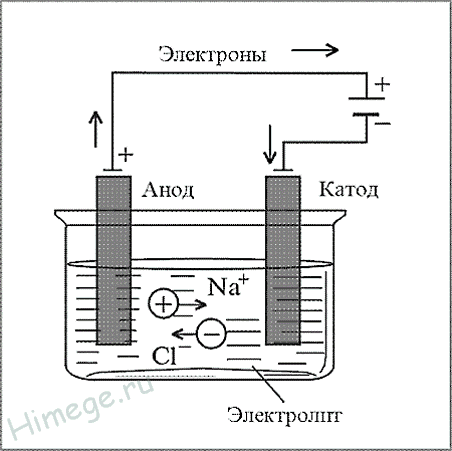
Электрометаллургия — восстановление металлов из растворов или расплавов их соединений под действием электрического тока (электролиз).
В процессе электролиза за счёт электрической энергии осуществляется химическая реакция, которая самопроизвольно идти не может.

Электролизный цех металлургического завода
1. Восстановление активных металлов электролизом из расплавов их солей (галогенидов).
Например, натрий можно получить из расплавленного хлорида натрия под действием электрического тока:
2Na+1Cl−1⟶электролиз2Na0+Cl02.
2. Восстановление металлов средней активности и неактивных металлов электролизом из растворов их солей.
- Например, олово образуется при электролизе раствора хлорида олова((II)):
- Sn+2Cl2−1⟶электролизSn0+Cl02.
- Медь образуется при электролизе раствора сульфата меди((II)):
- 2Cu+2S+6O−24+2H+12O−2⟶электролиз2Cu0+O02+2H2+1S+6O−24.
§ 81. Способы промышленного получения металлов [1971 Ходаков Ю.В., Эпштейн Д.А., Глориозов П.А. — Неорганическая химия. Учебник для 9 класса]
Новости Библиотека Таблица эл-тов Биографии Карта сайтов Ссылки О сайте
Современная металлургия охватывает производство очень большого числа продуктов — около 75 металлов и на их основе многих тысяч сплавов. Способы их промышленного получения многочисленны и разнообразны.
Однако перед металлургией любого металла, за редким исключением, стоят две общие задачи: восстановление металла из его окисла или какого-либо другого соединения и отделение металла от других одновременно образующихся веществ.
Так, при доменном производстве железо восстанавливается из его окислов и чугун отделяется от образовавшегося шлака.
Путь от руды к металлу складывается часто из десятков последовательно осуществляемых разнообразных механических и химических операций, начиная с обогащения руды и кончая очисткой (рафинированием) металла. Их характер зависит прежде всего от того, каким способом решается основная задача — восстановление металла, какой восстановитель выбран для этой цели.
В промышленности для восстановления железа и многих цветных металлов — цинка, свинца и др.- используют в качестве восстановителей каменноугольный кокс и окись углерода.
Восстановление происходит при высоких температурах, в ряде случаев сопровождается растворением углерода в металле и образованием карбидов. Так, в восстановленном железе растворяется углерод, а также образующийся карбид железа Fe3C Аналогично протекает восстановление углеродом марганца, хрома, ванадия и некоторых других металлов.
Поэтому если необходим сплав с малым содержанием углерода, то часто применяют в качестве восстановителя металлы. Например, хром восстанавливают из окиси хрома алюминием:
Cr2O3 + 2Al = Al2O3 + 2Cr + Q
Реакция начинается после подогрева смеси порошков окиси хрома и алюминия. Она протекает с выделением большого количества теплоты, достаточного для расплавления хрома. Вместо алюминия можно использовать более дешевый кремний.
Восстановление металлов из их соединений другими металлами или кремнием называется металлотермией.
Металлотермические методы получили широкое применение. Кроме хрома, так получают марганец, титан и некоторые другие металлы. В качестве восстановителей, кроме алюминия и кремния, применяют магний, натрий.
Восстановление алюминием называется алюминотермией.
Металлы, отличающиеся большой химической активностью, образуют очень прочные соединения с кислородом и другими элементами. Получение их восстановлением углеродом затруднительно или невозможно вследствие образования соединений углерода с металлом. Также не всегда возможно и часто неэкономично получать такие металлы металлотермическим методом. Их получают электролизом.
Электрохимический способ получения металлов широко применяется в промышленности. Посредством электролиза получают щелочные и щелочноземельные металлы, алюминий, магний, бериллий.
Эти металлы выделяют из электролитов, не содержащих ионов водорода, так как при электролизе водных растворов их солей на катоде выделяется не металл, а водород (вспомните электролиз водного раствора иодида калия).
Электролит не должен содержать также ионы металлов, способных при данных условиях электролиза выделяться на катоде и загрязнять продукт. Поэтому большое внимание уделяют чистоте веществ, подвергаемых электролизу. Получение их часто составляет наиболее сложную часть всей цепи производственных операций в производстве металла из руды.
Электрохимический способ применяют и для очистки (рафинирования) металлов, полученных другими методами. Так, из меди, загрязненной примесями никеля и железа, отливают аноды. Их помещают в ванну с электролитом, содержащим серную кислоту и сульфат меди (II). При прохождении через ванну постоянного электрического тока на катоде (медной пластине) осаждается чистая медь.
Таковы основные методы восстановления металлов, применяемые в промышленности. Процессы восстановления углеродом или металлами протекают при высоких температурах и объединяются в группу пирометаллургических. Перевод полезных компонентов руды в раствор и выделение продукта в чистом виде посредством электролиза относятся к гидрометаллургическим процессам.
- Составьте уравнения реакций восстановления металлов всеми известными вам способами.
- Каковы технические и экономические достоинства и недостатки металлотермии по сравнению с восстановлением углеродом топлива?
- Какие требования предъявляют к составу электролитов при получении металлов?
- Как вы объясните, что электрохимические методы получения металлов получили широкое применение только в XX в., хотя реакции были известны уже в начале XIX в.?
Химия. 11 класс
Общие способы получения металлов
Значительная химическая активность металлов является причиной того, что в земной коре они существуют, как было отмечено ранее, преимущественно в виде соединений — минералов.
Горные породы (скопления минералов), из которых технологически возможно и экономически выгодно извлекать валовым способом металл, называют рудой. Руда практически никогда не содержит соединения металла в чистом виде, в ней всегда присутствуют примеси других минералов, которые называют пустой породой.
Поэтому проблемой является не только разработка технологии извлечения металлов из минералов, но и поиск способов очистки минералов от пустой породы.
Современные технологии делают экономически выгодным извлекать железо из руд, в которых его содержание составляет 30–55 %; цинк — 2–6 %; олово — 0,2–2 %; золото — 0,00002–0,0002 %.
Область науки и техники, отрасль промышленности, связанную с извлечением металлов из руд и получением их в виде, пригодном для использования, называют металлургией.
Металлургические процессы принято подразделять на три этапа.
Первый этап — предварительная обработка руды. На этом этапе производят обогащение руды — отделение всех ценных минералов от пустой породы. Если рудой являются сульфиды металла (CuFeS2, PbS, ZnS и др.), то такую руду предварительно обжигают в присутствии кислорода для перевода металлов в оксиды:
Второй этап — восстановление металлов из их соединений: оксидов или солей. Методы восстановления можно разделить на три большие группы: пирометаллургические, электрохимические и гидрометаллургические.
На третьем этапе проводят очистку металлов — рафинирование.
Метод получения металла из его руды выбирают с учётом свойств соединений металла и его химической активности.






