- Химические свойства металлов, их разнообразие :
- Определение термина
- Физические свойства
- Реакции замещения
- Металл плюс кислород
- Реакции с галогенами
- Металлы и другие простые вещества
- Что будет, если добавить к металлу воду?
- Кислоты и неактивные металлы
- Заключение
- Химические свойства металлов. Электродные потенциалы металлов, ряд активности. Взаимодействие металлов с солями, кислотами и основаниями. Коррозия металлов, виды коррозии, борьба с коррозией
- Видеоурок «Химические свойства металлов. Взаимодействие металлов с неметаллами»
- Химические свойства металлов
- 1. Взаимодействие металлов с неметаллами
- 2. Взаимодействие металлов с водой
- 3. Взаимодействие металлов с растворами солей
- 4. Взаимодействие металлов с растворами щелочей
- 5. Взаимодействие металлов с кислотами
- Химические свойства металлов
Уважаемые учащиеся 9 класса!
В 8 классе вы приступили к изучению основ удивительной науки — химии. Вы узнали, что эта наука изучает превращения веществ, сопровождающиеся изменением их состава и (или) строения. Опираясь на наблюдения и эксперимент, вы познакомились с различными веществами и их свойствами, с химическими реакциями (превращением одних веществ в другие), с языком химической науки.
В 9 классе изучается неорганическая химия (металлы, неметаллы и их соединения), а также происходит знакомство с основами органической химии.
Вы продолжите систематическое изучение основ химии: глубже и конкретнее рассмотрите свойства групп химических элементов, изучите их соединения, а также характерные для этих соединений химические реакции.
Ведущую роль при этом будут играть теоретические знания, которые в 9 классе пополнятся теорией электролитической диссоциации, закономерностями протекания химических реакций.
Желаю вам успехов в изучении химии!
Учебные пособия
| Химия. Неорганическая химия. Органическая химия. 9 класс. Рудзитис Г.Е., Фельдман Ф.Г. | |
| Рабочая тетрадь по химии. 9 класс. К учебнику Рудзитиса Г.Е., Фельдмана Ф.Г. — Боровских Т.А. | |
| Тетрадь для практических работ по химии. 9 класс. К учебнику Г.Е. Рудзитиса, Ф.Г. Фельдмана. — Микитюк А.Д. | |
| Сборник задач и упражнений по химии. 8 — 9 классы. Рябов М.А. | |
| Химия. Задачник с «помощником». 8-9 классы. Гара Н.Н., Габрусева Н.И. | |
| Химия. 9 класс. Контрольные измерительные материалы. Корощенко А.С., Яшукова А.В. |
В таблице отражены основные темы за курс химии 9 класса. Для того, чтобы просмотреть, изучить, повторить определенную тему, наведите курсор на тему и перейдите по ссылке.
- Тема 1: “Повторение основных вопросов изучения химии в 8 классе”
- Тема 2: “Классификация химических реакций”
- Тема 3: “Химические реакции в водных растворах”
- Тема 4: “Галогены”
- Тема 5: “Неметаллы: кислород и сера”
- Тема 6: “Неметаллы: азот и фосфор”
| 1 | Положение азота и фосфора в ПСХЭ, строение их атомов. Азот, физические и химические свойства, получение, применение |
| 2,3 | Аммиак, строение, свойства, получение и применение. Соли аммония |
| 4 | П.Р. №5: “Получение аммиака и изучение его свойств” |
| 5,6 | Азотная кислота |
| 7 | Соли азотной кислоты. Азотные удобрения |
| 8 | Фосфор, аллотропия фосфора, свойства, получение и применение |
| 9 | Оксид фосфора (V), ортофосфорнаф кислота и ее соли. Фосфорные удобрения |
| 10 | С.Р. по теме: “Азот, фосфор и их соединения” |
Тема 7: “Неметаллы: углерод и кремний”
| 1,2 | Положение углерода и кремния в ПСХЭ, строение их атомов. Углерод, аллотропные модификации, физические и химические свойства углерода. Адсорбция |
| 3,4 | Угарный газ, свойства, физиологическое действие на организм. Углекислый газ, угольная кислота и ее соли. |
| 5 | П.Р. №6 по теме: “Получение углекислого газа и изучение его свойств. Распознавание карбонатов” |
| 6 | Кремний и его соединения. Стекло. Цемент. |
| 7 | Решение расчетных задач на вычисление объема газообразного продукта реакции, полученного из вещества, содержащего примеси. Подготовка к к.р. |
| 8 | К.Р. №3 по теме: “Неметаллы” |
- Тема 8: “Металлы”
- Тема 9: “Органические вещества”
- Тема 10: “Повторение, обобщение”
| 1 | Итоговая контрольная работа по курсу 9 класса |
При создании уроков использованы ресурсы и материалы:
Химические свойства металлов, их разнообразие :
Всего в природе существует 92 химических элемента (это не считая тех, которые синтезируются искусственным путем). Все они подразделяются на неметаллы и металлы. Последних заметно больше, чем первых.

Определение термина
Металлы в химии — это элементы, встречающиеся в природе в виде простых веществ и обладающие похожими физическими свойствами.
Среди них, в зависимости от их особенностей и от того, в состав каких соединений они могут входить, выделяют щелочные, щелочноземельные, переходные, легкие, полуметаллы, лантаноиды и актиноиды.
Химические свойства металлов всех групп похожи. Следует также отметить, что бериллий и магний не входят ни в одну из групп.
Физические свойства
Несмотря на то что химические свойства металлов мало чем отличаются, физические довольно разнятся. Для всех веществ данной группы характерен металлический блеск. Лучше всех металлов свет способны отражать серебро и алюминий, что позволяет использовать их в производстве зеркал.
Плотность металла может быть различной. По этому критерию выделяют легкие и тяжелые. К первым можно отнести те, плотность которых составляет не более 5 г/см3. Такими являются литий, натрий, кальций, алюминий, магний.
Первый — самый легкий из всех, его плотность почти в два раза меньше, чем у воды, а именно 0,53 г/см3. К тяжелым принадлежат железо, цинк, никель, свинец, хром, золото, серебро и другие. Самый тяжелый металл в природе — осмий. Его плотность составляет 22,6 г/см3.
Также среди физических свойств металлов выделяют твердость. Существует шкала Мооса, по которой и определяется данный показатель.
 Самые мягкие металлы: калий, цезий, натрий, рубидий — их можно разрезать ножом. Твердость натрия по шкале Мооса составляет 0,4. Самым твердым металлом, которым можно порезать стекло, является хром (9 по шкале Мооса). Следующий критерий, по которому можно охарактеризовать вещество данной группы, — пластичность. Самым высоким показателем в этом плане обладают золото, серебро, медь; средним — олово; низким — свинец, цинк, железо. Также металлы различаются по своей тугоплавкости. К легкоплавким относятся те, которые начинают превращаться в жидкость при температуре менее +1000 градусов по шкале Цельсия. Такими являются калий, натрий, свинец, олово, магний, цинк, алюминий, кальций. Самый легкоплавкий металл в природе — ртуть — она становится жидкой при температуре -39 градусов Цельсия. К тугоплавким относятся медь, золото, тантал, платина, железо, никель, молибден. Самая высокая температура плавления у вольфрама — +3410 градусов. По теплопроводности металлы также различаются. Железо, вольфрам, алюминий, золото, медь, серебро — вот последовательность в порядке увеличения теплопроводности. По возрастанию электропроводности также металлы можно расположить в ряд: он будет таким же, как и предыдущий, то есть самый низкий показатель — у железа, самый высокий — у серебра и меди.
Самые мягкие металлы: калий, цезий, натрий, рубидий — их можно разрезать ножом. Твердость натрия по шкале Мооса составляет 0,4. Самым твердым металлом, которым можно порезать стекло, является хром (9 по шкале Мооса). Следующий критерий, по которому можно охарактеризовать вещество данной группы, — пластичность. Самым высоким показателем в этом плане обладают золото, серебро, медь; средним — олово; низким — свинец, цинк, железо. Также металлы различаются по своей тугоплавкости. К легкоплавким относятся те, которые начинают превращаться в жидкость при температуре менее +1000 градусов по шкале Цельсия. Такими являются калий, натрий, свинец, олово, магний, цинк, алюминий, кальций. Самый легкоплавкий металл в природе — ртуть — она становится жидкой при температуре -39 градусов Цельсия. К тугоплавким относятся медь, золото, тантал, платина, железо, никель, молибден. Самая высокая температура плавления у вольфрама — +3410 градусов. По теплопроводности металлы также различаются. Железо, вольфрам, алюминий, золото, медь, серебро — вот последовательность в порядке увеличения теплопроводности. По возрастанию электропроводности также металлы можно расположить в ряд: он будет таким же, как и предыдущий, то есть самый низкий показатель — у железа, самый высокий — у серебра и меди.
Здесь необходимо учесть то, что все они делятся на активные и неактивные. Первые стоят в электрохимическом ряду левее водорода, вторые — правее. Химические свойства металлов, которые обладают высокой активностью, не характерны для вторых.

Реакции замещения
Они свойственны только активным металлам. Такой процесс происходит при добавлении последних к кислоте. Вследствие этого образуется соль данного металла и водород, который выделяется в виде газа. Выразить это можно с помощью такого уравнения: 2К + 2НСІ = 2КСІ + Н2.
Кроме того, такого типа реакции происходят между металлами и солями. Для этого металл, который добавляют в раствор, должен быть активнее, чем тот, который входит в состав соли. В этом случае образуется новая соль, а металл из предыдущей выпадет в виде осадка.
Примером подобного рода химического взаимодействия может служить следующее уравнение: 2К + СаСІ2 = 2КСІ + Са.
Металл плюс кислород
Для таких реакций необходимо нагреть реагенты до высокой температуры. В этом процессе образуется оксид. Пример уравнения: 2Са + О2 = 2СаО. Однако в случае с калием реакция происходит без нагревания. Ее уравнение выглядит так: 4К + О2 = 2К2О. Поэтому данный металл необходимо хранить в специальных условиях, иначе на его срезе моментально образуется пленка из оксида.
Реакции с галогенами
Это такие вещества, как СІ2, Br2, І2 и др. При подобного рода взаимодействиях образуется соль, например, хлорид. 2К + СІ2 = 2КСІ.

Металлы и другие простые вещества
По типу описанной выше реакции может происходить и взаимодействие с другими химическими соединениями, состоящими из одного элемента. Для этого необходимо нагревание.
Это могут быть такие вещества, как сера, фосфор, азот, водород. Вследствие реакций образуются сульфиды, фосфиды, нитриды и гидриды соответственно.
Во взаимодействие с водородом вступают только металлы первой и второй групп периодической системы. Уравнения: 3Са + 2Р = Са3Р2; 2К + Н2 = 2КН.
Что будет, если добавить к металлу воду?
В реакции с этим веществом также вступают только активные металлы, а также обладающие средней активностью при нагревании. Вследствие этого образуется либо гидроксид (в первом случае), либо оксид (во втором) и водород. Примеры уравнений: 2К + 2Н2О = 2КОН + Н2; Zn + Н2О = ZnO + Н2.
Кислоты и неактивные металлы
К таким относятся висмут, медь, серебро и др.
 Они могут взаимодействовать только с концентрированными растворами серной и азотной кислот. При этом образуется сульфат/нитрат металла, диоксид сульфура/нитрогена и вода.
Они могут взаимодействовать только с концентрированными растворами серной и азотной кислот. При этом образуется сульфат/нитрат металла, диоксид сульфура/нитрогена и вода.
Заключение
Из всех приведенных выше примеров химических свойств металлов можно сделать вывод, что они являются сильными восстановителями.
Химические свойства металлов. Электродные потенциалы металлов, ряд активности. Взаимодействие металлов с солями, кислотами и основаниями. Коррозия металлов, виды коррозии, борьба с коррозией
- Взаимодействие с простыми веществами
- 1) С кислородом большинство металлов образует оксиды – амфотерные и основные:
- 4Li + O2 = 2Li2O,
- 4Al + 3O2 = 2Al2O3.
- Щелочные металлы, за исключением лития, образуют пероксиды:
- 2Na + O2 = Na2O2.
- 2) С галогенами металлы образуют соли галогеноводородных кислот, например,
- Cu + Cl2 = CuCl2.
- 3) С водородом самые активные металлы образуют ионные гидриды – солеподобные вещества, в которых водород имеет степень окисления -1.
- 2Na + H2 = 2NaH.
- 4) С серой металлы образуют сульфиды – соли сероводородной кислоты:
- Zn + S = ZnS.
- 5) С азотом некоторые металлы образуют нитриды, реакция практически всегда протекает при нагревании:
- 3Mg + N2 = Mg3N2.
- 6) С углеродом образуются карбиды:
- 4Al + 3C = Al3C4.
- 7) С фосфором – фосфиды:
- 3Ca + 2P = Ca3P2.
 Металлы могут взаимодействовать между собой, образуя интерметаллические соединения:
Металлы могут взаимодействовать между собой, образуя интерметаллические соединения:- 2Na + Sb = Na2Sb,
- 3Cu + Au = Cu3Au.
- 9) Металлы могут растворяться друг в друге при высокой температуре без взаимодействия, образуя сплавы.
- Электродные потенциалы металлов
- Стандартный электродный потенциал — это потенциал металла, определенный относительно стандартного (нормального) водородного электрода, при условии, что концентрация ионов водорода Н+ и ионов испытуемого металла Men+ равны 1 моль-ион/л при стандартных условиях.
- Ряд стандартных электродных потенциалов служит для сравнительной характеристики свойств атомов и ионов металлов в растворе.
- Взаимодействие металлов с солями
При взаимодействии металлов с солями происходит реакция замещения: электроны от атомов замещающего – более активного металла переходят к ионам замещаемого – менее активного металла. То сеть происходит замещение металла металлом в солях. Данные реакции не обратимы: если металл А вытесняет металл В из раствора солей, то металл В не будет вытеснять металл А из раствора солей. В порядке убывания химической активности, проявляемой в реакциях вытеснения металлов друг друга из водных растворов их солей, металлы располагаются в электрохимическом ряду напряжений (активности) металлов.
Металлы, расположенные в этом ряду левее, более активны и способны вытеснять следующие за ними металлы из растворов солей.
В электрохимический ряд напряжений металлов включён водород, как единственный неметалл, разделяющий с металлами общее свойство — образовывать положительно заряженные ионы.
Поэтому водород замещает некоторые металлы в их солях и сам может замещаться многими металлами в кислотах, например:
Zn + 2HCl = ZnCl2 + H2↑ + Q
Металлы, стоящие в электрохимическом ряду напряжений до водорода, вытесняют его из растворов многих кислот (соляной, серной и др.) , а все следующие за ним, например, медь не вытесняют.
Взаимодействие металлов с кислотами
Все реакции неорганической кислоты с металлом приводят к образованию солей. Исключением является, пожалуй, лишь реакция благородного металла с царской водкой, смесью соляной и азотной кислоты.
Любое другое взаимодействие кислот с металлами приводит к образованию соли.
В случае если кислота не является ни серной концентрированной, ни азотной, то в качестве продукта выщепляется молекулярный водород.

- Взаимодействие металлов с основаниями
- Растворы щелочей взаимодействуют с металлами, которые образуют амфотерные оксиды и гидроксиды(Al, Zn, Cr и др.) 2Al+2KOH+2H2O=2KAlO2+3H2 Zn+2NaOH=Na2ZnO2+H2
- Коррозия металлов, виды коррозии, борьба с коррозией.
- Коррозией называют разрушение металла под воздействием окружающей среды.
- Виды коррозии.
- В зависимости от механизма процесса разрушения металла коррозия может быть химической и электрохимической.
Химическая коррозия возникает при действии на металл сухих газов или жидкостей органического происхождения, которые не являются электролитами. Примером химической коррозии служит окисление металла при высоких температурах, в результате чего на его поверхности возникает продукт окисления – окалина. Данный вид коррозии встречается редко.
- Электрохимическая коррозия образуется в результате воздействия на металл электролитов (растворов кислот, щелочей и солей
- В зависимости от характера окружающей среды электрохимическая коррозия может быть: атмосферной, подводной, почвенной, вызванной блуждающими токами.
- Существуют различные методы защиты металлов от коррозии:
Лакокрасочные покрытия – наиболее распространенный вид антикоррозионной защиты металла. В качестве пленкообразующих материалов используют нитроэмали, нефтяные, каменноугольные и синтетические лаки, краски на основе растительных масел и др. Образующаяся при покрытии на поверхностях конструкций плотная пленка изолирует металл от воздействия окружающей его влажной среды.
Неметаллические покрытия довольно разнообразны. К ним относят эмалирование, покрытие стеклом, цементно-казеиновым составом, листовым пластиком и плитками, напыление пластмасс.
Металлические покрытия наносят на металлы гальваническим, химическим, горячим, металлизацией и другими способами.
При гальваническом способе защиты на поверхности металла путем электролитического осаждения из раствора солей металлов создается тонкий защитный слой какого-либо металла. Химическая обработка поверхности металла – изделия погружают в ванну с расплавленным защитным металлом.
Металлизация – распространенный способ защиты металлов в строительстве. Он состоит в нанесении сжатым воздухом тончайшего слоя распыленного расплавленного металла.
При защите легированием в металл вводят легирующие элементы, повышающие сопротивление сплава коррозии. Защита от огня.
- Для защиты металлоконструкций наиболее перспективны вспучивающиеся покрытия или краски на основе полимерных связующих, которые при воздействии огня образуют закоксовавшийся вспененный расплав, препят-ствующий нагреву металла.
- Для повышения предела огнестойкости (600 °С) металлических, в том числе алюминиевых, конструкций применяют также асбестоцементные, асбестоперлитовые, асбестовермикулитовые покрытия, наносимые пневмонапылением.
- Новый вид огнезащиты – фосфатное покрытие толщиной 20-30 мм, представляющее собой стойкую (при 1000 °С) монолитную легкую массу.
Традиционные способы увеличения предела огнестойкости, использование облицовок и штукатурок из несгораемых огнезащитных материалов (кирпича, пустотелой керамики, гипсовых плит, растворов и др.).
Вопрос 11.
Типы химических реакций. Окислительно-восстановительные реакции: реакции межмолекулярного, внутримолекулярного окисления-восстановления, реакции самоокисления самовосстановления. Методы электронного и электронно-ионного баланса.
ТИПЫ КЛАССИФИКАЦИИ РЕАКЦИИ:
| По числу веществ и образующихся веществ | По изменению степени окисления атомов | |
| Без изменения степени окисления | С изменением степени окисления | |
| СОЕДИНЕНИЯ A + B = AB Из нескольких простых или сложных веществ образуется одно сложное | CaO+H2O=Ca(OH)2 PbO+SiO2=PbSiO3 | H2+Cl2=2HCl 4Fe(OH)2+2H2O+O2=4Fe(OH)3 |
| РАЗЛОЖЕНИЯ AB = A + B Из сложного вещества образуется несколько простых или сложных веществ | Cu(OH)2=CuO+H2O CaCO3=CaO+CO2 NH4Cl=NH3+HCl | 4HNO3=2H2O+4NO2+O2 4KClO3=3KClO4+KCl |
| ЗАМЕЩЕНИЯ A + BC =AC + B Атом простого вещества замещает один из атомов сложного | CuSO4+Fe=FeSO4+Cu 2KBr+Cl2=2KCl+Br2 | |
| ОБМЕНА AB + CD = AD + CB Сложные вещества обмениваются своими составными частями | AgNO3+KBr =AgBr NaOH+HCl=NaCl+H2O |
По тепловому эффекту:
| Экзотермические реакции (теплота выделяется) | Эндотермические реакции (теплота поглощается) |
| 4Al+3O2 = 2Al2O3+Q | N2+O2 2NO-Q |
По присутствию других веществ:
| Каталитические ( протекают в присутствии катализаторов-веществ, ускоряющих реакцию) | Некаталитические |
| SO2+O2 SO3 | 2NO+O2 = 2NO2 |
Окислительно-восстановительными называют реакции, происходящие с изменением степеней окисления элементов, входящих в состав взаимодействующих веществ.
Степенью окисления атома в молекуле называют условный заряд, возникающий при смещении электронной пары к более электроотрицательному атому. Степень окисления подсчитывают, исходя из того, что сумма степеней окисления всех атомов в молекуле вещества равна нулю.
Окислитель присоединяет электроны и при этом восстанавливается (понижает свою степень окисления). Вещества, в состав которых входят элементы с максимальной степенью окисления, всегда являются окислителями.
Восстановитель отдает электроны и при этом окисляется (повышает свою степень окисления). Вещества, содержащие элементы с минимальной степенью окисления всегда являются восстановителями.
- Таким образом, в окислительно-восстановительных реакциях происходит следующий процесс: окислитель(I) + восстановитель(II) ⇆ восстановитель(I) + окислитель(II)
- Если в состав вещества входят элементы с промежуточной степенью окисления, то такие вещества могут проявлять как окислительные, так и восстановительные свойства.
- Для составления уравнений окислительно-восстановительных реакций нужно знать окислительно-восстановительные свойства исходных веществ, на основании которых устанавливают состав продуктов реакции.
Если известна схема реакции (исходные вещества и продукты), то остается расставить стехиометрические коэффициенты. Для этой цели применяют методы электронного баланса и ионно-электронный.
Для реакций, протекающих в растворах, чаще всего используют ионно-электронный метод, сущность которого заключается в том, что для составления полуреакций процессов окисления и восстановления берут реально существующие в растворе ионы.
Для составления реакций окисления-восстановления следует:
1. Учитывать, в какой среде протекает окислительно- восстановительная реакция.
2. Написать уравнение реакции в молекулярной и ионной форме.
3. Выбрать ионы или молекулы, в которых элементы меняют степень окисления, т.е. выбрать окислитель и восстановитель.
4. Уравнять количество элементов в правовой и левой частях (в кислой среде при наличие кислорода он уравнивается молекулой воды, в щелочной кислород уравнивается удвоенным количеством гидроксильных групп, в нейтральной среде – слева только вода).
5. Уравнять количество зарядов в правой и левой частях путем добавления или отнятия электронов.
6.Уравнять число электронов, отданных восстановителем и принятых окислителем.
7. Сложить уравнения полуреакций с учетом найденных коэффициентов. Сократить одноименные ионы и молекулы, встречающиеся в обеих частях уравнения.
8. Расставить коэффициенты в уравнении реакции.
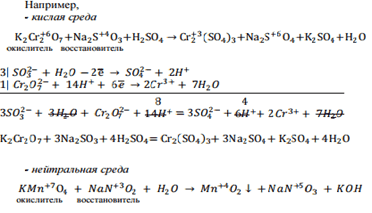
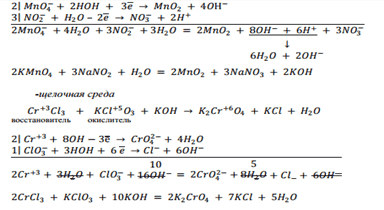


Вопрос 12.
Видеоурок «Химические свойства металлов. Взаимодействие металлов с неметаллами»
§ 1 Взаимодействие металлов с неметаллами
- В этом уроке мы рассмотрим взаимодействие металлов с неметаллами.
- Металлы проявляют восстановительные свойства, так как их атомы отдают свои электроны и образуют положительные ионы – катионы, а атомы неметаллов выступают в роли окислителей – принимают электроны.
- Взаимодействие металлов с галогенами (элементами седьмой группы главной подгруппы: фтором, хлором, бромом, иодом).

- При взаимодействии металлов с хлором образуются хлориды, например, если тонкую стальную проволоку накалить и опустить в колбу, заполненную газообразным хлором, проволока сгорает, образуя бурый хлорид железа (III).
- Запишем уравнение реакции: 2Fe + 3Cl2 = 2FeCl3 .
- Если высыпать в колбу с хлором порошок меди, он горит без нагревания с образованием хлорида меди (II). Уравнение этой реакции записывается так:
- Cu+Cl2 = CuCl2.
При взаимодействии металлов с бромом образуются бромиды, например, при смешивании порошок алюминия с бромом загорается, и образуется бромид алюминия. Уравнение этой реакции записывается так: 2Al + 3Br2 = 2AlBr3.
При взаимодействии металлов с иодом образуются иодиды, если взять смесь порошков цинка и иода (в соотношении 1:1) и капнуть из пипетки несколько капель воды, начнется бурная химическая реакция, в результате которой образуется иодид цинка. Уравнение этой реакции записывается так: Zn+I2=ZnI2. Вода в данной реакции является катализатором.
- Взаимодействие металлов с кислородом.
- С кислородом воздуха легко взаимодействуют щелочные и щелочноземельные металлы с образованием оксидов, пероксидов, поэтому их хранят под слоем керосина, а литий — в вазелиновом масле.
- При взаимодействии лития с кислородом образуется оксид лития.
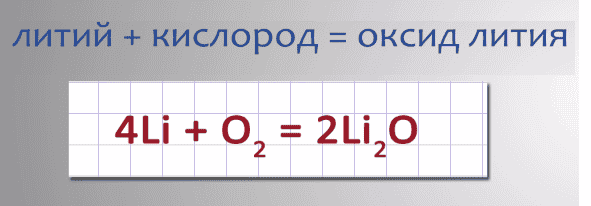
Запишем уравнение реакции: 4Li + O2 = 2Li2O.

Кальций на воздухе окисляется до оксида кальция, уравнение этой реакции записывается так: 2Ca+ O2 = 2CaO.
Химические реакции с менее активными металлами происходят при нагревании.
Например, для реакции кислорода с магнием необходимо порошок магния поджечь. Магний моментально сгорает ярким пламенем с образованием белого оксида магния.

Уравнение этой реакции записывается так: 2Mg+ O2 = 2MgO.
Это свойство магния – ярко гореть – используется в пиротехнике. Измельченный магний – составляющая смесей для фейерверков. Вспышку магния использовали фотографы 100 лет назад для освещения моделей.
Медь и другие менее активные металлы энергично окисляются кислородом только при нагревании. Если прокаливать медную проволоку на пламени спиртовки, она покрывается черным налетом оксида меди (II). Запишем уравнение этой реакции: 2Cu+O2 = 2CuO.
- Золото и платиновые металлы кислородом воздуха не окисляются.
- Взаимодействие металлов с другими неметаллами.
- При взаимодействии металлов с серой образуются сульфиды. Если смесь порошков цинка и серы поджечь, образуется сульфид цинка по следующему уравнению:
- Zn+ S= ZnS.
Сульфид ртути образуется при взаимодействии серы с ртутью, при комнатной температуре реакция идет очень медленно, при нагревании процесс ускоряется. Уравнение этой реакции: Hg+ S= HgS. Это соединение нелетучее и не растворяется в воде, поэтому его можно использовать при демеркуризации помещений.
Металлы могут реагировать с водородом с образованием гидридов, реакции протекают при нагревании. Например, уравнение реакции получение гидрида натрия: 2Na+ H2 = 2NaH.
§ 2 Краткий итог урока
Взаимодействие металлов с неметаллами происходит с образованием бинарных соединений: хлоридов, оксидов, бромидов, сульфидов и других.
Условия протекания химических реакций зависят как от активности металла, так и от активности неметалла.
Наиболее активные металлы (щелочные и щелочноземельные) вступают в реакции без нагревания, менее активные металлы реагируют только при нагревании. В результате химических реакций металлы отдают свои электроны, а неметаллы принимают.
Список использованной литературы:
- Габриелян О.С. Химия. 9 класс: учебник для общеобразовательных учреждений. — М.: Дрофа, 2010.
- Химия. 9 класс: Настольная книга учителя./О.С. Габриелян, И.Г. Остроумов. – М.: Дрофа, 2003.
- school-collection.edu.ru/catalog/res/55a4babd-d3a0-e5b4-6daa…/view/
Использованные изображения:
Химические свойства металлов
Металлы занимают в Периодической таблице левый нижний угол. Металлы относятся к семействам s-элементов, d-элементов, f-элементов и частично – р-элементов.
Самым типичным свойством металлов является их способность отдавать электроны и переходить в положительно заряженные ионы. Причём металлы могут проявлять только положительную степень окисления.
Ме – ne = Men+
1. Взаимодействие металлов с неметаллами
- а) Взаимодействие металлов с водородом.
- С водородом непосредственно реагируют щелочные и щелочноземельные металлы, образуя гидриды.
- Например:
- 2Na + H2 = NaH
- Ca + H2 = CaH2
- Образуются нестехиометрические соединения с ионной кристаллической структурой.
- б) Взаимодействие металлов с кислородом.
- Все металлы за исключением Au, Ag, Pt окисляются кислородом воздуха.
- Пример:
- 2Na + O2 = Na2O2 (пероксид)
- 4K + O2 = 2K2O
- 2Mg + O2 = 2MgO
- 2Cu + O2 = 2CuO
- в) Взаимодействие металлов с галогенами.
- Все металлы реагируют с галогенами с образованием галогенидов.
- Пример:
- 2Al + 3Br2 = 2AlBr3
- В основном это ионные соединения: MeHaln
- г) Взаимодействие металлов с азотом.
- С азотом взаимодействуют щелочные и щелочноземельные металлы.
- Пример:
- 3Ca + N2 = Ca3N2
- Mg + N2 = Mg3N2 – нитрид.
- д) Взаимодействие металлов с углеродом.
Соединения металлов и углерода – карбиды.
Они образуются при взаимодействии расплавов с углеродом. Активные металлы образуют с углеродом стехиометрические соединения:
4Al + 3C = Al4C3
Металлы – d-элементы образуют соединения нестехиометрического состава типа твердых растворов: WC, ZnC, TiC – используются для получения сверхтвёрдых сталей.
2. Взаимодействие металлов с водой
- Активные металлы более активно реагируют с водой, разлагая воду с выделением водорода.
- Na + 2H2O = H2↑ + 2NaOH
- Менее активные металлы медленно разлагают воду и процесс тормозится из-за образования нерастворимых веществ.
3. Взаимодействие металлов с растворами солей
Такая реакция возможна, если реагирующий металл активнее, чем находящийся в соли:
Zn + CuSO4= Cu0↓ + ZnSO4
= – 0,76 B., = + 0,34 B.
Металл, обладающий более отрицательным или менее положительным стандартным электродным потенциалом, вытесняет другой металл из раствора его соли.
4. Взаимодействие металлов с растворами щелочей
Со щелочами могут взаимодействовать металлы, дающие амфотерные гидрооксиды или обладающие высокими степенями окисления в присутствии сильных окислителей. При взаимодействии металлов с растворами щелочей, окислителем является вода.
- Пример:
- Zn + 2NaOH + 2H2O = Na2[Zn(OH)4] + H2↑
- 1 Zn0 + 4OH– – 2e = [Zn(OH)4]2– окисление
- Zn0 – восстановитель
- 1 2H2O + 2e = H2 + 2OH– восстановление
- H2O – окислитель
- Zn + 4OH– + 2H2O = [Zn(OH)4]2– + 2OH– + H2↑
- Металлы, обладающие высокими степенями окисления, могут взаимодействовать со щелочами при сплавлении:
- 4Nb +5O2 +12KOH = 4K3NbO4 + 6H2O
5. Взаимодействие металлов с кислотами
- Это сложные реакции, продукты взаимодействия зависят от активности металла, от вида и концентрации кислоты и от температуры.
- По активности металлы условно делятся на активные, средней активности и малоактивные.
- Кислоты условно делятся на 2 группы:
I группа – кислоты, обладающие невысокой окислительной способностью: HCl, HI, HBr, H2SO4(разб.), H3PO4, H2S, окислитель здесь H+. При взаимодействии с металлами выделяется кислород (H2↑).
С кислотами первой группы реагируют металлы, обладающие отрицательным электродным потенциалом.
II группа – кислоты, обладающие высокой окислительной способностью: H2SO4(конц.), HNO3(разб.), HNO3(конц.). В этих кислотах окислителями являются анионы кислоты: . Продукты восстановления аниона могут быть самыми разнообразными и зависят от активности металла.
- H2S↑ – c активными металлами
- 6+ +8е
- H2SO4 +6е S0↓ – с металлами средней активности
- SO2↑ – c малоактивными металлами
- NH3 ( NH4NO3 )– c активными металлами
- 5+ +8e
- HNO3 +4,5e N2O, N2 – с металлами средней активности
- разб.
- +3e
- NO – c малоактивными металлами
HNO3(конц.) – NO2↑ – c металлами любой активности.
Если металлы обладают переменной валентностью, то с кислотами I группы металлы приобретают низшую положительную степень окисления: Fe → Fe2+, Cr → Cr2+. При взаимодействии с кислотами II группы – степень окисления +3: Fe → Fe3+, Cr → Cr3+, при этом никогда не выделяется водород.
Некоторые металлы (Fe, Cr, Al, Ti, Ni и др.) в растворах сильных кислот, окисляясь, покрываются плотной оксидной плёнкой, которая защищает металл от дальнейшего растворения (пассивация), но при нагревании оксидная плёнка растворяется, и реакция идёт.
Малорастворимые металлы, обладающие положительным электродным потенциалом, могут растворяться в кислотах I группы, в присутствии сильных окислителей.
Химические свойства металлов
Разработан учителем химии МКОУ оош села Сплавнуха Красноармейского района Саратовской области Кинжигалиевой Т.А.
Цель урока: Систематизировать сведения о химических свойствах металлов.
Задачи урока:
- Охарактеризовать важнейшие химические свойства металлов;
- На примере реакций, характеризующих химические свойства, повторить типы химических реакций
- Продолжить формирование умения работать с лабораторным оборудованием.
Ход урока
1. Организационный момент
Проверка готовности к уроку. Сообщение темы и цели урока.
2. актуализация знаний
- Актуализация знаний по теме “Физические свойства металлов. Сплавы”.
- Работа по группам. Класс делится на 3 группы (либо по рядам, либо по другому принципу). Задания для групп может быть следующее:
Задание для группы № 1
Варианты вопросов:
- Способность вещества изменять форму под внешним воздействием и сохранять ее после прекращения воздействия? (пластичность);
- Тип химической связи в металлах? (металлическая);
- Какие подвижные частицы кристаллической решетки обеспечивают физические свойства металлов? (электроны);
- Какую плотность имеют легкие металлы (менее 5 г/см3);
- Самый легкий металл? (литий);
- Лучшие проводники электричества среди металлов? (серебро и медь);
- Название известного сплава на основе алюминия (дюралюминий);
- Важнейшие сплавы на основе железа? (чугун и сталь);
- Какой неметалл входит в состав сплавов железа (углерод);
- Укажите не менее трех металлов, которые могут выступать в качестве легирующих добавок? (хром, никель, молибден)
Задание для группы № 2
Решение задачи по теме “Сплавы”:
Вычислите количества вещества меди и никеля, которые нужно взять для производства 25 кг. мельхиора.
Задание для группы № 3.
Группа получает образец металла, который необходимо охарактеризовать по физическим свойствам и примерным областям применения.
На выполнение задания отводится не более 5 минут. После чего происходит проверка результатов.
3. Формирование новых знаний.
Учитель проговаривает основные задачи урока
Мы должны к заключению урока:
- знать общие химические свойства металлов;
- уметь записывать уравнения реакций, характеризующие химические свойства металлов;
- получить навыки проведения химических реакций.
Актуально задать обучающимся вопрос: “А зачем необходимо знать химические свойства металлов?”
Химические свойства металлов
Объяснение нового материала излагается в форме активного диалога с обучающимися, так как часть учебного материала, а именно: принципы написания химических уравнений, свойства кислот и солей, признаки и типы химических реакций, правила ряда напряжения металлов, ОВР процессы им известны. Таким образом, по – ходу изучения нового материала происходит закрепление ряда тем курса химии за 8 класс.
1. Взаимодействуют с неметаллами.
Просматривается видеофрагмент и записывается уравнение реакции. Например: горение магния: 2Mg + O2 = 2MgO. Разбираются процессы окисления — восстановления.
2. Взаимодействие с водой.
- С водой активно реагируют щелочные и щелочноземельные металлы. Реакция разбирается на примере натрия: 2Na + 2H2O = 2NaOH+ H2
- Реакция менее активного металла с водой разбирается на примере железа.
- 3Fe + 4H2O = Fe3O4 + 4H2
- 3. Взаимодействие с кислотами
- с учетом правил по положению металлов в ряду напряжения
- K Ca Na Mg Al Zn Fe Ni Sn Pb H2 Cu Hg Ag Au
- Металл в ряду должен стоять до водорода (не распространяется на щелочные и щелочноземельные металлы);
- Полученная соль должна быть растворимой;
- Азотная и концентрированная серная кислоты реагируют с металлами по – особому.
- Далее просматриваются видеофрагменты взаимодействия алюминия с соляной кислотой и меди с концентрированной азотной кислотой и записываются уравнения данных реакций.
- 2Al + 6HCl = 2AlCl3+3H2
- Cu + 4HNO3 = Cu(NO3)2 + 2NO2 + 2H2O
- 4. Взаимодействие с солями
- с учетом правил по положению металлов в ряду напряжения
- K Ca Na Mg Al Zn Fe Ni Sn Pb H2 Cu Hg Ag Au
- Металл в ряду должен стоять до металла соли (не распространяется на щелочные и щелочноземельные металлы);
- Все соли, участвующие в реакции должны быть растворимы
- Просматривается видеофрагмент взаимодействия цинка с хлоридом меди (II) и учащиеся записывают уравнение реакции:
- Zn + CuCl2 = ZnCl2 + Cu
- Общий вывод по этапу формирование новых знаний:
- Металлы вступают в реакцию:
- (с учетом условий)
- (с учетом правил ряда напряжений металлов)
- (с учетом правил ряда напряжений металлов)
- 4. Закрепление изученного материала
- На этапе закрепления обучающимся предлагается выполнение лабораторной работы по изучению химических свойств металлов.
- Взаимодействие меди с кислородом;
- Взаимодействие цинка с соляной кислотой;
- Взаимодействие железа с раствором сульфата меди(II)
- Работа выполняется в парах, результаты комментируются и оформляются в тетради.
- 5. Подведение итогов (рефлексия)
- А) Что я узнал о химических свойствах металлов?
- Б) Для чего необходимо знать химические свойства металлов?
- В) Что бы Вы могли предложить для лучшего усвоения материала по данной теме?
- 6. Домашнее задание с ми
- Изучить § 8
- ЗАПОМНИТЬ! Химические свойства металлов
- Выполнить письменно задания: № 1-5 (тетрадь с печатной основой)






